乳脂肪球膜(milk fat globule membrane,MFGM)是包被乳脂肪球的复杂膜结构,因为MFGM的存在,使乳脂肪球具有一定的稳定性[1]。MFGM厚度为10~50 nm[2],为3层膜结构,由内单层膜和外磷脂双分子层构成。内单层膜来源于内质网和泌乳细胞细胞质,外膜磷脂双分子层来源于乳腺上皮细胞的顶端质膜[3],具有一定流动性。黄嘌呤氧化还原酶(xanthinedehydrogenase,XDH)、脂肪分化蛋白质(adipophilin,ADPH)等与膜结构密切相关的整合蛋白镶嵌于膜内,乳凝集素(lactadherin,PAS6/7)、分化抗原簇(cluster of differentiation 36,CD36)等与膜结合较弱的外周蛋白突出于膜外[4],磷脂在膜表面不均匀分布,图1为MFGM结构示意图。MFGM主要成分为蛋白质和脂质,占其干重的90%以上。其中MFGM蛋白质含量占MFGM总量的25%~60%,占总乳蛋白1%~4%,脂质多为极性脂质,也含有部分中性脂质如甘油三酯、胆固醇等[5]。

图1 MFGM结构示意图[1]
Fig.1 Schematic illustration of milk fat globule membrane structure[1]
随着对MFGM的研究不断深入,发现其在抗炎症反应、抑制病毒、抗癌及促进婴幼儿大脑发育等方面具有独特的营养功能[6]。并且MFGM具有亲水亲油性,是一种性能良好的天然乳化剂,其优越的乳化特性也逐渐引起人们的关注。近年来为了更好地利用MFGM的功能特性,其制备方法逐渐成为研究热点。常用的MFGM制备方法有离心浓缩法和膜过滤法,通过对这2种方法进行工艺改进,可以提高MFGM的得率和纯度。本文根据目前的研究进展,对工业规模生产MFGM原料来源、分离方法及其乳化特性进行了综述,以期为进一步的加工利用提供参考。
1 工业规模生产MFGM原料来源
黄油和干酪加工过程中产生的副产物富含MFGM成分,但这些副产物经济价值较低,进行二次加工将大大提高其工业附加值,减少资源浪费和环境污染。
在黄油生产过程中,完整的乳脂肪球被破坏,大量MFGM碎片进入酪乳、黄油乳清等副产物中[2]。通过对黄油工业生产过程中,不同工艺处理阶段得到的酪乳、黄油乳清等物质进行蛋白质组学分析,发现黄油乳清中MFGM蛋白质种类最多,且MFGM最主要的蛋白质如XDH、嗜乳脂蛋白(butyrophilin,BTN)等含量极高[7]。而干酪加工过程中排出的乳清则富含MFGM脂质,干酪乳清一般用于分离乳清蛋白和浓缩乳清蛋白的商业生产,MFGM脂质在此过程中作为副产物被丢弃。ZHU等[8]以干酪乳清为原料萃取MFGM中的脂质,萃取物中磷脂含量为31%,其中鞘磷脂含量最为丰富,占总磷脂含量的33%左右。大量研究表明干酪乳清是制备MFGM极性脂质的极好来源,但到目前为止,尚未见有对干酪乳清中MFGM蛋白质定性定量的研究。
2 MFGM的制备方法
在原料乳的加工过程中,均质和热处理都会对MFGM成分和结构造成影响[9]。尤其是热处理,对MFGM蛋白质影响较大。在加热过程中酪蛋白会与MFGM蛋白发生交联反应,乳清蛋白会以巯基-二硫键的形式与MFGM蛋白结合,造成MFGM上蛋白质的负载量随着时间和温度的增加而增加[10],导致MFGM成分发生改变,从而对功能造成一定影响。MFGM成分具有乳化和有益健康的特性,促进了其作为功能性食品成分的应用研究,目前成功制备的MFGM已经应用于婴幼儿配方乳粉中,显著提高了24周婴幼儿的认知能力,缩小了配方乳粉喂养与母乳喂养婴儿在身体健康方面的差距[11]。制备MFGM主要有离心浓缩、膜过滤以及超临界萃取等方法。由于超临界萃取主要针对MFGM极性脂质的分离,并且建立在膜过滤基础之上,所以本文主要对离心浓缩法和膜过滤法进行详细综述。
2.1 离心浓缩技术在制取MFGM中的应用
离心浓缩技术利用脂肪球和水连续相的密度差异,使在牛乳中分离脂肪球膜物质成为可能[12]。该分离方法大致通过以下几个步骤进行,首先原料乳离心分离出乳脂,在37 ℃条件下用去离子水或盐类缓冲液作为洗涤剂洗涤乳脂3次,目的是去除附着在脂肪球上乳清蛋白、酪蛋白及其他小分子物质,从而得到洁净乳脂肪球。将得到的乳脂肪球在搅拌器中搅拌,破坏乳脂肪球结构,从中释放MFGM成分,收集得到的酪乳,并将熔化的黄油颗粒加入同体积蒸馏水中,离心分离回收黄油乳清。最后将酪乳和黄油乳清混合并高速离心得到MFGM悬浮液,再次高速离心并冷冻干燥即得到MFGM颗粒[13],具体操作流程见图2。
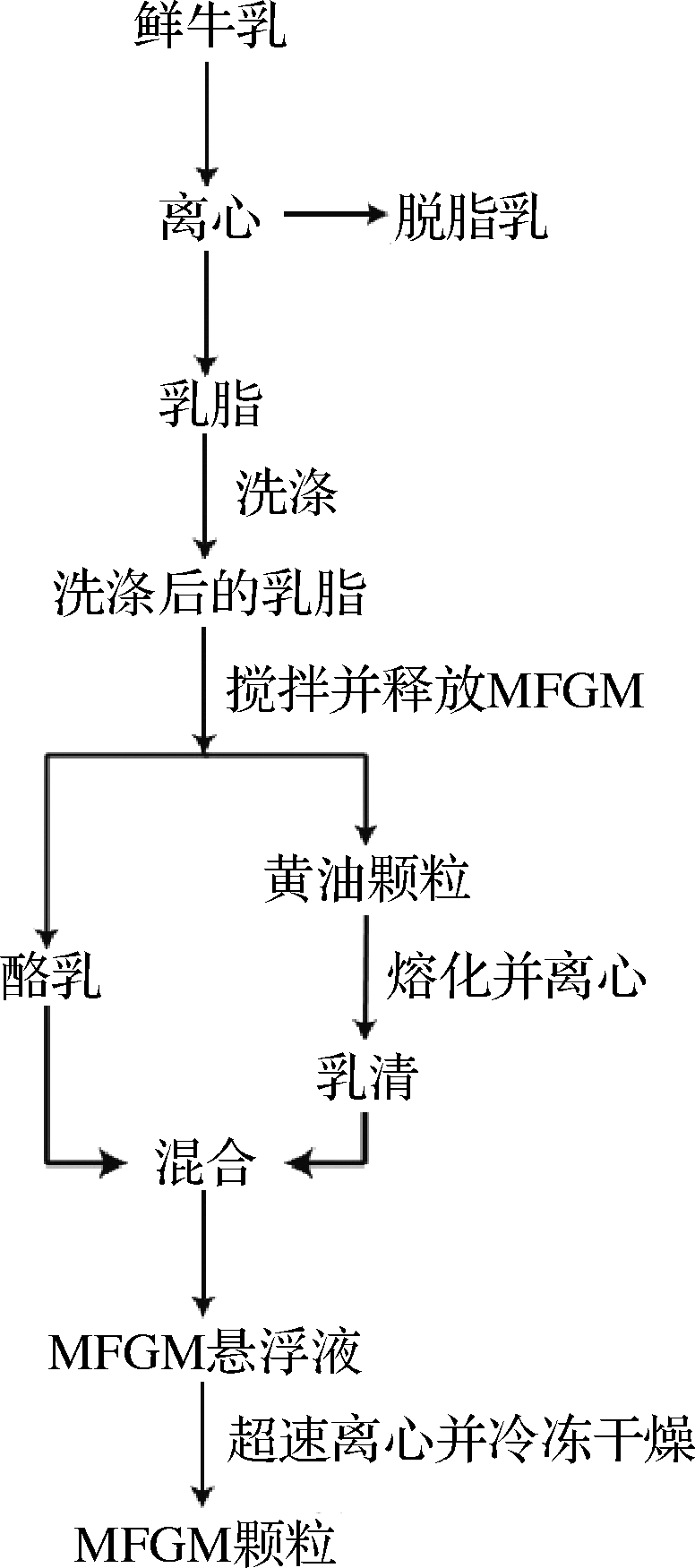
图2 离心浓缩法制备MFGM流程图[18]
Fig.2 Flow chart of MFGM production by centrifugal concentration method[18]
离心浓缩技术制备MFGM操作简单,但是得率不高。将乳脂洗涤4次后,MFGM蛋白质损失高达60%~90%[12]。LE等[14]对洗涤过的MFGM蛋白进行分析,发现即使是XDH和嗜乳脂蛋白等与MFGM联系紧密的整合蛋白[15],也会在洗涤过程中被消耗殆尽。除蛋白质外,极性脂质在洗涤过程中也有损失。BRITTEN等[16]将脂肪含量为45%~50%的乳脂稀释10倍并洗涤,在完成第一次洗涤以后乳脂中磷脂含量下降了20%,在随后的洗涤步骤中,每重复洗涤1次就会造成大概10%的磷脂损失。在后续的研究中,研究人员发现诸如洗涤次数、洗涤液体积、洗涤液种类和离心条件变化等洗涤条件会对MFGM得率产生影响。通过对这些条件进行优化,能够减少原料乳中制备MFGM材料的损失[17]。
2.1.1 洗涤次数和洗涤液体积对MFGM分离的影响
在制备MFGM材料过程中,洗涤次数和洗涤液体积都可以根据实际情况的不同而发生变化,这些参数没有固定的标准。但是在分析乳脂肪球洗涤效果和MFGM得率的时候,这些参数作为影响因素也要被考虑进去。理论上,乳脂洗涤次数越多,杂质蛋白残留量会越少。但是,增加洗涤次数可能会对脂肪球的稳定性产生一些负面影响,造成一定程度的聚集,进而影响MFGM的分离效果[17]。LE等[17]研究MFGM分离过程中洗涤条件对MFGM蛋白质回收率的影响,为了最大限度地减少MFGM材料的损失,建议将洗涤次数控制在1~2次,但是得到的MFGM蛋白质的纯度不高,与进行了3~4次洗涤的乳脂相比,有较高的乳清蛋白残留。乳脂与洗涤液的体积比例一般差别很大[19],因为有研究表明增大洗涤液的体积会使乳脂中的酪蛋白和乳清蛋白去除的更彻底[17]。通过综合比较洗涤次数和洗涤液体积2个变量对MFGM蛋白分离的影响,当洗涤液体积从6.75 L增加至13.5 L,MFGM蛋白总量保持不变。然而将洗涤次数由2次增加到3次时,MFGM蛋白含量由4.5 mg/g降低至4.2 mg/g[17]。由此可见,为了减少MFGM的损失,增大洗涤液的体积较增加洗涤次数更有效。
2.1.2 洗涤液种类对MFGM分离的影响
去离子水是洗涤乳脂常用的洗涤液,但也有使用盐水缓冲液代替去离子水的研究。ZHANG等[20]分析盐离子浓度对磷脂酰乙醇胺-磷脂酰甘油双分子层膜的影响,通过AA-MD模拟计算,当模拟时间超过100 ns时,各浓度的钙离子稳定地吸附在磷脂双分子层膜上,镁离子动态地吸附于磷脂膜上。并且随着盐离子浓度的增高,减小了磷脂双分子层膜的单个磷脂面积,同时使膜的厚度增加。由此可见,盐离子的加入会作用于MFGM的磷脂双分子层,保护了生物膜结构,从而减少了MFGM材料的损失。
BASCH等[21]比较了6种不同组成成分的洗涤液对MFGM分离的影响,结果表明用NaCl和MgCl2配制的盐水缓冲液比去离子水对酪蛋白的清除能力更强,并且MFGM组分损失较少。然而LE等[17]却发现去离子水比NaCl配制的盐水缓冲液洗涤乳脂得到的MFGM蛋白含量高10%左右,并且用去离子水洗涤去除的乳清蛋白更多。此外,他们还发现用盐溶液洗涤乳脂,会导致更多的脂肪小球聚集,MFGM表面积比变小[22],从而使产量变低。因此,还需对盐水缓冲液和去离子水的洗涤效果进行综合分析,确定合适的洗涤液,以减少MFGM的损失。
2.1.3 离心条件变化对MFGM分离的影响
离心是制备MFGM物质的关键步骤,转速越快以及离心时间越长,乳脂分离的效果越好。同时在离心过程中,如果脂肪浓度高,转速快会使MFG之间相互摩擦,造成MFGM的损失[23]。因此,脂肪的浓度水平要根据转速和离心时间进行相应的调整[19]。
ZHENG等[13]分析离心条件对MFGM影响,发现在转速低、时间短的温和离心条件下,MFG的聚集更为明显,粒度分布模态直径增加了大概19%。但是在转速高、时间长的强化离心条件下,直径仅增加了6%左右。此外他们还发现强化离心并洗涤后的MFGM蛋白质含量和ζ-电位增加,猜测可能与MFGM最外层的磷脂双分子层有关。为了深入探究出现该现象的原因,ZHENG等[24]利用激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)观察强化离心过程中MFGM磷脂双分子层的结构变化。图像显示MFGM蛋白质的染色加深,磷脂酰乙醇胺和磷脂酰胆碱等极性脂质有不同程度的缺失。因此可以进一步说明在强化离心的条件下,膜表面的蛋白质增加,极性脂质在离心过程中脱落或者发生了一定程度的重排。因此在对脂肪含量高的乳脂进行离心操作时,可以考虑加入脱脂乳调节脂肪含量,再采取强化离心的手段,以减少MFGM的损失。
2.2 膜浓缩技术在制取MFGM中的应用
切向流过滤(tangential flow filtration,TFF)是实验室规模制备MFGM普遍采用的技术,通过尺寸排除将胶体颗粒从悬浮液中分离出来[25]。该方法制备MFGM即是利用MFGM片段与酪蛋白胶束、乳清蛋白尺寸的差异,利用合适的膜孔径,在合适的跨膜压力、温度等条件下[19]将MFGM富集液中的杂质分离出去,得到较纯的MFGM物质。表1为在部分原料中过滤分离MFGM的实验条件。相比起离心浓缩制取MFGM,膜浓缩原料多为乳品工业生产中的副产物,能够显著降低能耗并且提高MFGM得率,适宜在工业规模上应用。
表1 膜过滤分离MFGM的实验条件
Table 1 Experimental conditions for separation of MFGM by membrane filtration
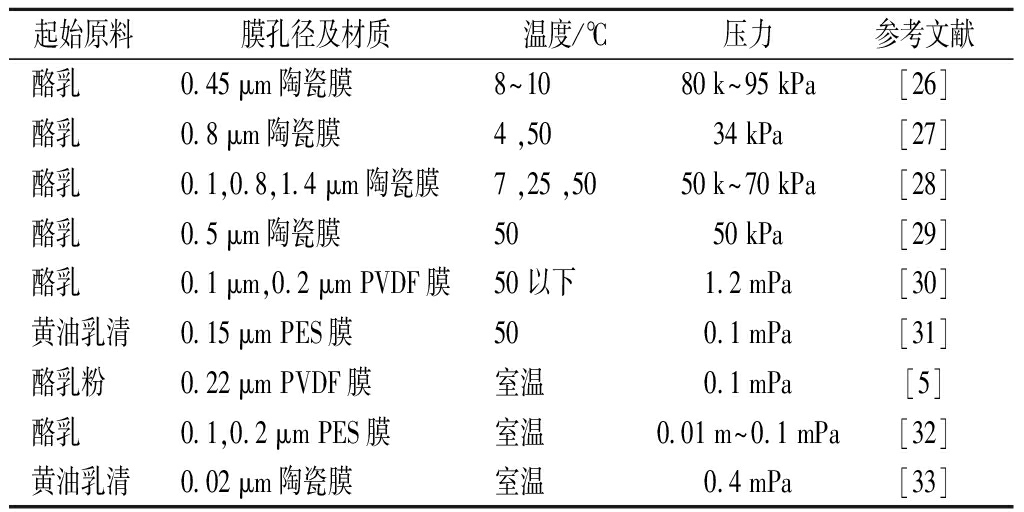
起始原料膜孔径及材质温度/℃压力参考文献酪乳0.45 μm陶瓷膜8~10 80 k~95 kPa[26]酪乳0.8 μm陶瓷膜4 ,50 34 kPa[27]酪乳0.1,0.8,1.4 μm陶瓷膜7 ,25 ,50 50 k~70 kPa[28]酪乳0.5 μm陶瓷膜50 50 kPa[29]酪乳0.1 μm,0.2 μm PVDF膜50 以下1.2 mPa[30]黄油乳清0.15 μm PES膜500.1 mPa[31]酪乳粉0.22 μm PVDF膜室温0.1 mPa[5]酪乳0.1,0.2 μm PES膜室温0.01 m~0.1 mPa [32]黄油乳清0.02 μm陶瓷膜室温0.4 mPa[33]
MFGM片段与酪蛋白胶束的尺寸有部分重叠是TFF技术分离MFGM面临的最大挑战[34]。MFGM片段大小为0.1~3 μm,酪蛋白胶束大小为0.05~0.6 μm[35],因此在MFGM富集液前处理阶段需要对酪蛋白胶束进行一定程度的尺寸重构,使其整体尺寸<0.1 μm,或使其凝结形成块状沉淀并去除[36]。除酪蛋白尺寸外,滤膜材质、跨膜压力和跨膜温度等也能影响膜通量,须对其进行优化,才能保证滤膜不被堵塞并提高MFGM材料的纯度。
2.2.1 酪蛋白尺寸重构在膜浓缩技术中的应用
柠檬酸钠是重构酪蛋白尺寸常用的试剂,加入柠檬酸钠处理并静置一段时间后,大部分酪蛋白胶束尺寸会减小至0.1 μm以下。有研究以柠檬酸钠作为解离剂对酪蛋白胶束尺寸进行重构,后用孔径为0.1 μm的滤膜过滤,得到的滤液中MFGM蛋白含量显著高于未加入柠檬酸钠的对照组[30]。ROMBAUT等[31]以温度和柠檬酸钠浓度为变量设计正交实验,得到其最佳解离温度为50 ℃,在此温度下过滤得到的MFGM蛋白含量较高,且加入柠檬酸钠提高了渗透通量,使污垢最小化。但是同时也造成脂质失稳,导致极性脂质大量损失。MFGM材料中不仅蛋白质具有生物活性功能,极性脂质也有不可替代的作用,因此柠檬酸钠是否为最适合的酪蛋白胶束解离液仍有待考究。
除柠檬酸钠外,凝乳酶也是重构酪蛋白尺寸的常用试剂,其原理与柠檬酸钠解离酪蛋白胶束使其尺寸变小不同,凝乳酶能诱导酪乳中的酪蛋白胶束聚结,尺寸变大,形成块状沉淀。HOLZMÜLLER[37]等以酪乳为原料,经凝乳酶凝结后过滤制取MFGM,具体流程图见图3。
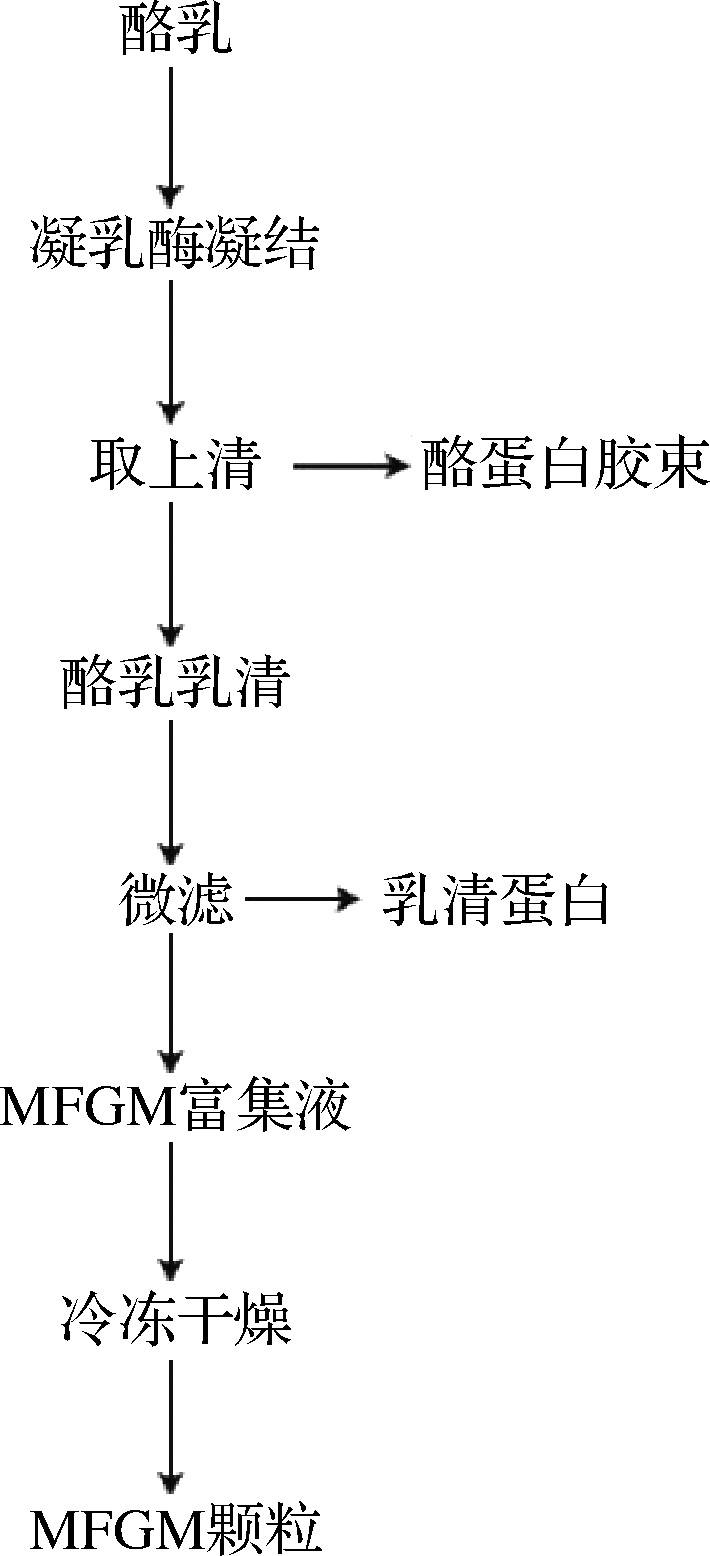
图3 凝乳酶凝结后微滤制取MFGM流程图[37]
Fig.3 Flow chart of microfiltration to produce MFGM after rennet[37]
首先使用凝乳酶使酪乳中的天然酪蛋白胶束凝结,待聚集的酪蛋白胶束沉淀后取上清液,得到酪乳乳清。第2步过滤乳清,去除乳清蛋白,乳糖和矿物质等,即得到纯净的MFGM。结果表明,该方法对于分离MFGM材料效果明显,MFGM蛋白含量远高于乳脂洗涤方法。但是与分离之前的原料酪乳相比,蛋白质仍然有较大的损失。必须要对凝乳酶凝结条件如温度、pH等,做进一步的优化。因此他们对之前两步法制取MFGM的凝乳条件进行了改进,在凝乳过程中,通过改变酪乳的温度和pH,确定既能完全去除酪蛋白胶束同时又得到最多的MFGM蛋白的最佳凝乳条件。结果表明,在25 ℃、pH 6.4和40 ℃、pH 7.5的环境下,所有的酪蛋白胶束都被去除[30]。与酸化制取MFGM[38]相比,30%~40%的嗜乳脂蛋白、40%~50%的XDH等MFGM整合蛋白被保留下来。对于凝乳酶聚集酪蛋白胶束制取MFGM,不仅凝乳条件需要进一步的优化。对于之后的微滤过程也要进行研究,合理的微滤次数和膜孔径等对MFGM纯度的影响是未来研究的重点。
2.2.2 切向流过滤系统在膜浓缩制备MFGM中的应用
切向流过滤与传统的垂直过滤(normal flow filtration,NFF)不同,在TFF中酪乳等原料呈切向流过膜表面,蠕动泵产生的跨膜压力将部分料液压过滤膜到达透过端口,而不能通过滤膜的截留部分则在体系中循环流动,整个过程中料液以一定的速度流过滤膜表面同时对膜表面进行冲刷,使富集液中残留的部分酪蛋白胶束不会在膜表面堆积,保证滤膜有足够的通量,提高过滤效率及MFGM纯度[39]。TFF技术制备MFGM物质对滤膜的材质有一定的要求,在之前的研究中大多采用陶瓷材质的滤膜,这种滤膜具有较高的耐化学性,可承受温度范围较宽等优势。但是该材质的滤膜与一部分MFGM蛋白质所带电荷相反,会导致蛋白质与膜之间静电吸引,使部分MFGM蛋白质吸附于膜表面,造成了一定程度的蛋白质损失且降低膜通量。而改性聚醚砜材质的滤膜对蛋白质表现出较低的吸附性[31],可以在制备MFGM时保证足够的通量,但是能够生产该材质滤膜的厂家较少,因此在制备MFGM的研究中应用也较少。除滤膜材质外,跨膜压力、温度等因素也会对膜通量和MFGM分离效果有一定的影响,但是由于TFF系统在运行过程中会由于膜堵塞导致通量变低等因素导致跨膜压力发生一定程度变化且跨膜温度也无法进行精确控制,所以目前还缺乏对这些因素的优化研究。
TFF技术制备MFGM,虽然能够降低能耗且提高得率,但是其价格昂贵,后续对滤膜的清洗及保养过程较为繁琐,若清洗不彻底会对滤膜的通量及使用寿命造成一定的影响,所以这也是膜浓缩制备MFGM在工业规模上应用的最大障碍。
3 MFGM的乳化特性
乳液体系由被分散的油相和连续的水相组成,由于油相与水相之间存在密度差,随着时间的推移,乳液内部会出现重力分离、颗粒聚集、絮凝、相分离和Ostwald熟化等现象[40]。为了克服这些问题,通常将乳化剂加入到水包油型乳液中。乳化剂包括合成乳化剂和天然乳化剂,目前已经证明合成乳化剂在稳定乳液方面效果显著,但是考虑到将其加入食品中的安全问题,研究人员更倾向于探索一些天然乳化剂。MFGM在牛乳中即扮演乳化剂的角色,对阻止脂肪球聚集起着关键作用。研究表明,MFGM主要组分蛋白质和极性脂质,都具有很强的乳化性。并且MFGM作为一种在牛乳中提取到的物质,安全性有保证,具有替代合成乳化剂的潜力。
3.1 MFGM各组分的乳化性
3.1.1 MFGM蛋白质的乳化性
MFGM蛋白质具有亲水亲油性,可像酪蛋白等具有乳化性的乳蛋白一样,吸附到液滴表面。有研究分析了MFGM蛋白质对水包油乳液的影响,发现在相同浓度下,MFGM蛋白质比低分子量表面活性物质更容易吸附于水油界面上[5]。待MFGM蛋白质吸附于水油界面后,会在油滴周围形成一层黏弹性吸附膜。这种膜会产生静电斥力,防止液滴之间的聚集,使乳液具有稳定性[41]。SHIMIZU等[42]观察到在洗涤过的洁净乳脂中,当MFGM蛋白质被木瓜蛋白酶消化时,聚集的脂肪球使乳脂稳定性大大降低,较直观地体现了MFGM蛋白质是通过中断脂肪球聚集从而在稳定乳脂中发挥重要作用。
乳液物理指标如液滴粒径大小、ζ-电位等可作为判断乳化剂乳化性效果强弱的标准。一般来说,在水包油乳液中加入乳化剂并混合均匀后,所形成的乳液ζ-电位(正或负)绝对值越高,乳状液液滴粒径越小,表明乳液体系越稳定[43]。HE等[44]发现在相同的浓度下MFGM蛋白质制备的水包油型乳剂比用MFGM极性脂质制备的粒径更小,并且在pH影响乳液稳定性实验中,ζ-电位始终略高于以MFGM极性脂质为乳化剂制备的乳液。目前对MFGM蛋白质乳化性强弱的研究大多以同为MFGM组分的极性脂质为对照,尚缺乏与同类具有乳化性的乳蛋白对比分析,还需要在进一步的研究中完善。
MFGM蛋白质的乳化能力强弱与加入乳液的pH值有关,在乳液pH<6时,MFGM蛋白质的乳化能力会降低,导致其出现明显的液滴聚集现象[6]。进一步的研究表明,大部分MFGM蛋白质的pI值在4~6,当pH<6时,一些MFGM蛋白质会沉淀下来导致排斥性电荷减少,进而液滴之间的排斥力减小,造成一定程度的聚集。因此,在MFGM蛋白质稳定的乳液pH值较低时,可以向乳液体系中加入多价阳离子,如Ca2+、Fe2+等[45],用于平衡排斥性电荷减少导致的液滴聚集。
越来越多的研究证明MFGM蛋白质具有较强的乳化作用,但是其乳化性与MFGM诸多种蛋白质中哪一种有关,目前还没有确切结论。MFGM蛋白质种类多含量少,且多数为与膜结构紧密相关的整合蛋白,对分离纯化造成了很大的困难,因此尚且没有分析具体特定蛋白质在起乳化作用的研究。
3.1.2 MFGM极性脂质的乳化性
极性脂质是MFGM重要组成部分,其乳化功能特性极大地取决于头部极性基团磷酸酯。SHIMIZU等[42]利用磷脂酶C去除磷脂的极性头基团,造成奶油乳液出现液滴聚集现象,稳定性明显下降。猜测可能是磷脂通过极性头离子基团产生的排斥力阻断了脂肪球的结合。头部极性基团不同的磷脂主要有卵磷脂、磷脂酰甘油、磷脂酰肌醇、磷脂酰丝氨酸和磷脂酸等,其中磷脂酰肌醇和磷脂酰丝氨酸在MFGM磷脂中占比较高。在用于覆盖乳液液滴的各种表面活性剂中,MFGM磷脂由于其良好的生物相容性比简单的表面活性剂更有效[44]。ZHU等[8]以干酪乳清为原料分离出MFGM,并用乙醇萃取MFGM中的磷脂,探究MFGM极性脂质的乳化性。以2%MFGM磷脂浓度配制的乳液在常温下放置14 d,无明显液滴聚集现象。以大于4% MFGM磷脂浓度制备的乳液能非常稳定地在室温下保存60 d以上,且平均液滴尺寸保持在0.4 μm,没有出现明显的液滴聚集现象。
此外,HE等[44]研究了MFGM极性脂质作为乳化剂制备乳液的流变特性,结果表明其制备的乳液黏度较高,流变性能较MFGM蛋白质制备的乳液差。因此对MFGM极性脂质在产品上的应用造成一定局限。
3.1.3 MFGM蛋白质与极性脂质协同乳化作用
单一乳化剂作用于乳液,都有其缺点。例如单独以蛋白质作为乳化剂,它们在液滴表面形成的黏弹性吸附膜韧性通常不够,不能长时间保持液滴分散,难以满足乳液稳定的需求[44]。单独以极性脂质作为乳化剂,虽然在降低界面张力,形成更薄、延展性更强的界面层方面效率更高,但界面层由于缺乏空间排斥,易受脂肪滴聚结的影响。而蛋白质与极性脂类物质协同作用于乳液液滴,在蛋白质形成黏弹性膜的同时,极性脂质会作用于界面蛋白膜网络之间的小孔或缺陷,从而降低表面张力,增加吸附膜的韧性,达到乳液长期贮存保持稳定的效果[46],图4为该协同过程示意图。而MFGM组分的特殊性则可以满足上述条件,MFGM主要由蛋白质和极性脂质组成,可以近似地看做两者协同。HE等[44]发现用完整的MFGM材料比仅用MFGM极性脂质作为乳化剂制备的乳液具有更小的液滴粒径且稳定性更高。
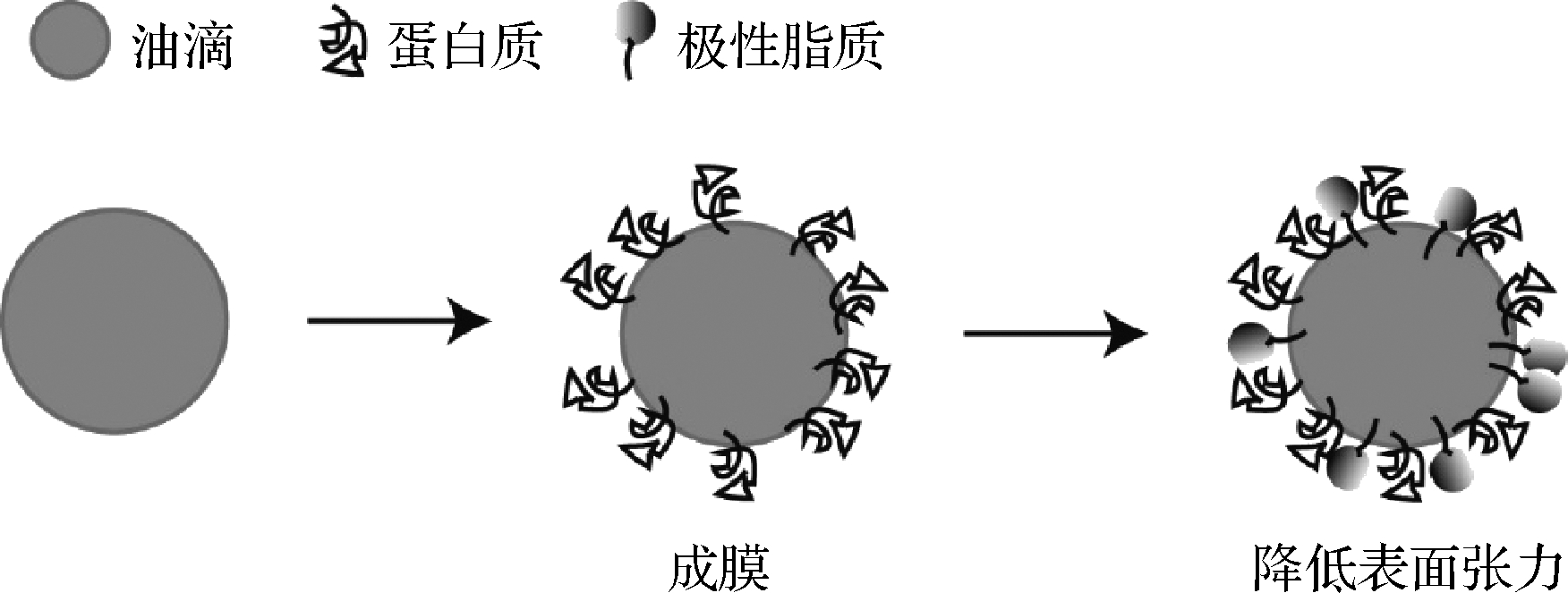
图4 蛋白质与极性脂质协同稳定乳液液滴过程示意图[46]
Fig.4 Schematic diagram of the process of protein and polar lipids synergistically stabilizing emulsion droplets[46]
目前,MFGM蛋白质与极性脂质协同作用,在减小乳液液滴尺寸和维持稳定性方面效果明显。但是蛋白质与极性脂质协同作用于乳液还会产生竞争性吸附问题,极性脂质属于小分子表面活性剂,会因浓度问题与液滴表面蛋白质产生置换现象,使液滴界面形成以极性脂质为主体的界面层,导致液滴表面排斥性电荷减少。最直观的体现就是随着极性脂质浓度的不断升高,乳液的ζ-电位逐渐降低,从而对乳液稳定性产生一定的影响。目前对MFGM蛋白质和MFGM极性脂质协同作用于乳液的研究不多,是否会发生竞争性吸附问题还需要进一步的研究阐明。
3.2 MFGM作用于乳液的界面性质
界面性质是微观角度上衡量乳化剂性能强弱的标准,乳化剂的最佳使用取决于对其界面物理化学特性的了解,如表面活性、可混溶性、表观黏度等,特别是分析在流体界面形成吸附膜动力学[47]。PHAN等[5]发现MGFM受到其组分蛋白质和脂质相互作用的影响,导致界面性质不同。在这一研究结果基础之上,PRIYANKA等[48]利用朗缪尔等温线研究乳脂球膜各组分的界面性质,朗缪尔薄膜是表征单分子层和分子间相互作用的有效工具,能有效地对MFGM各组分的界面性质进行表征。结果发现富含蛋白质的MFGM组分在空气/水界面形成的薄膜表面弹性低于其他组分,说明其对泡沫和悬浮液的稳定能力不理想。具有丰富极性脂质的MFGM组分相对于其他组分具有更好的表面弹性,对泡沫和悬浮液具有更好的稳定作用。
迄今为止,所有表征MFGM界面性能的研究都是在空气/水界面进行的,由于胶体组成体系的复杂性,因此鲜有对MFGM乳液油/水界面性能的研究。与MFGM空气/水界面相比,油/水界面处形成的膜具有更大的膨胀相。造成膨胀的原因是因为相转变,在第一次转变期间,一些分子被迫进入油相,这导致液体膨胀相的扩展,油层与MFGM中的一些在油中高度溶解且带有疏水侧链氨基酸的蛋白质以及MFGM中性脂质结合。第2次相转变期间,MFGM极性脂质发生位移,与部分蛋白质结合进入油相[48]。为了更好地理解这一问题,未来的研究可以转向分析MFGM极性脂质、蛋白质的行为及其在油/水界面上的相互作用。
3.3 MFGM的乳化性应用
3.3.1 仿MFGM结构脂质体系构建
牛乳中甘油三酯是在粗面内质网膜上合成的,它将磷脂、糖脂、胆固醇和蛋白质转移到微脂滴上,形成了主要的界面层。这些微脂滴通过合并而增长,最终运输到顶端质膜被原生质膜包裹,通过budding-off机制被排泄到乳汁中,再次被来自于乳腺上皮细胞的双层膜包裹,从而形成MFGM的3层纳米结构。这种独特的膜结构既能阻止脂滴之间的聚集,又能保护脂滴免受酶的降解[2]。受该结构的启发,可以用来制备封装含天然食品成分的乳状液滴。这种结构的预期好处是对包封脂滴核心含有的氧化敏感食品成分起到一定的保护作用,并且可以有效地阻止液滴聚集,保持乳液长时间稳定。LIVNEY等[49]以乳铁蛋白作为主乳化剂,外层利用磷脂双分子层包覆,制备了类似MFGM结构的“涂层乳液”并对其进行表征。在透射电子显微镜图像中观察到了不同磷脂浓度下层片状磷脂结构的形成,以及1个或几个油滴的包覆/包封。但是层状结构不完整,还需要进一步优化工艺以提高涂层的均匀性。CHEN等[50]受MFGM结构启发,以植物磷脂和乳蛋白作为包封材料制备DHA油乳液,成功制备的DHA油乳液具有纳米级颗粒,显著降低了DHA油乳液的表面张力,从而增加了乳液的稳定性。且喷雾干燥后形成的DHA微胶囊体外消化实验表明,能有效抵抗胃蛋白酶酶解,保护其在肠道内的生物活性。这种对敏感物质起保护作用的新型封装方法,是一种潜在的工业应用。若要成功应用这项技术,还需对包封参数进行优化[49]。进一步研究将集中于在包封的均匀性和完整性两方面,以达到完全保护敏感食品成分和维持乳液稳定性的效果。
3.3.2 MFGM改善发酵食品的持水性
食品的持水能力关系到其香气、滋味及营养成分等,在发酵食品制作过程中添加MFGM,能改善其持水性并且增加产品的营养成分。LE等[51]利用膜浓缩技术从酪乳中分离出MFGM,观察MFGM应用于发酵酸奶生产的效果。结果表明酸奶的发酵效果没有因为MFGM的加入而改变,并且随着MFGM浓度的增加使得酸奶持水能力显著提高。通过CLSM观察,富含MFGM酸奶的微观结构比普通酸奶更为致密。除了发酵乳制品外,在发酵烘焙制品中有同样的效果。TANG等[52]研究了MFGM的添加对面团性质、微观结构和小麦面包保鲜的影响。结果表明,MFGM的加入改变了面团的性质。与对照组相比,采用MFGM制备的面团持水性较好。通过扫描电镜观察面包片的微观结构,加入了MFGM的面包片中,面筋与淀粉之间形成了具有层状结构的薄膜,有效地提高小麦面包的品质,延长面包的保质期。
3.3.3 MFGM改善稀奶油搅打性
稀奶油的搅打性与其脂肪含量有关,脂肪含量越高搅打性越好,这与当前崇尚低脂饮食的生活理念相悖。而低脂稀奶油加工过程中必须加入一定量的乳化剂,用以延长货架期且改善搅打性。目前稀奶油常用乳化剂如单、双甘油脂肪酸酯等大多为人工合成,安全性不如MFGM这类天然乳化剂。且有研究表明,MFGM蛋白质可以与具有乳化作用的乳蛋白乳清蛋白、酪蛋白一样,改善稀奶油的搅打性,MFGM蛋白质可以在界面处吸收,从而降低界面张力,稳定脂滴和泡沫[53]。该研究为MFGM应用于脂肪含量较低的稀奶油中提供了一定理论基础,但是目前尚无MFGM添加到低脂稀奶油的应用研究,还需要对添加MFGM成分的低脂稀奶油搅打性进行综合评价,看有无替代单、双甘油脂肪酸酯等常用乳化剂的可能性。
4 结语
MFGM以其独特的结构和成分,有效地保证了牛乳在贮藏期间的稳定性。将它从牛乳或其他原料中提取出来,依然保持着其原始功能。在MFGM的制备方面,国外技术已经相对成熟,丹麦Arla食品公司产品如Lacprodan® MFGM-10等工艺相对完善,且已应用于多款旗下产品中。但是国内目前对MFGM的研究刚刚起步,制备技术仍然停留在实验室阶段,真正大规模工业化应用还任重道远。因此,研究除离心浓缩法和膜过滤法之外的制备技术,或者在2种方法的基础上进行工艺的优化是未来研究的重点。随着对MFGM功能研究的不断深入,其乳化特性逐渐引起了人们的广泛关注。考虑到加入食品中的安全性问题,天然乳化剂代替合成乳化剂是当前的趋势。MFGM作为天然乳化剂,除了具有乳化性外,还有抗炎、抗病毒等生物功能。将其加入到食品中,既能改善食品的性质又能增加其营养成分。但是现在将其乳化特性应用于产品中的研究较少,还需要在未来的研究中进一步完善。
[1] SINGH H,GALLIER S.Nature’s complex emulsion:The fat globules of milk[J].Food Hydrocolloids,2017,68:81-89.
[2] JUKKOLA A,ROJAS O J.Milk fat globules and associated membranes:Colloidal properties and processing effects[J].Advances in Colloid and Interface Science,2017,245:92-101.
[3] LOPEZ C,MADEC M-N,JIMENEZ-FLORES R.Lipid rafts in the bovine milk fat globule membrane revealed by the lateral segregation of phospholipids and heterogeneous distribution of glycoproteins[J].Food Chemistry,2010,120(1):22-33.
[4] ZOU X Q,GUO Z,JIN Q Z,et al.Composition and microstructure of colostrum and mature bovine milk fat globule membrane[J].Food Chemistry,2015,185:362-370.
[5] PHAN T T Q,LE T T,VAN DE WALLE D,et al.Combined effects of milk fat globule membrane polar lipids and protein concentrate on the stability of oil-in-water emulsions[J].International Dairy Journal,2016,52:42-49.
[6] JUKKOLA A,PARTANEN R,XIANG W C,et al.Food emulsifiers based on milk fat globule membranes and their interactions with calcium and casein phosphoproteins[J].Food Hydrocolloids,2019,94:30-37.
[7] QU X N,HU H Y,WANG Y,et al.Proteomics analysis of milk fat globule membrane enriched materials derived from by-products during different stages of milk-fat processing[J].LWT,2019,116:108 531.
[8] ZHU D,DAMODARAN S.Dairy lecithin from cheese whey fat globule membrane:Its extraction,composition,oxidative stability,and emulsifying properties[J].Journal of the American Oil Chemists’ Society,2013,90(2):217-224.
[9] SHARMA P,OEY I,EVERETT D W.Interfacial properties and transmission electron microscopy revealing damage to the milk fat globule system after pulsed electric field treatment[J].Food Hydrocolloids,2015,47:99-107.
[10] YE A Q,SINGH H,TAYLOR M W,et al.Interactions of whey proteins with milk fat globule membrane proteins during heat treatment of whole milk[J].Le Lait,2004,84(3):269-283.
[11] TIMBY N,DOMELLÖF M,LÖNNERDAL B,et al.Supplementation of infant formula with bovine milk fat globule membranes[J].Advances in Nutrition,2017,8(2):351-355.
[12] HOLZMÜLLER W,MÜLLER M,HIMBERT D,et al.Impact of cream washing on fat globules and milk fat globule membrane proteins[J].International Dairy Journal,2016,59:52-61.
[13] ZHENG H T,JIMÉNEZ-FLORES R,EVERETT D W.Bovine milk fat globule membrane proteins are affected by centrifugal washing processes[J].Journal of Agricultural and Food Chemistry,2013,61(35):8 403-8 411.
[14] LE T T,DEBYSER G,GILBERT W,et al.Distribution and isolation of milk fat globule membrane proteins during dairy processing as revealed by proteomic analysis[J].International Dairy Journal,2013,32(2):110-120.
[15] WANG Y,LIU M X,QU X N,et al.Changes in the fat globule membrane protein components of pasteurized milk caused by different homogenization conditions determined using a label-free proteomic approach[J].LWT,2019,115:108 430.
[16] BRITTEN M,LAMOTHE S,ROBITAILLE G.Effect of cream treatment on phospholipids and protein recovery in butter-making process[J].International Journal of Food Science & Technology,2008,43(4):651-657.
[17] LE T T,VAN CAMP J,ROMBAUT R,et al.Effect of washing conditions on the recovery of milk fat globule membrane proteins during the isolation of milk fat globule membrane from milk[J].Journal of Dairy Science,2009,92(8):3 592-3 603.
[18] BRUNNER J R,DUNCAN C W,TROUT G M.The fat-globule membrane op nonhomogenized and homogenized milk.i.the isolation and amino acid composition of the fat-membrane proteins[J].Journal of Food Science,1953,18(1-6):454-462.
[19] HOLZMÜLLER W,KULOZIK U.Technical difficulties and future challenges in isolating membrane material from milk fat globules in industrial settings - A critical review[J].International Dairy Journal,2016,61:51-66.
[20] ZHANG T,QIU Y G,LUO Q C,et al.Concentration dependent effects of Ca2+ and Mg2+ on the phosphatidylethanolamine-phosphatidylglycerol bilayer[J].物理化学学报,2019,35(8):840-849.
[21] BASCH J J,GREENBERG R,FARRELL H M.Identification of the milk fat globule membrane proteins.:II.Isolation of major proteins from electrophoretic gels and comparison of their amino acid compositions[J].Biochimica et Biophysica Acta (BBA),1985,830(2):127-135.
[22] GUERIN J,BURGAIN J,GOMAND F,et al.Milk fat globule membrane glycoproteins:Valuable ingredients for lactic acid bacteria encapsulation?[J].Critical Reviews in Food Science and Nutrition,2019,59(4):639-651.
[23] GAUVIN M P,POULIOT Y,BRITTEN M.Rennet coagulation properties of milk in the presence of MFGM fragments isolated from raw-and pasteurised-cream buttermilk[J].International Dairy Journal,2018,85:153-158.
[24] ZHENG H T,JIMÉNEZ-FLORES R,GRAGSON D,et al.Phospholipid architecture of the bovine milk fat globule membrane using giant unilamellar vesicles as a model[J].Journal of Agricultural and Food Chemistry,2014,62(14):3 236-3 243.[LinkOut]
[25] JUKKOLA A,PARTANEN R,ROJAS O J,et al.Separation of milk fat globules via microfiltration:Effect of diafiltration media and opportunities for stream valorization[J].Journal of Dairy Science,2016,99(11):8 644-8 654.
[26] MORIN P,POULIOT Y,JIMéNEZ-FLORES R.A comparative study of the fractionation of regular buttermilk and whey buttermilk by microfiltration[J].Journal of Food Engineering,2006,77(3):521-528.
[27] ASTAIRE J C,WARD R,GERMAN J B,et al.Concentration of polar MFGM lipids from buttermilk by microfiltration and supercritical fluid extraction[J].Journal of Dairy Science,2003,86(7):2 297-2 307.
[28] MORIN P,JIMÉNEZ-FLORES R,POULIOT Y.Effect of temperature and pore size on the fractionation of fresh and reconstituted buttermilk by microfiltration[J].Journal of Dairy Science,2004,87(2):267-273.
[29] MORIN P,BRITTEN M,JIMÉNEZ-FLORES R,et al.Microfiltration of buttermilk and washed cream buttermilk for concentration of milk fat globule membrane components[J].Journal of Dairy Science,2007,90(5):2 132-2 140.
[30] CORREDIG M,ROESCH R R,DALGLEISH D G.Production of a novel ingredient from buttermilk[J].Journal of Dairy Science,2003,86(9):2 744-2 750.
[31] ROMBAUT R,DEJONCKHEERE V,DEWETTINCK K.Microfiltration of butter serum upon casein micelle destabilization[J].Journal of Dairy Science,2006,89(6):1 915-1 925.
[32] ROMBAUT R,DEJONCKHEERE V,DEWETTINCK K.Filtration of milk fat globule membrane fragments from acid buttermilk cheese whey[J].Journal of Dairy Science,2007,90(4):1 662-1 673.
[33] GASSI J Y,BLOT M,BEAUCHER E,et al.Preparation and characterisation of a milk polar lipids enriched ingredient from fresh industrial liquid butter serum:Combination of physico-chemical modifications and technological treatments[J].International Dairy Journal,2016,52:26-34.
[34] MORIN P,JIMÉNEZ-FLORES R,POULIOT Y.Effect of processing on the composition and microstructure of buttermilk and its milk fat globule membranes[J].International Dairy Journal,2007,17(10):1 179-1 187.
[35] HOLZMÜLLER W,GMACH O,GRIEBEL A,et al.Casein precipitation by acid and rennet coagulation of buttermilk:Impact of pH and temperature on the isolation of milk fat globule membrane proteins[J].International Dairy Journal,2016,63:115-123.
[36] DEWETTINCK K,ROMBAUT R,THIENPONT N,et al.Nutritional and technological aspects of milk fat globule membrane material[J].International Dairy Journal,2008,18(5):436-457.
[37] HOLZMÜLLER W,KULOZIK U.Isolation of milk fat globule membrane (MFGM) material by coagulation and diafiltration of buttermilk[J].International Dairy Journal,2016,63:88-91.
[38] KANNO C,KIM D H.A simple procedure for the preparation of bovine milk fat globule membrane and a comparison of its composition,enzymatic activities,and electrophoretic properties with those prepared by other methods[J].Agricultural and Biological Chemistry,1990,54(11):2 845-2 854.
[39] MUSUMECI T,LEONARDI A,BONACCORSO A,et al.Tangential flow filtration technique:An overview on nanomedicine applications[J].Pharmaceutical Nanotechnology,2018,6(1):48-60.
[40] ZHAO R N,SONG R,SUN G G,et al.Cutoff Ostwald ripening stability of eugenol-in-water emulsion by co-stabilization method and antibacterial activity evaluation[J].Food Hydrocolloids,2020,107:105 925.
[41] GUNNING P A,MACKIE A R,GUNNING A P,et al.Effect of surfactant type on Surfactant-Protein interactions at the Air-Water interface[J].Biomacromolecules,2004,5(3):984-991.
[42] SHIMIZU M,YAMAUCHI K,KANNO C J.Effect of proteolytic digestion of milk fat globule membrane proteins on stability of the globules[J].Milchwissenschaft,1980,35(1):9-12.
[43] 孙颜君.乳蛋白浓缩物加工特性及其应用研究进展[J].食品工业,2014,35(7):210-215.
SUN Y J.The functionality and application of milk protein concentrate[J].The Food Industry,2014,35(7):210-215.
[44] HE S H,TANG H S,YI H X,et al.Properties of emulsions from milk fat globule membrane and its components[J].International Journal of Food Properties,2017,20(sup2):1 342-1 353.
[45] 王君文,韩旭,李田甜,等.乳化剂稳定乳液的机理及应用研究进展[J].食品科学,2020,41(21):303-310.
WANG J W,HAN X,LI T T,et al.Mechanism and application of emulsifiers for stabilizing emulsions:A review[J].Food Science,2020,41(21):303-310.
[46] MCCLEMENTS D J,JAFARI S M.Improving emulsion formation,stability and performance using mixed emulsifiers:A review[J].Advances in Colloid and Interface Science,2018,251:55-79.
[47] CEJUDO FERN NDEZ M,CARRERA S
NDEZ M,CARRERA S NCHEZ C,ROSARIO RODR
NCHEZ C,ROSARIO RODR GUEZ NI
GUEZ NI O M,et al.Structural characteristics of adsorbed protein and monoglyceride mixed monolayers at the air-water interface[J].Food Hydrocolloids,2007,21(5-6):906-919.
O M,et al.Structural characteristics of adsorbed protein and monoglyceride mixed monolayers at the air-water interface[J].Food Hydrocolloids,2007,21(5-6):906-919.
[48] PRIYANKA M,SABINE D,AMAN P,et al.The interfacial properties of various milk fat globule membrane components using Langmuir isotherms[J].Food Bioscience,2017,20:96-103.
[49] LIVNEY Y D,RUIMY E,YE A M,et al.A milkfat globule membrane-inspired approach for encapsulation of emulsion oil droplets[J].Food Hydrocolloids,2017,65:121-129.
[50] CHEN Y,GE H,ZHENG Y,et al.Phospholipid-protein structured membrane for microencapsulation of DHA oil and evaluation of its in vitro digestibility:Inspired by milk fat globule membrane[J].Journal of Agricultural and Food Chemistry,2020,68(22):6 190-6 201.
[51] LE T T,VAN CAMP J,PASCUAL P A L,et al.Physical properties and microstructure of yoghurt enriched with milk fat globule membrane material[J].International Dairy Journal,2011,21(10):798-805.
[52] TANG H S,HE S H,PENG F S,et al.The effects of milk fat globule membrane and its individual components on dough properties and bread quality[J].RSC Advances,2016,6(104):102 617-102 625.
[53] PENG F S,HE S H,YI H X,et al.Physical,textural,and rheological properties of whipped cream affected by milk fat globule membrane protein[J].International Journal of Food Properties,2018,21(1):1 190-1 202.