L-苏氨酸是人体必需氨基酸之一,具有恢复疲劳、促进生长发育的效果,被广泛应用于食品、饲料和医疗等领域[1]。大肠杆菌是苏氨酸的主要发酵菌株,通过对大肠杆菌系统改造能够有效提升苏氨酸产量[2]。例如,过表达苏氨酸合成途径的关键酶以优化碳代谢流;弱化竞争支路以积累可利用的前体物;降低胞内苏氨酸消耗;提高胞外运输等[3-6]。此外,通过优化碳氮源、溶氧等发酵条件,苏氨酸的发酵产量进一步提升[7]。最近,研究者在苏氨酸发酵过程中加入甜菜碱,提升了发酵菌株的耐高渗能力以及产酸能力[8]。
甜菜碱是在甜菜糖蜜中发现的季铵型生物碱,与蛋氨酸、胆碱的化学结构比较相似[9]。甜菜碱是高效的甲基供体,对脱氮假单胞菌维生素B12的生物合成具有促进作用[10-11]。甜菜碱还是一种重要的细胞相容性溶质,在渗透调节方面和保持酶活力方面具有重要作用。YING等[12]比较了4种不同的渗透压保护剂海藻糖、甘氨酸、甜菜碱、脯氨酸对赖氨酸发酵的影响,发现甜菜碱比其他物质更能促进发酵菌株的生长以及产物积累。XU等[13]在研究乳酸发酵时发现,甜菜碱的加入能够提升高糖浓度下乳酸菌的细胞生长速率和乳酸脱氢酶的活力,进而提高乳酸产量。随着系统生物学的发展,从整体水平上研究细胞的生命活动现象已成为可能。通过定量分析细胞成分的变化情况,能够全面地描述并预测细胞的代谢过程。因此,本研究以苏氨酸生产菌株 Escherichia coli THRD 为研究对象,采用代谢组学技术,考察产酸期甜菜碱作用下大肠杆菌胞内代谢物组成和含量的动态变化,筛选出与苏氨酸合成代谢相关的差异代谢物,从代谢层面揭示甜菜碱对大肠杆菌的作用效果。
1 材料与方法
1.1 苏氨酸发酵菌株及培养条件
苏氨酸生产菌株E.coli THRD保存于天津科技大学菌种保藏中心[14]。
种子培养基:蔗糖2.5%(质量分数)、酵母粉1%(质量分数)、蛋白胨0.6%(质量分数)、KH2PO4 0.12%(质量分数)、MgSO4 0.05%(质量分数)、FeSO4 10 mg/L、MnSO4 10 mg/L、维生素B1 1.3 mg/L、维生素H 0.3 mg/L、消泡剂1~2滴。调节pH至7.0~7.2。灭菌条件:115 ℃,15 min。
发酵培养基:葡萄糖3%(质量分数)、酵母粉0.2%(质量分数)、蛋白胨0.4%(质量分数)、柠檬酸钠0.1%(质量分数)、KH2PO4 0.2%(质量分数)、MgSO4 0.07%(质量分数)、FeSO4 100 mg/L、MnSO4 100 mg/L、维生素B1 0.8 mg/L、维生素H 0.2 mg/L、消泡剂3~5滴。调节pH至7.0~7.2。灭菌条件:115 ℃,15 min。
发酵培养方法:将3 mL培养好的种子液接种到装有30 mL发酵培养基的锥形瓶(500 mL)中,在37 ℃、220 r/min下培养菌体24 h。以添加0.5 g/L甜菜碱的发酵培养基为实验组,无添加甜菜碱的为对照组。在发酵过程中,实验组补加含2 g/L甜菜碱的60%的葡萄糖溶液,对照组补加60%的葡萄糖溶液。
1.2 发酵菌体收集及胞内代谢物提取
在取样时间点用移液器快速量取1 mL发酵液,13 000 r/min、-4 ℃下离心3 min,用PBS洗涤2次后离心收集菌体。将菌体置于液氮中研磨成粉末,用天平称取50 mg粉末置于1.5 mL离心管中,加入1 mL预冷的乙腈提取液,振荡均匀后置于液氮中1 min,取出等待融化,如此反复冻融3次,使胞内代谢物逐渐被提取液溶出。13 000 r/min、-4 ℃下离心10 min,取上清液100 μL转移至内衬管中,待测。
1.3 胞内代谢物检测条件
使用超高效液相色谱-飞行时间质谱联用技术(ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry, UPLC Q-TOF MS)分析胞内代谢物。ACQUITY BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)。UPLC采用正负2种离子模式进行采集。正离子模式的流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-乙腈溶液。负离子模式的流动相A为0.1%氨水溶液,流动相B为乙腈溶液。进样量5 μL,进样流速0.5 mL/min,柱温35 ℃,梯度洗脱程序参照文献[15]。Q-TOF采用ESI+和ESI-扫描模式,离子源温度100 ℃,质核比扫描范围50~10 000 m/z,数据采集模式为Centroid。
1.4 数据处理
将所采集的数据使用Masslynx和Progenesis QI软件(Waters,Milford,USA)进行色谱峰的导入、峰对齐、峰提取以及归一化处理。采用无监督主成分分析(principal component analysis,PCA)和有监督正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)进行多元统计分析。为了验证多元统计分析筛选出的变量是否不同,还利用了 Progenesis QI与SPSS软件进行了差异性检验(t检验)与差异倍数检验(fold change)与变量投影重要性指标(variable importance projection,VIP)以确定显著差异代谢物。根据差异代谢物的质荷比、保留时间以及二级碎片信息,通过Progenesis QI软件在HMDB以及KEGG数据库进行检索确定其结构是否与标准物质一致。将鉴定无误的差异代谢物输入Metaboa Analyst 3.0和KEGG数据库进行代谢通路的构建。
2 结果与分析、
2.1 甜菜碱作用下大肠杆菌发酵生产苏氨酸
考察了添加甜菜碱对E.coli THRD摇瓶发酵产苏氨酸的影响。发酵过程中菌体的生物量变化情况如图1-a所示,对照组中最高生物量达到19.05 g/L,与实验组中最高生物量(20.83 g/L)较为接近,说明甜菜碱的加入不会影响细胞的正常生长。发酵过程中对照组和实验组的葡萄糖消耗量均为135 g/L,产物积累情况如图1-b所示,24 h对照组中苏氨酸的产量和糖酸转化率分别为50.74 g/L和37.45%,与之相比,实验组中苏氨酸的产量和糖酸转化率则分别为54.59 g/L和40.69%,分别增加了7.58%和8.65%。由此可以看出,甜菜碱的加入能提高E.coli THRD的发酵产酸能力和糖酸转化率。

a-细胞干重;b-苏氨酸产量
图1 甜菜碱添加对大肠杆菌细胞生长和发酵生产 苏氨酸的影响
Fig.1 Effect of glycine betaine addition on cell growth and threonine production of E.coli THRD
2.2 甜菜碱作用下大肠杆菌胞内差异代谢物分析
2.2.1 PCA
根据2.1的实验结果,选取发酵对数中期12 h以及对数后期18 h作为取样点,将对照组和实验组分别标记为Con-12、Con-18、Bet-12和Bet-18,每个组包括6个平行发酵样本。将质谱测定的胞内代谢物相对含量的数值经标准化和归一化处理,再使用PCA技术处理后得到正、负离子模式下的PCA得分图,如图2所示。PCA是一种无监督的多维统计分析方法,能从总体上反应各组样本之间的总体代谢差异和组内样本之间的变异度大小。图2-a和2-b中各组6个样本紧密聚集,表明组内重复性好,各组间样本存在明显分离状态,表明组间差异性较大。图中QC表示控制样本,QC紧密聚集,说明实验仪器操作重复性良好,所得数据可靠。
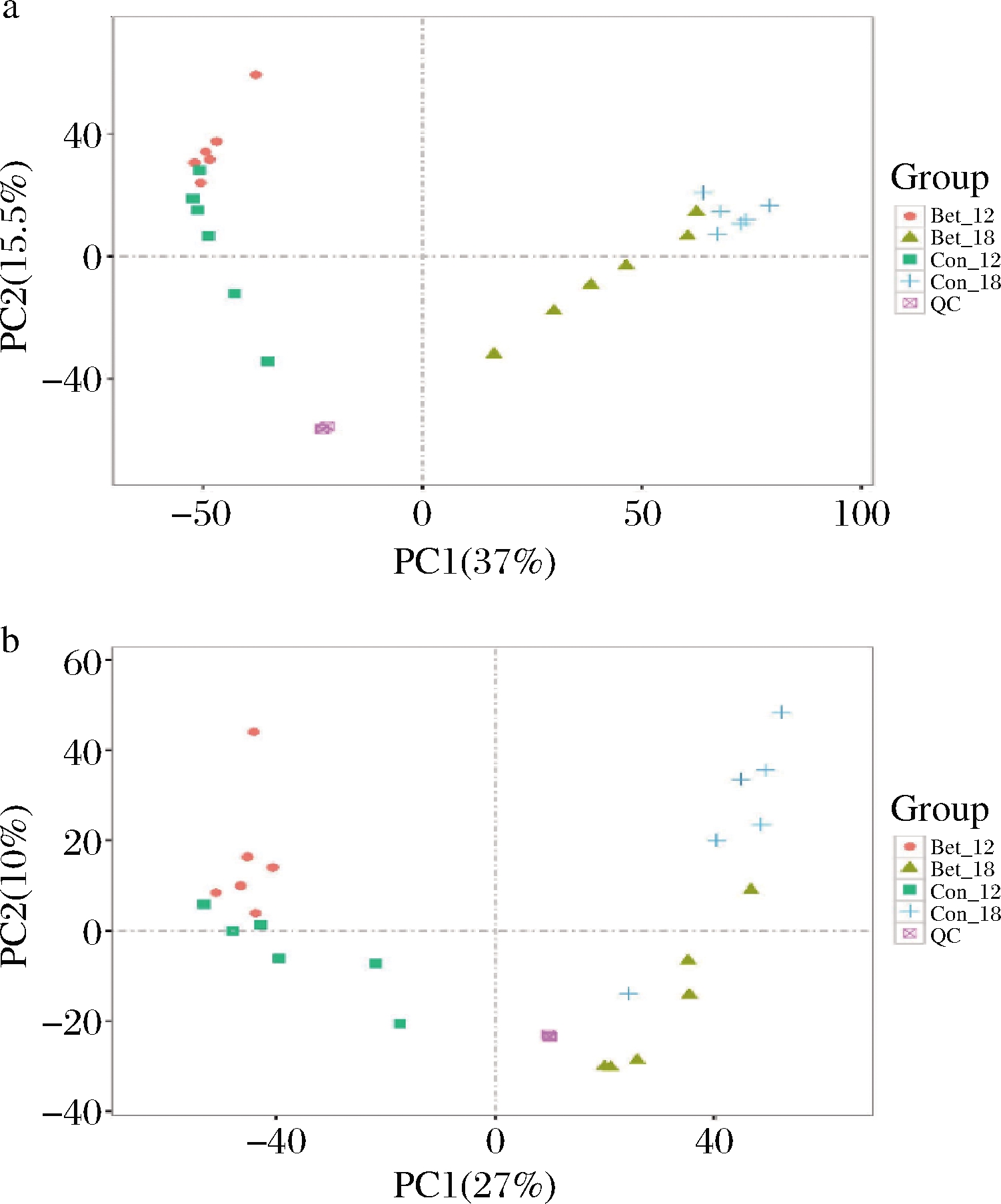
a-正离子模式;b-负离子模式
图2 不同离子模式下的PCA得分图
Fig.2 PCA scoring plots under different ion modes
2.2.2 OPLS-DA
使用OPLS-DA分析正、负离子模式下Con-12和Bet-12,以及Con-18和Bet-18之间的差异代谢物,结果如图3所示。图中各组样本分成明显的2个群且都位于椭圆(95%的置信区间)内,说明2个组别的代谢物有明显的差异。负离子模式下OPLS-DA模型的Q2<0.5(图3-b),说明该模型对于正离子模式下Con-18和Bet-18之间的差异代谢物的预测能力有限。OPLS-DA模型参数中的Q2>0.5(图3-c和3-d),表示模型预测能力较好。

a-正离子模式Con-12 vs Bet-12;b-正离子模式Con-18 vs Bet-18;c-负离子模式Con-12 vs Bet-12;d-负离子模式Con-18 vs Bet-18
图3 不同离子模式下的OPLS-DA得分图
Fig.3 OPLS-DA scoring plots under different ion modes
2.2.3 显著差异代谢物的筛选
结合多元统计分析OPLS-DA的VIP值和单变量统计分析t检验P值来筛选不同比较组间的显著差异代谢物,其中以VIP≥1和P<0.05为筛选标准得到显著差异代谢物178个,与苏氨酸合成代谢相关的显著差异代谢物有28个,分布在糖酵解(Embden-Meyerhof-Parnas,EMP)途径、磷酸戊糖途径(pentose phosphate pathway,PPP)、三羧酸(tricarboxylic acid,TCA)循环以及氨基酸代谢途径,结果如表1所示。
表1 与苏氨酸合成代谢相关的显著差异代谢物
Table 1 Significant differential metabolites related to threonine biosynthesis

模式质荷比保留时间/min代谢物名称分子式相关代谢途径ESI-2591.281-磷酸葡萄糖C6H13O9P2411.386-磷酸葡萄糖C6H13O9P2591.776-磷酸果糖C6H13O9PEMP途径892.413-磷酸甘油醛C3H7O6P8085.52乙酰辅酶AC23H38N7O17P3S2731.196-磷酸葡萄糖酸C6H9O5PPPP途径2111.365-磷酸核酮糖C5H11O8P2291.35-磷酸核糖C5H11O8P2891.277-磷酸景天庚酮糖C7H15O10P1335.98苹果酸C4H6O5TCA循环ESI+2135.825-磷酸木酮糖C5H11O8PPPP途径2011.874-磷酸赤藓糖C4H9O7P3553.46柠檬酸C6H8O71637.31α-酮戊二酸C5H6O5TCA 循环1012.28琥珀酸C4H6O41161.82L-脯氨酸C5H9NO21303.47L-谷氨酸C5H9NO41751.42L-精氨酸C6H14N4O2氨基酸合成代谢1502.48L-甲硫氨酸C5H11NO2S1202.57L-高丝氨酸C4H9NO31201.51L-苏氨酸C4H9NO31342.45L-天冬氨酸C4H7NO41471.27L-赖氨酸C6H14N2O21323.71L-异亮氨酸C6H13NO21051.64L-丝氨酸C3H7NO3902.43L-丙氨酸C3H7NO21182.29L-缬氨酸C5H11NO21323.99L-亮氨酸C6H13NO2
2.3 结合代谢通路解析甜菜碱对大肠杆菌合成苏氨酸的影响
苏氨酸属于天,其合成与葡萄糖中心代谢以及天冬氨酸支路代谢密切相关。苏氨酸合成是一个高还原力(还原型辅酶Ⅱ,NADPH)需求的过程,而细胞内NADPH主要通过PPP途径提供,因此葡萄糖向EMP途径和PPP途径的代谢流量分配会直接影响苏氨酸的合成。如图4所示,Bet-12组6-磷酸果糖和3-磷酸甘油醛的相对含量与Con-12组相比分别下降了55%和49%,而6-磷酸葡萄糖和6-磷酸葡萄糖酸的相对含量与Con-12组相比分别上升了13%和312%。Bet-18组6-磷酸果糖和3-磷酸甘油醛的相对含量与Con-18组相比分别下降了48%和82%,而5-磷酸木酮糖和4-磷酸赤藓糖的相对含量与Con-18组相比分别上升了44%和198%。以上结果表明,在苏氨酸合成期加入甜菜碱对葡萄糖代谢分配的影响是持续性的,葡萄糖流经EMP途径的代谢通量减弱,而流经PPP途径的代谢通量增强。细胞通过PPP途径回补缺失的6-磷酸果糖和3-磷酸甘油醛。这一过程虽然伴随着碳源的损失,但为苏氨酸合成提供了充足的NADPH,从而使得Bet-12组和Bet-18组的苏氨酸相对含量明显提升。苏跃稳[16]利用MATLAB软件考察了甜菜碱对苏氨酸菌种代谢流分布的影响,发现添加甜菜碱后细胞内葡萄糖流向PPP途径的代谢流量提高了57.3%。LI等[17]发现甜菜碱的添加能够提升苏氨酸菌种6-磷酸果糖脱氢酶的酶活力以及其编码基因zwf的表达量,6-磷酸果糖脱氢酶催化的反应伴随着NADPH的形成,因此为苏氨酸的合成提供了更多的还原力。上述研究结果与本研究代谢组学的分析结果一致。
天冬氨酸作为苏氨酸合成的重要前体物,是由草酰乙酸接受谷氨酸转移的氨基形成的,该反应由谷-草转氨酶催化。细胞内天冬氨酸的合成量与底物草酰乙酸和谷氨酸的供给情况密切相关。从图4可知,Bet-12组和Bet-18组谷氨酸的相对含量与Con-12组和Con-18组相比分别提高了21%和49%,脯氨酸的相对含量与Con-12组和Con-18组相比分别下降了25%和77%,说明在苏氨酸合成期加入甜菜碱有助于增强谷氨酸的合成代谢,弱化谷氨酸的支路代谢,进而为转氨反应提供充足的底物。在大肠杆菌中,草酰乙酸的供应主要有2种途径,一种是通过TCA循环,另一种是通过磷酸烯醇式丙酮酸羧化酶催化的CO2固定反应。Bet-12组乙酰辅酶A、柠檬酸和α-酮戊二酸的相对含量与Con-12组相比分别下降了64%、11%和18%,而琥珀酸和苹果酸的相对含量与Con-12组相比变化不大,说明在苏氨酸合成早期加入甜菜碱会减弱草酰乙酸到柠檬酸的代谢,增强磷酸烯醇式丙酮酸到草酰乙酸的代谢。Bet-18组乙酰辅酶A、柠檬酸和α-酮戊二酸的相对含量与Con-12组相比分别上升了307%、49%和44%,而琥珀酸和苹果酸的相对含量与Con-12组相比分别下降了33%和42%,说明在苏氨酸合成中后期加入甜菜碱会强化整个TCA循环的代谢通量流向草酰乙酸和谷氨酸。总体来说,甜菜碱加入有助于细胞积累谷氨酸和草酰乙酸用于合成前体物天冬氨酸,从而使得Bet-12组和Bet-18组的苏氨酸相对含量明显提升。郭群群[18]研究了甜菜碱对苏氨酸生物合成关键酶活性的影响,发现磷酸烯醇式丙酮酸羧化酶的活性提高了16.3%,草酰乙酸的合成量有了明显提高。此外,甜菜碱能够上调乙酰辅酶A合成酶基因和柠檬酸合成酶基因的转录水平,提升TCA循环的代谢通量。上述研究结果与本研究代谢组学的分析结果一致。

图4 甜菜碱对大肠杆菌胞内代谢的影响
Fig.4 Effect of betaine on intracellular metabolism of E.coli THRD 注:图中白色斜纹条表示不加甜菜碱组,黑色条表示加甜菜碱组;所有的胞内代谢物含量均进行了归一化处理;代谢物缩写如下:G1P,1-磷酸果糖;G6P,6-磷酸葡萄糖;6PG,6-磷酸葡萄糖酸;Ribu5P,5-磷酸核酮糖;R5P,5-磷酸核糖;S7P,7-磷酸景天庚酮糖;X5P,5-磷酸木酮糖;E4P,4-磷酸赤藓糖;F6P,6-磷酸果糖;GAP,3-磷酸甘油醛;PEP,磷酸烯醇式丙酮酸;Cit,柠檬酸;α-KG,α-酮戊二酸;Suc,琥珀酸;Fum,延胡索酸;Mal,苹果酸;Oxa,草酰乙酸;Asp,L-天冬氨酸;Lys,L-赖氨酸;Thr,L-苏氨酸;Ile,L-异亮氨酸;Met,L-甲硫氨酸;Glu,L-谷氨酸;Arg,L-精氨酸;Pro,L-脯氨 酸;Ser,L-丝氨酸;Ala,L-丙氨酸;Val,L-缬氨酸;Leu,L-亮氨酸
大肠杆菌内其他氨基酸的合成会竞争性的影响葡萄糖流经苏氨酸的代谢通量,因此对其他氨基酸浓度进行监测有助于进一步理解甜菜碱的作用效果。从图4可知,Bet-12组和Bet-18组丝氨酸的相对含量与Con-12组和Con-18组相比分别下降了22%和25%,说明在苏氨酸合成期加入甜菜碱会减弱3-磷酸甘油醛向丝氨酸的支路代谢,增加了3-磷酸甘油醛的供给。Bet-18组丙氨酸、缬氨酸和亮氨酸的相对含量与Con-18组相比变化不大,说明甜菜碱的加入不会显著影响丙酮酸向这些氨基酸的支路代谢。Bet-18组赖氨酸和异亮氨酸的相对含量与Con-18组相比分别下降了16%和10%,说明甜菜碱的加入会减少天冬氨酸和苏氨酸的支路代谢,促进苏氨酸的合成。Bet-18组高丝氨酸的相对含量与Con-18组相比下降了73%,而甲硫氨酸和苏氨酸的相对含量与Con-18组相比分别提高了60%和276%,说明甜菜碱的加入会促进高丝氨酸的支路代谢,但更偏向于促进高丝氨酸向苏氨酸的转化。
3 结论
为了提高苏氨酸的合成效率,本研究在苏氨酸发酵过程中加入甜菜碱,并利用代谢组学系统分析了甜菜碱对大肠杆菌合成苏氨酸的影响。发酵结果表明,甜菜碱的加入能够明显提高大肠杆菌的苏氨酸产量和糖酸转化率。组学结果表明,甜菜碱的加入能够改变EMP以及PPP途径的碳流分配,使得更多的葡萄糖流经PPP途径为苏氨酸的合成提供还原力;能够动态调节磷酸烯醇式丙酮酸羧化酶催化的CO2固定反应和TCA循环,使细胞能够积累更多的草酰乙酸和谷氨酸用于合成苏氨酸;能够减弱丝氨酸、赖氨酸和异亮氨酸的合成,减少3-磷酸甘油醛、天冬氨酸以及苏氨酸的支路代谢。本研究从代谢层面揭示了甜菜碱的作用效果,为甜菜碱在其他工业发酵产品中的应用提供了理论参考。后续研究需要进一步考察关键代谢节点处的酶表达以及酶活力变化情况,从分子层面阐明甜菜碱对于大肠杆菌的作用方式和作用机制。
[1] BECKER J,WITTMANN C.Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J].Current Opinion in Biotechnology,2012,23(5):718-726.
[2] SONG K H,LEE H H,HYUN H H.Characterization of salt-tolerant mutant for enhancement of L-threonine production in Escherichia coli[J].Applied Microbiology and Biotechnology,2000,54(5):647-651.
[3] DONG X Y,QUINN P J,WANG X Y.Metabolic engineering of Escherichia coli and Corynebacterium glutamicum for the production of L-threonine[J].Biotechnology Advances,2011,29(1):11-23.
[4] ALMAAS E,KOV CS B,VICSEK T,et al.Global organization of metabolic fluxes in the bacterium Escherichia coli[J].Nature,2004,427(6 977):839-843.
CS B,VICSEK T,et al.Global organization of metabolic fluxes in the bacterium Escherichia coli[J].Nature,2004,427(6 977):839-843.
[5] LEE K H,PARK J H,KIM T Y,et al.Systems metabolic engineering of Escherichia coli for L-threonine production[J].Molecular Systems Biology,2007,3(1):149.
[6] LEE J H,SUNG B H,KIM M S,et al.Metabolic engineering of a reduced-genome strain of Escherichia coli for L-threonine production[J].Microbial Cell Factories,2009,8(1):1-12.
[7] CHEN N,HUANG J,FENG Z B,et al.Optimization of fermentation conditions for the biosynthesis of L-threonine by Escherichia coli[J].Applied Biochemistry and Biotechnology,2009,158(3):595-604.
[8] SU Y W,GUO Q Q,WANG S,et al.Effects of betaine supplementation on L-threonine fed-batch fermentation by Escherichia coli[J].Bioprocess and Biosystems Engineering,2018,41(10):1 509-1 518.
[9] FIGUEROA-SOTO C G,VALENZUELA-SOTO E M.Glycine betaine rather than acting only as an osmolyte also plays a role as regulator in cellular metabolism[J].Biochimie,2018,147:89-97.
[10] XIA W,PENG W F,CHEN W,et al.Interactive performances of betaine on the metabolic processes of Pseudomonas denitrificans[J].Journal of Industrial Microbiology and Biotechnology,2015,42(2):273-278.
[11] WARREN M J,RAUX E,SCHUBERT H L,et al.The biosynthesis of adenosylcobalamin (vitamin B12)[J].Natural Product Reports,2002,19(4):390-412.
[12] YING H X,HE X,LI Y,et al.Optimization of culture conditions for enhanced lysine production using engineered Escherichia coli[J].Applied Biochemistry and Biotechnology,2014,172(8):3 835-3 843.
[13] XU K,XU P.Betaine and beet molasses enhance L-lactic acid production by Bacillus coagulans[J].PLoS One,2014,9(6).DOI:10.1371/journal.pone.0100731.
[14] 刘旭峰, 王宁,郝亚男,等.CRISPRi干扰中心代谢基因转录对苏氨酸合成的影响[J].食品与发酵工业,2019,45(8):1-7.
LIU X F,WANG N,HAO Y N,et al.Threonine synthesis under interfered transcriptions of genes involved in central metabolic pathway by CRISPRi[J].Food and Fermentation Industries,2019,45(8):1-7.
[15] MI Z H,KWOK L Y,XUE J G,et al.Fermentation dynamics of Lactobacillus helveticus H9 revealed by ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J].International Journal of Food Science & Technology,2018,53(6):1 442-1 451.
[16] 苏跃稳. L-苏氨酸基因工程菌的改造及发酵过程的优化[D].长春:吉林大学,2017.
SU Y W.Modification of L-threonine-producing strain and optimization of fermentation process[D].Changchun:Jilin University,2017.
[17] LI Y J,ZHANG D Z,CAI N Y,et al.Betaine supplementation improved l-threonine fermentation of Escherichia coli THRD by upregulating zwf (glucose-6-phosphate dehydrogenase) expression[J].Electronic Journal of Biotechnology,2019,39:67-73.
[18] 郭群群. 三甲基甘氨酸对大肠杆菌发酵生产L-苏氨酸的影响[D].长春:吉林大学,2018.
GUO Q Q.Effects of trimethylglycine on L-threonine production in Escherichia coli[D].Changchun:Jilin University,2018.