α-淀粉酶 (EC 3.2.1.1) 是一类重要的工业酶,它可以催化水解淀粉等碳水化合物分子内部的α-D-(1,4)-糖苷键,广泛应用于淀粉糖化、烘焙、纺织等行业[1-2]。目前,α-淀粉酶仍存在发酵酶活力低或耐酸、耐热性不足等问题,并不能完全满足工业需求[3]。地衣芽孢杆菌 (Bacillus licheniformis) 是产α-淀粉酶的重要宿主,具有耐热,蛋白分泌能力强等特点,在淀粉酶发酵工业中具有广泛应用[4]。同时,地衣芽孢杆菌作为一种很有潜力的底盘细胞,在代谢工程、酶工程等领域也备受关注,实现了不同酶的高效表达。然而,关于地衣芽孢杆菌遗传操作系统虽然已有报道[5-10],但是现阶段的遗传操作方法仍存在效率低及不稳定等问题。
近年来,基于自动化和仪器分析技术的高通量筛选平台突破了人工筛选在效率、稳定性和标准化等方面的限制,成为菌种选育与工业酶改造筛选的重要方法。其中,液滴微流控是一种将反应体系微型化的技术,被应用于生物医学以及微生物、酶的高通量筛选[11-16]。该技术可以实现在微体积、大小均一的液滴中对单细胞进行培养、反应、检测和筛选,具有筛选成本低、效率高 (106/h) 等优势[17]。AGRESTI等[18]利用液滴微流控体系对辣根过氧化物酶进行定向进化,通过对107个酵母细胞表面展示的突变体筛选,10 h内成功将酶活性提高10倍。HUANG等[19]利用液滴微流控系统筛选诱变处理的α-淀粉酶分泌酵母菌株,对筛选到的高淀粉酶分泌菌株全基因组测序,并解析其分泌机制。
本研究基于实验室前期筛选获得的产α-淀粉酶地衣芽孢杆菌BLH菌株及其突变体库,通过单细胞液滴制备、液滴反应时间与筛选电压等条件优化,建立了高效的产α-淀粉酶地衣芽孢杆菌液滴微流控筛选方法,最终获得5株高产α-淀粉酶突变菌株。本研究利用高通量筛选方法实现了高产淀粉酶地衣芽孢杆菌的高效进化筛选,也为其他高性能蛋白表达分泌宿主的筛选提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
本研究所用的产α-淀粉酶地衣芽孢杆菌BLH及其突变体库为实验室保藏菌株;LB培养基(g/L):酵母粉5,胰蛋白胨10,NaCl 10,固体培养基加入琼脂粉34;TB培养基(g/L):酵母粉24,胰蛋白胨12,磷酸氢二钾12.54,磷酸二氢钾2.31,甘油5。
1.1.2 主要实验材料
DQ淀粉底物 (BODIPY荧光素偶联淀粉),赛默飞;2% Pico-Surf in Novec 7500/FC40,Dolomite;Droplet Generation Oil for EvaGreen,Bio-Rad;可溶性淀粉及其他化学试剂,国药集团。
二硝基水杨酸 (dinitrosalicylic acid,DNS) 还原糖测定试剂:称取6.3 g DNS并量取262 mL 2 mol/L NaOH加到酒石酸钾钠的热溶液中 (182 g酒石酸钾钠溶于500 mL去离子水中),再加入5 g结晶酚和5 g亚硫酸氢钠,搅拌溶解,冷却后定容至1 000 mL,贮存于棕色瓶中,放置7 d后使用。
缓冲液 (pH=6.0):称取45.23 g Na2HPO4·12H2O和8.07 g一水合柠檬酸,用去离子水溶解并定容至1 000 mL,用pH计校正后使用。
1.1.3 主要仪器与设备
本研究用到的液滴微流控平台包括液滴生成系统、光路系统和分选系统等部分。其中,微液滴生成系统包括液滴生成芯片及微量注射泵,光路系统包括激光器及荧光数据采集器,筛选系统包括高压放大器及液滴微流控分选芯片[20]。
1.2 实验方法
1.2.1 α-淀粉酶荧光检测方法
将DQ淀粉配制成质量浓度为200 μg/mL的溶液,取标准α-淀粉酶溶液稀释至不同浓度,分别取50 μL DQ淀粉溶液和50 μL不同浓度的α-淀粉酶溶液加入到荧光检测专用酶标板中,测定不同时间的荧光值 (Ex=488 nm/Em=520 nm),以验证荧光强度与酶活力及反应时间的相关性关系。
1.2.2 单细胞制备方法
将出发菌株单菌落或突变体库接种于3 mL LB培养基中,37 ℃ 250 r/min培养10~12 h至OD600=2.0左右。此时菌体处于指数生长期,为菌丝状态,无法用于单细胞液滴包埋。因此,将菌液超声处理1~4 min (950 W,2%,超声5 s,停5 s),并在显微镜下观察单细胞分散效果,选择细胞分散效果最好且菌体破碎较少的处理时间进行实验,再用5 μm滤膜除去大颗粒及未彻底分散的菌丝,制备获得单细胞。
1.2.3 单细胞液滴包埋方法
用LB培养基清洗突变体库单细胞菌体3遍,并将OD600值调整至0.07,利用液滴生成芯片制备单细胞液滴。水相为含突变体菌体的LB培养基悬液,其中含有终质量浓度为100 μg/mL的DQ淀粉,总体积400 μL;油相为2% Pico-Surf in FC40、2% Pico-Surf in Novec 7500或者Bio-Rad液滴生成油。将油相和水相分别吸到1 mL无菌注射器内,注射器安装到微量注射泵中并用导管与芯片连接,设定油相流速为400 μL/h,水相流速为200 μL/h,生成直径约为20 μm的单细胞液滴,用装有200 μL对应油相的1 mL无菌注射器收集液滴。将装有单细胞液滴的注射器放置在37 ℃下避光静置培养,定时取样观察液滴,评价液滴稳定性,选择液滴最稳定的油相进行后续实验。
1.2.4 突变体库的液滴微流控筛选
将收集到的单细胞液滴放置在37 ℃下静置培养,定时取样观察液滴中的荧光变化情况,选择适宜的培养时间进行液滴微流控筛选。筛选时将装有油相和液滴的注射器安装到微量注射泵中,用导管将注射器出口连接到微流控液滴分选芯片对应的入口,设置油相流速为200 μL/h、液滴流速为10~15 μL/h,此时液滴流速约为500~1 000个/s。将蓝色激光 (488 nm) 对准筛选芯片的检测点,并采集每个液滴的绿色荧光信号 (520 nm),针对荧光强度最高的30%左右的液滴进行加电,电压设置为300 或500 V,使这些液滴流向筛选芯片的液滴收集出口,将收集到的液滴涂布到LB平板上。
1.2.5 筛选后菌株摇瓶发酵
从平板上挑取若干经液滴微流控筛选出的单菌落接种到2 mL LB培养基中,37 ℃ 250 r/min培养12 h作为种子液,同时接种出发菌株作为对照。初筛时将种子液按1%的接种量转接到装有10 mL TB培养基的100 mL摇瓶中,复筛时按起始OD600=0.05进行转接,37 ℃ 250 r/min培养72 h。测定发酵液OD600值,并用DNS法测定上清液中的α-淀粉酶活性。
1.2.6 酶活力测定方法
用DNS法[21]测定发酵液上清液中的α-淀粉酶活性,具体方法如下:将可溶性淀粉加去离子水煮沸至完全透明,配制成2%的溶液作为酶反应底物,取300 μL底物和100 μL pH=6.0缓冲液到试管中,70 ℃预热2 min,再加入100 μL适当稀释的发酵上清液,70 ℃准确反应5 min后,加入500 μL DNS试剂终止反应,沸水浴10 min,冰上冷却至室温后,将显色后的反应液用去离子水稀释4倍并测定540 nm下的吸光值,以灭活酶为对照,根据葡萄糖制作的标准曲线计算体系中的还原糖量 (以葡萄糖计),计算发酵液上清液中的α-淀粉酶活性,1 U酶活力定义为:1 min降解可溶性淀粉生成1 mg葡萄糖当量的还原性糖的酶量。
2 结果与分析
2.1 α-淀粉酶荧光检测方法的建立与优化
本研究中所用DQ淀粉底物骨架上嵌合有BODIPY荧光素,初始状态下荧光素处于淀粉颗粒内部,无法被激发产生荧光。当淀粉被淀粉酶水解时,淀粉链打开,其中的荧光素暴露出来,能被激发产生荧光,而淀粉水解速度与酶活性具有相关性,所以可以通过荧光强度检测酶活力高低[22]。为建立DQ淀粉底物荧光强度与酶活力的相关性曲线,将不同酶活力的α-淀粉酶溶液与DQ淀粉底物溶液混合进行反应,并测定不同反应时间的荧光值。结果显示,α-淀粉酶能有效降解DQ淀粉并产生荧光,且反应灵敏度高,微量酶活力 (>0.001 U/mL) 条件下,30 min即能产生明显荧光差异 (图1)。在一定酶活力范围内(<0.008 U/mL),荧光强度与酶活呈线性关系 (R2>0.97),同时也与反应时间呈正相关 (R2>0.96),能完全满足检测液滴内单细胞产生的α-淀粉酶活性的要求。

图1 基于DQ淀粉底物的荧光检测方法的优化
Fig.1 Optimization of fluorescence test based on DQ starch substrate
2.2 高活性单细胞制备
地衣芽孢杆菌在指数生长期以菌丝状态存在 (图2-a),无法直接用于单细胞液滴包埋和筛选。虽然培养至稳定期菌丝会断裂成单细胞,但是实验中发现稳定期的地衣芽孢杆菌单细胞无法在液滴中产酶,甚至无法生长,推测是由于稳定期的菌体活性较低导致,无法适用于进一步的液滴包埋、培养和分选等环节。因此,为获得能用于单细胞液滴包埋和筛选所需要的高活性地衣芽孢杆菌单细胞,本研究选取指数生长期的菌丝进行超声处理 (950 W,2%,超声5 s,停5 s) 获得单细胞菌液[23],再经5 μm滤膜过滤去除剩余菌丝及细胞团等颗粒[24]。超声处理2 min后,大部分菌丝断裂成单细胞,虽然仍有部分菌丝,但经过滤处理后,菌液中均为单细胞 (图2-b)。后续实验也证明超声波处理后的单细胞具有较好活力,可以在液滴中有效产α-淀粉酶并用于后续的液滴筛选。
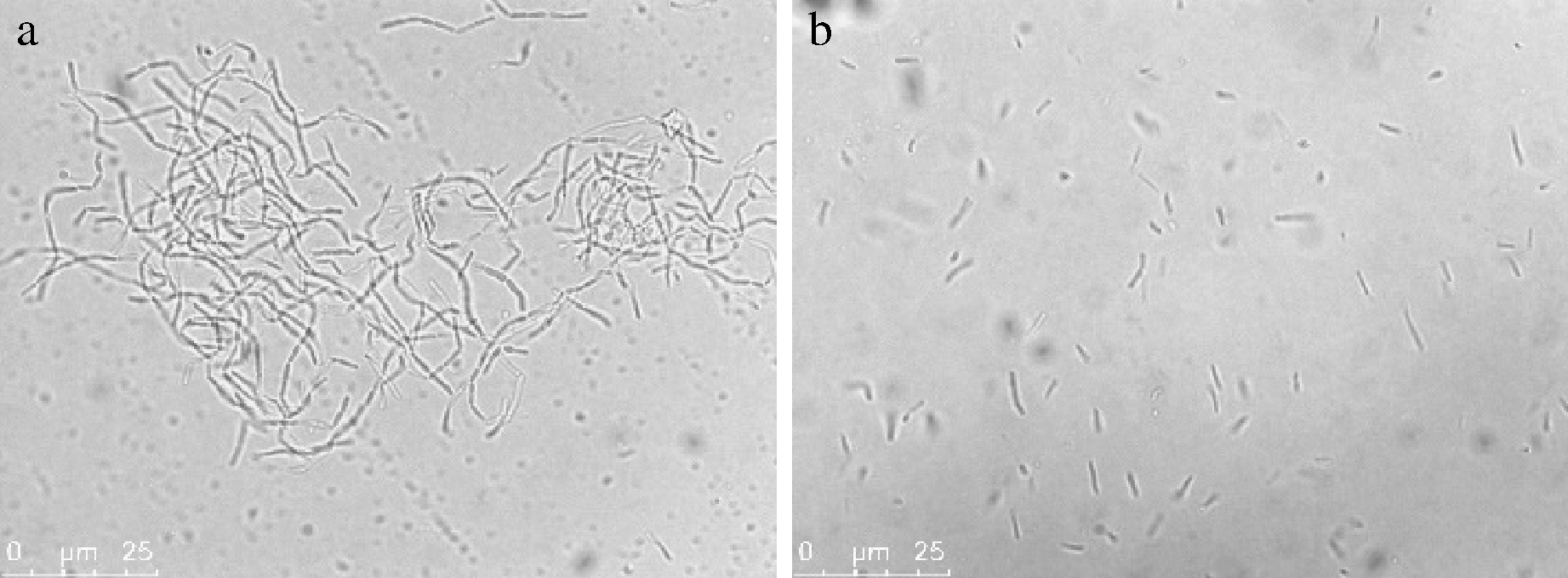
a-指数生长期的地衣芽孢杆菌;b-超声波处理并过滤后的地衣芽孢杆菌
图2 超声波处理地衣芽孢杆菌菌丝制备高活性单细胞
Fig.2 Ultrasonic treatment of cell chains for high performance single cells of B.licheniformis
2.3 单细胞液滴包埋条件优化
液滴稳定性是液滴微流控技术的关键影响因素[11],已有报道表明水相和油相性质等对液滴的稳定性影响较大[25]。为评价不同油相对产α-淀粉酶地衣芽孢杆菌微液滴包埋的影响并选出合适的油相,本研究分别选用2% Pico-Surf in FC40、2% Pico-Surf in Novec 7500和Bio-Rad液滴生成油进行单细胞液滴包埋并评价其稳定性。其中2% Pico-Surf in FC40黏度较大,无法在芯片中生成液滴。2% Pico-Surf in Novec 7500和Bio-Rad液滴生成油均能生成直径20 μm左右的均一液滴,将两者放置在37 ℃下静置培养。培养6 h后,分别取样观察液滴,发现2% Pico-Surf in Novec 7500生成的液滴较稳定 (图3-a),所有液滴直径均保持在20 μm左右;而Bio-Rad液滴生成油生成的液滴出现部分较大的液滴 (图3-b),约10%的液滴直径达到了30~40 μm,说明部分液滴发生了破碎和融合,因此本研究选用2% Pico-Surf in Novec 7500进行单细胞液滴包埋。

a-2% Pico-Surf in Novec 7500生成的单细胞液滴; b-Bio-Rad液滴生成油生成的单细胞液滴
图3 不同油相对单细胞液滴稳定性的影响
Fig.3 The stability of single cell droplets in different oil phase
2.4 突变体库的液滴微流控筛选
将突变体库单细胞液滴放置在37 ℃下静置避光培养,定时取样观察荧光,以确定合适的液滴分选时间。结果表明:液滴培养2 h,液滴中出现较弱的荧光;继续培养至3 h,液滴荧光增强,达到液滴微流控筛选的分选范围。此时,部分液滴荧光较强,另一部分液滴荧光较弱,说明液滴中的单细胞产出的α-淀粉酶活性有差异 (图4)。

图4 不同培养时间对单细胞液滴荧光的影响
Fig.4 Effect of culture time for fluorescence intensity in single cell droplets
由于不同批次液滴的荧光强度分布具有差异,液滴分选时需要根据实际荧光信号分布进行筛选阈值的优化,对高于筛选阈值的液滴进行适当加电筛选 (图5),备选电压有300和500 V。实验结果表明,使用500 V进行筛选时,液滴内的细胞存活率降低,大部分情况平板上无菌落长出;筛选电压降到300 V时,细胞存活率提高至15%左右,菌落数足够用于后续的摇瓶发酵验证。根据以上单细胞液滴培养时间和筛选参数的优化,将单细胞液滴在37 ℃下静置避光培养3 h后进行液滴筛选,筛选时将电压设置为300 V,同时设置合适的阈值以筛选出荧光强度最高的3‰左右的液滴,将筛选出的液滴涂布到LB平板上。
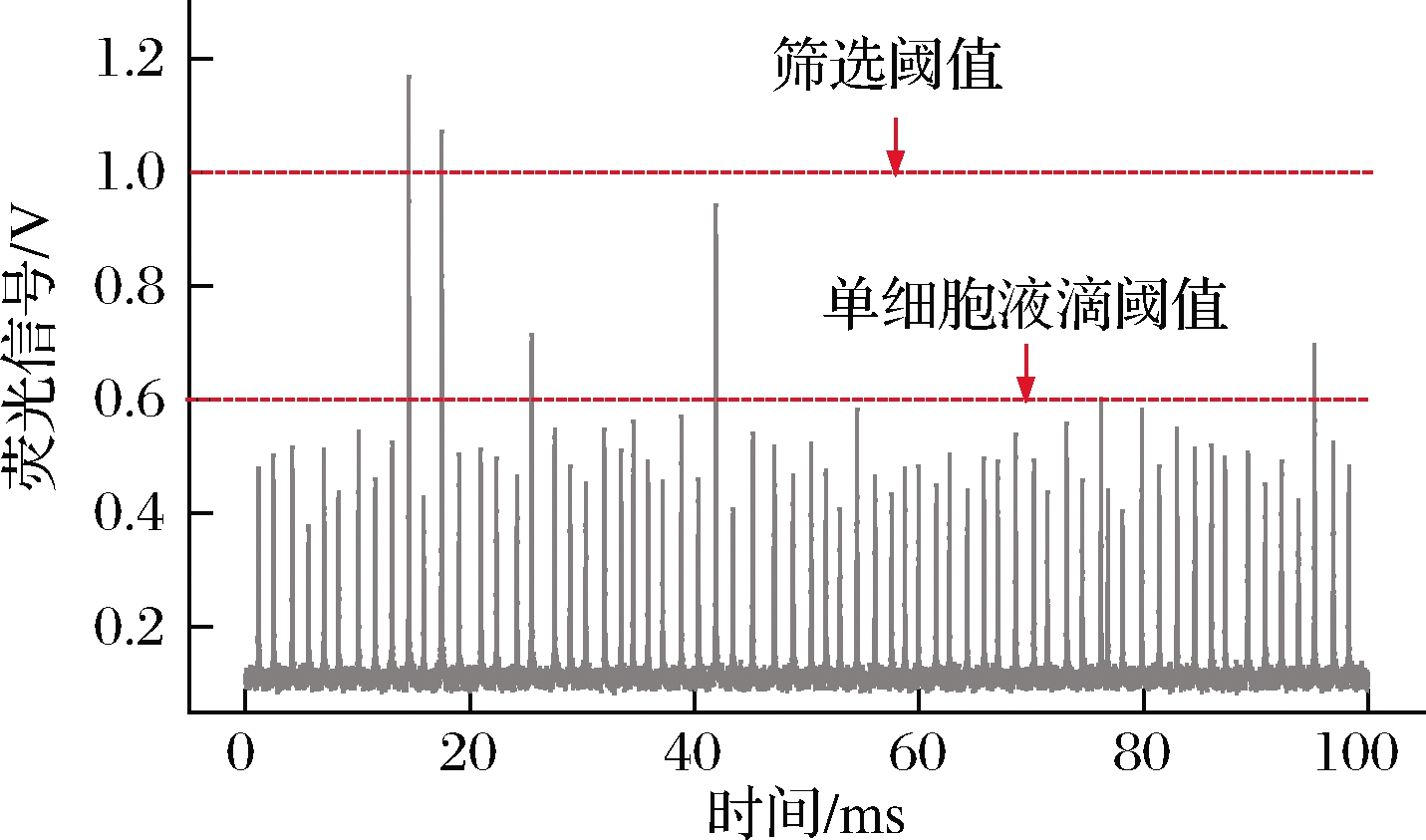
图5 液滴筛选阈值设置
Fig.5 Threshold setup for droplet sorting
2.5 菌株的摇瓶发酵评价
待平板上长出菌落,随机挑取81个单菌落进行摇瓶发酵初筛。从结果可以看出,与出发菌株BLH相比,除个别菌株酶活力降低外,其他菌株酶活力均有不同程度的提高,其中最高酶活力为969 U/mL,提高了63% (图6-a)。通过对发酵酶活力降低的菌株分析发现,发酵酶活力的降低主要由单位细胞产酶能力降低或者菌体生长能力不足造成。因此,生产菌株需要在菌体生长和单位细胞产酶能力之间达到一个最佳的平衡点才能使得总产酶量最大化。
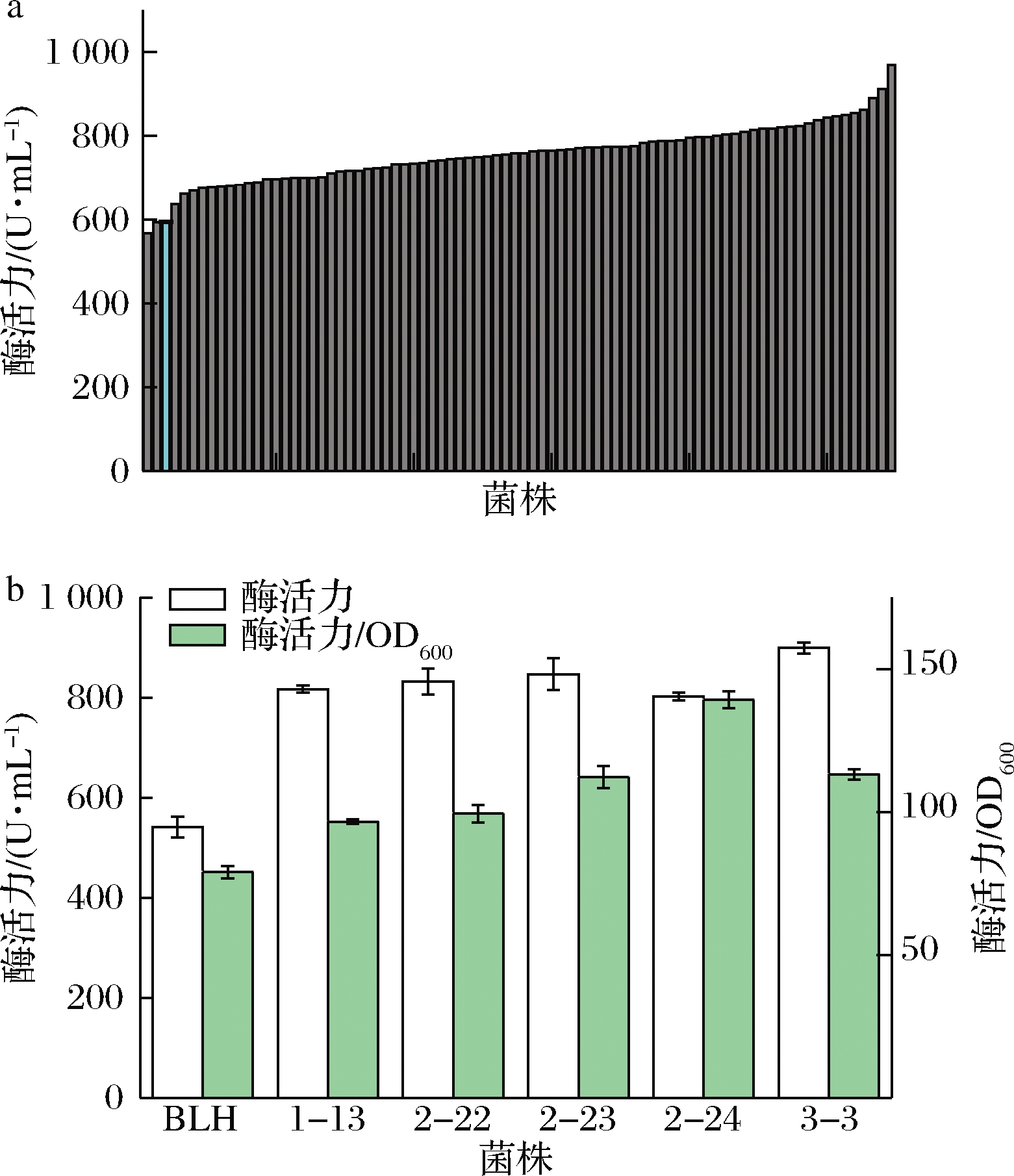
a-摇瓶初步评价酶活分布;b-高产菌株摇瓶验证
图6 筛选菌株酶活评价及高产菌株摇瓶验证
Fig.6 α-amylase activity distribution and reassessment of several best strains
选择初筛发酵酶活力最高的5株菌进行摇瓶发酵复筛验证。结果显示,这5株菌的发酵酶活力分别为:817、832、847、802和900 U/mL,较出发菌株BLH (541 U/mL) 分别提高了51%、54%、57%、48%和66%,单位细胞酶活力较BLH分别提高了23%、25%、42%、76%和43% (图6-b)。可以看出发酵酶活力提升的比例与单位细胞酶活力提升的比例并不完全一致,发酵酶活力最高的菌株的菌体浓度和单位细胞酶活力均处于中间偏高的位置,这也进一步说明菌体生长和单位细胞产酶能力需要一定的平衡才能达到最优的产酶效率。
3 结论
地衣芽孢杆菌作为产α-淀粉酶的重要工业微生物,广泛应用于食品、纺织等行业。针对地衣芽孢杆菌的微生物育种研究也越来越多,但缺乏适用于地衣芽孢杆菌的高通量筛选方法成为目前主要的障碍。本研究以产α-淀粉酶地衣芽孢杆菌为例,通过超声处理将指数生长期的地衣芽孢杆菌菌丝制备成高活性的单细胞,并选用2% Pico-Surf in Novec 7500作为油相包埋获得稳定的单细胞液滴,最后优化了培养时间和筛选电压分别为3 h和300 V,构建基于液滴微流控的高通量筛选方法,并成功从地衣芽孢杆菌BLH的突变体库中筛选出了5株α-淀粉酶产量有效提高的突变体,发酵酶活力最高提高66%。
为进一步解析菌株高产α-淀粉酶的机制,我们将从高产菌株的基因组中挖掘分析突变位点,从中找出提高酶的表达和分泌量的关键突变位点,为提高地衣芽孢杆菌中的分泌表达效率提供指导。此外,在实验过程中,我们发现液滴微流控筛选时的电压对菌体的存活率影响较大。针对这一点,可以继续优化水相和油相的成分,并对筛选芯片通道进行改进,达到在更低电压下实现目标液滴偏转的效果,提高筛选菌株存活率。随着人工智能等领域的快速发展,液滴微流控设备不断成熟,硬件条件基本能满足大部分微生物的包埋、培养等。因此,如何针对不同目标底物或产物开发特异性筛选方法将成为构建液滴微流控等高通量筛选方法的关键,也将进一步扩大其在工业生物技术中的应用[26]。
[1] ZHANG Q G,HAN Y,XIAO H Z.Microbial α-amylase:A biomolecular overview[J].Process Biochemistry,2017,53:88-101.
[2] 徐挺亮, 唐诗哲,彭晶,等.芽胞杆菌属产α-淀粉酶的研究进展[J].生命科学研究,2019,23(1):65-72.
XU T L,TANG S Z,PENG J,et al.Research progresses of α-amylases produced by Bacillus spp[J].Life Science Research,2019,23(1):65-72.
[3] 师瑞琳. 耐酸性高温α-淀粉酶的分子改造、性质表征和热稳定性研究[D].长春:吉林大学,2016.
SHI R L.Discovery,characterization and thermal stability mechanism of A novel acid resistant thermal stable α-amylase[D].Changchun:Jilin University,2016.
[4] BOER A S,PRIEST F,DIDERICHSEN B.On the industrial use of Bacillus licheniformis:A review[J].Applied Microbiology and Biotechnology,1994,40(5):595-598.
[5] LIU X,YANG H Y,ZHENG J W,et al.Identification of strong promoters based on the transcriptome of Bacillus licheniformis[J].Biotechnology Letters,2017,39(6):873-881.
[6] CAI D B,ZHU J,ZHU S,et al.Metabolic engineering of main transcription factors in carbon,nitrogen,and phosphorus metabolisms for enhanced production of bacitracin in Bacillus licheniformis[J].ACS Synthetic Biology,2019,8(4):866-875.
[7] ZHOU C X,ZHOU H Y,ZHANG H T,et al.Optimization of alkaline protease production by rational deletion of sporulation related genes in Bacillus licheniformis[J].Microbial Cell Factories,2019,18(1):1-12.
[8] LI Y R,WANG H R,ZHANG L,et al.Efficient genome editing in Bacillus licheniformis mediated by a conditional CRISPR/Cas9 system[J].Microorganisms,2020,8(5):754.
[9] RAO Y,CAI D B,WANG H,et al.Construction and application of a dual promoter system for efficient protein production and metabolic pathway enhancement in Bacillus licheniformis[J].Journal of Biotechnology,2020,312:1-10.
[10] LI Y R,JIN K,ZHANG L,et al.Development of an inducible secretory expression system in Bacillus licheniformis based on an engineered xylose operon[J].Journal of Agricultural and Food Chemistry,2018,66(36):9 456-9 464.
[11] WIPPOLD J A,HUANG C,STRATIS-CULLUM D,et al.Enhancing droplet transition capabilities using sloped microfluidic channel geometry for stable droplet operation[J].Biomedical Microdevices,2020,22(1):1-5.
[12] VAN DER LINDEN P J E M,POPOV A M,PONTONI D.Accurate and rapid 3D printing of microfluidic devices using wavelength selection on a DLP printer[J].Lab on a Chip,2020,20(22):4 128-4 140.
[13] TAHK D,BANG S,HYUNG S,et al.Self-detachable UV-curable polymers for open-access microfluidic platforms[J].Lab on a Chip,2020,20(22):4 215-4 224.
[14] SUN Y L,TAYAGUI A,GARRILL A,et al.Microfluidic platform for integrated compartmentalization of single zoospores,germination and measurement of protrusive force generated by germ tubes[J].Lab on a Chip,2020,20(22):4 141-4 151.
[15] MUTAFOPULOS K,LU P J,GARRY R,et al.Selective cell encapsulation,Lysis,pico-injection and size-controlled droplet generation using traveling surface acoustic waves in a microfluidic device[J].Lab on a Chip,2020,20(21):3 914-3 921.
[16] QIAO Y X,ZHAO X Y,ZHU J,et al.Fluorescence-activated droplet sorting of lipolytic microorganisms using a compact optical system[J].Lab on a Chip,2017,18(1):190-196.
[17] LONGWELL C K,LABANIEH L,COCHRAN J R.High-throughput screening technologies for enzyme engineering[J].Current Opinion in Biotechnology,2017,48:196-202.
[18] AGRESTI J J,ANTIPOV E,ABATE A R,et al.Ultrahigh-throughput screening in drop-based microfluidics for directed evolution[J].Proceedings of the National Academy of Sciences of the Llnited States of America,2010,107(9):4 004-4 009.
[19] HUANG M T,BAI Y P,SJOSTROM S L,et al.Microfluidic screening and whole-genome sequencing identifies mutations associated with improved protein secretion by yeast[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(34):E4 689-E4 696.
[20] 袁会领, 董立兵,涂然,等.液滴微流控芯片系统中微液滴特性表征及氨基酸检测应用[J].生物工程学报,2014,30(1):139-146.
YUAN H L,DONG L B,TU R,et al.Micro-dropleMicro-droplet characterization and its application for amino acid detection in droplet microfluidic system[J].Chinese Journal of Biotechnology,2014,30(1):139-146.
[21] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[22] SJOSTROM S L,BAI Y P,HUANG M T,et al.High-throughput screening for industrial enzyme production hosts by droplet microfluidics[J].Lab on a Chip,2014,14(4):806-813.
[23] 吕彤, 涂然,袁会领,等.毕赤酵母液滴微流控高通量筛选方法的建立与应用[J].生物工程学报,2019,35(7):1 317-1 325.
LYU T,TU R,YUAN H L,et al.Development and application of a droplet-based microfluidic high-throughput screening of Pichia pastoris[J].Chinese Journal of Biotechnology,2019,35(7):1 317-1 325.
[24] CABEEN M T,LOSICK R.Single-cell microfluidic analysis of Bacillus subtilis[J].Journal of Visualized Experiments,2018(131).DOI:10.3791/56901.
[25] DEBON A P,WOOTTON R C R,ELVIRA K S.Droplet confinement and leakage:Causes,underlying effects,and amelioration strategies[J].Biomicrofluidics,2015,9(2).DOI:10.1063/1.4917343.
[26] ZENG W Z,GUO L K,XU S,et al.High-throughput screening technology in industrial biotechnology[J].Trends in Biotechnology,2020,38(8):888-906.