辣白菜作为东北地区具有民族特色的开胃菜,以白菜为基本原料[1],辣椒粉、蒜、姜、盐、蔗糖等为基本辅料[2],在自然条件下低温发酵而成,以其辣,脆、酸、甜的特点而广受大众喜爱。根据传统工艺进行辣白菜的腌制,发酵7~14 d得到成品[3]。辣白菜在发酵过程中,微生物的菌群结构[4-5]对辣白菜品质和风味[6]具有重要影响,在微生物代谢的帮助下,白菜中大分子营养物质变成更容易被人体所吸收的小分子物质,如还原糖、氨基酸等,同时使辣白菜具有独特的风味[7]。
辣白菜发酵过程中以乳酸菌[8]代谢为主,这类微生物的多样性结构显著地影响着还原糖、氨基酸、乙酸和乳酸等呈味物质[9],目前,关于辣白菜发酵过程中微生物结构[10]与呈味物质间的相关性还不清楚。如今高通量测序技术已被证明是探索复杂环境微生物和跟踪发酵过程的有效研究手段[11],可以更客观地揭示食品发酵过程中微生物多样性[12]的变化,并且此项技术已被应用于泡菜发酵过程中微生物演替的研究。本研究在控制温度、盐度[13]、发酵时间等条件不变的条件下,测定了还原糖、氨基酸、总酸等主要呈味物质的含量,利用高通量测序技术探究辣白菜在发酵过程中的菌群结构,利用主成分分析探究两者相关性[14-15]。
1 材料与方法
1.1 材料
白菜、辣椒粉、蒜、姜、苹果、盐、蔗糖,市售;平板计数培养基,青岛海博;NaOH、乙酸锌、亚铁氰化钾、碱性酒石酸铜、盐酸、甲氧基胺、甲醇、三甲基氯硅烷、三氟乙烷、乙醇(分析纯),北京化工厂。
1.2 仪器与设备
PH3-3C型pH仪,上海佑科仪器仪表有限公司;台式冷冻离心机,德国 Eppendorf 公司;磁力加热搅拌器,上海达理仪器厂;气相色谱6890 N,美国安捷伦公司。
1.3 辣白菜的制作
辣白菜根据现有的传统工艺,以新鲜的白菜为原料,以蒜、辣椒粉、姜、苹果等材料制作成糊状酱料[19]。使用白菜质量4%的食盐腌制白菜后,将酱料在菜叶上涂匀,装入塑料盒中保持在10 ℃下发酵。在发酵的第1天、第4天、第7天、第11天和第14天各取1次样品检测相关指标,选取第1天、第7天和第14天的样品进行菌群结构检测以及主要呈味物质含量的检测,第1天、第7天和第14天的样品分别编号为N1、N4和N7。
1.4 还原糖测定
称取打碎的5 g样品于容量瓶中稀释定容,加入乙酸锌和亚铁氰化钾溶液再次定容后,过滤取滤液,利用碱性酒石酸铜溶液滴定滤液至溶液蓝色消失为滴定终点,利用平均耗用体积来计算还原糖的含量(以葡萄糖计)。
1.5 可滴定酸及氨基酸态氮含量检测
称取10 g糊状样品于容量瓶稀释定容,在磁力搅拌器的作用下使用标准NaOH溶液进行滴定,通过NaOH溶液体积计算可滴定酸(总酸)含量。用滴定法检测总酸后,再加入甲醛溶液继续用标准NaOH滴定溶液滴定,记录标准NaOH滴定溶液的体积,用于计算氨基酸态氮含量。
1.6 气相色谱法检测乳酸、乙酸含量
使用气相色谱仪,采用DB-5 ms毛细管柱(30 m×0.25 mm,膜厚0.25 μm)分离样品,以15 ℃/min升高至240 ℃,运行26 min。进样温度240 ℃,载气He,流速1 mL/min[20]。
1.7 菌群结构分析
采用 CTAB 或SDS方法对样本的基因组 DNA 进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组 DNA 为模板,根据测序区域的选择,使用带 Barcode 的特异引物New England Biolabs 公司的 Phusion® High-Fidelity PCR Master Mix with GC Buffer,和高效高保真酶进行PCR,确保扩增效率和准确性。PCR产物使用2%(质量分数)的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE 2%的琼脂糖胶电泳纯化PCR 产物,剪切回收目标条带。产物纯化试剂盒使用的是Thermo Scientific 公司GeneJET 胶回收试剂盒回收产物,测序由北京诺禾致源科技股份有限公司进行。
1.8 数据处理及统计分析
本次实验进行6次平行试验,所有数据均以平均值±标准差表示。使用SPSS 20.0软件以单因素方差分析(ANOVA)分析数据。Tukey的数据测试使用Graphpad 8.0进行。组间的显着差异用Tukey的平均值检验,置信度为95%(P<0.05)。
2 结果与讨论
2.1 理化指标
2.1.1 还原糖测定
糖是发酵过程中微生物生长繁殖的重要碳源及能量来源[21],辣白菜在发酵过程中还原糖含量变化如图1所示,相对于第1天,发酵4和7 d还原糖含量未显著增加,发酵14 d还原糖含量显著增加。在制作辣白菜时,配料中人为添加了蔗糖,为发酵过程提供了微生物代谢所需要的碳源,随着发酵过程中微生物数量的增加,蔗糖等大分子糖数量有限,分解到一定程度后不再分解,因而还原糖数量上升速度减慢。
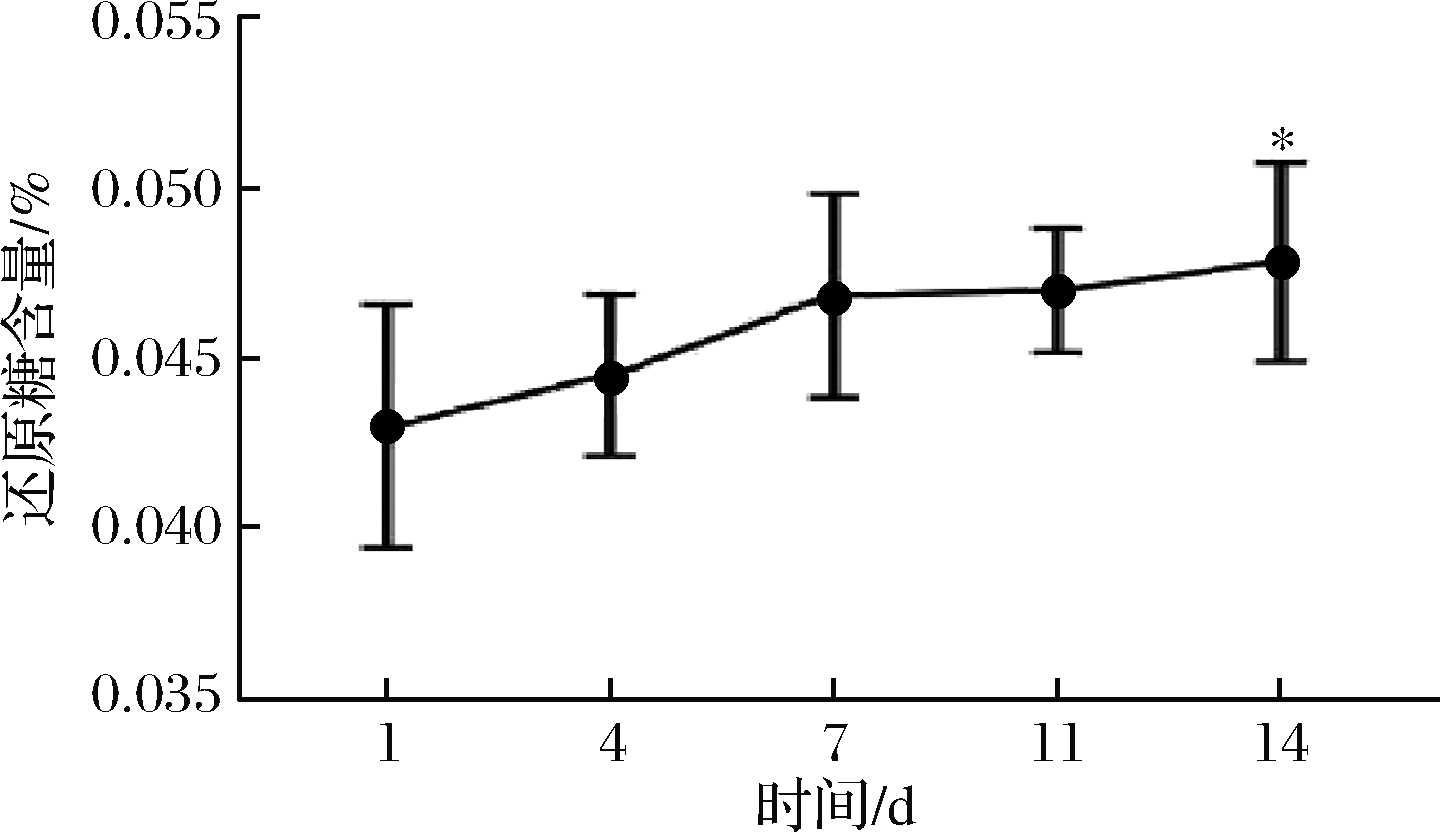
图1 发酵过程中还原糖含量的变化
Fig.1 Changes in reducing sugar content during fermentation 注:*表示与第1天相比差异显著,P<0.05;**表示 与第1天相比差异极显著P<0.01(下同)
2.1.2 可滴定酸含量检测
有机酸作为辣白菜的挥发性特征风味之一,可以利用可滴定酸的含量来衡量辣白菜的成熟度。可滴定酸含量变化如图2所示,可滴定酸含量逐渐升高,相对第1天,发酵7、11、14 d可滴定酸含量极显著增加,可滴定酸显示发酵过程中总酸含量变化,从可滴定酸的变化可推测出有一定数量产酸的微生物参与到发酵中,并且随着酸含量的增加,微生物[18]将呈现产酸微生物或耐酸微生物变化。
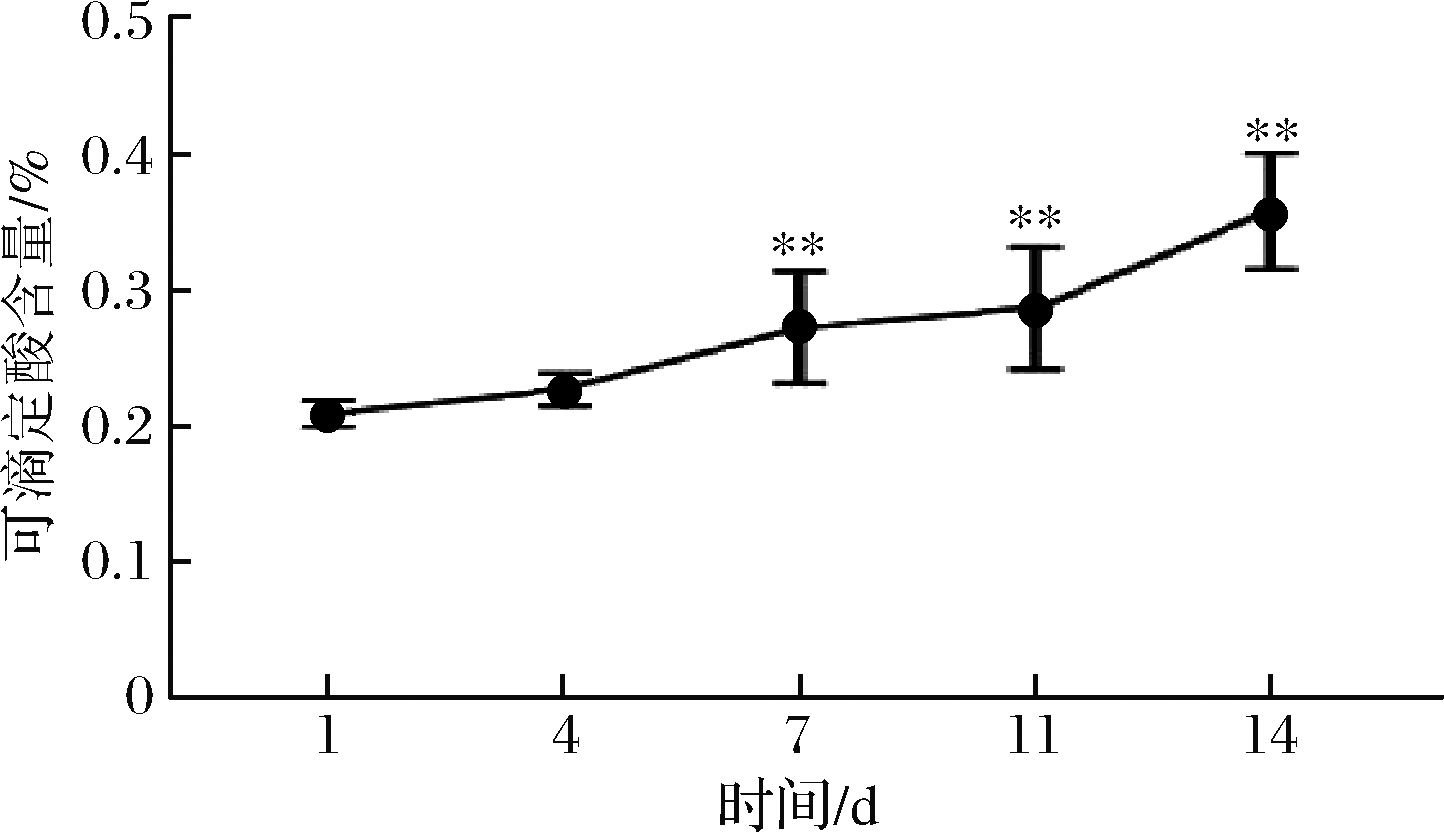
图2 发酵过程中可滴定酸的变化
Fig.2 Change of titratable acid during fermentation
2.1.3 氨基酸含量检测
由于氨基酸不能直接测定,但可通过测氨基酸氮的含量代替检测样品分解、代谢氨基酸的含量[19]。如图3所示,氨基酸氮的含量随着发酵时间延长而增加,相比第1天,发酵14 d之前氨基酸氮的含量未有显著增加,发酵14 d氨基酸氮含量具有极显著增加。氨基酸含量不断增加,也说明了辣白菜中含有的大分子蛋白质类物质在不断降解,微生物利用蛋白质为氮源进行生长繁殖。
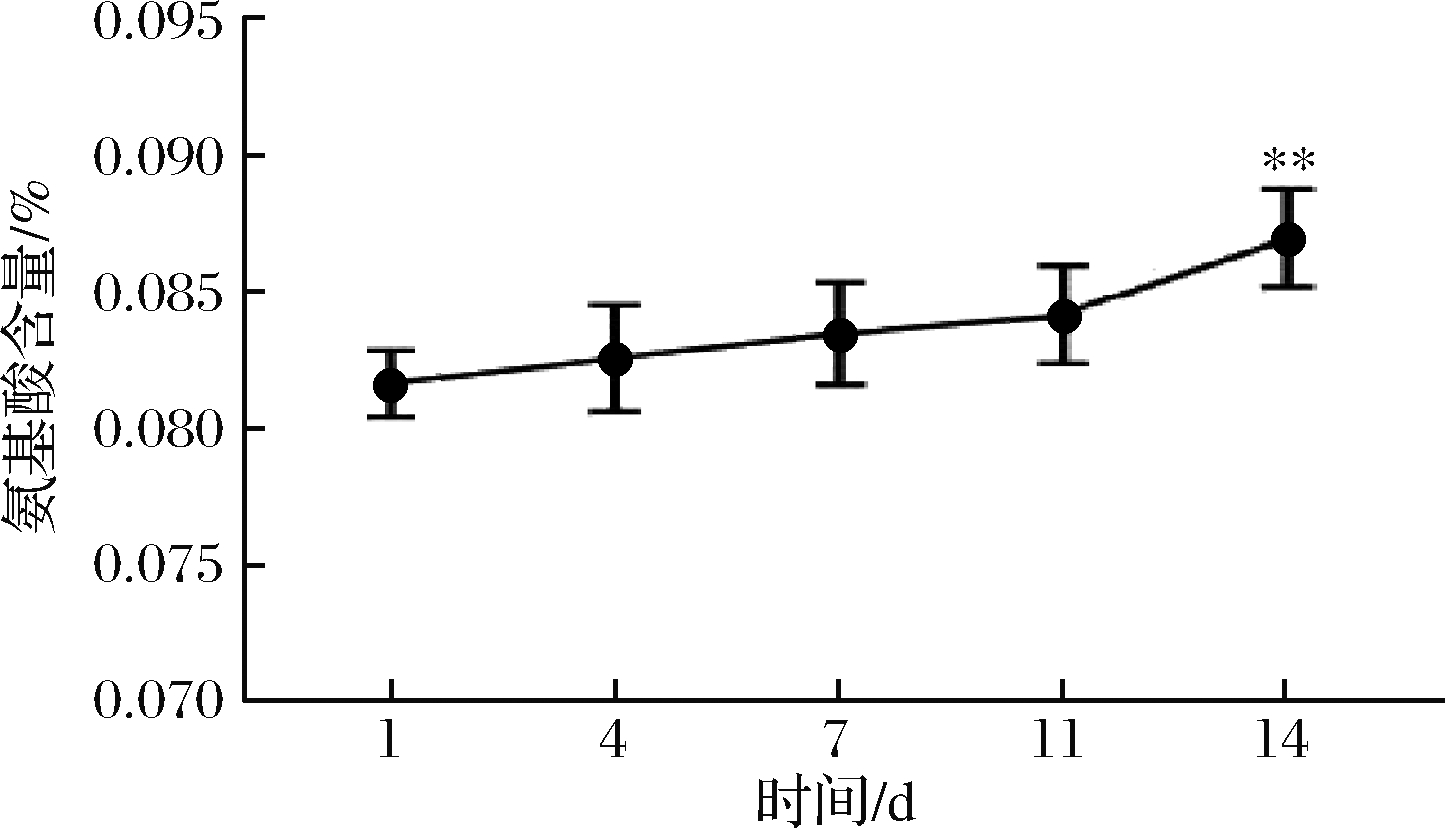
图3 发酵过程中氨基酸含量的变化
Fig.3 Change of amino acid content during fermentation
2.2 有机酸含量测定
辣白菜中主要的有机酸包括乳酸、乙酸、柠檬酸等,其中乳酸给人柔和的感觉,乙酸给人刺激的感觉[18-19],作为辣白菜在发酵过程中主要的呈味物质[15],其在发酵过程中含量变化与呈味有着密切的关系。如图4所示,样品中的乳酸和乙酸的含量不断增加,第7天相对第1天的乳酸含量显著性增长,14 d时乳酸含量具有极显著增长;第7天相对第1天乙酸含量增长不显著,14 d时乙酸含量极显著增长。随着乳酸和乙酸含量的增加,对辣白菜的风味有着重要的影响,对总酸含量的变化也起到重要作用。
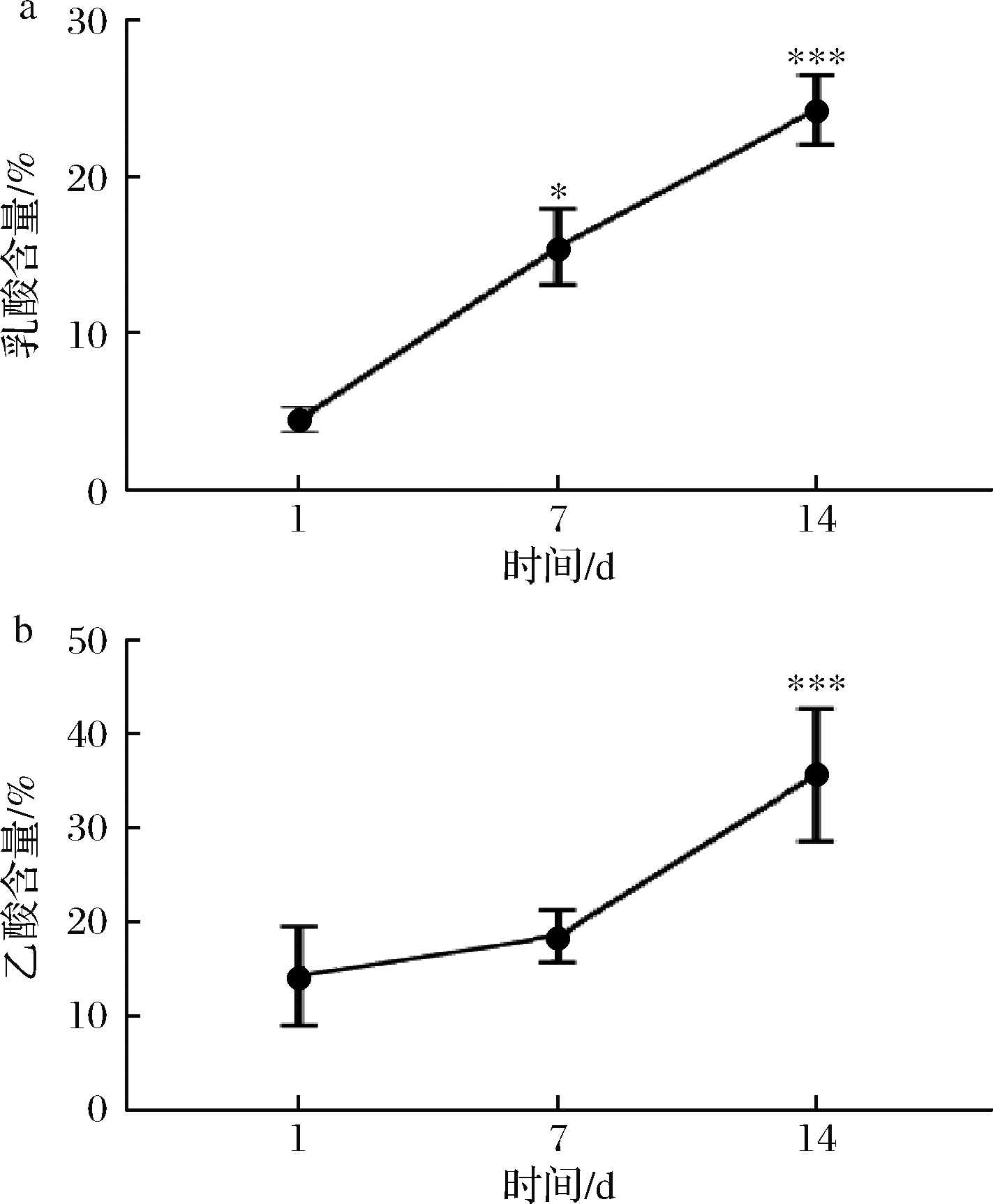
a-乳酸含量;b-乙酸含量
图4 发酵过程中乳酸和乙酸含量变化
Fig.4 Change of lactic acid and acetic acid content during fermentation
2.3 发酵过程中的菌群结构测定
2.3.1 Alpha多样性分析
Alpha多样性可用于分析样品内的微生物群落的丰富度和多样性[20],采用Shannon指数、Chao1指数和覆盖率(goods_coverage)对样品微生物物种的丰富度和多样性进行评估。样品的Shannon指数、Chao1指数和覆盖率反映了样品的多样性、相对丰度和测序深度,Shannon指数表示丰富度和均匀度,Shannon指数越高,表明群落的多样性越高;Chao1指数表示群落的丰度指数,Chao1指数越大,表明群落的丰富度越高;覆盖率反映样本的真实情况,覆盖率指数越高,则样本中序列未被测出的概率越低。由表1可知,微生物覆盖率大于0.999,说明样品序列基本上被测出,即样本测序结果可以反映样品真实情况;N1组的Shannon指数最高,N4和N7组的Shannon指数降低,发酵过程中微生物的丰富度下降;N1组、N4组、N7组的Chao1指数越来越小,说明样品中的微生物的相对丰度降低。根据已知的Shannon 指数以及Chao1指数的变化趋势可以表明,发酵过程中,与N1组相比较,N4组与N7组微生物的相对丰度有显著性的下降趋势,说明发酵1 d时,微生物群落组成上最丰富,随着发酵的进行,微生物群落多样性降低。
表1 Alpha多样性分析
Table 1 Microbial Alpha diversity index of samples
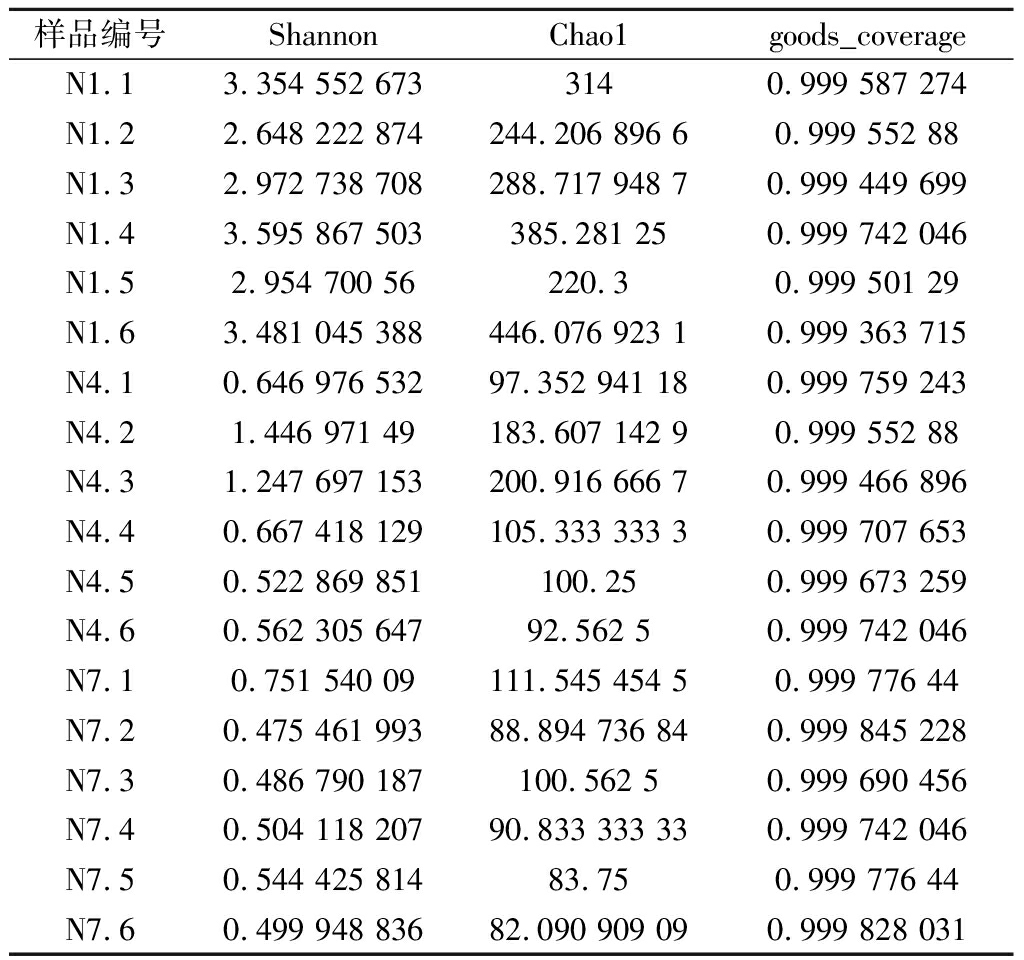
样品编号ShannonChao1goods_coverageN1.13.354 552 6733140.999 587 274N1.22.648 222 874244.206 896 60.999 552 88N1.32.972 738 708288.717 948 70.999 449 699N1.43.595 867 503385.281 250.999 742 046N1.52.954 700 56220.30.999 501 29N1.63.481 045 388446.076 923 10.999 363 715N4.10.646 976 53297.352 941 180.999 759 243N4.21.446 971 49183.607 142 90.999 552 88N4.31.247 697 153200.916 666 70.999 466 896N4.40.667 418 129105.333 333 30.999 707 653N4.50.522 869 851100.250.999 673 259N4.60.562 305 64792.562 50.999 742 046N7.10.751 540 09111.545 454 50.999 776 44N7.20.475 461 99388.894 736 840.999 845 228N7.30.486 790 187100.562 50.999 690 456N7.40.504 118 20790.833 333 330.999 742 046N7.50.544 425 81483.750.999 776 44N7.60.499 948 83682.090 909 090.999 828 031
2.3.2 辣白菜发酵过程中物种丰度变化
Venn图能够直观表现出样品中独有和共有操作分类单元 (operational taxonomic units,OTU)数目,同时也能够较直观地表现样本的 OTU 数目组成相似性及重叠情况[21],在发酵不同阶段 OTU 数目的重叠情况如图5-a所示,3组样品共有OTU数目为170,N1 组独有OTU 数目为373,N4组独有OTU数目为12,N7组样品中的独有 OTU 数量降低至 4。可以发现物种丰度最大值出现在发酵初始阶段,此时的总OTU数量为699,随着发酵时间的延长不仅总OTU数量下降,独有OTU数量也急速下降,N7组的总OTU数量下降至222,说明在辣白菜发酵过程中,样品中微生物物种丰度下降。
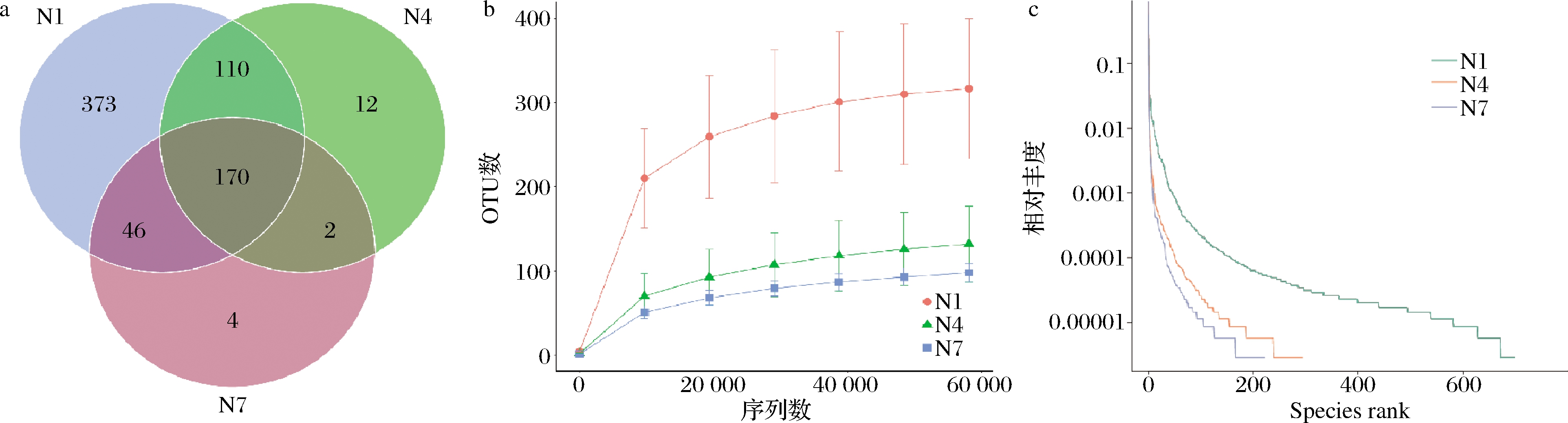
a-Venn图;b-稀释度曲线;c-Rank-abundance 曲线
图5 辣白菜发酵过程中物种丰度
Fig.5 Species abundance of samples during kimchi fermentation
稀释曲线可以直接反映数据合理性,也可间接反映样本物种的丰富程度,稀释度曲线中随着序列数增加到60 000,OTU数量趋于稳定,证明测序数据的合理性,同时OTU数量越多,微生物的相对丰度越高,菌群结构越复杂,反之OTU数量减少说明微生物的相对丰度降低,菌群结构相对简单。如图5-b所示,整个发酵过程中OTU数量呈下降趋势,在发酵的初始阶段,N1 组样品曲线最为陡峭,纵坐标OTU数量范围也最大,表明发酵的第1天微生物种类最为复杂,但随着发酵的进行,OTU数量出现了迅速下降,发酵7 d的OTU数量几乎与发酵14 d时的OTU数量相近,说明发酵第1天的菌群结构十分复杂,微生物种类繁多,随着发酵的进行,微生物种类逐渐降低,菌群结构也变得简单。
Rank-abundance曲线可以清晰地显示出发酵过程中的物种丰度和物种均匀度等级,聚类曲线可直观地反映样本中微生物物种的丰度及均匀度。如图5-c所示,水平方向上,微生物物种的丰度由曲线的宽度来反映;垂直方向上,曲线的平滑程度反映样本中微生物物种的均匀程度,N1 组样品中微生物丰度最高,分布相对均匀,OTU 在200~600分布较为均匀,而N4和N7组的曲线较为陡峭,说明样品中微生物分布均匀度逐渐降低,发酵过程中微生物的相对丰度随时间的增加而降低,OTU在0~200有3组相对丰度数值较为接近,与Venn图当中N1、N4、N7组共有部分相关。
2.3.3 辣白菜发酵过程中微生物菌群组成
选取分组在属水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图,以便直观查看各样本在不同分类水平上,相对丰度较高的物种及其比例。图6-a是在属的水平下,N1、N4、N7 丰度水平前10的物种,其他物种合并为others,图6-b显示了N1、N4、N7各组每个样品在发酵过程中属水平上相对丰度前10的物种。通过图6-a、6-b可知,发酵的第1天,样品中微生物以 Virgibacillus 属和 Weissella 属为主,Weissella 属是在整个发酵阶段一直稳定的优势菌属,随着发酵的进行,在发酵第7天达到93.47%,在发酵第14天达到 96.91%,而Virgibacillus 属的相对丰度逐渐减少。此外,样品中被检出的相对丰度位于前10的还有Lentibacillus、unidentified_Rhizobiaceae、unidentified_Cyanobacteria、Pantoea、Sphingomonas、Stenotrophomonas、unidentified_Rickettsiales和Alkalibacillus等。
菌群热图是通过颜色梯度及相似程度来反映多个样品在各分类水平上群落组成的相似性和差异性,图6-c显示了N1、N4、N7 在属水平上的菌群热图,每个样品中前25种微生物物种相似性和差异性。在发酵的第1天,物种的相对丰度都较为丰富,当发酵到第7天时,样品的微生物丰度大部分下降,以Leuconostoc,Lactobacillus,Weissella 和Lactococcus为主,当发酵到第14天时,样品中的Weissella 属的相对丰度显著性增加,其他各菌属的相对丰度均减少。
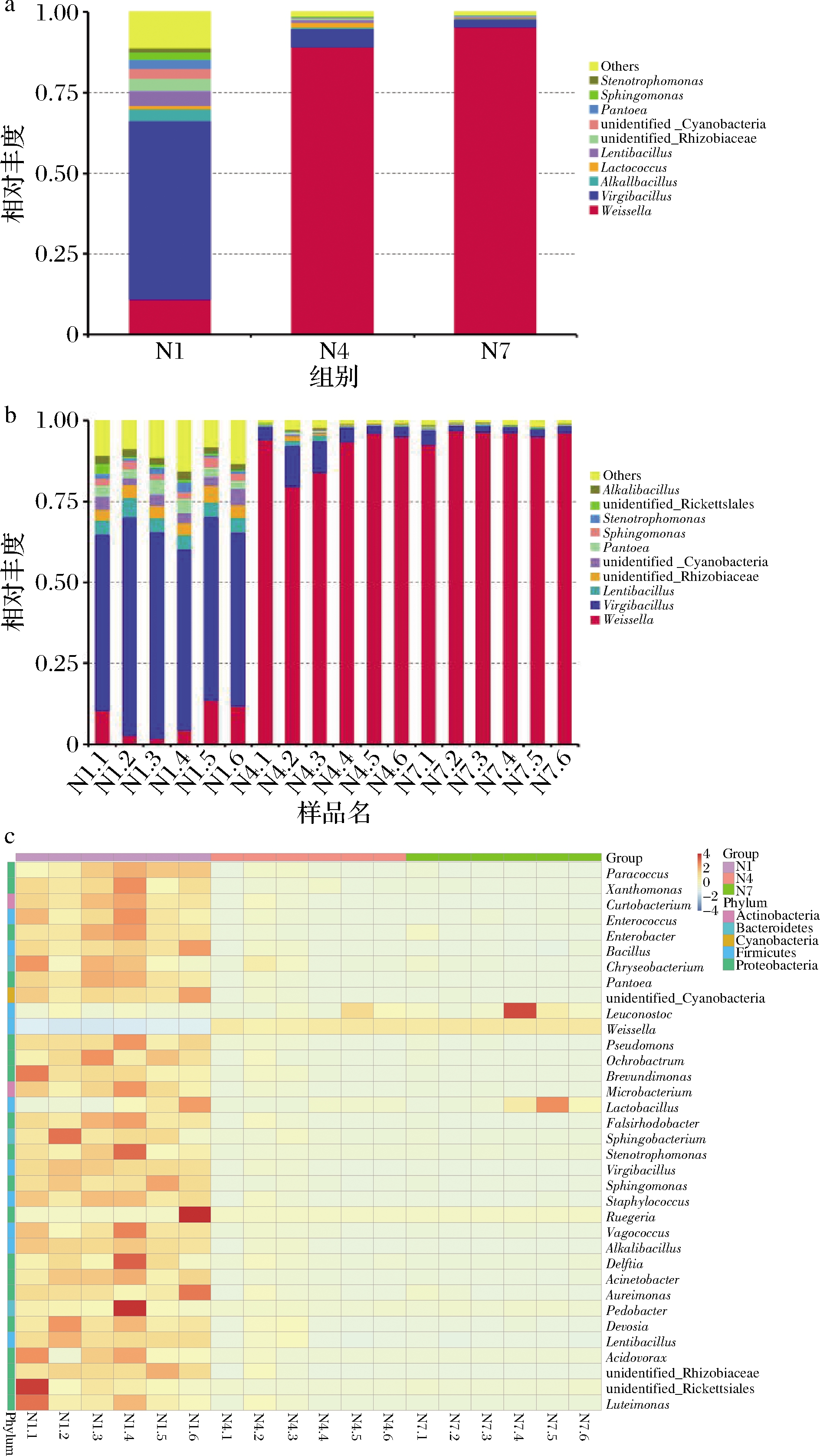
a、b-丰度;c-属水平热图
图6 细菌丰度各组样品属水平热图
Fig.6 Bacterial abundance heatmap of each group at genus level
2.3.4 发酵过程微生物丰度及分布
为了研究不同类群之间的相似性,使用非加权组平均法(unweighted pair-group method with arithmetic mean,UPGMA)进行聚类分析,并将聚类分析结果与门级每组的物种相对丰度相结合。如图7所示,3组样品中主要显示了11 个门类菌群,分别为Firmicutes、Proteobacteria、Cyanobacteria、Bacteroidetes、Actinobacteria、Nitrospirae、Chloroflexi、Acidobacteria、Verrucomicrobia、Gemmatimonadetes、others。其中Firmicutes相对丰度占绝对优势,随着发酵的进行,Proteobacteria的相对丰度降低,通过聚类分析可知N4和N7欧里距离最近,其微生物种类和数量最为相似,说明在发酵第7天和第14天的菌群结构相似,也符合细菌丰度图与菌群热图的结果分析。
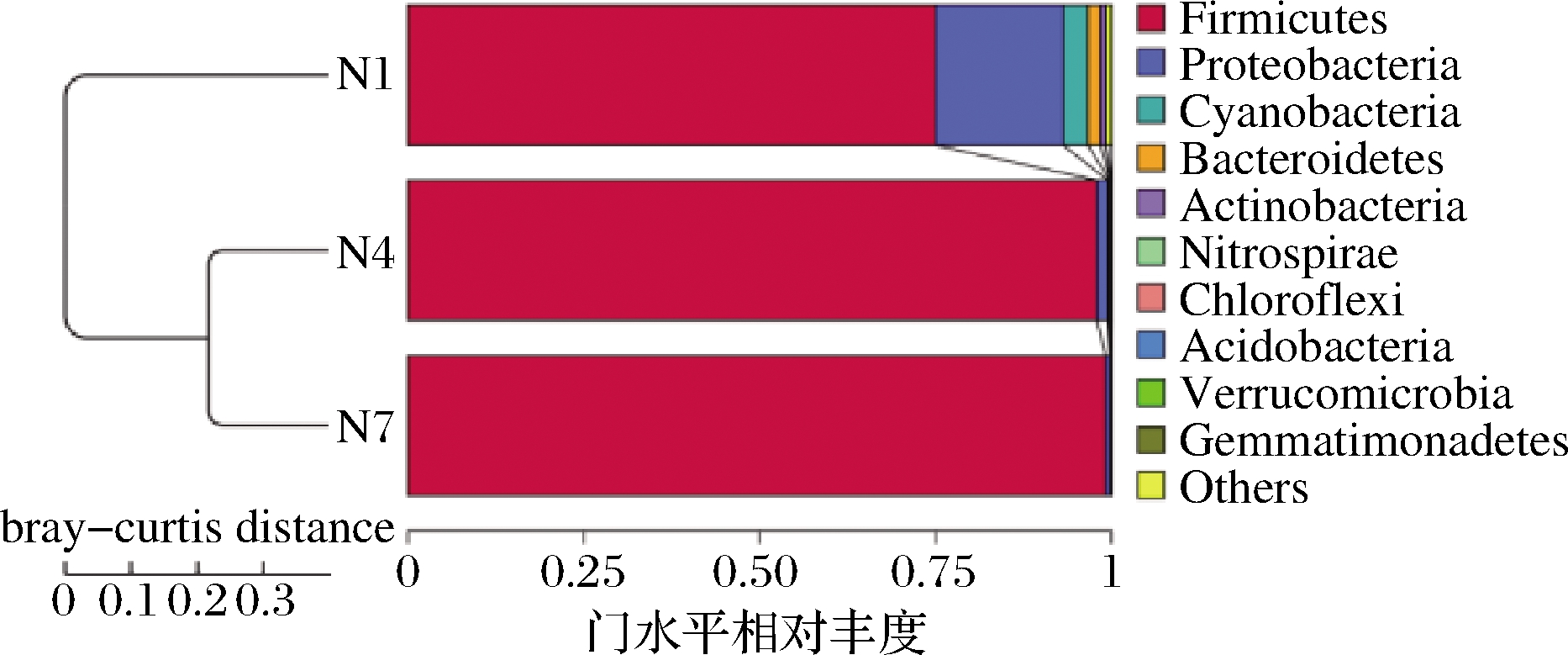
图7 基于Unweighted Unifrac距离的UPGMA聚类树
Fig.7 UPGMA clustering tree based on unweighted unifrac distance
2.3.5 发酵过程菌群主坐标分析
主坐标分析可呈现研究数据相似性或差异性的可视化坐标,是一种非约束性的数据降维分析方法,可用来研究样本群落组成的相似性或相异性[22]。对3组样品进行分析,结果如图8所示,第1主成分和第2主成分的贡献率分别为98.20%,0.84%,在加权和非加权主坐标分析中所选主成分均可以充分解释原始数据中的差异,通过图中样品点距离的远近,可观察个体或群体间的差异,样品点越相近说明样品间微生物群落构成越相似。在N1组内两点间间距较大,样品组间有一定的差异性,而N4、N7组内的样品的两点间间距极小,样品内部差异性较小;N1与N4、N7两组相比较明显分离,说明N1组与其他两组在菌群结构上有显著的差异性,N4组与N7组的样品点的距离较近,说明在发酵第7天与第14天的菌群多样性无明显变化,这个结果与细菌丰度图与菌群热图也保持一致。
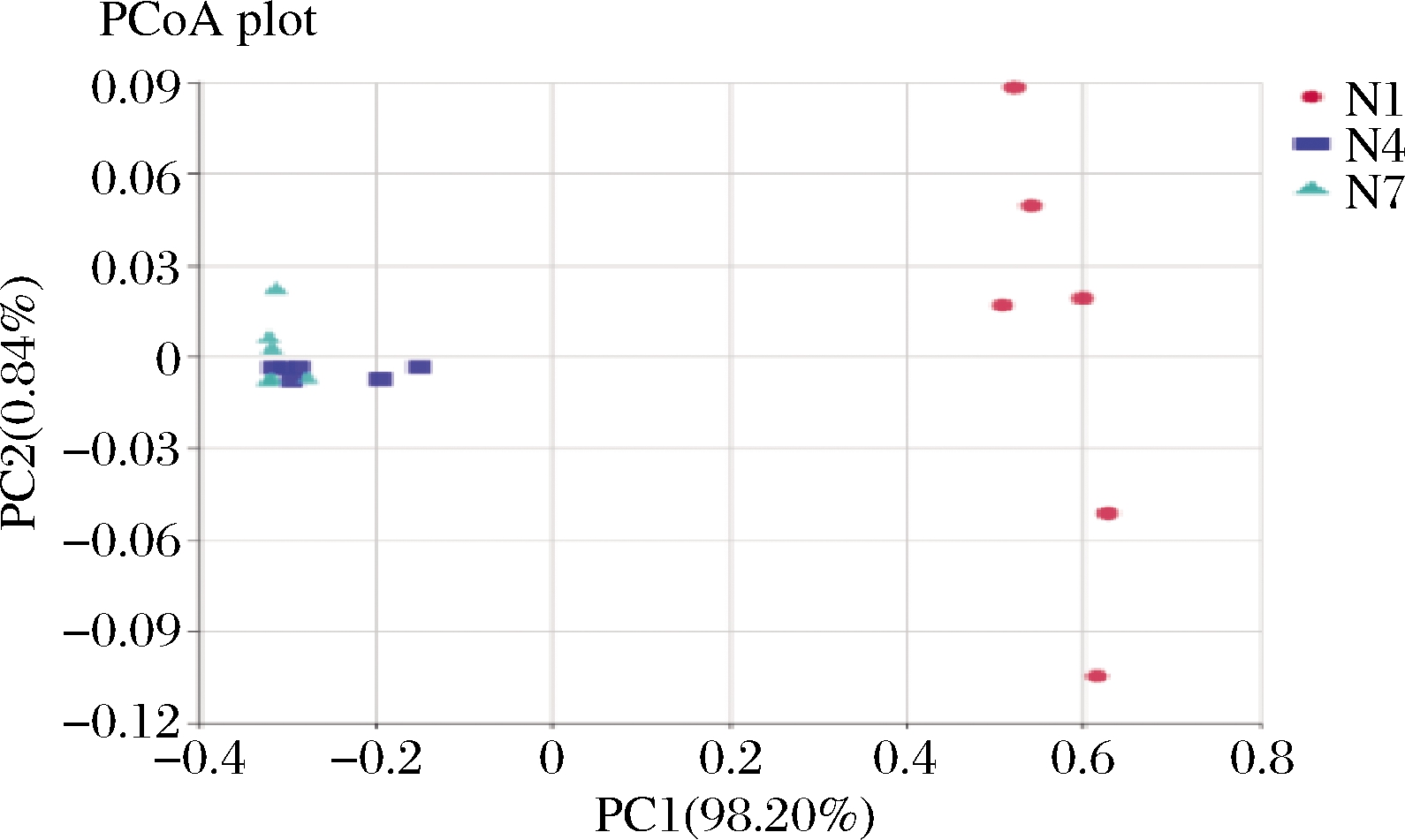
图8 主坐标分析
Fig.8 Principal coordinate analysis
2.4 呈味物质与菌群结构的相关性
主成分分析可直观地将辣白菜发酵过程中主要呈味物质与菌群结构之间的关系体现在二维坐标图上,将微生物在属水平上相对丰度前10名与主要呈味物质进行主成分分析,结果结合图9和表2所示,主成分1和主成分2显示发酵过程中主要呈味物质与菌群相对丰度前10名74.98%和7.45%的信息,前2个主成分之和大于80%,说明数据能够代表主要呈味物质与菌群相对丰度绝大部分信息。主要呈味物质中的总酸含量、氨基酸氮含量、还原糖含量、乳酸含量和乙酸含量与Weissella 属[23]都呈正相关,与其他菌属呈负相关,这说明Weissella 属与主要呈味物质影响较大。Weissella 属对于食品的发酵具有促进作用[26],除了作为乳酸菌的产酸特性以外,还是食品风味形成的重要贡献者,根据主成分分析来看,Weissella 属与主要呈味物质有密切关系[25-26],通过比较传统四川泡菜和韩国泡菜的微生物组成与风味发现,四川泡菜发酵过程中不含Weissella菌,而在韩国泡菜中Weissella是优势乳酸菌之一;Weissella菌在提高酱油中氨基酸和有机酸含量有摄取的优势[27]。结合相关研究可以得出,Weissella 是泡菜发酵中的优势菌群;Virgibacillus 属具有产酸的特性,它的数量变化与其他乳酸菌的数量变化能对应发酵过程中总酸含量的变化,其他菌属相对主要呈味物质没有很强的相关性。
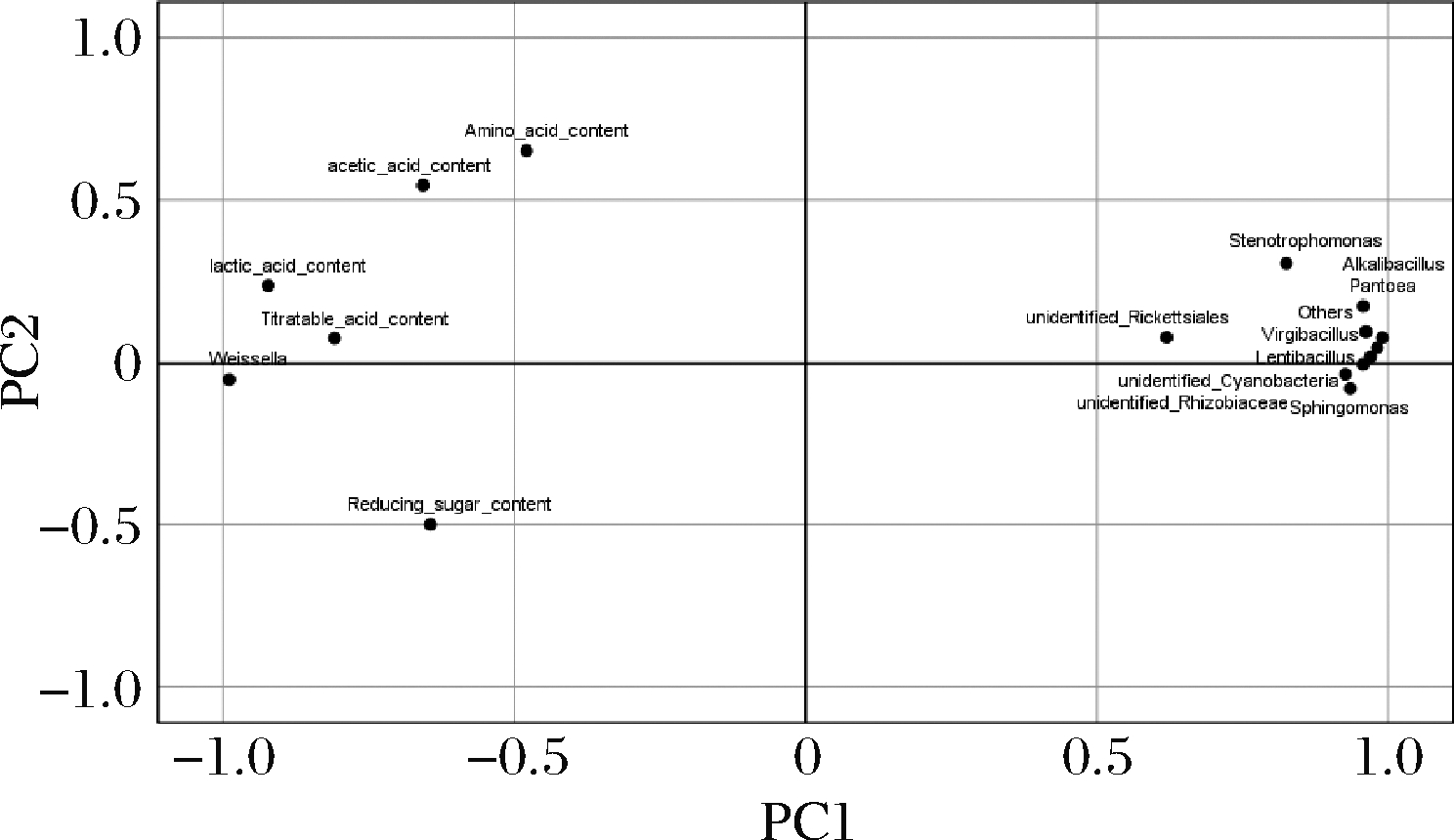
图9 主要呈味物质与发酵菌群属水平前10名主成分 分析载荷图
Fig.9 Principal component analysis load chart of the top ten main flavor substances and fermentation flora
表2 主要呈味物质与发酵菌群属水平前10名主成分分析相关矩阵分析
Table 2 Correlation matrix analysis of principal component analysis between main flavor compounds and top ten fermentative flora
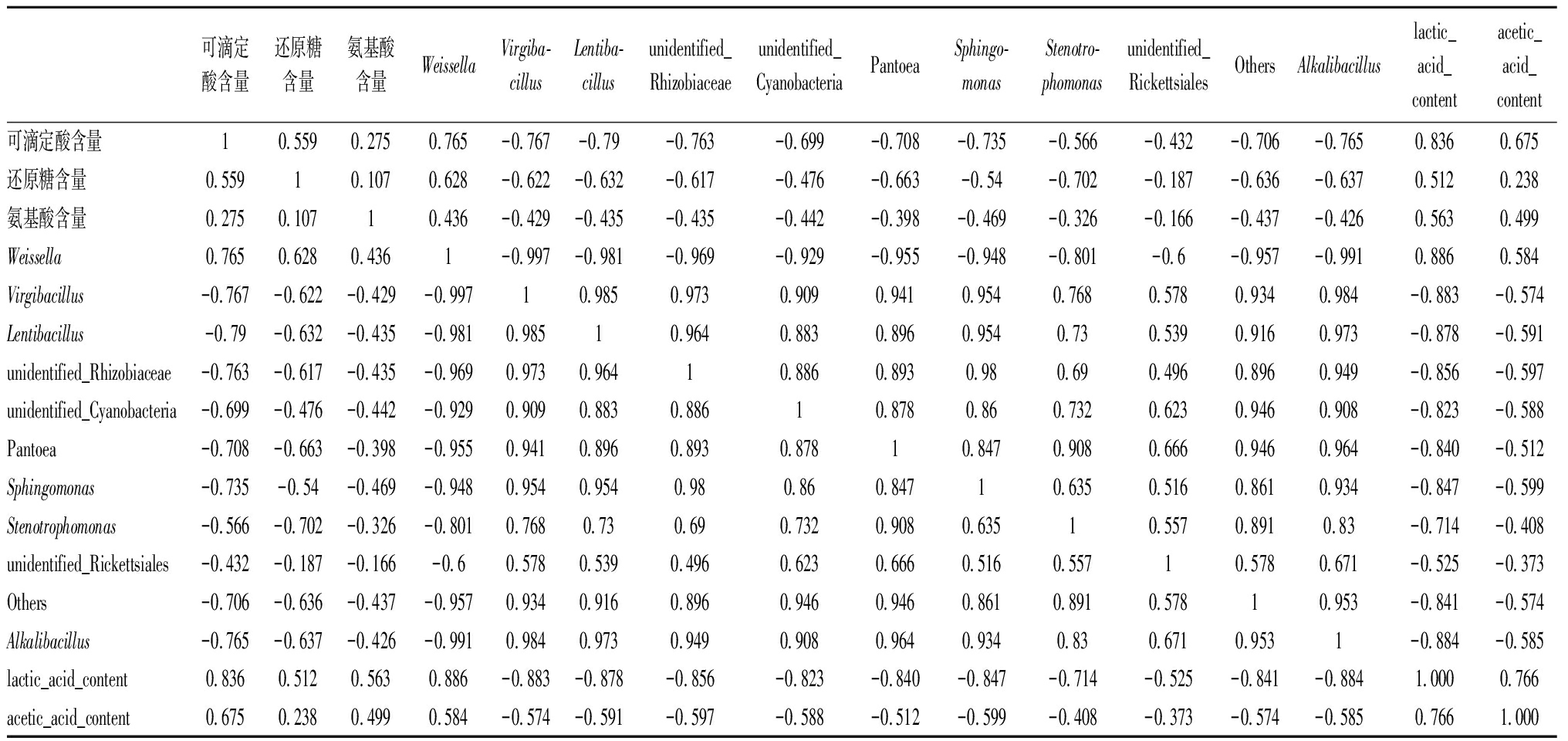
可滴定酸含量还原糖含量氨基酸含量WeissellaVirgiba-cillusLentiba-cillusunidentified_Rhizobiaceaeunidentified_CyanobacteriaPantoeaSphingo-monasStenotro-phomonasunidentified_RickettsialesOthersAlkalibacilluslactic_acid_contentacetic_acid_content可滴定酸含量10.5590.2750.765-0.767-0.79-0.763-0.699-0.708-0.735-0.566-0.432-0.706-0.7650.8360.675还原糖含量0.55910.1070.628-0.622-0.632-0.617-0.476-0.663-0.54-0.702-0.187-0.636-0.6370.5120.238氨基酸含量0.2750.10710.436-0.429-0.435-0.435-0.442-0.398-0.469-0.326-0.166-0.437-0.4260.5630.499Weissella0.7650.6280.4361-0.997-0.981-0.969-0.929-0.955-0.948-0.801-0.6-0.957-0.9910.8860.584Virgibacillus-0.767-0.622-0.429-0.99710.9850.9730.9090.9410.9540.7680.5780.9340.984-0.883-0.574Lentibacillus-0.79-0.632-0.435-0.9810.98510.9640.8830.8960.9540.730.5390.9160.973-0.878-0.591unidentified_Rhizobiaceae-0.763-0.617-0.435-0.9690.9730.96410.8860.8930.980.690.4960.8960.949-0.856-0.597unidentified_Cyanobacteria-0.699-0.476-0.442-0.9290.9090.8830.88610.8780.860.7320.6230.9460.908-0.823-0.588Pantoea-0.708-0.663-0.398-0.9550.9410.8960.8930.87810.8470.9080.6660.9460.964-0.840-0.512Sphingomonas-0.735-0.54-0.469-0.9480.9540.9540.980.860.84710.6350.5160.8610.934-0.847-0.599Stenotrophomonas-0.566-0.702-0.326-0.8010.7680.730.690.7320.9080.63510.5570.8910.83-0.714-0.408unidentified_Rickettsiales-0.432-0.187-0.166-0.60.5780.5390.4960.6230.6660.5160.55710.5780.671-0.525-0.373Others-0.706-0.636-0.437-0.9570.9340.9160.8960.9460.9460.8610.8910.57810.953-0.841-0.574Alkalibacillus-0.765-0.637-0.426-0.9910.9840.9730.9490.9080.9640.9340.830.6710.9531-0.884-0.585lactic_acid_content0.8360.5120.5630.886-0.883-0.878-0.856-0.823-0.840-0.847-0.714-0.525-0.841-0.8841.0000.766acetic_acid_content0.6750.2380.4990.584-0.574-0.591-0.597-0.588-0.512-0.599-0.408-0.373-0.574-0.5850.7661.000
3 结论
本文主要研究辣白菜中的主要呈味物质随着发酵时间的增加的变化情况,利用高通量测序研究菌群结构变化,以及主要呈味物质与菌群结构的关系。在发酵过程中,有机大分子被微生物分解成小分子,如还原糖和氨基酸,它们的含量都随着发酵时间的延长而增加,与发酵过程中的微生物数量的变化趋势基本一致。形成辣白菜风味有机酸的代表,乳酸和乙酸含量也显著性增加。通过高通量测序技术对发酵过程中的辣白菜中的微生物多样性进行分析,在发酵过程中微生物丰度呈下降趋势,物种分布均匀度也降低,根据主要呈味物质变化情况与菌群结构相互联系,推测其菌群结构与风味之间的关系。根据数据分析,可以清楚的看到Weissella 属与菌落计数相距最近,同时也与总酸含量的呈味物质呈正相关,其贡献率最好,其他菌属呈负相关,并且对主要呈味物质贡献率为负,说明Weissella 属对主要呈味物质有重要作用。
[1] CHO K C,MIN S K,CHOI W Y,et al.Method of manufacturing cut whole kimchi.US,20170000141A[P].2017-01-15.
[2] 张文, 徐梓焓,谢建美,等.辣白菜制作工艺优化[J].食品工业科技,2019,40(14):182-187;202.
ZHANG W,XU Z H,XIE J M,et al.Optimization of processing technology for kimchi[J].Science and Technology of Food Industry,2019,40(14):182-187;202.
[3] 刘刚,邓钱江,汪淑芳,等.发酵过程中韩式泡菜质构变化的研究[J].食品工业科技,2017,38(15):112-116.
LIU G,DENG Q J,WANG S F,et al.Study on the change of Kimchi’s texture characteristic during fermentation process[J].Science & Technology of Food Industry,2017,38(15):112-116.
[4] 王宗敏. 镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学,2016.
WANG Z M.Correlation between structural shifts of microbiota and compositions of flavors during the stage of acetic acid fermentation of Zhenjiang aromatic vinegar[D].Wuxi:Jiangnan University,2016.
[5] 王欢, 席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
WANG H,XI D Z,HUANG Y G,et al.Bacterial community structure and diversity in different stacking fermentation rounds in mechanized Maotai-flavor liquor brewing[J].Food Science,2020,41(2):188-195.
[6] 任大勇, 高良锋,杨柳,等.植物乳杆菌在辣白菜发酵过程中对其感官品质的影响[J].中国调味品,2019,44(8):22-26;43.
REN D Y,GAO L F,YANG L,et al.Effect of Lactobacillus plantarum on sensory quality in fermentation process of spicy cabbage[J].China Condiment,2019,44(8):22-26;43.
[7] 杜连娇, 陈琳.影响泡菜风味形成的因素探究[J].中国果蔬,2019,39(5):18-21.
DU L J,CHEN L.Study on the causes affecting the flavor of pickles[J].China Fruit & Vegetable,2019,39(5):18-21.
[8] 任大勇, 宫圣洁,周亭亭,等.朝鲜族辣白菜中益生性乳酸菌的筛选及其功能特性[J].中国食品学报,2018,18(7):76-82.
REN D Y,GONG S J,ZHOU T T,et al.Screening and functional characteristics of Lactobacillus from spicy cabbage[J].Journal of Chinese Institute of Food Science and Technology,2018,18(7):76-82.
[9] CHOI Y J,LEE H W,YANG J H,et al.Changes in quality properties of kimchi based on the nitrogen content of fermented anchovy sauce,Myeolchi Aekjeot,during fermentation[J].Food Science & Biotechnology,2018,27(4):1 145-1 155.
[10] 刘长蕾,苗乘源,文宇萍,等.东北酸菜和朝鲜族辣白菜发酵过程中微生物的变化[J].东北农业科学,2019,44(3):74-77;82.
LIU C L,MIAO C Y,WEN Y P,et al.Changes of microorganism in pickled cabbage and kimchi fermentation[J].Journal of Northeast Agricultural Sciences,2019,44(3):74-77;82.
[11] ZHANG L,CHE Z M,XU W Z,et al.Dynamics of physicochemical factors and microbial communities during ripening fermentation of Pixian Doubanjiang,a typical condiment in Chinese cuisine[J].Food Microbiology,2020,86:103 342.
[12] JEONG S H,LEE S H,JUNG J Y,et al.Microbial succession and metabolite changes during long-term storage of kimchi[J].Journal of Food Science,2013,78(5):763-769.
[13] CHUN B H,KIM K H,JEONG S E,et al.The effect of salt concentrations on the fermentation of Doenjang,a traditional Korean fermented soybean paste[J].Food Microbiology,2020,86:103 329.
[14] 蔡方圆, 王沛,王智婷,等.基于相关性分析和主成分分析的米豆腐品质评价[J].食品工业科技,2018,39(17):33-39;45.
CAI F Y,WANG P,WANG Z T,et al.Evaluation of rice tofu quality based on correlation analysis and principal component analysis[J].Science and Technology of Food Industry,2018,39(17):33-39;45.
[15] 刘凡, 仇钰莹,周新虎,等.洋河浓香型白酒酒醅中产酸细菌与有机酸合成的相关性研究[J].食品与发酵工业,2018,44(12):22-29.
LIU F,QIU Y Y,ZHOU X H,et al.The correlation between organic acid producing bacteria and organic acids biosynthesis in fermented grains of Yanghe strong-aroma spirit[J].Food and Fermentation Industries,2018,44(12):22-29.
[16] KANG J S,CHUNG W H,NAM Y D,et al.Impact of clay minerals on bacterial diversity during the fermentation process of kimchi[J].Applied Clay Science,2018,154:64-72.
[17] 陈大鹏, 郑娅,周芸,等.自然发酵与人工接种发酵法发酵泡菜的品质比较[J].食品工业科技,2019,40(18):368-372.
CHEN D P,ZHENG Y,ZHOU Y,et al.Quality comparison of pickled cabbage fermented by natural fermentation and artificial inoculation[J].Science and Technology of Food Industry,2019,40(18):368-372.
[18] 张露, 梁寒峭,陈建国,等.酿造酱油中有机酸种类与含量的检测分析[J].食品科技,2019,44(3):295-299.
ZHANG L,LIANG H Q,CHEN J G,et al.Analysis of 10 kinds of organic acids composition in fermented soy sauce[J].Food Science and Technology,2019,44(3):295-299.
[19] 庞敏, 蔡松铃,刘茜.葡萄酒中有机酸及其分析方法的研究进展[J].食品安全质量检测学报,2019,10(6):1 588-1 593.
PANG M,CAI S L,LIU Q.Research progress on the analysis methods of organic acids in wine[J].Journal of Food Safety & Quality,2019,10(6):1 588-1 593.
[20] KIM M J,KWAK H S,JUNG H Y,et al.Microbial communities related to sensory attributes in Korean fermented soy bean paste (Doenjang)[J].Food Research International,2016,89:724-732.
[21] 赵烜影, 苑秀娟,郭鸰,等.传统自然发酵黏豆包面团微生物菌群结构分析[J].食品科学,2018,39(18):67-72.
ZHAO H Y,YUAN X J,GUO L,et al.Microbial community composition of traditional spontaneously fermented sticky bean bun dough[J].Food Science,2018,39(18):67-72.
[22] HONG S P,LEE E J,KIM Y H,et al.Effect of fermentation temperature on the volatile composition of kimchi[J].Journal of Food Science,2016,81(11):2 623-2 629.
[23] KIM H Y,BONG Y J,JEONG J K,et al.Heterofermentative lactic acid bacteria dominate in Korean commercial kimchi[J].Food Science & Biotechnology,2016,25(2):541-545.
[24] 王海娟, 戴雨珂,潘渠.魏斯氏菌的研究现状[J].成都医学院学报,2014,9(6):747-750.
WANG H J,DAI Y K,PAN Q.Research status of Weissner's fungus[J].Journal of Chengdu Medical College,2014,9(6):747-750.
[25] 金红星, 杨希寅,成文玉.辣白菜中分离含内源性质粒的魏斯氏菌及其鉴定[J].中国酿造,2012,31(1):77-79.
JIN H X,YANG X Y,CHENG W Y.Isolation and identification of Weissella containing endogenous plasmids from kimchi[J].China Brewing,2012,31(1):77-79.
[26] SONG H S,WHON T W,KIM J,et al.Microbial niches in raw ingredients determine microbial community assembly during kimchi fermentation[J].Food Chemistry,2020,318:126 481.
[27] 胡传旺, 李巧玉,周朝晖,等.酱醪细菌菌株的分离及功能分析[J].微生物学通报,2017,44(8):1 899-1 907.
HU C W,LI Q Y,ZHOU Z H,et al.Functional analysis of bacteria isolated from soy sauce moromi[J].Microbiology China,2017,44(8):1 899-1 907.