群体感应(quorum sensing,QS)是指细菌基于基因的表达,通过细胞间通讯系统协调细菌-细菌的相互作用和与高等生物的联系[1]。细菌利用分泌的信号分子感应周围环境变化,当其自身产生的信号分子分泌量或者感知外界信号分子浓度达到一定阈值时,将会引发细菌QS相关基因的表达,造成细菌某些生物行为的改变,如生物被膜的形成、毒力因子的表达等[2]。N-酰基高丝氨酸内酯(acyl-homoserine lactones,AHLs)和自诱导肽2(AI-2)等小分子在细菌细胞中作为信号分子调控细菌的发病机制[3],这些信号分子也参与细菌的各种生理过程。其中,革兰氏阴性菌主要分泌的信号分子为AI-1型信号分子。
群体感应抑制剂(quorum sensing inhibitors,QSIs)是一种能够特异性干扰细菌细胞间通信,且不会对细菌正常生长产生抑制作用的物质。牛慧超[4]报道了1,10癸二醇能够作为QSI干扰杀鲑气单胞菌的QS现象,同时可降低其腐败活性。张宁[5]利用紫色杆菌(Chromobacterium violaceum 026,CV026)验证了茶多酚的QSI活性,并进一步证实了其对肺炎克雷伯菌群体感应和毒力因子的影响。丁婷等[6]报道了米曲霉源环二肽对荧光假单胞菌QS现象的抑制作用,并表明其作用机制可能是由于环二肽能够结合荧光假单胞菌LuxⅠ蛋白,从而降低荧光假单胞菌的信号分子生成能力,进而导致相关基因表达量降低。与传统的食品保鲜剂相比,QSIs以食品腐败菌QS系统为靶点,通过干扰QS系统从而达到保鲜的目的。因此,利用QSIs作为食品保鲜剂是目前有效抑制食品腐败的一种新型策略。
微生物是造成水产品腐败的主要原因。在不同情况的水产品腐败过程中,部分致腐能力强的微生物将会参与整个腐败过程,这种微生物被称作特定腐败菌[7]。因鱼类地域广阔、品种繁多、处理方式不同等,其特定腐败菌也不尽相同。气单胞菌 (Aeromonas spp.) 是引发人畜共患胃肠炎和败血症的条件致病菌之一[8],属于革兰氏阴性菌,广泛存在于海水、池塘等水生环境中[9]。同时气单胞菌属在生鲜鱼类的贮藏过程中展现出致腐能力,其分泌的AHLs类信号分子具有调控毒力基因表达的能力[10]。杀鲑气单胞菌(Aeromonas salmonicida)导致的疾病是虹鳟、大西洋鲑等鲑科鱼类养殖生产过程中造成损失的主要因素之一[11]。葛阳杨等[12]研究证明杀鲑气单胞菌具有QS现象,能够通过自身分泌AHLs调控QS相关基因的表达。
脱氢乙酸钠是一种新型的食品保鲜剂,在禽畜肉制品、水产品、果蔬类食品以及饮料中应用广泛[13]。其性质稳定,添加后不会对食品风味造成影响,且对人体无毒副作用。能抑制或杀死食品中的酵母菌、霉菌等微生物,从而有效延长食品货架期[14]。虽然脱氢乙酸钠应用广泛,但是目前作为QSI的研究鲜有报道,故本研究以脱氢乙酸钠作为QSI,研究其在亚抑菌浓度下对杀鲑气单胞菌QS现象的抑制作用。
1 材料与方法
1.1 菌种与试剂
紫色杆菌CV026是1株生物报告菌株,本身不会产生AHLs,当该菌株遇到短链的AHLs(C4-HSL~C8-HSL)时,会产生紫色菌素,通过这种现象可检测AHLs产生。其对卡那霉素具有抗性,使用过程中应添加卡那霉素至终质量浓度为20 mg/mL。杀鲑气单胞菌,分离自海鲈鱼,上述2种菌株均由渤海大学食品科学研究院保藏。
脱氢乙酸钠(纯度99%),上海阿拉丁生化科技股份有限公司;LB肉汤、LB营养琼脂,青岛高科园海博生物技术有限公司;正丁醇、冰乙酸、浓硫酸、乙酸异戊酯、苯酚,天津风船化学试剂有限公司;十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、卡那霉素,国药集团化学试剂有限公司;结晶紫,天津致远化学试剂有限公司;脱脂奶粉,美国BD公司;琼脂粉、蛋白胨、胰蛋白胨、D(+)-葡萄糖,北京奥博星生物技术有限责任公司;NaCl,天津市优谱化学试剂有限公司;锌片,上海迈砷化工有限公司;AHLs信号分子(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL),美国Sigma公司。
1.2 仪器与设备
W-CJ-2FD超净工作台,苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅,上海申安医疗器械厂;LRH系列生化培养箱,上海一恒科技有限公司;MS105UD电子分析天平,瑞士梅特勒-托利仪器有限公司;Czone系列抑菌圈测定及菌落计数仪,杭州迅数科技有限公司;Imark酶标仪,美国BIO-RAD公司;Biofuge Stratos冷冻高速离心机,美国Thermo Fisher公司;SS-4800场发射扫描电子显微镜,日本日立公司;7890 N/5975气相色谱-质谱联用仪,美国Agilent公司。
1.3 试验方法
1.3.1 脱氢乙酸钠的最小抑菌浓度测定及QS抑制效果
参照吴雅萍等[15]的方法略加修改。利用牛津杯法测定脱氢乙酸钠的最小抑菌质量浓度。将菌种CV026和杀鲑气单胞菌分别接种于LB肉汤中进行活化,接种比例为1∶100(体积比),28 ℃、160 r/min摇床培养。连续活化2次后,将活化好的菌液接种于LB营养琼脂中混匀后倒板,用牛津杯打孔。待其凝固后,将不同质量浓度(1.0~5.0 mg/mL)的脱氢乙酸钠溶液分别取200 μL加入孔中,于28 ℃培养箱中静置培养48 h,观察菌株的变化情况,并记录抑菌圈直径大小。以添加去离子水作为空白对照。
将菌种CV026以1∶100(体积比)的比例接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。连续活化2次后,将活化好的菌液接种于LB营养琼脂中,并添加C6-HSL信号分子混匀后倒板,待其凝固后牛津杯打孔。将不同质量浓度(0.4、0.8、1.2、1.6 mg/mL)的脱氢乙酸钠溶液分别取200 μL加入孔中,置于28 ℃生化培养箱中静置培养48 h,观察菌株的变化情况,并记录抑菌圈的大小。以去离子水作为空白对照。
1.3.2 脱氢乙酸钠对CV026紫色菌素产量的影响
参照孔凡栋等[16]的方法:将菌种CV026以体积比1∶100接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。连续活化2次后,将杀鲑气单胞菌以1∶100(体积比)的比例接种于含有终质量浓度为0.4、0.8、1.2、1.6 mg/mL脱氢乙酸钠的LB肉汤,并且添加C6-HSL信号分子继续摇床培养。另外,设立不添加信号分子的实验组,验证脱氢乙酸钠对CV026生长的影响。培养完成后取300 μL培养后的菌液于离心管,加入150 μL 100 mg/mL SDS溶液,振荡15 s,而后加入600 μL正丁醇振荡,提取10 s。而后于8 000 r/min离心10 min,吸取200 μL的上清液于96孔板中,并于波长595 nm下测定OD值。以去离子水为空白对照。
1.3.3 脱氢乙酸钠对杀鲑气单胞菌运动性的影响
将杀鲑气单胞菌按体积比1∶100接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。参照赵龙华等[17]的方法配制群集与泳动培养基,并在其中添加过滤后的脱氢乙酸钠溶液,使其终质量浓度分别为0.4、0.8、1.2、1.6 mg/mL,混匀倒板。待凝固后,取5 μL连续活化后的杀鲑气单胞菌菌液打在含有不同质量浓度脱氢乙酸钠的群集与泳动培养基上,风干后放入培养箱培养48 h,测量其直径大小。分别以添加去离子水和C12-HSL为空白和阳性对照。
1.3.4 脱氢乙酸钠对杀鲑气单胞菌胞外蛋白酶活性的影响
参照LEE等[18]的方法,将杀鲑气单胞菌按体积比1∶100接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。连续活化2次后,添加过滤后的脱氢乙酸钠溶液使其终质量浓度分别为0.4、0.8、1.2、1.6 mg/mL,继续摇床培养48 h。配制牛奶琼脂固体培养基并倒板,用预先灭菌的牛津杯打孔,待其凝固后,吸取200 μL上述菌液过滤于孔中。平板置于培养箱静置培养48 h,培养过程中观察菌株的变化情况,并测量其透明菌圈的大小。分别以添加去离子水和C12-HSL为空白和阳性对照。
1.3.5 脱氢乙酸钠对杀鲑气单胞菌生物被膜形成率的影响
参照WEI等[19]的方法,将杀鲑气单胞菌按体积比1∶100接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。连续活化2次后,添加经滤膜过滤后的脱氢乙酸钠溶液使其终质量浓度分别为0.4、0.8、1.2、1.6 mg/mL。并分装于1.5 mL无菌离心管中,每管1 mL,每组重复3次,静置培养48 h。取上清液测定菌液密度后,弃上清液,无菌水冲洗3~5次,并干燥40 min。取1 mL 1 mg/mL的结晶紫溶液染色20 min。弃结晶紫染液,用无菌水冲洗至干净透明。用体积分数为33%的冰乙酸溶解。取200 μL溶解后的冰乙酸混合液加入96孔板测定吸光度。分别以添加去离子水和C12-HSL为空白和阳性对照。按公式(1)计算生物被膜相对形成率:
生物被膜相对形成率![]()
(1)
式中:OD595(处理组),脱氢乙酸钠处理后的生物被膜的吸光度值;OD595(空白对照组),添加去离子水后的生物被膜吸光度值。
1.3.6 脱氢乙酸钠对杀鲑气单胞菌生物被膜形态的影响
参照赵朵等[20]的方法,将锌片剪裁成边长为10 mm的正方形,并用抛光机抛光后置于无水乙醇和去离子水中超声清洗30 min,烘干后灭菌备用。将连续活化2次后的菌液与经滤膜过滤后的脱氢乙酸钠溶液混合,使其终质量浓度分别为0.4、0.8、1.2、1.6 mg/mL,并置于无菌培养皿内。将灭菌后的锌片浸没其中,常温放置72 h,取出锌片,无菌水清洗至完全除掉菌液,放入预先于冰箱中预冷体积分数为2.5%的戊二醛溶液中浸泡4 h,取出锌片后用体积分数分别为50%、70%、80%、90%、100%的乙醇溶液进行梯度洗脱,最后经乙酸异戊酯置换2次后用无菌风干燥固定。喷金处理后利用扫描电子显微镜观察生物被膜形态。
1.3.7 脱氢乙酸钠对杀鲑气单胞菌AHLs产量的影响
参照孙晓佳等[21]的方法。AHLs粗提液制备:将杀鲑气单胞菌按体积比1∶100接种于LB肉汤中进行活化,28 ℃,160 r/min摇床培养。连续活化2次后,添加脱氢乙酸钠使其终质量浓度分别为0.4、0.8、1.2、1.6 mg/mL,继续摇床培养48 h。培养好的菌液10 000 r/min离心15 min,取上清液。加入相同体积0.1%冰乙酸酸化后的乙酸乙酯提取液提取,并在提取液中加入一定量的无水硫酸钠。利用旋转蒸发仪去除溶剂,蒸发后的残留物用1 mL甲醇进行溶解,置于-20 ℃保存。分别以添加去离子水和C12-HSL为空白和阳性对照。
GC-MS测定:以甲醇为溶剂制备6种AHLs标准品的混合溶液,通过GC-MS测定各类AHLs的保留时间,而后测定上述提取AHLs粗提液的保留时间。
2 结果与分析
2.1 脱氢乙酸钠最小抑菌质量浓度测定及QS抑制效果
通过菌株生长情况可以观察到脱氢乙酸钠对CV026和杀鲑气单胞菌的最小抑菌质量浓度为2 mg/mL。在此浓度下杀鲑气单胞菌的生长并不会受到抑制。综合考虑,选取亚抑菌质量浓度为1.6 mg/mL。试验中选取脱氢乙酸钠质量浓度为0.4、0.8、1.2、1.6 mg/mL进行后期试验。图1为亚抑菌浓度下脱氢乙酸钠对CV026产生紫色菌素的抑制作用。由图1可知,加入脱氢乙酸钠水溶液的处理孔周围有白色不透明抑制圈出现,初步表明在CV026生长没有受到抑制的前提下,脱氢乙酸钠能抑制CV026产生紫色菌素。这说明了脱氢乙酸钠能干扰报告菌株CV026的QS系统,进而影响紫色菌素的产量。

1-脱氢乙酸钠(2 mg/mL);2-去离子水
图1 脱氢乙酸钠对CV026产生紫色菌素的抑制活性
Fig.1 Inhibitory activity of sodium dehydroacetate against violacein production in CV026
2.2 脱氢乙酸钠对CV026紫色菌素产量的影响
通过酶标法测定了不同质量浓度脱氢乙酸钠对菌株CV026紫色菌素产量的影响(图2)。随着脱氢乙酸钠质量浓度的增加,紫色菌素的产量逐渐下降,而对CV026的菌液密度几乎没有影响。与空白对照相比,脱氢乙酸钠质量浓度为1.6 mg/mL时,紫色菌素的产量下降近63.39%。结果表明,在亚抑菌质量浓度下,脱氢乙酸钠是通过干扰CV026的QS系统从而抑制CV026产生紫色菌素的能力。
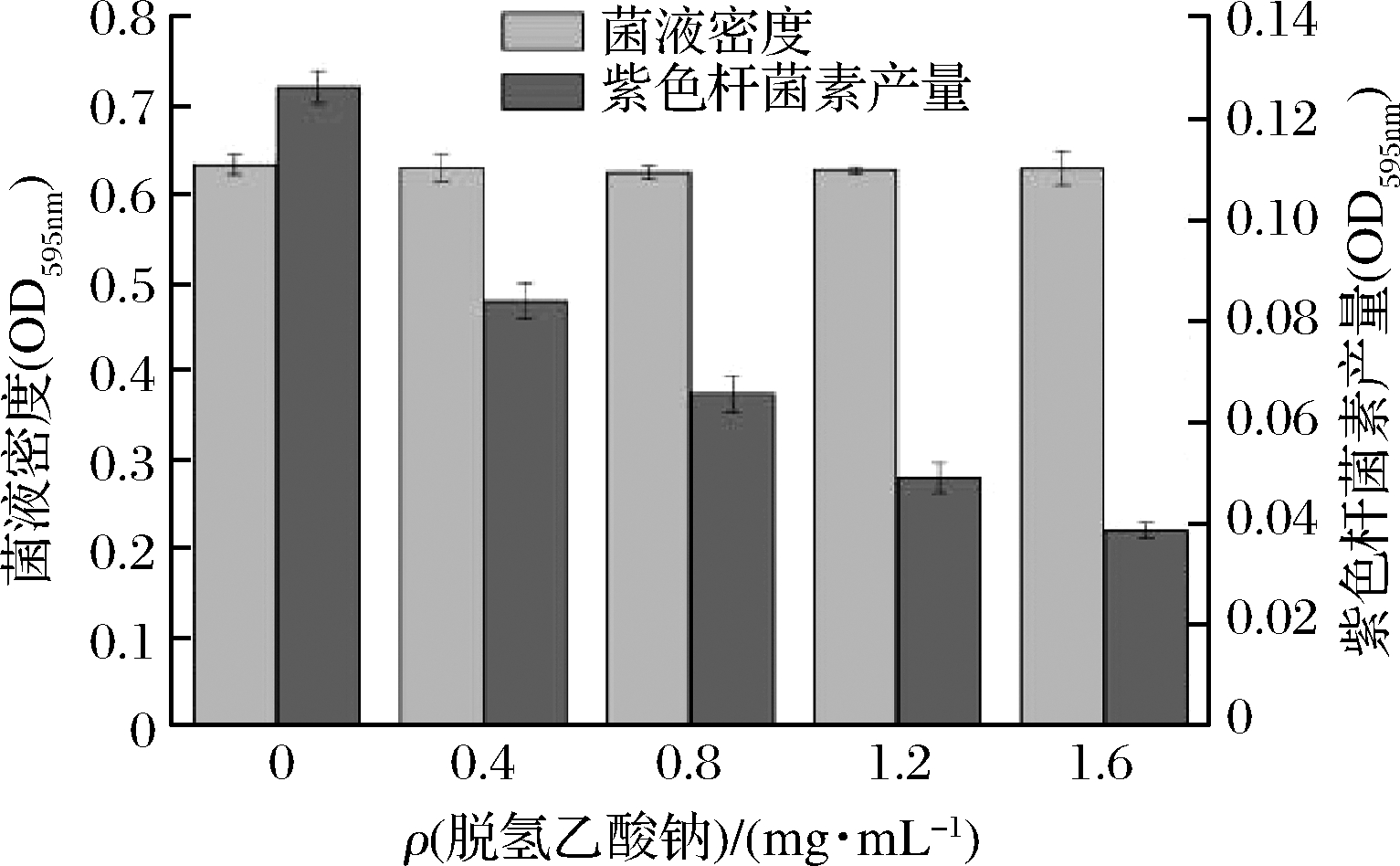
图2 不同质量浓度脱氢乙酸钠对CV026产紫色菌素 和菌液密度的影响
Fig.2 The effect of sodium dehydroacetate on the production of violacein and bacterial density of CV026 strain
2.3 脱氢乙酸钠对杀鲑气单胞菌运动性的影响
图3、4表明不同质量浓度的脱氢乙酸钠对杀鲑气单胞菌的群集和泳动的影响。随着脱氢乙酸钠质量浓度的增加,菌群的迁移直径会逐渐减少。可以判断杀鲑气单胞菌的运动能力与脱氢乙酸钠质量浓度呈负相关,当脱氢乙酸钠终质量浓度为1.6 mg/mL时,杀鲑气单胞菌的群集和泳动能力分别下降了82.76%和73.41%。说明在亚抑菌质量浓度情况下,杀鲑气单胞菌的运动能力微弱。当添加C12-HSL信号分子时,杀鲑气单胞菌迁移直径明显增加。渠宏雁等[22]报道了抑制剂抑制副溶血弧菌的群集与泳动的现象。
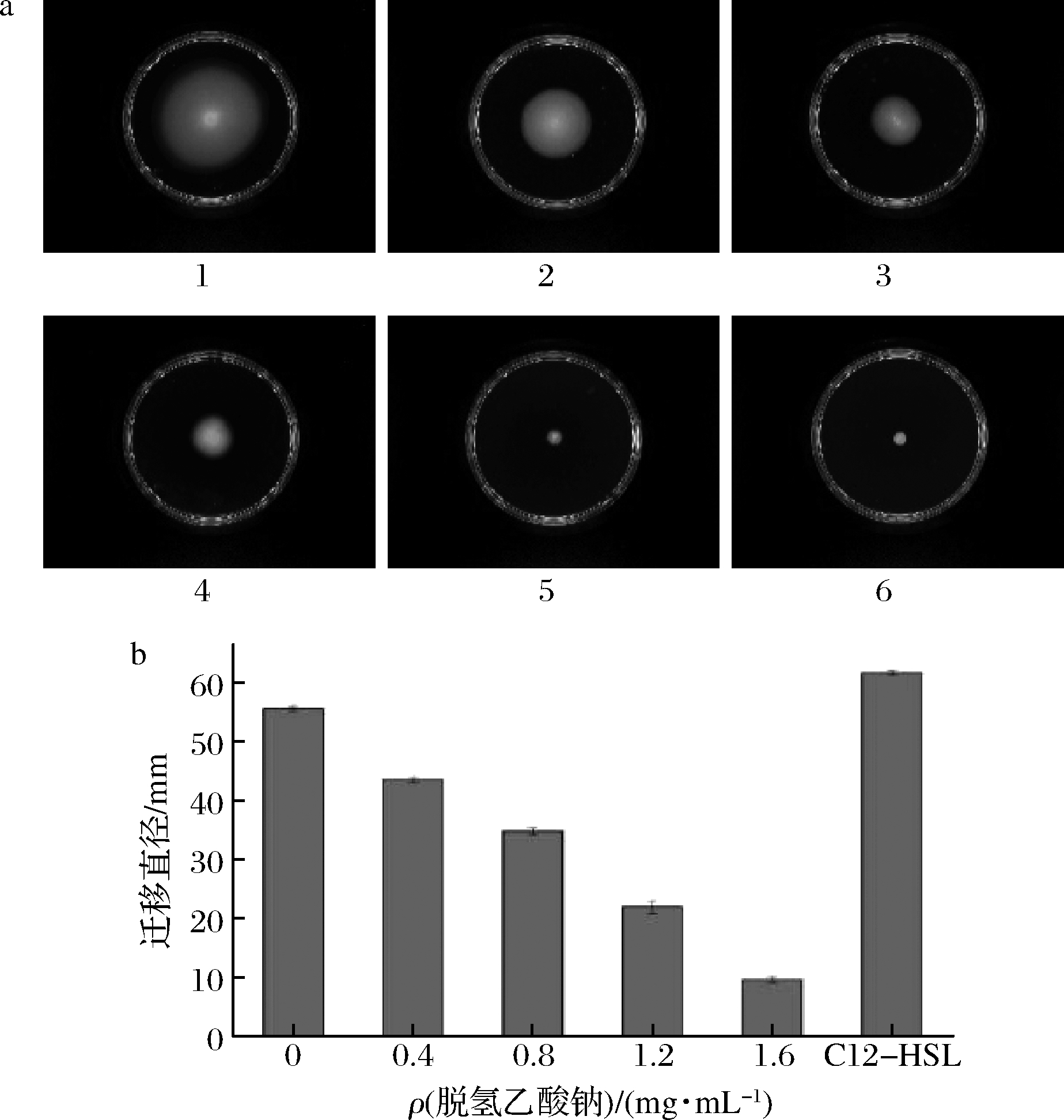
a-群集平板图;b-迁移直径 1-C12-HSL;2-去离子水;3-0.4 mg/mL; 4-0.8 mg/mL;5-1.2 mg/mL;6-1.6 mg/mL
图3 脱氢乙酸钠对杀鲑气单胞菌群集的影响
Fig.3 The effect of sodium dehydroacetate on swarming motility of A.salmonicida
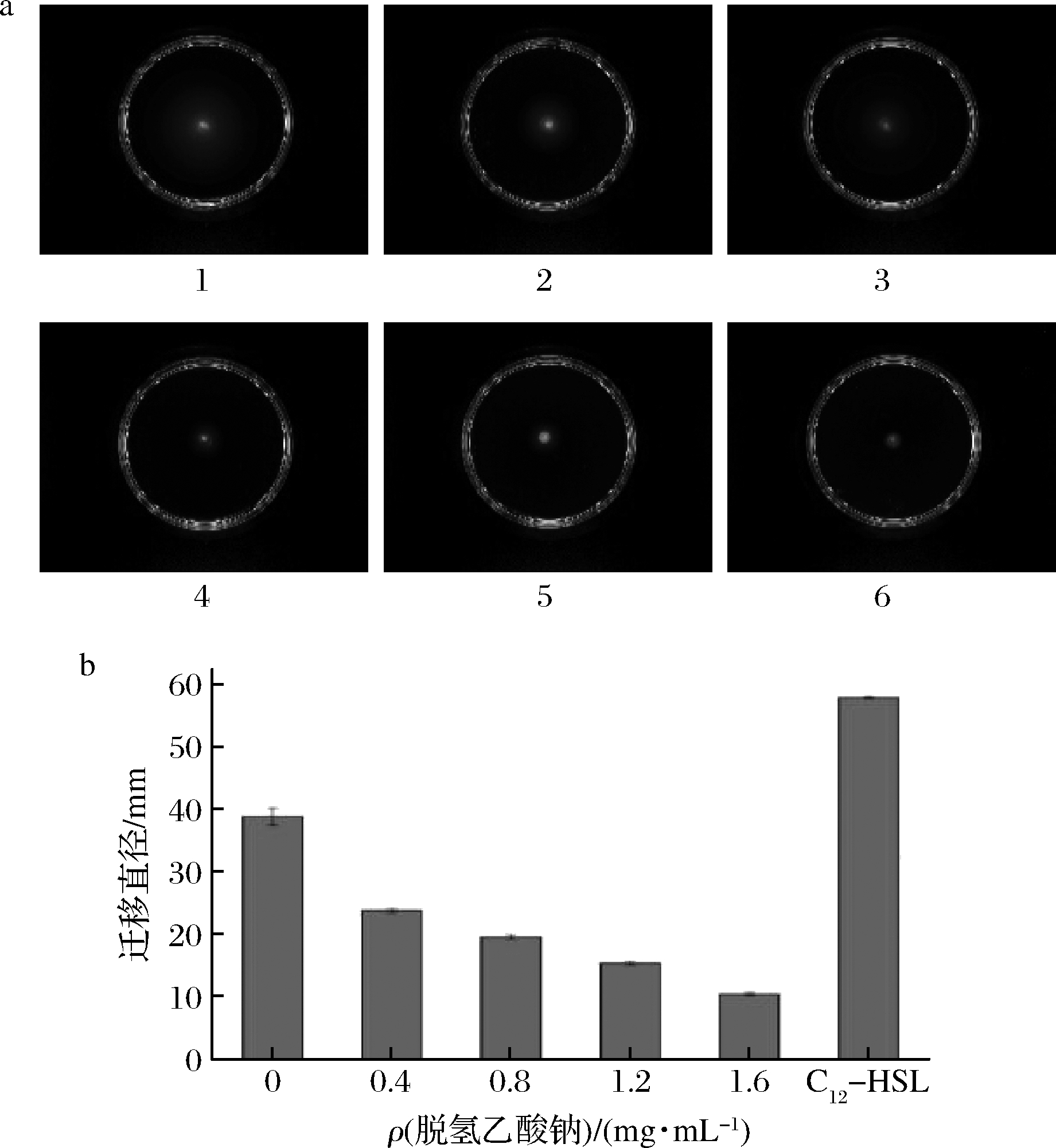
a-群集平板图;b-迁移直径 1-C12-HSL;2-去离子水;3-0.4 mg/mL;4-0.8 mg/mL; 5-1.2 mg/mL;6-1.6 mg/mL
图4 脱氢乙酸钠对杀鲑气单胞菌泳动的影响
Fig.4 The effect of sodium dehydroacetate on swimming motility of A.salmonicida
2.4 脱氢乙酸钠对杀鲑气单胞菌胞外蛋白酶活性的影响
新鲜水产品因肌肉中水分和蛋白质含量高、不饱和脂肪酸易氧化等特点,为微生物的生长繁殖提供优良的环境,微生物则是造成水产品腐败的主要原因。而胞外蛋白酶能快速分解鱼类蛋白质导致鱼类腐败变质,周围[23]研究表明粘质沙雷氏菌胞外蛋白酶的分泌量受到AHLs介导的QS系统的调控。如图5所示,随着脱氢乙酸钠质量浓度的增加,胞外蛋白酶分解蛋白质产生的水解圈直径变小。当添加外源信号分子C12-HSL时,胞外蛋白酶水解圈直径与阴性对照组相比明显增加。梅永超等[24]证实了绿薄荷精油对温和气单胞菌的胞外蛋白酶起到抑制作用。由此可以看出,杀鲑气单胞菌胞外蛋白酶活性是由AHLs所介导的QS系统影响,脱氢乙酸钠通过干扰杀鲑气单胞菌的QS系统,从而抑制其胞外蛋白酶的活性。
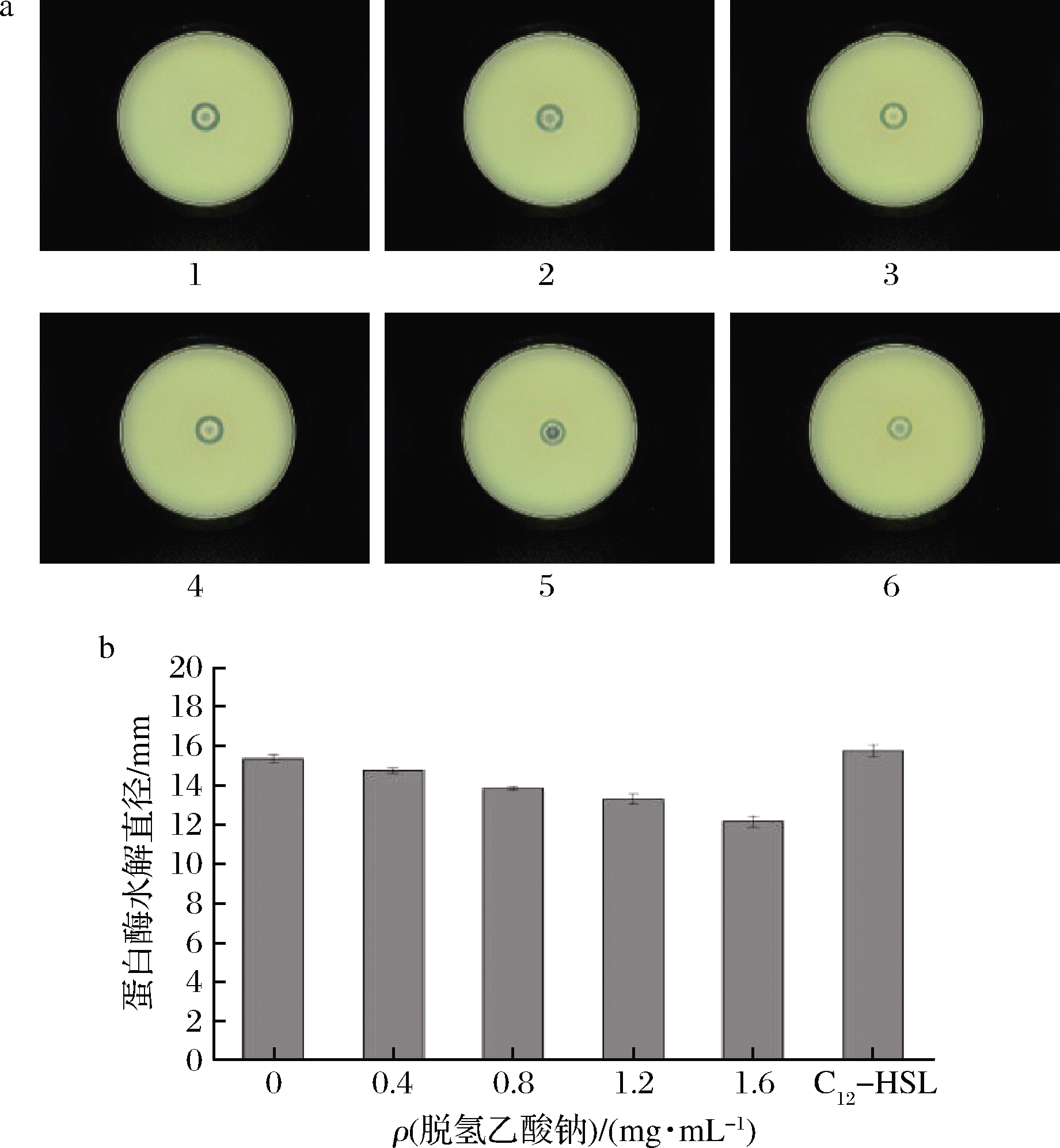
a-牛奶平板图;b-蛋白酶水解直径 1-C12-HSL;2-去离子水;3-0.4 mg/mL;4-0.8 mg/mL;5-1.2 mg/mL; 6-1.6 mg/mL
图5 脱氢乙酸钠对杀鲑气单胞菌胞外蛋白酶的影响
Fig.5 The effect of sodium dehydroacetate on extracellular protease activity of A.salmonicida
2.5 脱氢乙酸钠对杀鲑气单胞菌生物被膜相对形成率的影响
细菌生物被膜是由附着于惰性或活性实体表面的细菌细胞和包裹细菌的水合性胞外聚合物组成的结构性细菌群落[25]。生物被膜是大多数细菌在自然状态下的一种存在形态,这使得细菌具有更好的自我竞争优势。一些细菌生物被膜的形成受到其自身QS系统的调控,并且该系统所调控的多种生理行为主要依赖与群体密度影响[26]。由图6可知,脱氢乙酸钠对菌液密度的影响不大,但随着脱氢乙酸钠质量浓度升高,生物被膜的形成率反而有所下降,说明脱氢乙酸钠能有效抑制杀鲑气单胞菌生物被膜的形成。同时,与阴性对照相比,当添加终质量浓度为1.6 mg/mL脱氢乙酸钠,生物被膜相对形成率仅为31.78%,而作为阳性对照添加外源信号分子C12-HSL生物被膜相对形成率达到129.37%。由此看出,脱氢乙酸钠可能通过干扰杀鲑气单胞菌的QS系统调控生物被膜的形成。
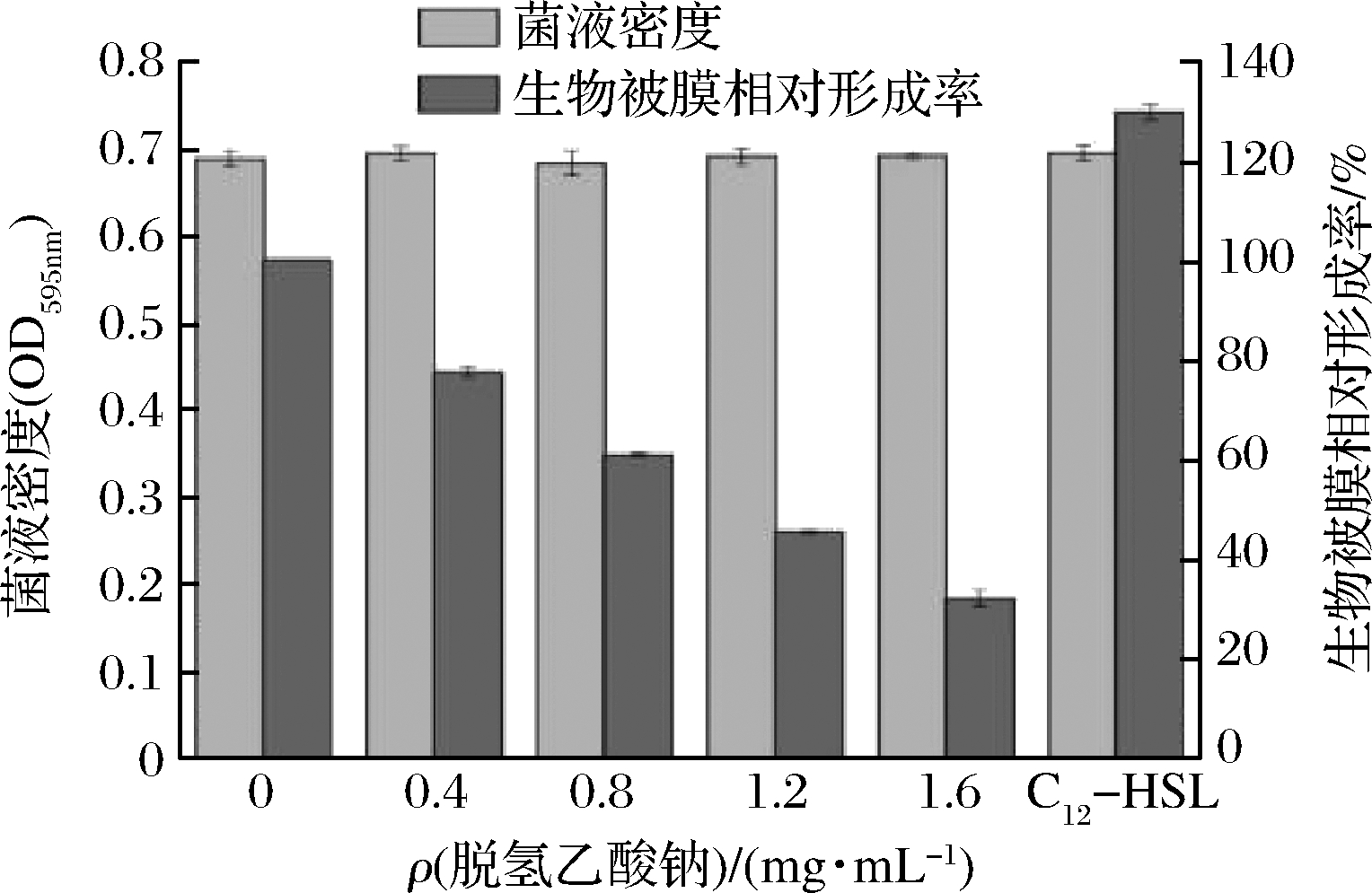
图6 脱氢乙酸钠对杀鲑气单胞菌生物被膜相对形成率的影响
Fig.6 The effect of sodium dehydroacetate on biofilm formation of A.salmonicida
2.6 脱氢乙酸钠对杀鲑气单胞菌生物被膜形态的影响
图7是经不同质量浓度脱氢乙酸钠处理后,杀鲑气单胞菌形成的生物被膜的扫描电镜图。由图7可知,阳性对照组中生物被膜形态结构粗糙致密,堆叠状态加深、结构更为复杂。从图7可知,随着脱氢乙酸钠的质量浓度增加,生物被膜形态破坏愈剧烈。

1-C12-HSL;2-去离子水;3-0.4 mg/mL;4-0.8 mg/mL; 5-1.2 mg/mL;6-1.6 mg/mL
图7 脱氢乙酸钠对杀鲑气单胞菌生物被膜影响的 扫描电子显微镜图
Fig.7 Scanning electron microscopic images showing the effect of sodium dehydroacetate on biofilm formation of A.salmonicida
结果与上述酶标法测定生物被膜形成量一致,印证了脱氢乙酸钠可显著降低杀鲑气单胞菌生物被膜的形成能力。ZHANG等[26]研究发现乙醇脱氢酶可以调节不动杆菌QS现象,从而对生物被膜的形成造成影响。
2.7 脱氢乙酸钠对杀鲑气单胞菌AHLs产量的影响
RANI等[27]利用GC-MS测定铜绿假单胞菌AHLs信号分子的的分泌情况。图8是6种混合AHLs(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL)标准品的GC-MS检测图。6种混合标准品已经完全分离,峰形尖锐,其相应特征峰的保留时间依次为3.296、4.895、6.742、8.760、11.143、13.908 min。图9表示杀鲑气单胞菌所产的AHLs是C12-HSL,且在相同培养条件下,随着脱氢乙酸钠质量浓度增加,AHLs的峰面积逐渐减小,两者呈负相关。结果表明,脱氢乙酸钠可以有效抑制杀鲑气单胞菌AHLs的产生。结合上文所述,证实了脱氢乙酸钠对杀鲑气单胞菌信号分子的产生具有抑制作用。
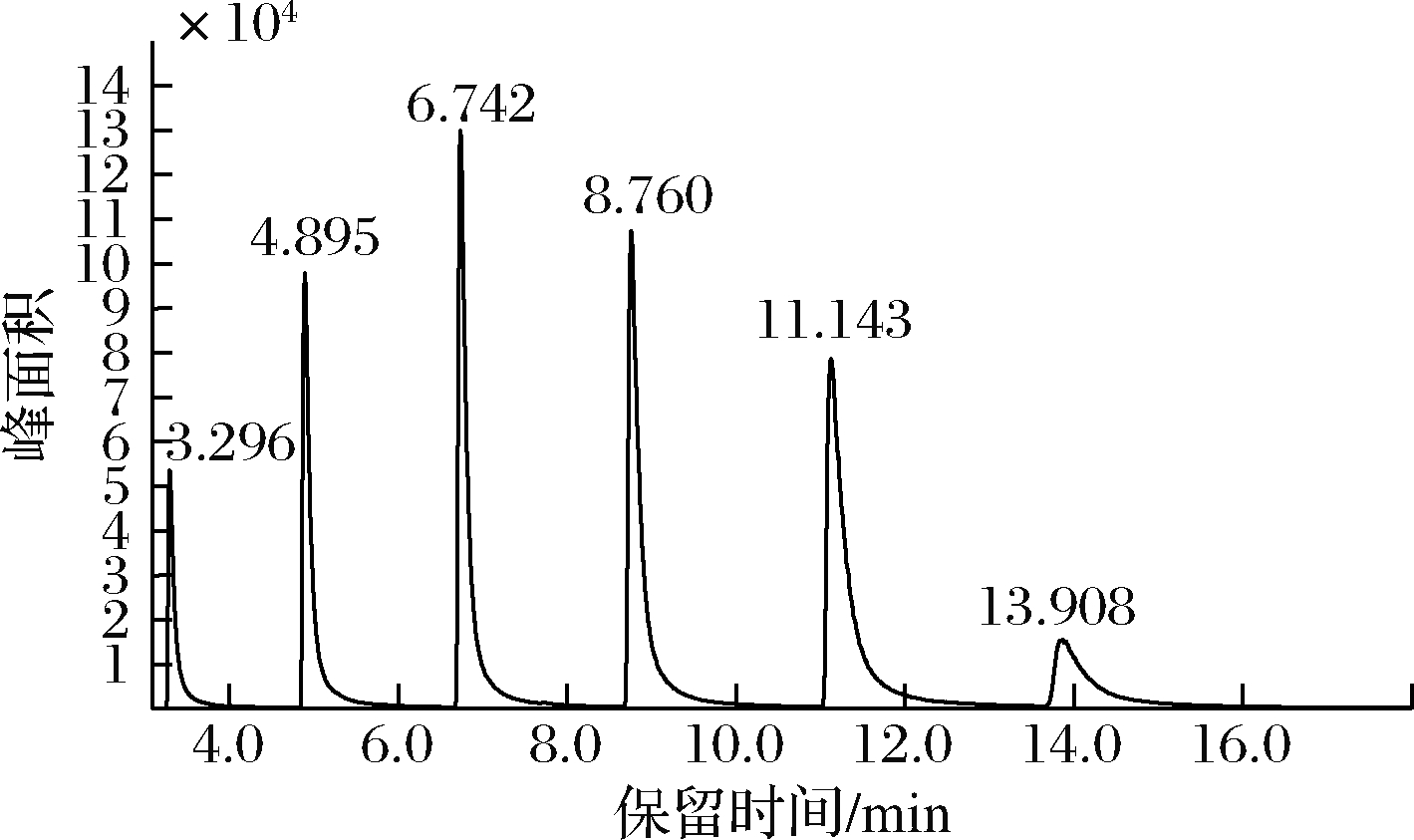
图8 AHLs混合标准品的GC-MS图
Fig.8 GC-MS diagram of AHLs mixed with the standard

图9 脱氢乙酸钠对杀鲑气单胞菌AHLs产量的影响
Fig.9 The effect of sodium dehydroacetate on the production of AHLs from A.salmonicida
3 结果与讨论
本文通过杀鲑气单胞菌测定脱氢乙酸钠的最小抑菌浓度,并利用报告菌株CV026验证了脱氢乙酸钠具有QS抑制性。通过QS现象表型如:细菌的运动性、胞外蛋白酶水解活性以及生物被膜的抑制性以及破坏作用,进一步证实在亚抑菌浓度情况下,脱氢乙酸钠对杀鲑气单胞菌的QS现象均起到抑制作用。最后,通过GC-MS进行特征峰分析抑制能力。综上所述,脱氢乙酸钠具有抑制杀鲑气单胞菌自身分泌AHLs信号分子的能力,从而达到影响杀鲑气单胞菌的QS系统的效果。
[1] DALGAARD P.Qualitative and quantitative characterization of spoilage bacteria from packed fish[J].International Journal of Food Microbiology,1995,26(3):319-333.
[2] 励建荣, 李婷婷,王当丰.微生物群体感应系统及其在现代食品工业中应用的研究进展[J].食品科学技术学报,2020,38(1):1-11.
LI J R,LI T T,WANG D F.Research progress on microbial quorum sensing system and its application in modern food industry[J].Journal of Food Science and Technology,2020,38(1):1-11.
[3] GANESH P S,RAI V R.Evaluation of anti-bacterial and anti-quorum sensing potential of essential oils extracted by supercritical CO2 method against Pseudomonas aeruginosa[J].Journal of Essential Oil Bearing Plants,2015,18(2):264-275.
[4] 牛慧超. 1,10-癸二醇对杀鲑气单胞菌群体感应抑制作用及对大黄鱼保鲜效果研究[D].锦州:渤海大学,2020.
NIU H C.Study on the inhibitory effect of 1,10-decanediol on quroum sensing of Aeromonas salmon and its preservation effect on Larimichthys crocea[D].Jinzhou:Bohai University,2020.
[5] 张宁. 基于群体感应途径探讨茶多酚对肺炎克雷伯菌毒力及耐药性的作用[D].南昌:南昌大学,2020.
ZHANG N.Effects of tea polyphenols on virulence and drug resistance of Klebsiella pneumoniae based on quorum sensing[D].Nanchang:Nanchang University,2020.
[6] 丁婷, 李勇.米曲霉来源的环二肽对荧光假单胞菌群体感应的抑制及其机制[J].生物加工过程,2020,18(2):234-244.
DING T,LI Y.Inhibition on quorum sensing of Pseudomonas fluorescens by cyclic dipeptide isolated from Aspergillus oryzae and its mechanism[J].Chinese Journal of Bioprocess Engineering,2020,18(2):234-244.
[7] ZHENG R H,XU X R,XING J L,et al.Quality evaluation and characterization of specific spoilage organisms of Spanish mackerel by high-throughput sequencing during 0 ℃ cold chain logistics[J].Foods,2020,9(3):312.
[8] 于红雷, 韩云艳,曾名湧,等.凡纳滨对虾源气单胞菌的分离鉴定及群体感应[J].生物加工过程,2019,17(3):324-328.
YU H L,HAN Y Y,ZENG M Y,et al.Identification and quorum sensing of Aeromonas from Litopenaeus vannamei[J].Chinese Journal of Bioprocess Engineering,2019,17(3):324-328.
[9] GARDE C,BJARNSHOLT T,GIVSKOV M,et al.Quorum sensing regulation in Aeromonas hydrophila[J].Journal of Molecular Biology,2010,396(4):849-857.
[10] KHAJANCHI B K,KOZLOVA E V,SHA J,et al.The two-component QseBC signalling system regulates in vitro and in vivo virulence of Aeromonas hydrophila[J].Microbiology,2012,158(1):259-271.
[11] 雷美华.杀鲑气单胞菌对鱼类致病性的研究[J].海洋与渔业,2020(3):68-69.
LEI M H.Studies on the pathogenicity of salmon killing Aeromonas on fish[J].Ocean and Fishery,2020(3):68-69.
[12] 葛阳杨, 朱军莉,刘丽,等.大黄鱼源气单胞菌的分离鉴定及致腐表型[J].水产学报,2017,41(6):861-869.
GE Y Y,ZHU J L,LIU L,et al.Spoilage phenotypic characterization and identification of Aeromonas isolated from spoiled Larimichthys crocea[J].Journal of Fisheries of China,2017,41(6):861-869.
[13] 叶银枝. 脱氢醋酸钠在食品中的应用[J].中国食品添加剂,2002(3):64-66.
YE Y Z.Use of sodium dehydroacetate in food[J].China Food Additives,2002(3):64-66.
[14] 黎婉园, 姚朔影,夏枫耿,等.脱氢醋酸钠及其抗菌性试验[J].中国食品添加剂,2004(2):41-44.
LI W Y,YAO S Y,XIA F G,et al.Studied on antibacterial properties of disodium dehydroacetate[J].China Food Additives,2004(2):41-44.
[15] 吴雅萍,江晓佟,张帅,等.乳链球菌素最小抑菌浓度(MIC)测定及理化性质分析[J].中国食品添加剂,2020,31(5):119-123.
WU Y P,JIANG X T,ZHANG S,et al.Nisin minimum inhibitory concentration (MIC) determination and its physicochemical property[J].China Food Additives,2020,31(5):119-123.
[16] 孔凡栋, 周丽曼,马青云,等.革兰氏阴性细菌LuxR/Ⅰ型群体感应抑制剂研究进展[J].现代生物医学进展,2017,17(30):5 984-5 988.
KONG F D,ZHOU L M,MA Q Y,et al.Research advances in the LuxR/I type quorum sensing inhibitors of gram-negative bacteria[J].Progress in Modern Biomedicine,2017,17(30):5 984-5 988.
[17] 赵龙华,杨维青.细菌群集运动与生物被膜和耐药性的关系[J].国际检验医学杂志,2011,32(17):1 986-1 988.
ZHAO L H,YANG W Q.The relationship between bacterial swarm movement and biofilm and drug resistance[J].International Journal of Laboratory Medicine,2011,32(17):1 986-1 988.
[18] LEE S O,KATO J,TAKIGUCHI N,et al.Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp.strain A28[J].Applied and Environmental Microbiology,2000,66(10):4 334-4 339.
[19] WEI L N,SHI C Z,LUO C X,et al.Phloretin inhibits biofilm formation by affecting quorum sensing under different temperature[J].LWT,2020,131.DOI:10.1016/j.lwt.2020.109668.
[20] 赵朵, 肖娜,裴曼君,等.金黄色葡萄球菌生物被膜形成及检测方法研究[J].教育教学论坛,2020(47):388-390.
ZHAO D,XIAO N,PEI M J,et al.Research on the formation and detection methods of Staphylococcus aureus biofilm[J].Education Teaching Forum,2020(47):388-390.
[21] 孙晓佳, 李婷婷,赫彬彬,等.富马酸钠对荧光假单胞菌群体感应现象及其腐败活性的抑制作用[J].食品科学,2019,40(11):7-13.
SUN X J,LI T T,HE B B,et al.Inhibitory effect of sodium fumarate on quorum sensing and spoilage capacity of Pseudomonas fluorescens[J].Food Science,2019,40(11):7-13.
[22] 渠宏雁, 李学鹏,孟良玉,等.抑制剂对副溶血性弧菌运动性的影响[J].食品与生物技术学报,2014,33(5):480-485.
QU H Y,LI X P,MENG L Y,et al.Effect of inhibitors on the motilities of Vibrio parahaemolyticus[J].Journal of Food Science and Biotechnology,2014,33(5):480-485.
[23] 周围. 粘质沙雷氏菌次生代谢产物灵菌红素的生理与生物学活性的研究[D].重庆:西南大学,2014.
ZHOU W.The physiological and biological activities of prodigiosin,the secondary metabolites of Serratia marcescens[D].Chongqing:Southwest University,2014.
[24] 梅永超, 李婷婷,刘楠,等.绿薄荷精油对温和气单胞菌群体感应现象及其腐败特性的抑制作用[J].食品科学,2018,39(15):17-23.
MEI Y C,LI T T,LIU N,et al.Effect of spearmint oil on quorum sensing and spoilage characteristics of Aeromonas sobria[J].Food Science,2018,39(15):17-23.
[25] DONLAN R M,COSTERTON J W.Biofilms:Survival mechanisms of clinically relevant microorganisms[J].Clinical Microbiology Reviews,2002,15(2):167-193.
[26] ZHANG K J,YANG X Y,YANG J L,et al.Alcohol dehydrogenase modulates quorum sensing in biofilm formations of Acinetobacter baumannii[J].Microbial Pathogenesis,2020,148.DOI:10.1016/j.micpath.2020.104451.
[27] RANI S,KUMAR A,MALIK A K,et al.Occurrence of N-acyl homoserine lactones in extracts of bacterial strain of Pseudomonas aeruginosa and in sputum sample evaluated by gas chromatography-mass spectrometry[J].American Journal of Analytical Chemistry,2011,2(2):294-302.