中性蛋白酶是其最适作用 pH 6.0~7.5的一类蛋白酶[1],作为最先发现并使用的酶制剂[2],其具有作用底物广泛、高效专一、污染小等特点,已经广泛应用于食品工业、饲料加工、纺织、医药等方面[3-5]。枯草芽胞杆菌(Bacillus subtilis)是美国食品药物管理局公布的安全菌种[3],是常用的中性蛋白酶生产菌种。益生菌是一种能够黏附在宿主体内来提高其健康程度的活性微生物,常见益生菌有乳杆菌、枯草杆菌等[6]。FAO/WHO《食品益生菌评价指南》中指出,益生菌必须能够在胃肠道有效地发挥作用,其功能性评价主要包括耐酸和耐胆盐、黏附和定植、有效生物活性及良好生产性能等[7]。枯草芽胞杆菌作为很好的食品级益生菌菌株[8-9],在改善肠道菌群、调节免疫力、改善脂类代谢等方面都有广泛应用[10],它是农业部公布的16种可以直接饲喂动物的饲料级益生菌菌种之一[11]。枯草芽胞杆菌能在动物肠道中生长,有利于肠道正常菌群的繁殖,并有效抑制致病菌的生长,其代谢产物能调节宿主肠道内微生物菌群的平衡,对宿主有益、无害、无致病性[12]。
在工业化生产过程中,由于菌种的衰退,菌种产酶能力下降、稳定性降低,加之原材料价格上涨,行业企业竞争等,微生物遗传改良菌种对提高中性蛋白酶酶活力具有重要的现实意义。诱变包括物理诱变、化学诱变和生物诱变。紫外作为一种传统的诱变技术,具有操作方便、节约成本、诱变效果好等优点。牛春华等[13]通过初筛和紫外诱变筛选得到正突变枯草芽胞杆菌菌株B4-56,其透明圈与菌落直径比值为5.52,较原始菌株的3.01明显增大,产蛋白酶能力显著提高。王晓云等[14]利用紫外诱变获得1株高活性蛋白酶枯草芽胞杆菌B38,蛋白酶活力为 86.82 U/mL,是出发菌株BC2的3.14倍。LiCl作为一种高效低毒的化学诱变剂,被广泛应用于赤灵芝[15]、蛹虫草[16]、3-羟基丙酸产生菌[17]、植酸酶高产菌株[18]等多种微生物优良菌株的选育。复合诱变具有协同效应,其诱变效果要好于单一诱变[19]。紫外与化学诱变剂的复合诱变成功应用于产γ-氨基丁酸乳酸菌[20]、中性蛋白酶高产菌株[21]、谷氨酰胺转胺酶高产菌株[22]、产低温弹性蛋白酶菌株[23]、中性植酸酶高产菌株[24]、红霉素高产菌株[25]等菌种的选育。
本研究从实验室保藏的枯草芽胞杆菌中挑选出中性蛋白酶酶活力较高的菌株,以此菌株为出发菌株,通过紫外、LiCl、紫外-LiCl等方式来提高该菌株产中性蛋白酶酶活力的能力,并模拟动物体外胃肠道环境,测定高产菌株的耐热、表面特性、降脂能力和对几种致病菌的抑菌能力,并以此评价其益生特性,以期为进一步利用该菌株开发微生态制剂奠定一定理论依据。
1 材料与方法
1.1 材料与试剂
枯草芽胞杆菌WT、大肠杆菌(Escherichia coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)、金黄色葡萄球菌(Staphylococcus aureus)保藏于微生物遗传育种实验室。
甘油三酯测定试剂盒、胆固醇测定试剂盒,长春汇力生物技术有限公司;L-酪氨酸、酪蛋白、胆固醇、无水氯化锂、福林酚等,均为国产分析纯;脱脂高钙奶粉食品级,双城雀巢有限公司。
1.2 培养基
筛选培养基:脱脂奶粉 15 g,牛肉浸膏 3 g,琼脂粉 20 g,NaCl 5 g,蛋白胨 10 g。蒸馏水1 000 mL,pH 7.2,121 ℃灭菌20 min备用。
种子培养基(LB培养基):胰蛋白胨10 g,酵母浸膏5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.2,121 ℃灭菌20 min备用。添加琼脂(15 g/L)制成试管斜面培养基。
LB半固体培养基:在种子培养基中加7.5 g/L琼脂粉。
发酵培养基:蛋白胨 30 g,D-无水葡萄糖 60 g,NaCl 10 g,CaCl2 2.7 g,Na2HPO4 4 g,pH 7蒸馏水1 000 mL。121 ℃灭菌20 min备用。
胆固醇培养基:LB培养基中加入0.1 g/L胆固醇,0.1 g/L蔗糖酯,体积分数0.1%Tween-80,体积分数0.5%冰乙酸,2 g/L巯基乙酸钠,pH 6.0,121 ℃灭菌15 min。
甘油三酯培养基:LB培养基中加入体积分数5% Tween-80和1%猪油,2 g/L巯基乙酸钠,pH 6.0,121 ℃灭菌15 min。
1.3 仪器与设备
SynergyHI酶标仪,美国Biotek 公司;TU-19紫外可见分光光度计,北京普析通用仪器有限责任公司;PB-20型pH计,德国Sartarius公司;64RL高速冷冻离心机,美国Beckeman公司。
1.4 实验方法
1.4.1 中性蛋白酶酶活力的测定
依据GB/T 23537—2009《蛋白酶制剂》,利用福林-酚法测定酶活力[26]。中性蛋白酶活力定义:1 mL酶液在40 ℃,pH 7.5条件下,酪蛋白水解1 min产生1 μg 酪氨酸为1个活力单位,用U/mL表示。酶活力根据公式(1)计算:
蛋白酶活力![]()
(1)
式中:A,样品OD值;K,吸光常数;V1,试剂的总体积;t,反应时间;V2,粗酶液的体积;N,稀释总倍数。
1.4.2 紫外诱变
在超净工作台中,通过固定紫外灯的功率18 W和照射距离30 cm,改变紫外照射时间来得到不同的剂量。以未经紫外照射的菌液做对照计算致死率。37 ℃避光培养24 h,待菌落长出后,取出平板进行计数,按照公式(2)计算致死率:
致死率![]()
(2)
式中:n0,未照射平板的菌落数;n1,照射平板的菌落数。
1.4.3 LiCl诱变
将紫外诱变选育得到的高产中性蛋白酶菌株活化24 h,然后取2 mL菌液到50 mL种子液中,培养12 h,再吸取0.1 mL活化了12 h稀释至10-7,10-8梯度的菌悬液至不同浓度的 LiCl(0、0.3%、0.6%、0.9%、1.5%、2.1%、2.4%和2.7%质量分数,下同)脱脂奶粉固体分离平板上涂布,37 ℃,培养24 h,计数并计算致死率。
1.4.4 紫外-LiCl复合诱变
将筛选得到的中性蛋白酶酶活力较高的菌株,先按照1.4.3进行紫外诱变,再把紫外诱变后的菌悬液涂布于含0%、0.3%、0.6%、0.9%、1.5%、2.1%、2.4%和2.7% LiCl的诱变筛选培养基平板上,进行复合诱变。
1.4.5 突变菌株的筛选
在最佳诱变剂量下对菌悬液进行诱变,稀释涂布于筛选平板上,37 ℃培养24~60 h,记录培养期间水解圈直径H(mm)与菌落直径C(mm),初筛标准为 C 在 2.0~3.5 mm 且 H/C 较大。初筛得到的单菌落于斜面传代,活化种子液按 5%(体积分数)接种至发酵培养基,37 ℃、150 r/min 摇床培养 72 h,发酵液12 000 r/min 离心 5 min,取上清液测定中性蛋白酶的酶活力进行复筛。
1.4.6 遗传稳定性实验
将筛选得到的高产菌株进行传代培养,连续传10代,分别检测每代菌株中性蛋白酶酶活力,以考察突变菌株的遗传稳定性。
1.4.7 高产菌株的益生特性
1.4.7.1 耐热性
用若干无菌离心管各装取1 mL刚活化好的高产菌株的发酵液,同时放入80 ℃水浴锅恒温水浴10 min杀死活菌后,以3 000 r/min离心10 min,取上清液分别放在 60、70、80和90 ℃不同温度的水浴锅中加热10 min,冷却至室温后,梯度稀释进行菌落计数,按照公式(3)计算其存活率:
存活率/%=NT/No×100
(3)
式中:NT,用不同温度处理的活菌数;No,37 ℃处理的活菌数(对照)。
1.4.7.2 耐模拟胃肠液能力的测定[27]
耐模拟胃肠液实验:以5%的接种量将刚活化好的高产菌株种子液,分别接入现配的50 mL模拟胃液和肠液中,在37 ℃,150 r/min摇床中振荡培养,分时间段于0、1、2、3 h取出发酵液,模拟胃液、肠液梯度稀释并涂布,进行菌落计数,以0 h为对照,按照公式(4)计算每个时间段的存活率:
存活率/%=Nt/No×100
(4)
式中:Nt,不同时间段的活菌数;No,0 h的活菌数,对照。
1.4.7.3 表面凝集性
表面凝集性按照文献[28]进行。菌体凝集性C按公式(5)计算:
(5)
式中:Ai,菌悬液初始吸光度;At,菌悬液静置后吸光度。
1.4.7.4 表面疏水性
采用碳烃化合物法[28]。
1.4.7.5 对胆固醇、甘油三酯的降解特性
按照李文等[29]的胆固醇、甘油三酯降解率测定方法进行。
1.4.7.6 抑菌特性分析
将指示菌金黄色葡萄球菌、大肠杆菌、鼠伤寒沙门氏菌分别接种到LB液体培养基中,37 ℃、120 r/min培养12 h,使其达到对数生长期后备用。采用牛津杯法,测定枯草芽孢杆菌UL-191发酵液的抑菌活性。将3 种指示菌分别用LB半固体培养基稀释至浓度为106~107CFU/mL,倒平板。凝固后,把灭过菌的牛津杯放在琼脂表面上。设置2组样品:(1)枯草芽孢杆菌发酵上清液;(2)空白培养基。以上2组样液均用无菌微孔0.22 μm滤膜除菌,分别吸取200 μL加到牛津杯中,37 ℃恒温培养24 h后,观察并测量抑菌圈直径。
1.4.8 统计分析
所有实验数据均是3 次重复结果的平均值,数据以x±s表示,利用SPSS 16.0对数据进行统计分析,采用Duncan’s ANOVA进行多重比较,P<0.05,差异显著;P<0.01,差异极显著。
2 结果与分析
2.1 高产中性蛋白酶菌株的诱变选育
在最佳紫外线照射时间240 s,LiCl最佳浓度2.1%条件下,对出发菌株WT进行紫外、LiCl和紫外-LiCl多轮诱变,通过脱脂奶粉水解圈H/C比值初筛,液态发酵后测定中性蛋白酶酶活力复筛,筛选出高产中性蛋白酶菌株15株,其酶活力测定结果如图1 所示。
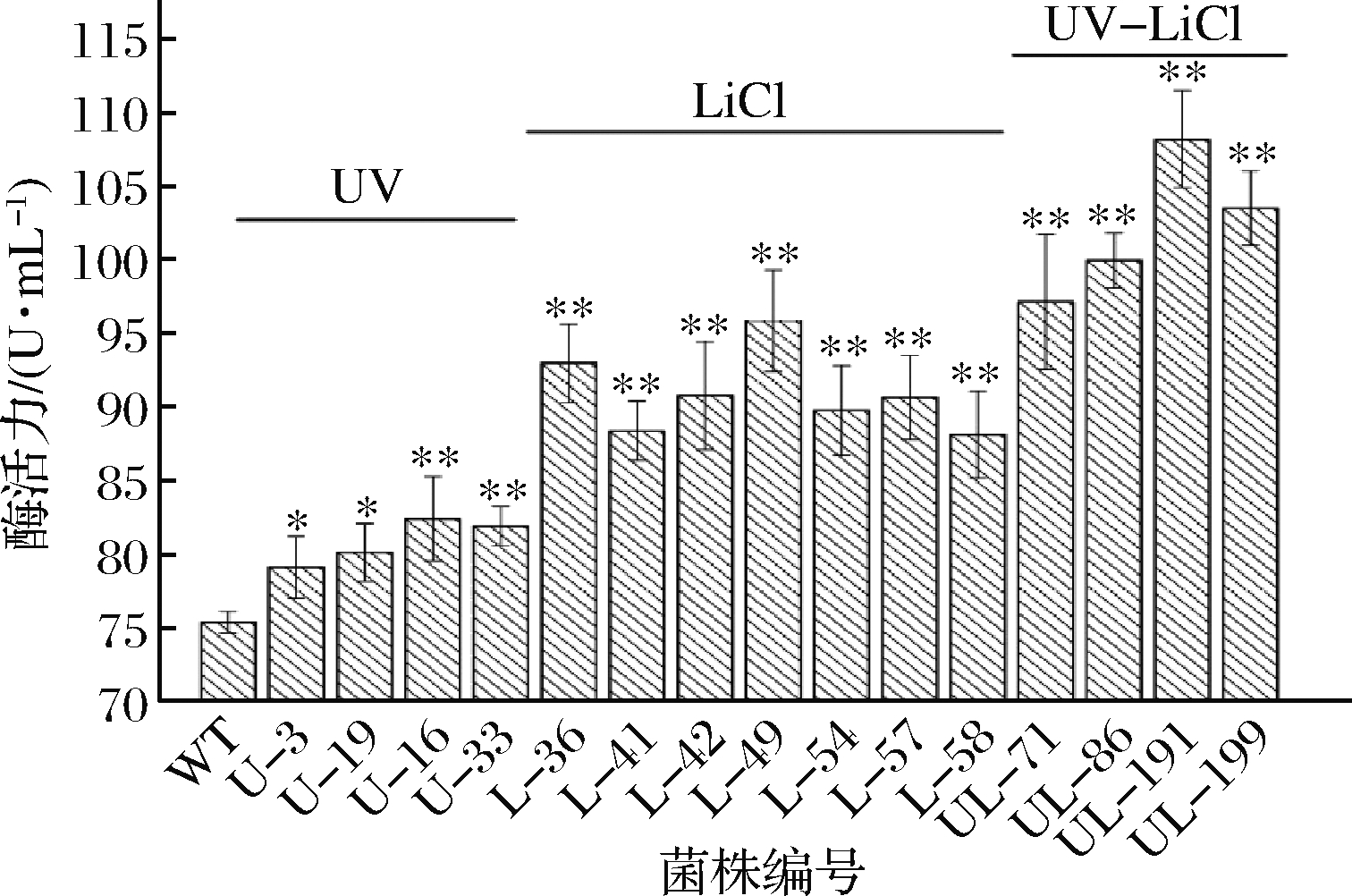
图1 诱变菌株在发酵培养基中产中性蛋白酶的筛选结果
Fig.1 The screening results of neutral protease by mutant strains treated with UV,LiCl and UV-LiCl 注:*表示与出发菌株WT相比有显著差异(P<0.05), **表示与出发菌株WT相比有极显著差异(P<0.01)
由图1可知,经过第1轮紫外诱变,获得了4 株中性蛋白酶酶活力显著高于出发菌株WT(P<0.05)的突变株,其中产中性蛋白酶能力最强的菌株为U-16,酶活力为82.280 U/mL,比出发菌株酶活力提高了9.6%。因此,把菌株U-16作为第2轮LiCl诱变的起始菌株。在LiCl诱变菌株中,筛选得到7株中性蛋白酶酶活力极显著高于出发菌株WT(P<0.01)的突变株,其中L-49酶活力最高为95.612 U/mL,比出发菌株酶活力提高了17.2%。以L-49作为紫外-LiCl复合诱变的出发菌株,复合诱变菌株中,选育得到4株中性蛋白酶酶活力显著高于紫外、LiCl诱变得到的突变菌株,其中UL-191酶活力最高,为108.812 U/mL,较菌株L-49提高了13.1%,与起始菌株WT相比提高了44.2%。
2.2 遗传稳定性
将复合诱变所得中性蛋白酶产量最高的突变株 UL-191连续传代10次,测定每一代中性蛋白酶酶活力,结果如图2,每代菌株的蛋白酶活力间无显著性差异(P>0.05),即传代次数对中性蛋白酶酶活力无显著影响,说明该高产菌株具有较好的遗传稳定性。
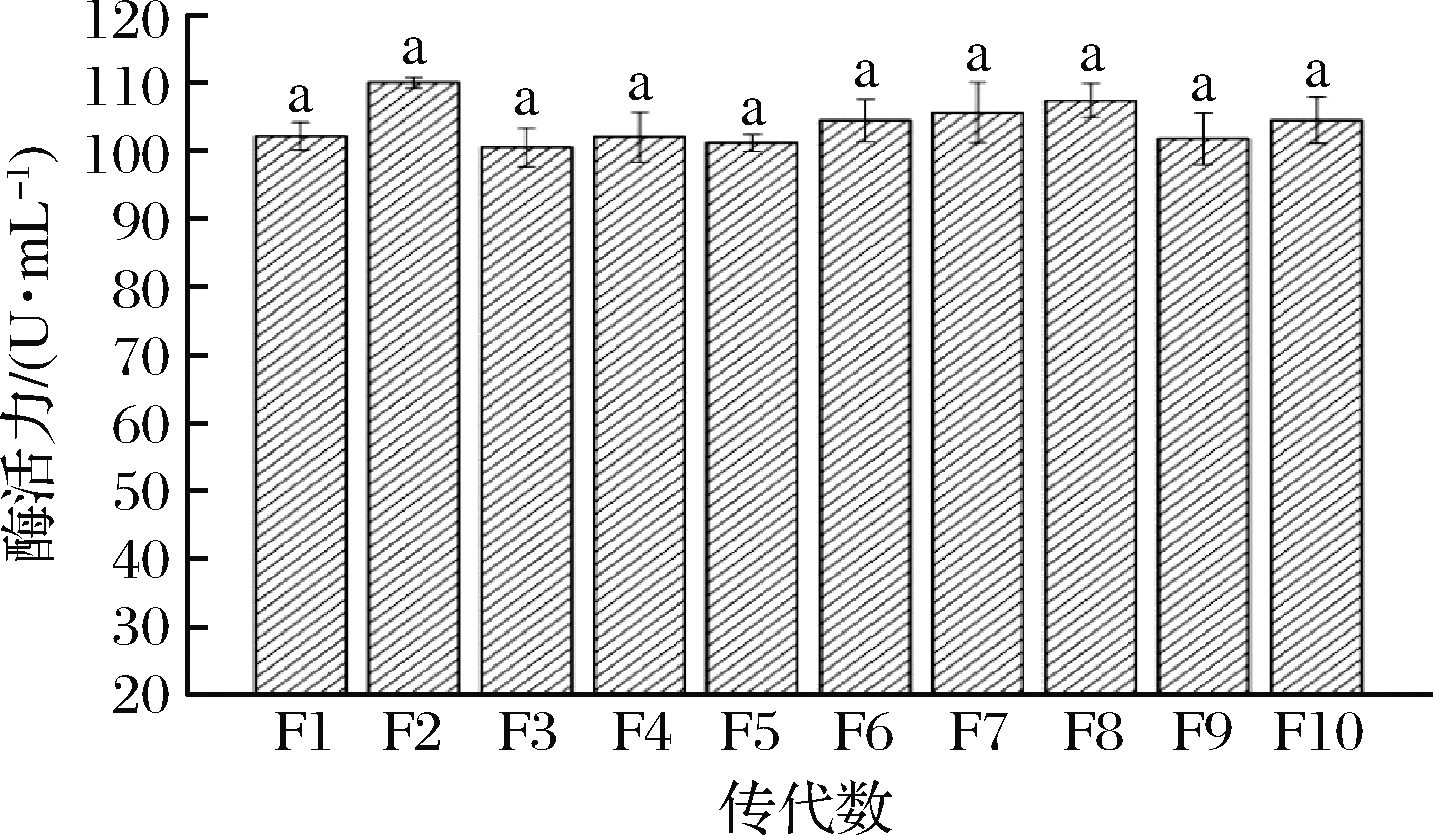
图2 突变株 UL-191 遗传稳定性
Fig.2 Genetic stability of mutant strain UL-191 注:不同小写字母表示差异显著(P<0.05)
2.3 菌株的耐热性
益生菌制剂在制料过程中需要承受一定高温,因此枯草芽孢杆菌想要作为微生态制剂就需要对高温有一定耐受性。将菌株UL-191菌悬液于60、70、80和90 ℃ 这4种不同温度的水浴锅中放置10 min,以未处理作为对照,计算存活率,结果如图3所示。
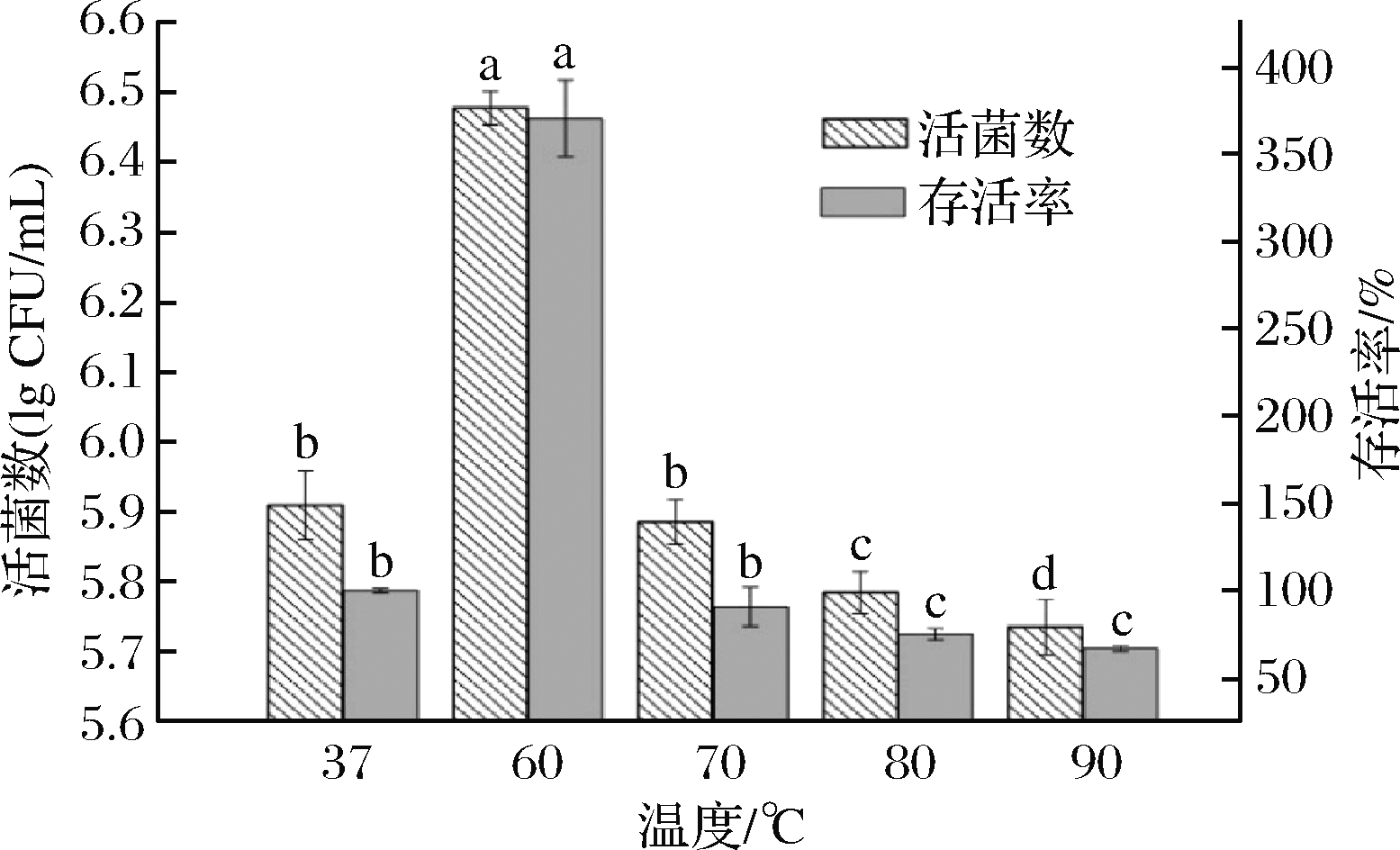
图3 温度对菌株活菌数和存活率的影响
Fig.3 Effect of temperature on viable count and survival rate of the strain 注:相同柱形上不同小写字母表示差异显著(P<0.05)(下同)
由图3可知,以37 ℃菌株的存活率为100%,菌株经60 ℃处理过后的芽孢存活率极高,高达368%,活菌数可达6.48 lg CFU/mL,因为芽孢在60 ℃会有一个复苏期。经70、80和90 ℃处理的芽孢存活率都低于100%,并随温度升高存活率有所下降。菌株经70 ℃处理后的存活率为90.79%,活菌数为5.74 lg CFU/mL;80 ℃以后,随着温度继续升高,存活率变化不显著(P>0.05)。总体来说,菌株UL-191具有较好的耐热性。
2.4 菌株的耐模拟胃肠液能力
食入的益生菌都要经过胃、肠,当食团进入胃时,胃液pH会降至2~3,过低的pH会使微生物在胃液中不能存活,胆盐对微生物生长繁殖具有明显抑制作用,只有在较高胆盐含量中保持活力并能够繁殖的菌株才能抵抗住肠道消化作用而存活[30]。因此本实验配制模拟胃液和肠液,并分别探究菌株UL-191在其中培养0、1、2、3 h的活菌总数及存活率,结果如图4所示。

a-模拟胃液;b-模拟肠液
图4 模拟胃肠液对菌株活菌数和存活率的影响
Fig.4 Effect of simulated gastric and intestinal fluid on viable count and survival rate of the strain
由图4可知,随着时间的延长,UL-191的存活率呈现下降趋势,经过模拟胃液作用3 h后活菌数略有下降,但存活率仍都能保持在78.23%以上,活菌数由7.31 lg CFU/mL降至7.20 lg CFU/mL。随着在模拟肠液中培养时间的延长,存活率也呈逐渐下降的趋势,经过模拟肠液作用3 h后,存活率降至60.00%,活菌数由6.49 lg CFU/mL降至6.27 lg CFU/mL。菌株在模拟胃肠液中存活率均在60%以上,表明该菌株对模拟胃液和肠液都具有良好的耐受性。
2.5 菌株的表面性质
菌株能否在肠道中发挥益生作用,关键在于能否在肠道中吸附定植,如果能被轻易冲掉,那么菌株的益生作用就表现得微乎其微,因此菌株表面特性十分重要。益生菌能够发挥作用的前提是确保菌株能够通过黏附作用定植于消化道内。通过测量菌株的表面疏水性和凝集特性来评估菌株的表面特性,突变株 UL-191的表面凝集性为69.38%,以二甲苯作为有机溶剂时,其表面疏水性为46.02%,以正己烷作为有机溶剂时,其表面疏水性为31.41%,能够较好地定植于消化道表面并进行生长繁殖,发挥益生作用。
2.6 菌株的降脂能力
甘油三酯是动物的主要能量来源,为身体提供能量。过量摄入甜食和主食会导致甘油三酯含量增加。胆固醇主要用于合成细胞,包括性腺激素在内的许多激素,也依赖胆固醇来合成。同时,胆固醇也能促进胆汁酸的消化,但如果血清中胆固醇过多,很容易积聚在血管壁上,长时间会形成斑块,更有甚者会导致血栓,危及生命。枯草芽孢杆菌能否作为全面有效的益生菌制剂,其降脂能力也十分重要。将UL-191在胆固醇培养基和甘油三酯培养基中培养,并测其在0和48 h发酵液中胆固醇和甘油三酯浓度,其结果如表1所示。
表1 降胆固醇、甘油三酯能力 单位:mmol/L
Table 1 Degradation of cholesterol and triglyceride by the strain UL-191

发酵时间/h胆固醇浓度甘油三酯浓度00.77±0.08a4.28±0.21a480.50±0.09b2.18±0.19b
注:同列不同小写字母表示差异显著(P<0.05)
0 h时,胆固醇、甘油三酯浓度分别为0.77、4.28 mmol/L;经枯草芽孢杆菌UL-191发酵48 h后,浓度分别降为0.50、2.18 mmol/L,降解率分别为35.00%和49.12%。由此可见,此菌株具备降解这2种物质的能力。
2.7 菌株的抑菌活性
通过研究突变菌株UL-191对金黄色葡萄球菌、大肠杆菌、鼠伤寒沙门氏菌的抑制作用所形成的抑菌圈直径大小来评估益生菌对体内致病菌感染的预防和抑制能力。突变菌株UL-191发酵上清液加入到以金黄色葡萄球菌、大肠杆菌和沙门氏菌为指示菌的LB半固体培养基上,以空白培养基作对照,实验结果如表2所示。突变菌株UL-191发酵上清液的抑菌圈直径均大于14.00 mm,说明菌株对3 种致病菌具有较好的抑制作用,菌株对金黄色葡萄球菌抑制效果最为明显,抑菌圈直径为23.40 mm,其次为鼠伤寒沙门氏菌,抑菌圈直径为17.52 mm,对大肠杆菌也有一定的抑制作用,抑菌圈直径为14.90 mm。
表2 菌株对致病菌的抑菌活性
Table 2 Inhibitory activities of the strain UL-191 against various pathogens

样品抑菌圈直径/mm金黄色葡萄球菌大肠杆菌鼠伤寒沙门氏菌发酵上清液23.40±1.12a14.90±0.29b17.52±0.54c空白培养基---
注:同行不同小写字母表示差异显著(P<0.05);-表示没有抑菌圈
3 结论与讨论
枯草芽孢杆菌所产中性蛋白酶已经被广泛应用于食品、酿造、医药等行业。紫外线作为一种简便、快捷的诱变方法,已被用于高产蛋白酶枯草芽孢杆菌的选育[13-14]。相比单一诱变方法,复合诱变能显著改善菌株对诱变剂的敏感程度,提高正突变率。本实验以野生型中性蛋白酶产生菌枯草芽孢杆菌WT为出发菌株,通过紫外、LiCl和紫外-LiCl多轮复合诱变,以不溶性脱脂奶粉筛选平板进行初筛,水解圈直径H与菌落直径C比值大小作为筛选标准,以液体发酵培养进行复筛,最终选育出高产中性蛋白酶枯草芽孢杆菌突变菌株15株,其中UL-191产中性蛋白酶酶活力最高,高达108.812 U/mL,较原始菌株WT提高了44.2%,比单独紫外、LiCl诱变分别提高了32.3%、13.1%,也高于王晓云等[14]紫外诱变选育得到的枯草芽孢杆菌的蛋白酶酶活力(86.82 U/mL)。经过10代斜面传代后,该菌株表现出良好的遗传稳定性。由此可见,紫外-LiCl复合诱变可发挥紫外与LiCl的协调诱变效应,显著提高了正突变率,明显好于单一诱变剂的诱变效果。
当动物摄入益生菌或益生菌产品后,益生菌本身需要克服体内环境影响才能发挥其正常的益生效果。动物胃中含有胃酸,肠液中含有胆盐,想让益生菌在动物体内发挥作用,就必须保证其在到达肠胃的过程中不被动物体内的胃酸和胆盐致死[9]。本研究通过模拟胃肠液环境,突变菌株枯草芽孢杆菌UL-191连续在模拟胃、肠液中培养3 h后,其存活率分别在78.23%、60.00%以上,说明菌株对模拟胃肠液具有良好的耐受性,能以较高的存活率通过胃肠道。枯草芽孢杆菌要发挥其益生作用,必须先定植在细胞上,经测定,枯草芽孢杆菌UL-191表面凝集性为69.38%,以二甲苯作为有机溶剂时,其表面疏水性为46.02%,以正己烷作为有机溶剂时,其表面疏水性为31.41%,UL-191能够较好地定植于消化道表面并进行生长繁殖,发挥益生作用。影响益生菌表面疏水性与凝集性的因素较多,不同菌株间存在一定差异。UL-191显示出对3种肠道致病菌(金黄色葡萄球菌、大肠杆菌、鼠伤寒沙门氏菌)有较好的抑制能力,对胆固醇和甘油三酯都有良好的降解能力,分别达到35.00%、49.12%,说明菌株具备降解这2种物质的能力。综上所述,枯草芽孢杆菌UL-191具备高产中性蛋白酶的能力,同时又兼具较好的益生特性,因此,该菌株在食品、饲料等行业中具备一定的应用潜力。
[1] 朱明军, 区健发,陈鸿图.中性蛋白酶高产菌株的诱变选育[J].现代食品科技,2013,29(11):2 686-2 691.
ZHU M J,OU J F,CHEN H T.Mutation and screening of neutral protease high-yield strain[J].Modern Food Science and Technology,2013,29(11):2 686-2 691.
[2] QUEIROGA A C,PINTADO M E,MALCATA F X.Search for novel proteolytic enzymes aimed at textile and agro-industrial applications:An overview of current and novel approaches[J].Biocatalysis and Biotransformation,2012,30(1):154-169.
[3] 刘颖, 张彬彬,孙冰玉,等.枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J].食品科学,2014,35(13):166-170.
LIU Y,ZHANG B B,SUN B Y,et al.Optimization of fermentation conditions for production of neutral protease by Bacillus subtilis 10075[J].Food Science,2014,35(13):166-170.
[4] 孙晓鸣, 王萍,邬向东.产中性蛋白酶芽孢杆菌配伍发酵响应面法研究[J].中国食品学报,2010,10(2):117-124.
SUN X M,WANG P,WU X D.Study on fermentation conditions of neutral protease from Bacillus compatibility by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology,2010,10(2):117-124.
[5] KASANA R C,SALWAN R,YADAV S K.Microbial proteases:Detection,production,and genetic improvement[J].Critical Reviews in Microbiology,2011,37(3):262-276.
[6] CAGGIA C,DE ANGELIS M,PITINO I,et al.Probiotic features of Lactobacillus strains isolated from Ragusano and Pecorino Siciliano cheeses[J].Food Microbiology,2015,50:109-117.
[7] 李军训, 罗学刚,高洁,等.益生菌的分类、生理功能与有效性评价研究进展[J].中国农业科技导报,2010,12(6):49-55.
LI J X,LUO X G,GAO J,et al.Research progress on classification,physiological function and validity evaluation of probiotics[J].Journal of Agricultural Science and Technology,2010,12(6):49-55.
[8] 赵天惠, 张佰清.耐受性枯草芽孢杆菌的脉冲强光诱变筛选及产酶活力分析[J].食品科学,2018,39(2):192-197.
ZHAO T H,ZHANG B Q.Pulsed light mutagenesis and screening of Bacillus subtilis for improved tolerance and extracellular enzymatic activities of screened mutants[J].Food Science,2018,39(2):192-197.
[9] KIERS J L,VAN LAEKEN A E,ROMBOUTS F M,et al.In vitro digestibility of Bacillus fermented soya bean[J].International Journal of Food Microbiology,2000,60(2-3):163-169.
[10] 卢超, 陈景鲜,王国霞,等.枯草芽孢杆菌L07产中性蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(16):148-153.
LU C,CHEN J X,WANG G X,et al.Optimization of fermentation conditions for the production of neutral protease by Bacillus subtilis L07[J].Food and Fermentation Industries,2020,46(16):148-153.
[11] 严美婷, 李海闽,张超凤,等.四特酒大曲中枯草芽孢杆菌的益生特性研究[J].2016(3):57-60.
YAN M T,LI H M,ZHANG C F,et al.Study on probiotic properties of Bacillus subtilis isolated from site-flavor Daqu[J].Liquor-Making Science & Technology,2016(3):57-60.
[12] 汪海峰, 王井亮,王翀,等.一株肠源枯草芽孢杆菌的生长、抗逆和产酶特性分析[J].中国畜牧杂志,2012,48(17):66-70.
WANG H F,WANG J L,WANG C,et al.Research on growth property,resistance characteristics and enzyme activity of intestinal Bacillus subtilis[J].Chinese Journal of Animal Science,2012,48(17):66-70.
[13] 牛春华, 高岩,李玉秋,等.紫外诱变选育高产蛋白酶枯草芽孢杆菌[J].中国酿造,2011,30(12):67-69.
NIU C H,GAO Y,LI Y Q,et al.Selection of high protease-producing strain of Bacillus subtilis by UV mutation[J].China Brewing,2011,30(12):67-69.
[14] 王晓云, 王慧,赵燕,等.紫外诱变选育高活性蛋白酶枯草芽孢杆菌及其降解饲料能力评价[J].中国水产科学,2016,23(6):1 351-1 357.
WANG X Y,WANG H,ZHAO Y,et al.UV-mutated breeding of Bacillus subtilis strain with high protease activity and evaluation of its substrate degradation ability[J].Journal of Fishery Sciences of China,2016,23(6):1 351-1 357.
[15] 董玉玮, 曹泽虹,苗敬芝,等.氯化锂诱变赤灵芝原生质体选育高锗菌株的研究[J].食品科技,2011,36(1):18-22.
DONG Y W,CAO Z H,MIAO J Z,et al.Research on breeding of high germanium yield strains of Ganoderma lucidum by lithium chloride mutagenesis[J].Food Science and Technology,2011,36(1):18-22.
[16] 王陶, 储渊明,陈宏伟,等.氯化锂诱变蛹虫草菌株液体发酵富集微量元素锌[J].食品科学,2017,38(6):74-80.
WANG T,CHU Y M,CHEN H W,et al.Zinc enrichment of Cordyceps militaris cultured in liquid medium:Optimization of medium components and culture conditions and strain improvement by LiCl mutagenesis[J].Food Science,2017,38(6):74-80.
[17] 王陶, 谢平进,董玉玮,等.氯化锂诱变选育3-羟基丙酸高产菌株[J].工业微生物,2017,47(2):1-6.
WANG T,XIE P J,DONG Y W,et al.Breeding of 3-hydroxypropnic acid high-producing strain by lithium chloride mutagenesis[J].Industrial Microbiology,2017,47(2):1-6.
[18] 李文, 王陶,李同祥.氯化锂诱变黑曲霉原生质体选育高产植酸酶菌株[J].食品与发酵工业,2012,38(2):69-73.
LI W,WANG T,LI T X.Breeding of phytase high-producing Aspergillus niger using protoplasts by lithium chloride mutagenesis[J].Food and Fermentation Industries,2012,38(2):69-73.
[19] 张克旭. 代谢控制发酵[M].北京:中国轻工业出版社,2007.
ZHANG K X.Metabolism controlled fermentation[M].Beijing:China Light Industry Press,2007.
[20] 李文, 董明盛.发酵鹰嘴豆乳产γ-氨基丁酸乳酸菌的复合诱变选育[J].食品科学,2018,39(16):147-153.
LI W,DONG M S.Improving γ-aminobutyric acid production of lactic acid bacteria in chickpea milk by compound mutagenesis[J].Food Science,2018,39(16):147-153.
[21] 游玟娟, 冯刚利.紫外线与亚硝酸复合诱变选育中性蛋白酶高产菌株[J].食品科技,2010,35(10):23-26.
YOU M J,FENG G L.Screening of high neutral protease producing strains with compound mutagenesis by UV and HNO2[J].Food Science and Technology,2010,35(10):23-26.
[22] 张莹, 郭琛琛,黑东燕,等.复合诱变法选育谷氨酰胺转胺酶高产菌株[J].食品科学,2014,35(11):139-142.
ZHANG Y,GUO C C,HEI D Y,et al.Screening and characterization of high-yield microbial transglutaminase-producing mutants induced by a novel method[J].Food Science,2014,35(11):139-142.
[23] 樊陈, 王茂广,高兆建,等.产低温弹性蛋白酶菌株的高效诱变及酶学特性[J].食品科学,2013,34(19):190-194.
FAN C,WANG M G,GAO Z J,et al.Highly efficient mutation of Bacillus brevis to obtain cold-active elastase-producing strain and enzymatic characterization[J].Food Science,2013,34(19):190-194.
[24] 王陶,李文,尹龙,等.紫外-氯化锂复合诱变选育中性植酸酶高产菌株[J].食品科学,2012,33(13):217-220.
WANG T,LI W,YIN L,et al.Mutation breeding of neutral phytase-producing strain using both UV light and lithium chloride[J].Food Science,2012,33(13):217-220.
[25] 虞龙, 张宇,龚文静,等.氯化锂-紫外-离子束复合诱变红霉素高产菌株研究[J].原子能科学技术,2011,45(7):780-784.
YU L,ZHANG Y,GONG W J,et al.Screening of erythromycin high-yielding strain by compound mutation of LiCl,UV and ion beam[J].Atomic Energy Science and Technology,2011,45(7):780-784.
[26] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.蛋白酶制剂:GB/T 23527—2009[S].北京:中国标准出版社,2009.
State Administration of technology supervision of the people’s Republic of China.GB/T 23527—2009 Protease preparation[S].Bei Jing:China Standards Press,2009.
[27] 陈明, 柯文灿,张娟,等.青藏高原牦牛酸奶中具有抗氧化活性乳酸菌的体内外益生特性[J].食品科学,2017,38(23):178-183.
CHEN M,KE W C,ZHANG J,et al.Probiotic properties in vitro and in vivo of antioxidative lactic acid bacteria from yak yogurt in Tibetan Plateau[J].Food Science,2017,38(23):178-183.
[28] 赵晴, 张甲耀,陈兰洲,等.疏水性石油烃降解菌细胞表面疏水性及降解特性[J].环境科学,2005,26(5):132-136.
ZHAO Q,ZHANG J Y,CHEN L Z,et al.Cell-surface hydrophobicity and degradation characteristics of hydrophobic hydrocarbon degrading bacteria[J].Chinese Journal of Environmental Science,2005,26(5):132-136.
[29] 李文, 陈银元,陈立明,等.两株魏斯氏菌的益生特性比较[J].食品与发酵工业,2019,45(15):37-43.
LI W,CHEN Y Y,CHEN L M,et al.Comparative analysis of probiotic properties of two Weissella strains[J].Food and Fermentation Industries,2019,45(15):37-43.
[30] 杨颖,田丰伟,陈卫,等.两株乳杆菌益生特性的体外研究[J].中国乳品工业,2006,34(6):16-19.
YANG Y,TIAN F W,CHEN W,et al.In vitro study of two Lactobacillus strains as potential probiotics[J].China Dairy Industry,2006,34(6):16-19.