α-乳白蛋白(bovine α-lactalbumin,BLA)是一种钙离子结合蛋白[1],具有独特的氨基酸序列和很高的营养价值,同时也是婴儿配方奶粉中的一种重要的组成成分[2],但BLA潜在的致敏性,使得其在乳制品中的应用具有一定的局限性。
目前,国内外在脱减BLA致敏方面做了大量研究,包括化学修饰(糖基化、磷酸化、乙酰化等)、非热加工、酶解和发酵等技术[3]。其中,糖基化和磷酸化等化学修饰技术通过破坏BLA的过敏表位,降低其致敏性[4]。糖基化修饰常发生在赖氨酸和精氨酸中,磷酸化修饰位点常见于酪氨酸、丝氨酸和苏氨酸[5];乙酰化修饰发生在蛋白质的丝氨酸和苏氨酸上[6]。此外,相关研究表明人过敏与肠道微生物组成有关。动物模型中的共生微生物群会导致肠黏膜远端部位的全身性自身免疫性疾病和过敏性疾病[7];患有特应性皮炎和食物过敏的婴儿中的肠道菌群多样性较低[8];健康的婴儿体内含有防止食物过敏的肠道细菌[9];牛奶过敏的新生儿连续6个月摄入添加鼠李糖乳杆菌配方的奶粉会显著增加新生儿肠道菌群的多样性,同时提高参与新生儿短链脂肪酸代谢的菌群数量,缓解其过敏症状[10]。由此可见,过敏性疾病的发生与肠道内微生物菌群结构有着密不可分的关系,改善肠道微生态平衡可能会减少过敏反应的发生。
蛋白质修饰技术被广泛用于改善蛋白质的功能特性,但糖基化、磷酸化和乙酰化修饰的BLA在消化过程中对人肠道微生物的影响鲜有报道。故本论文通过电泳、荧光光谱、紫外光谱和间接ELISA法等研究糖基化,磷酸化和乙酰化修饰对BLA结构与IgE结合能力的影响规律,结合16S rRNA高通量测序技术评估修饰后的BLA对人肠道微生物的影响,以期为低致敏乳制品在人消化过程中的安全评估提供参考。
1 实验与材料
1.1 材料与试剂
半乳糖(galactose,Gal)、焦磷酸钠(sodium pyrophosphate,SP)、胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250),北京Solarbio公司;乙酸酐(acetic anhydride,AA),西陇化工股份有限公司;α-乳白蛋白,山羊抗人IgE-辣根过氧化物酶,美国Sigma公司;其余常用试剂均为分析纯。
1.2 仪器与设备
酶标仪(Synergy H1),美国伯腾仪器有限公司;荧光光谱仪(F-7000),紫外可见分光光度计(U-2910),HITACHI;厌氧培养箱(HYQX-II),上海跃进医疗器械有限公司;Mini-Protean电泳仪,美国Bio-Rad公司;冷冻离心机(5430R),德国艾本德公司;超滤离心管(3 kDa),美国Millipore公司。
1.3 实验方法
1.3.1 样品制备
参照LIU等[11]方法进行样品制备。首先用双重蒸馏水溶解BLA,使其质量浓度为1 mg/mL。将3 mg半乳糖和焦磷酸钠分别溶于3 mL BLA溶液中,搅拌混匀后冻干,在55 ℃和65%相对湿度中孵育3 h。孵育结束后在冰浴中停止反应,使用3 kDa的超滤离心管除去未反应的半乳糖和焦磷酸钠。随后进行乙酰化样品制备,用1 mol/L NaOH溶液将1 mg/mL BLA溶液调节pH为8,在37 ℃下缓慢加入2 mL乙酸酐,不断添加1 mol/L NaOH溶液将pH维持在8左右。待乙酰化反应结束后,用2 mol/L HCl溶液将反应溶液调pH至4,3 500 r/min离心10 min,收集沉淀。重复上述实验方法,同样采用3 kDa超滤离心管除去盐。天然的BLA命名为BLA,糖基化、磷酸化和乙酰化修饰的BLA分别命名为Gal_BLA、SP_BLA和AA_BLA。
1.3.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析
参照LIU等[4]方法,对BLA、Gal_BLA、SP_BLA和AA_BLA进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.3 游离氨基的测定
参照刘俊等[12]报道的方法稍加修改,采用邻苯二甲醛法对BLA、Gal_BLA、SP_BLA和AA_BLA中的游离氨基进行测定,按照公式(1)计算反应程度:
反应程度![]()
(1)
式中:ρ,BLA中游离氨基含量,mg/mL;ρ0,BLA与Gal、SP和AA结合成络合物的游离氨基含量,mg/mL。
1.3.4 内源荧光及紫外吸收强度测定
参照KIM等[13]的方法稍加修改,采用荧光光谱仪测定BLA、Gal_BLA、SP_BLA和AA_BLA的荧光强度。
采用U-2910紫外可见光光度计测定BLA、Gal_BLA、SP_BLA和AA_BLA的紫外吸收强度,测定方法如下:用蒸馏水将待测样品稀释至1 mg/mL,测定条件为:扫描发射波长范围为200~400 nm,扫描速度为1 200 nm/min。
1.3.5 间接ELISA分析
参照MA等[14]的方法且略作调整。采用间接ELISA来测定BLA、Gal_BLA、SP_BLA和AA_BLA的IgE结合能力。
1.3.6 模拟胃肠道消化
参照沙小梅等[15]报道的方法,将BLA、Gal_BLA、SP_BLA和AA_BLA进行体外模拟消化。
1.3.7 微生物厌氧培养
粪便样本取自3名成人(18~22岁),没有任何已知的代谢或胃肠道疾病,且在研究前3个月未使用益生菌、益生元和抗生素。采集样品并保存在厌氧培养箱中,然后按照1∶5(g∶mL)的比例用磷酸盐缓冲液(0.1 mol/L,pH 7.4)进行稀释,并在均质器以正常速度均匀化1 min,均质完成后进行分装。最后将模拟体外胃肠道消化的BLA、Gal_BLA、SP_BLA和AA_BLA的样品添加到均质后的粪便中进行厌氧培养。所有添加、接种和培养均在厌氧培养箱48 h内进行[16]。
1.3.8 高通量测序及生物信息分析方法
厌氧培养完成后,离心收集粪便,冻存于-80 ℃,然后送至上海美吉生物医药科技有限公司提取DNA并测序。测序用引物为16S rRNA基因V4区通用引物:515F 5′-GTGCCAGCMGCCGCGGTAA-3′和806R 5′-GCACTACHVGGGTWTCTAAT-3′。
基于上海美吉生物医药科技有限公司旗下I-sanger生信云平台(http://www.isanger.com/index.html)进行所有的生物信息分析。
1.3.9 数据处理
采用SPSS 24.0软件对实验数据进行单因素方差分析,显著水平为P<0.05,所有数据作图均采用Origin 2019软件作图。
2 结果与分析
2.1 结构分析
2.1.1 SDS-PAGE
BLA修饰前后的SDS-PAGE如图1所示,与BLA的蛋白条带相比,Gal_BLA和SP_BLA的蛋白条带轻微上移,其中Gal_BLA向上迁移较为明显,而AA_BLA的蛋白条带消失。结果表明,BLA与半乳糖或焦磷酸钠之间产生了共价交联[17],形成了高分子质量物质,导致蛋白条带向上迁移。但在图1中没有看到AA_BLA的电泳条带,可能的原因是乙酰化反应破坏了BLA的结构构型,使其发生降解,无法观察到蛋白条带。
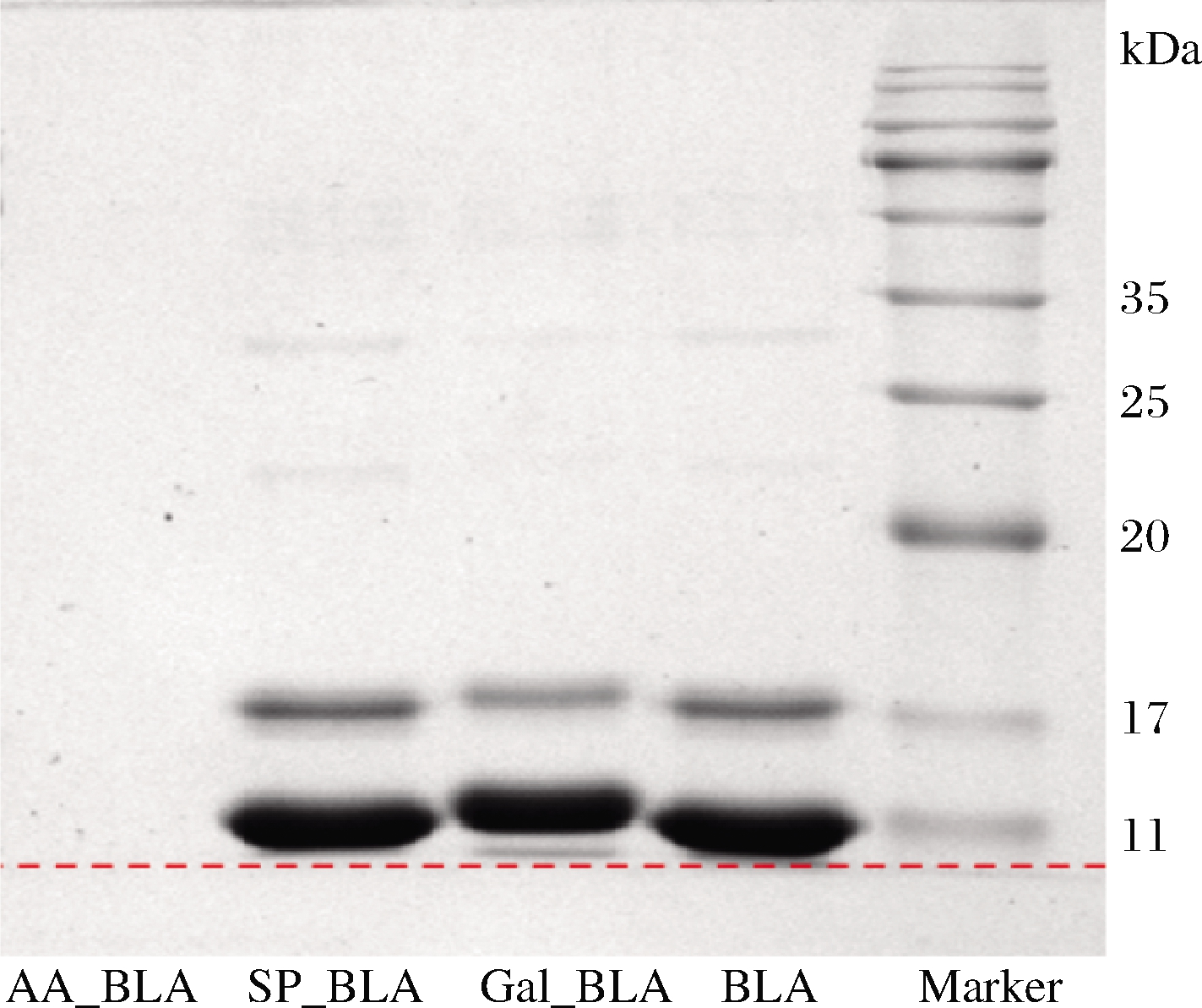
Marker-彩虹广谱蛋白(分子质量:11 k~180 kDa)
图1 BLA、Gal_BLA、SP_BLA和AA_BLA的SDS-PAGE
Fig.1 SDS-PAGE of BLA,Gal_BLA,SP_BLA and AA_BLA
2.1.2 游离氨基和反应程度
BLA、Gal_BLA、SP_BLA和AA_BLA的游离氨基含量和反应程度如表1所示。与BLA游离氨基含量相比,SP_BLA、Gal_BLA和AA_BLA的游离氨基含量逐渐降低,表明BLA发生糖基化、磷酸化和乙酰化反应。AA_BLA的游离氨基含量最低,其次是Gal_BLA和SP_BLA,这可能是由于BLA被磷酸化和糖基化修饰时,其修饰位点比乙酰化修饰位点少[11],故AA_BLA的游离氨基含量明显地比Gal_BLA与SP_BLA的游离氨基含量低。另外,与BLA的反应程度相比,SP_BLA、Gal_BLA和AA_BLA的反应程度逐渐增强,说明BLA发生磷酸化、糖基化和乙酰化的程度为:乙酰化>糖基化>磷酸化。
表1 BLA、Gal_BLA、SP_BLA和AA_BLA的游离 氨基含量和反应程度
Table 1 Free amino content and degree of reaction of BLA, Gal_BLA,SP_BLA and AA_BLA

样品游离氨基含量/(mg·mL-1)反应程度/%BLA0.086±0.003aGal_BLA0.039±0.004bc54.01±5.04abSP_BLA0.044±0.001b48.69±1.22aAA_BLA0.033±0.005c61.37±6.124b
注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.3 内源荧光及紫外吸收强度
BLA、Gal_BLA、SP_BLA和AA_BLA的内源荧光强度(a)和紫外吸收(b)的变化如图2所示。BLA中的芳香氨基酸,特别是色氨酸(Trp),是内源荧光光谱的基础[18]。由图2-a可以看出,当激发波长为280 nm时,BLA经磷酸化、糖基化和乙酰化修饰后荧光强度逐渐增强,可能原因是BLA经磷酸化、糖基化和乙酰化修饰后空间结构被破坏,破坏的程度为乙酰化>糖基化>磷酸化,使得原本包裹在BLA分子内部的色氨酸残基暴露于溶剂中[11],导致荧光强度的变化。与BLA、SP_BLA和Gal_BLA相比,AA_BLA内源荧光强度波动较大,最大发射峰出现了红移现象,该结果也说明乙酰化修饰比糖基化和磷酸化修饰更能显著地改变BLA的构象结构。
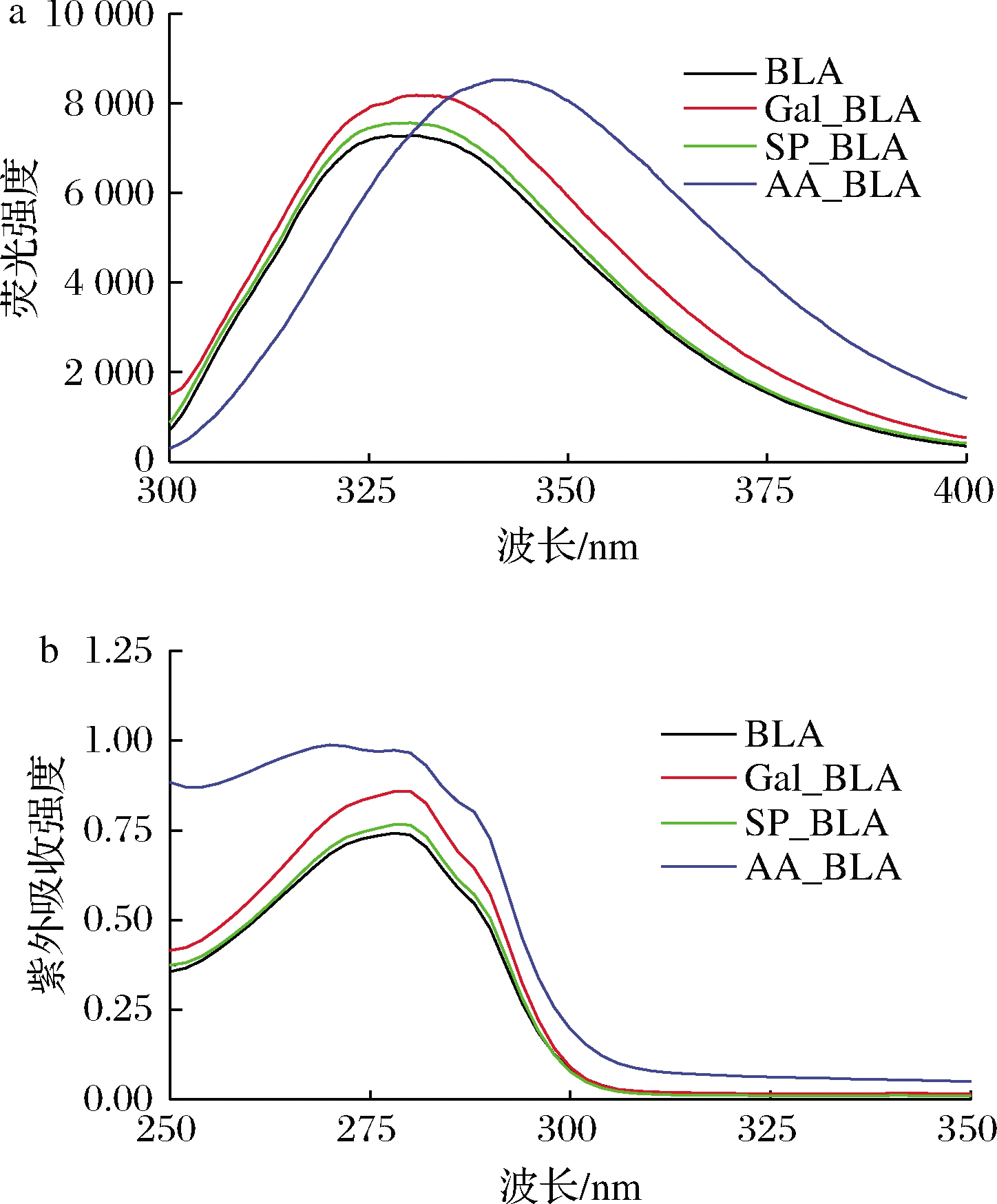
a-荧光强度;b-紫外吸收
图2 BLA、Gal_BLA、SP_BLA和AA_BLA的荧光强度 和紫外吸收
Fig.2 Fluorescence intensity and ultraviolet absorption of BLA,Gal_BLA,SP_BLA and AA_BLA
在紫外吸收光谱中,Trp和酪氨酸(Tyr)残基的共轭双键在280 nm波长处具有特征吸收峰,而苯丙氨酸(Phe)的特征吸收峰在257 nm左右[19]。由图2-b可以看出,BLA、Gal_BLA、SP_BLA和AA_BLA在280 nm处含有特征吸收峰,说明BLA、Gal_BLA、SP_BLA和AA_BLA的发色基团主要是Trp和Tyr。与BLA相比,SP_BLA、Gal_BLA和AA_BLA紫外吸收强度逐渐升高,AA_BLA紫外吸收强度波动最大,该趋势与内源荧光强度的结果一致。该结果说明乙酰化修饰能最显著地改变BLA的构象结构,其次是糖基化和磷酸化修饰。
2.2 特异性抗体IgE结合能力
图3为BLA、Gal_BLA、SP_BLA和AA_BLA与牛奶过敏患者血清的特异性IgE结合能力。由图3可知,BLA、Gal_BLA、SP_BLA和AA_BLA的IgE结合能力存在一定的差异。在1号血清样本中,经磷酸化、糖基化及乙酰化修饰BLA的OD值逐渐降低,但样品与样品之间的差异不明显(P>0.05);2号血清样本中的OD值变化趋势与1号血清样本变化趋势一致;在3号血清样本中,BLA与SP_BLA、Gal_BLA和AA_BLA的OD值有显著性差异(P>0.05),但Gal_BLA和AA_BLA之间没有显著差异;在4号血清样本中,BLA与SP_BLA的OD值无显著性差异(P>0.05),但与Gal_BLA和AA_BLA的OD值具有显著性差异(P<0.05),这是由于不同血清样本的IgE能力不同导致的差异性。总体来看,经过磷酸化、糖基化和乙酰化修饰后的BLA特异性IgE结合能力呈逐渐降低,下降的程度为SP_BLA
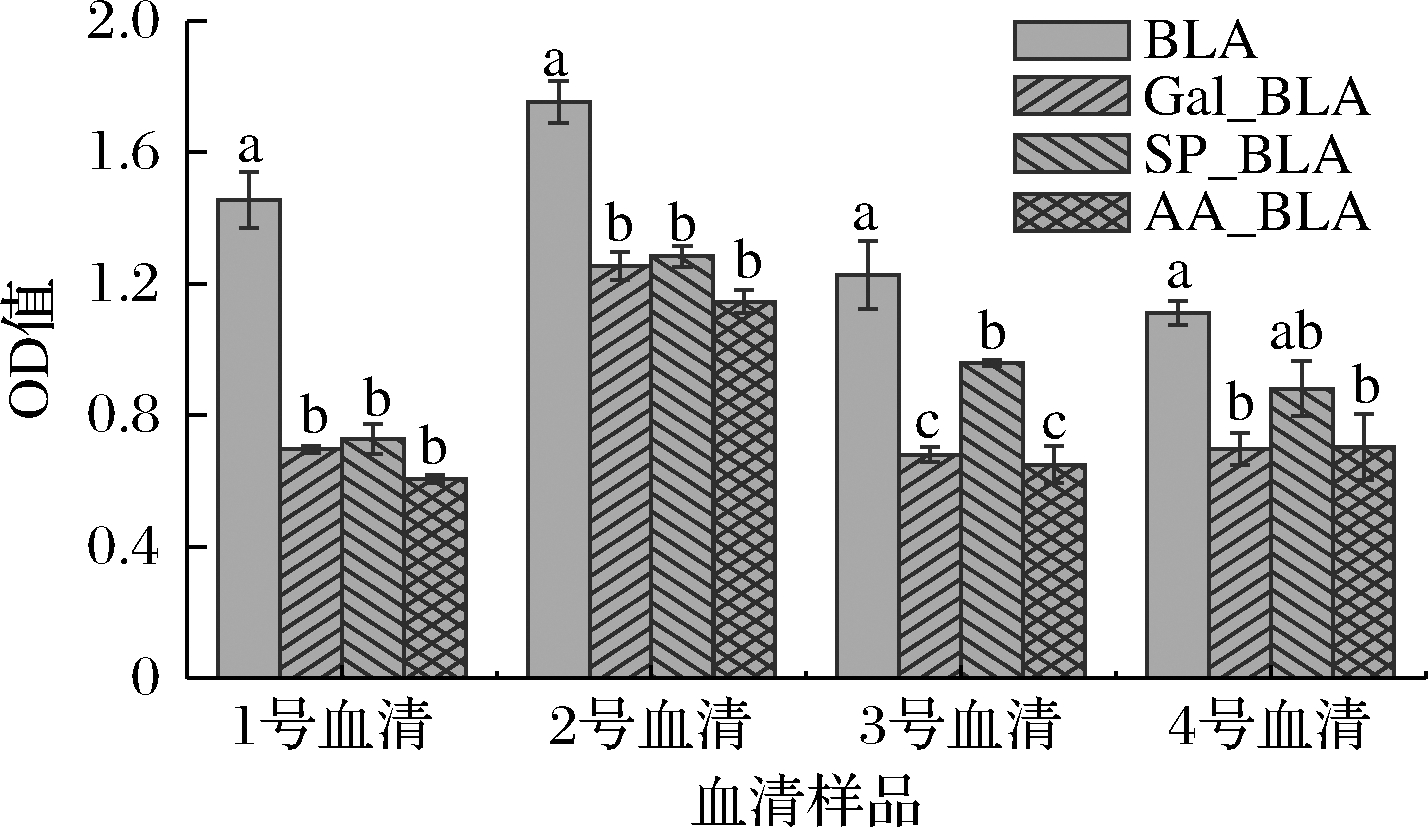
图3 BLA、Gal_BLA、SP_BLA和AA_BLA的IgE结合能力
Fig.3 IgE binding ability of BLA,Gal_BLA,SP_BLA and AA_BLA 注:1~4血清来自于Plasma Lab International(Everett,WA,U.S.A.)(下同)
2.3 高通量测序
2.3.1 测序质量
测序质量能反映出人肠道菌群的组成和种类的变化。利用测得的序列进行随机抽样,以抽到的序列数与它们所代表的操作分类单位(operational taxonomic unit,OTU)数量构建稀释曲线。如图4所示,随着所测序列数量的增加,各组样品的OTU数量也随之增大,但增大的幅度呈递减趋势,说明高通量测序质量较好,能准确地反映出在不同样品中人肠道菌群的组成和种类的变化,测序深度满足实验要求。
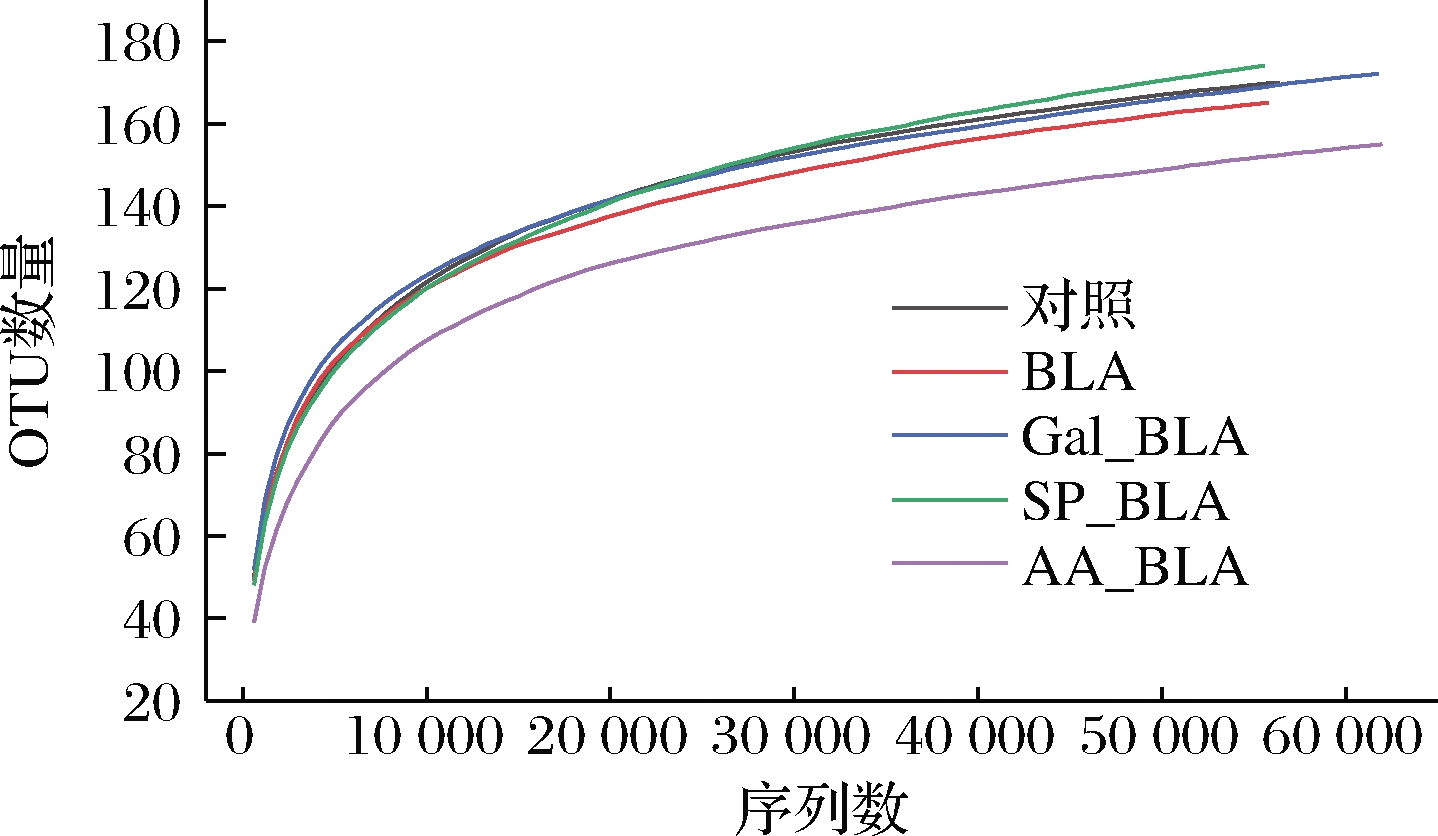
图4 高通量测序稀释曲线
Fig.4 Dilution curves of high throughput sequencing 注:对照为没有已知的代谢或胃肠道疾病的成人肠道菌群(下同)
2.3.2 肠道菌群Alpha多样性分析
根据图4中肠道微生物的OTU数量,对样品进行Alpha指数分析,结果如表2所示。每个样品的Coverage均达到了99.9%以上,说明肠道微生物群落Alpha多样性检测结果可靠[20]。与对照组和BLA中Chao指数值相比,Gal_BLA、SP_BLA和AA_BLA的指数值发生变化,表明糖基化、磷酸化和乙酰化修饰能够改变人肠道菌群丰富度。与对照组中Shannon指数值相比,Gal_BLA、SP_BLA和AA_BLA的Shannon指数值均降低,说明糖基化、磷酸化和乙酰化修饰能降低人肠道菌群的多样性。结合Chao指数、Shannon指数和Simpson指数结果可知,Gal_BLA、SP_BLA和AA_BLA经体外模拟人胃肠道消化后,其消化产物可影响人肠道微生物的群落丰富度和群落多样性。
表2 人肠道菌群Alpha多样性指数表
Table 2 Alpha diversity indexes of human intestinal microbiota

样品ShannonSimpsonChaoCoverage对照2.6330.129195.0000.999 52BLA2.2980.265182.1050.999 53Gal_BLA2.4550.190208.2500.999 51SP_BLA2.3000.244211.4000.999 39AA_BLA1.9740.258184.0800.999 55
2.3.3 肠道菌群结构和组成分析
BLA、Gal_BLA、SP_BLA和AA_BLA的肠道菌群在门水平与属水平的相对丰度如图5所示。由图5-a可知,机体中98%的肠道菌群是由拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、放线菌门(Actinobacterota)和变形菌门(Proteobacteria)组成。在对照组中,优势菌群以Bacteroidota和Firmicutes为主,其次是Actinobacterota和Proteobacteria。在BLA、Gal_BLA、SP_BLA和AA_BLA中,优势菌群与对照的优势菌群种类相同,该结果与李梦寒等[21]研究结果一致。与对照组中门水平的优势菌群相比,BLA显著增加了Bacteroidota的相对丰度,降低了Actinobacterota、Firmicutes和Proteobacteria的相对丰度。这表明由BLA诱导的人肠道菌群发生了显著变化,这些优势菌群的变化与食物过敏有关[22]。与BLA中Bacteroidota和Firmicutes相对丰度相比,SP_BLA、Gal_BLA和AA_BLA中Bacteroidota相对丰度逐渐降低,而Firmicutes相对丰度呈相反的趋势。Bacteroidota和Firmicutes相对丰度的变化与人过敏反应有关。这些结果表明糖基化、磷酸化和乙酰化修饰的BLA能够显著影响门水平上优势菌群的相对丰度,影响程度为乙酰化>糖基化>磷酸化。
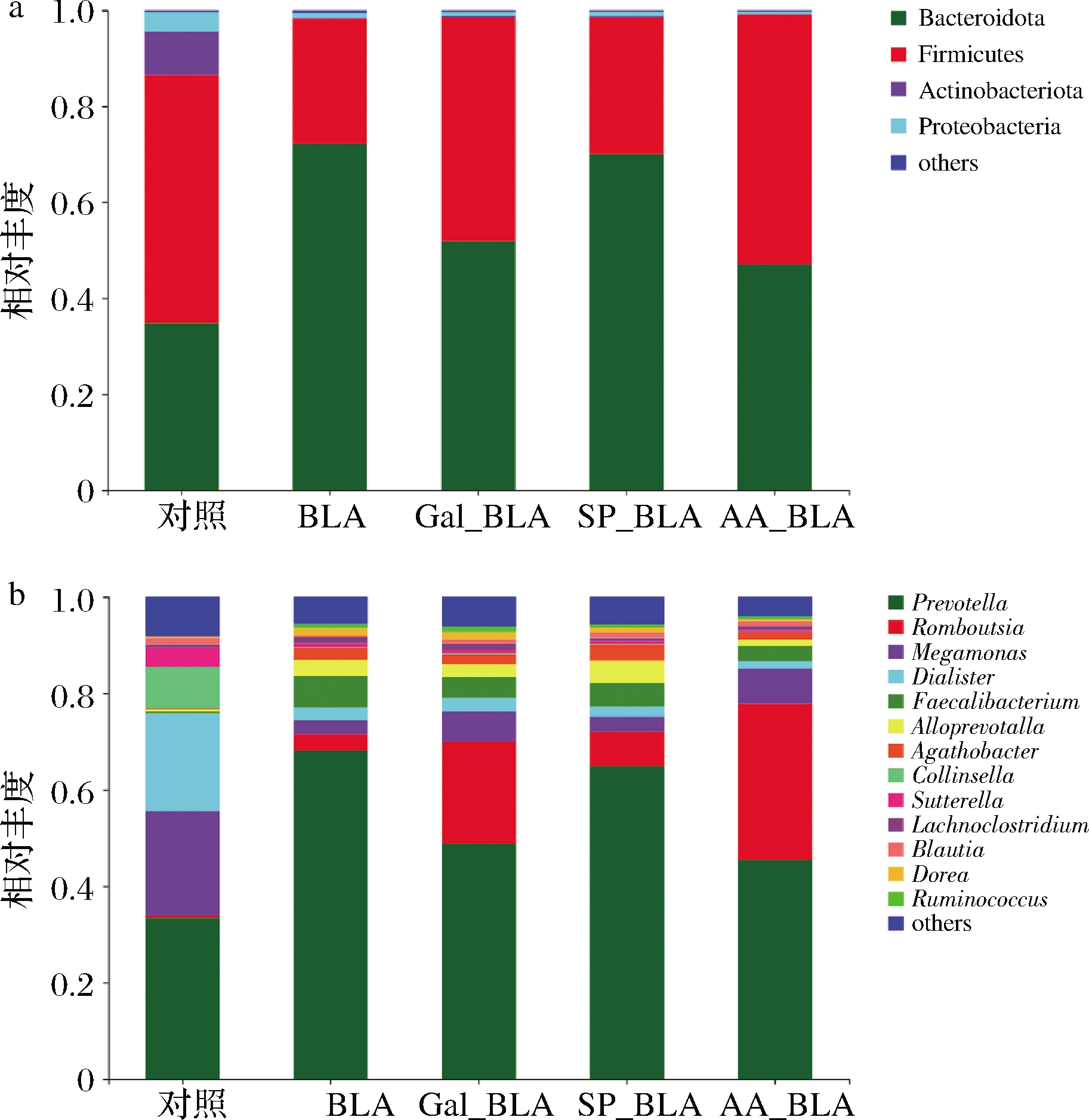
a-门水平;b-属水平
图5 人肠道菌群在门属水平上的相对丰度
Fig.5 Relative abundance of human intestinal microbiota at phylum and genus levels
肠道的优势菌属包括普雷沃氏菌属(Prevotella)、罗姆布茨菌属(Romboutsia)、粪杆菌属(Faecalibacterium)、巨单孢菌属(Megamonas)、杆菌属(Agathobacter)小杆菌属(Dialister)和柯林斯菌属(Colinsella)等。如图5-b所示,从整体肠道菌群的属水平结构来看,对照组中的优势菌属为Prevotella、Megamonas、Dialister和Colinsella,而BLA、Gal_BLA、SP_BLA和AA_BLA中优势菌属主要为Prevotella、Romboutsia、Megamonas和Faecalibacterium,说明BLA样品能够影响优势菌属的种类。与对照组的优势肠道菌属相比,BLA能增加Prevotella和Faecalibacterium的相对丰度,降低Megamonas、Dialister和Colinsella的相对丰度;与BLA中Faecalibacterium、Romboutsia、Megamonas和Prevotella的相对丰度相比,SP_BLA、Gal_BLA和AA_BLA中Prevotella和Faecalibacterium相对丰度逐渐降低,而Romboutsia和Megamonas的相对丰度呈相反的趋势,这些优势菌属的相对丰度的变化与降低BLA潜在的致敏性有关[23]。结果表明,BLA影响了人肠道优势菌属的生态平衡,而其经糖基化、磷酸化和乙酰化修饰后能够改善人肠道优势菌属的生态平衡。因此,糖基化、磷酸化和乙酰化修饰的BLA能够显著影响优势菌属的相对丰度,可在一定程度上缓解由BLA诱导的人肠道菌群改变,缓解程度为乙酰化>糖基化>磷酸化。
2.3.4 肠道菌群属水平热图分析
为分析各样品组肠道菌群之间的相似性和差异性,取前20种属水平上相对丰度高的肠道菌群进行群落组分相似度的聚类式热图统计分析[23]。如图6所示,BLA、Gal_BLA、SP_BLA和AA_BLA的主要优势菌属Prevotella的颜色深度与Control组的颜色深度相似,而Romboutsia、Megamonas的颜色深度存在明显差异;经糖基化、磷酸化和乙酰化修饰后的BLA优势菌属Romboutsia、Megamonas颜色深度高于BLA组,颜色深浅依次为AA_BLA>Gal_BLA>SP_BLA,表明糖基化、磷酸化和乙酰化修饰的BLA肠道优势菌属之间存在明显差异性。
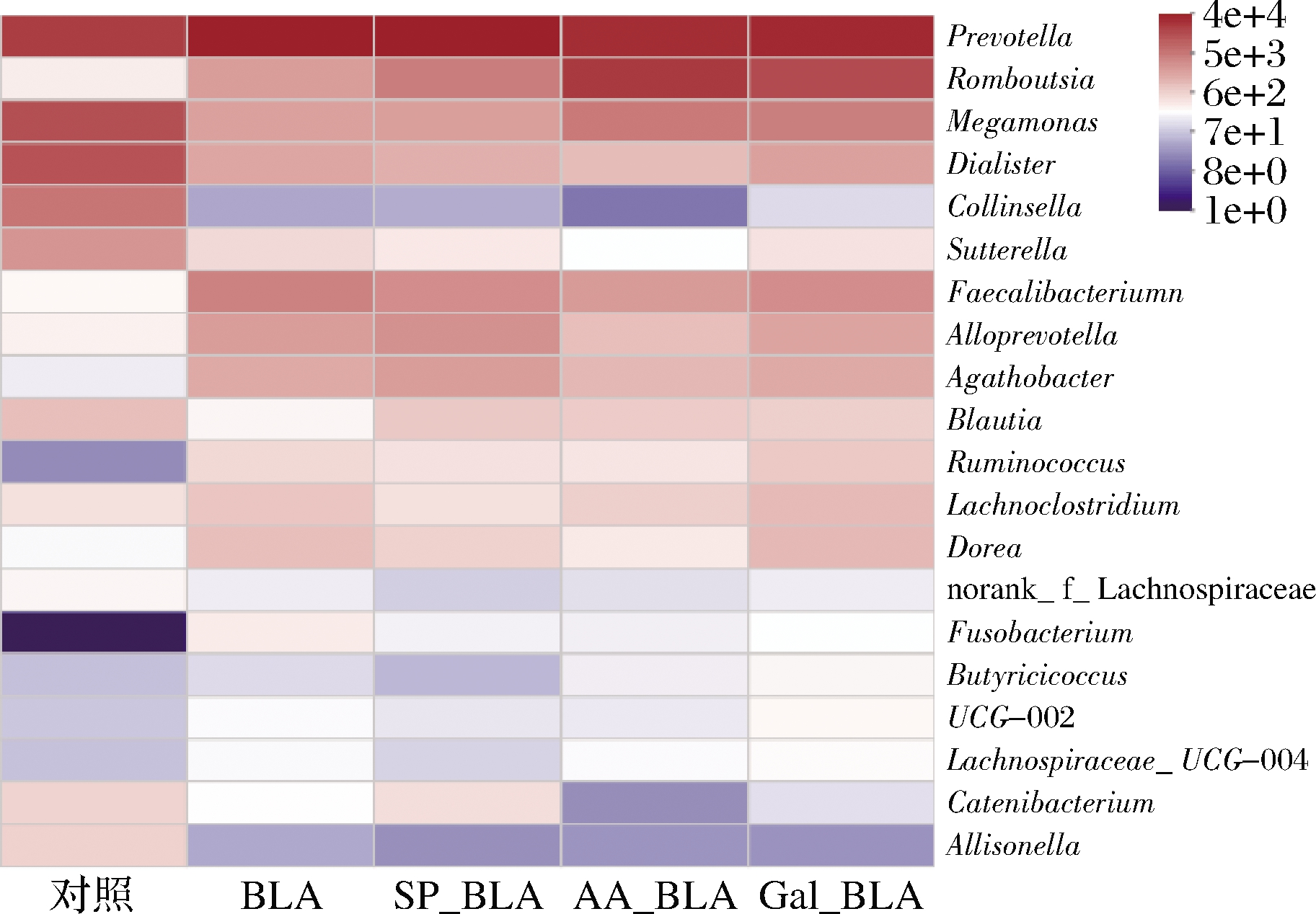
图6 人肠道菌群的属水平热图
Fig.6 Heat map of human intestinal microbiota at the genus level
2.4 糖基化、磷酸化和乙酰化修饰对BLA致敏性和人肠道微生物群的影响
BLA是牛乳以及乳制品中的主要过敏原,如何降低其致敏性具有重要的意义。本研究采用半乳糖、焦磷酸钠和乙酸酐分别对BLA修饰,这些修饰通过共价结合改变了BLA的分子质量(图1),减少BLA的游离氨基含量和增强BLA的反应程度(表1),以及增强荧光强度(图2-a)与紫外吸收强度(图2-b),同时显著降低了BLA的特异性抗体IgE的结合能力(图3)。这是由于糖基化、磷酸化及乙酰化修饰改变了BLA的结构,破坏其过敏表位[11],阻止IgE与BLA的相互作用,从而降低与特异性抗体IgE的结合能力。因此,经糖基化、磷酸化和乙酰化修饰的BLA的结构和分子质量的变化与BLA致敏性有关。
食物过敏反应的发生受遗传因素、环境刺激、过敏原及胃肠道微生物等的影响[24]。在这些因素中,食物过敏反应的发生与宿主肠道菌群的改变密切相关[25]。牛乳过敏原BLA经胃肠道消化后,其消化产物能够到达肠腔,从而影响肠道微生态系统的平衡。糖基化、磷酸化和乙酰化修饰的BLA能够显著影响人肠道微生物的群落丰富度、群落多样性(表2)以及人肠道群落在门和属水平上的相对丰度(图5和图6)。在门属水平的优势菌群相对丰度中(图5),BLA经糖基化、磷酸化和乙酰化修饰后Bacteroidota和Prevotella的相对丰度逐渐降低,而Firmicutes和Romboutsia的相对丰度逐渐增加,IgE结合能力也呈相反的趋势,表明Bacteroidota、Firmicutes、Prevotella和Romboutsiade相对丰度的变化与IgE结合能力的降低有关,这一研究与BERNI等研究结果类似[10]。因此,糖基化、磷酸化和乙酰化修饰能够降低BLA的致敏性,影响人肠道微生态平衡。
3 结论
BLA经磷酸化、糖基化和乙酰化修饰后分子质量发生了改变,游离氨基含量逐渐降低,反应程度、荧光强度和紫外吸收强度均逐渐增强,其特异性抗体IgE的结合能力显著降低。修饰后的BLA不仅对人肠道菌群丰富度和多样性有影响,对肠道菌群结构也有明显的影响。与BLA相比,经磷酸化、糖基化和乙酰化修饰后的BLA中Bacteroidota相对丰度逐渐降低,而Firmicutes相对丰度逐渐升高;Prevotella和Faecalibacterium相对丰度逐渐降低,而Romboutsia和Megamonas的相对丰度呈相反的趋势。结果表明,糖基化、磷酸化和乙酰化修饰改变了BLA的结构,降低致敏性,影响了人肠道微生物群落的结构,影响程度为乙酰化>糖基化>磷酸化。通过改善肠道微生态平衡能有效降低BLA的致敏性,但尚需通过体内实验进一步验证。
[1] CHENG Y H,TANG W J,XU Z,et al.Structure and functional properties of rice protein-dextran conjugates prepared by the maillard reaction[J].International Journal of Food Science & Technology,2018,53(2):372-380.
[2] 盛雪. 巴氏杀菌α-乳白蛋白的免疫调节作用[D].哈尔滨:东北农业大学,2019.
SHENG X.Immunomodulatory effects of pasteurized α-lactalbumin[D].Harbin:Northeast Agricultural University,2019.
[3] ZHANG M,ZHENG J Y,GE K S,et al.Glycation of α-lactalbumin with different size saccharides:Effect on protein structure and antigenicity[J].International Dairy Journal,2014,34(2):220-228.
[4] LIU J,TU Z C,ZHANG L,et al.Influence of ultrasonication prior to glycation on the physicochemical properties of bovine serum albumin galactose conjugates[J].Food Science and Technology Research,2018,24(1):35-44.
[5] ALVERDI V,Di PANCRAZIO F,LIPPE G,et al.Determination of protein phosphorylation sites by mass spectrometry:A novel electrospray-based method[J].Rapid Communications in Mass Spectrometry,2005,19(22):3 343-3 348.
[6] MUKHERJEE S,HAO Y H,ORTH K.A newly discovered post-translational modification-the acetylation of serine and threonine residues[J].Trends in Biochemical Sciences,2007,32(5):210-216.
[7] HOOPER L V,LITTMAN D R,MACPHERSON A J.Interactions between the microbiota and the immune system[J].Science,2012,336(6 086):1 268-1 273.
[8] ABRAHAMSSON T R,JAKOBSSON H E,ANDERSSON A F,et al.Low diversity of the gut microbiota in infants with atopic eczema[J].Journal of Allergy and Clinical Immunology,2012,129(2):434-440.
[9] FEEHLEY T,PLUNKETT C H,BAO R Y,et al.Healthy infants harbor intestinal bacteria that protect against food allergy[J].Nature Medicine,2019,25(3):448-453.
[10] BERNI CANANI R,SANGWAN N,STEFKA A T,et al.Lactobacillus rhamnosus GG-supplemented formula expands butyrate-producing bacterial strains in food allergic infants[J].The ISME Journal,2016,10(3):742-750.
[11] LIU J,CHEN W M,SHAO Y H,et al.The mechanism of the reduction in allergenic reactivity of bovine α-lactalbumin induced by glycation,phosphorylation and acetylation[J].Food Chemistry,2020,310.DOI:10.1016/j.foodchem.2019.125853.
[12] 刘俊. 超声波辅助糖基化修饰对蛋白质功能性质的影响及机制初探[D].南昌:江西师范大学,2018.
LIU J.Effect and mechanism of ultrasonication combined with glycation on the functional properties of proteins[D].Nanchang:Jiangxi Normal University,2018.
[13] KIM D Y,SHIN W S.Characterisation of bovine serum albumin fucoidan conjugates prepared via the maillard reaction[J].Food Chemistry,2015,173:1-6.
[14] MA J J,TUSHAR RAMESH P,LI Z X,et al.Optimisation of an extraction technique of fish allergens suitable for detection and diagnosis[J].Czech Journal of Food Sciences,2017,35(No.1):24-31.
[15] 沙小梅, 胡姿姿,涂宗财,等.基于体外模拟消化的糖基化草鱼鱼鳞明胶抗氧化性研究[J].食品与发酵工业,2018,44(3):58-64.
SHA X M,HU Z Z,TU Z C,et al.Study of antioxidant properties of glycated grass carp (Ctenopharyngodon idella) scale gelatin by in vitro simulated digestion[J].Food and Fermentation Industries,2018,44(3):58-64.
[16] DO PRADO S B R,MINGUZZI B T,HOFFMANN C,et al.Modulation of human gut microbiota by dietary fibers from unripe and ripe papayas:Distinct polysaccharide degradation using a colonic in vitro fermentation model[J].Food Chemistry,2021,348.DOI:10.1016/j.foodchem.2021.129071.
[17] WU X L,LU Y Q,XU H X,et al.Reducing the allergenic capacity of β-lactoglobulin by covalent conjugation with dietary polyphenols[J].Food Chemistry,2018,256:427-434.
[18] 徐洪亮. 小分子药物与牛血清白蛋白相互作用研究[D].长春:吉林大学,2013.
XU H L.Study on the interaction between small-molecular drugs and bovine serum albumin[D].Changchun:Jilin University,2013.
[19] BI H N,TANG L,GAO X,et al.Spectroscopic analysis on the binding interaction between tetracycline hydrochloride and bovine proteins β-casein,α-lactalbumin[J].Journal of Luminescence,2016:72-83.
[20] 丁红秀, 李忠莹,刘俊,等.不同生境草鱼肠道微生物组成和群落特征分析[J].微生物学报,2021,61(3):729-739.
DING H X,LI Z Y,LIU J,et al.Comparison of intestinal microbiome composition and community characteristics of grass carp from different habitats[J].Acta Microbiologica Sinica,2021,61(3):729-739.
[21] 李梦寒. α-乳白蛋白对肠道菌群的影响[D].哈尔滨:东北农业大学,2019.
LI M H.Effect of α-lactalbumin on gut microbiota of infants[D].Harbin:Northeast Agricultural University,2019.
[22] CHEN C C,CHEN K J,KONG M S,et al.Alterations in the gut microbiotas of children with food sensitization in early life[J].Pediatric Allergy and Immunology,2016,27(3):254-262.
[23] 陈宏健, 周杨,夏小洪,等.松墨天牛成虫室内外种群肠道细菌的多样性及功能分析[J].微生物学报,2021,61(3):683-694.
CHEN H J,ZHOU Y,XIA X H,et al.Diversity and function of intestinal bacteria in adult monochamus alternatus hope(Coleoptera:Cerambycidae) fed indoors and outdoors[J].Acta Microbiologica Sinica,2021,61(3):683-694.
[24] SAVAGE J H,LEE-SARWAR K A,SORDILLO J,et al.A prospective microbiome-wide association study of food sensitization and food allergy in early childhood[J].Allergy,2018,73(1):145-152.
[25] ZHAO W,HO H E,BUNYAVANICH S.The gut microbiome in food allergy[J].Annals of Allergy,Asthma & Immunology,2019,122(3):276-282.