枸杞(Lycium barbarum),又称枸杞子、红耳坠,为茄科枸杞属,是一种 “药食同源”的植物性保健食品[1]。现代医学研究充分表明,枸杞多糖、β-胡萝卜素、甜菜碱、牛磺酸、黄酮是枸杞中重要的有效活性成分[2],具有较强的生理活性、细胞保护作用和免疫活性,对抗肿瘤、保肝、降压、降血糖、抗衰老具有一定功效[3]。近年来,关于枸杞的研究主要集中在枸杞深加工[4]、抗氧化[5]、抗炎[6]和抗衰老等功效研究以及发酵过程中活性物质的变化等动态过程研究[7]。
目前,枸杞多糖能有效减轻化学毒素引起的坏死性炎症[8]和氧化应激[9],作为一种食品补充剂在预防肝脏疾病方面具有很大的应用潜力。酒精性肝损伤已经成为威胁人类健康和生命的一大疾病[10],预防和治疗酒精性肝损伤的重要机制主要为降低氧化应激、坏死性炎症和核转录因子活性从而实现肝脏损伤的保护作用[11],还涉及各途径介导的肠道菌群失调,肠屏障功能障碍等[12]。
为使得枸杞的有效成分得到利用,除对枸杞多糖、黄酮等提取加工成功能食品外,还可利用生物技术发酵这种成本较低且能广泛应用的深加工方式。通过控制微生物的生长,酶的释放将枸杞中成分转化,制备具有健康益处的饮料[13-14]。植物细胞壁的结构使胞浆中的活性成分不易提取出来,微生物在代谢过程中会产生多种酶,这些酶会破坏植物细胞壁的结构或者对细胞壁结构加以修饰,使得枸杞中的活性物质容易释放出来[15]。发酵能产生独特的风味、香气和质地,也可用于食品品质改良及风味提升。在加工生产中,乳酸菌被广泛使用,酵母菌MN0110自身能够产生超氧化物歧化酶(superoxide dismutase,SOD)等具有强抗氧化性的物质,提高自由基的清除能力并缓解脂质氧化[16]。
本研究采用乳杆菌MN1030、乳杆菌MN0727、乳杆菌MN0930和酵母菌MN0110对宁夏枸杞原浆进行液态发酵,通过ADH激活率和SOD酶活力优化各自的发酵工艺。对发酵后的枸杞酵素分别进行对HepG2细胞酒精性损伤模型的保护作用评价。以期选择能够增强枸杞酵素解酒护肝功效的的菌种,为开发保护酒精性肝损伤的功能性食品提供基本依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
宁夏干果,宁夏润德健康产业有限公司(2020年);酪蛋白胨、牛肉膏、酵母菌MN0110粉、乙酸钠、柠檬酸二胺、琼脂、葡萄糖、三氯乙酸,国药集团化学试剂有限公司;纤维素酶50 000 U/g、果胶酶30 000 U/g、D-异抗坏血酸钠(VC钠)、食品添加剂,食全食美有限责任公司;酵母菌MN0110(Lactobacillus MN0110)、乳杆菌MN0727(Lactobacillus MN1030)、乳杆菌MN0930(Lactobacillus MN0727)、乳杆菌MN1030(Lactobacillus MN0930),实验室保藏。HepG2细胞(实验代数为27~41代),中科院上海细胞库。BCA蛋白浓度测定试剂盒(增强型)、MTT细胞增殖及细胞毒性检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性试剂盒、总SOD活性检测试剂盒(WST-8法)(T-SOD)、RIPA裂解液(强),上海碧云天生物技术有限公司;谷氨酸-丙酮酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、乙醇脱氢酶(alcohol dehydrogenase,ADH)检测试剂盒,南京建成生物工程研究所有限公司。
1.1.2 仪器与设备
AL04型电子分析天平(感量0.000 1 g),梅特勒-托利多(上海)仪器有限公司;L12-Energy61型打浆机,九阳股份有限公司;LDZX-50KB立式压力蒸汽灭菌锅,上海申安医疗器械厂;ZHJH-112B超净工作台,上海智城分析仪器有限公司;ZWY-211B恒温培养箱,上海一恒科技有限公司;Multiskan GO 全波长酶标仪,赛默飞科技有限公司;Centrifuge 5415R 高速冷冻离心机,艾本德股份公司(德国)。
1.2 实验方法
1.2.1 工艺流程
枸杞→热烫→护色→预煮→榨汁→酶解→灭菌→冷却→接菌→发酵→离心→酵素→清汁→调味→高压均质→灭菌
1.2.2 发酵菌液的制备
菌种的活化:将乳杆菌MN1030、乳杆菌MN0930、乳杆菌MN0727分别划线接种到MRS、MC、MRS培养基上,37 ℃培养48 h。
液体扩大培养至OD600为0.5~0.6,用无菌水洗涤2遍,调整至1×107 CFU/mL。
酵母菌MN0110的活化:将酵母粉按10%的比例加入到灭菌水中,35 ℃活化30 min。
1.2.3 枸杞发酵原浆的制备工艺
将干枸杞先经过热烫,捞出后,枸杞以1∶4的料水比在80 ℃的水中浸提30 min,加入0.3%的Vc钠作为护色剂,冷却后打浆,得到浆料。采用复合酶[m(纤维素酶)∶m(果胶酶)=2∶8],酶解条件:酶解温度40 ℃;酶解时间3 h;加酶量0.2%。
1.2.4 发酵工艺的条件优化
1.2.4.1 枸杞酵素的单因素试验
调整初始pH为5.5,接种量为3%,在37 ℃下分别发酵36 h,探究不同加糖量(1%、2%、3%、4%、5%),接菌量(1%、3%、5%、7%、9%)对枸杞原浆发酵的影响,根据SOD酶活力,ADH激活率确定接菌量。分别在发酵温度(29、33、37、41、45 ℃)下对枸杞原浆进行发酵,对枸杞原浆进行不同时间的发酵(12、24、36、48、60 h),根据SOD酶活力,ADH激活率确定最优发酵条件。
1.2.4.2 SOD酶活力和ADH激活率的测定
将以上4种枸杞酵素液先超声波处理30 min,再于4 000 r/min离心15 min,取上清液,根据SOD酶试剂盒说明书进行SOD酶活力的测定。根据瓦勒-霍赫(Valle &Hoch)法[17]测定ADH的激活率。SOD活性已成为抗衰老药物和抗衰老保健食品的一个重要指标,被广泛用作组织中抗氧化剂状态的指标。
1.2.5 HepG2 肝癌细胞上验证酒精性肝损伤的保护作用
1.2.5.1 酒精性HepG2肝细胞损伤模型的建立
按卢梦瑶[18]的方法培养细胞,待细胞密度达到70%~80%后,使用不完全培养基(只含0.5%的双抗)将无水乙醇稀释成500、600、700、800、900、1 000 mmol/L,每个浓度设置6个复孔。采用四甲基偶氮唑盐微量酶反应比色法(MTT比色法)测定细胞的存活率筛选乙醇的作用浓度和作用时间[19]使用酶标仪在570 nm下测定每孔的吸光值,细胞存活率的计算如公式(1)所示:
存活率![]()
(1)
在MTT法筛选出的细胞存活率为50%处选择造模浓度范围,每个浓度设置6个复孔。LDH泄露率多用来比较细胞损伤程度,以及评估药物治疗作用效果[20],采用LDH泄露率确定最终造模浓度。使用酶标仪在490 nm下测定每个孔的吸光值,LDH泄露率的计算如公式(2)所示:
LDH泄露率![]()
(2)
1.2.5.2 枸杞酵素的细胞毒性分析
细胞培养条件如1.2.5.1,将以上选择的造模浓度作用于分别培养3、6、12、24、36、48 h的细胞,采用MTT法研究不同的枸杞酵素在不同浓度下对HepG2的毒性作用。
1.2.5.3 细胞上清液中AST、ALT、LDH的测定
LDH用来检测细胞膜通透性的改变,AST和ALT的释放量能够反应肝细胞的受损程度。不同浓度的酵素提取液作用相同时间,选取1.2.5中最佳酒精造模浓度和时间继续孵育相同时间。以不做任何处理的细胞组为对照组,不经过给药处理的但经过酒精造模的组别作为模型组。分别检测上清液中ALT、AST、LDH的产生量,并用各孔的蛋白总量进行校正,评价不同菌种最优发酵条件下对HepG2酒精性细胞损伤的保护作用。
1.2.5.4 细胞内丙二醛(malondialdehyde,MDA)、ADH、SOD的测定
条件同1.2.5.3参照试剂盒的方法检测细胞内ADH激活率、MDA与SOD活力。ADH激活率一般反映细胞的解酒能力,MDA的含量反映脂质过氧化与损伤程度,SOD水平反映对细胞过氧化表达的保护作用。
1.2.6 试验数据分析
每个样品至少做3次平行,所有的试验数据均表示为平均值±标准差,采用SPSS 25.0软件对数据进行单因素方差分析(ANOVA 法),以P<0.01 表示极显著的差异,P<0.05表示显著性差异。图表采用Origin 2018绘制。
2 结果与分析
2.1 发酵工艺的条件优化
2.1.1 接菌量
在一定范围内,不同的接菌量影响发酵酵素的产酸的速度,在一定范围的pH下,菌种的生长又能受到pH的影响。此外,接种量的增多能够缩短发酵时间或缩短延滞期。如图1,随着酵母菌MN0110接菌量的增加,ADH激活率逐渐增大,SOD酶活力缓慢上升后趋于不变,在5%时达到最大。乳杆菌MN0727随着接菌量的增加,在5%接种量下ADH激活率达到最大,但SOD酶活力却相对较小,选则3%作为接菌量。乳杆菌MN1030和乳杆菌MN0930变化趋势一致,SOD酶活力分别于5%,3%时达到最大。综合以上,乳杆菌MN0727、乳杆菌MN0930最优接菌量为3%,酵母菌MN0110、乳杆菌MN103最优接菌量为5%。

图1 接菌量对ADH激活率和SOD酶活力的影响
Fig.1 Effect of the amount of inoculation amount on ADH activation rate and SOD activity 注:不同字母不同表示同一菌种在不同加糖量之间的差异, 字母不同表明差异显著(P<0.05)(下同)
2.1.2 发酵温度
为了探究温度对不同菌种发酵枸杞酵素产生的影响,设置不同温度作为发酵条件(图2)。菌种在发酵过程中温度过低或过高,菌种生长缓慢,ADH激活率和SOD酶活力降低。因此,选择了37 ℃作为乳杆菌MN0727和乳杆菌MN1030的最终发酵温度,29 ℃作为酵母菌MN0110的发酵温度,41 ℃作为乳杆菌MN0930的最终发酵温度。
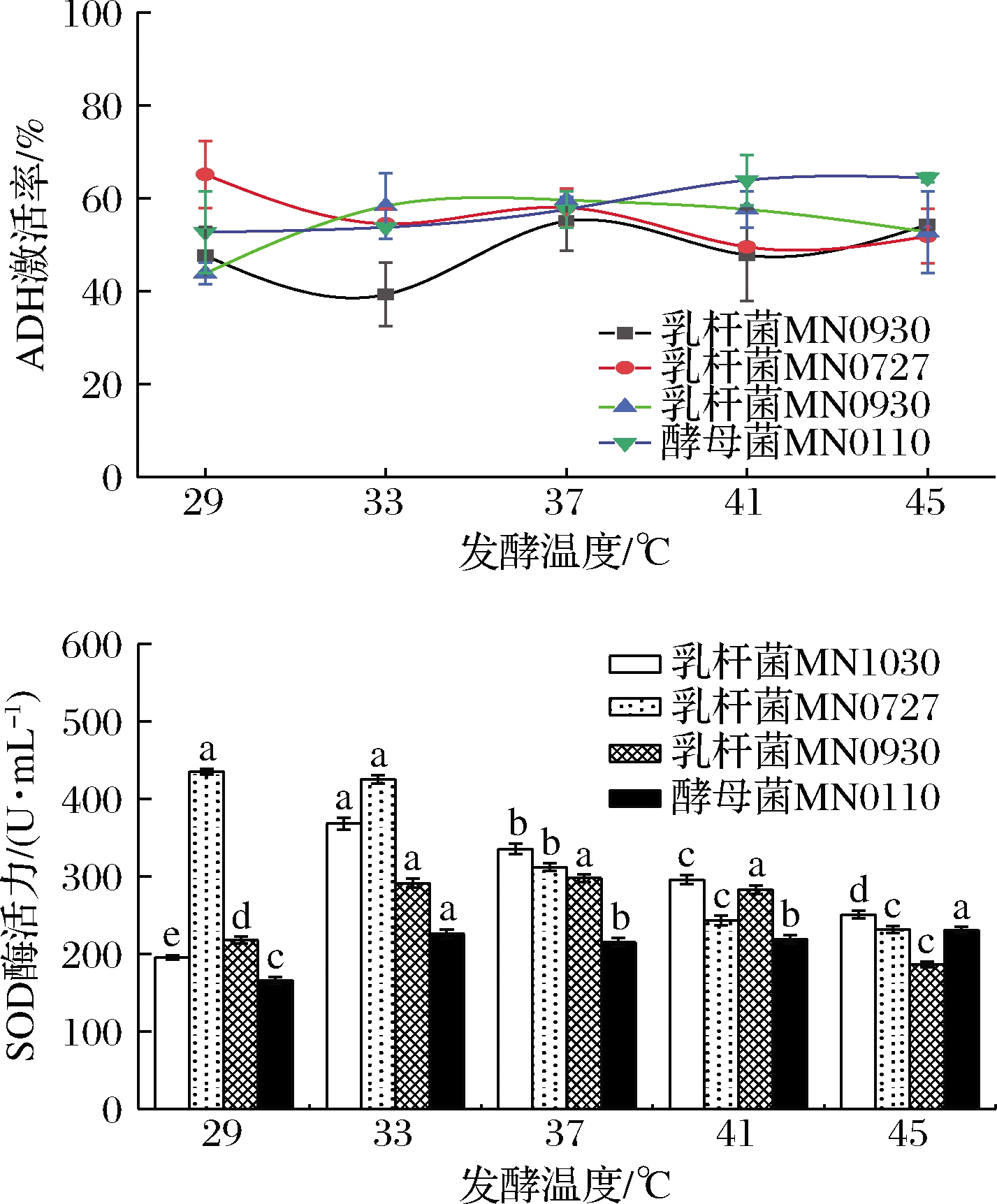
图2 发酵温度对ADH激活率和SOD酶活力的影响
Fig.2 Effect of fermentation temperature on ADH activation rate and SOD activity
2.1.3 发酵时间
由图3可知,不同种类的菌种对于ADH激活率和SOD酶活力的影响各不相同,主要是由于菌种的不同特性决定的。4种菌种除乳杆菌MN1030发酵枸杞酵素在ADH的激活率呈现先上升后下降的趋势。随着发酵时间的延长,SOD酶活均呈现先缓慢升高后下降的趋势。因此,乳杆菌MN0727枸杞酵素和枸杞酵素的最佳发酵时间为36 h,乳杆菌MN1030的最优发酵时间为48 h,乳杆菌MN0930的最优发酵时间为24 h。
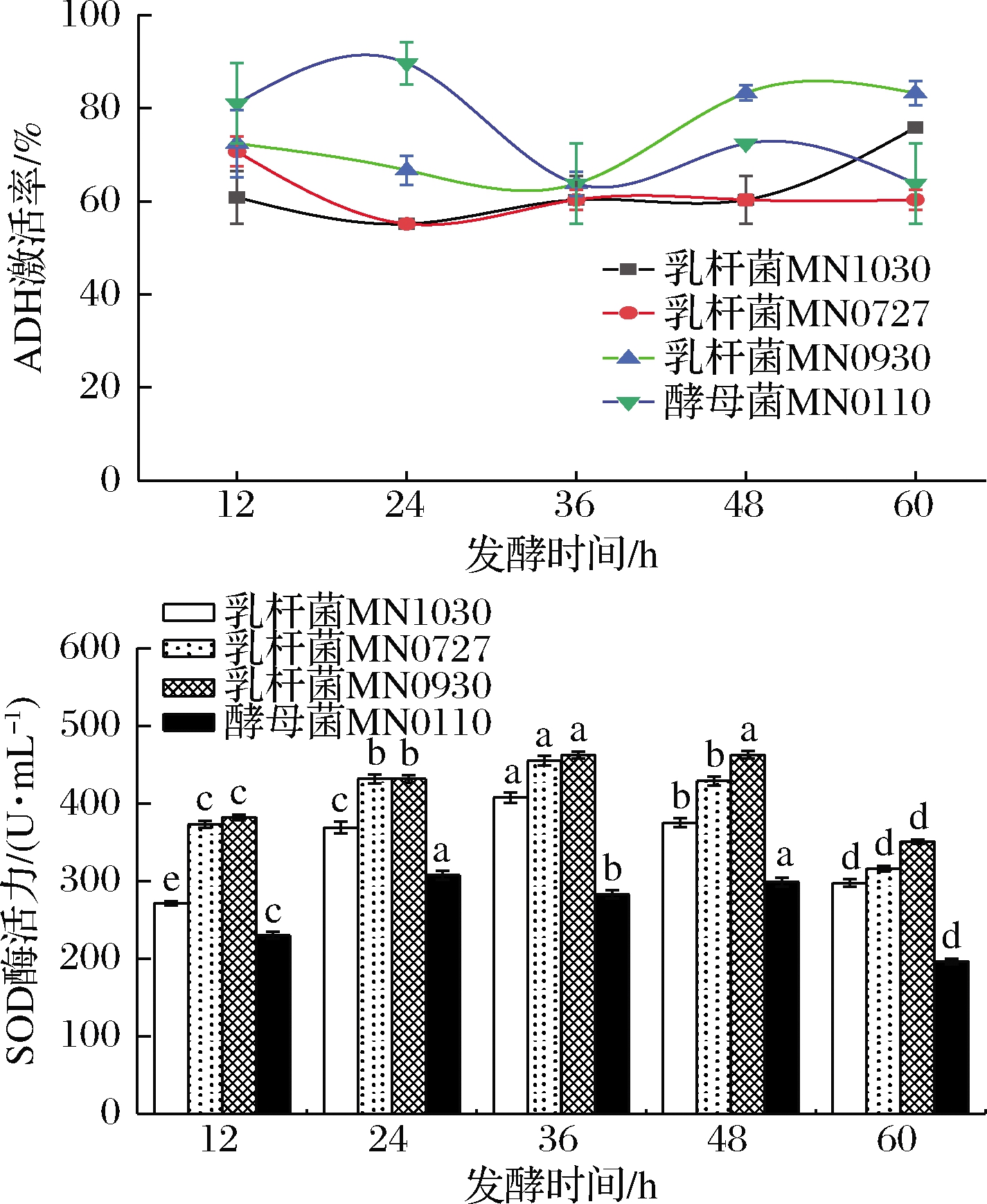
图3 发酵时间对ADH激活率和SOD酶活力的影响
Fig.3 Effect of fermentation time on ADH activation rate and SOD activity
2.2 HepG2 肝癌细胞上验证酒精性肝损伤的保护作用
2.2.1 MTT筛选造模浓度和给药浓度
用 HepG2 细胞为模型细胞,用酒精为损伤诱导剂,构建 HepG2 细胞酒精性损伤模型。利用MTT法检测发现(图4),随着酒精浓度的上升,细胞的存活率逐渐下降,在700 mmol/L时达到IC50。选取500、600、700 mmol/L浓度测定LDH泄露率。当酒精浓度为600 mmol/L左右时,细胞存活率在50%左右,超过半数致死率,说明造模的酒精浓度给细胞造成损伤但又不至于造成细胞全部死亡,对应的浓度为建立 HepG2 细胞酒精性损伤模型的最佳损伤浓度。
未做任何处理的细胞对照组的LDH泄露率为100%,此时,不同的造模浓度的泄露量分别为127.80%、153.21%、152.77%。酶的泄露量在600和700 mmol/L相差不多,由于后面继续添加给药组,时间增加24 h,可能也会给细胞带来损伤。因此,将HepG2细胞酒精性损伤模型的造模酒精浓度设置为600 mmol/L。
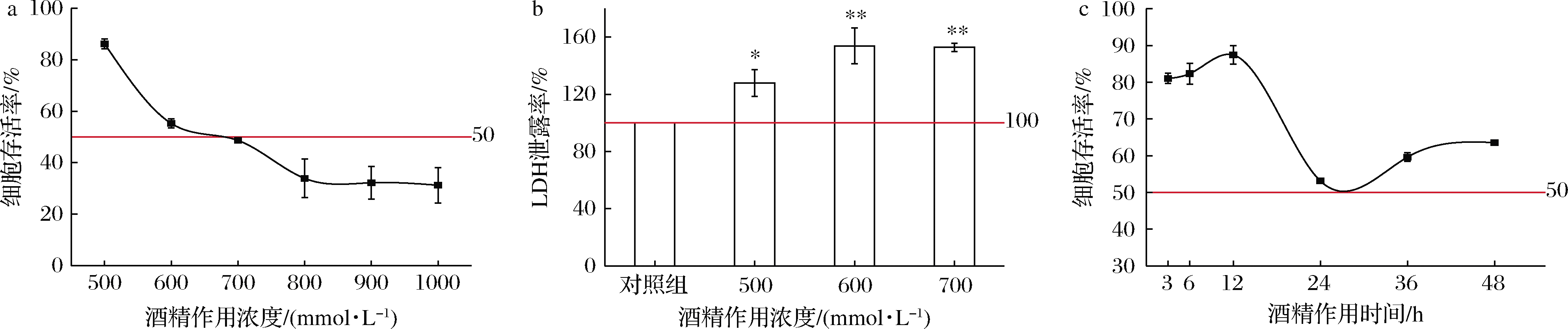
a-酒精作用浓度对对HepG2细胞存活率的影响;b-造模酒精浓度对LDH泄露率的影响;c-酒精作用时间对HepG2细胞存活率的影响
图4 酒精性肝损伤造模条件
Fig.4 Model conditions of alcoholic liver injury.
2.2.2 给药浓度
由图5可知,原浆和4个不同菌种枸杞酵素处理组在400 μg/mL以内,HepG2 细胞存活率均在90%以上,不显示毒性作用,且各样品组的细胞存活率相近,说明试验所选各样品质量浓度均不会影响HepG-2 细胞的正常生长,因此将400 μg/mL作为后续的实验质量浓度。

图5 不同菌种发酵枸杞酵素预处理对HepG2 细胞存活率的影响
Fig.5 Effect of fermented Lycium barbarum juice by different strains on the viability rate of HepG2 cells
2.2.3 ADH
由图6可知,乳杆菌MN1030发酵枸杞酵素,酵母菌MN0110均可显著提高受损细胞中的ADH活力(P<0.01)。ADH的酶活性在酒精处理后会由于细胞损伤和酒精代谢而增加。酵素组处理后,HepG2细胞中ADH活性升高,说明增强了酒精的代谢,防止乙醛积聚来迅速缓解乙醇诱导的HepG2细胞损伤。
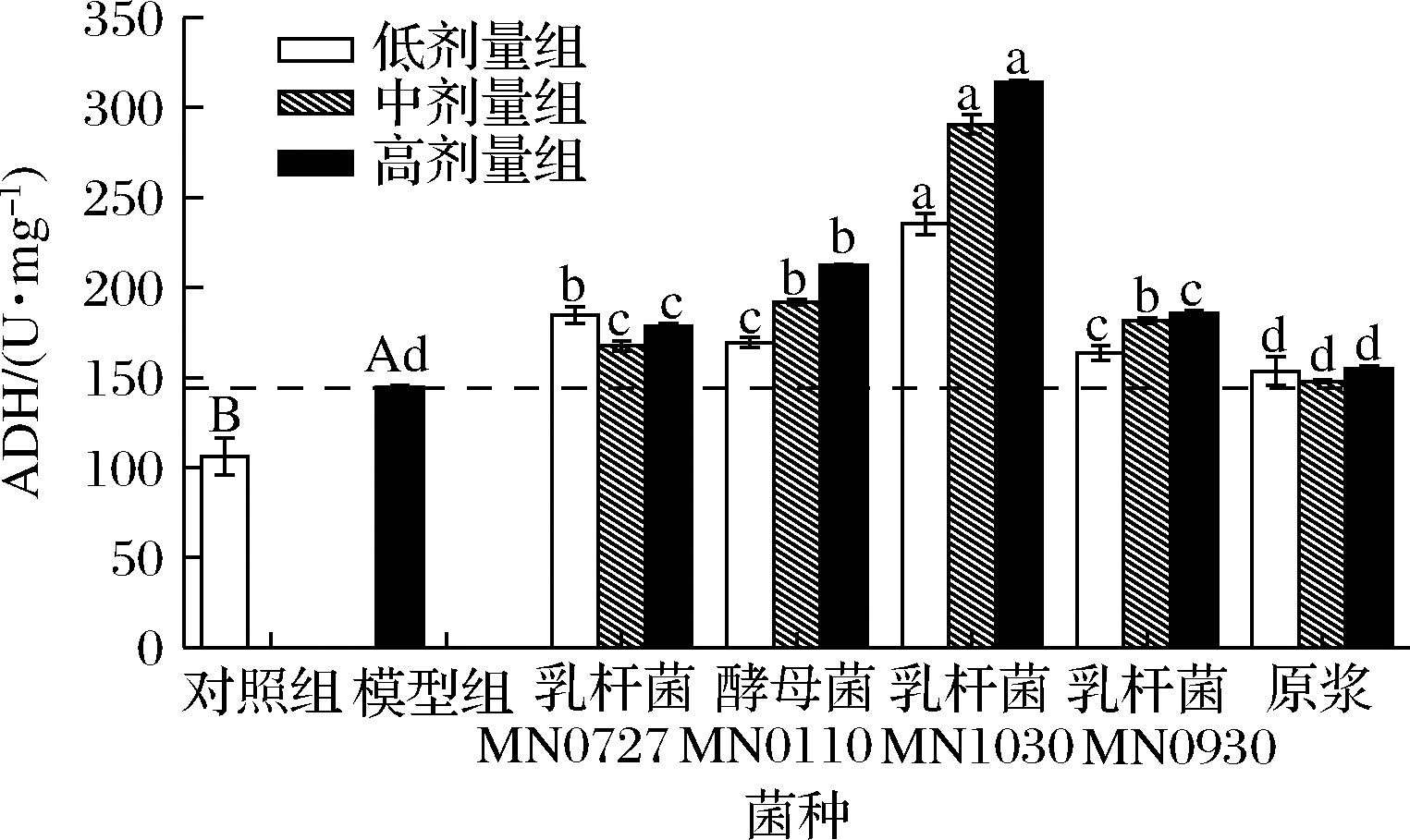
图6 不同菌种发酵枸杞酵素预处理对酒精性肝损伤 HepG2细胞中ADH活力的影响
Fig.6 Effect of fermented Lycium barbarum juice by different strains on the content of ADH in HepG2 cells induced by alcohol
2.2.4 AST和ALT
ALT全部存在于细胞基质中,AST有20%存在细胞质基质中,80%存在线粒体中[21]。AST,ALT是体内重要的转氨酶,主要存在细胞内,当肝细胞受损时,细胞膜的通透性增加,酶被释放到胞外。通过酒精性损伤细胞、AST和ALT的释放量能够反应肝细胞的受损程度。炎症和ROS的产生会导致细胞外的AST和ALT含量产生变化,细胞损伤程度轻,胞内的ALT和部分AST逸出,细胞损伤程度重,线粒体内的AST逸出。酒精的处理可能导致细胞膜和线粒体损伤,AST和ALT被释放到细胞外。与模型组相比,乳杆菌MN0930发酵处理组和原浆处理组的细胞外AST含量具有一定的下降,但是没有明显的差异(P>0.05)。乳杆菌MN0727、酵母菌MN0110、乳杆菌MN1030组均显著降低了细胞外的AST的含量(P<0.05)。与对照组相比,模型组ALT的含量显著升高。较模型组,不同剂量组可显著降低受损干细胞的ALT 的分泌量。乳杆菌MN1030与模型组差异显著(P<0.01),且与对照组水平相近。说明乳杆菌MN1030酵素组对酒精性肝损伤有较好的干预作用。

图7 不同菌种发酵枸杞酵素预处理对酒精性肝损伤 HepG2细胞中AST和ALT的影响
Fig.7 Effect of fermented Lycium barbarum juice by different strains on the content of AST and ALT in HepG2 cells induced by alcohol
2.2.5 MDA
MDA 作为生物体脂质过氧化的标志物,主要是由于炎症因子以及ROS等造成细胞内的氧化机制遭受到破坏,引起细胞膜的不饱和脂肪酸发生脂质过氧化[22]。如图8所示,与对照组相比,模型组的MDA生成量显著升高(P<0.01),是对照组的2.94倍。不同菌种发酵枸杞酵素单独作用于细胞,均可显著降低受损肝细胞内MDA的产生量,却不能恢复至细胞的最初水平。对照组的MDA产生量在2.30 μmol/g prot,作用效果最好的酵母菌MN0110和乳杆菌MN1030能将造模组6.77 μmol/g prot分别恢复至2.46和3.81 μmol/g prot。
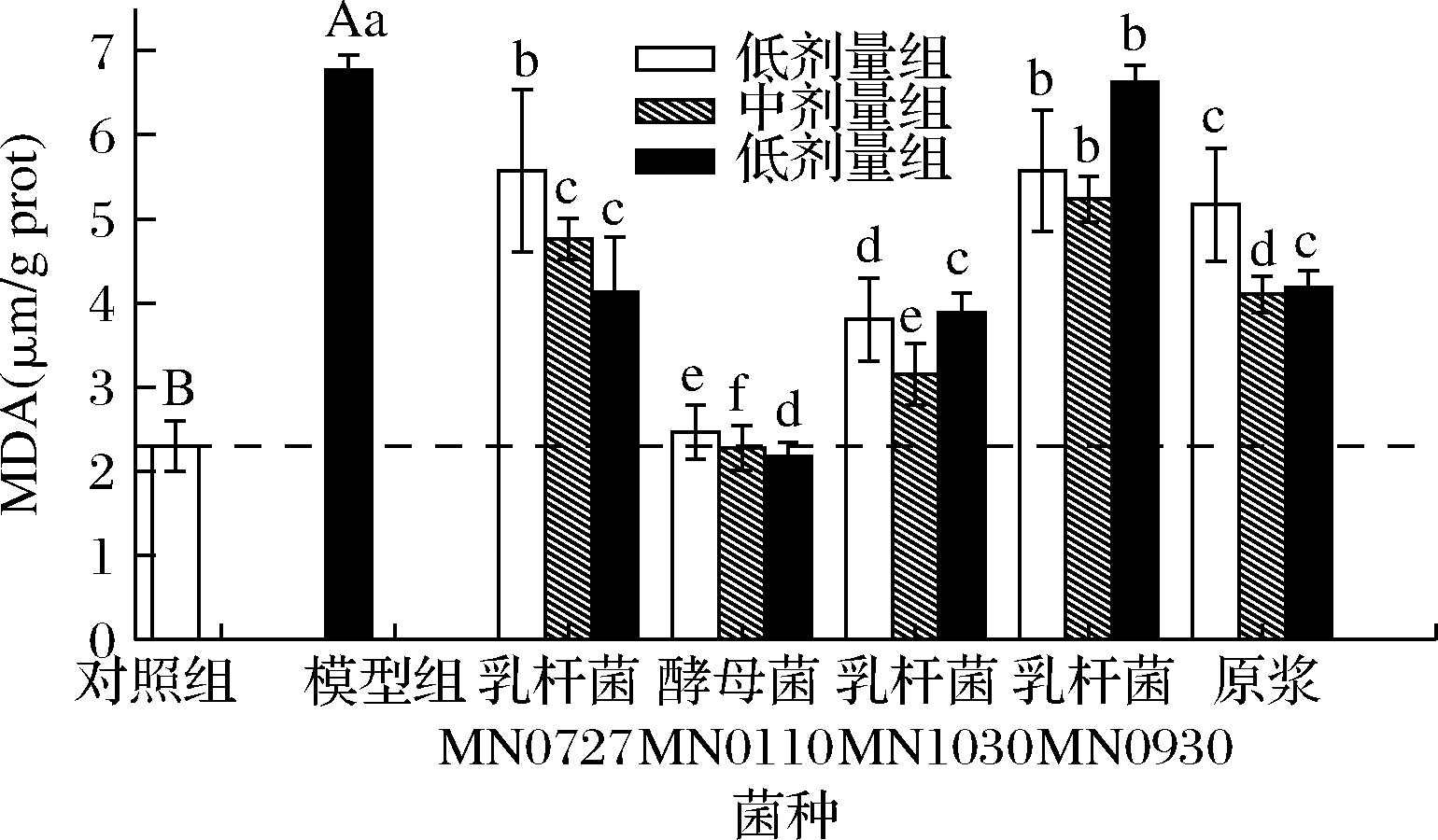
图8 不同菌种发酵枸杞酵素预处理对酒精性肝损伤 HepG2细胞中MDA的影响
Fig.8 Effect of fermented Lycium barbarum juice by different strains on the content of MDA in HepG2 cells induced by alcohol
MDA的显著降低说明乳杆菌MN0727和酵母菌MN0110发酵对保护细胞免受脂质过氧化的能力要高于其他处理组。
2.2.6 SOD
SOD是细胞内抵抗氧化应激的主要酶系之一,是SOD、CAT、GSH-Px抗氧化酶系中最重要的一种酶[23]。图9显示,模型组较对照组的SOD酶活力显著降低(P<0.01),细胞内的抗氧化机制已经失衡,细胞已处于氧化损伤状态。酵素处理组较模型组SOD酶活力均有不同程度的升高,表明酵素处理组能抵御酒精诱导的氧化应激损伤,通过过量表达SOD酶来恢复HepG2细胞的氧化应激机制。其中酵母菌MN0110发酵处理组的SOD酶活力最高,乳杆菌MN1030、乳杆菌MN0930次之、原浆和乳杆菌MN0727最弱。与对照组差异显著(P<0.01),说明酵素处理并不能完全抵御酒精造成的细胞损伤,但在一定程度上具有保护作用。
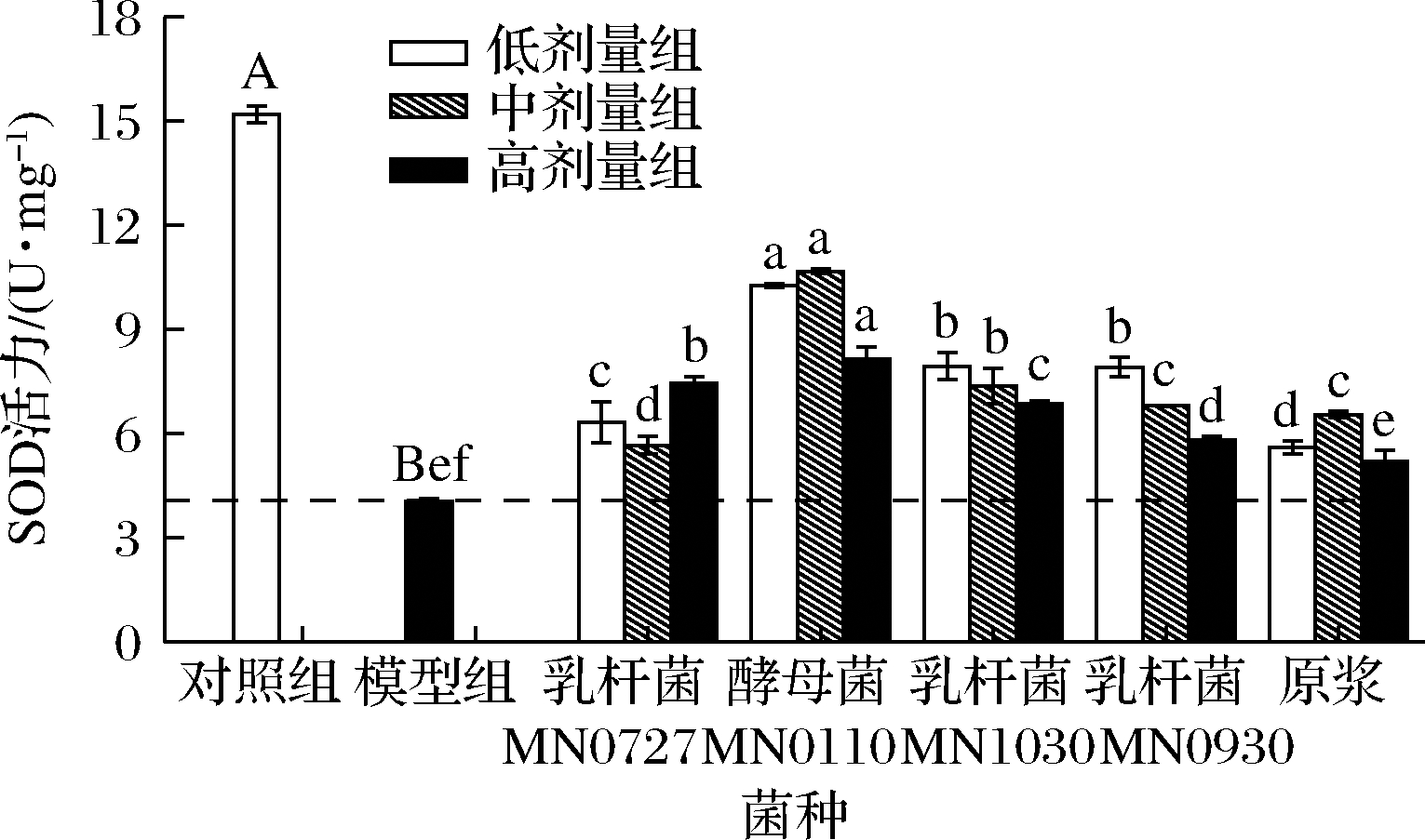
图9 不同菌种发酵枸杞酵素预处理对酒精性肝损伤 HepG2细胞中SOD抗氧化酶活力的影响
Fig.9 Effect of fermented Lycium barbarum juice by different strains on the Intracellular SOD antioxidant enzyme activity in HepG2 cells induced by alcohol
3 结论
本实验将乳杆菌MN1030、酵母菌MN0110、乳杆菌MN0727、乳杆菌MN0930接种于枸杞原浆进行发酵,通过对发酵条件(接菌量、时间、温度)进行优化,确定具有潜在护肝功能的枸杞酵素的最优发酵条件。使用最优发酵条件下不同菌种发酵的枸杞酵素作用细胞,能显著降低造模组MDA的产生、AST和ALT的分泌量,显著增加SOD酶活力和ADH 的激活率。结果表明,处理组对损伤细胞均具有保护作用,其中酵母菌MN0110和乳杆菌MN1030的保护作用最为显著(P<0.01),未发酵原浆对损伤细胞有保护作用,但是效果不显著(P>0.05)。酵母菌MN0110和乳杆菌MN1030发酵的枸杞酵素可从氧化应激、脂质代谢方面对缓解酒精性肝损伤具有一定功效。
[1] 代金霞, 杜晓宁.宁夏枸杞内生菌的抗菌和抗肿瘤活性研究[J].中国中药杂志,2017,42(11):2 072-2 077.
DAI J X,DU X N.Antimicrobial and anti-tumor activities of endophytes from Lycium barbarum of Ningxia[J].China Journal of Chinese Materia Medica,2017,42(11),2 072-2 077.
[2] 刘敦华, 刘军,李佩佩,等.枸杞深加工产品开发现状及研究进展[J].食品科学技术学报,2020,38(4):10-20.
LIU D H,LIU J,LI P P,et al.Development status and research progress of deep processing products of Lycium barbarum[J].Journal of Food Science and Technology,2020,38(4):10-20.
[3] AMAGASE H,FARNSWORTH N R.A review of botanical characteristics,phytochemistry,clinical relevance in efficacy and safety of Lycium barbarum fruit (Goji)[J].Food Research International,2011,44(7):1 702-1 717.
[4] WANG M Z,OUYANG X Y,LIU Y R,et al.Comparison of nutrients and microbial density in Goji berry juice during lactic acid fermentation using four lactic acid bacteria strains[J].Journal of Food Processing and Preservation,2021,45(1).DOI:10.1111/jfpp.15059.
[5] LEE S R,AN M Y,HWANG H J,et al.Antioxidant effect of Lycium barbarum leaf through inflammatory and endoplasmic Reticulum stress mechanism[J].Antioxidants,2020,10(1):20.
[6] DING H,WANG J J,ZHANG X Y,et al.Lycium barbarum polysaccharide antagonizes LPS-induced inflammation by altering the glycolysis and differentiation of macrophages by triggering the degradation of PKM2[J].Biological and Pharmaceutical Bulletin,2021,44(3):379-388.
[7] ROCCHETTI G,CHIODELLI G,GIUBERTI G,et al.UHPLC-ESI-QTOF-MS profile of polyphenols in Goji berries (Lycium barbarum L.) and its dynamics during in vitro gastrointestinal digestion and fermentation[J].Journal of Functional Foods,2018,40:564-572.
[8] AW W,JIA H J,LYU W D,et al.Integrated omics profiling of dextran sodium sulfate-induced colitic mice supplemented with Wolfberry (Lycium barbarum)[J].Npj Science of Food,2020,4:5.
[9] JEONG H C,JEON S H,QUN Z G,et al.Lycium chinense Mill improves hypogonadism via anti-oxidative stress and anti-apoptotic effect in old aged rat model[J].The Aging Male,2020,23(4):287-296.
[10] KWONG E K,PURI P.Gut microbiome changes in Nonalcoholic fatty liver disease & alcoholic liver disease[J].Translational Gastroenterology and Hepatology,2021,6:3.
[11] 李凡. 滨海白首乌酵素的制备及其功效性研究[D].无锡:江南大学,2019.
LI F.Preparation of Cynanchum auriculatum royle ex wight ferment and its research on efficacy[D].Wuxi:Jiangnan University,2019.
[12] XIAO J,ZHANG R F,WU Y J,et al.Rice bran phenolic extract protects against alcoholic liver injury in mice by alleviating intestinal microbiota dysbiosis,barrier dysfunction,and liver inflammation mediated by the endotoxin-TLR4-NF-κB pathway[J].Journal of Agricultural and Food Chemistry,2020,68(5):1 237-1 247.
[13] ZHAO D D,WEI J,HAO J X,et al.Effect of sodium carbonate solution pretreatment on drying kinetics,antioxidant capacity changes,and final quality of wolfberry (Lycium barbarum) during drying[J].LWT,2019,99:254-261.
[14] DIMIDI E,COX S R,ROSSI M,et al.Fermented foods:Definitions and characteristics,impact on the gut microbiota and effects on gastrointestinal health and disease[J].Nutrients,2019,11(8):1 806.
[15] 高庆超, 常应九,马蓉,等.黑果枸杞酵素发酵前后主要成分分析及其体外抗氧化活性研究[J].食品与发酵工业,2020,46(5):275-283.
GAO Q C,CHANG Y J,MA R,et al.Analysis of main components and antioxidant activity in vitro for Lycium ruthenicum Murr.Jiaosu before and after fermentation[J].Food and Fermentation Industries,2020,46(5):275-283.
[16] 赵治巧, 曾莉,万玉军,等.酵母菌-植物乳杆菌复合发酵菠萝酵素生物活性的初步研究[J].食品与发酵工业,2020,46(7):110-115.
ZHAO Z Q,ZENG L,WAN Y J,et al.Study on the bioactivity of pineapple Jiaosu fermented by yeast and Lactobacillus plantarum[J].Food and Fermentation Industries,2020,46(7):110-115.
[17] 戴雨霖. 葛花人参解酒护肝机制的研究[D].长春:长春中医药大学,2014.
DAI Y L.The study of relieving alcoholism and protecting liver by the flowers of Pueraria iobata and Panax ginseng roots[D].Changchun:Changchun University of Chinese Medicine,2014.
[18] 卢梦瑶. 油基对脂质伴随物细胞抗氧化的影响研究[D].无锡:江南大学,2020.
LU M Y.Study on the effect of oil bases on cellular antioxidant activities of lipid concomitants[D].Wuxi:Jiangnan University,2020.
[19] 何念武, 曹思娟,张咪.万寿菊多糖的纯化、组成分析及其体外抗氧化和抗肿瘤活性研究[J].食品与发酵工业,2020,46(15):216-223.
HE N W,CAO S J,ZHANG M.Purification and composition analysis of polysaccharide from Tagetes erecta L.and its antioxidant and antitumor activities in vitro[J].Food and Fermentation Industries,2020,46(15):216-223.
[20] 洪庆涛, 宋岳涛,唐一鹏,等.细胞培养液乳酸脱氢酶漏出率的比色测定及其应用[J].细胞生物学杂志,2004,26(1):89-92.
HONG Q T,SONG Y T,TANG Y P,et al.Determination and application of leakage rate of lactate dehydrogenase in the cultured medium of cells[J].Chinese Journal of Cell Biology,2004,26(1):89-92.
[21] SUTOH Y,HACHIYA T,SUZUKI Y,et al.ALDH2 genotype modulates the association between alcohol consumption and AST/ALT ratio among middle-aged Japanese men:A genome-wide G×E interaction analysis[J].Scientific Reports,2020,10(1):1 622.
[22] 陈继铭,吴晓静,刘田丰,等.水飞蓟素对四氯化碳致小鼠肝损伤和骨代谢的影响[J].中国组织工程研究,2021,25(8):1 224-1 228.
CHEN J M,WU X J,LIU T F,et al.Effects of silymarin on liver injury and bone metabolism induced by carbon tetrachloride in mice[J].Chinese Journal of Tissue Engineering Research,2021,25(8):1 224-1 228.
[23] 马婕馨, 蔡程山,高苏,等.蛹虫草SOD高活性菌株筛选及液体培养条件优化[J].食品与发酵工业,2019,45(10):122-128.
MA J X,CAI C S,GAO S,et al.Screening and fermentation optimization of Cordyceps militaris having high SOD activity[J].Food and Fermentation Industries,2019,45(10):122-128.