甲基萘醌类是一类广泛存在于微生物细胞内的化合物,在孢子形成、氧化磷酸化和电子传递等方面起着重要的作用[1]。甲基萘醌类又被称为维生素K2[2],它们是维生素K依赖蛋白谷氨酸残基翻译后转化的重要辅助因子。目前,存在有14种menaquinone-n(MK-n),其中n为侧链上的异戊二烯单位数,这条尾巴的长度因微生物的不同而不同[3]。MK-4在凝血、预防骨质疏松、缓解心血管钙化、预防糖尿病和抑制炎症[4-5]等方面具有重要作用。
MK-4的合成方法包括化学合成法和微生物发酵法。化学合成法生产MK-4具有挑战性,因为全反式构型的MK-4才具有生物活性[6]。微生物发酵法具有选择性生产全反式异构体的优势[7]。目前研究者已经在野生型Bacillus subtilis natto[8]、Flavobacterium sp.238-7-K3-15[9]、Pichia pastoris[10]菌株中对MK-4的合成进行研究。但是,这些菌株的代谢途径复杂,改造相对困难。然而,B.subtilis 168被普遍认为是食品安全级模式菌株,且具有生长速度快、遗传特性良好等优点,还具有合成生物学工具和专门的文库[11-12],因此,我们选择B.subtilis 168进行代谢途径的合成和调控。在前期研究中,我们通过采用模块途径工程策略提高了B.subtilis 168中MK-4的产量,但由于代谢途径固有的局限性,MK-4的产量仍然较低[13]。基于群体感应(quorum sensing,QS)的动态调控已被广泛应用[14],作为一种基本工具,在细胞密度变化的反应中微调基因表达,而无需添加昂贵的诱导物[15]。采用PhrQ-RapQ-ComA QS系统来动态控制枯草芽孢杆菌中MK-4的合成,提高MK-4的产量[16]。目前,关于微生物发酵法主要通过基因工程手段激活或改善胞内途径基因的表达以强化MK-4的生产,有关质膜稳态调控的报道相对较少。微生物的质膜起着保护屏障的作用,将细胞质和细胞外环境分开。在工业发酵条件下,菌株的生存在很大程度上取决于膜稳态,它涉及许多重要的生理功能,如信号转导、抗压力、能量代谢、溶质运输、细胞生长和生产[17]。因此,维持膜内稳态是提高工业生物过程生产力的有效途径。
工业发酵条件下,细胞面临各种压力条件,如pH值、极端温度、氧化、渗透压变化、溶剂和有毒代谢物[17],会对细胞生长产生负面影响并限制代谢产物的产生。膜损伤经常被认为是这种应力诱导的主要机制之一[18]。因此,本研究对B.subtilis BC04进行细胞膜稳态优化,通过整合分析改善细胞膜的完整性相关基因srfAD、pssA、clsA、groESL、tagO、guaA和dacA,流动性相关基因fabD、ypkP,渗透性相关基因fadR的缺失,提高MK-4的积累。在此基础上,在3 L发酵罐上分析MK-4的发酵过程,为进一步提升工业水平MK-4发酵性能奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
枯草芽孢杆菌B.subtilis 168为本实验室保存,BC04是经过基因改造获得的高产菌株[13, 16]。质粒pHT-XCR6和pcrF17 NM为本实验室保存[19]。
1.1.2 重组质粒的构建
以pcrF17 NM为模板PCR扩增载体获得pcrF17 NM-crRNA,整合基因融合片段与载体,运用一步克隆的方式构建重组质粒[19]。所用引物如表1所示。
表1 本文使用的引物
Table 1 Primers used in this study

引物名称引物序列(5′-3′)pssA-FGTGAATTACATCCCCTGTATGATTACGATAGGAAACpssA-RCTAATTCCATCTCCCAGACTCCAGGTTTTCTGCCGsrfAD-FATGAGCCAACTCTTCAAATCATTTGATGCGTCGGAAAAAACACAGCTCATCTGTTTTCCsrfAD-RTCACGGTTGAATGATCGGATGCTGATTCAAGATCGCAAAAATCCGTTCTGCGACTTCTTGroELS-FTTGTTAAAGCCATTAGGTGATCGCGTTGTCATTGAGroELS-RTTACATCATTCCACCCATACCGCCCATGCCGCCCAfabD-FATGAGTAAGATTGCATTTTTATTCCCGGGTCAGGGATCACAATTTATCGGCATGGGAAAfabD-RTTAAGCATTATCATTCTCCTCCTTAAGCGTTTGAATTGCCAGCTCGATCGTTTCCGGATypkP-FTTGGTTCGCTACAGCCTTCTAGTGGTTTATATTGTGypkP-RTTATGCACGTAATTGTTTTTCATTGGCAGGTATATAAGCFadR-FTTGAAGCAAAAACGGCCAAAGTATATGCAGATTATTGATGCAGCAGTAGAAGTCATTGCFadR-RTTACTTATTGTGAATTCCGGATACCAATAATTCTAAAACGCTGTTTGAAAGCGCAACGATagO-FATGCTTGACGAACGCATGATTCGCATTGTTGTTGCGTTTATTGTCTCGCTGCTGACAGTTagO-RTTAATTCCTTTTCACCAGCCGTTTATAAAACTTTGTAAACGGCTTAAATTTTTCATTCAClsA-FGTGAGTATTTCTTCCATCCTTTTATCACTTTTTTTCATTTTAAATATTCTTTTGGCCATClsA-RTTATAAGATCGGCGACAACAGCCGCGAGACGGATTCTTTTATTCGAATCCACAACGGGCTuaA-FGTGAGTGCAGAGAAAAGCATGAATGTGAGTCGTGAATTCTCAGTTCAACAAATACATTCTuaA-RTTATCTTGCACCATCACCCGTCCAAACTACTTTACAAGTTTTTAACATAATTTTTAATTDacA-FTTGAACATCAAGAAATGTAAACAGCTACTGATGTCATTGGTTGTGTTAACTCTAGCTGTDacA-RTTAAAACCAGCCGGTTACCGTATCAACAATGCTTCCCCAAATTCCGGCAAAAAATCCGCBF01-AZFAGATTGTTTATTATAATCTTCCCGCGCBF01-AZRAATTGCGCGGGAAGATTATAATAAACABF01-P1TCGAAAGAACAAGCGGCGAGCACCTCGGCAGCCTTTTTACABF01-P2TGAAATTGTTATCCGCTCTTACTTCTCTTTTCCGGGTTTTCTTTTTGCTGAGTATGCGGGBF01-P3TAACCCGGAAAAGAGAAGTAAGAGCGGATAACAATTTCACACAGGAAACAGCBF01-P4GGCTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCTATCACTBF01-P5CGGTACCATTATAGGTAAGAGAGGAATGTACACATGAGCCAACTCTTCAAATCATTTGATGCGTCGGAAAAAACACAGCTBF01-P6GATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTCACGGTTGAATGATCGGATGCTGATTCAAGATCGCAABF01-P7GCAGAATAACTTGTCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGBF01-P8-TAGTTACATGATTTTTTCTGAAGGTGAGGTGGTTCTCGTGAAGAAGCBF02-P9CATACAGGGGATGTAATTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCBF02-P10GGTAAGAGAGGAATGTACACATGAATTACATCCCCTGTATGATTACGATAGGAAACTTCATTTGCGGBF02-P11GGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGCTAATTCCATCTCCCAGACTCCAGGTTTTCBF02-P12GCAGAATAACTTGTCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGBF03-P13GGATGGAAGAAATACTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCTABF03-P14GGTAAGAGAGGAATGTACACATGAGTATTTCTTCCATCCTTTTATCACTTTTTTTCATTTTAAATATTCTTTTGGCCBF03-P15GATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTATAAGATCGGCGACAACAGCCGCGAGACGGABF03-P16GCAGAATAACTTGTCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGAATATCGTCTGTCBF04-P17CGATCACCTAATGGCTTTAACATGTGTACATTCCTCTCTTACCTATAATGGTACCBF04-P18GGTAAGAGAGGAATGTACACATGTTAAAGCCATTAGGTGATCGCGTTGTCABF04-P19GACTGCCGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTACATCATTCCACCCATACCGCCCATGCCGBF04-P20CAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGAATATCGBF05-P21CGTTCGTCAAGCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCTBF05-P22GGTAAGAGAGGAATGTACACATGCTTGACGAACGCATGATTCGCATTGTTG
续表1

引物名称引物序列(5′-3′)BF05-P23AGACTGCCGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTAATTCCTTTTCACCAGCCGTTTATAAAACTTTGTAAACGGCTBF05-P24TCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGAATATCGBF06-P25GCTTTTCTCTGCACTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCTBF06-P26GGTAAGAGAGGAATGTACACATGAGTGCAGAGAAAAGCATGAATGTGAGTCBF06-P27GGAAAAAAGACTGCCGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTATCTTGCACCATCACCCGTCCAAACTACTTTBF06-P28TGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGBF07-P29GTAGCTGTTTACATTTCTTGATGTTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCBF07-P30GGTAAGAGAGGAATGTACACATGAACATCAAGAAATGTAAACAGCTACTGATGTCATTGGTTGTGBF07-P31CGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTAAAACCAGCCGGTTACCGTATCAACABF07-P32ATAACTTGTCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGBF08-P33CTTACTCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCTATCACBF08-P34GCGGTACCATTATAGGTAAGAGAGGAATGTACACATGAGTAAGATTGCATTTTTATTCCCGGGTCAGGGBF08-P35CCGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTAAGCATTATCATTCTCCTCCTTAAGCGTTTGAATTGCCBF08-P36TTGTCAGACTGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGAATATCGTCBF09-P37GCTGTAGCGAACCATGTGTACATTCCTCTCTTACCTATAATGGTACCGCBF09-P38GGTAAGAGAGGAATGTACACATGGTTCGCTACAGCCTTCTAGTGGTTTATABF09-P39AAAAAAGACTGCCGGGATTTCCCGGCAGTCTGACAAGTTATTCTGCAATAGTTATGCACGTAATTGTTTTTCATTGGCAGGTATATAAGCTBF09-P40TGCCGGGAAATCCCGGCAGTCTTTTTTCCATTAAAACACGGCGGTTTTTATGTTTATTATAATCTTCCCGCGCGAATATCGTCBF10-P41AGATTTTTTAAAATAGAGATAGATAAGBF10-P42AATTCTTATCTATCTCTATTTTAAAAABF10-P43GATCCATTCCGCTCCGTCATCCTGAATCTTTBF10-P44AGTCACAGGTATCCAAAATTGCCACTGTGACAACTTGGGTGATGAATGACCAABF10-P45GTTGTCACAGTGGCAATTTTGGATACCTGTGACTGGTGGTAGBF10-P46ACAAACCGACGCTCTTTCCTGGCGCACCGABF11-P47CTAGAAGGCTGTAGCGAACCATGCCGTGTTTTAATGGAAAAAAGACTGCCGGGBF11-P48TTAAAACACGGCATGGTTCGCTACAGCCTTCTAGTGGTTTATATTGTG
1.1.3 主要试剂
大豆蛋白胨、蛋白粉、酵母粉,Oxoid公司;MK-4标品,Sigma-Aldrich公司;其他试剂来自国药试剂。
1.1.4 培养基
LB培养基 (g/L):蛋白胨 10,酵母膏 5,NaCl 10。加入15~20 g/L琼脂制作固体培养基,于121 ℃ 下灭菌20 min。
发酵培养基 (g/L):葡萄糖 50,大豆蛋白胨 50,甘油50,KH2PO4 0.6。于115 ℃下灭菌20 min。
上罐发酵培养基 (g/L):大豆蛋白胨 50,甘油50,KH2PO4 0.6,补料瓶中葡萄糖 500。于115 ℃下灭菌20 min。
1.1.5 仪器与设备
恒温摇床,上海知楚仪器有限公司;722 s可见分光光度计,上海棱光技术有限公司;葡萄糖-乳酸生物传感器分析仪,深圳西尔曼科技有限公司;3 L发酵罐,上海迪比尔生物工程有限公司;台式高速离心机,德国Eppendorf公司;安捷伦1260液相色谱仪,美国安捷伦公司;恒温培养箱,上海跃进医疗器械厂。
1.2 实验方法
1.2.1 培养条件
种子培养:挑取活化的单菌落于液体种子培养基中,于37 ℃,220 r/min培养12 h。
摇瓶发酵培养:培养好的种子液以10%的接种量接入装有发酵培养基的摇瓶中,在40 ℃,220 r/min的摇床上进行发酵培养。
发酵罐培养:以10%接种量将培养好的种子液转接到3 L发酵罐中,总装液量为1.5 L,搅拌转速500 r/min,通气量2 g/(L·h),500 g/L葡萄糖溶液调节控制葡萄糖质量浓度在4~10 g/L,40 ℃下培养。发酵过程中多次取样测定菌株的发酵参数。
1.2.2 分析方法
取适当体积的发酵液,加入2 mL萃取剂,萃取剂为V(2-丙醇)∶V(正丁烷)=1∶2[20]。加入去离子水将菌液稀释至合适的倍数,测定OD600值。细胞干重(dry cell weight,DCW)与吸光度之间的关系为DCW=0.35×OD600;利用葡萄糖-乳酸生物传感器分析仪对发酵液中葡萄糖含量进行测定;利用高效液相色谱对MK-4含量进行检测分析。其色谱检测条件为:有机酸柱型号为C18 ODS column (5 μm,250 mm×4.6 mm),紫外检测波长254 nm,柱温箱温度为40 ℃,进液量为10 μL,流速为1 mL/min,流动相为V(甲醇)∶V(二氯甲烷)=9∶1,吸取萃取上清液用于样品分析;采用Graph Pad Prism 8对单因素实验结果进行显著性分析,统计显著性表示如下,*为P<0.05,**为P<0.01。
2 结果与分析
2.1 增强细胞膜的完整性对MK-4合成和细胞生长的影响
膜完整性的丧失与生存能力的降低有关,它可以作为一个标记区分活细胞和死细胞[21]。膜的完整性受饱和、不饱和脂酰基链比例[22]、磷脂头基团的分布、麦角甾醇和鞘脂含量、膜蛋白的活性等因素的影响[23]。因此,膜的完整性的提高可通过膜脂组成、膜蛋白、胁迫耐受性等方面采取措施。由于合成MK-4发酵周期长,细胞容易裂解,因此加强细胞膜完整性相关基因的表达对MK-4的合成尤为重要[24-25]。膜蛋白相关基因srfAD,膜脂质相关基因pssA和clsA,细胞抵抗不良外界环境的相关基因groESL、tagO、guaA和dacA,加强这些基因的表达(图1-a),并通过HPLC对菌株BF01~BF07的MK-4产量进行检测,分析比较MK-4生产菌株的产量变化。
由图1-b可知,7株不同菌株BF01~BF07的MK-4最终产量有所差异。其中,BF01的MK-4产量相对最高,达到(203.11±3.23) mg/L,MK-4生产强度为1.21 mg/(L·h)(表2)。说明膜蛋白相关基因srfAD对于膜的完整性和MK-4的合成有一定的影响。膜蛋白包括转运、通道、受体、酶和结构域-锚定域等蛋白,参与积累和传递能量,膜蛋白的表达可以增强膜的完整性[26]。因此,膜蛋白SrfAD的表达有助于加强膜的完整性和强化MK-4的生产。

a-整合基因获得对应的菌株BF01~BF07;
b-菌株BF01~BF07的MK-4产量的变化
图1 膜完整性相关基因的整合及对MK-4产量的影响
Fig.1 Integration of membrane integrity-related
genes and its effect on MK-4 production
表2 不同菌株发酵参数的对比
Table 2 Comparison of fermentation parameters of
different strains
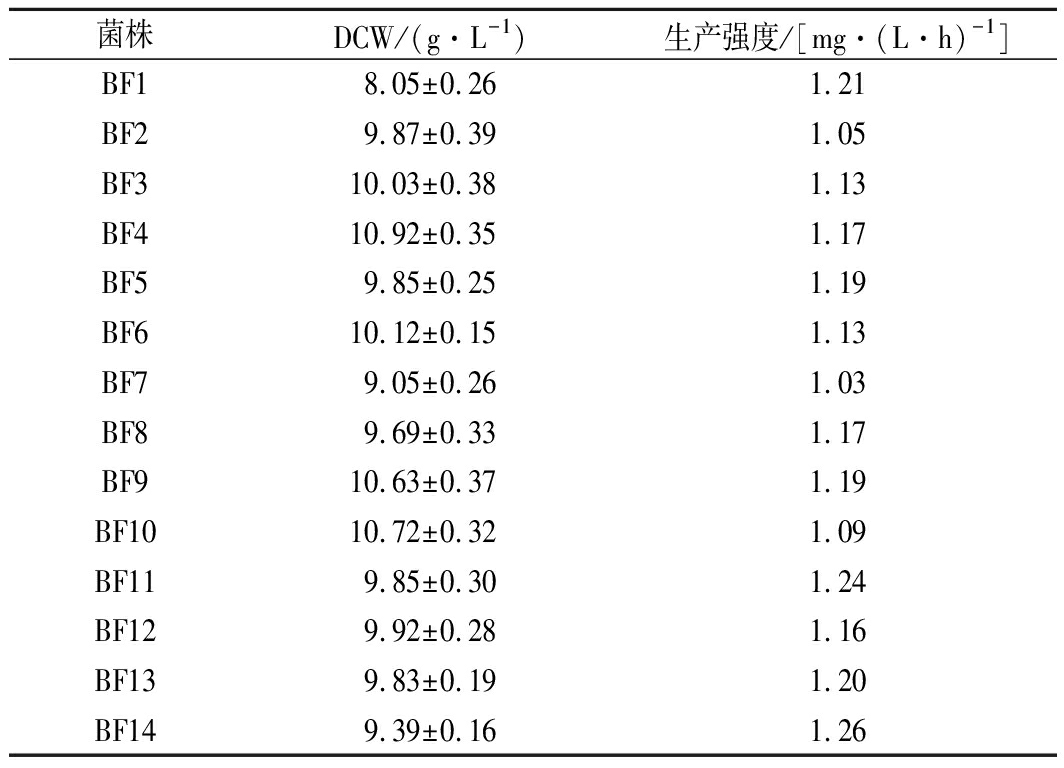
菌株DCW/(g·L-1)生产强度/[mg·(L·h)-1]BF18.05±0.261.21BF29.87±0.391.05BF310.03±0.381.13BF410.92±0.351.17BF59.85±0.251.19BF610.12±0.151.13BF79.05±0.261.03BF89.69±0.331.17BF910.63±0.371.19BF1010.72±0.321.09BF119.85±0.301.24BF129.92±0.281.16BF139.83±0.191.20BF149.39±0.161.26
2.2 增强细胞膜的流动性对MK-4合成和细胞生长的影响
微扰膜的流动性是影响工业菌株生存能力的一个常见问题和挑战[27]。膜流动性是由膜上直链不饱和脂肪酸的长度和程度决定,因此,调节膜的流动性可通过调节直链脂肪酸结构、鞘脂和甾醇含量、非直链脂肪酸的合成。基因fabD的表达可以调节脂肪酸链的结构,增强膜脂酰基链的长度。基因ypkP的表达可以上调膜鞘脂含量,以适应不良环境。如图2-a所示,分别加强这2个基因的表达,并通过HPLC对菌株MK-4的最终产量进行检测,分析BF08和BF09菌株产量的变化。
由图2-b可知,在以上2株不同菌株中,MK-4最终产量有所差异。BF08的MK-4产量达到(197.23±1.26) mg/L,MK-4生产强度为1.17 mg/(L·h)。BF09的MK-4产量相对最高,达到(200.85±1.6) mg/L,MK-4生产强度为1.19 mg/(L·h)。因此,基因fabD和ypkP的表达,有利于MK-4产量的积累,且基因ypkP的表达更有利于MK-4产量的提高。

a-整合基因获得对应的菌株BF08~BF09;
b-菌株BF08~BF09的MK-4产量的变化
图2 膜流动性相关基因的整合及对MK-4产量的影响
Fig.2 Integration of membrane fluidity-related genes and its
effect on MK-4 production
2.3 调节膜的渗透性对MK-4合成和细胞生长的影响
调节膜的渗透性包括调节离子、营养物质和有毒物质的跨膜[28]。微生物维持膜的渗透性通过膜脂质的稳态,膜蛋白的作用,以及调节细胞内的能量系统用于膜组装和允许底物跨膜移动。脂肪酸降解调节因子的缺失,可增加膜不饱和脂肪酸的含量,进而使膜对有机溶剂渗透性下降,从而提高菌株的耐受性[29]。
基因fadR的缺失,可以使菌株耐溶性增强,饱和脂肪酸和不饱和脂肪酸的比例提高[29]。由图3可知,基因fadR缺失后,BF10菌株的产量上升,达到(183.35±1.66) mg/L,MK-4生产强度为1.09 mg/(L·h)。因此,调节B.subtilis BC04脂肪酸的比例,可实现调节细胞膜的渗透性,促进MK-4的产量的提高。

图3 基因fadR对菌体MK-4产量的影响
Fig.3 Effects of gene fadR on the MK-4 production
2.4 脂膜稳态相关基因的组合对MK-4合成和细胞生长的影响
近年来膜稳态工程的发展表明,膜稳态工程方法提高工业菌株的生理功能,是一种提高生产效率的有效方式。通过对上述影响B.subtilis细胞膜完整性、流动性和渗透性相关基因的分析,我们将上述较优的特征进行组合,如图4所示,并通过发酵分析找出能合成MK-4 产物的最优菌株。
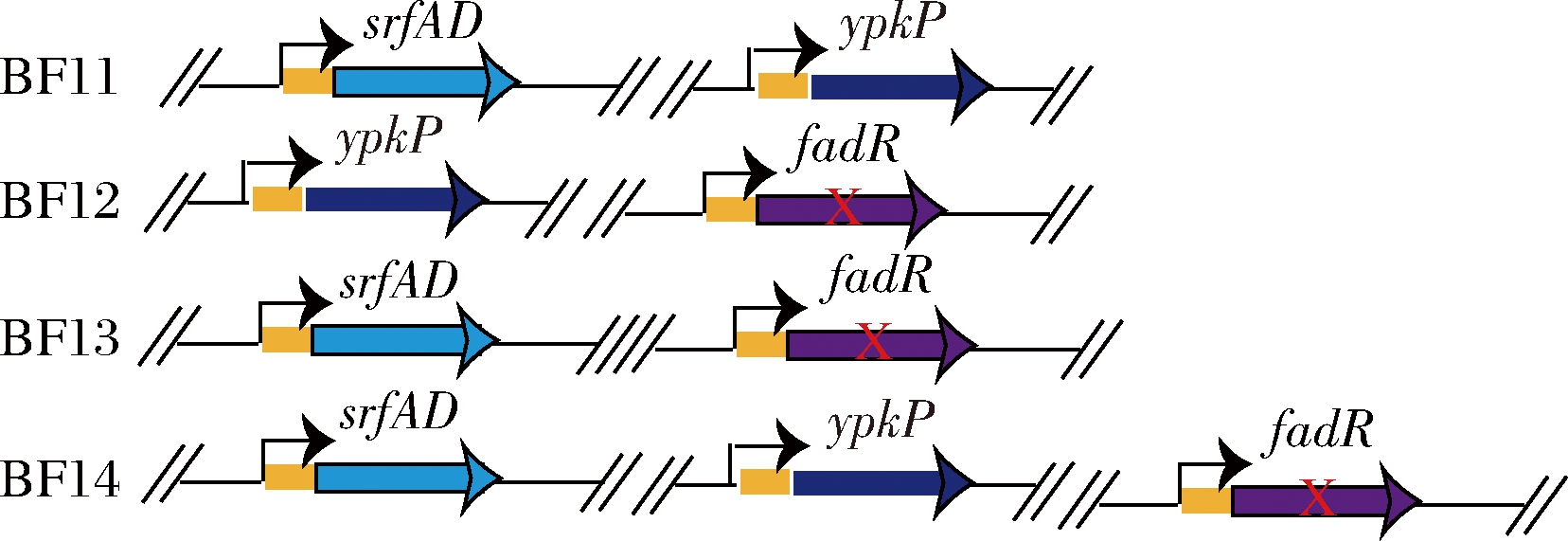
图4 基因组装获得对应的菌株BF11~BF14
Fig.4 The corresponding strains BF11~BF14 obtained by
assembly of genes
由图5可知,在以上4株不同菌株中,MK-4最终产量有所差异。其中,BF14的MK-4产量相对最高,达到(213.80±2.16) mg/L,MK-4生产强度为1.26 mg/(L·h)。因此,BF14可作为最优菌株用于进一步的分析。
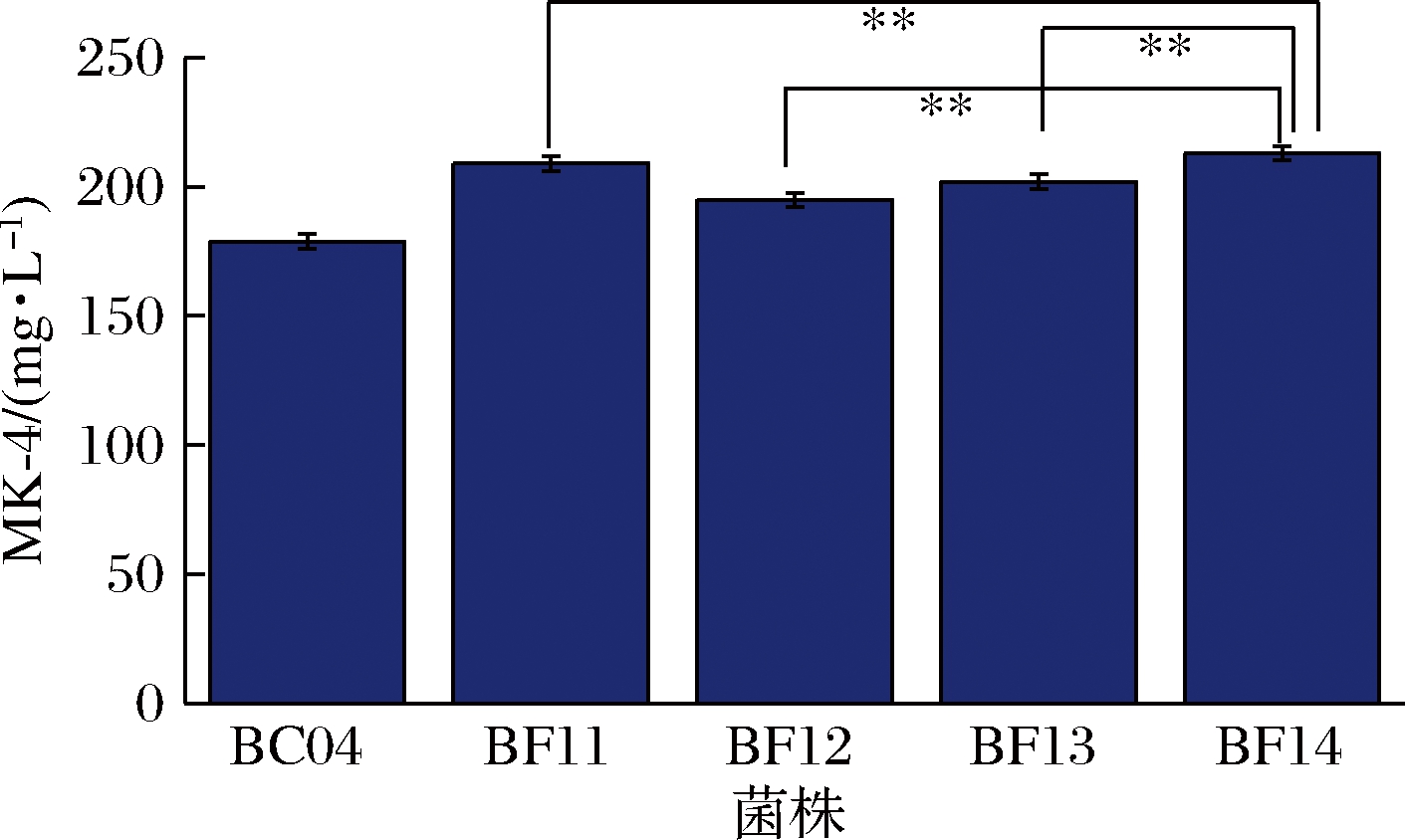
图5 基因的组装对菌体MK-4产量的影响
Fig.5 Effects of gene assembly on the MK-4 production
注:**表示差异极显著(P<0.01)
2.5 重组枯草芽孢杆菌的3 L罐连续补料发酵
在摇瓶培养的基础上,将工程菌株BF14在3 L发酵罐中进行补料分批培养。由图6-a可知,在发酵第1天,发酵液中检测到MK-4,且上清液中MK-4的含量高于细胞内的含量。在分批补料培养条件下,葡萄糖质量浓度控制在4~10 g/L,培养第2天和第4 天分别在发酵罐中添加1%(体积分数)甘油和2%(质量分数)大豆蛋白胨。细胞培养30 h时密度达到29.5(OD600),之后下降。在pH自然状态下,第5天MK-4的最大产量达到(249.65±2.34) mg/L(图6-b),生产强度达到2.08 mg/(L·h)。上述结果表明,葡萄糖质量浓度控制的补料分批培养有利于菌株BF14生产MK-4,为MK-4的规模化生产提供了依据。

a-3 L发酵罐分批发酵过程图;b-MK-4产量分析图
图6 BF14在3 L罐中补料分批发酵
Fig.6 Batch fermentation of BF14 in 3 L fermentor
3 结论
MK-4作为一种重要的维生素,广泛应用于制药、日化、食品以及农业等领域[5]。目前主要通过基因工程手段改善细胞中分支代谢途径、群体响应调控细胞生长与产物形成,有关脂膜稳态的优化与控制的报道相对较少。本文从细胞膜稳态方面进行分析,首先分析了细胞膜的完整性,包括膜蛋白相关基因srfAD,膜脂质相关基因pssA和clsA,细胞抵抗不良外界环境的相关基因groESL、tagO、tuaA和dacA。加强这些基因的表达,摇瓶水平发酵7 d MK-4最高产量为(203.11±3.23) mg/L。膜流动性相关基因ypkP的表达上调膜鞘脂含量,MK-4产量达到(200.85±1.6) mg/L。调控脂质介导的调节因子fadR的缺失,提高了菌株MK-4的产量,达到(183.35±1.66) mg/L。较未优化前分别提高了13.53%、12.27%和2.49%。通过组合优化,MK-4最高产量为(213.80±2.16) mg/L,较BC04提高了19.51%。在此基础上进行3 L发酵罐的放大发酵并对过程中的发酵动力学参数进行了分析。维持葡萄糖质量浓度为4~10 g/L,最终MK-4产量、生产强度分别达到(249.65±2.34) mg/L、2.08 mg/(L·h)。已有的研究表明,枯草芽孢杆菌有害物质的积累是影响MK-4代谢合成的原因之一。近年来,关于CRISPRI的基因编辑方法日趋成熟[30]。在后续研究中,通过建立CRISPRI系统并弱化潜在的代谢产物合成相关基因表达,有望进一步提升MK-4积累水平。本研究相关脂膜优化与补料策略为利用枯草芽孢杆菌发酵生产MK-4的放大实验提供了理论与技术参考。
[1] VERMEER C.Vitamin K:The effect on health beyond coagulation-an overview[J].Food Nutrition Research, 2012,56.DOI:10.3402/fnr.v56io.5329.
[2] IKARI Y, TORII S, SHIOI A, et al.Impact of menaquinone-4 supplementation on coronary artery calcification and arterial stiffness:An open label single arm study[J].Nutrition Journal, 2016, 15(1):53.
[3] CHATRON N, HAMMED A, BENO T E, et al.Structural insights into phylloquinone (vitamin K1), menaquinone (MK4, MK7), and menadione (vitamin K3) binding to VKORC1[J].Nutrients, 2019, 11(1):1-20.
T E, et al.Structural insights into phylloquinone (vitamin K1), menaquinone (MK4, MK7), and menadione (vitamin K3) binding to VKORC1[J].Nutrients, 2019, 11(1):1-20.
[4] HARSHMAN S G, SHEA M K.The role of vitamin K in chronic aging diseases:Inflammation, cardiovascular disease, and osteoarthritis[J].Current Nutrition Reports, 2016, 5(2):90-98.
[5] VOS M, ESPOSITO G, EDIRISINGHE J N, et al.Vitamin K2 is a mitochondrial electron carrier that rescues pink1 deficiency[J].Science, 2012, 336(6 086):1 306-1 310.
[6] TARENTO T D C, MCCLURE D D, TALBOT A M, et al.A potential biotechnological process for the sustainable production of vitamin K1[J].Critical Reviews in Biotechnology, 2019, 39(1):1-19.
[7] SHEARER M J, NEWMAN P.Recent trends in the metabolism and cell biology of vitamin K with special reference to vitamin K cycling and MK-4 biosynthesis[J].Journal of Lipid Research, 2014, 55(3):345-362.
[8] SATO T, YAMADA Y, OHTANI Y, et al.Efficient production of menaquinone (vitamin K2) by a menadione-resistant mutant of Bacillus subtilis[J].Journal of Industrial Microbiology Biotechnology, 2001, 26(3):115-120.
[9] TANI Y, TAGUCHI H.Extracellular production of menaquinone-4 by a mutant of Flavobacterium sp.238-7 with a detergent-supplemented culture[J].Journal of Bioscience and Bioengineering,1989, 67(2):102-106.
[10] SUN X W, LIU H, WANG P, et al.Construction of a novel MK-4 biosynthetic pathway in Pichia pastoris through heterologous expression of HsUBIAD1[J].Microbial Cell Factories, 2019, 18(1):169.
[11] POPP P F, DOTZLER M, RADECK J, et al.The Bacillus BioBrick Box 2.0:Expanding the genetic toolbox for the standardized work with Bacillus subtilis[J].Scientific Reports, 2017, 7:15058.
[12] YUAN P H, CUI S X, LIU Y F, et al.Metabolic engineering for the production of fat-soluble vitamins:Advances and perspectives[J].Applied Microbiology and Biotechnology, 2020, 104(3):935-951.
[13] YUAN P H, CUI S X, LIU Y F, et al.Combinatorial engineering for improved menaquinone-4 biosynthesis in Bacillus subtilis[J].Enzyme and Microbial Technology, 2020, 141:1-9.
[14] LYU Y Q, QIAN S, DU G C, et al.Coupling feedback genetic circuits with growth phenotype for dynamic population control and intelligent bioproduction[J].Metabolic Engineering, 2019, 54:109-116.
[15] LYON G J, NOVICK R P.Peptide signaling in Staphylococcus aureus and other Gram-positive bacteria[J].Peptides, 2004, 25(9):1 389-1 403.
[16] YUAN P H, SUN G Y, CUI S X, et al. Engineering a ComA Quorum-Sensing circuit to dynamically control the production of Menaquinone-4 in Bacillus subtilis.[J]. Enzyme and Microbial Technology, 2021, 147:109782.
[17] LING H, TEO W, CHEN B, et al.Microbial tolerance engineering toward biochemical production:From lignocellulose to products[J].Current Opinion in Biotechnology, 2014, 29:99-106.
[18] FLETCHER E, PILIZOTA T, DAVIES P R, et al.Characterization of the effects of n-butanol on the cell envelope of E.coli[J].Applied Microbiology and Biotechnology, 2016, 100(22):9 653-9 659.
[19] WU Y K, LIU Y F, LYU X Q, et al.CAMERS-B:CRISPR/Cpf1 assisted multiple-genes editing and regulation system for Bacillus subtilis[J].Biotechnology and Bioengineering, 2020, 117(6):1 817-1 825.
[20] CUI S X, LYU X Q, WU Y K, et al.Engineering a Bifunctional Phr60-Rap60-Spo0A quorum-sensing molecular switch for dynamic fine-tuning of menaquinone-7 synthesis in Bacillus subtilis[J].ACS Synthetic Biology, 2019, 8(8):1 826-1 837.
[21] SANDOVAL N R, PAPOUTSAKIS E T.Engineering membrane and cell-wall programs for tolerance to toxic chemicals:Beyond solo genes[J].Current Opinion in Microbiology, 2016, 33:56-66.
[22] FANG Z J, CHEN Z X, WANG S, et al.Overexpression of OLE1 enhances cytoplasmic membrane stability and confers resistance to cadmium in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology, 2017, 83(1):1-11.
[23] NAKAYAMA T, ZHANG-AKIYAMA Q M.pqiABC and yebST, putative mce operons of Escherichia coli, encode transport pathways and contribute to membrane integrity[J].Journal of Bacteriology, 2017, 199(1):e00606-16.
[24] QI Y, LIU H, CHEN X, et al.Engineering microbial membranes to increase stress tolerance of industrial strains[J].Metabolic Engineering, 2019, 53:24-34.
[25] CAO H, VAN HEEL A J, AHMED H, et al.Cell surface engineering of Bacillus subtilis improves production yields of heterologously expressed α-amylases[J].Microbial Cell Factories, 2017, 16:56.
[26] CHUNG J, TORTA F, MASAI K, et al.INTRACELLULAR TRANSPORT.PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER-plasma membrane contacts[J].Science, 2015, 349(6 246):428-432.
[27] MYKYTCZUK N C, TREVORS J T, LEDUC L G, et al.Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress[J].Progress Biophysics Molecular Biology, 2007, 95(1-3):60-82.
[28] DONG S J, YI C F, LI H.Changes of Saccharomyces cerevisiae cell membrane components and promotion to ethanol tolerance during the bioethanol fermentation[J].International Journal of Biochemistry Cell Biology, 2015, 69:196-203.
[29] OH H Y, LEE J O, KIM O B.Increase of organic solvent tolerance of Escherichia coli by the deletion of two regulator genes, fadR and marR[J].Applied Microbiology and Biotechnology, 2012, 96(6):1 619-1 627.
[30] WU Y K, CHEN T C, LIU Y F, et al.Design of a programmable biosensor-CRISPRi genetic circuits for dynamic and autonomous dual-control of metabolic flux in Bacillus subtilis[J].Nucleic Acids Research, 2020, 48(2):996-1 009.