衰老是指随年龄增长,细胞衰老累及组织及器官,致使衰老相关疾病发生的过程[1]。目前,随着人类平均寿命的增长,心血管疾病正在成为西方国家的第一大死因,在中国人群中也广泛存在[2-3]。衰老增加了罹患心血管疾病的风险,其本身也被认为是发展为心脏病的主要决定要素,其中心肌细胞衰老是引起心血管疾病的重要原因之一[4-5]。因此,延缓心肌细胞衰老对改善心血管疾病至关重要。
大豆是一种人类和动物优质蛋白质的主要来源,其具有高蛋白、无胆固醇的特点[6]。大豆中含有多种活性成分,包括异黄酮、多肽、维生素E等。金雀异黄酮(genistein, Gen),又名染料木素或染料木黄酮,是大豆异黄酮中的主要有效成分,约占大豆中异黄酮总量的60%[7-8]。此外,Gen亦分布于绿豆等蝶形花亚科的豆科植物中[9]。有研究表明,Gen具有抗肿瘤、类雌激素、降血压和抗脂质氧化等多种功能,但对其抗衰老作用研究较少[10-12]。因此,本实验采用叔丁基过氧化氢(tert-butyl hydroperoxide, TBHP)诱导H9c2细胞,构建衰老模型,观察Gen对衰老H9c2细胞的影响,为Gen在临床中防治心肌细胞衰老引起的心血管疾病的应用提供理论依据。
1 材料与试剂
1.1 实验材料
大鼠心肌细胞H9c2细胞株,博士德生物工程有限公司;Gen,上海阿拉丁生化科技股份有限公司;TBHP,上海迈瑞尔化学技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 [3-(4,5)-dimethylthiahiazo(-2)-3,5-diphenytetrazoliumromide,MTT],上海源叶生物科技有限公司;DMEM(Dulbecco′s modified Eagle′s medium)培养液、胰酶,美国Gibco公司;胎牛血清(fetal bovine serum,FBS),美国Gemini 公司;超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒、总抗氧化能力(total antioxidant capacity, T-AOC)检测试剂盒、过氧化氢酶(catalase, CAT)检测试剂盒、丙二醛(malondialdehyde, MDA)检测试剂盒、总谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒,碧云天生物技术有限公司;β-半乳糖苷酶(senescence-associated β-galactosidase, SA-β-gal)检测试剂盒,上海杰美基因医药科技有限公司;高效RIPA组织/细胞裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),中国Solarbio公司;细胞磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)抗体、蛋白激酶B(protein kinase B, AKT)抗体、p-AKT抗体、细胞外调节蛋白激酶(extracellular regulatory protein kinase1/2, ERK1/2)抗体、p-ERK1/2抗体、P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase, P38)抗体、Kelch样环氧氯丙烷相关蛋白-1(Kelch-like epichlorohydrin-related protein-1, Keap1)抗体,美国Santa Cruz公司;P53抗体、核因子E2相关因子(nuclear factor erythroid-2-related factor 2, Nrf2)抗体、血红素氧合酶1(heme oxygenase 1, HO-1)抗体、p-PI3K抗体,美国Abcam公司;P21抗体、p-P38抗体、c-Jun 氨基端激酶(c-jun amino-terminal kinase, JNK)抗体、p-JNK抗体、β-actin抗体,美国Cell Signaling公司;羊抗鼠二抗、羊抗兔二抗,纳川科技有限公司。
1.2 仪器与设备
RT-2100酶标仪、CO2 培养箱,美国Bio-Tek公司;低温高速离心机,美国科俊电器公司;垂直板电泳仪、迷你转印电泳仪,北京六一生物科技有限公司;UVP 凝胶成像仪,美国UVP公司。
1.3 实验方法
1.3.1 药品配制
Gen溶于二甲基亚砜(dimethyl sulfoxide,DMSO)配制成100 mmol/L原液,-20 ℃保存。实验中以培养液作为稀释液,制备到相应浓度(DMSO终体积分数<0.1%)。
1.3.2 细胞培养
H9c2细胞常规培养于培养液(含有10%FBS和1%双抗的DMEM培养液)中,置于37 ℃、5%CO2饱和湿度的培养箱中培养, 每2~3 d换液1次,当细胞密度达80%~90%时进行细胞传代或冻存。
1.3.3 MTT实验
取对数期生长的H9c2细胞,以5×104个/mL接种于96孔板中培育, 分为空白组、对照组、模型组和Gen低、中、高剂量组(0.04、0.2、1 μmol/L),每组设4个复孔,每孔100 μL(Gen剂量根据前期实验结果确定)。细胞培育24 h后,空白组、对照组和模型组更换培养液,Gen组分别加入终浓度为0.04、0.2、1 μmol/L Gen的培养液孵育24 h,弃去培养液,PBS冲洗2遍。除空白组和对照组换成无血清培养液外,其余各组均加入含200 μmol/L TBHP的无血清培养液,作用2 h,所有组别换成培养液继续培养24 h。按每孔10 μL加入MTT溶液,置于培养箱中孵育。4 h后弃去上清液,每孔加入150 μL的DMSO,振荡5~10 min,于492 nm处测定OD值,按公式(1)计算细胞存活率:
细胞存活率![]()
(1)
式中:A2表示用药组OD值;A1表示对照组OD值;A0表示空白组OD值
1.3.4 SA-β-gal染色
将细胞随机分成对照组、模型组以及Gen低、中、高剂量组。以密度为1×105个/mL的细胞接种于6孔板中培养24 h,各组细胞处理同方法1.3.3。按照SA-β-gal染色试剂盒说明书进行操作,显微镜下观察,每孔随机选 3个视野拍照计数,蓝染细胞为SA-β-gal阳性细胞, 实验重复3次。按公式(2)计算SA-β-gal染色阳性率:
SA-β-gal染色阳性率![]()
(2)
1.3.5 比色法检测生化指标
将细胞按方法1.3.4进行分组及处理后,按照各试剂盒说明书检测细胞内T-AOC的水平和SOD、GSH-Px、CAT的活性及MDA含量。
1.3.6 western blotting实验
细胞分组及处理同方法1.3.4,弃去培养液,PBS冲洗2次,加入裂解液V(高效RIPA组织/细胞裂解液)∶V(PMSF)=100∶1,在冰上裂解30 min,将细胞收集于EP管中,匀浆器充分裂解细胞,4 ℃、12 000 r/min 离心20 min,取上清液为细胞全蛋白。BCA法对蛋白样品进行定量。按每孔30 μg的蛋白上样量进行SDS-PAGE后,转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,室温下5%脱脂奶粉封闭1 h,随后相应一抗4 ℃孵育过夜。次日二抗室温孵育1 h,用ECL显色液显色,UVP凝胶成像分析仪中采集条带图片,应用Image J软件进行灰度分析。
1.3.7 统计学分析
实验数据均采用均值±标准误![]() 表示,应用Graph Pad Prism 7.0统计软件进行数据分析,采用单因素方差分析进行多组间比较,采用SNK方法进行多重比较,以P<0.05为差异有统计学意义。
表示,应用Graph Pad Prism 7.0统计软件进行数据分析,采用单因素方差分析进行多组间比较,采用SNK方法进行多重比较,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 Gen对H9c2细胞存活率的影响
如表1所示,与对照组相比,模型组H9c2的细胞存活率明显降低(P<0.01);与模型组相比,Gen低、中、高剂量组H9c2细胞的存活率分别提高7.44%、15.28%和26.55%,提示Gen对H9c2细胞具有一定的保护作用。
表1 Gen对H9c2细胞存活率的影响
Table 1 Effects of Gen on H9c2 cell viability
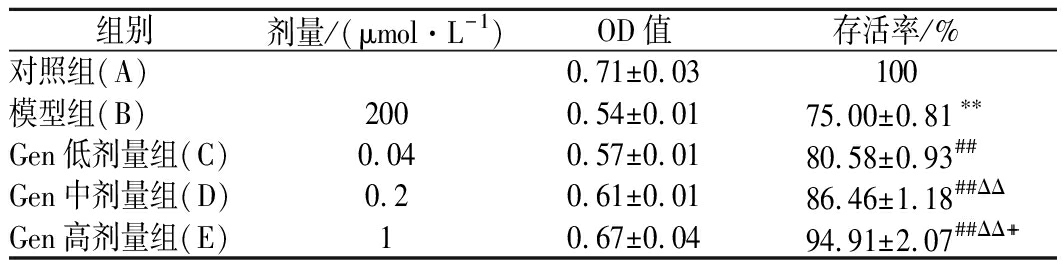
组别剂量/(μmol·L-1)OD值存活率/%对照组(A)0.71±0.03100模型组(B)2000.54±0.0175.00±0.81∗∗Gen低剂量组(C)0.040.57±0.0180.58±0.93##Gen中剂量组(D)0.20.61±0.0186.46±1.18##ΔΔGen高剂量组(E)10.67±0.0494.91±2.07##ΔΔ++
注:与对照组比较,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01;与Gen低剂量组比较,ΔΔ表示P<0.01;与Gen中剂量组比较,++表示P<0.01(下同)
2.2 Gen对H9c2细胞SA-β-gal阳性率的影响
如图1所示,与对照组比较,模型组H9c2细胞SA-β-gal阳性率显著增加(P<0.01),与模型组比较,Gen组H9c2细胞SA-β-gal阳性率分别下降36.09%、54.68%和58.33%(P<0.01),提示Gen可以抑制H9c2细胞因TBHP刺激而引起的衰老。

a-对照组;b-模型组;c-Gen低剂量组;d-Gen中剂量组;e-Gen高剂量组;f-SA-β-gal阳性率
图1 Gen对H9c2细胞SA-β-gal阳性率的影响(200×)
Fig.1 Effect of Gen on the positive staining of SA-β-Gal in H9c2 cells (200×)
注:与对照组比较,*表示P<0.05,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01;与Gen低剂量组比较,Δ表示P<0.05(下同)
2.3 Gen对H9c2细胞内T-AOC水平,SOD、GSH-Px和CAT活性及MDA含量的影响
如表2所示,与对照组相比,模型组H9c2细胞内T-AOC水平、SOD、GSH-Px、CAT的活性明显降低(P<0.01),MDA的含量明显升高(P<0.01);与模型组相比,Gen低、中、高剂量组H9c2细胞内的T-AOC水平分别升高60.96%、283.77%和378.51%(P<0.05),SOD活性分别升高35.55%、58.01%和112.91%(P<0.01),GSH-Px活性分别升高30.00%、76.00%和111.01%(P<0.05),CAT活性分别升高95.61%、156.58%和207.97%(P<0.01),MDA含量降低15.13%、41.72%和72.06%(P<0.01)。以上数据提示Gen可以提高H9c2细胞内的抗氧化能力,抑制TBHP诱导的氧化应激。
表2 Gen对H9c2细胞内T-AOC水平,SOD、GSH-Px和CAT活性及MDA含量的影响
Table 2 Effects of Gen on T-AOC, SOD, GSH-Px and CAT activities and MDA content in H9c2 cells

组别T-AOC/(mmol·g-1)SOD/(U·mg-1)GSH-Px/(U·mg-1)CAT/(U·mg-1)MDA/(nmol·mg-1)对照组12.72±0.7873.21±2.12134.14±10.6632.28±1.413.25±1.34模型组2.28±0.97∗∗26.41±2.18∗∗53.76±8.24∗∗8.66±2.27∗∗21.55±1.62∗∗Gen低剂量组3.67±0.95#35.80±2.26##69.89±8.38#16.94±3.31##18.29±2.04##Gen中剂量组8.75±0.28##41.73±1.51##94.62±13.26##22.22±2.63##12.56±1.63##Gen高剂量组10.91±1.49##56.23±2.56##113.44±12.98##26.67±2.21##6.02±1.71##
2.4 Gen对H9c2细胞内Keap1、Nrf2和HO-1蛋白表达的影响
如图2所示,与对照组相比,模型组H9c2细胞内Keap1的蛋白表达水平明显升高,Nrf2、HO-1蛋白表达水平明显降低(P<0.01);与模型组相比,Gen低、中、高剂量组细胞内Keap1蛋白表达水平分别降低13.01%、47.95%和44.18%(P<0.01),Nrf2、HO-1蛋白表达水平分别升高61.65%、93.76%、124.55%和12.57%、54.46%、100.51%(P<0.01),与MTT实验及SA-β-gal染色结果相吻合,提示Gen可以诱导Keap1/Nrf2信号通路的激活。

图2 Gen对H9c2细胞内Keap1、Nrf2和HO-1蛋白表达的影响
Fig.2 Effect of Gen on Keap1, Nrf2 and HO-1
protein expressions in H9c2 cells
2.5 Gen对H9c2细胞内P53、P21蛋白表达的影响
如图3所示,与对照组相比,模型组细胞内P53、P21蛋白表达水平明显升高(P<0.01);与模型组相比,Gen低、中、高剂量组细胞内P53、P21蛋白表达水平分别降低40.09%、32.09%、34.71%和57.72%、59.79%、73.28%(P<0.01)。表明Gen的延缓衰老作用可能与其抑制P53、P21蛋白表达有关。

图3 Gen对H9c2细胞内P53、P21蛋白表达的影响
Fig.3 Effects of Gen on the expressions of P53 and P21
proteins in H9c2 cells
2.6 Gen对H9c2细胞内PI3K/AKT信号通路相关蛋白表达的影响
如图4所示,与对照组相比,模型组细胞内PI3K与AKT蛋白磷酸化表达水平明显降低(P<0.05),与模型组相比,Gen低、中、高剂量组细胞内PI3K与AKT蛋白磷酸化水平分别升高8.17%、29.74%、34.03%和60.89%、111.26%、123.89%(P<0.05),提示Gen可以激活PI3K/AKT信号通路。

图4 Gen对H9c2细胞内PI3K/AKT信号通路关键
蛋白表达的影响
Fig.4 Effect of Gen on the expressions of PI3K/AKT
signaling pathway key proteins in H9c2 cells
2.7 Gen对H9c2细胞内MAPKs信号通路相关蛋白表达的影响
如图5所示,与对照组相比,模型组细胞内ERK1/2、P38及JNK蛋白磷酸化表达水平明显升高(P<0.01),与模型组相比,Gen低、中、高剂量组细胞内ERK1/2蛋白磷酸化水平分别降低17.69%、27.67%和59.30%(P<0.01),P38蛋白磷酸化水平分别降低19.14%、36.28%和49.75%(P<0.01),JNK蛋白磷酸化水平分别降低22.47%、27.70%和86.38%(P<0.01),提示Gen可以抑制MAPKs信号通路。

图5 Gen对H9c2细胞MAPKs信号通路关键蛋白表达的影响
Fig.5 Effect of Gen on the expressions of MAPKs signaling
pathway key proteins in H9c2 cells
3 讨论与结论
TBHP是一种可在多种细胞系中诱导氧化应激及细胞损伤的氧化剂,通过脂质过氧化、谷胱甘肽耗竭等发挥其作用,作用方式与H2O2相类似,但结构更稳定,现已被用于构建多种细胞衰老模型[13-15]。细胞发生衰老后,会出现细胞形态学改变、周期阻滞、衰老相关蛋白分子的变化等特点,其中SA-β-gal是经典的衰老标志物之一[16]。可通过检测SA-β-gal,鉴定细胞衰老水平。实验结果表明,TBHP刺激可导致SA-β-gal阳性率显著升高,而Gen处理后,SA-β-gal阳性率显著降低,提示Gen可延缓TBHP诱导的H9c2细胞衰老。
活性氧(reactive oxygen species, ROS)主要在线粒体中产生,而心肌细胞中线粒体含量较多且抗氧化酶(例如SOD、CAT)水平较低,致使心肌细胞易受到自由基的损害[17]。氧化应激是自由基过多造成的,机体可以通过调节抗氧化剂水平以抵御氧化应激,维持氧化剂/抗氧化剂的动态平衡[18-19]。T-AOC可以反映机体的总抗氧化能力;SOD、GSH-Px、CAT是组成机体抗氧化剂防御系统的重要抗氧化酶[20];MDA是最常用的脂质过氧化的间接指标,反映氧化应激水平[21]。为了解Gen对衰老H9c2细胞内抗氧化酶的影响,实验检测了上述指标。结果表明,Gen可以升高H9c2细胞内T-AOC的水平,SOD、GSH-Px、CAT的活性,降低H9c2细胞内MDA的含量,表明Gen可提高H9c2细胞的抗氧化能力,进而减缓细胞衰老。
为探究Gen延缓H9c2细胞衰老的具体作用机制,本实验通过western blotting检测Nrf2、Keap1、HO-1、P53、P21蛋白及PI3K/AKT、MAPKs通路相关蛋白的表达。Nrf2是细胞氧化应激的传感器之一,受Keap1负调节,在细胞质内Nrf2与Keap1以二聚体形式结合,当发生氧化应激,Nrf2被释放并转位到细胞核中,促进抗氧化基因HO-1等的转录和表达,抑制氧化应激[22]。当机体ROS增多,DNA的结构和功能出现损伤,肿瘤抑制因子P53可通过激活P21介导细胞周期停滞和衰老[23],同时P21还可与Keap1竞争结合Nrf2,阻止Nrf2的泛素化和降解[24]。研究发现,激活PI3K/AKT/Nrf2途径可减弱砷诱导的氧化性肾损伤[25];抑制MAPKs、激活Nrf2/HO-1信号通路可保护小鼠免受脂多糖/D-半乳糖诱导的急性肝损伤[26]。本实验结果显示,经Gen干预后,Keap1蛋白表达水平下降,Nrf2、HO-1蛋白表达水平上升;P53、P21蛋白表达水平降低,PI3K、AKT磷酸化蛋白表达水平升高,ERK1/2、P38、JNK磷酸化蛋白表达水平降低。此结果与前人报道相一致[25-26]。STRING数据库(https://string-db.org/)检索也与我们实验结果相吻合(图6)。

图6 Nrf2与P53、P21蛋白及PI3K/AKT、MAPKs
通路关键蛋白相关性
Fig.6 The correlation between Nrf2 and P53, P21 protein, and the
key proteins of PI3K/AKT, MAPKs pathways
综上所述,Gen可延缓H9c2细胞衰老,可能通过PI3K/AKT、MAPKs信号通路上调Nrf2发挥其抗衰老作用。从类雌激素作用到抗氧化、抗癌能力,越来越多的研究证实了Gen在不同疾病中的作用,且大豆价格低廉、获取便利,使Gen具有更好的发展前景。随着研究的不断深入,Gen在日常保健及疾病防治中发挥越来越大的作用。
[1] KIM E C, KIM J R.Senotherapeutics:Emerging strategy for healthy aging and age-related disease[J].BMB Reports, 2019, 52(1):47-55.
[2] MART N-FERN
N-FERN NDEZ B, GREDILLA R.Mitochondria and oxidative stress in heart aging[J].AGE, 2016, 38(4):225-238.
NDEZ B, GREDILLA R.Mitochondria and oxidative stress in heart aging[J].AGE, 2016, 38(4):225-238.
[3] CHEN W W, BOARD F T E,GAO R L, et al.Outline of the report on cardiovascular diseases in China, 2014[J].European Heart Journal Supplements Journal of the European Society of Cardiology, 2016, 18(Seppl F):2-11.
[4] APPIAH D, CAPISTRANT B D.Cardiovascular disease risk assessment in the united states and low-and middle-income countries using predicted heart/vascular age[J].Scientific Reports, 2017, 7(1):16673.
[5] ALFARAS I, DI GERMANIO C, BERNIER M, et al.Pharmacological strategies to retard cardiovascular aging[J].Circulation Research, 2016, 118(10):1 626-1 642.
[6] GANAI A A, FAROOQI H.Bioactivity of genistein:A review of in vitro and in vivo studies[J].Biomedicine & Pharmacotherapy, 2015, 76:30-38.
[7] 孙明明,王萍,李智媛,等.大豆活性成分研究进展[J].大豆科学,2018,37(6):975-983.
SUN M M, WANG P, LI Z Y,et al.Research progress of soybean active ingredients[J].Soybean Science, 2018,37(6):975-983.
[8] THANGAVEL P, PUGA-OLGU N A, RODR
N A, RODR GUEZ-LANDA J F, et al.Genistein as potential therapeutic candidate for menopausal symptoms and other related diseases[J].Molecules, 2019, 24(21):3 892.
GUEZ-LANDA J F, et al.Genistein as potential therapeutic candidate for menopausal symptoms and other related diseases[J].Molecules, 2019, 24(21):3 892.
[9] 隋雨婷,李乐乐,刘俊业,等.大豆异黄酮药理作用研究进展[J].吉林医药学院学报,2019,40(4):293-296.
SUI Y T, LI L L, LIU J Y,et al.Research progress of soy isoflavone′s extract and pharmacological effects[J].Journal of Jilin Medical University,2019,40(4):293-296.
[10] PINTOVA S, DHARMUPARI S, MOSHIER E, et al.Genistein combined with FOLFOX or FOLFOX-Bevacizumab for the treatment of metastatic colorectal cancer:Phase I/II pilot study[J].Cancer Chemotherapy and Pharmacology, 2019, 84(3):591-598.
[11] SUREDA A, SANCHES SILVA A, S NCHEZ-MACHADO D I, et al.Hypotensive effects of genistein:From chemistry to medicine[J].Chemico-Biological Interactions, 2017, 268:37-46.
NCHEZ-MACHADO D I, et al.Hypotensive effects of genistein:From chemistry to medicine[J].Chemico-Biological Interactions, 2017, 268:37-46.
[12] TULI H S, TUORKEY M J, THAKRAL F, et al.Molecular mechanisms of action of genistein in cancer:Recent advances[J].Frontiers in Pharmacology, 2019, 10:1 336.
[13] WEDEL S, MARTIC I, HRAPOVIC N, et al.tBHP treatment as a model for cellular senescence and pollution-induced skin aging[J].Mechanisms of Ageing and Development, 2020, 190:111318.
[14] MANU T M, ANAND T, KHANUM F.Attenuation of cytotoxicity induced by tBHP in H9c2 cells by Bacopa monniera and Bacoside A[J].Pathophysiology, 2018, 25(2):143-149.
[15] ![]() T, et al.The effect of tert-butyl hydroperoxide-induced oxidative stress on lean and steatotic rat hepatocytes in vitro[J].Oxidative Medicine & Cellular Longevity, 2014, 2014:752 506.
T, et al.The effect of tert-butyl hydroperoxide-induced oxidative stress on lean and steatotic rat hepatocytes in vitro[J].Oxidative Medicine & Cellular Longevity, 2014, 2014:752 506.
[16] HALL B M, BALAN V, GLEIBERMAN A S, et al.p16(Ink4a) and senescence-associated β-galactosidase can be induced in macrophages as part of a reversible response to physiological stimuli[J].Aging, 2017, 9(8):1 867-1 884.
[17] ZHANG Y T, AHMAD K A, KHAN F U, et al.Chitosan oligosaccharides prevent doxorubicin-induced oxidative stress and cardiac apoptosis through activating p38 and JNK MAPK mediated Nrf2/ARE pathway[J].Chemico Biological Interactions, 2019, 305:54-65.
[18] ZHANG H, DAVIES K J A, FORMAN H J.Oxidative stress response and Nrf2 signaling in aging[J].Free Radical Biology and Medicine, 2015, 88:314-336.
[19] JACOB K D, NOREN HOOTEN N, TRZECIAK A R, et al.Markers of oxidant stress that are clinically relevant in aging and age-related disease[J].Mechanisms of Ageing & Development, 2013, 134(3-4):139-157.
[20] GU Y H, ZHAO Z.Significance of the changes occurring in the levels of interleukins, SOD and MDA in rat pulmonary tissue following exposure to different altitudes and exposure times[J].Experimental and Therapeutic Medicine, 2015, 10(3):915-920.
[21] SCHMIDLIN C J, DODSON M B, MADHAVAN L, et al.Redox regulation by NRF2 in aging and disease[J].Free Radical Biology and Medicine, 2019, 134:702-707.
[22] HASSANEIN E H M, SAYED A M, HUSSEIN O E, et al.Coumarins as modulators of the Keap1/Nrf2/ARE signaling pathway[J].Oxidative Medicine & Cellular Longevity, 2020(2):1675957.
[23] WU D Y, PRIVES C.Relevance of the p53-MDM2 axis to aging[J].Cell Death & Differentiation, 2018, 25(1):169-179.
[24] CHEN W M, JIANG T, WANG H H, et al.Does Nrf2 contribute to p53-mediated control of cell survival and death[J].Antioxidants & Redox Signaling, 2012, 17(12):1 670-1 675.
[25] THANGAPANDIYAN S, RAMESH M, MILTONPRABU S, et al.Sulforaphane potentially attenuates arsenic-induced nephrotoxicity via the PI3K/Akt/Nrf2 pathway in albino Wistar rats[J].Environmental Science & Pollution Research International, 2019, 26(12):12 247-12 263.
[26] LI Z, FENG H H, WANG Y, et al.Rosmarinic acid protects mice from lipopolysaccharide/d-galactosamine-induced acute liver injury by inhibiting MAPKs/NF-κB and activating Nrf2/HO-1 signaling pathways[J].International Immunopharmacology, 2019, 67:465-472.