海藻是海洋生物的重要组成部分,形态多样,种类繁多。近年来,海藻作为功能性和生物活性化合物的优良来源越来越多地受到了科研工作者的关注。海藻多糖营养价值高,具有抗病毒、抗氧化、抗肿瘤等多种生理活性[1],现已成为食品、医药以及化妆品行业的研究重点。
长松藻(Codium cylindricum Holmes),绿藻门松藻目松藻科松藻属,别名柱海松,广泛分布于我国南海区域[2]。长松藻富含多糖、蛋白质和粗纤维等营养物质,是一种可食用大型绿藻[3]。但由于口感较差,长松藻至今未得到深入应用,仅用作于饲料和饵料[4]。事实上,研究表明长松藻含有抗凝血、抗血管的多糖类活性化合物,具有很好的开发价值和应用前景[5]。然而,天然多糖具有分子质量大,溶解性差的缺点[6],不利于精深加工与高值化利用。因此,对多糖进行适度降解处理,是目前国内外研究的一大热点。
多糖降解方法包括生物降解、物理降解及化学降解方法。生物降解法主要通过特异性酶解处理,条件温和且高效节能,但酶制剂价格昂贵,且特异性酶筛选具有难度[7]。常见的物理降解法有超声波降解、微波降解和辐射降解等,物理降解法高效环保,但有降解回收率低,设备成本高的缺点[8]。化学降解方法包括酸碱降解法、氧化降解法等,其中H2O2联合降解法操作简单,已受到广泛关注,目前主要有H2O2-维生素C及H2O2-Fe2+法,但同时也存在降解效率不高的问题[9]。ZHI等[10]采用超声辅助H2O2-Fe2+法制备低分子质量肝素,结果表明该复合降解法能在短时间内降低肝素的分子质量,释放羟基基团,显著增强肝素的抗凝血能力。姜慧等[11]研究发现超声辅助H2O2-维生素C法能够有效降解条斑紫菜多糖;降解处理后,条斑紫菜多糖分子质量显著降低,基本结构保持稳定,而体外抗氧化、胆酸盐结合以及细胞免疫活性提高。
随着生活节奏和饮食习惯的变化,糖尿病患病率日益提高,多糖作为具有降血糖功效的天然活性物质愈发受到关注[12]。降血糖功效是多糖的重要活性,与相对分子质量、单糖组成、高级结构等因素密切相关[13]。因此,本文以长松藻多糖(Codium cylindricum polysaccharides,CCP)为原料,采用复合降解方法,通过超声辅助H2O2-维生素C以及H2O2-Fe2+降解法,制备长松藻降解多糖,并探究多糖的理化性质、高级结构以及降血糖活性,以期为CCP的开发应用提供理论支持,促进长松藻资源的充分利用。
1 材料与方法
1.1 材料与试剂
长松藻,汕头南澳岛;α-淀粉酶、α-葡萄糖苷酶,合肥市博美生物科技有限责任公司;木瓜蛋白酶,广州市齐云生物技术有限公司;透析袋(Mw 1 000、Mw 7 000),广州华屿欣实验器材有限公司;抗坏血酸、三氟乙酸(trifluoroacetic acid,TFA)、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone,PMP)、甲醇、磷酸二氢钠、磷酸氢二钠、二硝基水杨酸(dinitrosalicylic acid,DNS)等其他试剂均为国产分析纯。
1.2 仪器与设备
BS224S分析天平,美国Sartorius公司;XT-500A型粉碎机,金华永康红太阳机电有限公司;Milli-Q超纯水机,美国Millipore公司;HWS24热恒温水浴锅,上海一恒科学仪器有限公司;Alpha1-4冷冻干燥机,德国Christ有限公司;ISI26 pH计,上海仪迈仪器科技有限公司;IRE-5220A旋转蒸发器,上海亚荣生化仪器厂;G-100S(800 W、40 kHz)超声波清洗机,深圳市歌能清洗设备有限公司;AvantiJ26XP高速离心机,德国Sigma公司;Synergy全功能酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 多糖提取
CCP的提取参考熊皓平等[4]的方法,并略作修改。称取10.0 g预处理后的长松藻粉末,加入500 mL无水乙醇浸泡脱脂2 h,过滤,滤渣于60 ℃烘干。以1∶100(g∶mL)加入蒸馏水,搅拌10 min,在95 ℃下浸提2 h,冷却至室温。加入木瓜蛋白酶(3 000 U/mL),60 ℃水浴振荡孵化2 h后,沸水浴处理5 min使木瓜蛋白酶变性。冷却至室温后,4 ℃、8 000 r/min 离心15 min,保留上清液,旋蒸浓缩至原体积1/3。浓缩液经7 000 Da透析袋去离子水透析48 h后,加入4倍体积的无水乙醇,醇沉过夜。4 ℃、10 000 r/min离心20 min并收集沉淀,冷冻干燥得到CCP。
1.3.2 CCP降解
1.3.2.1 超声辅助H2O2-维生素C降解
根据CHEN等[14]的方法,略加修改,对CCP进行降解处理。称取2.0 g CCP,加蒸馏水溶解,配制5 mg/mL CCP溶液,使用1.0 mol/L HCl调节CCP溶液pH至3.0,加入0.14 mL 30%(体积分数)H2O2与0.21 g维生素C,摇匀。将混合溶液超声处理30 min并调节至中性。经4 ℃、10 000 r/min离心20 min后收集上清液,1 000 Da透析袋透析48 h,旋蒸浓缩并冷冻干燥,得到超声辅助H2O2-维生素C降解多糖(维生素C-CCP)。
1.3.2.2 超声辅助H2O2-Fe2+降解
采用黄海潮等[8]的降解方法,稍作改动,对CCP进行降解处理。称取2.0 g CCP,加蒸馏水溶解,配制5 mg/mL CCP溶液,用1.0 mol/L HCl调节CCP溶液pH至3.0,加入4.53 mL 30% H2O2与0.17 g硫酸亚铁,摇匀。将混合溶液超声处理30 min并调节至中性,经4 ℃、10 000 r/min离心20 min后收集上清液,1 000 Da透析袋透析48 h,旋蒸浓缩并冷冻干燥,制得超声辅助H2O2-Fe2+降解多糖(Fe-CCP)。
1.3.3 多糖理化性质测定
1.3.3.1 溶解度
称取0.1 g CCP,加入100 mL蒸馏水,在不同温度(20、40、60、80、100 ℃)条件下磁力搅拌至完全溶解,记录CCP从开始到完全溶解所需要的时间[15]。
1.3.3.2 粒径分布与Zeta电位
准确称取1.0 mg的样品,加入1 mL超纯水,超声处理5 min,使样品完全分散后,通过纳米粒度电位仪测定CCP、维生素C-CCP及Fe-CCP的粒径分布及电位,连续测定3次。
1.3.4 多糖结构解析
1.3.4.1 单糖组成
称取10 mg(精确到0.1 mg)多糖样品于20 mL的钳口瓶中,加入5 mL浓度为2 mol/L的TFA,充N2封管,100 ℃烘箱中水解2 h。取1 mL水解液,加入1 mL甲醇后,70 ℃水浴下用N2吹干,重复2次,以去除TFA。加入1 mL 0.3 mol/L NaOH溶液充分溶解残渣,做一定稀释后衍生测定。
分别取400 μL的混合单糖标准液或多糖水解液于5 mL的具塞试管中,加400 μL PMP甲醇溶液,漩涡混匀。70 ℃水浴反应2 h,加入400 μL 0.3 mol/L 的HCl中和(pH 6~7),加水1 200 μL,再加等体积的氯仿,涡旋混匀振摇,静置,弃去氯仿相,如此萃取2次,0.45 μm微孔膜过滤后供LC-MS进样分析。流动相为乙腈与乙酸铵缓冲液(pH 7.0),流速为0.4 mL/min,柱温35 ℃,进样量2 μL。
1.3.4.2 原子力显微镜
取一定量的多糖粉末,溶解使样品稀释分散均匀后,滴到干净的云母片上,晾干后进行测试。通过原子力显微镜扫描,安装好探针,调整激光,移动样品台以及探头的位置,使样品位于探头正下方,直到看清样品表面为止,运行Nanoscope软件进行测定。
1.3.4.3 核磁共振(nuclear magnetic resonance,NMR)氢谱
称取50 mg样品,加入至核磁管,移取0.5 mL重水,振荡使样品完全溶解后进行测试,1H共振频率600 MHz,采样次数64次,弛豫时间2 s;13C为150.87 MHz,采样次数10 240次,弛豫时间2 s。布鲁克600 MHz AVANCE III测定。
1.3.5 多糖降血糖活性
1.3.5.1 α-淀粉酶抑制活性
根据周笑犁等[16]的方法测定α-淀粉酶抑制活性。移取不同浓度的多糖溶液0.3 mL至试管,加入1 mL PBS和1 mL α-淀粉酶溶液。37 ℃水浴加热10 min后,加入1 mL淀粉溶液。继续37 ℃水浴20 min,加入5 mL DNS溶液终止反应。冷却至室温,在540 nm处测得吸光值A1。将酶液替换为水,测得A2。把样品溶液换成水,测定对照组A3。样品溶液与酶液都替换为水,作空白对照A4。抑制率计算如公式(1)所示:
抑制率![]()
(1)
1.3.5.2 α-葡萄糖苷酶抑制活性
参考DUO等[17]的方法测定α-葡萄糖苷酶抑制活性。移取不同浓度的多糖溶液0.3 mL至试管,加入1.2 mL PBS和0.25 mL α-葡萄糖苷酶溶液。37 ℃ 水浴加热15 min后,加入0.25 mL对硝基苯酚吡喃葡萄糖苷(p-nitrophenol glucopyranoside,PNPG)溶液。继续37 ℃水浴25 min,加入1 mL碳酸钠溶液终止反应。冷却至室温,在405 nm处测得吸光值A1。将酶液替换为水,测得A2。样品溶液换成水,作空白对照A0。抑制率计算如公式(2)所示:
抑制率![]()
(2)
1.4 数据分析
所有实验重复3次,数据以平均数±标准差(x±SD)表示,采用SPSS 26统计软件进行方差分析。
2 结果与分析
2.1 多糖得率与溶解度
实验所得CCP的提取率为(8.21±0.57)%。超声辅助H2O2-Fe2+和H2O2-维生素C法降解多糖的回收率分别为(82.46±1.02)%与(76.39±1.43)%。经测定得到CCP、维生素C-CCP、Fe-CCP的总糖含量分别为68.51%、88.12%、71.75%,分子质量依次为50 745、15 072、8 474 Da。
通过多糖样品在不同温度条件下,完全溶解所需的时间来测定多糖的溶解性,结果如图1所示。结果表明,20~60 ℃时,随着温度上升,CCP的溶解时间显著降低,而维生素C-CCP与Fe-CCP变化不大。在20 ℃条件下,CCP的溶解时间分别为维生素C-CCP、Fe-CCP的11和13倍。经过降解处理后,多糖分子质量减小,溶解时间显著降低(P<0.01)。降解多糖在水中快速溶解,溶解性明显改善。在降解过程中,超声处理促进维生素C、Fe2+催化H2O2破坏多糖分子链间的氢键,导致短聚合链数量增加以及水合趋势增强,更易于溶解,有助于多糖发挥生物活性[7,10,18]。
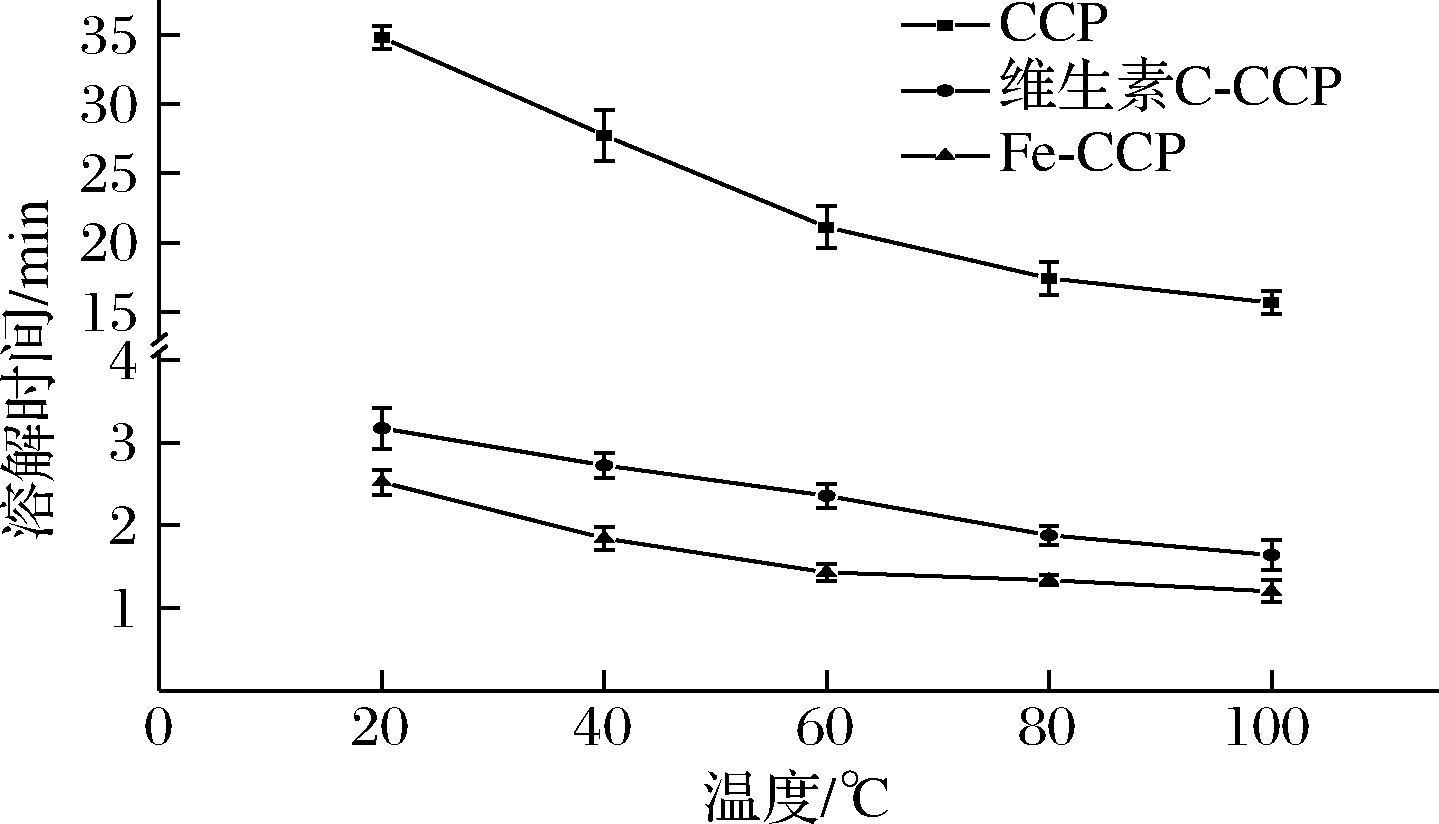
图1 不同温度条件下多糖溶解度的比较
Fig.1 The comparisons in solubility of polysaccharides at
different temperatures
2.2 粒径与Zeta电位
图2-a、图2-b、图2-c分别为CCP、维生素C-CCP以及Fe-CCP溶液的粒径分布图。由图2可看出,CCP主要集中在100~400 nm。而维生素C-CCP和Fe-CCP的粒径大小主要分布在10~100 nm,少部分分布在100~500 nm。经计算所得3个多糖样品的平均粒径分别为175.68、108.11、78.73 nm。2种降解多糖平均粒径小于CCP,此结果与上述分子质量分析结果一致。
Zeta电位可用于测定样品溶液表面所带静电荷的电位,反映溶液的稳定性[19]。图3-a、3-b、3-c分别为CCP、维生素C-CCP及Fe-CCP的Zeta电位分布图。3种多糖溶液表面均以负电荷为主,都是阴离子多糖。经计算所得CCP、维生素C-CCP及Fe-CCP的Zeta电位分别为-33.1、-23.5、-24.0 mV,3种多糖溶液都具有较好的物理稳定性。CCP的电位绝对值高于维生素C-CCP及Fe-CCP,说明降解处理后,多糖溶液从聚集趋向分散。降解处理产生的强剪切力使多糖发生分子电离[9],颗粒间静电斥力增强,导致粒径与Zeta电位降低,使多糖在水溶液中的聚集效应减弱,更易于被吸收利用[19-20]。

a-CCP;b-维生素C-CCP;c-Fe-CCP
图2 不同多糖的粒径分布
Fig.2 The Particle size distribution of different polysaccharides

a-CCP;b-维生素C-CCP;c-Fe-CCP
图3 不同多糖的Zeta电位
Fig.3 The Zeta potential of different polysaccharides
2.3 单糖组成
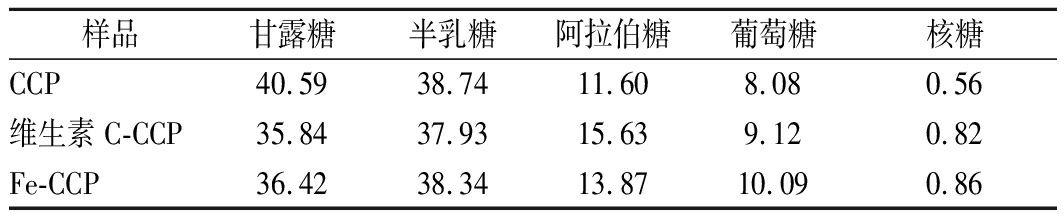
多糖样品经PMP衍生化处理后,通过LC-MS分析其单糖组成,结果如图4与表1所示。结果表明,CCP、维生素C-CCP、Fe-CCP均为杂多糖,单糖组成相似,说明降解处理没有改变多糖的单糖类型。3种多糖都主要由甘露糖(40.59%、35.84%、36.42%)、半乳糖(38.74%、37.9%、38.34%)、阿拉伯糖(11.60%、15.63%、13.87%)以及葡萄糖(8.08%、9.12%、10.09%)组成,单糖组成无明显变化,但单糖摩尔比不同。降解处理后,甘露糖和半乳糖含量最高,仍为主要单糖组分,但百分比有所下降,而阿拉伯糖、葡萄糖含量增加。说明超声辅助H2O2-Fe2+和H2O2-维生素C降解反应,优先作用于甘露糖、半乳糖附近的糖苷键,而在阿拉伯糖和葡萄糖附近的糖苷键较为稳定[21]。结果表明,超声辅助H2O2-Fe2+和H2O2-维生素C降解体系反应温和,主要作用于糖苷键上的氢键,多糖聚合度降低,而多糖的结构单元保持不变,这与CHEN等[14]的研究结果相一致。多糖基本结构稳定,对于其生物活性的维持具有重要意义。
表1 CCP、维生素C-CCP、Fe-CCP的单糖摩尔百分比 单位:%
Table 1 The monosaccharide molar percentage of CCP,
vitamin C-CCP and Fe-CCP
样品甘露糖半乳糖阿拉伯糖葡萄糖核糖CCP40.5938.7411.608.080.56维生素C-CCP35.8437.9315.639.120.82Fe-CCP36.4238.3413.8710.090.86
2.4 原子力显微镜
原子力显微镜是观察多糖表面结构形貌的有效方法,具有操作简便,环境要求低、分辨率高的优势,适用于生物大分子的可视化和功能化研究分析[22]。
图5-a、5-b、5-c分别为CCP、维生素C-CCP和Fe-CCP的原子力显微镜扫描结果。由图5-a可看出,粗多糖分子相互缠绕,分子链高度分布为6.3~16.8 nm。从3D图像看出,多糖分子出现聚集,这是由于分子间的氢键缔合作用强,多糖聚合较紧密[23]。
如图5-b所示,维生素C-CCP的分子高度为4.9~14.1 nm,分子聚集程度降低,分子散乱分布,仅有少量分子聚集。由图5-c可看出,Fe-CCP在溶液中的微观形态与维生素C-CCP类似,分子聚集程度较低,而分子高度有所不同(2.8~7.9 nm)。因此,2个降解多糖的分子聚集程度与分子高度均低于原始多糖,这与降解过程中多糖氢键断裂,分子间的缔合作用减弱有关[22,24]。多糖的聚合程度降低,可一定程度上影响多糖粒径与溶解度。

a-标准品;b-CCP;c-维生素C-CCP;d-Fe-CCP
图4 单糖标准品、CCP、维生素C-CCP及Fe-CCP的LC-MS色谱图
Fig.4 The LC-MS chromatogram of monosaccharides standard samples, CCP, vitamin C-CCP and Fe-CCP

a-CCP;b-维生素C-CCP;c-Fe-CCP
图5 原子力显微镜图谱
Fig.5 The atomic force microscope images
2.5 核磁共振波谱
不同多糖的核磁共振波谱图如图6所示。图6-a、图6-c、图6-e分别为CCP、维生素C-CCP和Fe-CCP的核磁共振氢谱图。1H-NMR可用于解析多糖结构的糖苷键构型。通常,多糖的异头氢质子信号集中出现在δH 4.5~5.5[25],同时β-构型糖苷的异头氢化学位移一般小于5.0[26]。而CCP、维生素C-CCP、Fe-CCP在4.69左右存在一个异头氢信号,说明3种多糖均含有β糖苷构型。根据相关参考文献[27],δH 4.69可能是甘露糖端基氢信号,这与单糖组成分析结果相符合。
图6-b、图6-d、图6-f分别为CCP、维生素C-CCP、Fe-CCP的核磁共振碳谱图。在1C-NMR中,多糖的异头碳信号位于δC 95~110[25]。CCP、Fe-CCP和维生素C-CCP均在100.1探测到异头碳信号,表明3种多糖都具有α-构型[28]。根据文献,82~84处的信号对应呋喃醛糖的C4及呋喃酮糖的C5,而3种多糖在82~88处均无化学位移,表明糖残基是吡喃型糖苷[27]。60~80的信号表示糖环上![]() 核磁共振波谱结果表明,CCP经过2种方法降解后糖苷键类型不变,说明复合降解处理不会破坏多糖的基本结构,可为其生物活性的应用提供保证。
核磁共振波谱结果表明,CCP经过2种方法降解后糖苷键类型不变,说明复合降解处理不会破坏多糖的基本结构,可为其生物活性的应用提供保证。

a-CCP核磁共振氢谱;b-CCP核磁共振碳谱;c-维生素C-CCP核磁共振氢谱;d-维生素C-CCP核磁共振碳谱;
e-Fe-CCP核磁共振氢谱;f-Fe-CCP核磁共振碳谱
图6 不同多糖的核磁共振波谱
Fig.6 The1H NMR and13C NMR spectra of different polysaccharides
2.6 降血糖活性
α-淀粉酶可以将淀粉等碳水化合物分解为寡糖,而α-葡萄糖苷酶催化糖苷键水解,将寡糖水解为葡萄糖,导致血糖水平上升。因此,抑制α-淀粉酶以及α-葡萄糖苷酶活性,能够有效延缓葡萄糖的释放,降低餐后的血糖水平,起到降血糖作用[12,16]。
如图7所示,3种多糖均对α-淀粉酶有一定的抑制作用,在2~10 mg/mL时呈剂量依赖性变化。在多糖浓度为10 mg/mL时,CCP、维生素C-CCP、Fe-CCP对α-淀粉酶最大抑制率分别为17.42%、19.84%、37.50%,低于阳性对照。与CCP相对比,Fe-CCP的抑制活性显著提高(P<0.05),而维生素C-CCP提高幅度相对较小(P>0.05),这可能与Fe-CCP分子质量更小有关。

图7 不同多糖的α-淀粉酶抑制活性
Fig.7 The α-amylase inhibitory activity of
different polysaccharides
如图8所示,CCP、维生素C-CCP、Fe-CCP对α-葡萄糖苷酶抑制活性呈线性变化。3种多糖样品对α-葡萄糖苷酶有较明显的抑制作用,降解处理后α-葡萄糖苷酶抑制能力明显提升(P<0.05),与α-淀粉酶抑制活性结果相吻合。多糖样品对α-葡萄糖苷酶的抑制力强弱依次为Fe-CCP>维生素C-CCP>CCP,在10 mg/mL,达到最大抑制活性47.74%、55.41%、60.07%,略低于阳性对照。

图8 不同多糖的α-葡萄糖苷酶抑制活性
Fig.8 The α-glucosidase inhibitory activity of
different polysaccharides
DOU等[17]研究表明,一定程度的降解处理可以有效降低黑莓多糖的分子质量,提高α-葡萄糖苷酶抑制活性,这与长松藻降解多糖的结果一致。杨玉洁等[13]研究发现,多数具有降血糖活性的多糖均含有半乳糖、阿拉伯糖、葡萄糖等单糖类型,CCP、维生素C-CCP、Fe-CCP的单糖组成与这相符合。超声辅助H2O2-Fe2+和H2O2-维生素C降解体系能够有效降解CCP,促进多糖糖苷键断裂,暴露更多羟基基团,可与消化酶中的氨基酸残基相结合,起到抑制酶活性,降低血糖水平的作用[6]。
3 结论
采用超声辅助H2O2-维生素C和H2O2-Fe2+复合法降解CCP后,溶解性显著提升,粒径和Zeta电位减小;多糖表面构象发生变化,分子聚集程度降低;单糖组成和糖苷键构型等结构保持稳定,为降解多糖的活性应用提供保证。降解反应破坏多糖糖苷键上的氢键,使更多的活性基团暴露。体外降血糖实验结果表明,CCP具有一定的α-淀粉酶抑制活性,降解处理后小幅提升,而α-葡萄糖苷酶抑制活性相对较强,降解处理后显著提升,最大抑制活性分别为47.74%、55.41%、60.07%。CCP经超声辅助H2O2-维生素C和H2O2-Fe2+法处理后理化性质改善,基本结构保持稳定,生物活性显著提高。该研究结果为长松藻降解多糖在食品、药品和化妆品的开发应用提供理论依据。
[1] 刘楠, 孙永, 曾帅, 等.海藻主要活性物质及其生物功能研究进展[J].食品安全质量检测学报, 2015, 6(8):2 875-2 880.
LIU N, SUN Y, ZENG S, et al.Research progress on bioactive substances and its biological activity of algae[J].Journal of Food Safety & Quality, 2015, 6(8):2 875-2 880.
[2] 张磊, 刘翠, 池姗, 等.长松藻ITS序列特征及其系统进化分析[J].海洋湖沼通报, 2013(2):177-182.
ZHANG L, LIU C, CHI S, et al.Characterization of its sequence and the phylogenetic analysis of Codium cylindricum[J].Transaction of Oceanology and Limnology, 2013(2):177-182.
[3] 吉宏武, 邵海艳, 章超桦, 等.长松藻化学成分及其营养评价[J].食品与发酵工业, 2007(7):129-131.
JI H W, SHAO H Y, ZHANG C H, et al.Chemical constituents in Codium cylindricum Holm and its nutrition evaluation[J].Food and Fermentation Industries, 2007(7):129-131.
[4] 熊皓平, 黄涛, 吉宏武, 等.长松藻基本营养成分分析及其多糖的提取[J].广东海洋大学学报, 2007(3):82-85.
XIONG H P, HUANG T, JI H W, et al.Analysis on basic nutrition constituents of Codium cylindricum Holmes and extraction of its polysaccharides[J].Journal of Guangdong Ocean University, 2007(3):82-85.
[5] MATSUBARA K, MORI M, MATSUMOTO H, et al.Antiangiogenic properties of a sulfated galactan isolated from a marine green alga, Codium cylindricum[J].Journal of Applied Phycology, 2003, 15(1):87-90.
[6] 徐雅琴, 杨海红, 李大龙, 等. 黑加仑果实降解多糖理化特性、结构及体外降血糖活性[J/OL]. 食品科学, 2020. http://kns.cnki.net/kcms/detail/11.2206.ts.20201120.1501.071.html.
XU Y Q, YANG H H, LI D L, et al. The physicochemical properties, structural characterization and hypoglycemic activity in vitro of degraded polysaccharides from Blackcurrant[J/OL]. Food Science, 2020.http://kns.cnki.net/kcms/detail/11.2206.ts.20201120.1501.071.html.
[7] SHEN X M, LIU Z F, LI J H, et al.Development of low molecular weight heparin by H2O2/ascorbic acid with ultrasonic power and its anti-metastasis property[J].International Journal of Biological Macromolecules, 2019, 133:101-109.
[8] 黄海潮, 王锦旭, 潘创, 等.超声波辅助过氧化氢法降解坛紫菜多糖及其抗氧化活性的研究[J].南方水产科学, 2020, 16(1):110-119.
HUANG H C, WANG J X, PAN C, et al.Degradation of porphyra haitanensis polysaccharide by ultrasonic assisted hydrogen peroxide method and its antioxidant activity analysis[J].South China Fisheries Science, 2020, 16(1):110-119.
[9] 张海芸, 贺亮, 李琴, 等.降解对植物多糖理化性质以及生物活性影响的研究[J].食品与发酵科技, 2019, 55(3):15-19.
ZHANG H Y, HE L, LI Q, et al.Study on the effect of degradation on the physicochemical properties and biological activity of plant polysaccharides[J].Food and Fermentation Sciences & Technology, 2019, 55(3):15-19.
[10] ZHI Z J, LI J H, CHEN J L, et al.Preparation of low molecular weight heparin using an ultrasound-assisted Fenton-system[J].Ultrasonics Sonochemistry, 2019, 52:184-192.
[11] 姜慧, 孔立敏, 王翀, 等.条斑紫菜多糖的降解条件优化及生物活性研究[J].食品科学, 2021,42(3):38-47.
JIANG H, KONG L M, WANG C, et al.Optimization of degradation conditions of polysaccharides from Porphyra yezoensis and changes in biological activities after degradation[J].Food Science, 2021,42(3):38-47.
[12] WANG B H, CAO J J, ZHANG B, et al.Structural characterization, physicochemical properties and α-glucosidase inhibitory activity of polysaccharide from the fruits of wax apple[J].Carbohydrate Polymers, 2019, 211:227-236.
[13] 杨玉洁, 刘静宜, 谭艳, 等. 多糖降血糖活性构效关系及作用机制研究进展[J/OL]. 食品科学, 2021. http://kns.cnki.net/kcms/detail/11.2206.TS.20210223.1532.002.html.
YANG Y J, LIU J Y, TAN Y, et al. Research progress on the structure-activity relationship and hypoglycemic mechanism of polysaccharid[J/OL]. Food Science, 2021. http://kns.cnki.net/kcms/detail/11.2206.TS.20210223.1532.002.html.
[14] CHEN S J, LIU H, YANG X Q, et al.Degradation of sulphated polysaccharides from Grateloupia livida and antioxidant activity of the degraded components[J].International Journal of Biological Macromolecules, 2020, 156:660-668.
[15] 李莹, 黄德春, 陈贵堂, 等.昆布多糖不同提取工艺优化及其理化性质和抗肿瘤活性比较[J].食品科学, 2019, 40(6):288-294.
LI Y, HUANG D C, CHEN G T, et al.Polysaccharides from Laminaria japonica:Optimization of different extraction processes and comparison of physicochemical properties and antitumor activity[J].Food Science, 2019, 40(6):288-294.
[16] 周笑犁, 阳桥美, 孔艳秋, 等.刺梨果渣多糖对α-淀粉酶活性的抑制作用[J].食品科技, 2020, 45(10):207-212.
ZHOU X L, YANG Q M, KONG Y Q, et al.Inhibitory effect of polysaccharides from Rosa roxburghii Tratt on activity of α-amylase[J].Food Science and Technology, 2020, 45(10):207-212.
[17] DOU Z M, CHEN C, FU X.The effect of ultrasound irradiation on the physicochemical properties and α-glucosidase inhibitory effect of blackberry fruit polysaccharide[J].Food Hydrocolloids, 2019, 96:568-576.
[18] 徐雅琴, 杜明阳, 杨露, 等.超声波处理对黑加仑果实多糖性质与生物活性的影响[J].食品科学, 2019, 40(15):148-153.
XU Y Q, DU M Y, YANG L, et al.Effect of ultrasonic treatment on properties and bioactivity of polysaccharides from blackcurrant Fruit[J].Food Science, 2019, 40(15):148-153.
[19] 东方, 于蕾, 程斌, 等.刺山柑多糖表征结构研究[J].哈尔滨商业大学学报 (自然科学版), 2014, 30(5):558-560.
DONG F, WANG L, CHENG B, et al.Study on characterization of Cappraris spinosa L. polysaccharide[J].Journal of Harbin University of Commerce (Natural Sciences Edition), 2014, 30(5):558-560.
[20] 别蒙, 谢笔钧, 孙智达.不同取代度水溶性羧甲基茯苓多糖的制备、结构表征及体外抑菌活性[J].食品科学, 2020, 41(12):67-76.
BIE M, XIE B J, SUN Z D, et al.Preparation, structural characterization and in vitro antibacterial activity of water-soluble carboxymethyl pachymaran with different degrees of substitution[J].Food Science, 2020, 41(12):67-76.
[21] 谭诗敏, 罗志刚, 程建华. H2O2-Vit C降解对香水莲花多糖结构与活性的影响[J/OL]. 食品科学, 2021. http://kns.cnki.net/kcms/detail/11.2206.TS.20210205.1542.026.html.
TAN S M, LUO Z G, CHENG J H, et al. Degradation of polysaccharides from Nymphaea hybrid using H2O2-Vit C and its effects on the structure and activities[J/OL]. Food Science, 2021. http://kns.cnki.net/kcms/detail/11.2206.TS.20210205.1542.026.html.
[22] 柳红, 张静.南瓜AP1多糖结构的分析和原子力显微镜研究[J].食品科学, 2009, 30(5):55-59.
LIU H, ZHANG J.Study on molecular structure of pumpkin polysaccharide AP1 by spectrospic and chromatographic analysis and atomic force microscopy[J].Food Science, 2009, 30(5):55-59.
[23] 伍乐芹, 姜绍芬, 张静.白术多糖WAM-1结构的色谱分析和原子力显微镜观察[J].天然产物研究与开发, 2012, 24(5):631-634.
WU L Q, JIANG S F, ZHANG J, et al.Chromatographic analysis and atomic force microscope observation of polysaccharide extracted from Atractylodes macrocephala Koidz[J].Natural Product Research and Development, 2012, 24(5):631-634.
[24] 霍达, 李琳, 张霞, 等.玉竹多糖的提取工艺优化、结构表征及抗氧化活性的研究[J].食品科技, 2020, 45(7):200-208.
HUO D, LI L, ZHANG X, et al.Optimization of extraction, structure characterization and antioxidant activity of polysaccharide from Polygonatum Ordoratum (Mill.) Druce[J].Food Science and Technology, 2020, 45(7):200-208.
[25] 刘玉红, 王凤山.核磁共振波谱法在多糖结构分析中的应用[J].食品与药品, 2007(8):39-43.
LIU Y H, WANG F S, et al.Applications of nuclear magnetic resonance spectroscopy in structural analysis of polysaccharides[J].Food Science and Technology, 2007(8):39-43.
[26] 李贞景, 王昵霏, 刘丹, 等.白灵菇根部抗癌活性多糖的分离纯化和结构分析[J].保鲜与加工, 2020, 20(3):101-106.
LI Z J, WANG N F, LIU D, et al.Isolation, purification and structure analysis of anticancer active polysaccharides from Pleurotus nebrodensis roots[J].Storage and Process, 2020, 20(3):101-106.
[27] 张安强, 张劲松, 潘迎捷.食药用菌多糖的提取、分离纯化与结构分析[J].食用菌学报, 2005(2):62-68.
ZHANG A Q, ZHANG J S, PAN Y J, et al.Extraction, isolation, purification and structure analysis of polysaccharide from edible-medicinal fungi[J].Acta Edulis Fungi, 2005(2):62-68.
[28] 刘影, 丁祥, 侯怡铃.獐子菌多糖SIK-1的结构鉴定及其生物活性研究[J].生物技术, 2020, 30(5):465-472.
LIU Y, DING X, HOU Y L, et al.Structure identification and bioactivity of Sarcodon imbricatus (L.ex Fr.) Karst polysaccharide SIK-1[J].Biotechnology, 2020, 30(5):465-472.
[29] 李艺萌, 李文芝, 钟瑞芳, 等.黑菇多糖的提取工艺优化及理化性质和抗氧化活性研究[J].河南工业大学学报 (自然科学版), 2020, 41(3):19-26.
LI Y M, LI W Z, ZHONG R F, et al.Study on extraction process optimization, physicochemical properties, and antioxidant activity of polysaccharide from Russula adusta (Pers.) Fr.[J].Journal of Henan University of Technology (Natural Science Edition), 2020, 41(3):19-26.