多糖,又称为聚糖,一般指由10个以上单糖通过糖苷键连接而成高分子化合物[1]。多糖在自然界中分布广泛,在真菌细胞壁中约占90 %[2],具有免疫调节[3]、调节肠道菌群[4]、降血糖[5-6]、降血脂[5]、抗氧化[7]、抗肿瘤[8]和保湿[9]等多种生物学功能。多糖分为胞内多糖、胞壁多糖和胞外多糖3种[10],与胞内多糖不同,真菌胞外多糖易与菌体分离,可通过液体发酵获得,具有生产周期短、成本低和易于控制等优势[11]。
阿魏侧耳(P.ferulae Lanzi),是一种食药兼用的担子菌,具有抗肿瘤、提高免疫力[12]和抗氧化等功效[13]。阿魏侧耳胞外多糖是从液体发酵液中提取的多糖组分[14],相关研究目前集中在液体发酵[14-15]、粗多糖提取[10]及粗多糖的生物活性探索等[10, 16-17],未有纯化组分对体外培养的巨噬细胞和淋巴细胞免疫调节作用的相关报道。本文对阿魏侧耳发酵液中的胞外粗多糖进行了分离纯化,初步研究了阿魏侧耳胞外多糖水提组分的性质及其对体外培养的巨噬细胞和淋巴细胞免疫能力的调节作用,为其开发利用提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1 材料
阿魏侧耳菌种,中国科学院菌种保藏中心;ICR 小鼠,斯贝福(北京)生物技术有限公司(许可证号SCXK(京)2016—0002),雄性,5~6 周龄,体重25 g 左右(伦理审查批准号为LFNUSKYLL2020001);DEAE-52 纤维素,美国Bio-Rad公司;Sephadex G-100葡聚糖凝胶,GE医疗集团生命科学部;F12K培养基,美国Sigma公司;优级胎牛血清(fetal bovine serum, FBS),浙江天杭生物科技股份有限公司;白细胞介素-1(interleukin-1,IL-1)、白细胞介素-2(interleukin-2,IL-2)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒,青岛海德诚生物工程有限公司;NO荧光探针(4-amino-5-methylamino-2′, 7′-difluorofluorescein diacetate,DAF-FM DA)和活性氧荧光探针(2′, 7′-dichlorofluorescin diacetate,DCFH-DA),北京碧云天生物技术有限公司;小鼠脾脏淋巴细胞分离液、葡聚糖标准品(Dextran T-10,Dextran T-40,Dextran T-70,Dextran T-500)、MD44透析袋(截留分子质量8 kDa),北京索莱宝科技有限公司;D-甘露糖(D-mannose, Man)、D-葡萄糖醛酸(D-glucuronic acid, GlcA)、D-半乳糖醛酸(D-galacturonic acid monohydrate, GalA)、L-鼠李糖(L-rhamnose, Rha)、D-葡萄糖(D-glucose, Glc)、D-半乳糖(D-galactose, Gal)、L-阿拉伯糖(L-arabinose, Ara)和L-岩藻糖(L-fucose, Fuc),上海麦克林生化科技有限公司;24孔细胞培养板和离心管,美国Corning公司;实验所需其他试剂均为分析纯。
1.1.2 仪器
1260 Infinity液相色谱仪(配有G1362A RID示差折光检测器和DAD检测器)、PL aquagel-OH MIXED-H 凝胶柱、Agilent ZORBAX SB-C18柱,美国Agilent科技公司;MCO-20AIC二氧化碳培养箱和MLS-3750高压蒸汽灭菌锅,日本SANYO公司;UV-1801紫外/可见分光光度计,北京北分瑞利分析仪器有限责任公司;iMark酶标仪,美国Bio-Rad公司;Milli-Q超纯水机,美国Millipore公司;Hei-VAp Advantage旋转蒸发仪,德国Heidolph公司;CKX41SF倒置显微镜(配有CCD图像传感器DP71及Image-pro plus 图像分析软件)、IX71倒置荧光显微镜(配有CCD图像传感器DP73),日本Olympus公司;ZHJH-C超净工作台,上海智城分析仪器制造有限公司;ALPHA 1-2 冷冻干燥机,德国Martin Christ 公司;HHS型电热恒温水浴锅、SPX-250B-Z生化培养箱、BSD-YX 3600立式智能摇床,上海博迅医疗生物仪器股份有限公司;UNIC-7200型可见光分光光度计,上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 阿魏侧耳胞外粗多糖的提取
发酵培养。挑选生长状态良好的阿魏侧耳菌丝体,接种于已优化的液体发酵培养基中(培养基组成:透析袋透析后的马铃薯浸提液200 g/L,葡萄糖20 g/L,蛋白胨4 g/L,MgSO4·7H2O 2 g/L),25 ℃,150 r/min摇床培养10 d,培养结束后收集发酵液,铜网过滤,4 000 r/min离心20 min,收集上层液体,用旋转蒸发仪60 ℃浓缩至原体积的1/10。
醇沉干燥。浓缩后的发酵液中加入3倍体积的无水乙醇,4 ℃醇沉12 h,4 000 r/min离心20 min,收集沉淀,用75 %(体积分数)乙醇洗涤2次,离心,去上清液体,沉淀用丙酮洗涤2次,离心收集沉淀,冷冻干燥后备用。
复溶和除蛋白。将醇沉干燥后的阿魏侧耳胞外多糖复溶于蒸馏水中,4 000 r/min离心20 min,收集上清液,转入分液漏斗,加入1/5 体积的Sevag试剂(氯仿-正丁醇,体积比为4∶1),振荡30 min,静置5 h,去除含白色凝胶物质的有机层;重复4~5次,直至有机层中无明显白色为止。
透析。将除蛋白后的阿魏侧耳胞外多糖溶液,分装于透析袋(截留分子质量8 kDa)中,流水透析24 h,超纯水4 ℃透析24 h,旋转蒸发仪浓缩,冷冻干燥后备用。
1.2.2 阿魏侧耳胞外多糖的分离纯化
1.2.2.1 DEAE-52 纤维素柱层析
将处理后的 DEAE-52纤维素装入层析柱(1 cm×20 cm),调整流速为1 mL/min,超纯水平衡 24 h。将冷冻干燥的阿魏侧耳多糖复溶于超纯水中(10 g/L),4 000 r/min离心10 min,收集上清5 mL,上样DEAE-52 纤维素柱,超纯水洗脱,流速1 mL/min,自动分步收集器收集,苯酚-硫酸法[18]跟踪检测,绘制洗脱曲线并按峰收集,每管5 mL,将收集到的多糖溶液浓缩、冷冻干燥后备用。
1.2.2.2 Sephadex G-100葡聚糖凝胶柱层析
将处理后的Sephadex G-100葡聚糖凝胶装柱(2 cm×60 cm),调整流速为0.5 mL/min,平衡和洗脱方法同上。将DEAE-52 纤维素柱层析分离的多糖复溶(浓度为10 g/L),针头滤器(孔径为0.45 μm)抽滤后,上样SephedexG-100葡聚糖凝胶柱,超纯水洗脱,按照1.2.2.1方法绘制洗脱曲线、按峰收集。将收集的溶液浓缩、冷冻干燥后得到纯化的阿魏侧耳胞外多糖水提组分。
1.2.3 阿魏侧耳胞外多糖的分子量测定
参照范三红等[7]的高效凝胶渗透色谱法(high performance gel permeation chromatography, HPGPC),并适当改进。将葡聚糖标样和多糖样品用超纯水溶解,滤器(孔径为0.45 μm)抽滤。色谱条件:Agilent 1260 Infinity 高效液相色谱仪,Agilent PL aquagel-OH MIXED-H 凝胶柱(7.5 mm×300 mm,8 μm),检测器为Agilent G1362A RID示差折光检测器,柱温35 ℃,进样量20 μL,流动相:超纯水,流速:0.6 mL/min;标准品为已知分子质量的葡聚糖(Dextran T-10、Dextran T-40、Dextran T-70和Dextran T-500)。将葡聚糖标准品配制成1.0 mg/mL的溶液,按上述条件测定各标准品和多糖样品的保留时间,以葡聚糖标准品平均分子质量的对数值lgMw为因变量,保留时间t为自变量,进行相关回归分析,得到一元线性回归方程,根据回归方程,计算多糖样品的平均分子质量。
1.2.4 阿魏侧耳胞外多糖的单糖组成分析
采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)柱前衍生化单糖,高效液相色谱法分离鉴定[16]。在离心管中加入0.05 moL/L单糖混样100 μL,0.5 mol/L PMP-甲醇溶液100 μL,0.3 mol/L NaOH 100 μL,涡旋混匀,70 ℃水浴30 min,冷却至室温,加入0.3 mol/L HCl 100 μL,混匀中和,加入蒸馏水1 mL,氯仿2 mL,充分混匀后静置,弃下层有机相,重复萃取3次;滤器(孔径为0.45 μm)抽滤后,转入样品瓶中待用,每个待测样品3个重复。取阿魏侧耳胞外多糖5 mg,置于安瓿瓶中,加入2 mol/L 三氟乙酸1 mL,酒精喷灯封口,110 ℃水解6 h,冷却至室温,加甲醇后真空干燥,重复操作多次,去除三氟乙酸,0.3 mol/L NaOH调中性,定容至1 mL。
HPLC条件:Agilent 1260 Infinity 高效液相色谱仪,Agilent ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm),检测器为Agilent DAD检测器,检测波长为250 nm,柱温35 ℃,上样体积20 μL;流动相:A:0.02 mol/L磷酸缓冲盐溶液(phosphate buffered solution,PBS),pH 6.0;流动相B:乙腈,流速1.0 mL/min;洗脱梯度:0 min,0%B;10 min,18%B;20 min,25%B。
1.2.5 阿魏侧耳胞外多糖水提组分的免疫细胞调节活性
1.2.5.1 细胞的收集和培养
巨噬细胞的收集采用灌洗腹腔法,参考王晶等[19]方法进行。将小鼠颈椎脱臼后,置75%(体积分数)乙醇中浸泡1 min,重复2次后转入超净工作台,无菌注射F12K培养液至小鼠腹腔,收集含细胞的腹腔液至离心管中,1 500 r/min离心10 min,弃上清液,细胞沉淀用含10 % FBS(F12K-FBS,体积比为9∶1)F12K培养液重悬后,均匀地接种到细胞培养板中,置37 ℃、5%(体积分数)CO2培养箱中培养。
淋巴细胞的收集采用密度梯度离心法,参照小鼠脾脏淋巴细胞分离液的操作说明进行。按上述方法处死小鼠,取脾脏置75%乙醇中浸泡1 min,PBS漂洗3次,转至F12K培养液中;脾脏一端剪一小口,缓慢挤出细胞,铜网过滤,收集细胞悬液至离心管(预先加入适量淋巴细胞分离液)中,2 500 r/min离心20 min,吸取第二层的淋巴细胞悬液至离心管中,细胞洗涤液洗涤,1 500 r/min离心10 min,弃上清液,重复1次,细胞用无血清的F12K培养液重悬后,按上述方法接种到细胞培养板中,置37 ℃、5% CO2培养箱中培养。
1.2.5.2 多糖处理
待巨噬细胞贴壁后,吸弃上层液体,添加无血清的F12K 培养液,并将细胞分为多糖处理组和空白对照组。多糖处理组分别添加终质量浓度为10、20 和30 mg/L的无菌阿魏侧耳胞外多糖水提组分,空白对照组添加等体积的F12K培养液,每组设3个重复。继续培养24 h后,分别收集细胞和上层培养液,荧光探针法测定细胞中NO 和活性氧含量;酶联免疫吸附实验测定细胞培养上清液中的IL-1、IL-6、TNF-α和IFN-γ的浓度。
将体外培养的小鼠脾淋巴细胞分为多糖处理组和空白对照组,多糖处理组分别添加终质量浓度为10、20和30 mg/L的无菌阿魏侧耳胞外多糖多糖水提组分,空白对照组添加等体积的F12K培养液,每组设3个重复,37 ℃、5% CO2培养箱中继续培养24 h。收集细胞培养液,酶联免疫吸附实验测定培养上清液中的IL-2和IFN-γ的浓度。
1.2.5.3 NO含量的测定
荧光探针法。按照DAF-FM DA 使用说明,将NO探针稀释400倍,添加到不同处理组巨噬细胞的表面, 37 ℃避光孵育30 min,PBS漂洗3次,荧光显微镜观察和拍照,软件IPP分析和测定平均光密度值(相对值)[19]。
1.2.5.4 细胞中活性氧测定
按照上述方法收集和接种巨噬细胞,多糖处理24 h。按照活性氧检测试剂盒说明,用无血清F12K培养液稀释DCFH-DA探针至终浓度为10 μmol/L,去除细胞培养液,PBS漂洗后,加入终浓度为10 μmol/L 的DCFH-DA探针,37 ℃恒温孵育20 min,无血清的F12K培养液洗涤3次,荧光显微镜观察和拍照,软件IPP分析和测定平均光密度值(相对值)。
1.2.5.5 IL-1、IL-2、IL-6、TNF-α和IFN-γ的测定
酶联免疫吸附试验采用双抗体一步夹心法[10]。取1.2.5.2细胞培养液,12 000 r/min离心10 min后收集上清液,按照试剂盒的说明操作,酶标仪检测A450 nm,根据各标准品的标准曲线计算各组培养上清中IL-1、IL-2、IL-6、TNF-α和IFN-γ浓度。
1.2.6 统计分析
采用SPSS 20.0统计分析;实验结果以平均数±标准差![]() 表示,单因素方差分析(ANOVA)进行组间差异性比较,P<0.05 时,表示差异显著。
表示,单因素方差分析(ANOVA)进行组间差异性比较,P<0.05 时,表示差异显著。
2 结果与分析
2.1 阿魏侧耳胞外多糖的分离纯化
使用优化后的培养基对阿魏侧耳进行液体发酵,将发酵液过滤、离心、浓缩、醇沉干燥、除蛋白、透析(去除分子质量小于8 kDa组分)、浓缩和冷冻干燥后得到阿魏侧耳胞外粗多糖。阿魏侧耳胞外粗多糖经DEAE-52 纤维素柱分离,以超纯水洗脱后,苯酚-硫酸法跟踪检测,得到1个明显主峰,洗脱曲线见图1-A,命名为PFEPw(water extract component of exopolysaccharides from P. ferulae Lanzi)。将PFEPw收集和冷冻干燥后经SephadexG-100葡聚糖凝胶柱进一步纯化,洗脱曲线见图1-B,可以看出,PFEPw的洗脱曲线出现4个独立峰,分别命名为PFEPw-1、PFEPw-2、PFEPw-3和PFEPw-4,由于PFEPw-2、PFEPw-3和PFEPw-4组分多糖含量较低,较难收集足够量进行后续研究,故仅对PFEPw-1组分进行收集、浓缩和冷冻干燥,作为下一步实验的样品。

A-DEAE-52 纤维素柱洗脱曲线;B-Sephadex G-100
葡聚糖凝胶柱洗脱曲线
图1 阿魏侧耳胞外多糖经DEAE-52 纤维素和
Sephadex G-100葡聚糖凝胶柱洗脱曲线
Fig.1 Elution curve of crude exopolysaccharides from
P.ferulae Lanzi by DEAE-52 cellulose column chromatography
and Sephadex G-100 column chromatography
2.2 阿魏侧耳胞外多糖水提组分分子质量和单糖组成
2.2.1 分子质量测定
采用HPGPC法测定葡聚糖标准品和阿魏侧耳胞外多糖水提组分PFEPw-1的保留时间(图2-A),以葡聚糖标准品的lgMw为因变量,保留时间t为自变量进行相关回归分析,得相关系数R=-0.953,P<0.05,表明,葡聚糖标准品平均分子质量对数lgMw与其保留时间t具有显著的负相关关系,一元线性回归方程为:lgMw=-0.926t+17.646。PFEPw-1的保留时间为13.842 min(图2-B),根据回归方程计算其平均分子质量为67.3 kDa。

A-葡聚糖标准品;B-PFEPw-1
图2 葡聚糖标准品和PFEPw-1的HPGPC图
Fig.2 HPGPC of standard dextrans and PFEPw-1
2.2.2 单糖组成测定
将PFEPw-1水解后,采用高效液相色谱法进行单糖组成分析。由高效液相色谱结果(图3)可知,PFEPw-1由D-甘露糖、D-葡萄糖、D-半乳糖和L-阿拉伯糖组成,各单糖含量比为2.42∶3.90∶2.27∶1.41,其中D-葡萄糖含量最高,L-阿拉伯糖含量最低。

A-混合单糖标准品;B-PFEP-1
图3 混合单糖标准品和PFEPw-1的高效液相色谱图
Fig.3 HLPC of mixed standard monosaccharides and PFEPw-1
注:1:D-甘露糖;2:D-葡萄糖醛酸;3:D-半乳糖醛酸;4:L-鼠李糖;
5:D-葡萄糖;6:D-半乳糖;7:L-阿拉伯糖;8:L-岩藻糖
2.3 体外培养的巨噬细胞和脾淋巴细胞
参照王晶等[19]方法和小鼠脾淋巴细胞分离液使用说明,分别收集小鼠巨噬细胞和脾淋巴细胞,建立体外培养体系。结果显示,培养24 h后,巨噬细胞贴壁或半贴壁生长,形状不规则(图4-A),脾淋巴细胞悬浮生长,圆形(图4-B),2种细胞透光性较好,说明实验建立的培养体系适合小鼠巨噬细胞和脾淋巴细胞的体外生长。

A-小鼠腹腔巨噬细胞;B-小鼠脾淋巴细胞
图4 体外培养的小鼠巨噬细胞和脾淋巴细胞(标尺= 100 μm)
Fig.4 Murine peritoneal macrophages and spleen
lymphocytes cultured in vitro (scale=100 μm)
2.4 阿魏侧耳胞外多糖水提组分对巨噬细胞NO和活性氧产生的影响
DAF-FM DA探针和DCFH-DA探针可通过活细胞的质膜进入细胞质,分别被酯酶水解为DAF-FM和DCFH。DAF-FM和DCFH均无荧光或有微弱的荧光且不能透过质膜,DAF-FM可与细胞中的NO结合,产生绿色荧光,荧光强度或平均光密度显示活细胞内NO的水平[19],DCFH则被细胞内活性氧氧化为DCF,产生绿色荧光,荧光强度或平均光密度则可显示活细胞内活性氧的水平。
为研究阿魏侧耳胞外多糖水提组分PFEPw-1对巨噬细胞免疫能力的影响,分别用DAF-FM DA探针和DCFH-DA探针标记PFEPw-1处理后的巨噬细胞,IPP软件测定相对平均光密度,结果显示,与空白组相比,10~30 mg/L的PFEPw-1处理24 h后,NO荧光探针(图5和图6)和活性氧荧光探针(图6和图7)的平均光密度值均显著增加(P<0.05)。说明,PFEPw-1处理24 h可促进巨噬细胞内NO和活性氧的产生。
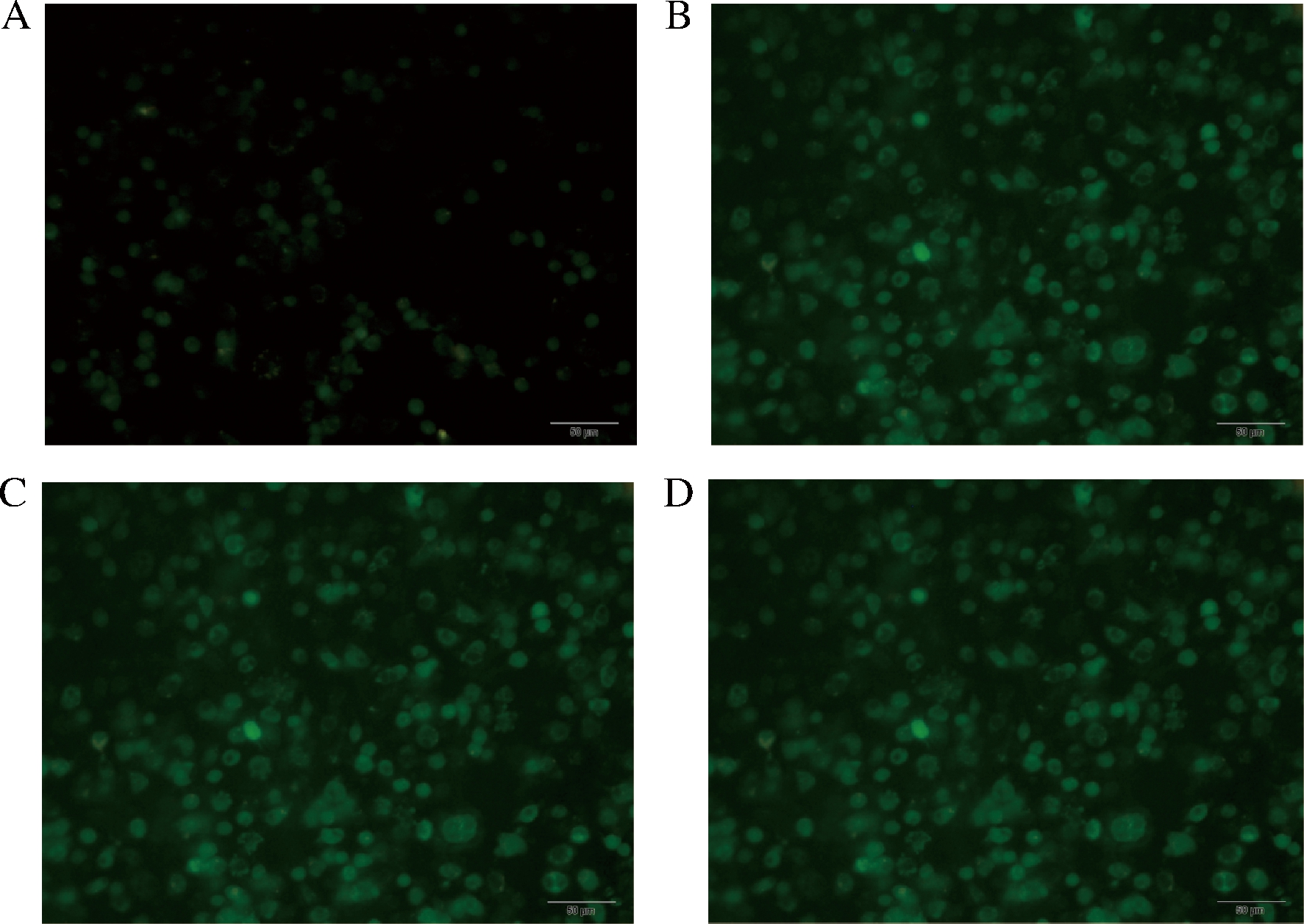
A-空白对照组;B-10 mg/L PFEPw-1处理组
C-20 mg/L PFEPw-1处理组;D-30 mg/L PFEPw-1处理组
图5 NO 荧光探针标记的小鼠巨噬细胞(标尺= 50 μm)
Fig.5 Murine macrophage stained by NO fluorescence
probe (scale=50 μm)
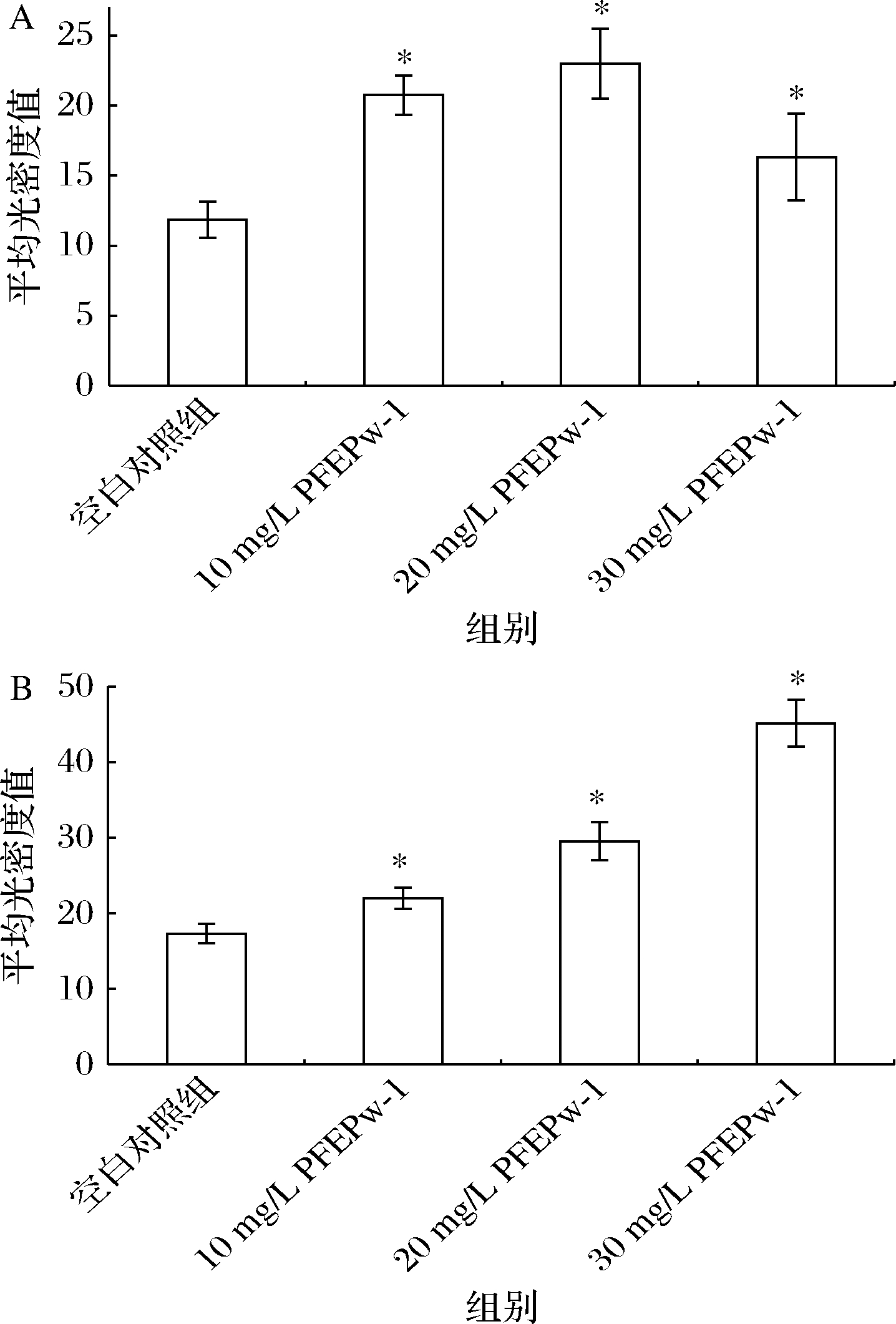
A-NO荧光的平均光密度值;B-活性氧荧光的平均光密度值
图6 小鼠巨噬细胞中NO荧光和活性氧荧光的平均光密度值
Fig.6 The average optic density of NO fluorescence in
murine macrophages in different groups
注:*表示与空白对照组相比差异显著(P<0.05)

A-空白对照组;B-10 mg/L PFEPw-1处理组
C-20 mg/L PFEPw-1处理组;D-30 mg/L PFEPw-1处理组
图7 DCFH-DA荧光探针标记的小鼠巨噬细胞
(标尺= 100 μm)
Fig.7 Murine macrophage stained by DCFH-DA
fluorescence probe (scale=100 μm)
2.5 阿魏侧耳胞外多糖水提组分对巨噬细胞IL-1、IL-6、TNF-α和IFN-γ分泌量的影响
PFEPw-1处理小鼠巨噬细胞24 h后,离心收集细胞培养上清液,采用酶联免疫吸附实验测定其中的多种免疫相关细胞因子浓度。结果显示,巨噬细胞培养上清液中可检测到IL-1、IL-6、TNF-α和IFN-γ,其中,TNF-α和IFN-γ的浓度较高,分别为(619.62±10.65) ng/L和(688.62±11.97) ng/L(表1)。与空白对照组相比,10、20和30 mg/L PFEPw-1处理组巨噬细胞培养上清液中TNF-α和IFN-γ的浓度显著增加(P<0.05)(表1);20和30 mg/L PFEPw-1处理组巨噬细胞培养上清液中IL-1和IL-6的浓度显著增加(P<0.05)(表1)。说明,一定添加浓度的PFEPw-1可促进小鼠巨噬细胞对IL-1、IL-6、TNF-α和IFN-γ的分泌。
表1 阿魏侧耳胞外多糖水提组分对巨噬细胞
IL-1、IL-6、TNF-α和IFN-γ分泌量的影响
Table 1 Effects of PFEPw-1 on the secretion of IL-1,
IL-6, TNF-α and IFN-γ from murine macrophages
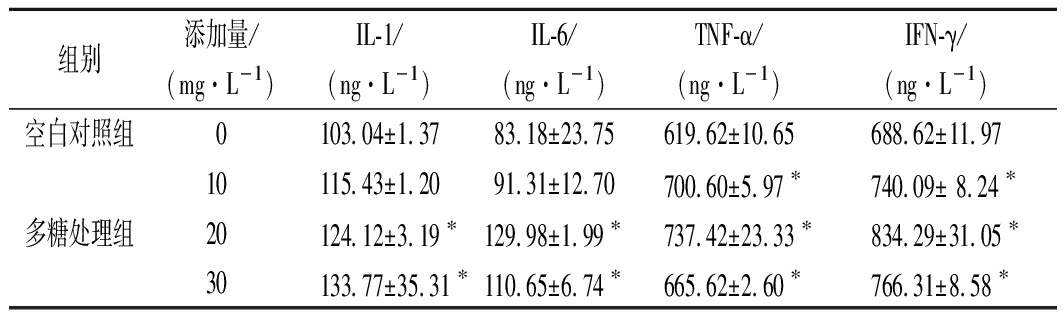
组别添加量/(mg·L-1)IL-1/(ng·L-1)IL-6/(ng·L-1)TNF-α/(ng·L-1)IFN-γ/(ng·L-1)空白对照组0103.04±1.3783.18±23.75619.62±10.65688.62±11.9710115.43±1.2091.31±12.70700.60±5.97∗740.09± 8.24∗多糖处理组20124.12±3.19∗129.98±1.99∗737.42±23.33∗834.29±31.05∗30133.77±35.31∗110.65±6.74∗665.62±2.60∗766.31±8.58∗
注:*表示与空白对照组相比差异显著(P<0.05)(下同)
相关研究显示,TNF-α、IL-1、IL-6、IFN-γ和NO是成熟单核细胞极化为M1型巨噬细胞后分泌的主要细胞因子或信号分子,M1型巨噬细胞可产生活性氮或活性氧,发挥机体免疫调节和抑制肿瘤细胞以及病原体增殖功能[20-21]。由此可见,阿魏侧耳胞外多糖水提组分PFEPw-1可能通过提高巨噬细胞对NO和活性氧合成及TNF-α、IL-1、IL-6和IFN-γ的分泌,促进M1型巨噬细胞的成熟,调节巨噬细胞的免疫能力,这与CHEN等[22]研究结果一致。
2.6 阿魏侧耳胞外多糖水提组分对体外培养的脾淋巴细胞IL-2和IFN-γ分泌量的影响
为研究PFEPw-1对淋巴细胞免疫功能的影响,使用小鼠脾脏淋巴细胞分离液无菌分离脾淋巴细胞,建立体外培养体系;收集PFEPw-1处理后的脾淋巴细胞培养上清,采用酶联免疫吸附实验测定其中的IL-2和IFN-γ浓度。结果显示,体外培养的脾淋巴细胞可分泌IL-2和IFN-γ,2种细胞因子浓度分别为(365.40±16.85) ng/L和(258.67±5.83) ng/L(表2)。与空白对照组相比,20和30 mg/L PFEPw-1处理组脾淋巴细胞的培养上清中IL-2和IFN-γ浓度显著增加(P<0.05),具有浓度依赖性(表2)。说明一定添加浓度的PFEPw-1可促进小鼠脾淋巴细胞对IL-2和IFN-γ的分泌。
表2 阿魏侧耳胞外多糖水提组分对脾淋巴细胞
IL-2和IFN-γ分泌量的影响
Table 2 Effects of PFEPw-1 on the secretion of
IL-2 and IFN-γ from spleen lymphocytes
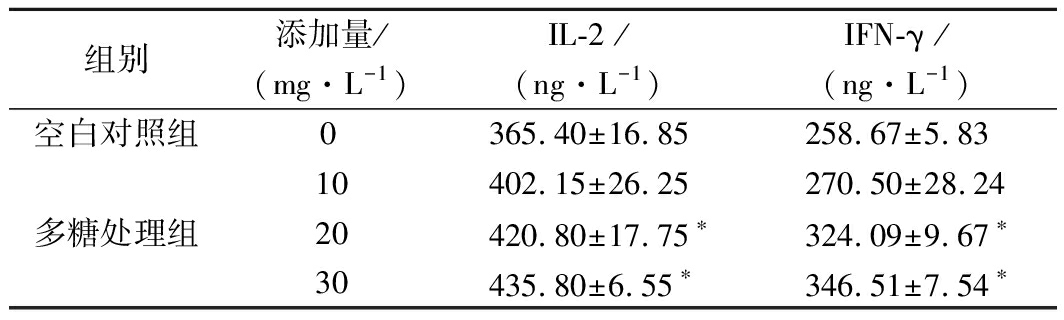
组别添加量/(mg·L-1)IL-2 /(ng·L-1)IFN-γ /(ng·L-1)空白对照组0365.40±16.85258.67±5.8310402.15±26.25270.50±28.24多糖处理组20420.80±17.75∗324.09±9.67∗30435.80±6.55∗346.51±7.54∗
IL-2是免疫系统中重要的细胞因子之一,可促进抗体形成、干扰素和肿瘤坏死因子的形成和释放,具有显著的免疫增强作用[23]。IFN-γ是由巨噬细胞和T淋巴细胞分泌的细胞因子,可激活巨噬细胞和淋巴细胞,促进细胞产生活性氧和氮的中间体或多种炎症因子,增强巨噬细胞的吞噬能力和淋巴细胞的免疫能力,具有抗肿瘤、抗病毒和免疫调节功能[24]。因此,阿魏侧耳胞外多糖水提组分PFEPw-1可能通过促进脾淋巴细胞对IL-2和IFN-γ的分泌,调节脾淋巴细胞的免疫能力。
相关研究显示,多糖的单糖组成和分子质量与其免疫调节活性有关,半乳糖、阿拉伯糖、甘露糖以及葡萄糖等单糖与多糖的免疫调节活性呈正相关[25],分子质量较大的多糖可能含有较多的高度重复结构,可以多向性交叉连接质膜表面受体,特异性增强免疫调节效果[26]。因此,阿魏侧耳胞外多糖水提组分PFEPw-1 可激活体外培养的巨噬细胞和脾淋巴细胞,具备较强的免疫调节活性,可能与其含有较高浓度的半乳糖、阿拉伯糖、甘露糖和葡萄糖以及分子质量较大有关。
3 结论
本研究将培养阿魏侧耳菌丝体的发酵液进行离心、浓缩、醇沉、除蛋白、透析、浓缩和冷冻干燥后得到阿魏侧耳胞外粗多糖,再用DEAE-52 纤维素柱层析和Sephadex G-100葡聚糖凝胶柱层析得到阿魏侧耳胞外多糖水提组分PFEPw-1,平均分子质量为64.2 kDa,单糖组成为D-甘露糖、D-葡萄糖、D-半乳糖和L-阿拉伯糖等,各单糖含量比依次为2.42∶3.90∶2.27∶1.41。体外细胞实验结果表明,在一定实验浓度范围内,PFEPw-1可激活巨噬细胞,促进巨噬细胞中NO和活性氧合成(P<0.05)以及TNF-α、IL-1、IL-6和IFN-γ的分泌(P<0.05),促进脾淋巴细胞对IL-2和IFN-γ的分泌(P<0.05)。本研究初步探究了阿魏侧耳胞外多糖水提组分PFEPw-1性质及其对体外培养的巨噬细胞和脾淋巴细胞的免疫调节作用,为阿魏侧耳胞外多糖的生产和应用提供理论基础。
[1] 孔繁祚. 糖化学[M].北京:科学出版社, 2007.
KONG F Z.Carbohydrate Chemistry[M].Beijing:Science Press, 2007.
[2] 邢来君, 李明春.真菌细胞生物学[M].北京:科学出版社, 2013.
XING L J, LI M C.Biology of the Fungal Cell[M].Beijing:Science Press, 2013.
[3] CAO J, TANG D, WANG Y, et al.Characteristics and immune-enhancing activity of pectic polysaccharides from sweet cherry(Prunus avium)[J].Food Chemistry, 2018, 254:47-54.
[4] 宋思媛, 王欣, 王泽旭, 等.银耳多糖对免疫抑制小鼠肠道菌群的保护作用[J].中国微生态学杂志, 2020, 32(7):772-776.
SONG S Y, WANG X, WANG Z X, et al.Protective effect of tremella polysaccharides on gut microbiota of immunosuppressed mice [J].Chinese Journal of Microecology, 2020, 32(7):772-776.
[5] HAN F, ZHANG S J, WAN M F, et al.Polysaccharides extracted from Phellinus linteus ameliorate high-fat high-fructose diet induced insulin resistance in mice[J].Carbohydrate Polymers, 2018, 200:144-153.
[6] 焦佳琪, 肖春, 吴清平, 等.重要食药用菌多糖降血糖分子机制研究进展[J].微生物学通报, 2021, 48(1):197- 209.
JIAO J Q, XIAO C, WU Q P, et al.Hypoglycemic effect of important edible and medicinal fungi polysaccharides:A review[J].Microbiology China, 2021, 48(1):197- 209.
[7] 范三红, 贾槐旺, 张锦华, 等.羊肚菌多糖纯化、结构分析及抗氧化活性[J].食品与发酵工业, 2020, 46(3):65-71.
FAN S H, JIA H W, ZHANG J H, et al.Purification, structural analysis and antioxidant activity of polysaccharides from Morchella esculenta[J].Food and Fermentation Industries, 2020, 46(3):65-71.
[8] 朱淼, 侯怡铃, 唐贤, 等.橙盖鹅膏多糖(AC-1)体外免疫调节活性、细胞毒性和抗肿瘤活性的研究[J].天然产物研究与开发, 2019, 31(9):1 481-1 490.
ZHU M, HOU Y L, TANG X, et al.The study of immunomodulatory activities,cytotoxicity and anti-tumor activities of polysaccharide from Amanita caesarea (AC-1) in vitro[J].Natural Product Research and Development, 2019, 31(9):1 481-1 490.
[9] 胡康. 羧甲基裂褶多糖的制备及其抗氧化、保湿活性研究[D].广州:华南理工大学, 2017.
HU K.Study on the preparation, antioxidant activity and moisture retention of carboxymethyl schizophyllan[D].Guangzhou:South China University of Technology, 2017.
[10] 王晶, 张春丹, 杨利敏, 等.阿魏侧耳胞外多糖对小鼠巨噬细胞的激活作用[J].食品工业科技, 2016, 37(10):356-359.
WANG J, ZHANG C D, YANG L M, et al.Activation effects of extracellular polysaccharides produced by Pleurotus ferulae Lanzi on murine macrophage[J].Science and Technology of Food Industry, 2016, 37(10):356-359.
[11] 范秀芝, 殷朝敏, 姚芬, 等.液体发酵黑木耳多糖的分离纯化及保湿性研究[J].现代食品科技, 2018, 34(10):49-57.
FAN X Z, YIN C M, YAO F, et al.Research on purification and moisturization effect of polysaccharides from Auricularia heimuer under submerged fermentation[J].Modern Food Science and Technology, 2018, 34(10):49-57.
[12] 王金辉,黄健,巩平,等.阿魏侧耳多糖抗癌作用机理研究[J].中国现代中药, 2011, 13(1):39-43.
WANG J H, HUANG J, GONG P, et al.Study on the mechanisms of anti-tumor effect of Pleurotus ferulae polysaccharide[J].Modern Chinese Medicine, 2011, 13(1):39-43.
[13] 田金强,朱克瑞,李新明,等.阿魏菇多糖的抗氧化功能及其对果蝇寿命的影响[J].食品科学, 2006,27(4):223-226.
TIAN J Q, ZHU K R, LI X M, et al.Antioxidation activity of Pleurotus nebrodensis mycelium polysaccharides in mice and its effect on senescence-resistance of fruit flies[J].Food Science, 2006,27(4):223-226.
[14] 闫训友,闫春江,史振霞,等.乙醇提取阿魏侧耳发酵液多糖的优化设计[J].食品工业科技, 2008, 29(1):197-199.
YAN X Y, YAN C J, SHI Z X, et al.Study on optimum extraction process of polysaccharide from Pleurotus ferulae Lanzi liquid fermentation by ethanol[J].Science and Technology of Food Industry, 2008, 29(1):197-199.
[15] 林增祥. 阿魏菇深层发酵及其多糖的研究与应用[D].乌鲁木齐:新疆大学, 2007.
LIN Z X.Studies on submerged fermentation technology and application of polysaccharide in Pleurotus ferulae Lanzi[D].Wulumuqi:Xinjiang University, 2007.
[16] 王晶, 闫训友, 王万雷, 等.阿魏侧耳胞外多糖对荷瘤小鼠免疫能力的影响[J].食品科学, 2014, 35(15):268-271.
WANG J, YAN X Y, WANG W L, et al.Effect of Extracellular Polysaccharides Produced by Pleurotus ferulae Lanzi on Immune Function of Tumor-Bearing Mice[J].Food Science, 2014, 35(15):268-271.
[17] 王晶, 常世民, 闫训友, 等.阿魏侧耳胞外多糖生物活性初步研究[J].西南农业学报, 2014, 27(4):1 433-1 437.
WANG J, CHANG S M,YAN X Y, et al.Bioactivitiy of Extracellular Polysaccharides Produced by Pleurotus ferulae Lanzi[J].Southwest China Journal of Agricultural Sciences, 2014, 27(4):1 433-1 437.
[18] 张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学, 2016, 37(4):158-163.
ZHANG Y Y, ZHANG B.Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in green tea[J].Food Science, 2016, 37(4):158-163.
[19] 王晶, 刘强, 孟微, 等.NO探针应用于细胞生物学实验的探索[J].实验室研究与探索, 2020, 39(6):175-179;184.
WANG J, LIU Q, MENG W, et al.Exploration of application of nitric oxide indicator in cell biology experiments[J].Research and Exploration in Laboratory, 2020, 39(6):175-179;184.
[20] WEISSER S B, MCLARREN K W, KURODA E, et al.Generation and characterization of murine alternatively activated macrophages[J].Methods in Molecular Biology, 2013, 946:225-239.
[21] VANNINI F,KASHFI K,NATH N,et al.The dual role of iNOS in cancer[J].Redox Bio, 2015, 6:334-343.
[22] CHEN Q, QI C, PENG G, et al.Immune-enhancing effects of a polysaccharide PRG1-1 from Russula griseocarnosa on RAW264.7 macrophage cells via the MAPK and NF-κB signalling pathways[J].Food and Agricultural Immunology, 2018, 29(1):833-844.
[23] 于善谦, 王洪海, 朱乃硕, 等.免疫学导论[M].北京:高等教育出版社, 2013.
YU S Q, WANG H H, ZHU N S, et al.Introduction to Immunology[M].Biejing:Higher Education Press, 2013.
[24] FENIMORE J, YOUNG H A.Regulation of IFN-γ expression[J].Advances in Experimental Medicine and Biology, 2016, 941:1-19.
[25] 肖颖, 吴梦琪, 张文清, 等.茯苓多糖 HPLC 指纹图谱与免疫活性的相关分析[J].华东理工大学学报(自然科学版), 2020, 46(5):672-679.
XIAO Y, WU M Q, ZHANG W Q, et al.Correlation analysis between hplc fingerprint of polysaccharides from poria cocos and immunological activity[J].Journal of East China University of Science and Technology, 2020, 46(5):672-679.
[26] 吴磊, 吴静, 胡居吾, 等.白莲莲子皮多糖的理化性质及免疫调节活性[J].现代食品科技, 2021, 37(5):1-9.
WU L, WU J, HU J W, et al.Physicochemical properties and immunomodulatory activity of polysaccharides from white lotus seed skins[J].Modern Food Science and Technology, 2021, 37(5):1-9.