茶(Camellia sinensis L.O.Ktze.)为山茶属多年生常绿木本植物,茶叶内富含多酚、咖啡碱、氨基酸、多糖和B族维生素等多种对人体有益的有效成分,具有降脂减肥[1]、抗氧化[2]、助消化和调理肠胃[3-5]等功效,是世界三大无酒精饮料之一[6]。随着国民生活水平的逐步提升,饮食性肥胖成为公众关注的重点健康问题。有研究表明,肥胖患者常伴有胰岛素抵抗症状致使机体营养代谢失调和脂肪积累,加剧高血脂、高血糖等并发疾病患病的风险,也是诱发非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)的重要原因之一[7]。
目前,关于改善胰岛素抵抗的西药包括:曲格列酮、口比格列酮、罗格列酮等二酮类化合物,在降低机体胰岛素抵抗的同时,对机体和肝脏均具有一定程度的毒副作用。因此,寻找一种天然有效降低胰岛素抵抗的食品或饮品具有重要意义。WU等[8]与PHUNG等[9]研究团队分别以流行病学分析和随机对照干预试验2个方向证明,习惯性饮茶可减少身体脂肪积累和腰围增加。CHEN等[10]研究者也提出,成人每日饮用10杯绿茶(约20 g)可有效预防肥胖,同时小鼠实验证明,饲料添加0.32%的表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)能显著降低小鼠体重增加,改善血浆总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)水平,减少脂肪吸收和积累。众多研究表明,茶能控制体重和体脂含量,对于肥胖及并发症具有显著调节作用。本实验以C57BL/6小鼠为研究对象,每天高脂饮食喂养小鼠模拟非健康饮食状态,通过补充1%茶叶水提物(tea water extract,TAE),研究TAE对于小鼠血脂水平、肝脏脂肪累积、胰岛素抵抗等功能指标的影响,以期阐明TAE改善小鼠胰岛素抵抗的作用机制,为进一步开发富含TEA的功能性食品和膳食补充剂提供依据。
1 材料与方法
1.1 TAE的制备
TAE制备过程:绿茶茶样500 g(茶叶原料品种:渝茶4号)来自重庆市农业科学院茶叶研究所,经过粉碎后过孔径350 μm筛,然后按照茶水质量比1∶20,用100 ℃沸蒸馏水浸提2次,第1次浸提20 min,第2次浸提10 min,合并滤液后过滤,于55 ℃下减压浓缩,最后冷冻干燥成粉110 g,-20 ℃冷冻保存备用。
1.2 HPLC分析
将TAE粉末25 mg溶解于25 mL甲醇中,经0.22 μm过滤器过滤后,采用安捷伦1200系列高效液相色谱仪进行定量分析。使用安捷伦C18色谱柱(250 mm×4.6 mm×5 μm)在278 nm处分离成分,控制条件(柱温30 ℃,剂量10 μL),流动相由甲醇(A)和水(B)组成,流速为0.8 mL/min,梯度洗脱方法:0~20 min,80%~50% A;20~25 min,50%~75% A。
1.3 动物和实验设计
8周龄雄性C57BL/6小鼠,购自重庆医科大学实验动物中心(认证号:SCXK 2018-0003),将小鼠圈养在(25±1) ℃和湿度受控的室内,其具有12 h光照/12 h黑暗循环。适应期为1周后,将小鼠随机分为4组(n=10):正常饮食(normal control,NC),高脂饮食(high fat diet,HF,脂肪40%卡路里),NT-NC补充1%(质量分数)TAE(NC+1%TAE)和HT-HF补充1%(质量分数)TAE(HF+1%TAE),持续13周。所有小鼠都可以自由饮水和饮食,每隔1 d记录体重和食物摄入量。
1.4 生化分析
关于血糖和胰岛素测量,在研究期的最后一天将小鼠禁食12 h后,使用罗氏血糖仪(Accu-Chek Active, Roche,Mannheim, Germany)从尾静脉血测定小鼠血糖水平。基于酶联免疫(enzyme linked immunosorbent assay,ELISA)方法通过胰岛素试剂盒测量小鼠胰岛素浓度。稳态模型评估(homeostasis model assessment,HOMA)是用于评估胰岛素抗性的方法,获得HOMA指数(HOMA-IR),计算如公式(1)所示:
(1)
1.5 血清指标测定
实验结束后,以20%(质量分数)氨基甲酸乙酯麻醉小鼠,心脏穿刺取小鼠血样,经3 000×g离心15 min,得到小鼠血清样本,采用中国上海中贝特生物技术有限公司的商用ELISA试剂盒测定小鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、TC、TG、胰岛素、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-2(interleukin-2,IL-2)、脂多糖(lipopolysaccharide,LPS)等指标。
1.6 组织学分析
制作石蜡切片,将小鼠附睾白色脂肪组织(epididymal white adipose tissue,Epi-WAT)在4%多聚甲醛中4 ℃固定浸泡,石蜡包埋,在5~7 μm处进行切片。苏木精和伊红(hematoxylin-eosin,HE)染色按标准方法进行[11],使用细胞轮廓仪软件分析Epi-WAT脂肪细胞的大小。小鼠肝脏冷冻切片(8~10 μm)用油红O(oil red O)染色,在正置显微镜下进行病理组织学观察。
1.7 统计分析
所有结果均以平均值±标准差表示。用SPSS 18.0软件进行单因素方差分析和Duncan多区间检验。
2 结果与分析
2.1 TAE生化成分分析
实验采用茶叶国标法和高效液相色谱法对TAE进行理化成分分析及儿茶素、咖啡因含量分析。TAE的理化成分含量如图1-A所示,茶多酚占比53.98%,氨基酸占比7.35%,咖啡碱占比7.03%,可溶性糖占比23.49%。TAE中儿茶素、咖啡因(caffeine, CAF)含量分析如图1-B所示,其中EGCG含量达(126.82±5.22) mg/g、CAF含量达(50.01±1.17) mg/g。

A-茶叶水提物常规理化成分;B-茶叶水提物儿茶素、咖啡因含量
图1 TAE生化成分分析
Fig.1 Biochemical analysis of TAE
2.2 TAE预防高脂诱导引起的肥胖
为研究TAE对于雄性C57BL/6小鼠体重的影响,8周龄雄性C57BL/6小鼠分别饲喂正常饮食NC、NC+1%TAE与高脂饮食HF、HF+1%TAE,共13周。如图2-A所示,高脂诱导饮食显著增加小鼠体重,是NC组的1.32倍,通过添加1%TAE可以显著降低高脂诱导小鼠的体重。喂食期间,添加1%TAE不影响正常饮食或高脂饮食小鼠的摄食量(图2-B)。
2.3 TAE改善高脂诱导引起的血脂异常和肝损伤
为了探索TAE抑制高脂血症的能力,研究测量了小鼠的血脂浓度。如图3-A,图3-B所示,实验饮食13周后,TG和TC浓度显著升高,补充1%TAE喂食可显著降低小鼠TG、TC含量。此外,由于血清ALT和AST水平是2个关键的肝脏病理学预后指标[12],所以研究测定了小鼠血清AST和ALT水平。如图3-C、图3-D所示,高脂诱导喂食以后,HF小鼠血清AST和ALT水平显著增高,表明小鼠肝脏受到损伤,而HT小鼠显著较低的血清AST和ALT水平水平,表明TAE对高脂诱导的肝损伤具有保护作用。

A-体重;B-饮食量
图2 TAE预防高脂诱导引起的肥胖
Fig.2 TAE prevents obesity induced by high-fat
注:数据显示为每组10只小鼠的平均值±SD;*表示与NC组相比
差异显著(P<0.05);#表示与HF组相比差异显著(P<0.05)(下同)
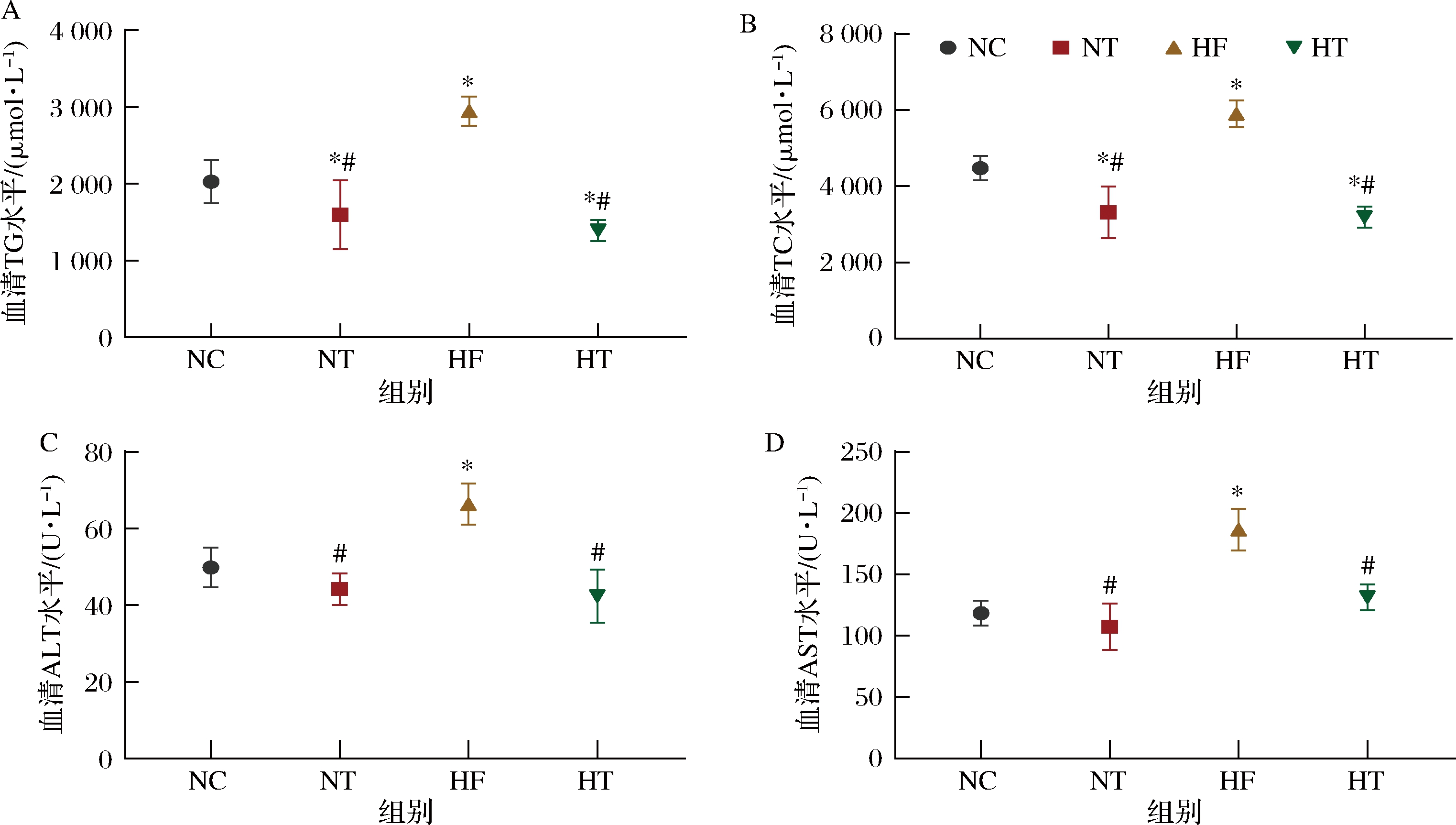
A-TG;B-TC;C-ALT;D-AST
图3 TAE改善高脂诱导引起的血脂异常和肝损伤
Fig.3 TAE improves dyslipidemia and liver damage induced by high-fat
2.4 TAE改善高脂诱导引起的胰岛素抵抗
有研究表明,肥胖和胰岛素抵抗密切相关。因此研究测定评估了小鼠空腹血糖、胰岛素水平及相应的HOMA-IR。如图4-A~图4-C所示,与NC组相比,HF高脂诱导了更高的空腹血糖和胰岛素浓度,而TAE显著逆转了它们的含量,通过添加TAE,HT组小鼠相应的HOMA-IR也显著降低到接近正常水平。
2.5 TAE可降低高脂诱导引起的全身低度炎症
通过研究TAE对小鼠血清内毒素的影响[LPS和炎性细胞因子(TNF-α和IL-2)水平],发现TAE可以显著降低高脂喂养肥胖小鼠血清的内毒素LPS、TNF-α、IL-2水平(图5),表明TAE对小鼠的肝脏脂肪变性有很强的抑制作用,并能改善全身低度炎症。

A-胰岛素水平;B-空腹血糖水平;C-HOMA-IR
图4 TAE改善高脂诱导引起的胰岛素抵抗
Fig.4 TAE improves insulin resistance induced by high-fat

A-IL-2;B-LPS;C-TNF-a
图5 TAE可降低高脂诱导引起的全身低度炎症
Fig.5 TAE can reduce systemic low-grade inflammation induced by high-fat
2.6 TAE预防高脂诱导小鼠Epi-WAT肥大和肝脏脂肪变性
通过自动图像分析测量脂肪细胞大小,从小鼠Epi-WAT切片中获得脂肪细胞的大小(图6-A)。在400倍视野下,HF与NC相比,平均脂肪细胞大小较大,而HT组可以明显地观察到细胞数目比HF多,平均脂肪细胞大小接近于NC组的正常水平。肝脏油红O染色结果显示(图6-B),HF组小鼠肝脏脂肪着色明显,可见大量的脂肪滴。HT与HF相比,切片内着色脂肪颗粒明显减少,分布稀疏,表明TAE能明显抑制HF小鼠肥胖和肝脏脂质积累,防止肝脏脂肪变性。

A-Epi-WAT、HE染色;B-油红O染色
图6 TAE对高脂诱导小鼠Epi-WAT、肝脏病理变化HE染色和油红O染色的影响
Fig.6 Effect of TAE on Epi-WAT and liver pathological changes in mice induced by high-fat in HE staining and oil red O staining
3 讨论
肥胖是目前备受全球关注的健康问题,主要表现为机体营养代谢失调和脂肪积累,现已成为影响人类健康生活的重要因素,其根本原因在于能量摄入超过了能量消耗。有研究表明,绿茶可以增强脂肪分解和能量消耗,以防止肥胖[13-14],HAMDAOUI等[15]通过动物实验证明,通过对Wistar大鼠灌胃5%的绿茶和红茶煎煮茶汤,能有效减少大鼠脂肪摄入,降低肝脏和血浆TG含量,减少脂肪累积,减轻体重;LEE等[16]研究普洱茶降脂减肥实验中发现,普洱茶可显著降低高脂饮食大鼠体重和脂肪系数。本研究对高脂诱导饮食C57BL/6小鼠喂养13周TAE,观察TAE对于小鼠肥胖和胰岛素抵抗的影响。实验发现,在高脂诱导饮食小鼠模型中,TAE喂养可显著降低小鼠体重增加和Epi-WAT平均脂肪细胞大小,使其接近对照水平,与之前研究结果保持一致,研究认为TAE具有显著的治疗饮食性肥胖的作用。
胰岛素抵抗与肥胖、非酒精性脂肪肝病、高胰岛素血症和血脂异常等严重代谢障碍密切相关[17]。实验中发现,高脂诱导喂养HF小鼠血糖和胰岛素水平显著增高,而TAE的补充使用产生了保护作用,抵消了肥胖小鼠胰岛素抵抗的增加。非酒精性脂肪性肝病的主要特征是脂肪变性,是由于细胞质脂质在肝细胞内过度积累而形成的,当肝脏中脂肪酸的合成或导入速度超过出口或分解代谢速度时,肝脏脂肪变性容易发生[18]。本研究中,添加1%TAE喂养的HT组小鼠能显著降低血清TG以及肝脏脂质积累,有助于改善肝脏脂肪变性。同时发现,补充1%TAE喂养可显著降低血清TC水平和ALT、AST浓度,这与CHEN等[19]在研究绿茶提取物帮助SD大鼠抵抗高能量饮食诱导的肥胖实验的研究结果保持一致,绿茶提取物可以增加大鼠能量消耗,减少脂肪积累,降低血清TG、TC、游离脂肪酸、LDL、ALT、AST浓度。因此,推断补充TAE可能是一种潜在的饮食补充,影响体内胆固醇代谢,以防止高胆固醇血症的发生,后续将对于胆固醇代谢相关基因检测,解析TAE补充后TC降低的可能机制做进一步探究。
高脂肪饮食会引起肠道菌群紊乱,导致代谢内毒素血症,异位脂肪沉积以及低水平的全身炎症。有研究表明,绿茶提取物与麦芽低聚糖协同作用,可以帮助饮食性肥胖小鼠的肠道微生态恢复正常,同时二者协同可降低小鼠血浆LPS、炎性细胞因子Resistin、TNF-α、IL-1、脂联素和IL-6的水平[20]。AXLING等[21]在研究绿茶粉与Lactobacillus plantarum DSM 15313(Lp)协同抑制肠道有害菌群,促进有益菌群增殖的实验中发现,复配物可降低小鼠炎症指标PAI-1、IL-6、MCP-1、TNF-α及TLR4的水平,改善小鼠脂质代谢。本实验中也发现TAE可以显著降低高脂喂养肥胖小鼠血清的内毒素LPS、TNF-α、IL-2水平,抑制肝脏脂肪变性,减轻了内毒素诱导的小鼠NAFLD,改善肠道菌群微生物菌群及代谢。但目前缺乏基础性的调节机制研究,证明TAE在调节胰岛素抵抗过程中与肠道微生物相互作用的因果关系。因此,本研究后续将从微生物种类及相关代谢通路上分析,阐明具体的作用靶点和调节机制,更深层次挖掘调节机理。
本研究以高脂饮食诱导C57BL/6小鼠模型为研究对象,通过补充1%TAE 13周后发现,TAE可显著降低高脂诱导小鼠体重增加和Epi-WAT平均脂肪细胞大小,减轻高脂诱导所致胰岛素抵抗,改善糖稳态、脂质代谢、肝氧化损伤等代谢参数。结果表明,TAE对高脂饮食引起的肥胖、胰岛素抵抗、肝脏脂肪变性和低度炎症具有保护作用,为改善饮食所致胰岛素抵抗,降低Ⅱ型糖尿病的发生提供有效途径,并为今后开发富含TAE的功能性食品和膳食补充剂提供重要的实验基础和理论支持。
[1] 袁野,章斌,陆小琴,等.雅安藏茶对脂质代谢紊乱大鼠减肥降脂作用研究[J].中药药理与临床,2016(2):161-164.
YUAN Y, ZHANG B, LU X Q, et al.Study on anti-obese and hypolipidemic effects of Ya′an Tibetan Tea in rats with dyslipidemias[J].Pharmacology and Clinics of Chinese Materia Medica,2016(2):161-164.
[2] 郭金龙. 雅安藏茶活性级分筛选和评价研究[D].雅安:四川农业大学,2010.
GUO J L.Screening and evaluation of active fractions of Ya′an Tibetan Tea[D].Ya′an:Sichuan Agricultural University,2010.
[3] 屠幼英,须海荣,梁惠玲,等.紧压茶对胰酶活性和肠道有益菌的作用[J].食品科学, 2002,23(10):113-116.
TU Y Y, XU H R, LIANG H L, et al.Effects of three kings of preesed teas compounds on the activities of three enzymes and two microoganisms[J].Food Science,2002,23(10):113-116.
[4] 吕晓华,徐家玉,孙冉,等.藏茶保健作用的人体试饮研究[J].食品研究与开发,2017,38(4):168-171.
LYU X H, XU J Y, SUN R, et al.Human trial of health effects of Tibetan Tea[J].Food Research and Development,2017,38(4):168-171.
[5] 李解,陈雪皎,郭承义,等.雅安藏茶和低聚木糖复配物润肠通便作用[J].食品科学,2015,36(1):220-224.
LI J, CHEN X J, GUO C Y, et al.Individual and combined laxative effects of Ya′an Tibetan Tea and xylooligosaccharide in constipation model rats[J].Food Science, 2015,36(1):220-224.
[6] 高丽萍,夏涛.茶树次生代谢产物的细胞工程技术研究进展[J].中国茶叶加工, 2000(2):27-31.
GAO L P, XIA T.Development of cell engineering on the secondary metabolic products of tea plant[J].China Tea Processing,2000(2):27-31.
[7] NAAZ H A.Obesity, inflammation,and insulin resistance[J].Gastroenterology,2007,132(6):2 169-2 180.
[8] WU C H, LU F H, CHANG C S, et al.Relationship among habitual tea consumption, percent body fat, and body fat distribution[J].Obesity Research,2003,11(9):1 088-1 095.
[9] PHUNG O J, BAKER W L, MATTHEWS L J, et al.Effect of green tea catechins with or without caffeine on anthropometric measures:A systematic review and meta-analysis[J].American Journal of Clinical Nutrition,2010,91(1):73-81.
[10] CHEN Y K, CHEUNG C, REUHL K R, et al.Effects of green tea polyphenol (-)-epigallocatechin-3-gallate on newly developed high-fat/Western-style diet-induced obesity and metabolic syndrome in mice[J].Journal of Agricultural & Food Chemistry, 2011,59(21):11 862-11 871.
[11] XU P F, DAI S, WANG J, et al.Preventive obesity agent montmorillonite adsorbs dietary lipids and enhances lipid excretion from the digestive tract[J].Scientific Reports,2016,6:19659.
[12] ZUNLI K, ZIYAN Z, YUANYUAN Z, et al.PMFs-rich Citrus extract prevents the development of non-alcoholic fatty liver disease in C57BL/6 J mice induced by a high-fat diet[J].Journal of Functional Foods,2018,47:28-39.
[13] BOLIN A P, FILHO C P B S, MARINOVIC M P, et al.Polyphenol-rich green tea extract induces thermogenesis in mice by a mechanism dependent on adiponectin signaling[J].The Journal of Nutritional Biochemistry,2019,78:108322.
[14] NEYRINCK A M, BINDELS L B, GEURTS L, et al.A polyphenolic extract from green tea leaves activates fat browning in high-fat-diet-induced obese mice[J].Journal of Nutritional Biochemistry,2017,49:15-21.
[15] HAMDAOUI M H, SNOUSSI C, DHAOUADI K, et al.Tea decoctions prevent body weight gain in rats fed high-fat diet;black tea being more efficient than green tea[J].Journal of Nutrition & Intermediary Metabolism,2016,6(C):33-40.
[16] LEE L K, FOO K Y.Recent advances on the beneficial use and health implications of Pu-Erh tea[J].Food Research International, 2013,53(2):619-628.
[17] YKI-JARVINEN H.Non-alcoholic fatty liver disease as a cause and a consequence of metabolic syndrome[J].The Lancet Diabetes & Endocrinology, 2014,2(11):901-910.
[18] BRADBURY M W, BERK P D.Lipid metabolism in hepatic steatosis[J].Clinics in Liver Disease,2004,8(3):639-671.
[19] CHEN L H, CHIEN Y W, LIANG C T, et al.Green tea extract induces genes related to browning of white adipose tissue and limits weight-gain in high energy diet-fed rat[J].Food & Nutrition Research,2017,61(1):1 347 480-1 347 490.
[20] SINGH D P, SINGH J, BOPARAI R K, et al.Isomalto-oligosaccharides, a prebiotic, functionally augment green tea effects against high fat diet-induced metabolic alterations via preventing gut dysbacteriosis in mice[J].Pharmacological Research, 2017,123:103-113.
[21] AXLING U, OLSSON C, XU J, et al.Green tea powder and Lactobacillus plantarum, affect gut micro-biota, lipid metabolism and inflammation in high-fat fed C57BL6 J mice[J].Nutrition & Metabolism,2012,9(1):105-123.