人体正常代谢会产生活性氧(reactive oxygen species,ROS),参与细胞的生理和病理过程。然而在一些极端环境下,会产生过量的ROS,当超过细胞的自然抗氧化防御能力时,过高浓度的ROS会破坏氧化还原稳态,导致机体细胞凋亡,特别是自由基不受抑制的产生和长时间积累与癌症、心血管疾病等慢性疾病密切相关[1]。近年来以蛋白质水解物和多肽形式的天然抗氧化剂因其无毒、高效和环保等特点被广泛应用于食品与药物加工中。比如抗氧化肽可以在食品配方中作为预防、延缓氧化应激相关疾病的成分;此外,抗氧化肽还可作为食品添加剂抑制食品的氧化等,对于防止含有油脂的食品氧化性腐败尤为有用[2-3]。已有许多研究已证明,从植物、动物中发现的多肽可以通过清除自由基,提高细胞内抗氧化酶活性和谷胱甘肽含量水平,进而抑制氧化应激[4]。
鸭胚蛋是健康受精蛋经特殊孵化工艺,使胚胎生长发育且具有生命力的蛋。胚蛋味道鲜美且富有营养,民间早已有食用的习惯,并作为营养、进补的佳品[5]。现代医学证明:胚蛋是优质蛋白的重要来源,也是最完善的天然食品之一[6],其所含的蛋白质、脂类物质、矿物质、维生素、干扰素、溶酶菌、免疫球蛋白等[7-8]与人体代谢和生理调节功能有关。据统计,我国蛋鸭总量占到禽蛋饲养量70%以上[9],且鸭蛋与鸡蛋、鹅蛋等相比有较高含量的蛋白质、必需氨基酸、维生素B1、维生素D3、卵磷脂等[10]。
研究表明,从鸡胚蛋中提取的多肽能以完整形式直接吸收进入人血液循环并参与机体的生理功能和代谢调节,具有增强人体免疫力和延缓衰老等显著功效[11];以鸡胚蛋为原料,制成复合鸡胚肽口服液、鸡胚营养液及冲剂等也深受消费者喜爱[12-13]。然而通过查阅文献发现,国内外对鸭胚蛋中多肽进行系统性研究的报道屈指可数。王旭清[14]采用不同工艺参数分离鉴定麻鸭鸭胚蛋和樱桃谷SM3鸭鸭胚蛋中的多肽,2条多肽均具有良好的起泡性、乳化性及稳定性,且通过动物试验验证其良好的耐缺氧性;吴礼萍[7]将鸭胚蛋中多肽与植物多糖进行复合,功能评价研究表明复合物具有较好的抗氧化及抗疲劳功能。本课题组前期研究发现,鸭胚蛋孵育期间抗氧化物质含量呈先上升后下降的趋势,且第15天时鸭胚蛋酶解物抗氧化活性最强,采用LC-MS/MS数据库功能注释、生物信息学预测和热点基肽等技术,从第15天的鸭胚蛋酶解物中识别到5条具有较强抗氧化功能多肽:VK24、GV17、RK14、LA18和TD12,其中TD12含抗氧化活性的氨基酸比例最高,超过50%[15]。因此本试验以鸭胚胎源抗氧化肽TD12为研究对象,通过化学方法,体外细胞试验等方法,验证鸭胚胎源抗氧化肽TD12对HepG2细胞氧化应激损伤的保护作用,为鸭胚胎源肽在氧化应激防护方面发挥的作用提供有力证据,以期为鸭胚蛋抗氧化功能性食品的开发提供一些思路。
1 材料与方法
1.1 材料与试剂
鸭胚源肽抗氧化肽TD12(Thr-Val-Asp-Gly-Pro-Ser-Gly-Lys-Leu-Trp-Arg-Asp,>98%),杭州专肽生物技术有限公司制备;人肝癌细胞(HepG2),上海富衡生物科技有限公司提供;无血清细胞冻存液,上海瑟欧生物科技有限公司;DMEM(dulbecco′s modified eagle medium)培养基、胎牛血清(fetal bovine serum,FBS)和0.25%胰酶,美国Gibco公司;Count star细胞计数板、H2O2溶液(分析纯),美国Sigma公司;DPPH自由基清除能力检测试剂盒、ABTS阳离子自由基清除能力检测试剂盒、羟自由基清除能力检测试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒、Hoechst 33342 染色剂、DCFH-DA活性氧ROS荧光探针、磷酸盐缓冲液(phosphate buffer saline,PBS)片剂、二甲基亚砜(dimethyl sulfoxide,DMSO)试剂和非变性组织细胞裂解液,北京索莱宝科技有限公司;CCK-8细胞增殖检测试剂盒,浙江如耀生物科技有限公司;BCA蛋白浓度测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、过氧化氢酶(catalase,CAT)和细胞丙二醛(malondialdehyde,MDA)测定试剂盒,南京建成生物研究工程所;细胞因子肿瘤坏死因子-ɑ(TNF-ɑ)、人白细胞介素-4(IL-4)、人白细胞介素-8(IL-8)和人白细胞介素-10(IL-10)酶联免疫检测试剂盒,碧云天生物技术有限公司。
1.2 仪器与设备
371高温灭菌CO2细胞培养箱、Count star全自动细胞计数仪、EVOS XL细胞成像系统、EVOS FL荧光倒置显微镜、BLF-6K 离心机,美国Sigma公司;WSZ-20A旋涡混匀器,上海一恒科学仪器有限公司;ATX224分析天平,日本岛津公司;369003台式低温离心机,美国Beckman Coulter公司;HVE50自动高压灭菌器,日本Hirayama公司;U-3900分光光度计,日本株式会社日立高新技术科学;Synergy H1多功能微孔板检测仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1 鸭胚源抗氧化肽TD12体外抗氧化能力检测
鸭胚源抗氧化肽TD12清除DPPH自由基、ABTS阳离子自由基和羟自由基能力均按照试剂盒说明书步骤操作,总抗氧化能力检测制备FeSO4标准曲线为:Y=21.056 X +0.008 6,R2=0.998 4,然后依照标准曲线求得不同浓度TD12的总抗氧化能力。待测样品为终浓度0.25、0.5、1、2.5、5 μmol/L的TD12溶液,每组待测样品浓度均设置3个重复。
1.3.2 鸭胚源抗氧化肽TD12对HepG2细胞毒性作用检测
HepG2细胞培养参考DONATO等[16]的方法,10%(体积分数)FBS混合DMEM高糖培养基,将细胞置于5%(体积分数)CO2细胞培养箱内进行培养。待HepG2细胞贴壁生长,融合成致密单层且细胞覆盖率达80%以上时,用0.25% 胰蛋白酶溶液消化传代或进行下一步试验。
鸭胚源抗氧化肽TD12对HepG2细胞的毒性检测参照张燕等[17]的方法并略作改进。将5×105cells/mL的HepG2细胞接种于96孔板中(每组设置6个复孔),设置空白组、对照组和试验组,空白组加入90 μL培养基,对照组和试验组加入90 μL细胞悬液,培养24 h细胞贴壁,空白组、对照组分别加入10 μL的培养液,试验组加入10 μL终浓度为0.2、0.25、0.3、0.5、1、2.5、5 μmol/L和1、5 mmol/L的鸭胚源抗氧化肽TD12溶液,在37 ℃,5% CO2培养箱中孵育24 h后,弃去旧培养液,加入CCK-8[18]工作液,继续孵育4 h,酶标仪检测450 nm处OD值。筛选出TD12高、中、低剂量组进行后续试验。细胞存活率计算如公式(1)所示:
HepG2细胞活率![]()
(1)
式中:A0表示空白组OD值;AC表示对照组OD值;AS表示试验组OD值。
1.3.3 H2O2诱导HepG2细胞氧化应激损伤的模型建立
参照XIE等[19]的方法并略作改进,具体操作为:将6×104cells/mL的HepG2细胞接种于96孔板中(每组设置6个复孔),设置空白组(90 μL培养基)、对照组(90 μL细胞悬液)和试验组(90 μL细胞悬液),在37 ℃,5% CO2培养箱中孵育24 h后,空白组和对照组分别加入10 μL培养液,试验组加入终浓度为100、200、400、600、800 μmol/L的H2O2,继续孵育 20、40、60、120、240 min 后,采用CCK-8法检测细胞存活率,HepG2细胞氧化损伤模型选取的最佳损伤浓度为细胞存活率在50%[20]最佳。
1.3.4 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞的保护作用
将密度为 5×104 cells/mL 的HepG2细胞接种于96孔板中(每组设置6个复孔),试验分为对照组、损伤组和TD12低剂量组,中剂量组及高剂量组,每组加入100 μL细胞混悬液。在37 ℃,5% CO2 培养箱中孵育24 h后,对照组和损伤组加入20 μL培养基,TD12低、中、高剂量组分别加入20 μL终浓度0.25、1、5 μmol/L的溶液继续孵育24 h。然后,对照组加入10 μL培养基,损伤组和保护组分别加入10 μL终浓度为400 μmol/L的 H2O2溶液,继续孵育1 h后,采用CCK-8法检测细胞存活率。
1.3.5 Hoechst 33342染色检测HepG2细胞凋亡
参照SHI等[21]的方法并做改进,将8×105 cells/mL的HepG2 细胞接种于6孔板中(每组设置3个复孔),细胞分为对照组、损伤组、TD12低剂量组、中剂量及高剂量组,按照1.3.4的方法处理,接着各组加入1 mL稀释好的Hoechst 33342 工作液,在37 ℃,5% CO2培养箱中染色30 min,弃染色液,用PBS洗涤3次,荧光显微镜下观察各组细胞状态。
1.3.6 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内ROS含量的影响
HepG2细胞内ROS含量检测方法采用DCFH-DA荧光探针法[22],将密度为 5×104 cells/mL的HepG2细胞接种于96孔荧光酶标板中(每组设置6个复孔),按照1.6方法将细胞分组,培养结束后,弃各孔培养液,并加入10 μmol/L的DCFH-DA溶液,37 ℃ 培养箱中孵育30 min后,弃上清液,用PBS清洗3次,用多功能酶标仪(激发波长485 nm,发射波长525 nm)检测荧光强度,同时荧光倒置显微镜拍照。
1.3.7 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内抗氧化酶活性的影响
将密度为6×105 cells/mL 的HepG2细胞接种于6孔板中(每组设置3个复孔),按照1.3.4方法将细胞分组,细胞培养结束后,吸取细胞培养液,用于检测乳酸脱氢酶(lactate dehydrogenase,LDH)含量;各孔加入600 μL细胞裂解液,冰上裂解30 min,在4 ℃,1 200 r/min离心10 min,吸取各组细胞悬浮液备用。制作牛血清蛋白标准曲线:Y= 0.000 5X+0.161 3,R2=0.996 2,根据标准曲线及BCA试剂盒操作说明书求得各组细胞蛋白浓度,LDH、MDA、SOD、CAT、GSH-Px含量检测均严格按照试剂盒操作。
1.3.8 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内细胞因子含量的影响
细胞因子检测方法参照文献介绍的ELISA法[23],将密度为5×105 cells/mL 的HepG2细胞接种于6孔板中(每组设置3个复孔),按照1.3.4方法将细胞分组,细胞培养结束后,按照TNF-ɑ、IL-8、IL-4和IL-10 酶联免疫试剂盒说明书进行操作。
1.4 统计与分析
数据均以平均值±标准差![]() 来表示。使用Excel 2019 和SPSS 26.0处理,GraphPad Prism v 8.0作图,差异显著性通过单因素方差分析(ANOVA)来分析。
来表示。使用Excel 2019 和SPSS 26.0处理,GraphPad Prism v 8.0作图,差异显著性通过单因素方差分析(ANOVA)来分析。
2 结果与分析
2.1 鸭胚源抗氧化肽TD12体外抗氧化能力
鸭胚源抗氧化肽TD12体外抗氧化能力的研究结果见图1。随着TD12浓度的增加,其清除DPPH自由基能力有小幅提升,浓度为1 mmol/L的TD12对DPPH自由基清除率最高,为(55.31±3.01)%;清除ABTS阳离子自由基、羟自由基能力和总抗氧化能力均呈浓度依赖性增加,浓度为1 mmol/L时清除ABTS阳离子和羟自由基能力达(92.97±4.40)% 和(98.53±4.08)%,总抗氧化能力为(81.69±1.06)μmol/g。CHI等[24]和MA等[25]的研究证明,从蓝鳍金枪鱼和荞麦蛋白质中测定的Gly-Pro-Pro、Gly-Val-Pro-Leu-Thr和Val-Phe-Pro-Trp 肽有较强的清除自由基的能力,其中Trp可产生氢自由基,从而提高肽的抗氧化活性。鸭胚源抗氧化肽TD12中含有较多的疏水氨基酸Trp、Gly、Pro序列,因此从一定程度上对清除自由基更加敏感。

图1 TD12体外抗氧化能力
Fig.1 TD12 in vitro antioxidant capacity
2.2 鸭胚源抗氧化肽TD12对HepG2细胞毒性作用
TD12对HepG2细胞活力的影响研究结果见图2。如图2所示,浓度在0.25 μmol/L~5 mmol/L的TD12作用细胞24 h后,各组细胞活力均>95%,与对照组没有差异(P>0.05)。此结果表明TD12对HepG2细胞无毒性作用。本研究选取0.25 μmol/L低剂量组、1 μmol/L中剂量组、5 μmol/L高剂量组作为鸭胚源抗氧化肽TD12对H2O2诱导细胞氧化损伤的干预剂量进行后续研究。

图2 不同浓度TD12溶液对HepG2细胞活力影响
Fig.2 Effect of TD12 solution of different concentrations on
the viability of HepG2 cells
2.3 H2O2诱导HepG2细胞氧化损伤的模型建立
不同浓度H2O2及时间对HepG2细胞存活率的影响见图3。如图3所示,随着H2O2浓度和处理细胞时间增加,细胞存活率降低。100和200 μmol/L的H2O2作用 HepG2细胞40 min后,细胞存活率分别为(89.06±3.40)%、(83.62±1.46)%,细胞存活率与对照组没有差异(P>0.05),此时H2O2对细胞没有致死作用,细胞凋亡率较低,未能达到氧化应激状态。终浓度为400 μmol/L的H2O2作用60 min 后,细胞存活率下降至(52.65±2.19)%(P<0.01);而终浓度为600、800 μmol/L的H2O2作用60 min后,细胞存活率仅为对照组的(32.08±2.06)%、(29.41±3.21)%(P<0.01),120和240 min时细胞存活率明显降低(P<0.01),这是由于氧化应激过于严重,直接导致细胞损伤死亡导致的结果。故选择400 μmol/L的H2O2浓度作为诱导HepG2损伤模型的最佳浓度,细胞在此状态下,既达到损伤的要求,又存有一定活力,符合细胞试验的要求。

图3 不同浓度H2O2及时间对HepG2细胞存活率影响
Fig.3 Effects of different concentrations of H2O2 and
time on the survival rate of HepG2 cells
2.4 Hoechst 33342染色检测HepG2细胞凋亡
不同浓度H2O2作用HepG2细胞1 h后的染色镜检结果见图4。100与200 μmol/L H2O2处理下,细胞间连接紧密,细胞核大小均一,与对照组相比活细胞数量无明显减少;400 μmol/L时,细胞核内部分染色质断裂,此时细胞凋亡增加,有明显的细胞呈碎块状;600、800 μmol/L时,荧光密度较低,氧化应激已过于严重,此时荧光微弱,细胞存活率极低,这与2.3中CCK-8检测结果一致。

a-对照组;b-100 μmol/L H2O2;c-200 μmol/L H2O2;
d-400 μmol/L H2O2;e-600 μmol/L H2O2;f-800 μmol/L H2O2
(标尺=200 μm)
图4 不同浓度H2O2作用HepG2细胞1 h后Hoechst
33342染色结果
Fig.4 Hoechst 33342 staining results of HepG2 cells treated
with different concentrations of H2O2 for 1 h
2.5 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞的保护作用
各剂量组TD12对HepG2细胞的保护作用见图5。由图5可知,在0.25~5 μmol/L,随着TD12浓度的增加,细胞相对活力呈浓度依赖性升高。H2O2处理的损伤组细胞存活率为对照组的(52.26±3.14)%;经TD12低剂量组(0.25 μmol/L)预处理细胞后,细胞存活率提升至(59.92±1.35)%,与对照组活率存在差异(P<0.05);当TD12浓度提高至1 μmol/L和5 μmol/L时,细胞存活率为(81.49±3.22)%和(97.43±2.17)%,均与损伤组细胞存在明显差异(P<0.01),在TD12高剂量处理下,细胞存活率几乎接近对照组。KETANWA等[26]的研究表明:肽链的氨基酸组成或空间结构对蛋白质水解物的抗氧化活性有较大的影响,含有Ala、Leu、Pro以及芳香族氨基酸Trp、Phe、Tyr和His的肽链能有效增强清除自由基能力。TD12(Thr-Val-Asp-Gly-Pro-Ser-Gly-Lys-Leu-Trp-Arg-Asp)中含抗氧化氨基酸比例较高,可见TD12对细胞氧化应激损伤的保护作用与这些氨基酸密切相关,且2.1中证明TD12有较强清除ABTS阳离子自由基与羟自由基能力,在一定程度上能防止羟自由基诱导的DNA损伤,因为非极性氨基酸残基之间的疏水相互作用能提高抗氧化能力活性[27]。结合2.2细胞毒性试验结果可以证明:鸭胚源抗氧化肽TD12对细胞的保护作用是通过抑制氧化应激实现的,并不是刺激细胞增殖实现的。

图5 各剂量组TD12对HepG2细胞的保护作用
Fig.5 The protective effect of TD12 in each dose group on HepG2 cells
注:与对照组相比,##表示差异显著(P<0.01);与损伤组相比,
*表示差异显著(P<0.05),**差异极显著(P<0.01)(下同)
2.6 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内ROS含量的影响
TD12对H2O2诱导损伤的HepG2细胞内ROS含量的影响试验结果见图6和图7,图6为荧光图片,图7为细胞相对荧光强度。DCFH-DA是一种可透过细胞膜的荧光染料,可以定性定量的检测ROS自由基的动态变化[28]。当400 μmol/L H2O2诱导HepG2细胞发生氧化应激后,增加了胞内ROS积累,大约为对照组的4倍,高水平的ROS可以导致关键细胞生物聚合物(如蛋白质、脂质和核酸)破坏损伤的反应,此时能改善氧化应激反应的方法是提供外源性肽来补充细胞抗氧化剂,经过不同剂量组鸭胚源抗氧化肽TD12预处理能显著抑制H2O2诱导的细胞活力下降,并以剂量依赖性方式减弱H2O2诱导的ROS生成,各组荧光强度也降低(P<0.01)。食源性蛋白质衍生肽是由肽键连接的氨基酸组成,如谷胱甘肽,是一种非常强大的天然细胞抗氧化剂,而TD12中一些疏水残基容易穿过细胞膜,更有效地与ROS相互作用,从而发挥抗氧化作用。这一结果与2.5细胞的保护效应是一致的。

a-对照组;b-400 μmol/L H2O2损伤组;c-0.25 μmol/L TD12+H2O2;
d-1 μmol/L TD12+H2O2;e-5 μmol/L TD12+H2O2(标尺=100 μm)
图6 不同浓度TD12处理后HepG2细胞荧光图像
Fig.6 Fluorescence image of HepG2 cells treated with
different concentrations of TD12

图7 各组荧光强度
Fig.7 Relative expression of DCFH-DA fluorescence in
different groups
2.7 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内抗氧化酶活性的影响
TD12对HepG2细胞中LDH、MDA、SOD、CAT和GSH-Px抗氧化酶活性的影响试验结果见表1。LDH对氧化应激有极为敏感,其水平升高可以直接反应氧化损伤的程度。当机体受到氧化刺激时会释放到细胞培养液中,使得培养液中LDH含量大幅升高,由表1可知,H2O2损伤组的LDH含量比对照组高3.3倍(P<0.01),随着TD12浓度增加,细胞培养液中LDH含量明显降低,这说明TD12预处理可以提高细胞存活率,保护细胞的完整性。MDA是过氧化脂质氧化过程的最终产物之一,MDA可以攻击细胞膜中不饱和脂肪酸从而引起细胞损伤。由表1可知,H2O2可以提升细胞内MDA含量(P<0.01),并与TD12浓度呈依赖性关系,TD12高剂量组(5 μmol/L)MDA含量接近对照组,可见TD12能有效抑制细胞内MDA释放,进而保护细胞膜。
SOD、CAT、GSH-Px是细胞抗氧化防御系统中重要的重要组成部分,可以有效清除体内过量的ROS及羟基诱发的脂质过氧化物,从而保护细胞结构和功能的完整性[29]。由表1可知,细胞经过H2O2处理后,SOD、CAT和GSH-Px的活性与对照组相比均显著降低(P<0.01)。经过TD12预处理后,3种酶的活性均有所提升且呈浓度依赖性关系,尤其在TD12高剂量组(5 μmol/L)预处理下,细胞内SOD活力为(183.16±2.60) U/mg,CAT活力为(23.83±0.35)U/mg,GSH-Px酶为(46.97±1.71)个活力单位,与损伤组对比均有提升(P<0.01)。
表1 TD12对HepG2细胞中LDH、MDA、SOD、GSH
的影响(n=3)
Table 1 The effect of TD12 on LDH、MDA、SOD、
GSH in H2O2-induced HepG2 cells(n=3)
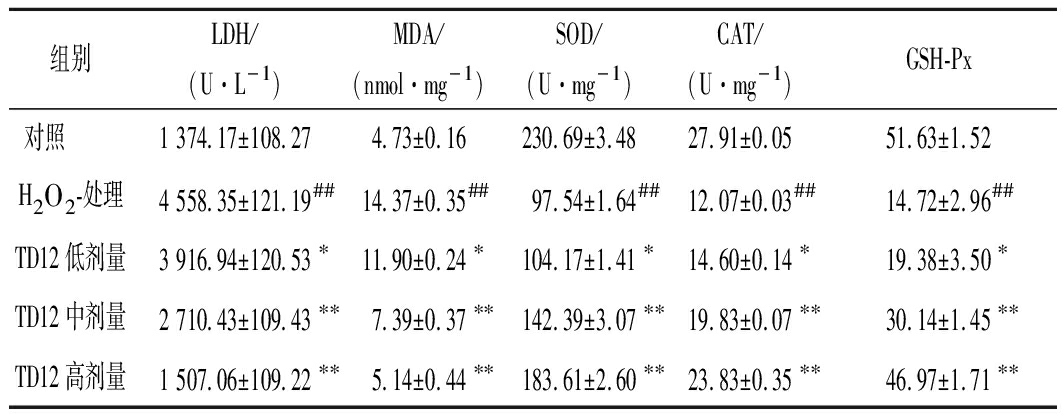
组别LDH/(U·L-1)MDA/(nmol·mg-1)SOD/(U·mg-1)CAT/(U·mg-1)GSH-Px对照 1 374.17±108.274.73±0.16230.69±3.4827.91±0.0551.63±1.52H2O2-处理4 558.35±121.19##14.37±0.35##97.54±1.64##12.07±0.03##14.72±2.96##TD12低剂量3 916.94±120.53∗11.90±0.24∗104.17±1.41∗14.60±0.14∗19.38±3.50∗TD12中剂量2 710.43±109.43∗∗7.39±0.37∗∗142.39±3.07∗∗19.83±0.07∗∗30.14±1.45∗∗TD12高剂量1 507.06±109.22∗∗5.14±0.44∗∗183.61±2.60∗∗23.83±0.35∗∗46.97±1.71∗∗
2.8 鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内细胞因子含量的影响
鸭胚源抗氧化肽TD12对H2O2诱导损伤的HepG2细胞内TNF-ɑ和IL-8、IL-4及IL-10含量的影响见图8。

a-TNF-α;b-IL-8;c-IL-4;d-IL-10
图8 TD12对HepG2细胞中细胞因子含量的影响
Fig.8 The effect of TD12 on the content of cytokines in HepG2 cells
MAPK是一条重要的炎症信号通路,当机体发生氧化应激时,ROS可刺激激活炎症信号通路核因子NF-κB,进而诱导多种炎症因子(TNF-ɑ、IL-8、IL-4等)的表达[30]。由图8可知,H2O2可显著提升HepG2细胞中TNF-ɑ和IL-8、IL-4及IL-10含量(P<0.01),经TD12高剂量预处理(5 μmol/L)细胞后,细胞内TNF-ɑ和IL-8含量几乎恢复至正常水平,且均浓度依赖性升高;IL-4与IL-10为抗炎因子,当机体受到氧化损伤时,IL-4与IL-10分泌增加,发挥保护机体的作用。TD12低剂量处理组(0.25 μmol/L)细胞内IL-10含量与损伤组相比,反而有所降低。浓度为5 μmol/L的TD12处理细胞后,IL-4含量相比对照组略高,这可能是由于TD12一定程度上可通过上调IL-4分泌增加从而抑制炎症发生,但具体在通路中相关基因表达,还待进一步研究。炎症反应与氧化应激密不可分,TNF-ɑ可直接诱导ROS的产生,进一步加重细胞氧化损伤。本试验结果证明,鸭胚源抗氧化肽TD12均能有效抑制HepG2细胞内TNF-ɑ、IL-8的释放,维持IL-4、IL-10的稳定,可能减弱炎症反应和细胞氧化损伤的程度。
3 结论
本试验研究证明鸭胚源新型抗氧化肽TD12体外清除自由基能力较强,且清除能力与浓度有明显关系;对H2O2诱导损伤的HepG2细胞表现出较强的预保护作用,可降低由氧化应激产生的ROS、LDH和MDA的含量,一定程度上恢复由H2O2诱导损伤的HepG2细胞中抗氧化酶SOD、CAT与GSH-Px活性;并且有效抑制了由H2O2诱导损伤的HepG2细胞内细胞因子TNF-ɑ、IL-8的释放及维持IL-4、IL-10的稳定。以上结果显示,鸭胚源抗氧化肽TD12可能是通过调节细胞中抗氧化酶SOD及GSH-Px等蛋白表达水平起到抑制氧化应激的作用,其相关作用通路有待进一步深入研究。
[1] YI G F, DIN J U, ZHAO F, et al.Effect of soybean peptides against hydrogen peroxide induced oxidative stress in HepG2 cells via Nrf2 signaling[J].Food & Function, 2020,11(3):2 725-2 737.
[2] HE R, JU X R, YUAN J, et al.Antioxidant activities of rapeseed peptides produced by solid state fermentation[J].Food Research International,2012,49(1):432-438.
[3] JE J Y, PARK S Y, HWANG J Y, et al.Amino acid composition and in vitro antioxidant and cytoprotective activity of abalone viscera hydrolysate[J].Journal of Functional Foods, 2015, 16:94-103.
[4] 张强, 李伟华.抗氧化肽的研究现状[J].食品与发酵工业,2021,47(2):298-304.
ZHANG Q, LI W H.Research progress of antioxidant peptides[J].Food and Fermentation Industries,2021,47(2):298-304.
[5] 张燕, 陈志飞, 赵颂宁, 等.蛋清源抗氧化肽对HEK293细胞氧化应激损伤的抑制作用及机制[J].中国食品学报, 2019,19 (10):11-22.
ZHANG Y, CHEN Z F, ZHAO S N, et al.The Anti-oxidative effects and mechanism of antioxidant peptides from egg white against oxidative stress injury in human embryonic kidney 293 cells[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(10):11-22.
[6] GÜNGÖR Ö F, TABAN S, et al.Comparison of different brown and white layer hybrid embryonic development and uptake of nutrients in the egg[J].Animal Reproduction Science,2018,8(48):57-64.
[7] 吴礼萍. 鸭胚蛋营养分析评价及与牛肝菌多糖配伍的功能性研究[D].泰安:山东农业大学, 2009.
WU L P.Study on nutritional components of duck embryonated egg and functionalities after compatibility with boletus polysaccharides [D].Taian:Shandong Agricultural University,2009.
[8] RAO S Q, XU M L, GAO L, et al.Study on synergistic antioxidant activities of egg white protein enzymatic peptides and soybean protein enzymatic peptides[J].Food Science,2014, 35(23):108-113.
[9] HUANG X, AHN D U.How can the value and use of egg yolk be increased?[J].Journal of Food Science,2019,84(2):205-212.
[10] BANASZEWSKA D, BIESIADA-DRZAZGA B, MARCINIUK M, et al.Comparison of the quality of cage and organic eggs available in retail and their content of selected macroelements[J].Acta Scientiarum Polonorum Technologia Alimentaria, 2020,19(2):159-167.
[11] SEO S H, LEE H K, AHN H J, et al.The effect of dietary supplementation of Fe-methionine chelate and FeSO4 on the iron content of broiler meat[J].Asian Australasian Journal of Animal Sciences, 2008,21(1):103-106.
[12] 朱方莉, 孙浩浩, 何钟瑜, 等.不同孵化时期鸡蛋蛋清小分子多肽的鉴定及功能分析[J].食品工业科技,2019,40(10):68-73.
ZHU F L, SUN H H, HE Z Y, et al.Identification and functional analysis of small molecular peptides from egg white in different incubation periods[J].Science and Technology Food Industry, 2019,40(10):68-73.
[13] NAKADE K, KAMISHIMA R, INOUE Y.et al.Identification of an antihypertensive peptide derived from chicken bone extract [J].Animal Science Journal,2010,79(6):710-715.
[14] 王旭清. 鸭胚蛋多肽的超滤分离、纯化及其功能性研究[D].泰安:山东农业大学,2009.
WANG X Q.The study of isolation and purification by ultra-filtration of ruck embryo peptide and its functional properties[D].Taian:Shandong Agricultural University,2009.
[15] HE Y, BU L J, XIE H D, et al.Antioxidant activities and protective effects of duck embryo peptides against H2O2-induced oxidative damage in HepG2 cells[J].Poultry Science,2019,98(12):7 118-7 128.
[16] DONATO M T, TOLOSA L, G MEZ-LECH
MEZ-LECH N M J.Culture and functional characterization of human hepatoma HepG2 cells[J].Methods in Molecular Biology (Clifton, N.J.),2015,1 250:77-93.
N M J.Culture and functional characterization of human hepatoma HepG2 cells[J].Methods in Molecular Biology (Clifton, N.J.),2015,1 250:77-93.
[17] 张燕, 魏汝君, 潘风光, 等.蛋清源活性肽抗氧化及抗炎活性[J].食品科学,2018,39(13):153-158.
ZHANG Y, WEI R J, PAN F G, et al.Antioxidant and anti-inflammatory effects of bioactive peptides derived from egg white proteins[J].Food Science, 2018,39(13):153-158.
[18] MA Z J, LU L, YANG J J, et al.Lariciresinol induces apoptosis in HepG2 cells via mitochondrial-mediated apoptosis pathway[J].European Journal of Pharmacology, 2018, 821:1-10.
[19] XIE Y F, GUO Y, CAO S D, et al.Hydroxysafflor yellow a attenuates hydrogen peroxide-induced oxidative damage on human umbilical vein endothelial cells[J].Evidence-based Complementary and Alternative Medicine, 2020,2 020(1):1-8.
[20] 张业尼, 钱磊, 陈雪, 等.过氧化氢诱导HepG2细胞氧化应激模型的建立[J].食品研究与开发,2018,39(5):160-164.
ZHANG Y N, QIAN L, CHEN X, et al.Establishment of hydrogen peroxide induced oxidative stress model in HepG2 cells[J].Food Research and Development,2018,39(5):160-164.
[21] SHI Q Q, SHI X P, ZUO G, et al.Anticancer effect of 20(S)-ginsenoside Rh2 on HepG2 liver carcinoma cells:Activating GSK-3β and degrading β-catenin[J].Oncology Reports, 2016,36(4):2 059-2 070.
[22] ZHANG Q, CUI C, CHEN C Q, et al.Anti-proliferative and pro-apoptotic activities of Alpinia oxyphylla on HepG2 cells through ROS-mediated signaling pathway[J].Journal of Ethnopharmacology, 2015,169:99-108.
[23] YU H, PENG X D, LIN J, et al.Anti-inflammatory effects of astaxanthin against fungal keratitis[J].International Journal of Ophthalmology,2020,13(11):1 681-1 688.
[24] CHI C F, WANG B, WANG Y M, et al.Isolation and characterization of three antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) heads[J].Journal of Functional Foods, 2015,12:1-10.
[25] MA Y, XIONG Y L, ZHAI J, et al.Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein [J].Food Chemistry, 2010, 118(3):582-588.
[26] KETNAWA S, WICKRAMATHILAKA M, LICEAGA A M.Changes on antioxidant activity of microwave-treated protein hydrolysates after simulated gastrointestinal digestion:Purification and identification[J].Food Chemistry, 2018,254:36-34.
[27] NWACHUKWU I D, ALUKO E.Structural and functional properties of food protein-derived antioxidant peptides[J].Journal of Food Biochemistry,2019,43(1):e12761.
[28] YU D L, ZHA Y Y, ZHONG Z, et al.Improved detection of reactive oxygen species by DCFH-DA:New insight into self-amplification of fluorescence signal by light irradiation[J].Sensors and Actuators B Chemical, 2021.DOI:10.1016/J.SNB.2021.129878.
[29] PARK Y R, PARK C, SOH Y.Antioxidant and anti-inflammatory effects of NCW peptide from clam worm (Marphysa sanguinea)[J].Journal of microbiology and biotechnology,2020,30(9):1 387-1 394.
[30] BAXTER E W, GRAHAM A E, RE N, et al.Standardized protocols for differentiation of THP-1 cells to macrophages with distinct M(IFNγ+LPS), M(IL-4) and M(IL-10) phenotypes[J].Journal of Immunological Methods,2020,478:112721.