随着经济的发展和人们生活水平的日益提高,心血管疾病、癌症等与机体氧化伤害有关的疾病发病率不断提高[1-2],如何有效维护人体健康,防止心血管疾病、肿瘤已成为人们普遍关注的社会问题。许多疾病可称为“自由基”疾病,据统计,心脏病、肿瘤、衰老、糖尿病等数百种疾病都与自由基有关,能否有效地清除自由基成为解决各类疾病的关键问题[3-5]。近年来生物活性肽受到广泛的重视,开发既具有抗氧化又具有抗肿瘤活性的双功能活性肽用以预防和治疗自由基引发的疾病[6],减少心脑血管疾病以及肿瘤、机体老化引发的各类疾病的发病率具有重要的意义。
乳清蛋白是一类利用现代生产工艺技术从牛奶中提取出来的蛋白质,乳清蛋白具有高蛋白、低脂肪、易于消化吸收、含有丰富必需氨基酸、营养价值高等优点, 被称为“蛋白之王”[7]。乳清蛋白生物活性成分中含有丰富的半胱氨酸,使其可以影响机体的抗氧化能力。本研究前期已证实乳酸菌发酵乳清蛋白产物具有较高的抗氧化活性和抗肿瘤活性[8-9]。而在活性肽的制备过程中,其分离纯化技术一直是研究的热点。由于发酵液具有成分复杂、分子质量小等特点,其分离纯化过程变得相对较难,想要分离纯化出单一肽段难度大,而且目前对多肽的研究大多仅集中于单一活性的评价[10],而双功能或多功能的多肽研究较少,可参考性较低,缺乏试验数据,但是因其安全性高、无副作用等优点[11-12],以抗氧化、抗肿瘤为主的双功能活性肽具有很好的开发前景[13-14]。
因此,本课题的研究目的是通过对乳酸菌的乳清蛋白代谢发酵产物经大孔吸附树脂及凝胶过滤层析方法进行分离纯化,以获得双功能活性肽组分,通过体外实验评价抗氧化、抗肿瘤活性,从而为开发抗氧化、抗肿瘤的双功能活性肽提供理论依据。
1 材料与方法
1.1 实验材料
二甲基亚砜(dimethyl sulfoxide,DMSO),生工生物工程股份有限公司;ABTS、水溶性维生素E(Trolox),Sigma-Aldric公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT),Amersco公司;邻苯二甲醛(O-phthaldialdehyde,OPA),国药集团化学试剂有限公司;彩色预染蛋白质分子量标准(Marker),北京康为世纪生物科技有限公司;其他试剂均为分析纯。色谱柱填料:大孔吸附树脂D101,艾美科健中国生物医药有限公司;葡聚糖凝胶G15,美国GE公司。
1.2 培养基
乳清蛋白-MRS培养基:根据改良MRS培养基作出调整,具体组成成分如下,脱盐乳清粉10 g、牛肉提取物10 g、酵母提取物5 g、葡萄糖20 g、吐温80 1 mL、磷酸氢二钾2 g、醋酸钠5 g、柠檬酸钠2 g、硫酸镁0.2 g、硫酸锰0.05 g,加水至1 L,121 ℃,灭菌15 min。
1.3 仪器与设备
冷冻干燥机(6 L),美国Labconco公司;UV-2550紫外分光光度计,日本岛津公司;Safire2酶标仪,奥地利Tecan公司;IS09001恒温培养振荡器,上海智城分析仪器制造有限公司;Z36HK大容量高速冷冻离心机,德国Hermle公司;Sepacore中压制备色谱(中压色谱柱 25 mm×460 mm),瑞士BUCHI公司;AKTA Explorer100全自动蛋白层析系统(蛋白层析柱16 mm×100 mm),美国GE公司。
1.4 乳酸菌B2-1发酵液的制备
乳酸菌B2-1是由玉米浸泡液中分离纯化获得的,现保存在齐齐哈尔医学院微生态工程技术研究中心。挑取B2-1菌种接种于1 mL灭菌的乳清蛋白-MRS培养基中厌氧培养48 h,连续扩培2次后,取培养物按体积分数5%的接种量接种于乳清蛋白-MRS培养基中培养5周后,6 000 r/min离心10 min,取上清液冻干,此为乳酸菌B2-1的乳清蛋白代谢产物发酵液冻干粉,存放于-20 ℃备用。
1.5 乳酸菌B2-1发酵乳清蛋白代谢产物的分离纯化
1.5.1 大孔吸附树脂D101柱层析分离
对乳酸菌B2-1的乳清蛋白代谢产物发酵液冻干粉采用大孔吸附树脂D101层析柱分离纯化,取冻干粉3 g溶解于20 mL纯净水离心后上样,先用2~3个柱体积纯净水洗脱,再采用梯度乙醇溶液和无水乙醇洗脱,流速为2.5 mL/min,采用自动收集器收集分离组分,每管收集时间为2 min,每隔3管测定馏分的214、254、280 nm处的吸光度值、多肽含量及ABTS阳离子自由基清除率,以体积为横坐标,以吸光度、多肽含量及ABTS阳离子自由基清除率为纵坐标,分别绘制曲线,综合上述实验结果收集3个组分,分别命名为F1、F2及F3,备用待测。
1.5.2 葡聚糖凝胶G15柱层析分离
将大孔吸附树脂D101分离出的组分中具有较高抗氧化活性和抗肿瘤活性的F3组分采用葡聚糖凝胶G15柱进行分离纯化,采用超纯水洗脱,F3组分上样量为5 mL(0.07 g/mL),流速为0.7 mL/min,每管收集体积为8 mL,采用自动收集器收集分离组分,根据出峰位置收集2个组分,命名为F3-1及F3-2,备用待测。
1.5.3 多肽含量的测定
采用OPA法进行测定[15]。取20 μL样品加入到150 μL的OPA试剂中,混匀后于室温下反应2 min,在340 nm下测定吸光度值,以水为空白对照,丝氨酸为标准品对照,计算样品多肽含量。
1.5.4 SDS-PAGE
取各样品10 μL,加入10 μL上样缓冲液后,煮沸3 min,待其冷却后备用。配制分离胶,待聚合完成后,配制浓缩胶,按顺序加样后,预电泳电压75 V电泳至分离胶处,改用120 V恒压电泳至溴酚蓝指示剂迁移到距前沿1~2 cm处停止电泳。将电泳结束后的凝胶取出,适当剪切,在考马斯亮蓝R250染色液中置于摇床上室温缓慢振荡,染色2 h,脱色液脱色后拍照[16]。
1.6 抗氧化活性的测定
抗氧化活性测定采用ABTS阳离子自由基清除能力进行测定[17]。利用50 mmol/L Tris-HCl(pH 7.4)缓冲液配制待测样品溶液,经稀释后制备不同浓度的工作液。ABTS阳离子自由基工作液,使用前以0.01 mol/L Tris-HCl(pH 7.4)适当稀释,使OD值在0.8左右。将40 μL质量浓度为1 g/L的样品与160 μL ABTS 试剂混匀,室温条件下避光反应6 min。利用酶标仪在734 nm处测定吸光度值。将50 mmol/L Tris-HCl(pH 7.4)缓冲液作为空白对照,Trolox作为阳性对照。计算如公式(1)所示:
ABTS阳离子自由基清除率![]()
(1)
1.7 抗肿瘤活性检测
抗肿瘤活性测定采用MTT法[16]。将消化好的人结肠癌细胞系LoVo细胞、人口腔癌细胞系Cal-27细胞和KB细胞分别接种于96孔板,接种细胞的起始浓度为1×104个/孔,样品作用细胞的时间为48 h,每个处理组设立3个复孔。48 h后每孔加入20 μL MTT溶液,继续培养3 h后终止培养,2 000 r/min离心10 min后吸去孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。酶标仪检测波长为570 nm,细胞的抑制率计算公式如(2)所示:
抑制率![]()
(2)
1.8 统计学方法
用SPSS 17.0软件对数据进行统计学分析。
2 结果与分析
2.1 乳酸菌B2-1的形态
将26种菌株接种到乳清蛋白-MRS培养基中培养,采用ABTS阳离子自由基清除实验及MTT实验进行评价筛选,最终得到菌株B2-1,其菌体形态如图1所示,菌株B2-1菌体呈双杆状,短小的杆菌,两端圆形。菌体成单、成对或成链,不形成芽孢。

图1 乳酸菌B2-1的形态示意图
Fig.1 Morphological diagram of Lactobacillus B2-1
2.2 乳酸菌B2-1发酵乳清蛋白代谢产物的分离纯化
2.2.1 大孔吸附树脂D101层析柱分离纯化
对乳酸菌B2-1的乳清蛋白代谢产物发酵液的冻干粉经大孔吸附树脂D101层析柱分离,通过紫外检测器检测其洗脱情况,结果如图2所示。大孔吸附树脂D101层析柱依次分离出来3个峰,分别为F1、F2和F3。对分离物进行多肽含量及ABTS阳离子自由基清除率的跟踪检测,结果显示多肽含量及ABTS阳离子自由基清除率较高的部分主要分布在峰F1、F2和F3上,因此综合上述实验,收集了3个大孔吸附树脂D101层析柱分离组分,经冷冻干燥分别命名为F1、F2和F3,每个组分的得率分别为25.72%、11.75%和3.29%。

a-大孔吸附树脂柱D101层析图谱示意图;b-大孔吸附树脂柱
D101层析馏分多肽含量和ABTS阳离子自由基清除率曲线
图2 大孔吸附树脂D101层析图谱及馏分多肽含量
和ABTS阳离子自由基清除率曲线
Fig.2 Chromatogram of macroporous adsorption resin D101, polypeptide
content and ABTS cationic free radical scavenging curve
对收集的3个组分F1、F2和F3进行多肽含量、ABTS阳离子自由基清除率、MTT实验检测,实验结果如表1和图3所示。多肽含量和ABTS阳离子自由基清除率的均最高的组分是F3,相比于乳酸菌B2-1 乳清蛋白代谢产物发酵液的冻干粉,经过大孔吸附树脂D101分离后组分的ABTS阳离子自由基清除率提高近2倍,因此认为F3组分是具有抗氧化活性的组分。抗肿瘤活性的初步筛选实验选择了3种细胞,分别为人结肠癌LoVo细胞,人口腔癌KB细胞和Cal-27细胞,每个组分作用时间为48 h。由图3可知,F1组分对3种细胞增殖的抑制作用不明显;F2组分对3种细胞增殖的抑制作用的顺序是LoVo细胞>KB细胞>Cal-27细胞,其中质量浓度8 g/L的F2组分对LoVo细胞增殖的抑制率已达到50%;F3组分对3种细胞增殖的抑制作用的顺序是LoVo细胞>KB细胞>Cal-27细胞,是3种组分中抗肿瘤效果最好的,质量浓度8 g/L的F3组分对LoVo细胞增殖的抑制率接近70%。

图3 大孔吸附树脂D101柱层析各组分对肿瘤
细胞增殖的抑制作用
Fig.3 Inhibitory effect of each component of macroporous adsorption
resin D101 column chromatography on tumor cell proliferation
注:与空白组相比,a表示P<0.01,b表示P<0.05(下同)
表1 大孔吸附树脂D101柱层析各组分收率、多肽含量
及ABTS阳离子自由基清除率
Table 1 The yield, polypeptide content, and ABTS cationic free
radical scavenging rate of each component of macroporous
adsorption resin D101 column chromatography
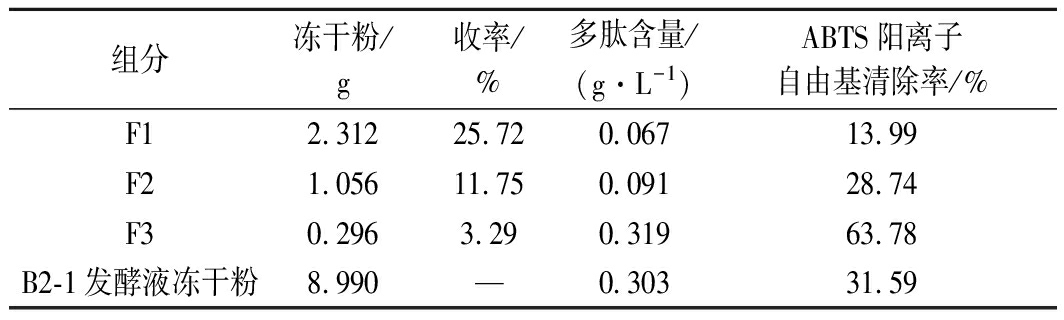
组分冻干粉/g收率/%多肽含量/(g·L-1)ABTS阳离子自由基清除率/%F12.31225.720.06713.99F21.05611.750.09128.74F30.2963.290.31963.78B2-1发酵液冻干粉8.990—0.30331.59
对各组分的样品进行SDS-PAGE实验,结果如图4所示。结果显示F1组分在10、20 kD左右有微弱条带,在F2组分的蛋白电泳未显示出条带,而F3组分在70 kDa及10~20 kDa附近均呈现较明显的条带,而各个组分在凝胶底部均出现条带,说明F1、F2和F3组分均有较小分子质量的多肽,因此,综合各组分的实验结果,从抗肿瘤实验和抗氧化实验初步筛选得到的结论是F3组分最优,是同时具有抗氧化和抗肿瘤双功能的组分,因此,后续的实验选择F3进行继续分离。

M-Marker
图4 大孔吸附树脂D101分离组分SDS-PAGE实验结果示意图
Fig.4 SDS-PAGE electrophoresis results of components separated
by macroporous adsorption resin D101 column chromatography
2.2.2 葡聚糖凝胶G15层析柱分离纯化
经大孔吸附树脂D101柱层析分离后,洗脱组分F3经葡聚糖凝胶G15层析柱进行分离纯化,洗脱曲线如图5所示,洗脱后得到2个组分,分别命名为F3-1和F3-2。

图5 F3的葡聚糖凝胶G15柱层析图谱
Fig.5 Sephadex G15 gel column chromatography of F3 component
对收集的2个组分进行多肽含量、ABTS阳离子自由基清除率及MTT实验检测,实验结果如表2和图6所示。相比于F3-2组分,F3-1的多肽含量为0.353 g/L,ABTS阳离子自由基清除率为69.29%。在MTT试验中,F3-1对3种肿瘤细胞的抑制率更显著,其中,对LoVo细胞的增殖的抑制率最高,当F3-1的质量浓度为8 g/L时,抑制率达到75.36%,因此,可以认为F3-1组分是具备双功能活性肽组分。
表2 F3的葡聚糖凝胶G15柱层析组分的多肽含量
及ABTS阳离子自由基清除率
Table 2 The polypeptide content and ABTS free radical
scavenging rate of Sephadex G15 gel column chromatography of
F3 component

组分多肽含量/(g·L-1)ABTS阳离子自由基清除率/%F3-10.35369.29F3-20.05523.91
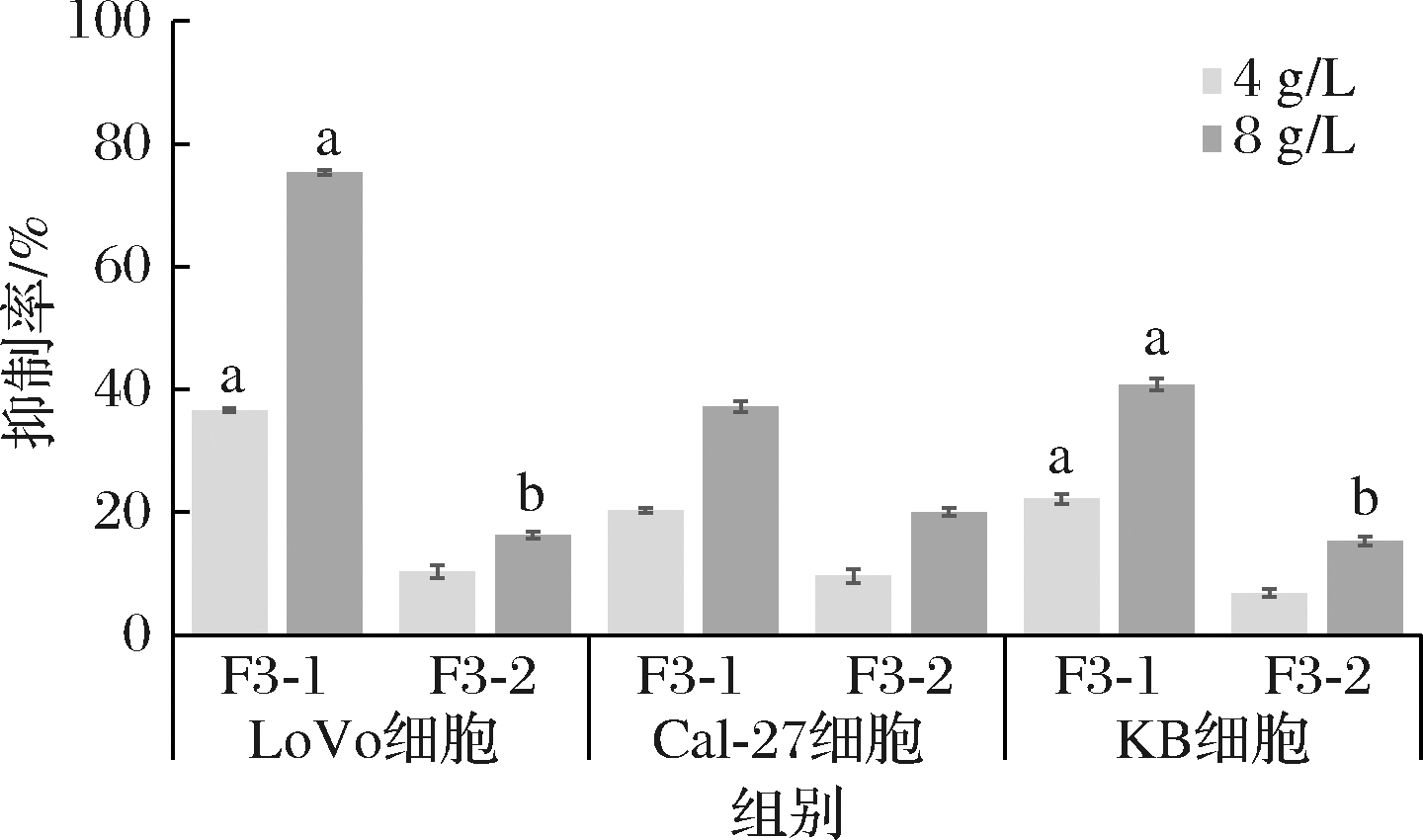
图6 G15层析柱分离后组分各组分对肿瘤细胞
增殖的抑制作用
Fig.6 Inhibitory effect of each component of Sephadex G15 gel column
chromatography of F3 component on tumor cell proliferation
3 结论
生物活性肽是指对生物机体的生命活动有益或具有生物活性的肽类化合物,它属于蛋白质片段,起着调节机体功能平衡的作用[18]。随着乳源生物活性肽研究的兴起与产品的开发,开发既具有抗氧化又具有抗肿瘤活性的双功能活性肽用以预防和治疗氧化及自由基引发的疾病,减少心脑血管疾病、肿瘤及机体老化引发的各类疾病的发病率具有重要的意义[19]。但由于目前中国整体乳清蛋白处理技术不发达,造成了大量产生的乳清蛋白无可用之地,其倾泻也对自然环境造成了一定的压力[20]。因此,开发以抗氧化、抗肿瘤为主的乳源双功能活性肽有很好的发展前景。
本研究通过大孔吸附树脂和凝胶过滤层析对乳酸菌B2-1的乳清蛋白代谢发酵产物进行分离纯化,提供一种抗氧化、抗肿瘤的双功能活性肽组分的制备方法。此种方法既有效的利用了乳清蛋白,又可以得到具有生物功能的活性肽成分,同时项目中的原料价格低廉,因此具有巨大的社会效益及经济效益。
[1] ARASU M V, AL-DHABI N A, REJINIEMON T S, et al.Identification and characterization of Lactobacillus brevis P68 with antifungal, antioxidant and probiotic functional properties[J].Indian Journal of Microbiology, 2015, 55(1):19-28.
[2] FUCHS-TARLOVSKY V.Role of antioxidants in cancer therapy[J].Nutrition, 2013, 29(1):15-21.
[3] ZENG Q, XIE L, ZHOU N, et al.Detection of PIK3CA mutations in plasma DNA of colorectal cancer patients by an ultra-sensitive PNA mediated PCR[J].Molecular Diagnosis & Therapy, 2017, 21(4):443-451.
[4] CHAI T T, LAW Y C, WONG F C, et al.Enzyme-assisted discovery of antioxidant peptides from edible marine invertebrates:A review[J].Marine Drugs, 2017, 15(2):42.
[5] HAN J M, LIM H N, JUNG H J.Hovenia dulcis Thunb and its active compound ampelopsin inhibit angiogenesis through suppression of VEGFR2 signaling and HIF-1α expression[J].Oncology Reports, 2017, 38(6):3 430-3 438.
[6] ROCHA G F, KISE F, ROSSO A M, et al.Potential antioxidant peptides produced from whey hydrolysis with an immobilized aspartic protease from Salpichroa origanifolia fruits[J].Food Chemistry, 2017, 237:350-355.
[7] 刘利锋. 乳清蛋白在运动营养中的应用[J].食品安全质量检测学报, 2020(21):7 740-7 745.
LIU L F.Application of whey protein in sports nutrition[J].Journal of Food Safety and Quality, 2020(21):7 740-7 745.
[8] 侯惠玲, 关宏, 郭皓, 等.脱盐乳清粉代谢产物的抗氧化和抗肿瘤活性初步研究[J].中国食品添加剂, 2016(4):104-109.
HOU H L, GUAN H, GUO H, et al.A preliminary study on antioxidant activity and antitumor activity of desalted whey powder metabolites[J].China Food Additives, 2016(4):104-109.
[9] 杨文钦, 关宏, 陈雪, 等.乳清蛋白肽美拉德反应产物的制备及其抗氧化特性的评价[J].中国食品添加剂, 2015(8):101-106.
YANG W Q, GUAN H, CHEN X, et al.Maillard reaction products from whey protein peptides and study on antioxidant activities[J].China Food Additives, 2015(8):101-106.
[10] WANG X Q, YU H H, XING R, et al.Characterization, preparation, and purification of marine bioactive peptides[J].Biomed Research International, 2017.DOI:10.1155/2017/9746720.
[11] DE CASTRO R J S, SATO H H.Biologically active peptides:Processes for their generation, purification and identification and applications as natural additives in the food and pharmaceutical industries[J].Food Research International, 2015, 74:185-198.
[12] OUDART J B, BRASSART-PASCO S, VAUTRIN A, et al.Plasmin releases the anti-tumor peptide from the NC1 domain of collagen XIX[J].Oncotarget, 2015, 6(6):3 656-3 668.
[13] ZHANG P C, CUI Y G, ANDERSON C F, et al.Peptide-based nanoprobes for molecular imaging and disease diagnostics[J].Chemical Society Reviews, 2018, 47(10):3 490-3 529.
[14] LIN J Z, ZOU Y X, CAO K L, et al.The impact of heterologous catalase expression and superoxide dismutase overexpression on enhancing the oxidative resistance in Lactobacillus casei[J].Journal of Industrial Microbiology & Biotechnology, 2016, 43(5):703-711.
[15] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5):642-646.
[16] GUO H, GUAN H, YANG W Q, et al.Pro-apoptotic and anti-proliferative effects of corn silk extract on human colon cancer cell lines[J].Oncology Letters, 2017, 13(2):973-978.
[17] 郭皓, 关宏, 侯惠玲, 等.玉米须提取液抗氧化功能特性的研究[J].中国临床药理学杂志, 2017, 33(3):258-261.
GUO H, GUAN H, HOU H L, et al.Study on antioxidative activity of the extract of corn silk[J].The Chinese Journal of Clinical Pharmacology, 2017, 33(3):258-261.
[18] DASKAYA-DIKMEN C, YUCETEPE A, KARBANCIOGLU-GULER F, et al. Angiotensin-I-converting enzyme (ACE)-inhibitory peptides from plants[J]. Nutrients, 2017, 9(4):316.
[19] VALIYARI S, SALAMI M, MAHDIAN R, et al.IL-24 peptide, a human interleukin-24 isoform, induces mitochondrial-mediated apoptosis in human cancer cells[J].Cancer Chemotherapy and Pharmacology, 2017, 80(3):451-459.
[20] CARVALHO F, PRAZERES A R, RIVAS J.Cheese whey wastewater:Characterization and treatment[J].Science of the Total Environment, 2013, 445-446:385-396.