半胱氨酸(cysteine,Cys)是生物体内常见的硫源供体,其L型具有生物学活性。L-Cys是蛋氨酸、硫胺素以及谷胱甘肽等生物体内常见物质的重要组成成分[1]。L-Cys在细胞生长和代谢过程中起着重要作用,包括蛋白质的折叠、修饰、催化活性的调节等[2]。此外,L-Cys可以通过氧化应激反应对细胞起保护作用[3]。作为生物体中一种重要氨基酸,L-Cys在医药、食品、化妆品和饲料行业中有广泛应用[4]。由于L-Cys活性巯基大量积累会对生物体产生毒性,因此制约了其作为发酵产物在微生物中进行大规模生产[5]。
L-Cys的生物合成途径和调节机制已被广泛研究。大肠杆菌(Escherichia coli)[6]、谷氨酸棒杆菌(Corynebacterium glutamicum)[7]、菠萝泛菌(Pantoea anantics)[8]、卡式棘阿米巴氏菌(Acanthamoeba castellanii)[9]以及鼠伤寒沙门氏菌(Salmonella typhimurium)[10]等均可以作为发酵菌株生产L-Cys。其中,以E.coli和C.glutamicum作为宿主菌最为常见。KAWANO等[11]研究发现E.coli中新的硫代硫酸盐利用途径,结合yciW基因的敲除,L-Cys 产量显著提升[12-13]。NAKATANI等[6]通过过表达氧化还原蛋白NrdH、亚硫酸盐还原酶CysI以及半胱氨酸合酶CysK提高L-Cys产量,降低了前体物质S-磺基半胱氨酸(S-sulfo-L-cysteine,SSC)积累。NONAKA等[14]通过敲除主要的半胱氨酸降解酶YhaM,显著改善了L-Cys的合成。YAMAZAKI等[15]发现了L-Cys转运蛋白YdjN在E.coli中参与SSC的转运,YdjN的表达受L-CysB调控。LIU等[16-18]利用代谢工程手段尝试不同的模块优化组合,最终在1.5 L发酵罐中得到了8.34 g/L的L-Cys。
除代谢改造工程菌株以获得高产菌株外,通过优化营养成分和培养条件来提高目标产物产量的方法也发挥着至关重要的作用。目前已有多种统计学方法应用于发酵过程的建模和优化[19]。其中,响应面分析方法较为成熟,其优势在于在多变量系统中能快速筛选关键因素,通过爬坡实验找到中心点附近位置以及整体连续考虑中心点附近的规律[20]。与传统方法相比,即使对其中的作用过程知之甚少,通过响应面法建立模型,测试不同变量之间的整体关系,也可得到最优响应值。
本研究以E.coli MCYS-7菌株为生产菌,利用响应面分析方法对培养基组分和浓度进行优化。同时,在2 L 发酵罐中优化了发酵条件,结合外源添加甜菜碱、氨基酸等物质,开发出了一条有效的L-Cys发酵工艺路线。
1 材料与方法
1.1 材料
1.1.1 菌株
生产菌株为E.coli MCYS-7(保藏号为CCTCC NO.M 2019108)。
1.1.2 试剂与仪器
L-Cys等各类氨基酸标准品、维生素B1、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、4-氯-3,5-二硝基三氟甲苯(4-chloro-3,5-dinitrobenzotrifluoride,CNBF)、甜菜碱,中国百灵威;氨苄青霉素,中国生工;异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),上海生工;乙酸钠,温州吉翔化工有限公司;乙腈,Tedia 公司。除另有说明外,所有其他化学品和试剂均为分析纯,并购自商业渠道。
Eppendorf AG紫外分光光度计、Thermo Scientific U3000超高压高效液相色谱系统,德国赛默飞;Waters高效液相色谱系统,美国沃特世;C18反相色谱柱(4.6 mm×250 mm, 5 μm),中国月旭;轨道培养箱摇床ZWYR-D2402,上海智域;2 L四联微小型平行生物反应器,上海迪必尔。
1.1.3 培养基
LB培养基(g/L):蛋白胨 10,酵母提取物5,NaCl 10;基础MS培养基:葡萄糖 20 g/L,硫酸铵 16 g/L,酵母粉 2 g/L,硫代硫酸钠 2 g/L,蛋白胨 1 g/L,磷酸二氢钾 1 g/L,盐溶液 1 mL/L,维生素B1 5 mg/L,CaCO3 10 g/L;补料培养基:葡萄糖 300 g/L,硫酸铵10 g/L,硫代硫酸钠12.5 g/L,磷酸二氢钾1 g/L,盐溶液 1 mL/L,维生素B1 5 mg/L。盐溶液配制(g/L):MnSO4·8H2O 5,MgSO4·7H2O 500,ZnSO4 5,FeSO4·7H2O 10。所有培养基均要加入100 mg/L的氨苄青霉素。
1.2 培养条件
1.2.1 摇瓶发酵
种子液的制备:从活化平板中将MCYS-7单菌落接种于10 mL LB试管,并在37 ℃和180 r/min条件下于轨道培养箱中摇床培养12 h。
摇瓶发酵:接种量为5%,装液量20 mL/500mL,30 ℃和180 r/min条件下培养,当培养进行至6 h后添加0.9 mmol/L的IPTG,培养48 h。
1.2.2 发酵罐发酵
一级种子液制备:见1.2.1。
二级种子液制备:取一级种子液1%(体积分数),装液量100 mL/500mL,30 ℃和180 r/min条件下于轨道箱中摇床培养12 h。
发酵罐发酵:使用2 L四联发酵罐,接种量为10%,装液量1 L/2L,用50%(体积分数)NH3·H2O和1 mol/L H3PO4溶液自动控制pH,培养温度30 ℃,当生长至OD600=20左右时加入0.9 mmol/L的IPTG,通过控制搅拌桨转速(0~800 r/min)以及通气量[0~5 m3/(m3·min)]来维持溶解氧在30%以上,当培养基初始的葡萄糖耗尽时,补料流加以维持发酵过程中葡萄糖质量浓度在5 g/L以下。发酵过程中定期取样检测相关参数。
1.3 响应面模型
响应面分析是多因素建模分析的有效方法,可在多变量系统中快速筛选关键因素,通过爬坡实验找到中心点附近位置以及整体连续考虑中心点附近的规律。与传统方法相比,即使对其中的作用过程知之甚少,通过响应面法建立模型,测试不同变量之间的整体关系,也可得到最优响应值。
以预实验中筛选到的葡萄糖,硫酸铵,硫代硫酸钠以及酵母粉作为重要影响因素,取葡萄糖质量浓度38~46 g/L,硫酸铵质量浓度7~9 g/L,酵母粉质量浓度5~7 g/L,硫代硫酸钠质量浓度5~7 g/L(表1)。
表1 Box-Behnken Design参数设计取值
Table 1 The parameter values designed in Box-Behnken Design
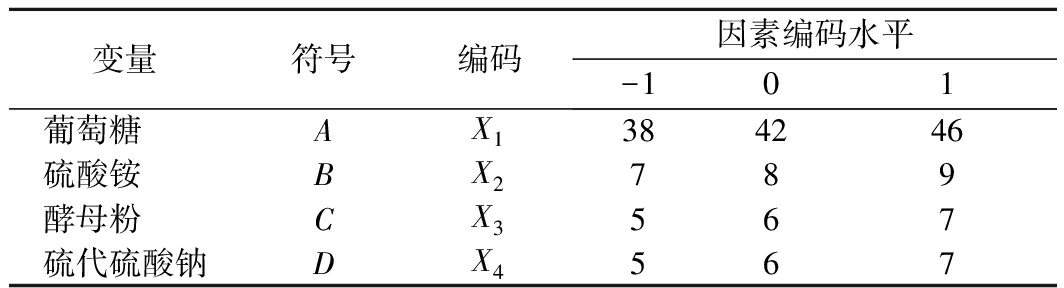
变量符号编码因素编码水平-101葡萄糖 AX1384246硫酸铵 BX2789酵母粉 CX3567硫代硫酸钠DX4567
以Box-Behnken设计(BBD)制定实验方案,以带有交互项的二次项模型进行拟合,拟合如公式(1)所示:
(1)
式中:Y表示L-Cys的产量,g/L;A0表示模型截距;Bi是一次项线性因子系数;Bii是二次项线性因子系数;Bij是交互项线性因子系数;Xi、Xj是每个变量的水平。
1.4 分析方法
通过用紫外分光光度计检测OD600来表示细胞生长情况。发酵液中的葡萄糖浓度使用DNS法进行定量[21]。乙酸等常见有机酸使用高效液相色谱系统测定[8]。L-Cys和(L-Cys)2的含量通过超高压高效液相色谱系统并配有C18反相色谱柱进行检测[22],将两者的总含量认为是L-Cys含量[18]。无特殊说明,所有样品均进行3次生物学重复,并选用平均值作为检测值。
2 结果与分析
2.1 基于响应面的L-Cys优化结果
2.1.1 影响L-Cys产量的因素分析
Box-Behnken Design的结果如表2所示。表3显示模型(P<0.05)有足够的精度来预测L-Cys的产量,该模型下的失拟项的均方为0.014 2,在一定程度上表明预测值与实际值在允许偏差的范围内,另外,模型的F值为18.453,表明实验结果足够显著,在统计学上有分析意义。
表2 Box-Behnken Design的结果 单位:g/L
Table 2 Results of Box-Behnken Design

标准序运行序A(葡萄糖)B(硫酸铵)C(酵母粉)D(硫代硫酸钠)L-Cys实际值L-Cys理论值241429673.393.39152427763.683.65203468763.293.38134427563.483.43115388673.313.32196388763.523.4137389663.163.16268428663.803.8019387663.213.232910428663.803.801711388563.022.942312427673.353.45713428573.013.011014468653.253.291615429763.703.802816428663.803.80917388652.712.88518428553.413.342219429653.453.36420469663.213.131821468562.812.942522428663.803.80823428773.793.802724428663.803.80625428753.503.452126427653.463.471227468672.992.871428429563.043.11229467663.283.23
表3 Box-Behnken Design结果的统计学分析
Table 3 Statistical analysis of Box-Behnken Design results

方差来源平方和自由度均方F值P值显著性模型2.612 2140.186 618.453 5<0.000 1∗∗A0.000 810.000 80.082 40.007 8∗∗B0.021 810.021 72.143 60.001 9∗∗C0.612 010.612 060.527 1<0.000 1∗∗D0.000 310.000 30.029 60.003 7∗∗AB0.000 110.000 10.009 90.922 2AC0.000 110.000 10.009 90.922 2AD0.184 910.184 918.286 40.000 8∗∗BC0.052 910.052 95.231 80.038 3∗BD0.000 610.000 60.061 80.807 3CD0.119 010.119 011.771 50.004 1∗∗A21.448 111.448 1143.220 7<0.000 1∗∗B20.129 410.129 412.799 10.003 0∗∗C20.168 710.168 716.680 20.001 1∗∗D20.373 610.373 636.950 9< 0.000 1∗∗残差0.141 6140.010 1失拟项0.141 6100.014 2纯误差040总离差2.753 828
注:**表示极为显著,*表示显著
2.1.2 基于响应面法的回归分析
将29个组合实验结果应用多元回归分析,建立回归分析方程式:
L-Cys=+3.80-8.333E-003A-0.043B+0.23C+5.000E-003D-5.000E-003AB-5.000E-003AC-0.21AD+0.11BC+0.012BD+0.17CD-0.47A2-0.14B2-0.16C2-0.24D2
通过设置方程式的偏导数可以计算响应值L-Cys的产量最大下的培养条件,具体表示为葡萄糖(42.69 g/L)、硫酸铵(7.77 g/L)、酵母粉(6.53 g/L)、硫代硫酸钠(6.22 g/L),其他成分:蛋白胨(1 g/L)、KH2PO4(1 g/L)、Na2HPO4·10H2O(2.5 g/L)、金属盐溶液(1 mL/L)。该条件下理论L-Cys的产量为3.74 g/L,实际发酵结果为3.85 g/L,两者结果吻合度较高,证实了模型预测的准确性和可靠性。
图1-a揭示了葡萄糖和硫酸铵影响L-Cys产量的变化过程,随着两者质量浓度在其范围内升高,响应值L-Cys质量浓度表现为先上升再下降的趋势,并且无明显的倾斜。这种趋势在图1-b~图1-d中也有类似体现。在图1-d探究硫酸铵和酵母粉对L-Cys的影响中,图形显示等高线向低水平的酵母粉方向倾斜,表明在低水平的酵母粉浓度下,酵母粉成为其主要的影响L-Cys产量的因素,酵母粉成为此时的主要限制条件。类似的现象也可以在图1-e和图1-f中显示。
2.2 在2 L发酵罐上的放大
根据摇瓶结果进行发酵放大,在罐上发酵的结果并没有如摇瓶中明显提升。通过发酵测试,发现高浓度的葡萄糖会对菌体生长产生一定抑制,同时发现菌体在罐上对硫源和氮源的利用能力进一步提升,对培养基进行适当优化,将葡萄糖质量浓度降低至30 g/L,提升硫酸铵和硫代硫酸钠质量浓度均至10 g/L,酵母粉和蛋白胨的添加量参考LB培养基,分别为5 g/L和10 g/L,再进行发酵放大。
2.2.1 发酵温度的优化
发酵测试了不同发酵温度下的L-Cys发酵过程特性,结果如图2所示。从发酵过程曲线中可以看出,温度是影响发酵结果的重要因素,26 ℃是生产L-Cys最适温度。总体上来说,在研究范围内,发酵温度越高,菌株产L-Cys的时间越提前;但当温度过低时,较低的发酵温度会影响菌株的正常生长并延缓发酵过程[23]。本研究中,当发酵温度低于26 ℃时,L-Cys 产量大幅下降,故选择26 ℃作为发酵最适温度,此时L-Cys产量可达6.13 g/L。

a-葡萄糖和硫酸铵对L-Cys产量影响;b-葡萄糖和酵母粉对
L-Cys产量影响;c-葡萄糖和硫代硫酸钠对L-Cys产量影响;
d-硫酸铵和酵母粉对L-Cys产量影响;e-硫酸铵和硫代硫酸钠对
L-Cys产量影响;f-酵母粉和硫代硫酸钠对L-Cys产量影响
图1 不同因素交互作用对L-Cys产量影响的响应面图
Fig.1 Effects of different factors on L-Cys yield in response
surface studies

图2 不同温度对L-Cys发酵过程的影响
Fig.2 The effects of different temperatures on L-Cys production
2.2.2 外源物质的添加
在氨基酸发酵过程中,菌株一方面会自身合成所需要的营养物质,另一方面会从外部摄取。当营养物质自身合成困难或者无法合成时,外源添加是一个很好的添加策略[24-25]。故尝试在罐上进行外源物质的添加,提高菌株发酵产L-Cys的能力。
2.2.2.1 甜菜碱的添加
甜菜碱是一种生物碱,化学名称为1-羧基-N, N, N-三甲氨基乙内酯,化学结构与氨基酸相似,属于季铵碱类物质,且广泛存在于动植物体内。据报道,甜菜碱可以调节细胞渗透压,保护细胞[26]。
发酵结果如图3所示,甜菜碱的添加对发酵来说有一定的作用。在添加2 g/L的甜菜碱之后,产量能够达到7.12 g/L,相比于不添加的产量6.13 g/L来说,提高了16.2%。由于L-Cys具有一定细胞毒性,甜菜碱的添加可以调节细胞渗透压从而保护细胞,使更多的菌株在平台期进行L-Cys合成(添加甜菜碱的发酵过程中菌株OD600达到20的时间在30 h左右,相比于不添加甜菜碱的60 h提前了30 h左右),进而提高了L-Cys发酵产量。

a-不添加甜菜碱;b-添加甜菜碱
图3 外源添加2 g/L的甜菜碱对发酵的影响
Fig.3 The effects of 2 g/L betaine addition on L-Cys fermentation
2.2.2.2 氨基酸的添加
氨基酸发酵过程中的多种菌株均为营养缺陷型菌株,因此氨基酸的外源添加有时候能够起到加强主路代谢,增强产物合成的作用。有研究表明,添加其他必需氨基酸对目标产物氨基酸的发酵会有促进作用[27]。
如图4所示,通过对比实验发现罐上添加1 g/L蛋氨酸、1 g/L苏氨酸以及1 g/L异亮氨酸后,L-Cys发酵产量能达到10.25 g/L,与不添加氨基酸相比(7.12 g/L)提高了43.9 %。从发酵结果可以看出,添加氨基酸有效提高了发酵过程中菌体的OD600,在培养基自身具有氨基酸时,菌株会摄取环境中的氨基酸代替自身合成,结余的物质、能量可能用于细菌生长,因此平台期OD600有一定程度的提高,在这种情况下,菌株更多的利用自身代谢进行产物发酵,从而提升发酵产量[28]。

a-不添加3种氨基酸;b-添加3种氨基酸
图4 外源添加1 g/L蛋氨酸,1 g/L苏氨酸,
1 g/L异亮氨酸对L-Cys发酵的影响
Fig.4 The effects of adding 1 g/L methionine, 1 g/L threonine,
and 1 g/L isoleucine together on L-Cys fermentation
2.3 优化前后相关参数的对比
文章中主要采用了响应面的培养基优化方法,以及发酵罐中外源添加的发酵策略,从一开始的发酵48 h产量为1.43 g/L,优化到发酵罐最终放大的结果为47 h产10.25 g/L L-Cys。对其中相关参数计算后发现,优化后的硫转化效率,糖酸转化率以及单位时间产量均有所提升。且优化培养基成分后,丙酮酸和乙酸含量均下降。其中,丙酮酸为关键中间代谢产物,一方面,其为糖酵解途径产物,维持细胞的正常代谢生长,另一方面,在保证细胞正常代谢情况下,丙酮酸积累的下降有利于碳源流向L-Cys合成,从而有利于L-Cys生产。乙酸作为大肠杆菌生产中最常见的副产物,其浓度过高会抑制细胞的正常代谢,优化后乙酸含量下降,降低了乙酸对细胞生长的抑制作用。相关参数辅助说明了优化发酵条件后,使得更多的碳源和硫源流向L-Cys的合成,从而提高L-Cys的产量。具体参数变化见表4。
表4 优化前后的L-Cys发酵结果
Table 4 The results of L-Cys production before and after optimization
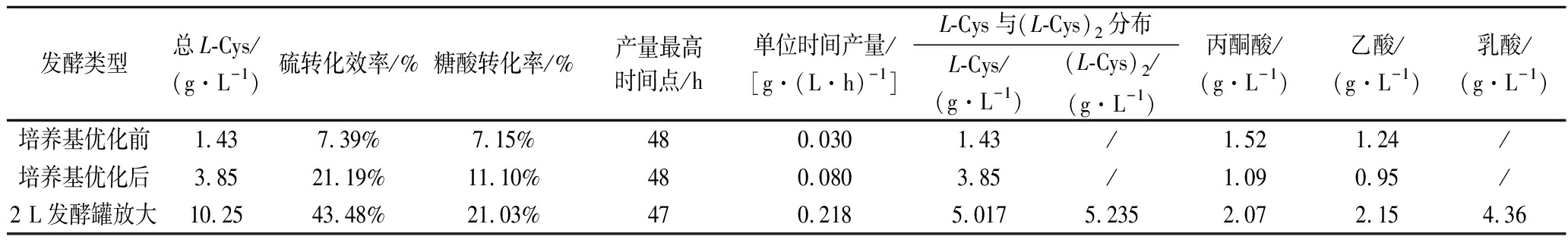
发酵类型总L-Cys/(g·L-1)硫转化效率/%糖酸转化率/%产量最高时间点/h单位时间产量/[g·(L·h)-1]L-Cys与(L-Cys)2分布L-Cys/(g·L-1)(L-Cys)2/(g·L-1)丙酮酸/(g·L-1)乙酸/(g·L-1)乳酸/(g·L-1)培养基优化前1.437.39%7.15%480.0301.43/1.521.24/培养基优化后3.8521.19%11.10%480.0803.85/1.090.95/2 L发酵罐放大10.2543.48%21.03%470.2185.0175.2352.072.154.36
注:/表示未检测到
3 结论
在本研究中,利用响应面分析方法,确定培养基成分为葡萄糖(42.69 g/L)、硫酸铵(7.77 g/L)、酵母粉(6.53 g/L)、硫代硫酸钠(6.22 g/L)、蛋白胨(1 g/L)、KH2PO4(1 g/L)、Na2HPO4·10H2O (2.5 g/L)、金属盐溶液(1 mL/L),维生素B1(5 mg/L),CaCO3(10 g/L),初始pH 7.0。优化后摇瓶发酵L-Cys的产量较优化前有大幅提高,达到3.85 g/L,较优化前的1.43 g/L提高了169%;在2 L的发酵罐上,结合不同的外源添加策略,最终L-Cys产量在47 h最高,达到10.25 g/L,为实现L-Cys的工业化生产奠定了基础。
[1] TAKAGI H, OHTSU I.L-Cysteine metabolism and fermentation in microorganisms[J].Advances in Biochemical Engineering/Biotechnology, 2017, 159: 129-151.
[2] JESSICA B B, SJOERD V D P, ARSHAG D M, et al.Spatial and temporal alterations in protein structure by EGF regulate cryptic cysteine oxidation[J].Science Signaling, 2020, 13(615):7 315.
[3] BYRNE D P, SHRESTHA S, GALLER M, et al.Aurora A regulation by reversible cysteine oxidation reveals evolutionarily conserved redox control of Ser/Thr protein kinase activity[J].Science Signaling, 2020, 13(639):2 713.
[4] HICKS J L, MULLHOLLAND C V.Cysteine biosynthesis in Neisseria species[J].Microbiology, 2018, 164(12):1 471-1 480.
[5] 张礼, 孙堆, 王晓,等.半胱氨酸参与生物体重金属抗性的研究进展[J].生物技术通报, 2017, 33(5):26-33.
ZHANG L, SUN D, WANG X, et al.Research progress on cysteine participation in heavy metal resistance in organism[J].Biotechnology Bulletin, 2017, 33(5):26-33.
[6] NAKATANI T, OHTSU I, NONAKA G, et al.Enhancement of thioredoxin/glutaredoxin-mediated L-cysteine synthesis from S-sulfocysteine increases L-cysteine production in Escherichia coli[J].Microbial Cell Factories, 2012, 11(1):62.
[7] WEI L, WANG H, XU N, et al.Metabolic engineering of Corynebacterium glutamicum for L-cysteine production[J].Applied Microbiology and Biotechnology, 2019, 103(3):1 325-1 338.
[8] TAKUMI K, ZIYATDINOV M K, SAMSONOV V, et al.Fermentative production of cysteine by Pantoea ananatis[J].Applied and Environmental Microbiology,2017, 83(5):e02502-e02516.
[9] WU D, FENG M, WANG Z X, et al.Molecular and biochemical characterization of key enzymes in the cysteine and serine metabolic pathways of Acanthamoeba castellanii[J].Parasites & Vectors, 2018, 11(1):604.
[10] KREDICH N M, TOMKINS G M.The enzymic synthesis of L-cysteine in Escherichia coli and Salmonella typhimurium[J].The Journal of Biological Chemistry, 1966, 241(21):4 955-4 965.
[11] KAWANO Y, ONISHI F, SHIROYAMA M, et al.Improved fermentative L-cysteine overproduction by enhancing a newly identified thiosulfate assimilation pathway in Escherichia coli[J].Applied Microbiology and Biotechnology, 2017, 101(18):6 879-6 889.
[12] KAWANO Y, OHTSU I, TAMAKOSHI A, et al.Involvement of the yciW gene in L-cysteine and L-methionine metabolism in Escherichia coli[J].Journal of Bioscience and Bioengineering, 2015, 119(3):310-313.
[13] KAWANO Y, OHTSU I, TAKUMI K, et al.Enhancement of L-cysteine production by disruption of yciW in Escherichia coli[J].Journal of Bioscience and Bioengineering, 2015, 119(2):176-179.
[14] NONAKA G, TAKUMI K.Cysteine degradation gene yhaM, encoding cysteine desulfidase, serves as a genetic engineering target to improve cysteine production in Escherichia coli[J].AMB Express, 2017, 7(1):1-9.
[15] YAMAZAKI S, TAKEI K, NONAKA G.YdjN encodes an S-sulfocysteine transporter required by Escherichia coli for growth on S-sulfocysteine as a sulfur source[J].FEMS Microbiology Letters, 2016, 363(17):185.
[16] LIU H, FANG G C, WU H, et al.L-Cysteine production in Escherichia coli based on rational metabolic engineering and modular strategy[J].Biotechnology Journal, 2018, 13(5):e1700695.
[17] LIU H, HOU Y H, WANG Y, et al.Enhancement of sulfur conversion rate in the production of L-cysteine by engineered Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2020, 68(1):250-257.
[18] LIU H, WANG Y, HOU Y H, et al.Fitness of chassis cells and metabolic pathways for L-cysteine overproduction in Escherichia coli[J]. Journal of Agricultural and Food Chemistry, 2020, 68(50):14 928-14 937.
[19] DINARVAND M, REZAEE M, MASOMIAN M, et al.Effect of C/N ratio and media optimization through response surface methodology on simultaneous productions of intra- and extracellular inulinase and invertase from aspergillus niger ATCC 20611[J].BioMed Research International, 2013, 2013(43):508 968.
[20] 宋思圆, 苏平, 王丽娟,等.响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J].食品科学, 2017, 38(2):283-289.
SONG S Y, SU P, WANG L J, et al.Optimization of ultrasonic extraction technology of pectin polysaccharide from okra flower and its in vitro antioxidant activity by response surface test[J].Food Science, 2017, 38(2):283-289.
[21] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[22] SHI T, TANG T, QIAN K, et al.High-performance liquid chromatographic method for determination of amino acids by precolumn derivatization with 4-chloro-3,5-dinitrobenzotrifluoride[J].Analytica Chimica Acta, 2009,654(2):154-161.
[23] 周丽,邓璨,崔文璟,等.温度调节基因开关调控大肠杆菌发酵合成L-丙氨酸[J].微生物学通报, 2015, 42(11):2 272-2 281.
ZHOU L, DENG C, CUI W J, et al.Temperature-regulated gene switch regulates fermentation and synthesis of L-alanine by Escherichia coli[J].Microbiology China, 2015, 42(11):2 272-2 281.
[24] NIMBALKAR P R, KHEDKAR M A, KULKARNI R K, et al.Strategic intensification in butanol production by exogenous amino acid supplementation:Fermentation kinetics and thermodynamic studies[J].Bioresource Technology, 2019, 288:121521.
[25] LU Z Y, ZHONG J J.Effect of furfural addition on validamycin-a production in fermentation of Streptomyces hygroscopicus 5008[J].Process Biochemistry, 2020, 92:43-48.
[26] CHEN T H H, MURATA N.Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes[J].Current Opinion in Plant Biology, 2002, 5(3):250-257.
[27] 张超,栾兴社,朱明晟,等.各种氨基酸对枯草芽孢杆菌生产聚谷氨酸的促进作用[J].食品工业, 2013, 34(1):119-122.
ZHANG C, LUAN X S, ZHU M S, et al.The promoting effect of various amino acids on the production of polyglutamic acid by Bacillus subtilis[J].The Food Industry, 2013, 34(1):119-122.
[28] 王大慧, 聂敏, 卫功元.基于两阶段氨基酸添加的谷胱甘肽发酵高产方法[J].食品科学, 2017, 38(22):22-27.
WANG D H, NIE M, WEI G Y.Glutathione fermentation high-yield method based on two-stage amino acid addition[J].Food Science, 2017, 38(22):22-27.