甜樱桃采后在贮藏的过程仍然是生命活体,依然进行着生理代谢过程,不可避免地产生活性氧(reactive oxygen species,ROS)[1]。ROS是一类强氧化能力、性质活泼的含氧类物质,主要以羟自由基、超氧阴离子自由基、H2O2和单线态氧(1O2)等形式存在,其被国内外学者认为是一类会损伤植物机体中生物膜脂成分和蛋白质成分的毒性物质。正常情况下,植物体内产生的ROS代谢处于平衡状态,然而当果蔬遭受衰老、失水、病原菌侵染等逆环境胁迫时,会刺激果蔬体内的氧化应激反应,来应对胁迫,一旦ROS和抗氧化防御机制之间失衡将会加剧采后果蔬生理代谢紊乱,进一步加剧果蔬的衰老[2]。因此,ROS代谢失衡被认为是影响果蔬劣变发生的最重要原因之一[3]。
植物的抗氧化机制受环境影响显著[4]。为了延缓甜樱桃采后衰老,目前我国主要采用气调方式改变甜樱桃贮藏环境。有研究表明,气调处理能够通过调节酶促系统的关键酶[超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、抗坏血酸过氧化物酶(aseorbateperoxidase,APX)、过氧化氢酶(catalase,CAT)]活性和非酶促系统的内源抗氧化物质的含量来减少ROS的积累,延缓采后果蔬的衰老进程[5]。陈勇等[6]发现70%O2+30%CO2的主动自发气调能够诱导SOD、POD酶活的增加和抗血酸等抗氧化物质含量增加,降低ROS含量,延缓衰老进程,维持西蓝花的采后品质。康慧芳等[7]同样发现气调包装能够提高猕猴桃抗氧化物质含量,延缓果实的衰老速度。但是,人工气调的成本相对较高,而被动气调包装同样能够改变贮藏的微环境,并且其成本低。
本试验以“红灯”樱桃为试材,采用不同包装对甜樱桃进行处理,以甜樱桃的抗坏血酸、总酚、总黄酮、总花青素的含量以及POD、SOD和APX酶活为指标,探讨被动气调包装对采后甜樱桃ROS清除的影响。
1 材料与方法
1.1 材料与试剂
于2019年6月5日从中国天津市宁河区采集新鲜的、未损坏的的“红灯”樱桃,并将其运往国家农产品保鲜工程技术研究中心(天津)。
草酸、EDTA、偏磷酸、醋酸、硫酸、无水乙醇、福林酚试剂,均为分析纯,天津市江天统一科技有限公司;POD酶活试剂盒、SOD酶活试剂盒、APX酶活试剂盒,南京建成生物科技有限公司。
1.2 仪器与设备
UV-1780型紫外分光光度计,北京普析通用仪器有限责任公司;雷磁DZS-708多参数分析仪,上海仪电科学仪器股份有限公司;SynergyH1酶标仪,美国伯腾有限公司。
1.3 实验方法
1.3.1 样品处理
樱桃样本随机分为4组,每组10份,每份含有(500±10) g。对照(CK)组:无包装,置于冷库中。P1组:用30 μm聚乙烯袋包装,袋大小为20 cm×30 cm。P2组:40 μm聚乙烯袋包装,袋大小为20 cm×30 cm。P3组:用50 μm聚乙烯袋包装,袋大小为20 cm×30 cm如表1所示。所有樱桃在(0±0.5) ℃和(90±5)%相对湿度(relative humidity,RH)下保存35 d,分别于0、7、14、21、28、35 d对甜樱桃取样测定相关指标,每个指标重复3次。
表1 20 ℃聚乙烯膜的性能指标
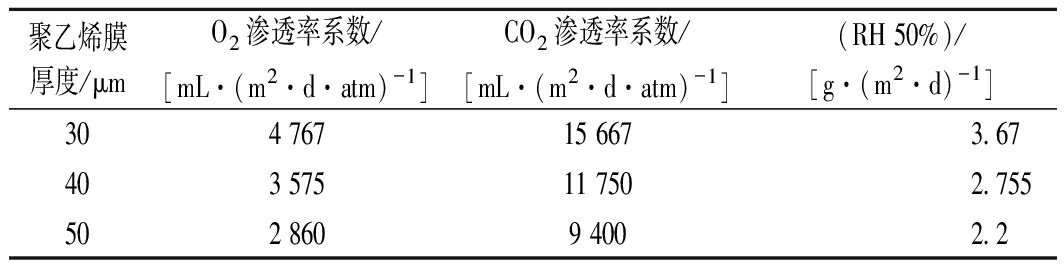
聚乙烯膜厚度/μmO2渗透率系数/[mL·(m2·d·atm)-1]CO2渗透率系数/[mL·(m2·d·atm)-1](RH 50%)/[g·(m2·d)-1]304 76715 6673.67403 57511 7502.755502 8609 4002.2
1.3.2 测定指标与方法
1.3.2.1 抗坏血酸
甜樱桃抗坏血酸含量的测定用钼蓝比色法测定[8],结果以mg/100g FW 表示。
1.3.2.2 总花青素
甜樱桃总花青素用pH示差法测定[9],结果以mg/kg表示。
1.3.2.3 总酚
甜樱桃中总酚的含量测定采用福林酚比色法测定[9],计算结果以没食子酸当量浓度,单位为mg/kg。
1.3.2.4 总黄酮
甜樱桃中总黄酮的测定采用JIA等[10]的方法测定。根据通过绘制儿茶素的系列浓度与吸光度绘制标准曲线,计算结果为儿茶素当量浓度,单位为mg/kg。
1.3.2.5 过氧化物酶
POD酶活测定使用POD盒测定。置于420 nm处,测定吸光度测定样品的POD活性。一个酶活力单位定义为每克组织每分钟催化1 μg底物的酶量,单位以U/g FW(每克鲜样中POD活力)计。
1.3.2.6 超氧化物歧化物酶
SOD酶活测定使用SOD试剂盒测定。置于450 nm处,测定吸光度测定样品的SOD活性。一个SOD酶活力单位定义为SOD抑制率达50%时所对应的酶量,单位以U/g FW(每克鲜样中SOD活力)计。
1.3.2.7 抗坏血酸过氧化物酶
APX酶活测定使用APX试剂盒测定。置于290 nm处,测定吸光度测定样品的APX活性。一个APX酶活力单位定义为每克组织每分钟在1 mL反应体系中催化1 μmol ASA,单位以U/g FW(每克鲜样中APX活力)计。
1.4 数据处理
数据采用Excel 2013软件处理,Origin 2018 Pro绘图,SPSS 20.0软件进行最小显著性差异分析(least-significant difference,LSD),在P<0.05上有显著性。
2 结果与分析
2.1 被动气调包装对甜樱桃抗坏血酸含量的影响
低水平的O2可能有助于延缓抗环血酸的氧化,而高浓度的CO2可能有助于延缓抗环血酸相关的氧化酶活性[11]。图1显示所有处理组甜樱桃抗坏血酸含量在贮藏期间急速下降。甜樱桃最初抗坏血酸含量为11.52 mg/100g FW,在第28天CK组该含量下降56.9%(由于CK组在第28天失去市场价值之后便不再进行测定),其他处理组抗坏血酸的的损失量要远小于CK组。这结果与AGLAR等[12]关于甜樱桃的报告一致。在贮藏35 d后P2组该值要高于P1和P2组,这可能是由于抗坏血酸也是呼吸代谢物质之一,不同的包装导致不同的气体氛围,P2组包装形成的气体氛围产生了相对较低的呼吸速率,能够降低抗坏血酸降解速率。在TIAN等[13]使用不同气调对甜樱桃进行研究过程中同样发现含氧量5%的大气氛围比含氧量16%组的抗血酸含量保留率高。但在GOMES等[14]的报告中表明氧水平分别为16.7%、1.8%和0.25%的条件下并未导致鲜切梨片抗坏血酸含量的变化,这与本研究存在差异。

图1 被动气调包装对甜樱桃抗坏血酸的影响
Fig.1 Effect of passive modified atmosphere
packaging on ascorbic acid of sweet cherry
注:不同小写字母表示差异显著(P<0.05)
2.2 被动气调包装对甜樱桃总花青素的影响
ROS积累到一定程度时会对植物造成损伤,花青素是植物体内清除ROS主要内源抗氧化物质之一[2]。不同聚乙烯(polyethylene,PE)包装对甜樱桃总花青素的影响如图2所示。CK组和处理组的总花青素的含量均呈现先下降后上升的趋势。对照组含量下降最大,下降了24.8%,且在整个贮藏过程中含量一直远小于处理组(P<0.05)。P1和P3组的花青素含量均在第7天下降到最低值,分别下降了19.55%和5.12%,P2组虽然在第14天下降到了最低值,但是下降了15.46%要低于P1组。整体上来说P3组下降的含量最小,且该组在整个贮藏期间该处理组的含量一直高于其他处理组(P<0.05)。这结果表明不同PE包装对维持甜樱桃中花青素均有一定的维持作用,其中P3组的包装最利于抑制花青素的降解,这可能是因为P3组形成的袋内气体微环境最有利于抑制甜樱桃中花青素的下降。杨相政等[15]的研究也表明硅窗气调包装能够延缓蓝莓果实中花青素的分解,维持果蔬的的颜色。章宁瑛[16]采用不同的气调处理蓝莓果实,结果发现5%O2+15%CO2的组合能够有效维持蓝莓中花青素的含量。

图2 被动气调包装对甜樱桃总花青素的影响
Fig.2 Effect of passive modified atmosphere packaging on
total anthocyanin of sweet cherry
2.3 被动气调包装对甜樱桃总酚的影响
酚类物质具有清除自由基的能力,主要通过提供电子或者氢原子来参与到清除ROS的过程当中,抑制自由基的积累,减少对果蔬的损伤[17]。图3显示不同的处理组对甜樱桃中总酚含量的影响不同,所有的处理组该值均成上升的趋势。对照组的含量一直呈现直线上升的趋势,在贮藏的结束时总酚的含量从425.20 mg/kg上升至497.73 mg/kg,且除了前7 d一直低于处理组(P<0.05)。P2组总酚的含量在贮藏结束的时候从425.20 mg/kg上升至541.47 mg/kg,且在整个贮藏期间总酚的含量一直高于其他处理组(P<0.05);P1、P3组在贮藏结束的时候从425.20 mg/kg分别上升至522.78和531.34 mg/kg。结果表明,气调包装对促进甜樱桃中总酚含量的上升有正面作用,其中P2组最有利于促进甜樱桃总酚含量的生成,这可能苯丙烷代谢途径相关。AGLAR等[18]采用气调包装处理甜樱桃发现增加果实中总酚的含量,在阻止氧化应激条件方面的积极作用。孙兴盛等[19]的研究同样表明适宜的气体环境(3%CO2+16%O2)能够有效维持总酚的含量及诱导苯丙烷代谢和抗氧化代谢的实现。
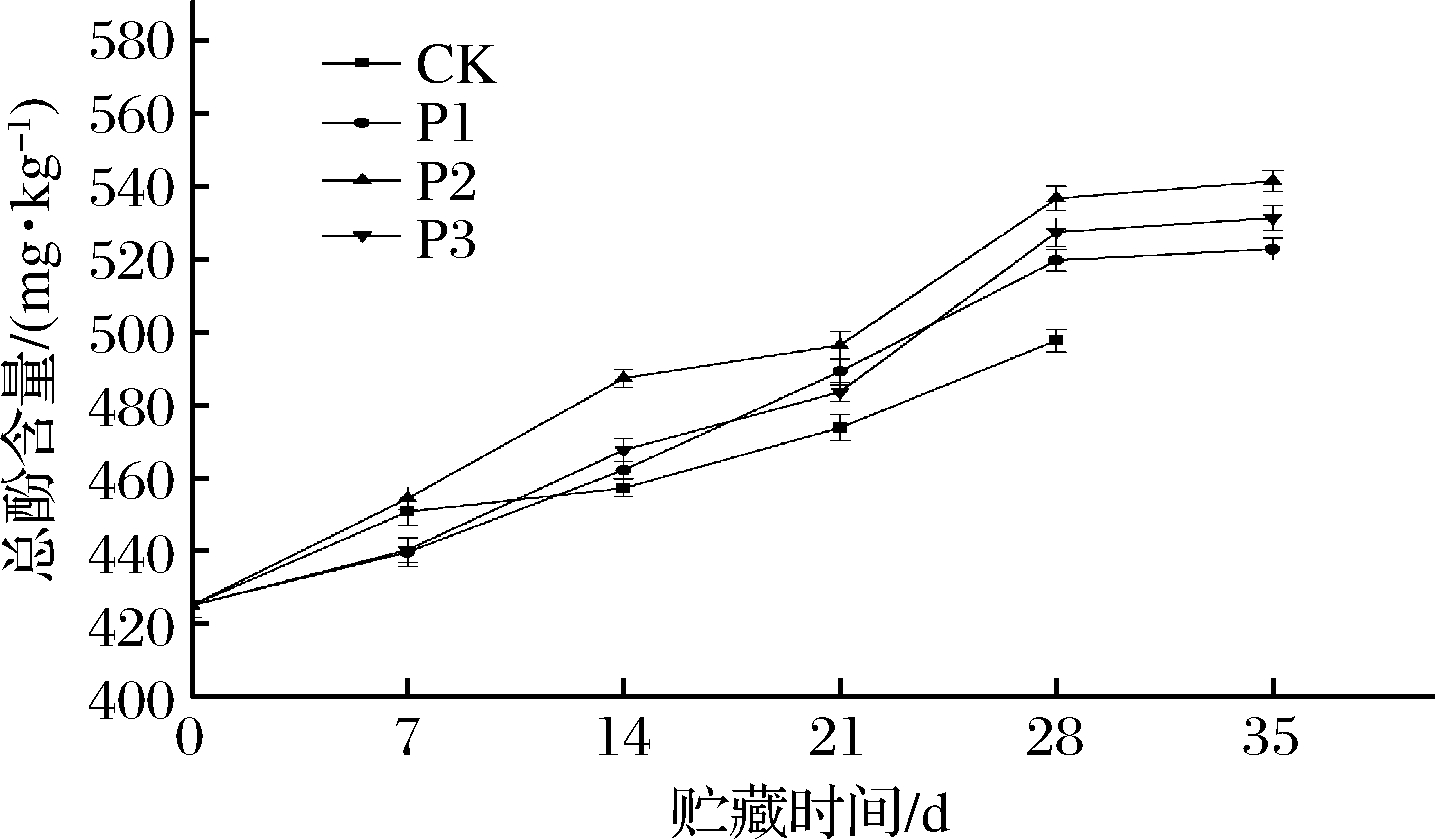
图3 被动气调包装对甜樱桃总酚含量的影响
Fig.3 Effect of passive modified atmosphere packaging on
total phenol content of sweet cherry
2.4 被动气调包装对甜樱桃总黄酮的影响
黄酮是清除植物体内ROS主要内源抗氧化物质之一,这种抗氧化能力主要是由于类黄酮中苯环上羟基有很强的抗氧化能力,能够高效的清除自由基[20]。如图4所示,所有的处理组呈现不同的变化趋势,CK促进总黄酮的生成量要低于处理组(P<0.05)。在贮藏结束时,处理组总黄酮的生成量分别增加了26.1%、29.5%和25.7%,P2组生成的量最大,且再整个贮藏过程中,含量一直高于其他处理组(P<0.05)。结果表明,被动气调包装均能促进甜樱桃中总黄酮生成,其中P2组最有利于促进总黄酮的生成,这可能与黄酮的次生代谢相关。周秋阳等[21]采用高氧气调包装处理了绿竹笋嫩茎,结果发现60%O2+20%CO2和80%O2+20%CO2最能有效延缓黄酮清除自由基能力的下降。MASHABELA等[22]探讨不同类型的气调包装膜和贮藏时间对鲜切花椰菜采后品质和生物活性物质的影响,结果表明20 NF包装(6.1%O2+11.4%CO2)能够有效维持类黄酮的含量。
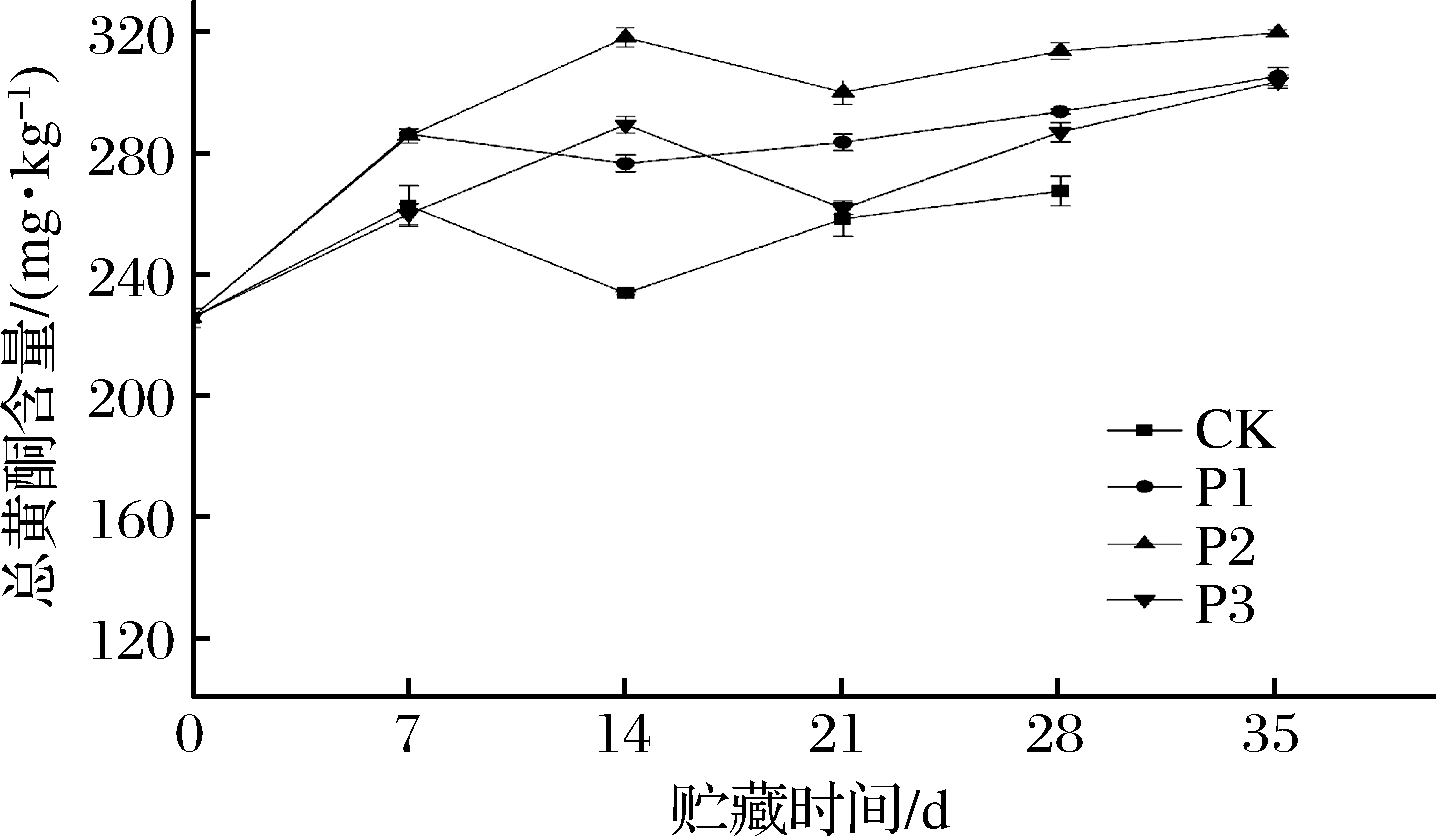
图4 被动同气调包装对甜樱桃总黄酮含量的影响
Fig.4 Effect of passive modified atmosphere packaging on
total flavonoids of sweet cherry
2.5 被动气调包装对甜樱桃POD酶活的影响
POD作为ROS清除酶的主要酶之一,主要是由于POD能够催化植物体内超氧阴离子自由基生成H2O2和O2,间接降低羟自由基产生,从而减少自由基对植物细胞的破坏,减缓植物的衰老进程[23]。如图5所示,所有的处理组均呈现先下降后上升再下降的趋势。对照组组先在前14 d下降了60.6%,之后虽然呈现上升的变化,但是POD活性一直显著低于PE处理组(P<0.05)。P2组同样在第14天下降到最低值,从78.89 U/g FW下降到了47.78 U/g FW,下降了39.4%,且该组在7 d后POD的活性一直处于最高的水平(P<0.05)。P1和P3组的POD活性分别在第7天和第14天下降到第1次的最小值,分别下降了43.5%和51.67%,但是之后P3组的POD活力增长的幅却要远大于P1组的增长幅度。结果表明,相较于对照组,被动气调包装均能延缓POD酶活的下降,其中P2组能够最有效缓解POD酶活的下降,保持甜樱桃的品质。LI等[24]研究了硅窗气调包装处理了茶树菇,结果发现的硅橡胶膜窗气调包装能够维持POD的活性,增强抗氧化酶系统活性最有利于延缓衰老进程。
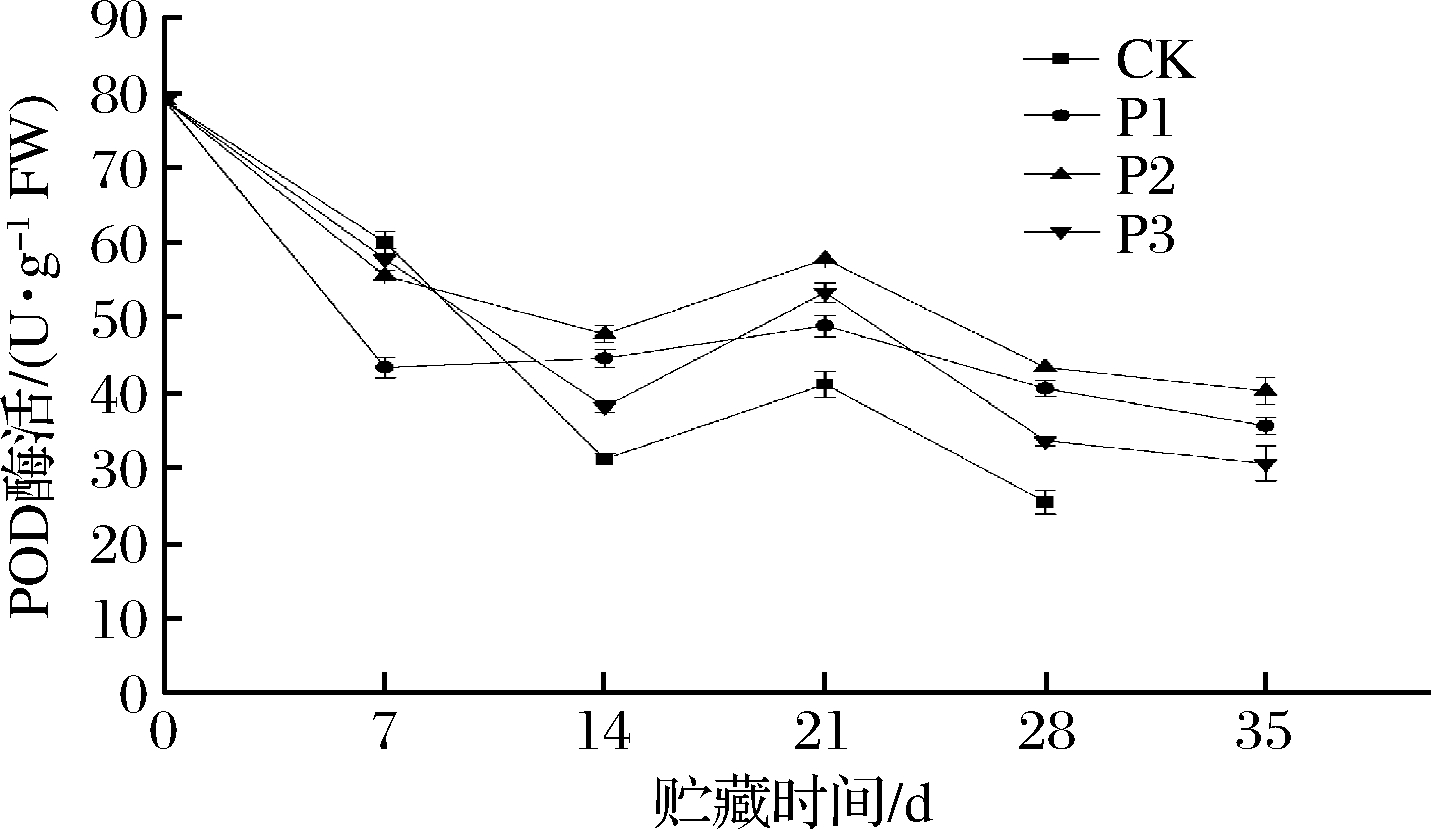
图5 被动同气调包装对甜樱桃POD酶活的影响
Fig.5 Effect of passive modified atmosphere packaging on
POD activity of sweet cherry
2.6 被动气调包装对甜樱桃SOD酶活的影响
SOD是超氧阴离子自由基主要清除酶,在清除ROS方面的作用于POD类似,都是清除自由基,将降低活性氧的积累,维持植物体内正常生理代谢[25]。如图6所示,气调包装组和空白对照组的呈现不同的变化趋势。对照组在贮藏结束时,1 059.35 U/g FW下降到了682.46 U/g FW。P1组和P2组的变化趋势一致,在促进P1、P2组的SOD酶活上升的能力是一样的,但P2组在第7天的SOD下降的程度显著大于P1组(P<0.05),且P1组在7 d后该组的SOD活力显著高于其他处理组(P<0.05)。虽P3组最能够延缓SOD酶活的下降,但是相较于P1、P2组,P3组却不利于诱导SOD酶活的上升。从整体上来看,不同的PE包装均能不同程度的诱导SOD活力的上升,其中P1组能够最有效诱导SOD酶活的上升。马佳佳等[26]将“波姬红”无花果为研究对象,使用4种不同的气体成分处理,发现8%O2+12%CO2的气调处理能够最有效维持无花果的SOD酶活性,提高抗氧化能力。这种结果同样在樱桃番茄[27]、双孢蘑菇[28]、鲜切芹菜[29]等中体现。

图6 被动气调包装对甜樱桃SOD酶活的影响
Fig.6 Effect of passive modified atmosphere packaging on
SOD activity of sweet cherry
2.7 被动气调包装对甜樱桃APX酶活的影响
APX是H2O2清除酶能够催化抗坏血酸与H2O2反应生成H2O,消除当植物遭受到逆境时产生的H2O2,从而减少H2O2对植物的损伤[30]。如图7所示,CK组和PE包装组均呈现先下降后上升的趋势。CK组APX酶活下降最大21.1%,之后酶活一直低于PE包装组。P1组和P3组分别在第7 天和第21 天下降到最低值,下降了15.8%和14.5%,但P1组在14 d的APX活力大幅度上升,之后2组无显著性差异(P>0.05),这表明短期贮藏P3组的包装比P1组更适合。P2组在第7天从0.292 3 U/g FW下降到0.266 9 U/g FW,下降了8.70%,在7 d后该组的APX的活力一直显著高于其他处理(P<0.05)。综合表明,被动气调包装均能影响甜樱桃的APX活力,其中相较于其他处理组,P2组能将APX的活力维持到相对较高的水平,能更高效将H2O2转化为H2O,减少H2O2伤害。郭乐音[31]采用不同厚度聚乙烯包装处理猕猴桃,发现MAP30既不产生冷害又不产生有害气调,能维持较高水平的清除活性氧酶促反应中酶活性,这一结果同样在蓝莓中体现[16]。

图7 被动气调包装对甜樱桃APX酶活的影响
Fig.7 Effect of passive modified atmosphere packaging on
APX activity of sweet cherry
3 结论
被动气调包装对于清除活性氧的抑制作用主要来源于果实体内活性氧清除的酶促系统和非酶促系统。对于非酶促系统,P2组能够有效抑制甜樱桃内部抗坏血酸含量的降解,促进总酚和总黄酮的生成,但维持总花青素的作用小于P3组;对于酶促系统来说,P2组处理不仅能够减小POD酶活下降的程度,而且能够维持APX酶活在高水平,但对SOD来说,虽然P2组处理能够诱导SOD酶活的上升,但其能力不如P1组。总体上看,P2组清除甜樱桃果实内ROS的能力最强,可增强抗氧化能力,减少自由基对果实的伤害。
[1] 胡均如, 张敏.热处理提高采后果蔬低温贮藏期间活性氧清除能力的机制[J].食品与发酵工业, 2021,47(12):269-276.
HU J R, ZHANG M.Mechanism of heat treatment to improve the active oxygen scavenging ability of postharvest vegetables during low temperature storage[J].Food and Fermentation Industries, 2021,47(12):269-276.
[2] 余经, 林育钊, 范中奇, 等.果蔬采后病害的发生与活性氧和膜脂代谢的关系研究进展[J].亚热带农业研究, 2020,16(2):132-137.
YU J, LIN Y Z, FAN Z Q, et al.Research progress on the relationship between disease occurrence and the metabolism of reactive oxygen species and membrane lipids in postharvest fruits and vegetables[J].Subtropical Agriculture Research, 2020,16(2):132-137.
[3] 孙小渊, 胡文忠, 刘程惠, 等.甜樱桃采后病害、贮藏期间品质变化及其防腐保鲜技术[J].食品工业科技, 2019,40(5):338-342.
SUN X Y, HU W Z, LIU C H, et al.Postharvest disease of sweet cherry, quality change during storage and its antisepesis and preservation technology[J].Science and Technology of Food Industry, 2019,40(5):338-342.
[4] IMAHORI Y, BAI J H, BALDWIN E.Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J].Scientia Horticulturae, 2016,198:398-406.
[5] 刘竟运, 林育钊, 范中奇, 等.活性氧在采后果蔬品质劣变中的作用及其控制技术研究进展[J].亚热带农业研究, 2020,16(1):52-59.
LIU J Y, LIN Y Z, FAN Z Q, et al.Research progress on the role of reactive oxygen species in quality deterioration of harvested fruits and wegetables and its control technologies[J].Subtropical Agriculture Research, 2020,16(1):52-59.
[6] 陈勇, 张玉笑, 郭衍银, 等.O2/CO2主动自发气调对西兰花活性氧代谢及保鲜效果的影响[J].山东理工大学学报(自然科学版), 2020,34(4):1-6.
CHEN Y, ZHANG Y X, GUO Y Y, et al.Effects of O2/CO2active modified atmosphere packaging on reactive oxygen species metabolism and storage quality of broccoli[J].Journal of Shandong University of Technology(Natural Science Edition), 2020,34(4):1-6.
[7] 康慧芳, 乔勇进, 刘晨霞, 等.气调贮藏对“徐香”猕猴桃采后保鲜效果影响[J].食品工业科技, 2020,41(2):279-282;287.
KANG H F, QIAO Y J, LIU C X, et al.Effect of controlled atmosphere storage on postharvest preservation of Xuxiang kiwifruit[J].Science and Technology of Food Industry, 2020,41(2):279-282;287.
[8] 刘绍俊, 牛英, 刘冰浩, 等.钼蓝比色法测定沙田柚果肉中还原型维生素C含量的研究[J].北方园艺,2011(1):8-12.
LIU S J, NIU Y, LIU B H, et al.Study on determination of the content of reduction-type VC in Chinese grapefruit's sarcocarp with phosphomolybdate-blue spectrophotometry[J].Northern Horticulture, 2011(1):8-12.
[9] ABDIPOUR M, SADAT MALEKHOSSINI P, HOSSEINIFARAHI M, et al.Integration of UV irradiation and chitosan coating:A powerful treatment for maintaining the postharvest quality of sweet cherry fruit[J].Scientia Horticulturae, 2020,264:109 197.
[10] JIA Z S, TANG M C, WU J M.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J].Food chemistry, 1999, 64(4):555-559.
[11] MANIWARA P, BOONYAKIAT D, POONLARP P B, et al.Changes of postharvest quality in passion fruit (Passiflora edulis Sims) under modified atmosphere packaging conditions[J].International Food Research Journal, 2015,22(4):1 596-1 606.
[12] AGLAR E, OZTURK B, GULER S K, et al.Effect of modified atmosphere packaging and‘Parka’treatments on fruit quality characteristics of sweet cherry fruits (Prunus avium L.‘0900 Ziraat’) during cold storage and shelf life[J].Scientia Horticulturae, 2017,222:162-168.
[13] TIAN S P, JIANG A L, XU Y, et al.Responses of physiology and quality of sweet cherry fruit to different atmospheres in storage[J].Food Chemistry, 2004,87(1):43-49.
[14] GOMES M H, FUNDO J F, POÇAS M F, et al.Quality changes in fresh-cut ‘Rocha’ pear as affected by oxygen levels in modified atmosphere packaging and the pH of antibrowning additive[J].Postharvest Biology and Technology, 2012,74:62-70.
[15] 杨相政, 王达, 吴茂玉, 等.预冷结合硅窗气调包装对蓝莓贮藏期品质的影响[J].中国果树, 2020(2):49-52.
YANG X Z, WANG D, WU M Y, et al.Effect of pre-cooling combined with silicon gum film modified atmosphere packaging on storage quality of blueberry[J].China Fruits, 2020(2):49-52.
[16] 章宁瑛. 臭氧处理及气调包装对蓝莓采后贮藏品质和生理代谢的影响[D].合肥:安徽农业大学, 2017.
ZHANG N Y.Effects of ozone treatment and modified atmosphere packaging on postharvest storage quality and physiological metabolism of blueberries[D].Hefei:Anhui Agricultural University, 2017.
[17] 夏乐晗, 陈玉玲, 冯义彬, 等.不同品种杏果实发育过程中类黄酮、总酚和三萜酸含量及抗氧化性研究[J].果树学报, 2016,33(4):425-435.
XIA L H, CHEN Y L, FENG Y S, et al.Changes in flavonoids, total phenolics, triterpenoidic acids and antioxidant capacity during fruit development of different cultivars of apricot[J].Journal of Fruit Science, 2016,33(4):425-435.
[18] AGLAR E, OZTURK B, GULER S K, et al.Effect of modified atmosphere packaging and‘Parka’treatments on fruit quality characteristics of sweet cherry fruits (Prunus avium L.‘0900 Ziraat’) during cold storage and shelf life[J].Scientia Horticulturae, 2017,222:162-168.
[19] 孙兴盛, 银徐蓉, 周福慧, 等.气调包装对软枣猕猴桃品质的影响[J].包装工程, 2019,40(19):73-79.
SUN X S, YIN X R, ZHOU F H, et al.Effect of modified atmosphere packaging on quality of Actinidia arguta[J].Packaging Engineering, 2019,40(19):73-79.
[20] 袁芳, 邱诗铭, 李丽.不同保鲜剂复合处理对鲜切芒果活性氧代谢、细胞膜透性和褐变的影响[J].食品科学, 2020,41(3):218-223.
YUAN F, QIU S M, LI L.Effect of composite preservatives on active oxygen metabolism, cell membrane permeability and browning of fresh-cut mango[J].Food Science, 2020,41(3):218-223.
[21] 周秋阳, 赵利, 濮杨, 等.高O2结合高CO2气调包装对绿芦笋抗氧化活性的影响[J].食品科技, 2016, 41(5):18-23.
ZHOU Q Y, ZHAO L, PU Y, et al.Effect of high oxygen modified atmosphere packaging combined with high carbon dioxide on antioxidant activity in green Asparagus[J].Food Science and Technology, 2016, 41(5):18-23.
[22] MASHABELA M, MAHAJAN P V, SIVAKUMAR D.Influence of different types of modified atmosphere packaging films and storage time on quality and bioactive compounds in fresh-cut Cauliflower[J].Food Packaging and Shelf Life, 2019, 22:100374.
[23] 林静颖, 李辉, 袁芳, 等.1-甲基环丙烯处理对采后‘油(木奈)’果实呼吸速率和活性氧代谢的影响[J].食品科学, 2020, 41(23):205-211.
LIN J Y, LI H, YUAN F, et al.Effect of 1-methylcyclopropene (1-MCP) treatment on respiration rate and reactive oxygen species metabolism during pastharues storage of ‘younai’ plum fruit[J].Food Science, 2020, 41(23):205-211.
[24] LI T H, ZHANG M.Effects of modified atmosphere package (MAP) with a silicon gum film window and storage temperature on the quality and antioxidant system of stored Agrocybe chaxingu[J].LWT-Food Science and Technology, 2010,43(7):1 113-1 120.
[25] LIN Y F, LIN Y X, LIN H T, et al.Inhibitory effects of propyl gallate on browning and its relationship to active oxygen metabolism in pericarp of harvested longan fruit[J].LWT-Food Science and Technology, 2015, 60(2):1 122-1 128.
[26] 马佳佳, 陆皓茜, 隋思瑶, 等.气调对无花果采后品质及活性氧代谢的影响[J].保鲜与加工, 2019,19(5):66-71.
MA J J, LU H Q, SUI S Y, et al.Influence of controlled atmosphere on postharvest quality and active oxygen metabolism of fig fruit[J].Storage and Process, 2019,19(5):66-71.
[27] 叶小平. 包装材料及方式对采后樱桃番茄品质的影响[D].扬州:扬州大学, 2017.
YE X P.Effects of packaging materials and methods on the quality of post-harvest cherry tomatoes[D].Yangzhou:Yangzhou University, 2017.
[28] 孙涵. 高氧动态气调对双孢蘑菇采后生理及品质的影响[D].淄博:山东理工大学, 2017.
SUN H.Effect of high O2 dynamic controlled atmosphere(DCA) on postharvest physiology and quality of Agaricus bisporus[D].Zibo:Shandong University of Technology, 2017.
[29] 罗淑芬, 胡花丽, 李鹏霞, 等.气调包装对鲜切芹菜贮藏品质的影响[J].江苏农业科学, 2016,44(11):315-319.
LUO S F, HU H L, LI P X, et al.Effects of modified atmosphere packaging on the storage quality of fresh-cut celery[J].Jiangsu Agricultural Sciences, 2016,44(11):315-319.
[30] CHEN H Y, LING J G, WU F H, et al.Effect of hypobaric storage on flesh lignification, active oxygen metabolism and related enzyme activities in bamboo shoots[J].LWT-Food Science and Technology, 2013,51(1):190-195.
[31] 郭乐音. 温度和限气包装对‘翠香’猕猴桃冷害及品质的影响[D].杨凌:西北农林科技大学, 2019.
GUO Y Y.Effect of temperature and dfferent modified atmospheve packaging on chilling injury and quality in posthanvest ‘kuixiang’ kiwifruit[D].Yangling:Northwest A&F University, 2019.