据国家统计局数据显示,我国2019年禽肉产量为2 239万t,其中60%为鸡肉[1],按照鸡血约占整鸡体重6%来算,产生的鸡血可达80.6万t。鸡血是一种优质动物蛋白资源,鸡血蛋白中含有人体所需的18种氨基酸及其他微量元素,但目前鸡血资源利用率不高,产生的附加值较低。血豆腐味道鲜美,加工方便且有较高的经济价值,是合理利用鸡血资源的有效途径。现阶段市场上供应的血豆腐主要是鸭血豆腐,由于鸡血豆腐保水性较差,品质稳定性低,给鸡血豆腐的工业化生产带来了阻碍。
凝胶特性是评价家禽血液制品品质优劣的重要评价标准,是形成鸡血凝胶制品保水性的基础,相关文献表明,食用胶具有改善蛋白热诱导凝胶的功能[2],瓜尔豆胶是一种水溶性膳食纤维,可作为增稠剂应用于食品,其主要成分为半乳甘露聚糖[3];阿拉伯胶在食品中可充当天然的乳化剂、稳定剂、黏合剂、悬浮剂、成膜剂等[4];由于魔芋胶亲水性较好,分子结构平滑,能通过与其他增稠剂复配以次级键结合的方式产生协同作用,有益于改善蛋白凝胶结构[5]。超声波是一种新型加工技术,在食品的物理加工中应用广泛,近年来常被用于膳食纤维、多糖、蛋白质及各种食品功能成分的提取与改性,相关研究表明超声对动物血液制品的质构、色泽和保水性能均有明显的改善作用[6]。
本研究在鸡血豆腐基本加工工序的基础上,将一定比例的瓜尔豆阿拉伯胶的复配胶或瓜尔豆魔芋胶的复配胶结合超声处理应用于鸡血中,制成鸡血豆腐后,研究复配胶结合超声处理对其凝胶特性及作用力的影响,为肉鸡副产物鸡血资源的综合利用及高值化工业生产提供理论基础。
1 材料与方法
1.1 材料与试剂
活鸡采购自南京孝陵卫菜市场,运回实验室现杀采血。
无水氯化钙、氯化钠、柠檬酸三钠(均为分析纯),国药集团化学试剂有限公司;乙二胺四乙酸二钠(分析纯),广东省化学试剂工程技术研究开发中心;尿素(分析纯),西陇化工股份有限公司;Tris-HCl缓冲液,南京森贝伽生物科技有限公司;瓜尔豆胶(食用级)、阿拉伯胶(食用级)、魔芋胶(食用级),河南万邦实业有限公司。
1.2 仪器与设备
Centrifuge 5810R离心机,德国Eppendorf;Direct-Q3uv超纯水机,美国Millipore;TVT300XP质构仪,瑞典TexVol;PTX-FA210S电子天平,福州华志科学仪器;MesoMR23-060H-1低场核磁共振成像与分析系统,苏州纽迈分析仪器;HH-4数显恒温水浴锅,常州国华公司。
1.3 试验方法
1.3.1 鸡血豆腐的优化制备
实验室自制,以0.5 g/100mL柠檬酸三钠(Na3C6H5O7)作为抗凝剂,加入4 g/L的瓜尔豆阿拉伯复配胶(复配质量比3∶7)或瓜尔豆魔芋复配胶(复配质量比5∶5)作为稳定剂,加入纯水控制血水体积比1∶2.5,再加入1%(质量分数)的氯化钙作为凝血剂。
具体操作:在鸡血中加入Na3C6H5O7溶液后于室温下搅拌30 s,取15 mL鸡血与复配食用胶的混合液,加入1 mL 1%质量分数无水氯化钙与原料血混合液于室温下搅拌30 s;在超声功率90 W下超声3 min,同时控制凝血时间12 min,然后将凝血后的样品置于90 ℃水浴锅中加热40 min,制成鸡血豆腐,室温下冷却后待用。
1.3.2 鸡血豆腐凝胶持水性
参考XUE等[7]的方法,以蒸煮损失来体现鸡血豆腐的持水性,精确称取3 g鸡血豆腐置于10 mL离心管中,放入离心机以转速4 000 r/min,温度4 ℃的条件下离心5 min,取出后用电子天平称取离心后的鸡血豆腐的质量。根据公式(1)来计算鸡血豆腐凝胶蒸煮损失,每种样品采样3次,取其平均值。
蒸煮损失![]()
(1)
式中:m1,鸡血豆腐原始质量,g;m2,离心后鸡血豆腐的质量,g。
1.3.3 鸡血豆腐凝胶强度
凝胶强度的测定根据NIAN等[8]的方法,采用TVT300XP质构仪检测0 h及4 ℃环境下保存48 h后鸡血豆腐的凝胶强度。测试参数:P/0.5探头,测试前、测试中及测试后速度均为1 mm/s,触发力5 g,压入凝胶中心位置4 mm,结束测试。此时的最大应力值是鸡血豆腐凝胶强度,以重力单位牛(N)表示。所有样品测试3次平行。
1.3.4 鸡血豆腐低场核磁测定
使用台式低场核磁共振成像与分析系统进行低场核磁共振弛豫测量。测试条件及参数参考WANG等[9]和HAN等[10]的方法并加以修改:测量温度32 ℃,质子共振频率22.6 MHz。在直径15 mm的核磁管中放入2 g的鸡血豆腐,然后进行LF-NMR测定。使用参数为:使用25 mm的线圈,r值200 μs,Tw值4 000,NECH:15 000,TE:0.25,NS:16,反演迭代次数100 000,取得鸡血凝胶自旋驰像时间T2,用CMPG序列进行测量,每组3次重复。
1.3.5 游离巯基
游离巯基参考CHEN等[11]的方法,并稍作修改。将0.5 mL鸡血蛋白溶液与4.5 mL 0.02 mol/L的Tris-HCl缓冲液(含10 mmol/L EDTA-2 Na,2%(质量分数)十二烷基硫酸钠,pH 7.5)混合。然后加入0.5 mL Ellman试剂在4 ℃下孵育1 h,在412 nm处测定混合物的吸光度。使用13 600 L/(mol·cm)的消光系数计算出游离巯基含量。
1.3.6 表面疏水性
参照YONGSAWATDIGUL等[12]的方法称取一定量鸡血蛋白样品溶于去离子水,稀释至鸡血蛋白质浓度为0.005~0.500 mol/mL,取4 mL不同浓度鸡血蛋白样品加入20 μL 8.0 mmol/L 8,8′-二苯胺基-5,5′-二黄酸联萘,混匀,避光静置15 min后检测荧光强度,设置参数:激发波长390 nm,发射波长470 nm,狭缝宽度5 nm。以荧光强度对蛋白浓度作图,斜率即为该蛋白样品的表面疏水性。
1.3.7 蛋白分子间作用力
根据YANG等[13]的方法测定鸡血豆腐的蛋白分子作用力,将样品分别溶解在4种选定的溶剂中,以表示凝胶形成过程中不同相互作用力的贡献。选择的4种溶剂为:0.6 mol/ L氯化钠溶液(S1),0.6 mol/L氯化钠溶液+ 1.5 mol/L尿素(S2),0.6 mol/L氯化钠溶液+8 mol/L尿素(S3),0.6 mol/L氯化钠溶液+8 mol/L尿素+0.5 mol/L β-巯基乙醇(S4)。将1 g鸡血凝胶样品溶解在10 mL的不同溶剂中,匀浆后离心(4 000 r/min,4 ℃,15 min)。然后通过考马斯亮蓝法测定上清液中的蛋白质浓度。以S1,(S2-S1),(S3-S2),(S4-S3)的溶解度分别代表离子键、氢键、疏水相互作用和二硫键的贡献。
1.4 统计分析
上述每组实验均重复3次,采用软件SPSS 18.0对数据进行统计分析,分析方法采用单因素ANOVA-图基检验法。P<0.05表示2组数据差异显著。
2 结果与分析
2.1 复配胶结合超声处理对鸡血豆腐持水性的影响
持水性是评价鸡血豆腐凝胶优劣的重要指标之一,会对鸡血豆腐的香气、滋味、嫩度、多汁性以及颜色等食用品质产生影响[14]。本研究以蒸煮损失表示鸡血豆腐的持水效果,复配胶联合超声处理对鸡血豆腐持水性的影响如图1所示。设置未添加复配胶及未超声处理组为CK1;仅超声处理组为CK2;仅添加瓜尔豆阿拉伯胶的复配胶组为A1;添加瓜尔豆阿拉伯胶的复配胶结合超声处理组为A2;仅添加瓜尔豆魔芋胶的复配胶组为M1;添加瓜尔豆魔芋胶的复配胶结合超声处理组为M2。由图1可知,CK1组的离心损失为32.39%,显著高于其他5组血豆腐(P<0.05),在添加瓜尔豆阿拉伯胶的复配胶、瓜尔豆魔芋胶的复配胶后,A1和M1组鸡血豆腐的蒸煮损失降低至17.63%和26.12%(P<0.05)。且经过超声处理后,各处理组对比相应的未超声组蒸煮损失显著下降(P<0.05),持水性进一步提高,M2组鸡血豆腐持水性对比CK1组提高了21.88%,说明复配胶及超声处理对鸡血豆腐的持水性有促进作用。瓜尔豆胶、阿拉伯胶和魔芋胶均属于亲水性胶体,其内部含有大量的羟基、羰基等亲水基团,能与自由水分子作用形成氢键并与蛋白产生交联反应,从而形成细密的三维网络结构,故能充分锁住水分子阻止其流失,从而提高鸡血豆腐的持水性[15]。适度超声可使鸡血细胞破裂,细胞的破裂会促进鸡血豆腐在加工过程形成凝胶时蛋白质交联程度增加,组织结构更加紧密,进而形成孔径更为细密的立体蛋白网络结构[16],有效地增强了鸡血蛋白与水分子的结合能力,增加鸡血豆腐的持水效果。
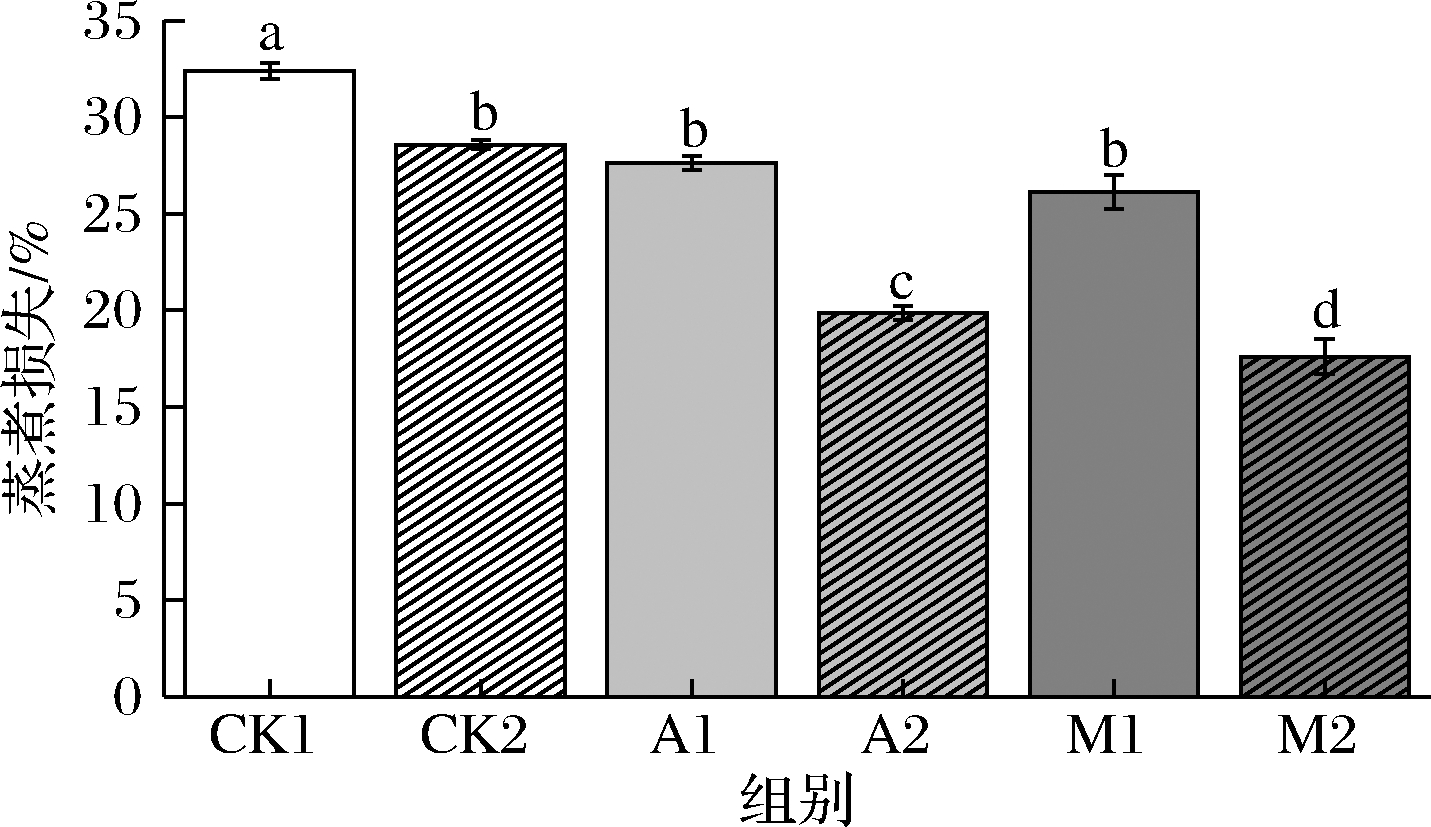
图1 复配胶结合超声处理对鸡血豆腐持水性影响
Fig.1 Effect of mixed food gums combined with
ultrasonic treatment on WHC of chicken blood tofu
注:图中上标小写字母差异表示差异显著(P<0.05)(下同)
2.2 复配胶结合超声处理对鸡血豆腐凝胶强度的影响
凝胶强度是反应蛋白质交联、变性的宏观特征之一,鸡血豆腐凝胶的形成过程既涉及鸡血蛋白与水的偶极-偶极相互作用,也依赖鸡血蛋白分子间的共价相互作用。凝胶强度的差异与蛋白质分子质量分布、氨基酸的组成及肽链长度密不可分[17]。复配胶联合超声处理对鸡血豆腐凝胶强度的影响如图2所示,0和48 h时各组鸡血豆腐凝胶强度的趋势基本一致,CK1组的鸡血豆腐凝胶强度分别为1.48和1.84 N,显著低于其他各处理组(P<0.05),添加复配胶后A1和M1组鸡血豆腐凝胶强度显著上升(P<0.05),说明复配胶对鸡血豆腐的凝胶强度有促进作用,且瓜尔豆魔芋胶的复配胶对鸡血豆腐凝胶强度的影响显著大于瓜尔豆阿拉伯胶的复配胶(P<0.05)。这可能是因为阿拉伯胶、魔芋胶及瓜尔豆胶为中性的非凝胶多糖,具有很好的黏性,在热诱导鸡血蛋白凝胶形成的过程中能进一步加固鸡血蛋白分子变形伸展及相互交联成鸡血蛋白凝胶网络,从而提高凝胶强度,但阿拉伯胶一般情况下不能形成凝胶,故其对鸡血豆腐凝胶强度的促进效果小于魔芋胶[18]。经过超声处理后,0 h时CK2、A2及M2组鸡血豆腐凝胶强度进一步提升至1.53、1.63和1.80 N,说明超声能够提高鸡血豆腐的凝胶强度。超声产生的微束流作用和空穴作用增加了鸡血的破壁程度,促进了疏水基团的暴露,在加热的过程中,蛋白分子间交联度提高,增强了鸡血凝胶的稳定性,促使鸡血蛋白凝胶强度升高[19]。此外,48 h 后,各处理组的凝胶强度均显著上升(P<0.05),这可能是因为在低温贮存过程中,鸡血豆腐凝胶中形成了更多的氢键,促进了鸡血豆腐的凝胶强度,张曦文等[20]的实验表明贮存过程中环境的温度也会影响凝胶强度,温度越低,凝胶强度越高,鸡血豆腐在4 ℃的低温环境下贮存,凝胶强度上升。

图2 复配胶结合超声处理对鸡血豆腐凝胶强度影响
Fig.2 Effect of mixed food gums combined with ultrasonic
treatment on jelly strength of chicken blood tofu
2.3 复配胶结合超声处理对鸡血豆腐低场核磁共振性质的影响
低场核磁是一种迅速且不具破坏性的分析食品中水分自由度和分布的技术。T2对水分子运动性变化非常灵敏,能准确地反映水分子自由运动的程度[21]。复配胶联合超声处理对鸡血豆腐T2弛豫时间的影响如图3所示,6组经不同处理的鸡血豆腐的低场核磁共振T2弛豫时间分布为4个峰,其所对应的T2弛豫时间可能对应水4种状态,分别是蛋白质结合水(T2b)、乳化层水(T2b-1)、不易流动水(T21)以及自由水(T22)。在弛豫时间0.14~16.29 ms(T2b,T2b-1)时出现2个小峰,代表强弱结合水,57.22~351.12 ms(T21)出现的峰是主峰,代表鸡血蛋白凝胶网络中的不易流动水,1 072.27~2 154.43 ms(T22)出现的峰,代表了鸡血豆腐蛋白凝胶网络结构之外的自由水。由图3可知,6组鸡血豆腐的T2弛豫时间分布峰形基本一致,且6组鸡血豆腐结合水均占比90%以上,但经超声及添加复配胶后,相较于CK1组其余各组鸡血豆腐的T2弛豫时间有左移趋势,且M2组左移趋势最明显,M2组T21弛豫时间对比CK1组提前了293.90 ms,说明在贮存过程中结合水与大分子物质之间作用力的强度不同。根据仪器的分析原理,T2坐标左移,说明对应的水分流动性减弱,结合性增强。影响鸡血蛋白凝胶持水性的水大部分是不易流动水,能通过位阻效应或者吸引结合水而保持[22]。自由水分是指在物料内部受束缚力最小的水分,这部分水在凝胶的贮存过程中最容易流失,经过添加复配胶及超声处理过后,M2组自由水峰面积比例比CK1组降低了4.28%,说明添加瓜尔豆魔芋胶的复配胶联合超声处理后,鸡血豆腐中水分子以更为稳定的不易流动水的形式而存在,故其拥有更好的持水效果。瓜尔豆胶、阿拉伯胶和魔芋胶均属于亲水性胶体,含有大量的亲水基团,通过氢键、诱导偶极、分子偶极和瞬间偶极等作用与水分子形成不易自由运动的大分子,在血豆腐的加热过程中可以直接与周围的水分和蛋白质相互作用,提高分子间的键合作用从而使鸡血豆腐具有更好的持水效果[23]。且适度超声后,鸡血细胞破裂,鸡血蛋白中的亲水基团充分暴露,增加了与水分子的结合能力,使得水分不容易受外界因素影响而分离[25]。

图3 复配胶结合超声处理对鸡血豆腐低场核磁共振
性质的影响
Fig.3 Effect of mixed food gums combined with ultrasonic
treatment on relaxation time distribution of chicken blood tofu
2.4 复配胶结合超声处理对鸡血豆腐游离巯基含量的影响
巯基是蛋白质中最活跃的化学基团,作为半胱氨酸的活性残基,其可通过氧化而形成二硫键,对蛋白质构象的形成和改变发挥着至关重要的作用。在蛋白质的空间结构中,巯基和二硫键是维持蛋白分子空间结构稳定以及改变功能特性的重要化学键,这些化学键的断裂、结合、重组,均可使蛋白质的更高级结构产生一定的变化,而这些变化往往又与蛋白质的功能特性紧密结合[25]。复配胶联合超声处理对鸡血豆腐游离巯基含量的影响如图4所示,CK1组游离巯基含量最高,为0.39 mmol/g,添加复配胶后,A1和M1组鸡血蛋白游离巯基含量显著降低(P<0.05)。WANG等[26]的研究指出,游离巯基的减少可能是由于蛋白分子的聚集,瓜尔豆胶、阿拉伯胶及魔芋胶等亲水性胶体与鸡血蛋白产生分子间缠绕或次级键相互作用时分子内部或分子间的巯基氧化反应或巯基与二硫键的交换反应形成更多二硫键,导致巯基含量下降。超声处理后,CK2、A2和M2的游离巯基含量进一步降低至0.33、0.25和0.23 mmol/g,这一变化和超声波对鸡血蛋白分子链打开作用有关,在蛋白凝胶形成的过程中,游离巯基含量的降低意味着其被氧化生成二硫键。超声处理形成的空穴作用中,产生了瞬态自由基(氢自由基、羟自由基),这些自由基发生交叉反应又形成氢过氧化物,氢过氧化物进一步氧化巯基形成新的二硫键[27]。

图4 复配胶结合超声处理对鸡血蛋白游离巯基含量的影响
Fig.4 Effect of mixed food gums combined with ultrasonic
treatment on active thiol of chicken blood protein
2.5 复配胶结合超声处理对鸡血蛋白疏水性含量的影响
疏水作用是维持蛋白质三级结构的主要作用力之一,对于蛋白质的结构和功能性质有着显著的影响。鸡血蛋白凝胶网络结构是蛋白分子之间或蛋白分子与溶剂水分子之间作用力平衡的结果,一定的疏水性对于鸡血蛋白凝胶的形成非常重要。复配胶结合超声处理对鸡血蛋白疏水性含量的影响如图5所示,CK1组鸡血蛋白表面疏水性最低,添加复配胶后,A1和M1组鸡血蛋白的疏水性显著上升(P<0.05),说明复配胶对鸡血蛋白疏水性有促进作用。且经过超声过后,A2和M2组鸡血蛋白疏水性分别上升了8.99%和9.38%,说明超声处理也能增加鸡血蛋白的表面疏水性。添加复配胶及超声引起鸡血蛋白表面疏水性上升可能是由于添加的瓜尔豆胶、阿拉伯胶和魔芋胶均为中性多聚糖,能与鸡血蛋白质发生糖基化反应,随着糖基化反应的进行鸡血蛋白部分结构展开,内部疏水基团暴露,待接枝度变化趋于稳定时,空间位阻效应减弱,蛋白表面疏水性上升[28]。以及超声促进了蛋白分子去折叠和展开,使得蛋白质的原始分子结构被破坏,原本埋藏在分子内部的疏水基团暴露到蛋白表面引起疏水性上升,这种展开有助于鸡血蛋白形成更为密集的蛋白网络结构[19]。对于凝胶而言,疏水作用是维持凝胶结构重要的作用力,而蛋白质的表面疏水性与分子疏水作用紧密相关,表面疏水性的增加有助于形成更紧密的蛋白网络结构。

图5 复配胶结合超声处理对鸡血蛋白疏水性的影响
Fig.5 Effect of mixed food gums combined with ultrasonic
treatment on hydrophobicity of chicken blood protein
2.6 复配胶结合超声处理对鸡血蛋白分子间作用力的影响
影响鸡血蛋白聚集的作用力主要分为两类,一类是蛋白质固有作用力形成的内相互作用力,如空间相互作用和范德华力;另一类是受周围环境影响的分子内相互作用,如离子键、氢键、疏水相互作用和二硫键,凝胶的形成和凝胶的组织特性主要取受周围环境影响的分子内相互作用影响[29]。本研究采用4种不同的溶剂破坏不同的相互作用力:0.6 mol/L的氯化钠溶液可破坏离子键;1.5 mol/L的尿素可破坏氢键;8 mol/L的尿素可同时破坏氢键和疏水作用;0.5 mol/L的β-巯基乙醇可破坏二硫键,通过蛋白质在不同溶液内溶解度的情况进而反映添加复配胶联合超声处理过程中蛋白分子相互作用力的变化[13]。复配胶结合超声处理对鸡血蛋白分子间作用力的影响如图6所示,径添加复配胶及超声处理后,鸡血豆腐在溶液中的溶解度变化较大,各组凝胶的离子键对应蛋白溶解量均小于0.1 mg/mL,说明离子键是维持鸡血蛋白的天然结构而不是维持鸡血蛋白凝胶三维网络结构的主要作用力。鸡血蛋白凝胶网络的形成主要由氢键、疏水相互作用和二硫键影响。而经过添加复配胶和超声处理后,蛋白离子键的影响显著降低(P<0.05),而氢键、疏水作用和二硫键对应的蛋白溶解量进一步提高,M2组鸡血豆腐二硫键对应的溶解量比CK1组提高145.70%,进一步说明了鸡血豆腐在加工及凝胶形成过程中,凝胶特性的形成与巯基减少和二硫键的增多有关,其结果与上文疏水性和游离巯基含量结果一致。分子间作用力结果表明,二硫键的作用力远大于离子键、氢键及疏水相互作用,说明影响鸡血凝胶的最主要的作用力是二硫键,在加热过程中,蛋白分子展开,通过巯基-二硫键交换以及疏水相互作用等形成了蛋白质聚集体[30]。而氢键、疏水相互作用和二硫键含量更高的M2组形成的鸡血凝胶将具有更好的稳定性。

图6 复配胶结合超声处理对鸡血蛋白分子间相互作用的影响
Fig.6 Effect of mixed food gums combined with ultrasonic
treatment on protein molecular interactions of chicken blood
3 结论
瓜尔豆阿拉伯胶的复配胶、瓜尔豆魔芋胶的复配胶及超声处理均能提高鸡血豆腐的持水力和凝胶强度,同等条件下,瓜尔豆魔芋胶的复配胶对鸡血豆腐持水力和凝胶强度的促进效果优于瓜尔豆阿拉伯胶的复配胶。研究发现,复配胶结合超声处理能进一步改善其持水力与凝胶强度。蛋白分子间作用力结果表明,离子键不是鸡血凝胶形成的主要作用力,经过添加复配胶及超声处理后,鸡血蛋白疏水相互作用提高,游离巯基含量下降,二硫键含量升高,影响鸡血豆腐凝胶形成的主要作用力是二硫键,以上结果有助于阐明鸡血豆腐凝胶的形成机理。研究表明,瓜尔豆与魔芋胶的复配胶结合超声处理能够对鸡血凝胶产生积极作用,因此在工业生产中可将瓜尔豆胶和魔芋胶复配并结合超声处理来提升鸡血豆腐的品质,提升肉鸡副产物鸡血资源的附加值及综合利用。
[1] 霍晓娜, 张剑波.近年来中国肉鸡产业发展现状及未来展望[J].农业展望, 2020, 16(3):62-65;97.
HUO X N, ZHANG J B.Status quo of china′s broiler industry development in recent years and its future outlook[J].Agricultural Outlook, 2020, 16(3):62-65;97.
[2] LAFARGE C, JOURNAUX L, BONNOTTE A, et al.Trapping of carvacrol by konjac glucomannan-potato starch gels:Stability from macroscopic to microscopic scale, using image processing[J].Food Hydrocolloids, 2017, 66:216-226.
[3] GUO N, ZHU G L, CHEN D, et al.Preparation and characterization of gellan gum-guar gum blend films incorporated with nisin[J].Journal of Food Science, 2020, 85(6):1 799-1 804.
[4] DAISY L L, NDUKO J M, JOSEPH W M, et al.Effect of edible gum Arabic coating on the shelf life and quality of mangoes (Mangifera indica) during storage[J].Journal of Food Science and Technology, 2020,57(1):79-85.
[5] JIANG Y Y, REDDY C K, HUANG K H, et al.Hydrocolloidal properties of flaxseed gum/konjac glucomannan compound gel[J].International Journal of Biological Macromolecules, 2019, 133:1 156-1 163.
[6] WANG D Y, ZHANG M H, BIAN H, et al.Effects of blood cell membrane disruption by ultrasonic technology on the quality of duck blood tofu[J].Agricultural Science & Technology, 2014, 15(4):616-619;626.
[7] XUE S W, XU X L, SHAN H M, et al.Effects of high-intensity ultrasound, high-pressure processing, and high-pressure homogenization on the physicochemical and functional properties of myofibrillar proteins[J].Innovative Food Science & Emerging Technologies, 2018, 45:354-360.
[8] NIAN L Y, CAO A L, WANG J, et al.Viscoelastic and functional properties of cod-bone gelatin in the presence of xylitol and stevioside[J].Frontiers in Chemistry, 2018, 6:111-120.
[9] WANG P, XU X L, HUANG M, et al.Effect of pH on heat-induced gelation of duck blood plasma protein[J].Food Hydrocolloids, 2014, 35:324-331.
[10] HAN M Y, ZHANG Y J, FEI Y, et al.Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J].European Food Research and Technology, 2009, 228(4):665-670.
[11] CHEN R, WENG L, SIZTO N C, et al.Ultrasound-accelerated immunoassay, as exemplified by enzyme immunoassay of choriogonadotropin[J].Clinical Chemistry, 1984, 30(9):1 446-1 451.
[12] YONGSAWATDIGUL J, SINSUWAN S.Aggregation and conformational changes of tilapia actomyosin as affected by calcium ion during setting[J].Food Hydrocolloids, 2007, 21(3):359-367.
[13] YANG X Y, SU Y, LI L.Study of soybean gel induced by Lactobacillus plantarum:Protein structure and intermolecular interaction[J].LWT-Food Science and Technology,2020,119:108974.
[14] UTRERA M, MORCUENDE D, ESTÉVEZ M.Fat content has a significant impact on protein oxidation occurred during frozen storage of beef patties[J].LWT-Food Science and Technology, 2014, 56(1):62-68.
[15] 李晓飞, 李培源, 李安琪, 等.黄原胶添加对碱法诱导魔芋胶凝胶特性及凝胶机制的影响[J].中国农业科学, 2020,53(14):2 941-2 955.
LI X F, LI P Y, LI A Q, et al.Effects of xanthan addition on the gel properties and gel mechanism of alkaline-induced konjac glucomannan gels[J].Scientia Agricultura Sinica, 2020,53(14):2 941-2 955.
[16] 陈菲, 王道营, 诸永志, 等.超声波破壁工艺对鸭血凝胶特性的影响[J].江苏农业学报, 2012, 28(1):181-185.
CHEN F, WANG D Y, ZHU Y Z, et al.Effect of breaking of cell wall by ultrasonic on gel characteristics of duck blood[J].Jiangsu Journal of Agricultural Sciences, 2012, 28(1):181-185.
[17] BADII F, HOWELL N K.Fish gelatin:Structure, gelling properties and interaction with egg albumen proteins[J].Food Hydrocolloids, 2006, 20(5):630-640.
[18] 罗华彬, 林露, 司永利, 等.不同亲水胶体对带鱼鱼糜凝胶品质的影响[J].核农学报, 2019, 33(7):1 371-1 376.
LUO H B, LIN L, SI Y L, et al.Effects of different hydrocolloids on the gel quality of hairtail surimi[J].Journal of Nuclear Agricultural Sciences, 2019, 33(7):113-118.
[19] 刘竞男, 张智慧, 王琳, 等.超声处理对谷氨酰胺转氨酶诱导的大豆分离蛋白凝胶冻融稳定性的影响[J].食品科学, 2020, 41(13):76-82.
LIU J N, ZHANG Z H, WANG L, et al.Effect of ultrasound on freeze-thaw stability of soy protein isolate gel induced by glutamine transaminase[J].Food Science, 2020, 41(13):76-82.
[20] 张曦文, 伍菱, 童风景, 等.贮藏条件对江蓠琼胶酶活性和琼胶凝胶强度的影响[J].水产科学, 2020, 39(6):880-886.
ZHANG X W, WU L, TONG F J, et al.Effects of storage temperature and humidity on enzyme activities and strength of agar gel in brown alga Gracilaria[J].Fisheries Science, 2020, 39(6):880-886.
[21] 刘晓庆, 刘松继, 陈江平, 等.不同改良剂对豌豆淀粉凝胶化及凝胶特性的影响[J].中国粮油学报, 2020, 35(1):143-148.
LIU X Q, LIU S J, CHEN J P, et al.Effects of different modifiers on gelation and gel properties of pea starch[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(1):143-148.
[22] HUFF-LONERHAN E, LONERGAN S M.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science, 2005, 71(1):194-204.
[23] 付丽, 陈晓, 高雪琴.食用胶复合添加对台湾烤肠品质影响的研究[J].肉类工业, 2019(11):25-30;40.
FU L, CHEN X, GAO X Q.Study on the effect of compounding addition of edible gum on the quality of Taiwan roasted sausage[J].Meat Industry, 2019(11):25-30;40.
[24] 姜国川, 孙洪蕊, 刘学军.超声波处理对猪血凝胶品质的影响[J].肉类工业, 2015(2):25-30;40.
JIANG G C, SUN H R, LIU X J.Effect of ultrasonic treatment on quality of porcine blood gel[J].Meat Industry, 2015(2):25-30;40.
[25] 王丹丹, 毛晓英, 孙领鸽, 等.氢过氧化物氧化对核桃蛋白结构和乳化特性的影响[J].中国食品学报, 2019, 19(12):60-68.
WANG D D, MAO X Y, SUN L G, et al.Effects of oxidation by hydrogen peroxide on the structure and emulsifing properties of walnut protein[J].Journal of Chinese Institute of Food Science and Techology, 2019, 19(12):60-68.
[26] WANG C Y, LI J, LI X H, et al.Molecular forces and gelling properties of heat-induced gel from egg white protein glycated with isomalto-oligosaccharide[J].Food Hydrocolloids, 2020, 99:105 356.
[27] 邓涵, 祖琴琴, 朱杰瑞, 等.超声处理对大豆7S蛋白潜在致敏性的影响[J].食品科学, 2017, 38(5):32-37.
DENG H, ZU Q Q, ZHU J R, et al.Effect of ultrasonic treatment on the potential allergenicity of soybean 7S globulin[J].Food Science, 2017, 38(5):32-37.
[28] 任孟珂, 布冠好, 左颖昕.葡聚糖接枝对大豆蛋白功能特性及结构的影响[J].食品研究与开发, 2020, 41(6):6-12.
REN M K, BU G H, ZUO Y X.Effects of dextran grafting on functional properties and structure of soy protein[J].Food Research and Development, 2020, 41(6):6-12.
[29] 郭丽萍, 熊双丽, 黄业传.超高压结合热处理对猪肉蛋白质相互作用力及结构的影响[J].现代食品科技, 2016, 32(2):196-204.
GUO L P, XIONG S L, HUANG Y Z.Effects of ultra-high pressure combined with thermal treatment on molecular interaction and structure of pork proteins[J].Modern Food Science and Technology, 2016, 32(2):196-204.
[30] 张洪超, 薛张芝, 徐晓蓉, 等.羟基自由基氧化对乌贼蛋白分子间作用力及结构的影响[J].核农学报, 2020, 34(1):131-138.
ZHANG H C, XUE Z Z, XU X R, et al.Effect of hydroxyl radical oxidation on myofibrillar protein intermolecular force and structural of Sepia esculenta[J].Journal of Nuclear Agricultural Sciences, 2020, 34(1):131-138.