干化葡萄酒是指将采收后的葡萄适度风干,失去部分水分,达到一定的糖度和酸度后再进行发酵得到的葡萄酒[1]。这种葡萄酒的酿造已经有四千余年的历史[2]。根据干化场所和干化过程葡萄失水的驱动因素的不同,干化处理主要包括日光干化、室内自然干化、设备辅助干化3种方式[3]。其中,室内自然干化是不受天气影响,不需额外设备投入的一种实用性强,成本较低的方式。
干化是一个复杂的过程,不仅引起葡萄中游离水的散失,而且导致葡萄表皮组织结构和细胞代谢方式发生明显的变化,因此干化葡萄的糖分、有机酸、多酚等成分都与新鲜果实有所不同[4-5]。干化期间葡萄细胞的代谢变化可以分为两步:第1步从开始干化至葡萄失水10%~12%,此时细胞对胁迫作用作出响应,脱落酸、脯氨酸和脂氧合酶积累;第2步发生在葡萄失水20%左右,这时脯氨酸和蛋白质显著积累,乙醇脱氢酶活性增强,乙醇和乙醛的合成增加,但随着乙酸乙酯的生成而有所减少[6]。
有机酸影响葡萄酒酸度和甜度的平衡,同时对葡萄酒的微生物稳定性和化学稳定性有益。花色苷是红葡萄酒和桃红葡萄酒的主要呈色物质。依据结构差异,花色苷可以分为基本花色苷、酰化花色苷、吡喃花色苷和花色苷衍生物[7]。新酿红葡萄酒中的花色苷通常以基本花色苷和酰化花色苷为主,而陈酿红葡萄酒的颜色来源主要是较稳定的花色苷衍生物和吡喃花色苷[8]。MARQUEZ 等[9]采用HPLC-MS分析发现,干化‘美乐’和‘西拉’葡萄醪中含有vitisin A和vitisin B,以及基本花色苷与儿茶素通过甲基-亚甲基桥形成的缩合花色苷。缩合单宁主要存在于葡萄的果皮和种子,是由黄烷-3-醇单体,包括儿茶素、棓儿茶素、表儿茶素、表棓儿茶素和表儿茶素没食子酸酯形成的复杂聚合物[10]。葡萄破碎后,葡萄皮和籽中的缩合单宁缓慢进入葡萄酒中,贡献了葡萄酒的涩感[10]。干化处理对葡萄化学成分的改变受到葡萄品种、干化方式、干化时间等多种因素的影响,这些改变是由各成分的浓缩与扩散、合成与氧化、聚合和降解等多种效应所决定的[11]。
‘马瑟兰’是由赤霞珠和歌海娜杂交而成的品种,具有环境适应力强、抗病力强、果粒小等优点。该品种自2001年由法国引入我国以来,其栽培面积不断扩大,具有生产高品质葡萄酒的潜力[12]。目前,国内对干化葡萄和葡萄酒的研究还较少[13-15]。本研究以‘马瑟兰’葡萄为材料,研究干化处理对其基本理化指标、有机酸、花色苷、单宁组分的影响,以提高或改善‘马瑟兰’葡萄品质,为酿造‘马瑟兰’干化葡萄酒提供参考和指导。
1 材料与方法
1.1 材料与试剂
实验材料‘马瑟兰’葡萄于2019年取自西北农林科技大学(合阳)葡萄试验示范站。还原糖137.50 g/L,滴定酸5.34 g/L(以酒石酸计),pH值3.36。
乙腈、甲醇(均为色谱纯),美国Tedia公司;甲酸(色谱纯),天津科密欧公司;丙酮、间苯三酚(均为分析纯),西陇科学公司;标准品:二甲花翠素-3-O-葡萄糖苷、草酸、酒石酸、苹果酸、柠檬酸、抗坏血酸、乳酸、琥珀酸、乙酸,美国Sigma公司。
1.2 仪器与设备
LB32T手持糖度计,广州速为公司;FE28 pH计,梅特勒-托利多仪器(上海)公司;冷冻干燥机,北京博医康公司;LC-20A高效液相色谱仪(二极管阵列检测器),日本岛津公司。
1.3 实验方法
1.3.1 葡萄干化方法
葡萄干化处理在无太阳直射、通风良好的房间进行,温度20~25 ℃,空气相对湿度65%~85%。葡萄悬挂于铝合金架,每穗间隔15~20 cm(图1)。整个干化时期持续27 d,分别在第0、10、18和27天采样。随机采集不同高度以及果穗底部、中部和顶部无物理性损伤及霉变的果实,共采集300粒浆果,分为3份。保存于-20 ℃冰箱备用分析。

图1 干化处理过程中的‘马瑟兰’葡萄
Fig.1 ‘Marselan’ grapes during the drying process
1.3.2 基本理化指标的测定
葡萄手工压榨并离心后得到澄清的果汁,进行基本理化指标测定。可溶性固形物含量通过手持糖量计测定。还原糖、滴定酸含量参照GB 15037—2006《葡萄酒、果酒通用分析方法》测定[16]。pH值采用pH计测量。
1.3.3 葡萄汁有机酸的测定
取葡萄清汁,用去离子水稀释5倍,用0.22 μm微孔滤膜过滤后进行HPLC分析。HPLC的色谱条件参照成冰等[17]的方法。配制质量浓度分别为 2.0、1.0、0.6、0.3、0.2、0.1、0.05、0.025、0.012 5、0.062 5 mg/mL的系列混标溶液,过滤后进行HPLC分析。色谱条件:色谱柱为Synergi C18 柱(250 mm×4.6 mm,4 μm),流动相为0.02 mol/L KH2PO4-甲醇(体积比97∶3)溶液(H3PO4调节pH为2.30),流速1 mL/min;柱温30 ℃,进样量10 μL,检测波长210 nm。
1.3.4 葡萄果皮花色苷的提取与测定
花色苷的提取参照岳泰新[18]的方法。准确称取0.500 g葡萄果皮冻干粉于50 mL离心管中,加入10 mL盐酸-甲醇-水溶液(体积比1∶600∶399),30 ℃下避光超声萃取30 min后,4 ℃、10 000 r/min离心10 min,随后转移上清液于新的离心管中,残渣重复提取3次,合并上清液并摇匀,储存于-20 ℃冰箱中。
HPLC分析参照本实验室YANG等[19]的方法。定量分析以二甲花翠素-3-O-葡萄糖苷为标准品,采用外标法进行定量分析,所有花色苷浓度以二甲花翠素-3-O-葡萄糖苷当量表示。花色苷标准曲线质量浓度范围为0.27~400 mg/L,决定系数为0.999 9。样品测定前经0.22 μm滤膜过滤,色谱柱为Synergi Hydro-RP C18柱(250 mm×4.6 mm, 4 μm)。流动相A[V(甲酸)∶V(乙腈)∶V(水)=2.5∶10∶80],流动相B[V(甲酸)∶V(乙腈)∶V(水)=2.5∶50∶40)]。梯度洗脱程序:0~45 min:0%~35%B;45~46 min:35%~100%B;46~50 min:100%B;50~51 min:100% ~0%B;51~55 min:0%B,流速:1 mL/min,柱温:35 ℃。检测波长为520 nm。根据花色苷的保留时间、最大吸收波长和本实验室花色苷质谱数据对花色苷进行定性分析[8, 19-20]。
1.3.5 葡萄皮和籽单宁的提取与测定
单宁提取:取10粒冷冻后的葡萄,剥离果皮和种子,在液氮保护下研磨成粉末,果皮和种子分别移入50 mL离心管中,加入10 mL丙酮水(体积比2∶1)溶液,离心管内充满氮气,室温下避光200 r/min振荡提取24 h。离心后取上清液在35 ℃下减压浓缩以除去有机相,剩余溶液冻干成粉末,最后加入1 mL甲醇复溶。
间苯三酚反应:取100 μL甲醇提取液与100 μL间苯三酚溶液(含0.2 mol/L HCl、100 g/L间苯三酚和20 g/L抗坏血酸)混合均匀,50 ℃水浴反应20 min,加入400 μL 0.2 mol/L乙酸钠水溶液终止反应。
HPLC测定:上述600 μL反应溶液用0.22 μm滤膜过滤,进样量10 μL。色谱柱与花色苷的检测相同。流动相A[V(水)∶V(甲酸)=98∶2],流动相B[V(乙腈)∶V(流动相A)=80∶20]。梯度洗脱程序:0~5 min:0%B;5~65 min:0%~20%B;65~66 min:20%~100%B;66~74 min:100%B;74~75 min:100%~0%B,流速:1 mL/min,柱温:35 ℃,检测波长:280 nm。参考BUSSE-VALVERDE等[21]和KENNEDY等[22]的方法定性分析。
1.4 数据分析
采用SPSS 23.0统计软件分析。通过Tukey检验和ANOVA方差分析法进行变量间差异显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 干化处理对‘马瑟兰’葡萄形态和基本理化指标的影响
图2展示了‘马瑟兰’葡萄在开始干化(记为CK)及干化第10、18和27天(分别记为G1、G2和G3)的形态变化。干化过程中,葡萄果梗颜色变深,果粒逐渐皱缩软化,挤压果粒可以发现果皮变薄且为碎片状,果汁轻微染成红色。FASOLI等[4]对‘Corvina’葡萄的干化试验发现了类似的现象。

图2 干化过程中‘马瑟兰’葡萄形态变化
Fig.2 Morphological alteration during postharvest dehydration of
‘Marselan’ grapes
由表1可知,干化处理后,G1、G2和G3失水率、皮占比和籽占比都显著高于CK,百粒重和出汁率显著低于CK(P<0.05)。G3的失水率最高,为32.76%,而出汁率最低,为54.67%。由于干化过程葡萄失水浓缩,葡萄汁的可溶性固形物含量不断上升,G3的还原糖含量达到268.67 g/L,与CK相比上升了95.4%。G1和G2的滴定酸均显著高于CK,而G3的滴定酸与CK无显著差异(P>0.05)。有文献报道,干化处理提高了‘赤霞珠’、‘美乐’、‘Xynisteri’、‘Mavro’、‘Chatus’的滴定酸,而‘Avana’、‘Nebbiolo’的滴定酸降低[5,9]。对‘Trebbiano’葡萄的研究发现,室内自然干化18 d,其总酸降低,而设备辅助干化18 d后其总酸升高[23]。因此,干化对滴定酸的影响可能与葡萄品种、干化程度和干化方式有关。干化过程中,葡萄汁的pH不断上升,与滴定酸的变化趋势不一致。这种差异可能与干化过程中金属阳离子(如K+)升高有关[24-25]。
表1 干化处理对‘马瑟兰’葡萄基本理化指标的影响
Table 1 Effect of postharvest dehydration on the basic
physiochemical parameters of‘Marselan’ grapes
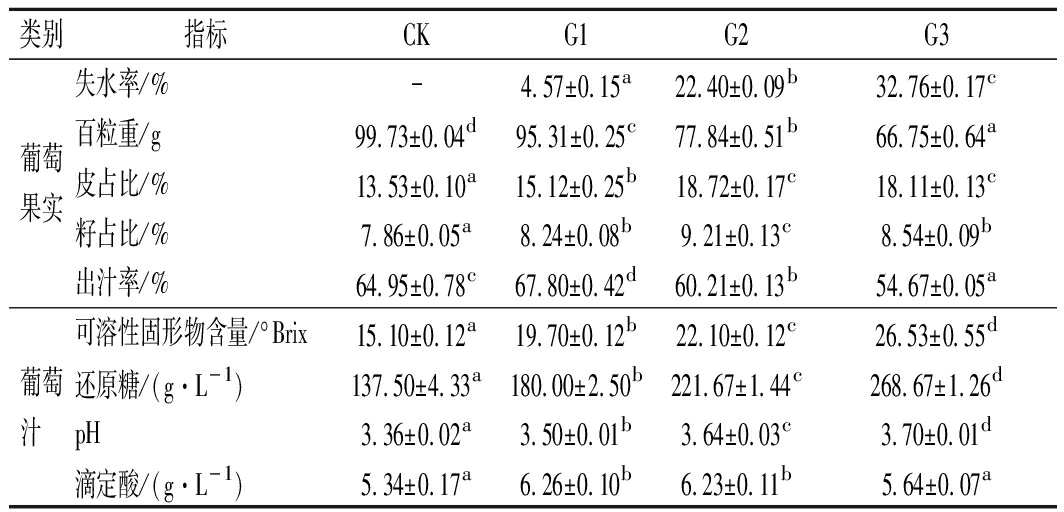
类别指标CKG1G2G3失水率/%-4.57±0.15a22.40±0.09b32.76±0.17c葡萄百粒重/g99.73±0.04d95.31±0.25c77.84±0.51b66.75±0.64a果实皮占比/%13.53±0.10a15.12±0.25b18.72±0.17c18.11±0.13c籽占比/%7.86±0.05a8.24±0.08b9.21±0.13c8.54±0.09b出汁率/%64.95±0.78c67.80±0.42d60.21±0.13b54.67±0.05a可溶性固形物含量/°Brix15.10±0.12a19.70±0.12b22.10±0.12c26.53±0.55d葡萄还原糖/(g·L-1)137.50±4.33a180.00±2.50b221.67±1.44c268.67±1.26d汁 pH3.36±0.02a3.50±0.01b3.64±0.03c3.70±0.01d滴定酸/(g·L-1)5.34±0.17a6.26±0.10b6.23±0.11b5.64±0.07a
注:不同小写字母表示显著性差异(P<0.05)(下同)
2.2 干化处理对‘马瑟兰’葡萄汁有机酸的影响
有机酸的组成和含量不仅直接影响了葡萄果实的风味和营养价值,同时也间接塑造了葡萄酒的口感和风格[25]。葡萄中有机酸的含量受到葡萄品种、产区气候、成熟度等因素的影响[26]。
‘马瑟兰’葡萄汁中共检测到草酸、酒石酸、苹果酸、抗坏血酸和柠檬酸5种有机酸(表2)。其中酒石酸含量最高,苹果酸次之,两者之和占有机酸总量的87%左右。所有干化处理葡萄汁有机酸总量较CK显著上升(P<0.05),其中G3含量最高,达(11.34±0.57) g/L。由表2可知,G1、G2和G3的草酸、酒石酸、柠檬酸的含量显著高于CK(P<0.05),说明干化过程果实失水浓缩导致这些成分含量升高。G1、G2和G3的抗坏血酸含量显著低于CK(P<0.05),这是由于降解引起的损失高于失水引起的浓缩。苹果酸的含量呈先上升后下降的趋势,与滴定酸的变化趋势相同。苹果酸含量的下降可能与细胞氧化分解或糖异生反应有关[26]。干化处理增加了葡萄原料的有机酸总量,有助于减少许多产区向葡萄酒中人为添加有机酸的措施。
表2 干化处理对‘马瑟兰’葡萄汁有机酸的影响 单位:g/L
Table 2 Effect of postharvest dehydration on
the organic acids of‘Marselan’ juices
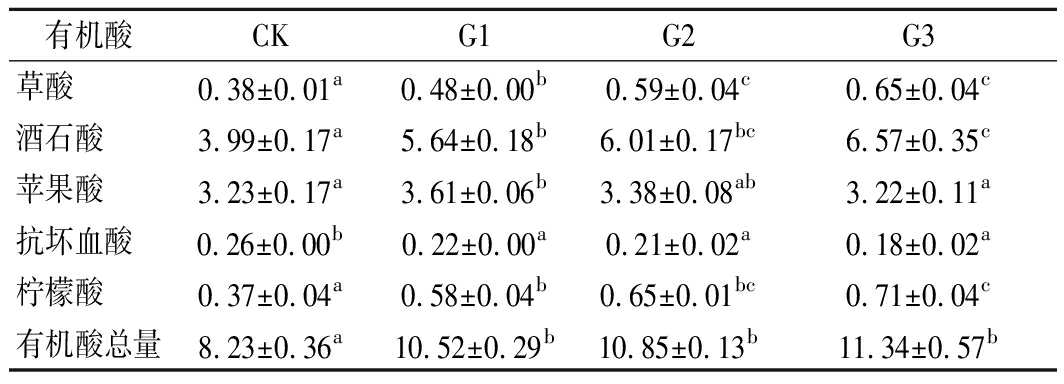
有机酸CKG1G2G3草酸 0.38±0.01a0.48±0.00b0.59±0.04c0.65±0.04c酒石酸 3.99±0.17a5.64±0.18b6.01±0.17bc6.57±0.35c苹果酸 3.23±0.17a3.61±0.06b3.38±0.08ab3.22±0.11a抗坏血酸 0.26±0.00b0.22±0.00a0.21±0.02a0.18±0.02a柠檬酸 0.37±0.04a0.58±0.04b0.65±0.01bc0.71±0.04c有机酸总量8.23±0.36a10.52±0.29b10.85±0.13b11.34±0.57b
2.3 干化处理对‘马瑟兰’葡萄皮花色苷类物质组分和含量的影响
如表3所示,‘马瑟兰’葡萄皮中共检测到19种花色苷,其中包括基本花色苷5种,乙酰化花色苷5种,香豆酰化花色苷5种,咖啡酰化花色苷2种,以及未鉴定结构的花色苷衍生物2种。
表3 干化处理对‘马瑟兰’葡萄花色苷含量的影响 单位:μg/g皮干重
Table 3 Effect of postharvest dehydration on the anthocyanins of‘Marselan’ grapes

编号花色苷名称花色苷含量CKG1G2G3基本花色苷1花翠素-3-O-葡萄糖苷549.69±0.77d462.93±1.95c347.88±2.37b316.34±6.42a2花青素-3-O-葡萄糖苷65.64±0.32d71.41±0.56c56.27±0.22b49.41±0.06a3甲基花翠素-3-O-葡萄糖苷702.09±2.98d583.43±1.06c422.15±1.21a437.48±4.95b4甲基花青素-3-O-葡萄糖苷422.28±2.88b451.31±2.59b347.46±0.28a370.15±2.88a5二甲花翠素-3-O-葡萄糖苷7 895.37±28.72d6 689.22±18.30c5 122.66±22.86a5 868.02±75.59b乙酰化花色苷6花翠素 3-O-乙酰化葡萄糖苷160.99±0.80d136.20±1.46c97.58±1.51b88.29±0.70a7花青素 3-O-乙酰化葡萄糖苷67.81±0.53a68.26±3.89a61.18±0.33a67.73±1.30a8甲基花翠素 3-O-乙酰化葡萄糖苷246.70±0.06c208.70±3.61b136.75±0.18a135.13±0.95a9甲基花青素 3-O-乙酰化葡萄糖苷179.59±0.40b175.11±4.42b134.42±0.65a140.69±13.09a10二甲花翠素 3-O-乙酰化葡萄糖苷3 719.71±7.79d3 084.43±11.46c2 324.69±0.92a2 550.78±75.40b香豆酰化花色苷11花翠素 3-O-反式香豆酰化葡萄糖苷23.93±0.11a23.90±1.24a23.01±0.21a23.59±0.68a12甲基花翠素 3-O-反式香豆酰化葡萄糖苷247.01±4.73c198.28±4.92b160.44±5.92a166.47±11.45a13二基花翠素 3-O-顺式香豆酰化葡萄糖苷99.13±0.91c62.20±0.74b48.71±1.12a48.70±1.86a14甲基花翠素 3-O-反式香豆酰化葡萄糖苷289.09±4.84a323.30±6.74b289.25±3.63a297.22±11.93ab15二甲花翠素 3-O-反式香豆酰化葡萄糖苷3 785.23±28.64c3 166.11±50.99b2 764.46±45.00a2 952.84±108.92ab
从B环结构来看,二甲花翠素类花色苷占总花色苷的比例最高,约占总量的81.37%~82.79%,花青素类花色苷占总花色苷的比例最低,约占总量的0.69%~0.91%。从C环取代形式来看,基本花色苷比例最大,占总量的48.66%~50.38%,其次为乙酰化葡萄糖苷、香豆酰化葡萄糖苷、咖啡酰化葡萄糖苷。FIGUEIREDO-GONZ LEZ等[27]研究了‘Garnacha Tintorera’葡萄在干化期间花色苷的变化,发现二甲花翠素类和花青素类花色苷分别是含量最高和最低的花色苷。
LEZ等[27]研究了‘Garnacha Tintorera’葡萄在干化期间花色苷的变化,发现二甲花翠素类和花青素类花色苷分别是含量最高和最低的花色苷。
新鲜‘马瑟兰’葡萄皮花色苷总量为(19 215.75±2.69)μg/g,G1、G2和G3的花色苷总量分别比CK低14.70%、32.67%和35.27%。与CK相比,G3中除花青素-3-O-乙酰化葡萄糖苷、花翠素-3-O-反式香豆酰化葡萄糖苷、甲基花翠素-3-O-反式香豆酰化葡萄糖苷之外的单体花色苷含量都显著下降(P<0.05)。MENCARELLI等[28]研究了干化处理对‘Aleatico’葡萄花色苷含量的影响,发现葡萄至干化结束时(失水40%)花色苷总量分别降低了4.71%、21.18%和60.71%。在正常的细胞中,花色苷等酚类物质与多酚氧化酶、过氧化物酶等氧化酶类位于不同的区域。干化处理诱导葡萄细胞壁代谢相关基因的表达,引起表皮细胞壁解体,氧气也更容易进入细胞中。因此,干化有可能促进了葡萄细胞中花色苷的酶促氧化[4]。另一方面,干化过程中,可观察到果肉被染成红色。因此,果皮花色苷向果肉扩散也是引起果皮花色苷含量降低的原因之一[27]。
花色苷衍生物比单体花色苷更能抵抗SO2的漂白,在葡萄酒中的颜色稳定性更强[8]。干化过程中,‘马瑟兰’葡萄中花色苷衍生物的含量不断上升,至干化结束时上升了36.23%。葡萄干化过程中,伴随有细胞破裂和氧化反应的发生,单体花色苷与其他化合物反应,从而导致了花色苷衍生物含量上升[9]。干化期间花色苷含量的动态变化是由其合成、降解、聚合等各种反应决定的[8]。
续表3

编号花色苷名称花色苷含量CKG1G2G3咖啡酰化花色苷16甲基花青素 3-O-咖啡酰化葡萄糖苷51.70±0.08c48.99±0.34bc40.80±0.16a46.01±1.63b17二甲花翠素 3-O-咖啡酰化葡萄糖苷484.76±5.66c371.04±8.45b268.25±3.52a340.51±15.32b花色苷衍生物18花色苷衍生物1177.22±0.55a214.65±11.37ab237.46±12.85b250.53±16.46b19花色苷衍生物247.81±1.69a52.42±0.95a55.44±3.43a56.04±4.35a基本花色苷总量9 635.08±35.67d8 258.30±24.45c6 296.43±26.50a7 041.39±89.90b乙酰化花色苷总量4 374.81±8.65d3 672.69±6.94c2 754.61±0.09a2 982.62±91.44b香豆酰化花色苷总量4 444.39±39.01c3 773.78±62.15b3 285.88±55.88a3 488.82±134.84ab咖啡酰化花色苷总量536.46±5.74a420.03±8.79b309.05±3.36a386.52±16.95b花色苷衍生物总量225.03±2.25a267.06±12.33ab292.90±16.28c306.56±20.81c总量19 215.75±2.69d16 391.87±100.78c12 938.86±49.12a14 205.92±353.94b
2.4 干化处理对‘马瑟兰’葡萄皮和籽缩合单宁组分的影响
如表4所示,‘马瑟兰’葡萄皮缩合单宁的末端亚基有儿茶素(catechin,C)和表儿茶素(epicatechin,EC)2种,延伸亚基有4种类型:C、EC、表棓儿茶素(epigallocatechin, EGC)及表儿茶素没食子酸酯(epicatechin gallate, ECG)。与葡萄皮不同,‘马瑟兰’葡萄籽缩合单宁亚基不含有EGC,末端亚基除C和EC外,还包括ECG。葡萄皮和籽缩合单宁相对含量最高的延伸亚基都为EC。
由表4可知, G3葡萄皮C延伸亚基、EGC延伸亚基和ECG延伸亚基的比例显著低于CK(P<0.05),G3葡萄籽ECG延伸亚基的比例显著高于CK(P<0.05),其他组分CK与G3间没有显著性差异(P>0.05)。FIGUEIREDO-GONZ LEZ等[27]对‘Garnacha Tintorera’葡萄的研究发现,末端亚基中C的比例最高(53%~61%),EC(36%~42%)和ECG(1.3%~2.5%)次之。在延伸亚基中,EC的比例(63%~70%)最高,随后是EGC(22%~27%)、C(6.5%~8.3%)和ECG(1.3%~2.5%)。
LEZ等[27]对‘Garnacha Tintorera’葡萄的研究发现,末端亚基中C的比例最高(53%~61%),EC(36%~42%)和ECG(1.3%~2.5%)次之。在延伸亚基中,EC的比例(63%~70%)最高,随后是EGC(22%~27%)、C(6.5%~8.3%)和ECG(1.3%~2.5%)。
缩合单宁的平均聚合度(mean degree of polymerization,mDP)和没食子酰化程度会影响涩感的质量属性。对模拟酒的研究发现,mDP 和没食子酰化程度增加会增强缩合单宁的粗糙感和褶皱感[29]。如表4所示,干化处理对‘马瑟兰’葡萄皮和籽的mDP没有显著影响(P>0.05)。与CK相比,G3葡萄皮的没食子酰化程度显著下降(P<0.05),而干化处理对G3葡萄籽没食子酰化程度没有显著影响(P>0.05)。对‘黑比诺’和‘Garnacha Tintorera’葡萄的研究都观察到干化过程中缩合单宁mDP下降[27, 30]。总之,干化处理对‘马瑟兰’葡萄皮缩合单宁的影响程度高于葡萄籽,有助于改善马瑟兰葡萄酒的涩感质量。
表4 干化处理对‘马瑟兰’葡萄缩合单宁组分的影响
Table 4 Effect of postharvest dehydration on the
condensed tannins fractions of‘Marselan’ grapes

类别指标CKG1G2G3tC/%60.88±2.16a63.45±1.59a62.92±5.74a68.55±4.74atEC/%4.41±0.22a4.97±0.05b4.55±0.02ab4.38±0.30aextC/%2.32±0.07c1.43±0.16b1.03±0.16a0.85±0.14a葡萄皮extEC/%29.96±2.84a28.06±1.82a29.93±5.39a25.22±4.45aextEGC/%0.74±0.14b0.22±0.03a0.15±0.00a0.08±0.00aextECG/%2.43±0.52b2.10±0.25ab1.57±0.17ab1.00±0.13amDP1.53±0.05a1.46±0.03a1.49±0.13a1.37±0.08aG/%2.43±0.52b2.10±0.25ab1.57±0.17ab1.00±0.13atC/%16.67±1.86a22.16±2.09b20.98±1.28b19.66±0.39abtEC/%23.31±1.39b18.25±3.50ab17.48±1.31a18.31±0.86abtECG/%7.17±0.45a7.39±0.27a7.43±0.50a7.05±0.69a葡萄籽extC/%6.50±0.12a6.73±0.64a7.27±0.25a7.36±0.17aextEC/%37.25±1.49a35.10±0.75a36.54±2.01a37.08±0.29aextECG/%9.10±0.36a10.36±0.12b10.30±0.42b10.54±0.39bmDP2.12±0.07a2.09±0.06a2.18±0.08a2.22±0.03aG/%16.27±0.77a17.76±0.19a17.73±0.66a17.59±1.09a
注:tC,儿茶素末端亚基;tEC,表儿茶素末端亚基;tECG,表儿茶素没食子酸酯末端亚基;extC,儿茶素延伸亚基;extEC,表儿茶素延伸亚基;extEGC,表棓儿茶素延伸亚基;extECG,表儿茶素没食子酸酯延伸亚基;mDP,平均聚合度;G,没食子酰化
3 结论
‘马瑟兰’葡萄采收后进行27 d的干化处理,果实的还原糖、酒石酸和柠檬酸含量显著提高(P<0.05)。单体花色苷含量显著降低(P<0.05),颜色稳定的花色苷衍生物含量增加了36.23%,葡萄果皮缩合单宁的没食子酰化程度显著下降(P<0.05)。干化处理提高了‘马瑟兰’葡萄的还原糖、有机酸、聚合花色苷含量和单宁品质,本研究为干化技术的应用和干化葡萄酒的酿造提供了理论依据。
[1] MARQUEZ A, PEREZ-SERRATOSA M,VARO M A, et al.Effect of temperature on the anthocyanin extraction and color evolution during controlled dehydration of tempranillo grapes[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7 897-7 902.
[2] CONSTANTINOU S, G MEZ-CARAVACA A M, GOULAS V, et al.Metabolic fingerprinting of must obtained from sun-dried grapes of two indigenous Cypriot cultivars destined for the production of “Commandaria”:A protected destignation of origin product[J].Food Research International, 2017, 100:469-476.
MEZ-CARAVACA A M, GOULAS V, et al.Metabolic fingerprinting of must obtained from sun-dried grapes of two indigenous Cypriot cultivars destined for the production of “Commandaria”:A protected destignation of origin product[J].Food Research International, 2017, 100:469-476.
[3] REBOREDO-RODR GUEZ P, GONZ
GUEZ P, GONZ LEZ-BARREIRO C, RIAL-OTERO R, et al.Effects of sugar concentration processes in grapes and wine aging on aroma compounds of sweet wines—A review[J].Critical Reviews in Food Science and Nutrition, 2015, 55(8):1 053-1 073.
LEZ-BARREIRO C, RIAL-OTERO R, et al.Effects of sugar concentration processes in grapes and wine aging on aroma compounds of sweet wines—A review[J].Critical Reviews in Food Science and Nutrition, 2015, 55(8):1 053-1 073.
[4] FASOLI M, DELL′ ANNA R, AMATO A, et al.Active rearrangements in the cell wall follow polymer concentration during postharvest withering in the berry skin of Vitis vinifera cv. Corvina[J].Plant Physiology and Biochemistry, 2019, 135:411-422.
[5] TORCHIO F, URCAN D E, LIN L, et al.Influence of different withering conditions on phenolic composition of Avanà, Chatus and Nebbiolo grapes for the production of ‘Reinforced’ wines[J].Food Chemistry, 2016, 194:247-256.
[6] COSTANTINI V, BELLINCONTRO A, DE SANTIS D, et al.Metabolic changes of Malvasia grapes for wine production during postharvest drying[J].Journal of Agricultural and Food Chemistry, 2006, 54(9):3 334-3 340.
[7] 韩富亮, 李杨, 李记明, 等.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报, 2011, 30(3):328-336.
HAN F L, LI Y, LI J M, et al.Relation between anthocyanin structures and color in red wine:A review[J].Journal of Food Science and Biotechnology, 2011, 30(3):328-336.
[8] WATERHOUSE A L, SACKS G L, JEFFERY D W.Understanding wine chemistry[M].New York:John Wiley & Sons, 2016:131-139.
[9] MARQUEZ A, DUE AS M, SERRATOSA M P, et al.Formation of vitisins and anthocyanin-flavanol adducts during red grape drying[J].Journal of Agricultural and Food Chemistry, 2012, 60(27):6 866-6 874.
AS M, SERRATOSA M P, et al.Formation of vitisins and anthocyanin-flavanol adducts during red grape drying[J].Journal of Agricultural and Food Chemistry, 2012, 60(27):6 866-6 874.
[10] WATERHOUSE A L, SACKS G L, JEFFERY D W.Understanding Wine Chemistry[M].New York:John Wiley & Sons, 2016.
[11] DE ROSSO M, SOLIGO S, PANIGHEL A, et al.Changes in grape polyphenols (V.vinifera L.) as a consequence of post-harvest withering by high-resolution mass spectrometry:Raboso Piave versus Corvina[J].Journal of Mass Spectrometry, 2016, 51(9):750-760.
[12] LYU J H, MA Y, XU Y, et al.Characterization of the key aroma compounds in Marselan wine by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission tests[J].Molecules, 2019, 24(16):E2978.
[13] 付丽霞, 张惠玲, 齐晓琴, 等.干化葡萄酒品质的比较及挥发性成分的GC-MS分析[J].中国酿造, 2017, 36(2):166-170.
FU L X, ZHANG H L, QI X Q, et al.Comparison of quality and volatile components of dried grape wine analysis by GC-MS[J].China Brewing, 2017, 36(2):166-170.
[14] 许晓鼎, 焦荣海, 韩国民, 等.风干工艺对烟台产区红葡萄酒质量影响的研究[J].酿酒科技, 2019(5):38-43.
XU X D, JIAO R H, HAN G M, et al.Effects of air drying process on the quality of red wine made in Yantai[J].Liquor-Making Science & Technology, 2019(5):38-43.
[15] 王琳, 赵裴, 刘洋, 等.干化处理对霞多丽葡萄酒质量的影响[J].食品与发酵工业, 2020, 46(7):83-88.
WANG L, ZHAO P, LIU Y, et al.The effect of dehydration treatment on Chardonnay wine[J].Food and Fermentation Industries, 2020, 46(7):83-88.
[16] 中华人民共和国国家质量监督检验检疫总局. GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社, 2006.
Administration of Quality Supervision, Inspection and Quarantine.GB/T 15038—2006 Analytical methods of wine and fruit wine[S].Beijing:Standards Press of China, 2006.
[17] 成冰,张京芳,徐洪宇,等.不同品种酿酒葡萄有机酸含量分析[J].食品科学, 2013, 34(12):223-228.
CHENG B, ZHANG J F, XU H Y, et al.Analysis of organic acid contents in wine grape from different cultivars[J].Food Science, 2013, 34(12):223-228.
[18] 岳泰新. 不同生态区酿酒葡萄与葡萄酒品质的研究[D].杨凌:西北农林科技大学, 2015.
YUE T X.Study on wine grape and wine quality from different ecological regions[D].Yangling:Northwest A&F University, 2015.
[19] YANG P, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from cabernet sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules, 2018, 23(2):354.
[20] ZHAO X, ZHANG S S, ZHANG X K, et al.An effective method for the semi-preparative isolation of high-purity anthocyanin monomers from grape pomace[J].Food Chemistry, 2020, 310:125 830.
[21] BUSSE-VALVERDE N, G MEZ-PLAZA E, L
MEZ-PLAZA E, L PEZ-ROCA J M, et al.Effect of different enological practices on skin and seed proanthocyanidins in three varietal wines[J].Journal of Agricultural and Food Chemistry, 2010, 58(21):11 333-11 339.
PEZ-ROCA J M, et al.Effect of different enological practices on skin and seed proanthocyanidins in three varietal wines[J].Journal of Agricultural and Food Chemistry, 2010, 58(21):11 333-11 339.
[22] KENNEDY J A, JONES G P.Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence of excess phloroglucinol[J].Journal of Agriculture and Food Chemistry, 2001, 49(4):1 740-1 746.
[23] BELLINCONTRO A, DE SANTIS D, BOTONDI R, et al.Different postharvest dehydration rates affect quality characteristics and volatile compounds of Malvasia, Trebbiano and Sangiovese grapes for wine production[J].Journal of the Science of Food and Agriculture, 2004, 84(13):1 791-1 800.
[24] PANCERI C P, DE GOIS J S, BORGES D L G, et al.Effect of grape dehydration under controlled conditions on chemical composition and sensory characteristics of Cabernet Sauvignon and Merlot wines[J].LWT - Food Science and Technology, 2015, 63(1):228-235.
[25] 王西成, 钱亚明, 吴伟民, 等.6-BA对葡萄果实中有机酸积累及相关基因表达的影响[J].华北农学报, 2017, 32(5):149-153.
WANG X C, QIAN Y M, WU W M, et al.Effect of 6-BA on organic acid content and related genes expression in grape berry[J].Acta Agriculturae Boreali-Sinica, 2017, 32(5):149-153.
[26] FOWLES G W A.Acids in grapes and wines:A review[J].Journal of Wine Research, 1992, 3(1):25-41.
[27] FIGUEIREDO-GONZ LEZ M, CANCHO-GRANDE B, SIMAL-G
LEZ M, CANCHO-GRANDE B, SIMAL-G NDARA J. Evolution of colour and phenolic compounds during Garnacha Tintorera grape raisining[J].Food Chemistry, 2013, 141(3):3 230-3 240.
NDARA J. Evolution of colour and phenolic compounds during Garnacha Tintorera grape raisining[J].Food Chemistry, 2013, 141(3):3 230-3 240.
[28] MENCARELLI F, BELLINCONTRO A, NICOLETTI I, et al.Chemical and biochemical change of healthy phenolic fractions in winegrape by means of postharvest dehydration[J].Journal of Agricultural and Food Chemistry, 2010, 58(13):7 557-7 564.
[29] VIDAL S, FRANCIS L, GUYOT S, et al.The mouth-feel properties of grape and apple proanthocyanidins in a wine-like medium[J].Journal of the Science of Food and Agriculture, 2003, 83(6):564-573.
[30] MORENO J J, CERPA-CALDER N F, COHEN S D, et al.Effect of postharvest dehydration on the composition of pinot noir grapes (Vitis vinifera L.) and wine[J].Food Chemistry, 2008, 109(4):755-762.
N F, COHEN S D, et al.Effect of postharvest dehydration on the composition of pinot noir grapes (Vitis vinifera L.) and wine[J].Food Chemistry, 2008, 109(4):755-762.