川陈皮素在柑橘类果皮中含量丰富且具有多种有益健康的生物学活性[1],如调节代谢紊乱[2]、抗炎[3-4]、抗癌[5-6]等。但因其熔点高(大于150 ℃)、疏水性高、水溶性差(小于100 μg/mL)[7],导致生物可及性低。因而人体难以对川陈皮素进行有效的吸收和利用,很大程度上限制了其生物活性的发挥和产业化应用。而利用纳米乳液将脂溶性营养素如β-胡萝卜素[8]、番茄红素[9]、维生素D3[10]等进行包埋,可有效提高其生物可及性[11]。
功能性油脂是一类对人体有特殊生理作用的油脂,其主要活性成分包括多不饱和脂肪酸、磷脂、脂溶性维生素等其他脂溶性成分[12]。近年来,随着生活水平的提高,人们对营养健康愈发重视。因此,以功能性油脂作为载体的饮料、乳液等复合型食品和保健品有着广阔的发展空间[13]。选用功能性油脂制备纳米乳液递送系统,不仅可在一定程度上提高装载物的吸收利用,增强其体内生物学功能,还能丰富食品和保健品的形式。
本研究选用紫苏籽油(C18∶3)、火麻仁油(C18∶2)和山茶油(C18∶1)3种功能性油脂为主要载体,利用高能量法制备了川陈皮素纳米乳液,并系统探究了其体外消化特性,以期获得基于功能性油脂的提高川陈皮素生物可及性的递送系统。
1 材料与方法
1.1 材料与设备
紫苏籽油、火麻仁油、山茶油、川陈皮素(纯度95%),由课题组实验室提供;黏蛋白、脂肪酶、胆盐,上海源叶生物科技有限公司;低温连续相变流体萃取装置,珠海共同机械有限公司;6YZ-180型液压压榨机,郑州八方机械设备有限公司;Mastersizer 3000激光粒度分布仪,英国Malvern公司;Zatasizer Nano ZS 90纳米粒度及Zeta电位分析仪,英国Malvern公司;TCS SP8激光共聚焦显微镜,德国LEICA公司。
1.2 实验方法
1.2.1 功能性油脂的制备
1.2.1.1 山茶油
将干燥油茶籽清理除杂后粉碎至一定粒度,把粉碎后的油茶籽粉装进萃取装置的20 L萃取釜中,在原料堆密度0.6 kg/L,萃取温度50 ℃,解析温度70 ℃,萃取压力0.6~0.7 MPa,萃取时间60 min的条件下进行低温连续相变萃取[14],获得山茶油。
1.2.1.2 火麻仁油、紫苏籽油
将清理后的原料分别投入压榨机中,工艺参数设置为:压力 40~50 MPa,提取时间30 min,出油温度32 ℃,压榨过滤后获得火麻仁油和紫苏籽油。
1.2.2 川陈皮素纳米乳液制备
1.2.2.1 油相制备
室温下将50 mg川陈皮素加入到25 g的油中,超声2~3 h,待川陈皮素完全溶解以制得乳液油相。
1.2.2.2 乳化剂比例
分别称取2、4、6、8、10 g的乳化剂(吐温80)和相应质量的超纯水于烧杯中,使水相总质量为75 g。加热搅拌至乳化剂完全溶解以制得乳液水相。将上述水相和油相混合,先以10 000 r/min高速均质10 min,再以100 MPa高压均质7次。3种不同功能性油脂均按此法制备纳米乳液,测定乳液的平均粒径。
1.2.3 体外消化
参考SUN等[15]配备模拟消化液备用。人工唾液的配制配方如表1所示,其中尿酸钠和乳酸钠提前一夜搅拌,总体积为1 L。
表1 体外消化模型中人工唾液的化学成分
Table 1 Chemical composition of artificial saliva
used in the in vitro digestion model
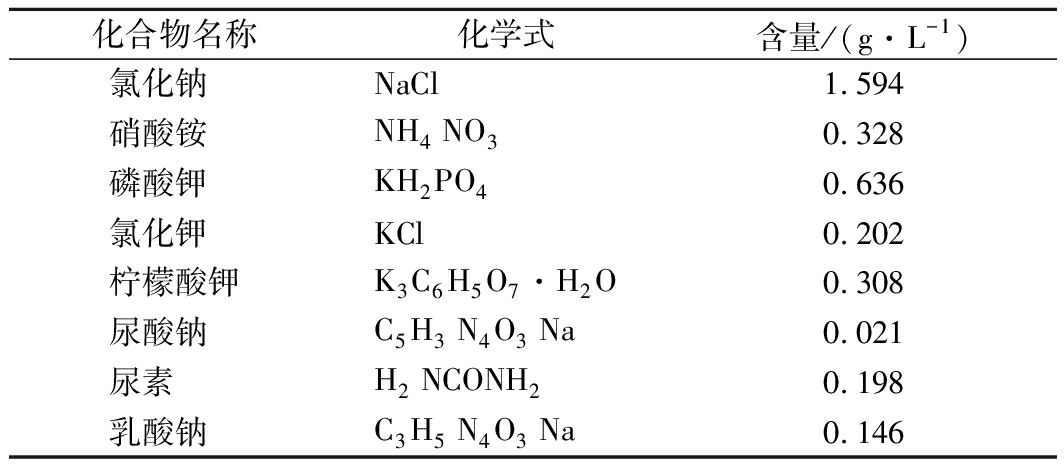
化合物名称化学式含量/(g·L-1)氯化钠 NaCl1.594硝酸铵 NH4 NO30.328磷酸钾 KH2PO40.636氯化钾 KCl0.202柠檬酸钾K3C6H5O7·H2O0.308尿酸钠 C5H3 N4O3 Na0.021尿素 H2 NCONH20.198乳酸钠 C3H5 N4O3 Na0.146
人工胃液由2 g氯化钠和7 mL盐酸溶于总体积为1 L的水中制得,然后调节pH值至1.2。人工小肠液由0.5 mol CaCl2·2H2O和5.6 mol NaCl溶于总体积为500 mL的水中制得。
取1.2.2.2 实验中所得最优川陈皮素纳米乳液进行体外消化模拟。
1.2.3.1 口腔阶段
取4 mL乳液加超纯水至20 mL,并加入20 mL人工唾液,调节pH至6.8,在37 ℃条件下100 r/min振荡10 min。
1.2.3.2 胃阶段
取上一步所得的口腔消化液20 mL,并加入20 mL人工胃液,调节pH至2.5,在37 ℃条件下100 r/min振荡2 h。
1.2.3.3 小肠阶段
分别将187.5 mg胆盐加入到3.5 mL 磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)中,60 mg脂肪酶加入到2.5 mL PBS中,搅拌制备成悬浊液备用。取30 mL上述胃消化液,加入1.5 mL小肠液和胆盐,调节pH至7。在37 ℃的条件下,向消化液中加入脂肪酶,并逐滴加 0.2 mol/L NaOH维持pH为7,滴定过程持续 2 h,记录下NaOH溶液的体积。
1.2.4 脂肪酸释放率测定
在模拟小肠消化的过程中,脂肪在脂肪酶的作用下,释放游离脂肪酸,使体系的pH不断下降。使用NaOH对游离脂肪酸进行中和,通过NaOH的消耗体积即可计算出游离脂肪酸的释放率,计算如公式(1)所示:
游离脂肪酸释放率![]()
(1)
式中:CNaOH为用于中和游离脂肪酸的NaOH浓度,mol/L;VNaOH为用于中和游离脂肪酸的NaOH所用体积,L;M油为油脂的平均分子质量,g/mol;m油为油脂的质量,g。
1.2.5 生物可及性测定
生物可及性是指胶束中所含川陈皮素与原有纳米乳液中所含的川陈皮素的比值。胶束由游离脂肪酸、甘油一酯和胆盐、磷脂组成,可溶解脂溶性营养素。生物可及性的计算如公式(2)所示:
生物可及性![]()
(2)
式中:C胶束中川陈皮素为胶束中川陈皮素的浓度,mol/L;C纳米乳液中川陈皮素为原有纳米乳液中川陈皮素的浓度,mol/L。
取1 mL所得小肠消化液于离心管中,25 ℃、15 000 r/min离心50 min。离心后的中层清液为胶束层。取200 μL胶束,加入2倍体积的乙酸乙酯,漩涡振荡30 s,以 25 ℃、1 170×g离心6 min。共萃取2次,合并2次清液。45 ℃蒸干乙酸乙酯后,加入200 μL甲醇溶解。待测液过膜,加入到内插管中,使用高效液相仪进行测量。
1.2.6 粒径分布变化测量
利用激光粒度分布仪分别测定原液和消化过程中所得的口腔、胃、小肠消化液的粒径分布。口腔、小肠消化液使用PBS做分散介质,胃消化液使用酸化水做分散介质。
1.2.7 平均粒径及电位变化测量
利用纳米粒度及Zeta电位分析仪测定原液、胶束及口腔、胃、小肠消化液的平均粒径和电位。原液用一级水稀释400倍,口腔、小肠消化液及胶束用PBS(pH 7)稀释400倍,胃消化液用酸化水(pH 2.5)稀释400倍,再取适量稀释待测液至比色皿中进行测定。
1.2.8 微观结构观察
利用激光共聚焦显微镜观察原液、口腔、胃、小肠消化液的微观结构。观察前,向原始纳米乳液和消化过程中的口腔、胃、小肠消化液加入10 μL尼罗红溶液进行染色,采用63倍的滴油物镜进行观察。所有图像均用仪器软件程序拍摄和处理。
1.2.9 数据处理
每组实验重复3次,各指标重复测定3次,实验结果以平均值±标准偏差表示。使用SPSS Statistics 24进行数据分析,用OriginPro 9.1软件作图。
2 结果与分析
2.1 乳化剂质量分数对乳液粒径的影响
吐温80是一种亲水型非离子表面活性剂,易形成水包油型纳米乳液,且毒性低、价格低廉,常被作为乳化剂、分散剂、浑浊剂等应用于食品中[16],因此本实验选取吐温80作为乳化剂。如图1和图2所示,乳化剂质量分数从2% 增加到10% 时,乳液的颗粒直径呈下降趋势。当乳化剂的质量分数为 4% 时,3种乳液的颗粒直径均小于 200 nm,符合纳米乳液粒径要求(直径小于200 nm)[17],且乳化剂用量较小,因此本实验选取的乳化剂质量分数为4%。制备得到的3种基于功能性油脂的川陈皮素纳米乳液,乳液外观均呈乳白色流体,质地均一、细腻,无特殊气味。

a-紫苏籽油组;b-火麻仁油组;c-山茶油组
图1 粒径分布测定原始谱图
Fig.1 Original spectra of particle size
distribution determination

图2 不同乳化剂比例对乳液平均粒径的影响
Fig.2 Effect of emulsifier ratio on the average
particle size of emulsion
2.2 消化过程中的乳液粒径与结构变化
由图3所示,3种乳液的原液、口腔消化阶段以及胃消化阶段的粒径分布较一致,但是在口腔和胃阶段,乳液出现轻微聚集。在小肠阶段,由于胆盐和胰脂肪酶的加入,纳米乳液中的油脂被消化,从而导致乳液结构均被破坏,出现大规模聚集[15]。小肠粒径分布均呈现双峰态或多峰态,这可能是由于体系中存在不同类型的颗粒物质,如不溶性钙盐、蛋白质等[18]。3种乳液在粒径为0.1~1 μm和10~100 μm范围内,均出现明显的峰,表明乳液发生聚集,形成了粒径较大的颗粒。其中在0.1~1 μm,相对密度从高到低为紫苏籽油>火麻仁油>山茶油,而在10~100 μm,相对密度从高到低为山茶油>火麻仁油>紫苏籽油。3种乳液在小肠消化阶段的粒径分布的差异,可能是由于乳液的破坏程度存在差别。
而由图4可以直观看出,在口腔和胃消化阶段,3种乳液的液滴都出现轻微聚集,这与粒径分布的结果一致。在小肠消化阶段可以看到,山茶油乳液的油滴粒径最小、只发生了轻微聚集现象;而紫苏籽油乳液的油滴粒径最大、并且大规模聚集;火麻仁油乳液的油滴大小和聚集程度处于前两者之间。

图4 三种纳米乳液消化过程的微观结构变化
Fig.4 Microstructural changes in the digestion
process of three nano emulsions
粒径分布和微观结构图中的结果均表明,3种纳米乳液的消化过程基本一致。但在小肠消化阶段,3种乳液的油滴粒径大小存在明显差异,最大为紫苏籽油,其次为火麻仁油,最小为山茶油,3种纳米乳液的油滴大小和聚集情况的差异,可能是由于3种油的消化程度存在差别而导致的[8]。

a-紫苏籽油组;b-火麻仁油组;c-山茶油组
图3 三种纳米乳液消化过程的粒径分布变化
Fig.3 Particle size distribution in the digestion process of three nanoemulsions
2.3 消化过程电位变化
由图5可知,3种乳液在消化的过程中,电位绝对值均呈现先下降后上升的趋势。具体来说,乳液进入口腔消化阶段时,离子环境的改变引发了静电屏蔽效应[10,19],导致电位绝对值下降;在胃消化阶段,乳液的电位绝对值均出现大幅度下降,其原因可能有:模拟胃液的pH值低、粒子浓度高[20],乳液表面的阴离子被胃液中的阳离子中和[21];而在小肠消化阶段,由于胆盐的加入和油脂分解产生的游离脂肪酸,使电位绝对值上升[8,22]。这3种乳液中,基于山茶油制备的乳液的电位绝对值最高,其次为火麻仁油,而紫苏籽油的电位绝对值最小。由于电位绝对值越小,液滴越容易趋向于聚集。因此,这部分结果有助于解释图4中小肠消化阶段所观察到的实验现象,即电位绝对值最小的紫苏籽油纳米乳液经消化后的液滴最大,而电位绝对值最大的山茶油纳米乳液经消化后的液滴则最小。

图5 三种纳米乳液消化过程的电位变化
Fig.5 Potential changes in the digestion process of
three nanoemulsions
2.4 脂肪酸释放率
如图6所示,3种油脂在小肠阶段的消化速率均呈先快后慢的趋势。消化的前10 min,紫苏籽油和火麻仁油的消化速率无明显差异,山茶油的消化速率最快。脂肪酸释放率越高,脂肪的消化程度越大。因此在消化程度方面,最大的是山茶油[(93.7±1.4)%],其次为火麻仁油[(83.0±1.8)%],最小为紫苏籽油[(76.4±0.9)%],这与粒径分布、微观结构图的结果相一致。

图6 三种纳米乳液小肠消化过程的脂肪酸释放率
Fig.6 Fatty acid release rate in the digestion of three
nano emulsions
在小肠消化阶段,由于山茶油纳米乳液的液滴尺寸最小、比表面积最大,增大了液滴与脂肪酶之间的接触面积和反应机会[23],从而使山茶油的消化速率最快。另一方面,由于多不饱和脂肪酸存在空间位阻效应[24-25],因此相较于富含多不饱和脂肪酸的紫苏籽油和火麻仁油,富含单不饱和脂肪酸的山茶油具有更高的消化程度。
2.5 川陈皮素生物可及性
3种纳米乳液的川陈皮素生物可及性如图7所示,图中的不同字母代表生物可及性存在显著性差异(P<0.05)。
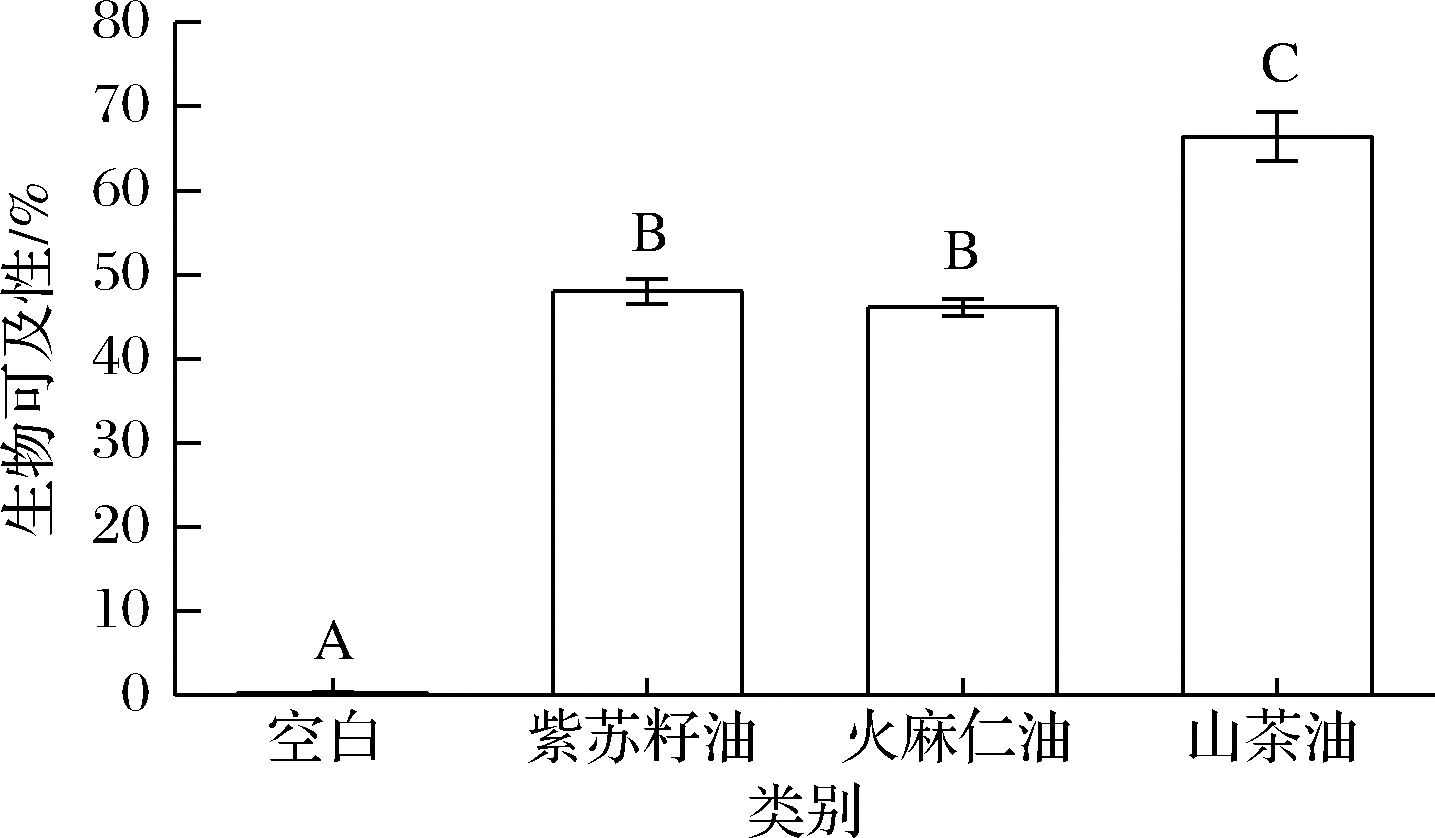
图7 三种纳米乳液的生物可及性
Fig.7 Bioaccessibility of three nanoemulsions
注:不同字母代表生物可及性存在显著性差异(P<0.05)
空白组的川陈皮素生物可及性仅为(0.3±0.1)%,而基于3种功能性油脂构建的纳米乳液,均显著提高了川陈皮素的生物可及性。其中,紫苏籽油纳米乳液为(48.0±1.5)%,火麻仁油纳米乳液为(46.0±1.0)%,山茶油纳米乳液(66.4±2.9)%。该结果表明,3种纳米乳液在经过消化过程后,川陈皮素有效溶解在胶束中[26],使川陈皮素的生物可及性显著提高。
值得关注的是,山茶油纳米乳液对川陈皮素生物可及性的提高效果显著优于紫苏籽油纳米乳液和火麻仁油纳米乳液,这可能是因为山茶油富含单不饱和脂肪酸,在消化过程中的空间位阻效应较小,消化程度更大,形成了更多的胶束来容纳川陈皮素[23],从而提升了其生物可及性。而对于同样是富含多不饱和脂肪酸的紫苏籽油和火麻仁油,虽然火麻仁油的消化程度高于紫苏籽油,但紫苏籽油纳米乳液的川陈皮素生物可及性却更高,这可能是由于紫苏籽油胶束和火麻仁油胶束对川陈皮素的溶解能力存在差异[15,20]。
3 结论
本研究证明了使用紫苏籽油、火麻仁油、山茶油包埋川陈皮素,并构建纳米乳液转运系统,可有效提高川陈皮素的生物可及性。其中,山茶油纳米乳液比紫苏籽油、火麻仁油能更有效地提高川陈皮素的生物可及性,这是由于山茶油的消化程度更大,形成了更多可容纳川陈皮素的胶束。在后续的研究中,可进一步通过细胞实验和动物实验,深入探究基于功能性油脂的纳米乳液对川陈皮素生物可及性和生物利用率的影响,为川陈皮素以及其他功能性化合物的产业化应用及丰富功能性食品的载体形式和种类提供理论与数据基础。
[1] LI S, PAN M, LO C,et al.Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones[J].Journal of Functional Foods, 2009, 1(1):2-12.
[2] WHITMAN S C, KUROWSKA E M, MANTHEY J A, et al.Nobiletin, a citrus flavonoid isolated from tangerines, selectively inhibits class A scavenger receptor-mediated metabolism of acetylated LDL by mouse macrophages[J].Atherosclerosis, 2005, 178(1):25-32.
[3] MURAKAMI A, NAKAMURA Y, OHTO Y, et al.Suppressive effects of citrus fruits on free radical generation and nobiletin, an anti-inflammatory polymethoxyflavonoid[J].Biofactors, 2000, 12(1-4):187-192.
[4] GUO S, QIU P, XU G, et al.Synergistic anti-inflammatory effects of nobiletin and sulforaphane in lipopolysaccharide-stimulated RAW 264.7 cells[J].Journal of Agricultural and Food Chemistry, 2012, 60(9):2 157-2 164.
[5] WU X, SONG M, WANG M, et al.Chemopreventive effects of nobiletin and its colonic metabolites on colon carcinogenesis[J].Molecular Nutrition & Food Research, 2015, 59(12):2 383-2 394.
[6] XIAO H, YANG C S, LI S, et al.Monodemethylated polymethoxyflavones from sweet orange (Citrus sinensis) peel inhibit growth of human lung cancer cells by apoptosis[J].Molecular Nutrition & Food Research, 2009, 53(3):398-406.
[7] LI Y, ZHENG J, XIAO H, et al.Nanoemulsion-based delivery systems for poorly water-soluble bioactive compounds:Influence of formulation parameters on polymethoxyflavone crystallization[J].Food Hydrocolloids, 2012, 27(2):517-528.
[8] SALVIA-TRUJILLO L, QIAN C, MART N-BELLOSO O, et al.Influence of particle size on lipid digestion and β-carotene bioaccessibility in emulsions and nanoemulsions[J].Food Chemistry, 2013, 141(2):1 472-1 480.
N-BELLOSO O, et al.Influence of particle size on lipid digestion and β-carotene bioaccessibility in emulsions and nanoemulsions[J].Food Chemistry, 2013, 141(2):1 472-1 480.
[9] 洪泽翰, 吴婉仪, 李璐, 等.不同大分子乳化剂构建番茄红素纳米乳液的体外消化规律比较[J].食品科学, 2019, 40(10):1-7.
HONG Z H, WU W Y, LI L, et al.Comparison of in vitro digestion of lycopene nanoemulsions stabilized with different macromolecular emulsifiers[J].Food Science, 2019, 40(10):1-7.
[10] OZTURK B, ARGIN S, OZILGEN M, et al.Nanoemulsion delivery systems for oil-soluble vitamins:Influence of carrier oil type on lipid digestion and vitamin D3 bioaccessibility[J].Food Chemistry,2015,187(15):499-506.
[11] 陈雨露, 孙婉秋, 高彦祥,等.食品运载体系提高酚类物质生物利用度的研究进展[J].食品科学, 2020, 41(5):323-330.
CHEN Y L, SUN W Q, GAO Y X,et al.Recent progress in food delivery systems for improving bioavailability ofphenolic compounds[J].Food Science, 2020, 41(5):323-330.
[12] 蒲凤琳, 孙伟峰, 车振明.功能性油脂研究与开发进展[J].粮食与油脂, 2016, 29(8):5-8.
PU F L, SUN W F, CHE Z M.Research and development progress of functional oils[J].Cereals & Oils, 2016, 29(8):5-8.
[13] 钟金锋, 覃小丽.功能性脂质纳米分散体研究进展[J].现代食品科技, 2014, 30(12):294-301.
ZHONG J F, QIN X L, Progress in functional lipid nanodispersion research[J].Modern Food Science & Technology,2014,30(12):294-301.
[14] 杜洁. 火麻仁油低温连续相变萃取、微囊包埋及质量评价研究[D].广州:华南农业大学, 2017.
DU J.Extraction and microcapsule of fructus cannabis iil by low-temperature continuous phase transition and study on the quality evaluation[D].Guangzhou:South China Agricultural University, 2017.
[15] SUN Y, XIA Z, ZHENG J, et al.Nanoemulsion-based delivery systems for nutraceuticals:Influence of carrier oil type on bioavailability of pterostilbene[J].Journal of Functional Foods, 2015, 13:61-70.
[16] 甘凌.负载植物甾醇纳米乳液的制备及其稳定性研究[D].杭州:浙江工业大学, 2019.
GAN L.Study on the preparation and stability of nanoemulsion loaded with phytosterol[D].Hangzhou:Zhejiang University of Technology, 2019.
[17] MCCLEMENTS D J.Edible nanoemulsions:Fabrication, properties, and functional performance[J].Soft Matter, 2011, 7(6):2 297-2 316.
[18] 伍文彬, 徐雨茜, 熊华, 等.钙盐和蛋白质配比对1,3-二油酸-2-棕榈酸甘油酯乳液体外消化的影响[J].食品科学, 2019, 40(16):17-24.
WU W B, XU Y X, XIONG H, et al.Influences of calcium salt and emulsifier composition on in vitro digestion properties of 1,3-dioleoyl-2-palmitoylglycerol emulsions[J].Food Science, 2019, 40(16):17-24.
[19] ZHANG R, ZHANG Z, ZOU L, et al.Impact of lipid content on the ability of excipient emulsions to increase carotenoid bioaccessibility from natural sources (raw and cooked carrots)[J].Food Biophysics, 2016, 11(1):71-80.
[20] LIU X, ZHANG R, MCCLEMENTS D J, et al.Nanoemulsion-based delivery systems for nutraceuticals:Influence of long-chain triglyceride (LCT) type on in vitro digestion and astaxanthin bioaccessibility[J].Food Biophysics, 2018, 13:412-421.
[21] SINGH H, YE A, HORNE D.Structuring food emulsions in the gastrointestinal tract to modify lipid digestion[J].Progress in Lipid Research, 2009, 48(2):92-100.
[22] 周欣慧. 基于乳清蛋白运载的β-胡萝卜素纳米乳液的制备及生物利用率的研究[D].长春:吉林大学, 2018.
ZHOU X H.Based on the delivery of whey protein to produce the β-carotene nanoemulsion and improve the bioavailability of β-cartene[D].Changchun:Jilin University, 2018.
[23] 刘涵, 袁曦, 刘晓娟, 等.赋形剂乳液粒径和油脂链长对橘子中β-胡萝卜素的物化特性及生物可给性的影响[J].食品工业科技, 2019, 40(13):14-22.
LIU H, YUAN X, LIU X J, et al.Effects of different particle size and different chain length lipids of excipient emulsions on physicochemical properties and bioaccessibility of β-carotene in orange[J].Science and Technology of Food Industry, 2019, 40(13):14-22.
[24] VERKEMPINCK S H E, SALVIA-TRUJILLO L, MOENS L G, et al.Kinetic approach to study the relation between in vitro lipid digestion and carotenoid bioaccessibility in emulsions with different oil unsaturation degree[J].Journal of Functional Foods, 2018, 41:135-147.
[25] 朱巧莎, 侯占群, 段盛林, 等.影响WPI-CMC油乳液体外消化因素探究[J].食品与发酵工业, 2020, 46(12): 21-28.
ZHU Q S, HOU Z Q, DUAN S L, et al.Exploration of factors affecting the in vitro digestion of WPI-CMC oil emulsion[J].Food and Fermentation Industries, 2020, 46(12): 21-28.
[26] QIAN C, DECKER E A, XIAO H, et al.Nanoemulsion delivery systems:Influence of carrier oil on β-carotene bioaccessibility[J].Food Chemistry, 2012, 135(3):1 440-1 447.