玉米纤维是玉米干法和湿法碾磨后的残渣。玉米纤维含有40%半纤维素、20%的纤维素、4%的酚酸和2%的蛋白质,其中半纤维素是其主要组分[1]。目前,我国玉米纤维主要用于作为低蛋白动物饲料,没有对其进一步加工利用,造成了资源的浪费。禾本科植物的半纤维素主要是阿拉伯糖木聚糖,玉米阿拉伯木聚糖(corn arabinoxylan,CAX)存在于谷类作物胚乳周围的麸皮和糊粉层细胞壁以及胚乳细胞壁中[2]。阿拉伯木聚糖以(1→4)-β-D-吡喃木糖残基聚合为线型主链,α-L-呋喃阿拉伯糖基(arabinoxylan,Ara)为侧链[3],此外,还含有少量的半乳糖、葡萄糖醛酸和甘露糖[1]。同时,阿拉伯木聚糖含有一定量的阿魏酸基团,以酯键的形式连接于Ara侧链的C(O)-5位上[4]。阿拉伯木聚糖作为一种高相对分子质量的结构性多糖,具有氧化交联性质[5]、乳化及乳化稳定性[6]、成膜性等性质[7],具有广泛的应用前景。壳聚糖(chitosan,CH)是自然界中一种大量存在的聚阳离子多糖[8]。由于CH具有良好的成膜性、抑菌作用,以及无毒、生物相容性和可生物降解等优点,可广泛应用于医药、食品、化妆品、农业、环保和纺织等领域[9]。
水凝胶是由三维网络结构的亲水聚合物构成。水凝胶根据交联方式可分为化学交联水凝胶和物理交联水凝胶两大类。化学交联水凝胶因制备过程中需要加入引发剂、交联剂等,而大多试剂具有一定的细胞毒性,不适于在生物细胞或组织中应用。物理交联水凝胶主要由氢键、静电作用、配位键、疏水结合、范德华力、物理缠绕等分子间可逆的非共价作用力形成交联,通常形成微晶、螺旋、离子配位、胶束等交联区域,可避免由于化学试剂使用带来的不利影响[10]。用于制备水凝胶的天然生物高分子包括明胶、透明质酸、海藻酸盐、半纤维素、CH、黄原胶等[11]。基于天然高分子多糖水凝胶以其良好的吸水能力、刺激响应能力和良好的生物相容性、天然可降解性以及丰富的来源等特点,在生物和生物医学领域应用引起了广泛的关注,拓宽了多糖的应用领域[12]。
CH分子中含有大量游离的氨基、羟基,可通过氢键或静电力与海藻酸钠、果胶、纤维素,以及半纤维素的相互作用形成具有一定机械强度、弹性和通透性能的聚电解质复合材料。半纤维素和CH能通过非共价作用力合成水凝胶。GABRIELII等[13]首先以桦木得到具有葡萄糖醛酸功能的木聚糖为原料,在酸性条件下与CH共溶,形成水凝胶。红外光谱法研究表明,CH的氨基与木聚糖的葡萄糖醛酸官能团的络合作用是形成网状结构的主要原因。研究发现水凝胶溶胀行为对pH值和盐溶液的刺激的反应是可逆的。之后GABRIELII等[14]对杨木木聚糖与CH共混成凝胶膜进行研究发现当CH含量达到5%~20%(质量分数)时,即得到完整的薄膜,且薄膜在水中浸泡后可得到水凝胶。将杨木木聚糖与CH混合,通过木聚糖的酸性基团和CH的氨基之间的静电,以及木聚糖间氢键相互结合作用交联形成微晶,CH与之形成共结晶网状结构,制得半纤维素与CH复合水凝胶。而谷物阿拉伯木聚糖与CH物理交联制备的水凝胶方面的研究却未见报道。
本文以脱淀粉玉米纤维为原料,采用碱性过氧化氢提取工艺制备CAX,对CAX的组成、酸性基团的数量和摩尔质量进行了表征。将CAX和CH在酸性条件下溶解,制成薄膜;然后将薄膜在水中浸泡、溶胀,得到水凝胶;研究了CAX与CH配比(CAX/CH)、不同pH下的成膜性和溶胀性能及凝胶的形成机理。
1 材料与方法
1.1 材料与试剂
玉米纤维,黑龙江省镜泊湖农业开发股份有限公司;耐高温α-淀粉酶(酶活力50 000 U/g)、碱性蛋白酶(102 511 U/g),中国丹麦诺维信公司;CH(黏度<50 Pa·s),山东奥康生物科技有限公司;阿拉伯糖、木糖、葡萄糖、鼠李糖、半乳糖、甘露糖、葡萄糖醛酸、半乳糖醛酸,生工生物工程(上海)有限公司;葡聚糖标样,美国AMRESCO公司;乙腈、甲醇,均为色谱纯,天津市科密欧化学试剂开发中心;其余试剂均为国产分析纯。
1.2 仪器与设备
DZF-6050型冷真空干燥箱,上海博讯实业有限公司;TDL-5-A型低速台式离心机,上海安亭科学仪器厂;HGZF-101-2型电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;ME1002E/02分析天平,梅特勒-托利多仪器;SHZ-DIII循环水式真空泵,郑州瑞涵仪器有限公司;PB-10型pH计,北京赛多利斯科学仪器有限公司;FW100型高速万能粉碎机,北京市光明医疗器械有限公司;RJX-3-9马弗炉,天津实验电炉厂;PRIMAIDE高效液相色谱仪,日本日立公司;Spectrum One傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR),美国PE公司;D8型X-射线衍射仪,德国BRUKER-AXS。
1.3 实验方法
1.3.1 CAX的制备
采用碱性过氧化氢提取工艺和超滤相结合方法,从玉米纤维中提取分离得到CAX,在DONER等[15]方法的基础上略有修正。
CAX制备流程:
玉米纤维→粉碎(过60目筛)→水煮脱淀粉→玉米纤维Ⅰ→酶法脱淀粉→自然干燥→玉米纤维Ⅱ→碱性过氧化氢提取→过滤(300目滤布)→滤液离心(300 r/min,15 min)→上清液→调pH至4.0→沉淀过夜→离心(3 000 r/min,15 min)→上清液超滤→浓缩液→醇沉→过滤(300目滤布)→析出物真空干燥→CAX制品
操作要点:
(1)水煮脱淀粉
将500 g玉米纤维加入3 500 mL水,煮沸30 min,趁热过滤(300目滤布),用5 000 mL沸水洗涤,趁热过滤,得到滤渣。重复上述操作,将得到滤渣,自然晾干得到玉米纤维Ⅰ。
(2)酶法脱淀粉
取200 g玉米纤维Ⅰ加入4 L水(料液比1∶20),然后调pH至6.0,沸水浴搅拌10 min,将其冷却至95 ℃ 后加入耐高温淀粉酶4%(质量分数,对原料玉米麸皮),恒温水浴92 ℃,搅拌3 h,过滤弃去滤液,将滤渣自然干燥。得到脱淀粉的玉米纤维Ⅱ。
(3)碱性过氧化氢提取
取200 g玉米纤维Ⅱ加入4 L纯净水,加入质量分数为30% H2O2溶液调提取液的H2O2浓度达到10 g/L,边加边快速搅拌。用NaOH溶液将提取液的pH值调整为11.5,料液比1∶25(g∶mL),在60 ℃恒温水浴中搅拌,并维持2 h。
(4)上清液超滤
采用6 000 Da中空纤维膜超滤上清液,使之脱盐、浓缩。工作压力0.10 MPa,浓缩倍数5倍。浓缩液用蒸馏水洗涤超滤2次。
(5)浓缩液醇沉、过滤
按V(浓缩液)∶V(无水乙醇)=1∶4加入无水乙醇,搅拌,室温过夜,过滤。
(6)析出物真空干燥
析出物在40 ℃下进行真空干燥。阿拉伯木聚糖得率计算如公式(1)所示:
CAX得率![]()
(1)
1.3.2 CAX成分分析
采用硫酸-苯酚方法[16]测定总糖含量。采用杜马斯燃烧法[17]测定蛋白质含量。采用热失重分析方法[18]测定灰分含量。采用索氏提取方法[19]测定脂肪含量。采用高效液相色谱法方法[20]测定阿魏酸含量。采用高效液相色谱法[21]测定CAX单糖组成。
采用高效凝胶渗透色谱法方法测定CAX分子质量分布。以Dextran T-2 000、Dextran T-1 000、Dextran T-200、Dextran T-100、Dextran T-50和Dextran T-20作为分子质量测量的标准品。Ultrahydrogel TM Linear,300 mm×7.8 mm id凝胶柱;示差折光检测器。色谱条件为:样品浓度为2 mg/mL,进样量20 μL,0.02 mol/L pH 7.4磷酸盐缓冲液为洗脱液,洗脱液的流速为1.0 mL/min,柱温:40 ℃;检测器温度:40 ℃。以保留时间为横坐标,lgMw为纵坐标,绘制标准曲线,建立线性方程,y=-0.763 4x+17.779,R2=0.983 4。样品分子质量的测定:配制2 mg/mL CAX溶液,过0.45 μm滤膜,进样。根据图谱中所得保留时间,通过上述回归方程计算CAX分子质量。
1.3.3 CAX基复合膜的制备
以CAX为原料,加入不同数量的CH,经干法混合,搅拌至盐酸酸化水中(pH 1.3~1.95)制成溶液,搅拌均匀。CAX/CH为100/0~0/100,干物质含量为1.5%按重量计。然后加热至95 ℃,维持20 min。溶液被冷却到室温,然后倒在聚苯乙烯盘上。40 ℃、12 h鼓风干燥,得到的薄膜厚度一般为50 μm。
1.3.4 CAX/CH对复合膜特性的影响
按CAX/CH为100/0、95/5、90/10、85/15、80/20、75/25、70/30、60/40、50/50、40/60、0/100,干法混合CAX和CH;然后,分别加入到pH 1.30~1.95酸化水中,搅拌均匀,制成溶液。然后加热至95 ℃,维持20 min。溶液被冷却到室温,然后倒在聚苯乙烯盘上。置于40 ℃、12 h鼓风干燥箱烘干成薄膜,监测成膜性。将薄膜在水中浸泡、溶胀,得到水凝胶,并测定膜的溶胀率。
1.3.5 溶剂酸化水pH对复合膜特性的影响
按CAX/CH为70/30,干法混合CAX和CH;然后,分别加入到pH 1.30、1.40、1.50、1.60、1.65、1.70、1.75、1.80、1.85、1.95的酸化水中,搅拌均匀,制成溶液。以下同1.3.4。
1.3.6 溶胀性能测试
小片(约1.5 cm×1.5 cm)的薄膜被放置在一个已知重量的玻璃表面皿里。加入25 mL去离子水,静置30 min,然后小心取出,将样品留在玻璃表面皿中。玻璃表面皿用滤纸擦干并称重。溶胀率也可以采用不同pH值的溶液进行测量。溶胀率计算如公式(2)所示:
溶胀率![]()
(2)
1.3.7 复合膜的表征
1.3.7.1 FTIR分析
取干燥膜,用刀片刮取膜表面得到粉末,将粉末与KBr混合,压片,将其置于样品架上在500~4 000 cm-1进行FTIR扫描。
1.3.7.2 X-射线衍射(X-ray diffraction,XRD)光谱分析
利用X-射线衍射仪测定复合膜的结晶特性,测试衍射角2θ范围为5°~50°,管压40 kV,管流40 mA。
1.3.7.3 扫描电镜(scanning electron microscope,SEM)分析
将CAX/CH复合膜在水中浸泡、溶胀,真空冷冻干燥。取2 mm×2 mm样品固定,喷金,SEM下观察样品截面形态并拍照,加速电压10 kV。
1.3.8 统计分析
所有实验均重复3次,实验数据采用平均数±标准差(mean±SD)表示,用SPSS v17.0统计软件进行方差分析,用邓肯法进行均值比较,以P<0.05为显著性检验标准。
2 结果与分析
2.1 碱性过氧化氢法提取的CAX成分分析
碱性过氧化法提取,CAX收率为35.80%,总糖含量为90.44%,蛋白质含量为2.09%,灰分含量为2.13%,脂肪含量为0.46%,摩尔质量为790 358 Da。CAX收率略低于文献报道[22],这可能与玉米原料不同和前处理条件不同有关系。CAX中蛋白质、灰分、脂肪含量较低,说明本研究所采用二次水煮与酶解的方法预处理玉米纤维,去除淀粉、脱脂肪、蛋白质的效果显著。CAX没有检出阿魏酸,这是因为碱可将结合于细胞壁上的阿魏酸游离出来[23]。CAX单糖组成:木糖44.69%,阿拉伯糖40.94%,半乳糖6.29%,酸性糖4.47%,鼠李糖0.80%,葡萄糖1.59%,甘露糖1.23%。说明玉米纤维半纤维素是CAX,主要含有木糖、阿拉伯糖,还含有少量的半乳糖、葡萄糖醛酸和甘露糖,与文献报道[1-2,22]基本一致。
2.2 CAX/CH对复合膜特性的影响
2.2.1 CAX/CH对复合膜成膜性的影响
CAX/CH对成膜性的影响的实验结果如表1所示。CAX/CH对复合膜成膜性影响很大。CAX/CH为100/0时,可以得到表面光滑的碎片;在95/5时,可以得到表面光滑的不完整的复合薄膜;CAX/CH为90/10~0/100时均可以得到连续的自支撑薄膜,而CAX/CH为90/10~85/15时制备的复合薄膜完整、表面光滑、柔韧性差、易碎。CAX/CH为80/20~70/30时制备的复合薄膜完整、表面光滑、柔韧性好、不碎。CAX/CH为60/40~0/100时制备的复合薄膜完整、表面多颗粒、柔韧性好、不碎。CAX/CH为95/5~85/15时制备的薄膜柔韧性性差的原因可能是CAX低摩尔质量的缘故。
表1 CAX/CH对成膜性的影响
Table 1 Effects of CAX/CH on film formation

CAX/CH100/095/590/1085/1580/2075/2570/3060/4050/5040/600/100成膜性大碎片、表面光滑、柔韧性差、易碎不完整薄膜、表面光滑、柔韧性差、易碎完整薄膜、表面光滑、柔韧性差、易碎完整薄膜、表面光滑、柔韧性一般、不碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面多颗粒、柔韧性好、不碎完整薄膜、表面多颗粒、柔韧性好、不碎完整薄膜、表面多颗粒、柔韧性好、不碎完整薄膜、表面多颗粒、柔韧性好、不碎
2.2.2 CAX/CH对复合膜溶胀率的影响
复合膜溶胀性能测定发现,CAX/CH=100/0的纯CAX碎片不吸收水分;CAX/CH在95/5~70/30时,复合膜吸收水分,溶胀形成水凝胶;CAX/CH在40/60及以上时,复合膜吸收水分,溶胀现象呈各向异性,测定溶胀率时触碰易破碎,且发生膜基质的散落,没有形成稳定的凝胶。由于膜中CH是处于离子形式,纯CH薄膜易在水中溶解,因此,CH含量30%及以上的薄膜溶胀发生基质散落是因为CH部分溶解所致。
对吸收水分,溶胀形成水凝胶的膜进行CAX/CH对复合膜溶胀率影响的实验结果如图1所示。CAX/CH在95/5~70/30时的复合膜,吸收水分溶胀形成水凝胶,溶胀率由8.10升高至180.10。CAX/CH为95/5和90/10的复合膜,溶胀率为8.10和8.60,CAX/CH对膜的溶胀率没有显著影响;而复合膜的CAX/CH在90/10~70/30时,溶胀率由8.60逐渐升高至180.10,CAX/CH对膜的溶胀率有显著影响。

图1 CAX/CH对复合膜溶胀率的影响
Fig.1 Effect of arabinoxylan/chitosan on swelling ratio of composite film
注:图中不同小写字母表示差异显著(P<0.05)(下同)
水凝胶暴露在外部变化刺激环境中,如碱-水溶液、不同pH值溶液。CAX/CH=70/30的复合膜在水和0.1 mol/L NaOH溶液中循环溶胀的效果如图2所示。当溶胀介质为NaOH时,复合膜的溶胀率较低,而溶胀介质更换为水时,水凝胶的溶胀率明显增大。水凝胶膜对环境循环刺激的变化具有可逆的反应。值得注意的是,水凝胶经过0.1 mol/L NaOH溶液浸泡后,再进行水中浸泡,其溶胀率明显低于初次水浸泡的溶胀率。
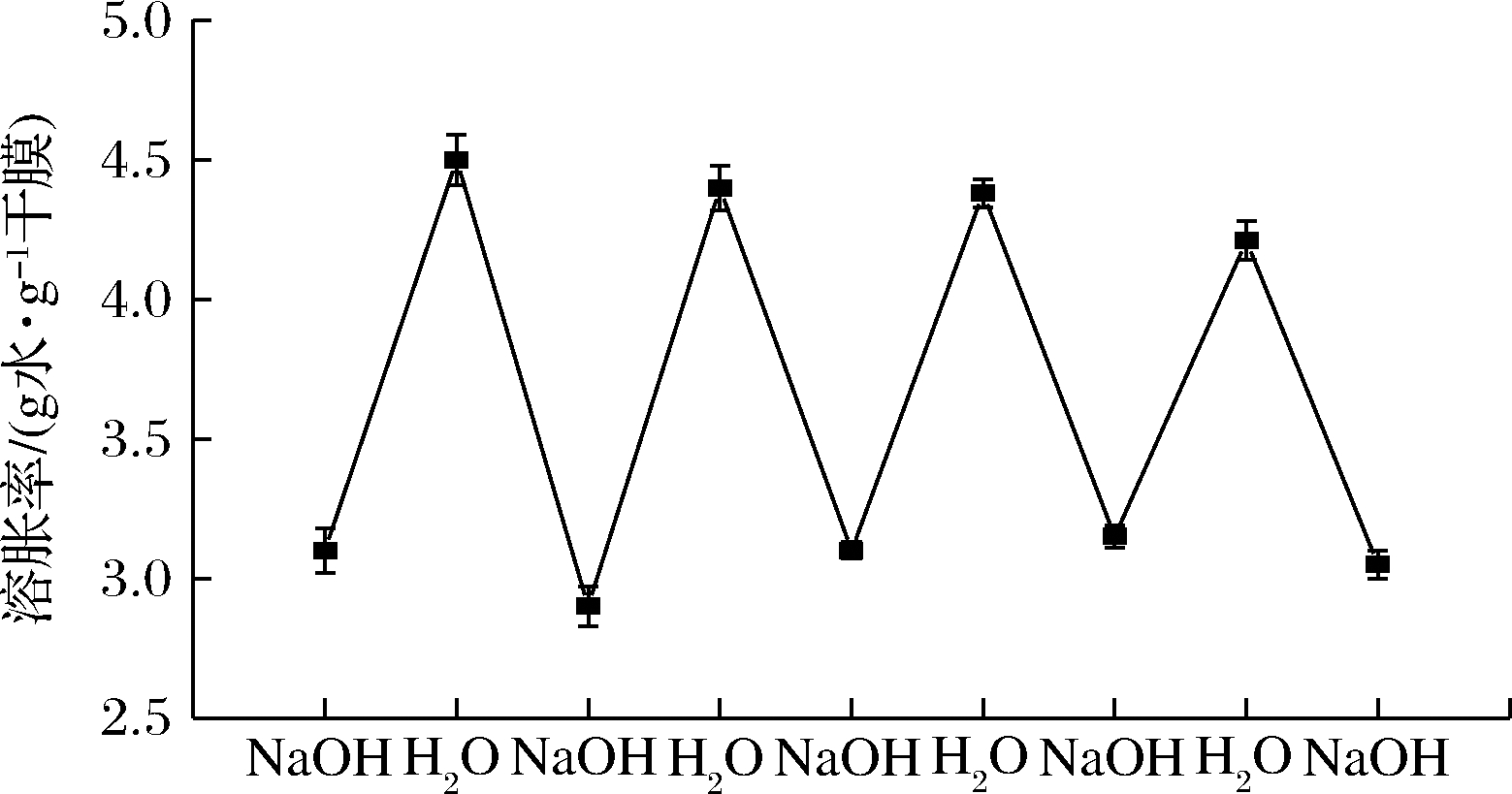
图2 水和0.1 mol/L NaOH溶液循环溶胀对复合膜溶胀
行为的影响
Fig.2 Effect of cyclic water and 0.1 mol/L sodium hydroxide
solution on swelling behavior of composite film
CAX/CH=70/30复合膜在pH 4~10的缓冲液的溶胀情况如图3所示。复合膜在pH 4、5、6、7的缓冲液的溶胀程度均明显高于pH 8、9、10的缓冲液。在高pH值下,溶胀率迅速减少。在中性pH值缓冲液中,复合膜的溶胀率为8.10,明显低于去离子水中该复合膜的溶胀率。这是因为凝胶中含有固定在网络聚合物上的可电离基团,在高pH值范围内形成羧酸盐离子的羧基,以及在低pH值范围内形成铵离子的氨基。这些离子被限制在凝胶中,使含有可移动离子的凝胶渗透压高于周围溶液的渗透压。凝胶高渗透压使较小的离子和水在凝胶和溶液之间自由流动,使凝胶溶胀,直到受到网络黏结力的限制。

图3 复合膜在不同pH的缓冲溶液中的溶胀情况
Fig.3 Swelling of composite films in different pH buffer solutions
2.3 溶剂酸化水pH对复合膜特性的影响
2.3.1 溶剂酸化水pH对复合膜成膜性的影响
按照CAX/CH=70/30,干法混合CAX和CH,分别加入到pH 1.30、1.40、1.50、1.60、1.65、1.70、1.75、1.80、1.85、1.90、1.95酸化水中,复合膜成膜结果如表2所示。酸化pH对复合膜成膜性、溶胀率影响很大。溶剂酸化水pH在1.30~1.95 时均可以得到连续的自支撑薄膜,而加入pH 1.30、1.40、1.50酸化水制备的复合薄膜表面光滑,但柔韧性较差、易碎;加入到pH 1.60、1.65、1.70酸化水制备的复合薄膜表面光滑、柔韧性好、不碎。加入到酸化水pH 1.75、1.80、1.85制备的薄膜表面有微小颗粒、柔韧性好、不碎。加入到酸化水pH 1.90、1.95制备的薄膜表面有颗粒、柔韧性好、不碎。
表2 酸化水pH对成膜性的影响
Table 2 Effects of acidified water pH on film formation

酸化水pH1.301.401.501.601.651.701.751.801.851.901.95成膜性完整薄膜、表面光滑、柔韧性差、易碎完整薄膜、表面光滑、柔韧性差、易碎完整薄膜、表面光滑、柔韧性差、易碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面光滑、柔韧性好、不碎完整薄膜、表面有微小颗粒、柔韧性好、不碎完整薄膜、表面有微小颗粒、柔韧性好、不碎完整薄膜、表面有微小颗粒、柔韧性好、不碎完整薄膜、表面有颗粒、柔韧性好、不碎完整薄膜、表面有颗粒、柔韧性好、不碎
2.3.2 溶剂酸化水pH对复合膜溶胀率的影响
不同pH 1.30、1.40、1.50、1.60、1.65、1.70、1.75、1.80、1.85、1.90、1.95酸化水制得CAX/CH=70/30薄膜的溶胀率测定结果如图4所示。酸化水pH对复合膜的溶胀率有显著影响。采用pH 1.30、1.40、1.50、1.60的酸化水制备CAX/CH=70/30复合膜,溶于水后不能溶胀形成凝胶。而当酸化水pH为1.65~1.95时,CAX/CH=70/30复合膜溶于水后能溶胀,形成凝胶。酸化水pH 1.65、1.70制备复合膜溶胀率明显高于其他酸化水pH制备复合膜的溶胀率,酸化水pH 1.70制备复合膜溶胀率最高,为180.10;随着酸化水pH由1.75升高到1.95,复合膜溶胀率呈下降趋势,当酸化水pH 1.95时复合膜溶胀率降为94.60。这是由于在溶剂酸化水pH值较低时,复合物上氨基部分质子化,水分子除与CH上亲水基团结合,还可与网络上的离子基团强烈缔合形成水合层[24],故凝胶中水含量较大,复合物结构溶胀,微观平均孔径较大。随着缓冲溶液pH值的增大,复合物表面弱碱性的氨基质子化趋势减弱,导致凝胶网络构造内水量的减少,结构收缩,因此复合物平衡溶胀度呈下降趋势;当酸化水中pH值达到1.95左右,出现了凝胶网络的快速收缩,导致复合物平衡溶胀度明显下降趋势。

图4 酸化水pH对复合膜溶胀率的影响
Fig.4 Effect of acidified water pH on swelling
ratio of composite film
2.3.3 CAX和CH复合膜的FTIR分析
波数为4 000~500 cm-1时,对CH样品、CAX样品、CAX和CH物理混合样和复合膜(CAX/CH=70/30)样品进行FTIR扫描,得FTIR谱图(图5)。由CH的FTIR扫描谱图可知,3 427 cm-1为CH中O—H拉伸振动峰,2 850 cm-1是C—H伸缩振动吸收峰,1 596 cm-1的特征吸收峰可归属于—NH2振动吸收峰,1 655.43 cm-1处为乙酰化基团C![]() O伸缩振动吸收峰,表明样品未完全脱乙酰化;1 380.33 cm-1为—NH角变形吸收峰;1 155.60~1 076.75 cm-1的峰带是CH糖链中C—O—C对称伸展形成[25]。由CAX的FTIR扫描谱图可知,3 406 cm-1为O—H伸缩振动峰,2 910 cm-1是甲基和亚甲基的C—H伸缩振动吸收峰,1 631 cm-1为C
O伸缩振动吸收峰,表明样品未完全脱乙酰化;1 380.33 cm-1为—NH角变形吸收峰;1 155.60~1 076.75 cm-1的峰带是CH糖链中C—O—C对称伸展形成[25]。由CAX的FTIR扫描谱图可知,3 406 cm-1为O—H伸缩振动峰,2 910 cm-1是甲基和亚甲基的C—H伸缩振动吸收峰,1 631 cm-1为C![]() O伸缩振动吸收峰,表明CAX样品中糖醛酸的存在[22]。1 044.16 cm-1为木糖吡喃环C—O—C伸缩振动吸收峰[26]。由图5可知,复合膜水凝胶图谱,相对于CH和CAX和CH物理混合图谱来说,在羰基和酰胺区域有显著的变化,即CH的1 596 cm-1处的
O伸缩振动吸收峰,表明CAX样品中糖醛酸的存在[22]。1 044.16 cm-1为木糖吡喃环C—O—C伸缩振动吸收峰[26]。由图5可知,复合膜水凝胶图谱,相对于CH和CAX和CH物理混合图谱来说,在羰基和酰胺区域有显著的变化,即CH的1 596 cm-1处的![]() 的吸收峰偏移至1 528 cm-1,CAX的1 631 cm-1处的—COO-的伸缩振动峰偏移至1 629 cm-1;除此之外,未发现有别于CH、CAX中的其他特殊峰值,即没有新的化学键生成,这说明复凝聚相是CH的
的吸收峰偏移至1 528 cm-1,CAX的1 631 cm-1处的—COO-的伸缩振动峰偏移至1 629 cm-1;除此之外,未发现有别于CH、CAX中的其他特殊峰值,即没有新的化学键生成,这说明复凝聚相是CH的![]() 与CAX的—COO-通过静电相互作用缔合形成的[27],而非通过化学相互作用联接形成的。3 327 cm-1处吸收峰是缔合的—NH2和—OH的伸缩振动形成的,相对于CAX和CH发生了低波数区域偏移,表明产生了红移氢键。说明复合膜中的CAX和CH之间产生了氢键缔合,增强CAX与CH之间的相互作用。以上图谱的变化表明凝胶的产生是由多种基团作用生成连接点,形成稳定的空间网状结构。
与CAX的—COO-通过静电相互作用缔合形成的[27],而非通过化学相互作用联接形成的。3 327 cm-1处吸收峰是缔合的—NH2和—OH的伸缩振动形成的,相对于CAX和CH发生了低波数区域偏移,表明产生了红移氢键。说明复合膜中的CAX和CH之间产生了氢键缔合,增强CAX与CH之间的相互作用。以上图谱的变化表明凝胶的产生是由多种基团作用生成连接点,形成稳定的空间网状结构。
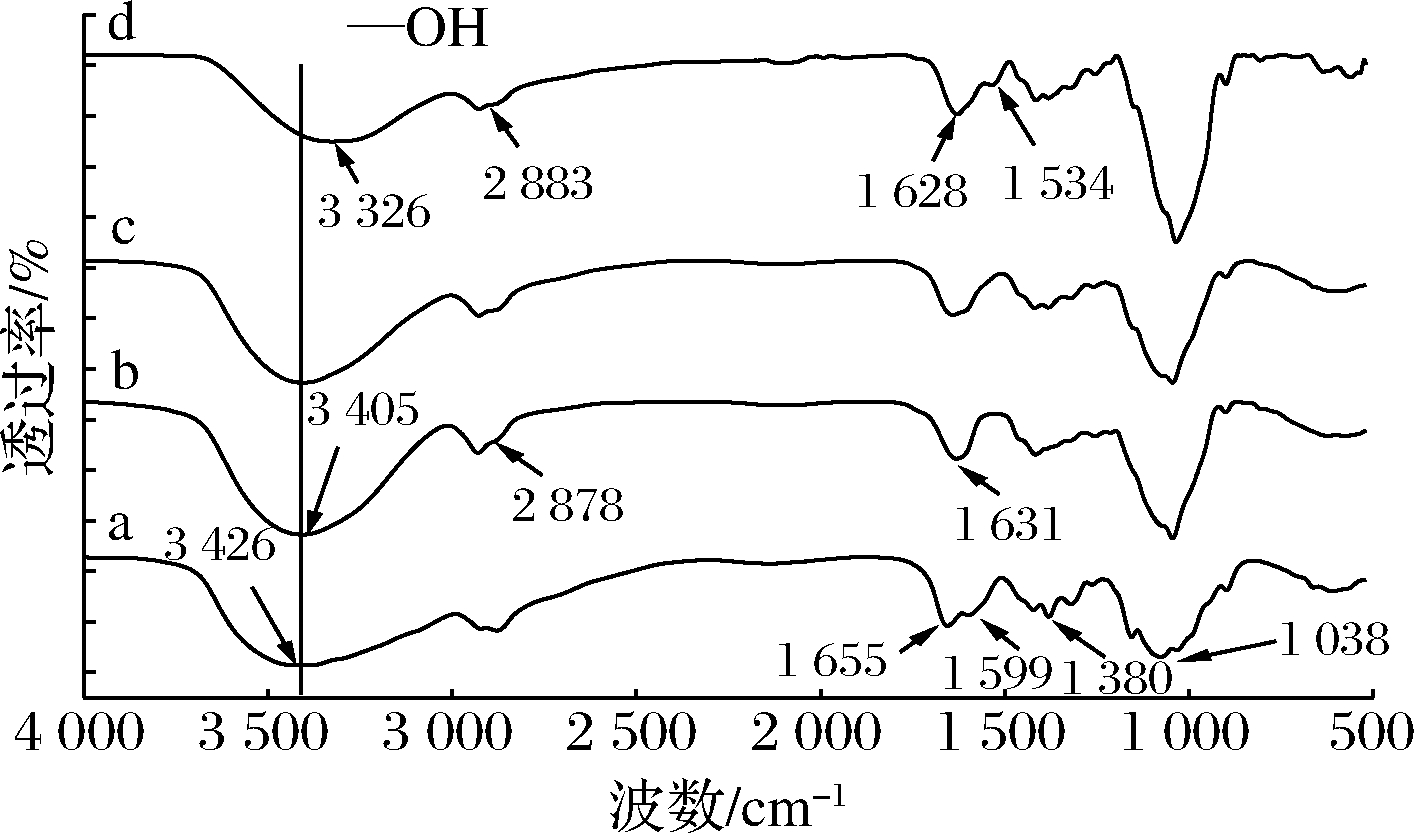
a-CH;b-CAX;c-CAX和CH物理混合;d-复合膜(CAX/CH=70/30)
图5 FTIR谱图
Fig.5 FTIR spectra
2.3.4 CAX和CH复合膜的XRD光谱分析
CH、纯CAX膜碎片和CAX/CH=70/30(酸化水pH 1.30、1.60、1.65、1.95)复合膜的XRD谱图如图6所示。由图6可知,纯CH粉末在2θ=10.66°和20.56°出现了2个衍射峰,其中20.56°为一个较大且尖锐的衍射峰,与文献资料[28]较一致。CAX膜碎片在2θ=17.12°、22.9°出现了2个衍射峰。如果CAX、CH之间没有相互作用,或相互作用很微弱,那么各组分在复合膜中会出现各自的结晶区,共混膜的衍射谱图会按各组分衍射峰强度简单叠加。而相容的共聚物体系,各组分间有较强的相互作用,衍射图谱则表现为某些聚合物组分特征衍射峰的消失,并使结晶发生变化。
采用pH 1.30、1.60的酸化水制备CAX/CH=70/30的CAX和CH复合膜在17.12°和 22.9°出现了2个衍射峰,与CAX膜碎片的特征衍射峰相同,但17.12°衍射峰强度比CAX膜碎片减弱,说明采用pH 1.30、1.60 酸化水制备CAX/CH=70/30复合膜,CH并未破坏CAX的晶体结构,且CH和CAX没有发生非共价作用力形成交联,复合膜溶于水不会转化为水凝胶。采用pH 1.65、1.95的酸化水制备CAX/CH=70/30复合膜在17.12°和22.9°的2个衍射峰消失了,且复合膜在2θ=10~40°处是一个宽而平缓的衍射峰,这表明在pH 1.65、1.95的酸化水制备的复合膜中CAX结晶结构已经被破坏,CAX中糖醛酸的羧基和CH的氨基之间通过静电作用,对CAX、CH分子原来的结晶形成干扰,进一步复合,形成结构较复杂、均匀的复合物,从而影响复合膜的结构,使膜溶于水转化为水凝胶。这是因为在不同pH溶液中CH及糖醛酸发生不同程度的解离,分子链上的静电电荷数量不同,影响了其静电复合的程度。CH的解离常数(pKa)介于6.3~7.35[29],糖醛酸pKa为2.9~4.1[30]。当酸化水pH<1.60时,CH分子中的—NH2质子化为![]() 但糖醛酸中的—COOH在此条件下不能解离,溶解度较低,两聚合物不能发生静电复合。当溶液pH 1.65时,CH分子中的—NH2质子化为
但糖醛酸中的—COOH在此条件下不能解离,溶解度较低,两聚合物不能发生静电复合。当溶液pH 1.65时,CH分子中的—NH2质子化为![]() 但糖醛酸中的—COOH在此条件下完全解离,CH与CAX晶体结构破坏,二者发生静电复合作用,形成结构较复杂、均匀的复合物。这一结果与文献报道基本一致[13],亦与本研究复合膜的FTIR光谱分析结果相吻合。
但糖醛酸中的—COOH在此条件下完全解离,CH与CAX晶体结构破坏,二者发生静电复合作用,形成结构较复杂、均匀的复合物。这一结果与文献报道基本一致[13],亦与本研究复合膜的FTIR光谱分析结果相吻合。

a-CH粉末;b-纯CAX膜碎片;c-CAX/CH=70/30
复合膜(酸化水pH 1.30);d-CAX/CH=70/30复合膜
(酸化水pH 1.60);e-CAX/CH=70/30复合膜(酸化水pH 1.65);
f-CAX/CH=70/30复合膜(酸化水pH 1.95)
图6 不同pH酸化水制备CAX/CH=70/30复合膜的XRD谱图
Fig.6 XRD spectra of CAX/CH=70/30 composite film prepared
from different acidified water
2.3.5 CAX和CH复合膜的SEM分析
将CAX/CH=80/20和CAX/CH=40/60的CAX/CH复合膜在水中浸泡、溶胀,真空冷冻干燥,样品分别切片,喷金后进行电镜扫描,得到SEM图如图7所示。CAX/CH=80/20复合膜溶胀冻干样品断面呈现出类似蜂窝状多孔的结构。CAX/CH=40/60复合膜溶胀冻干样品断面呈现出较为疏松的大孔性结构,其孔径大于CAX/CH=80/20复合膜溶胀冻干样品。SEM照片证实了CAX/CH=80/20复合膜溶胀后具有稳定的三维网状凝胶结构的存在,而CAX/CH=40/60 复合膜溶胀后不具有结实的三维网状结构,不能形成稳定的凝胶。这一结果与CAX/CH对复合膜溶胀性能影响的实验结论一致。

a-CAX和CH=80/20复合膜;b-CAX/CH=40/60复合膜(×150)
图7 CAX和CH复合膜溶胀冻干结构断面SEM图
Fig.7 SEM picture of cross-section of structure formed upon
freeze drying of the hydrogel after swelling of the composite film
3 结论
以玉米纤维为原料,采用碱提取和超滤相结合的方法,提取出富含木糖和阿拉伯糖,还含有少量葡萄糖醛酸的CAX,分子质量为790 358 Da,收率为35.80%。CAX溶液不具良好的成膜性能;CAX与CH共混时,在酸性条件下,CAX/CH为90/10~0/100时均可以得到连续的自支撑薄膜。CAX/CH为95/5~70/30时的复合膜浸入水中,溶胀形成水凝胶。水凝胶在碱液和水及不同pH值溶液的溶胀行为,表现为对各种刺激的反应是可逆的。酸化水pH对复合膜溶胀率有显著影响。酸化水pH>1.65制备的CAX/CH=70/30复合膜能溶胀形成凝胶,酸化水pH 1.70制备复合膜溶胀率最高。
采用FTIR法研究了凝胶的形成机理表明,CAX的葡萄糖醛酸羧基与CH的氨基之间的静电相互作用有关。XRD对薄膜形貌分析发现,纯CAX薄膜呈晶体状;酸化水pH影响CAX/CH=70/30复合膜中原有的晶体结构。当酸化水pH≥1.65时,CAX/CH=70/30复合膜中CAX结晶消失,复合膜具有凝胶性;当pH<1.65,复合膜中CAX结晶结构存在,复合膜不具有凝胶性。这进一步证明CAX与CH之间的静电相互作用,使原有的结晶消失,形成具有凝胶性且结构较复杂、均匀的复合物。用SEM扫描成像显示复合膜溶胀后的水凝胶具有类似蜂窝状多孔的结构。
[1] IZYDORCZYK M S, BILIADERIS C G.Cereal arabinoxylans:Advances in structure and physicochemical properties[J].Carbohydrate Polymers, 1999, 28(1):33-48.
[2] SINGH V, DONER L W, JOHNSTON D, et al.Comparison of coarse and fine corn fiber for corn fiber gum yields and sugar profiles[J].Cereal Chemistry, 2000, 77(5):560-561.
[3] REIS S F, COELHO E, COIMBRA M A, et al.Improved efficiency of Brewer′s spent grain arabinoxylans by ultrasound-assisted extraction[J].Ultrason Sonochem, 2015, 24:155-164.
[4] MONTGOMERY R, SMITH F.Identification of the methylated aldobiouronic acid obtained from methyl corn hull hemicellulose[J].Journal of the American Chemical Society, 1957, 79(3):695-697.
[5] FIGUEROA-ESPINOZA M C, ROUAU X.Oxidative cross-linking of pentosans by a fungal laccase and horseradish peroxidase:Mechanism of linkage between feruloylated arabinoxylans[J].Cereal Chemistry, 1998, 75(2):259-265.
[6] YADAV M P, FISHMAN M L, CHAU H K, et al.Molecular characteristics of corn fiber gum and their influence on CFG emulsifying properties[J].Cereal Chemistry, 2007, 84(2):175-180.
[7] FREDON E, GRANET R, ZERROUKI R, et al.Hydrophobic films from maize bran hemicelluloses[J].Carbohydrate Polymers, 2002, 49:1-12.
[8] SRINIVASAN A, EKAMBARAMS P,PERUMAL S S.Chemical characterization and immunostimulatory activity of phenolic acid bound arabinoxylans derived from foxtail and barnyard millets[J].Journal Food Biochemistry, 2020, 44:1-9.
[9] ARULDHAS J, ERUSAPPAN T, HERRERABALANDRANO D D, et al.Alkali-extracted feruloylated arabinoxylans from nixtamalized maize bran byproduct:A synonymous with soluble antioxidant dietary fiber[J].Waste and Biomass Valorization, 2020, 11:403-409.
[10] 顾雪蓉, 朱育平.凝胶化学(第一版)[M].北京:化学工业出版社, 2005.
GU X R, ZHU Y P.Gel Chemistry (1 st Edition)[M].Beijing:Chemical Industry Press, 2005.
[11] COVIELLO T, MATRICARDI P, MARIANECCI C, et al.Polysaccharide hydrogels for modified release formulations[J].Journal of Controlled Release, 2007, 119:5-24.
[12] SLAUGHTER B V, KHURSHID S S, FISHER O Z, et al.Hydrogels in regenerative medicine[J].Advanced Materials, 2009, 21:1-23.
[13] GABRIELII I, GATENHOLM P.Preparation and properties of hydrogels based on hemicellulose[J].Journal of Applied Polymer Science, 1998, 69:1 661-1 667.
[14] GABRIELII I, GATENHOLM P, GLASSER W G, et al.Separation, characterization and hydrogel-formation of hemicellulose from aspen wood[J].Carboohydrate Polymers, 2000, 43(4):367-374.
[15] DONER L W, HICKS K B.Isolation of hemicellulose from corn fiber by alkaline hydrogen peroxide extraction[J].Cereal Chemistry, 1997, 74(2):176-181.
[16] DUBOIS M, GILLES K A, HAMILTON J K.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[17] 王铁良, 魏亮亮, 刘冰杰, 等.杜马斯燃烧法测定大豆水溶性蛋白含量的方法研究[J].中国油脂, 2019, 44(1):127-131.
WANG T L, WEI L L, LIU B J, et al.Method for determination of water-soluble protein content in soybean by Dumas combustion method[J].China Oils and Fats, 2019, 44(1):127-131.
[18] 中华人民共和国卫生部.GB 5009.4—2010 食品安全国家标准 食品中灰分的测定[S].北京:中国标准出版社, 2010.
Ministry of Health of the People′s Republic of China.GB 5009.4—2010 National food safety standard Determination of ash in foods[S].Beijing:Standards Press of China, 2010.
[19] 董彩霞. 索氏提取法测定食品脂肪含量应注意的问题[J].中国质量技术监督, 2014(7):73.
DONG C X.Problems needing attention in determination of food fat content by Soxhlet extraction method[J].China Quality and Technical Supervision, 2014(7):73.
[20] 尚庆. 玉米纤维多糖的提取、纯化及性质研究[M].齐齐哈尔:齐齐哈尔大学, 2016.
SHANG Q.Preparation and Properties of Corn Fiber Polysaccharides[M].Qiqihar:Qiqihar University, 2016.
[21] 戴军, 朱松, 汤坚, 等.PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J].分析测试学报, 2007, 26(2):206-210.
DAI J, ZHU S, TANG J, et al.Analysis of monosaccharide compositions in polysaccharides from D.Salina by pre-column derivatization high performance liquid chromatography[J].Journal of Instrumental Analysis, 2007, 26(2):206-210.
[22] DONER L W, CHAU H K, FISHMAN M L, et al.An improved process for isolation of corn fiber gum[J].Cereal Chemistry, 1998, 75(4):408-411.
[23] 罗艳玲, 欧仕益.碱解玉米皮制备阿魏酸的研究[J].中国食品学报, 2007, 7(5):97-101.
LUO Y L, OU S Y.Studies on the preparation of ferulic acid from maize bran by alkaline hydrolysis[J].Journal of Chinese Institute of Food Science and Technology, 2007, 7(5):97-101.
[24] 杨亚江. 聚皂凝胶在溶液中的溶胀-消溶胀研究[J].高分子学报, 1999(3):108-113.
YANG Y H.Swelling behaviour of polysoap hydrogels[J].Acta Polymerica Sinica, 1999(3):108-113.
[25] UMEMURA K, KAWAI S.Preparation and characterization of Maillard reacted chitosan films with hemicellulose model compounds[J].Journal of Applied Polymer Science, 2008, 108(4):2 481-2 487.
[26] 吴培凤, 周德庆, 刘楠.浒苔半纤维素/壳聚糖复合水凝胶的制备及其强度的研究[J].应用化工, 2016, 45(12):2 313-2 316;2 325.
WU P F, ZHOU D Q, LIU N.Preparation and gel strength of enteromorpha prolifera hemicellulose / chitosan composite hydrogels[J].Applied Chemical Industry, 2016, 45(12):2 313-2 316;2 325.
[27] ESPINOSA-ANDREWS H, SANDOVAL-CASTILLA O, VAZQUEZ-TORRES H, et al.Determination of the gum arabic-chitosan interactionsby Fourier transform infrared spectroscopy and characterization of the microstructure and rheological features of their coacervates[J].Carbohydrate Polymers, 2010, 79(3):541-546.
[28] FAN L H, SUN Y, XIE W G, et al.Oxidized pectin cross-linked carboxymethyl chitosan:A new class of hydrogels[J].Journal of Biomaterials Science, 2012, 23:2 119-2 132.
[29] HUGO E, JUAN G, FRANCISCO C E J.Gum arabic-chitosan complex coacervation[J].Biomacromolecules, 2007, 8:1 313-1 318.
[30] MESHALI M M, GABR K E.Effect of interpolymer complex formation of chitosan with pectin or acacia on the release behavior of chloropromazine HCl[J].International Journal of Pharmaceutics, 1993, 89:177-181.