姜黄素是一种天然来源的多酚类化合物,主要从姜黄类植物的根茎中提取得到,目前作为调味料和食用色素被广泛应用于食品工业中[1]。大量研究表明,姜黄素具有抗炎症[2]、抗氧化[3]、抗肿瘤[4]等生理活性,同时对糖尿病[5]、人体缺陷免疫综合征[6]、心肌病[7]等疾病都有显著的预防和治疗效果。然而,姜黄素在水中溶解度极低[8],在光照、加热和化学处理时稳定性差,易发生变性和降解[9],这都造成了姜黄素的生物利用度较低,难以在实际应用中发挥其生理功能。因此,如何提高姜黄素的稳定性和生物利用度成为了当今的研究热点。
为解决上述问题,微胶囊包埋技术被广泛应用于姜黄素等功能活性物质的包埋和递送。常见的包埋载体主要包括脂质体、高分子纳米颗粒、环糊精、纳米乳液等[10],它们通常为食品级运载体系,具有来源广泛、无毒副作用、致敏性低、生物相容性高等优点[11]。更重要的是,包埋技术可以显著改善姜黄素等生物活性物质的水溶性和环境稳定性[12],提高生物利用度,保护其免受体内的酶和其他物质的分解,并实现靶向运输和可控性释放[13],最大限度地发挥生物活性功能。然而,这些包埋载体的制备过程较为复杂,且常常涉及到化学试剂(如戊二醛、丙酮等)的添加和高温处理[14-15],在安全性和经济性方面存在一定的局限性。
与上述包埋载体相比,酵母细胞基包埋载体在安全性、经济性和包埋效果方面都具有显著的优势[16]。同时,酵母包埋材料可以显著提高包埋物质的稳定性,防止活性物质在食品加工过程中发生分解,这主要得益于酵母细胞所具有的结构,即坚固的细胞壁结构、具有选择透过性的细胞膜和包含抗氧化成分的细胞质[17]。白地霉是一种性状类似酵母的的耐酸性霉菌,来源广泛且环境适应能力较强[18],被广泛应用于奶酪发酵、污水治理和动物饲养等领域[19-21]。白地霉和酵母菌在结构和功能方面的相似性,以及开菲尔源白地霉独特的益生功能,使其成为了一种理想的姜黄素包埋材料,在功能性食品开发和疾病预防治疗方面有着广阔的应用前景,但目前仍然没有关于白地霉在姜黄素包埋方面的研究。
本研究选用实验室保藏的1株从西藏开菲尔中筛选出的白地霉(Geotrichum candidum LG-8)作为包埋载体,确定了最佳包埋条件,表征了其对姜黄素的包埋能力,并探究了包埋产物的稳定性,旨在为提高姜黄素的稳定性和生物利用度提供新思路。
1 材料与方法
1.1 材料与试剂
姜黄素(分析纯),上海麦克林生物公司;白地霉,开菲尔源白地霉LG-8(G.candidum LG-8),保藏于本实验室中;葡萄糖、蛋白胨、酵母浸粉、甘油(分析纯)、无水乙醇、氢氧化钠、盐酸、PBS缓冲液(pH 7),上海阿拉丁生化试剂有限公司;实验用水均为纯水。
1.2 仪器与设备
LC-85L无油隔膜式真空泵,上海力辰仪器科技有限公司;μQuant微孔板扫描分光光度计,美国博腾仪器有限公司;Leica TCSSP8STED超高分辨共聚焦显微镜,德国徕卡仪器有限公司;UltraVIEW VoX活细胞高速激光共聚焦实时成像系统,美国铂金埃尔默公司;JEM2100透射电子显微镜,日本电子株式会社。
1.3 实验方法
1.3.1 白地霉包埋载体的制备
取甘油管保藏的白地霉,经酵母浸出粉胨葡萄糖液体培养基活化24 h后,以10%的接种量进行18 h二次活化和20 h扩大培养。离心得到白地霉菌体,用纯水洗涤3次,得到的菌泥为白地霉包埋载体,密封贮存在4 ℃冰箱中备用。
1.3.2 白地霉-姜黄素包埋产物的制备
参考YOUNG等[22]的方法,白地霉-姜黄素包埋产物(G.candidum-curcumin encapsulation products, GCEPs)的制备采用真空包埋法。称取1 g(湿重)白地霉菌泥加入5 mL乙醇溶液中制成悬浊液,并加入1 mL 1 mg/mL的姜黄素乙醇溶液,以90%的真空度对混合溶液进行抽真空处理,离心得到的沉淀即GCEPs。
1.3.3 GCEPs中姜黄素的提取与含量测定
GCEPs中的姜黄素通过超声处理的方法提取得到,并通过分光光度分析法计算姜黄素含量。将1 g GCEPs(湿重)加入5 mL无水乙醇中制成悬浊液,超声处理10 min使GCEPs中的姜黄素溶解于无水乙醇中,离心后测量上清液在425 nm处的吸光值,并通过姜黄素乙醇溶液的标准曲线回归方程计算GCEPs中的姜黄素含量。
1.3.4 包埋率的计算
包埋率被用作表征载体包埋能力的指标,具体是指姜黄素包埋量与姜黄素初始添加量的比值,计算如公式(1)所示:
包埋率![]()
(1)
式中:Vf,从GCEPs中提取得到的姜黄素溶液体积,5 mL;V0,姜黄素溶液初始添加体积,1 mL;ρf,从GCEPs中提取得到的姜黄素溶液质量浓度,mg/mL;ρ0,姜黄素溶液初始添加质量浓度,1 mg/mL。
1.3.5 包埋条件的优化
单因素实验:以包埋率为指标,探究包埋环境pH、包埋介质乙醇体积分数和真空处理时间对白地霉包埋姜黄素能力的影响。
包埋环境pH:称取1 g(湿重)白地霉菌泥,加入5 mL 体积分数为35%的乙醇溶液中制成悬浊液,调节悬浊液pH分别为2、4、6、8、10、12,加入1 mL 1 mg/mL的姜黄素溶液,真空处理1 min,计算包埋率。
包埋介质乙醇体积分数:称取1 g(湿重)白地霉菌泥,加入5 mL体积分数分别为0%、10%、20%、30%、40%、50%的乙醇溶液中制成悬浊液,调节悬浊液pH为7,加入1 mL 1 mg/mL的姜黄素溶液,真空处理1 min,计算包埋率。
真空处理时间:称取1 g(湿重)白地霉菌泥,加入到5 mL体积分数为35%的乙醇溶液中制成悬浊液,调节悬浊液pH为7,加入1 mL 1 mg/mL的姜黄素溶液,真空处理时间分别为0.5、1、5、10、20、30 min,计算包埋率。
响应曲面优化:基于上述单因素实验的结果,以包埋率为指标,设计3因素3水平的响应曲面实验,探究最佳包埋条件。各因素和水平编码见表1。
表1 响应曲面因素及水平
Table 1 Factors and levels of response surface
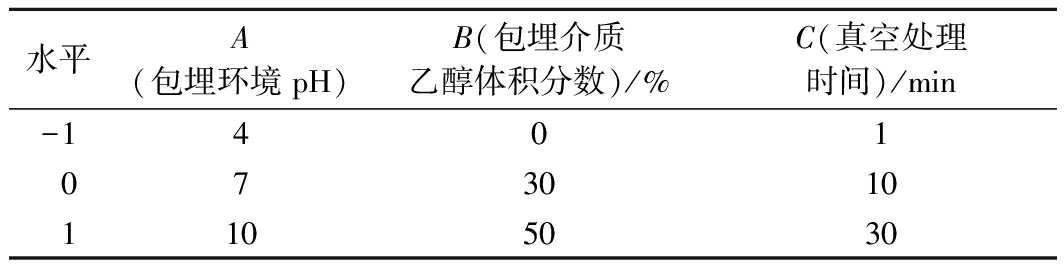
水平A(包埋环境pH)B(包埋介质乙醇体积分数)/%C(真空处理时间)/min-14010730101105030
1.3.6 GCEPs的表征
1.3.6.1 激光共聚焦显微镜观察
姜黄素可以在425 nm处产生绿色荧光,无需进行二次染色。用于制片的样品分别为:白地霉包埋载体、GCEPs和乙醇提取姜黄素处理后的GCEPs。制片方法为:取1 g(湿重)上述样品,加入5 mL PBS缓冲液(pH 7)中制成悬浊液,吸取少量悬浊液滴在载玻片上制成样片,盖好盖玻片并避光保存,防止发生荧光淬灭。将样片放置于无激发光状态下和425 nm激发光下分别拍摄照片,再将2张图片重合。
1.3.6.2 透射电镜观察
用于透射电镜的样品为白地霉包埋载体和GCEPs。制样方法为:将上述样品用PBS缓冲液(pH 7)清洗3次后,用体积分数为2.5%的戊二醛固定12 h,脱水处理并制备切片,再用柠檬酸铅和醋酸铀对超薄切片进行染色后,用透射电镜进行观察。
1.3.7 GCEPs的稳定性分析
1.3.7.1 贮存时间对GCEPs稳定性的影响
将1 g(湿重)GCEPs加入10 mL PBS缓冲液(pH 7)中制成悬浊液,静置避光保存0、1、5、10、20、30 d后,参考1.3.3中的方法提取出GCEPs中残留的姜黄素,并计算GCEPs中姜黄素的保留率。同时,未经过包埋的游离姜黄素在PBS缓冲液(pH 7)中的保留情况也被研究,并用来与GCEPs中的姜黄素比较。姜黄素保留率的计算如公式(2)所示:
姜黄素保留率![]()
(2)
式中:A1,不同处理前从GCEPs中提取出的姜黄素在425 nm处的吸光值;A2,不同处理后从GCEPs中提取出的姜黄素在425 nm处的吸光值。
1.3.7.2 pH对GCEPs稳定性的影响
将1 g(湿重)GCEPs加入10 mL PBS缓冲液(pH 7)中制成悬浊液,调节pH分别为2、4、6、8、10、12,静置避光保存0.5、1、3、5 h后,参考1.3.3中的方法提取出GCEPs中残留的姜黄素,并计算GCEPs中姜黄素的保留率,计算方法参考公式(2)。
1.4 数据处理
所有实验均进行3次重复,实验数据以平均数±标准差的形式表示;运用Origin 2021软件作图;运用SAS和Design Expert 8.0.6进行显著性统计分析,P<0.05 表示存在显著性差异。
2 结果与分析
2.1 包埋条件的优化
2.1.1 单因素实验
包埋环境pH、包埋介质乙醇体积分数和真空处理时间对姜黄素包埋率的影响如图1所示。总体来看,与碱性环境相比,白地霉在酸性环境中对姜黄素的包埋能力更强。当包埋环境为酸性时,随着酸性的减弱,包埋率逐渐增加,在pH为6时达到最大值,为(39.54±0.87)%。之后随着碱性增强,包埋率显著下降(P<0.05),pH 12时包埋率低于1%。这主要是由于白地霉在弱酸性环境中活性更强,对碱性环境更为敏感[23],当包埋环境过酸或过碱时,白地霉细胞的活性受到影响,使其对姜黄素的包埋效率下降。同时,姜黄素在酸性环境中的稳定性较强,而在碱性环境中极易发生降解[24]。随着包埋介质乙醇体积分数的增加,包埋率先上升后下降,在乙醇体积分数为40%时达到最大值,包埋率为(44.38±1.39)%。YOUNG等[22]的研究中也具有相似的结果:以酿酒酵母细胞为姜黄素包埋载体并使用真空包埋法,当包埋介质乙醇体积分数为35%时包埋率最高。随着真空处理时间的增加,白地霉的包埋率呈显著上升趋势(P<0.05),当真空处理时间为20 min时,白地霉对姜黄素的包埋能力趋于饱和,包埋率为(47.34±1.35)%。此后,随着真空处理时间的继续增加,包埋率显著下降(P<0.05),这是由于较长时间的真空处理导致白地霉细胞受损,包埋能力下降。

a-不同包埋环境pH的包埋率;b-不同包埋介质乙醇体积分数的包埋率;c-不同真空处理时间的包埋率
图1 不同因素对姜黄素包埋率的影响
Fig.1 The influence of different factors on curcumin encapsulation efficiency
注:同组不同小写字母表示存在显著性差异(P<0.05)
2.1.2 响应曲面优化
利用Design Expert 8.0.6软件,按照表1的编码水平设计17组实验,结果见表2。得到的三元二次回归方程为: Y=45.10-7.36A+4.05B+6.54C-1.90AB+2.02AC+1.19BC-13.87A2-8.02B2+2.42C2-0.94ABC
表2 响应曲面实验结果
Table 2 Results of response surface experiments
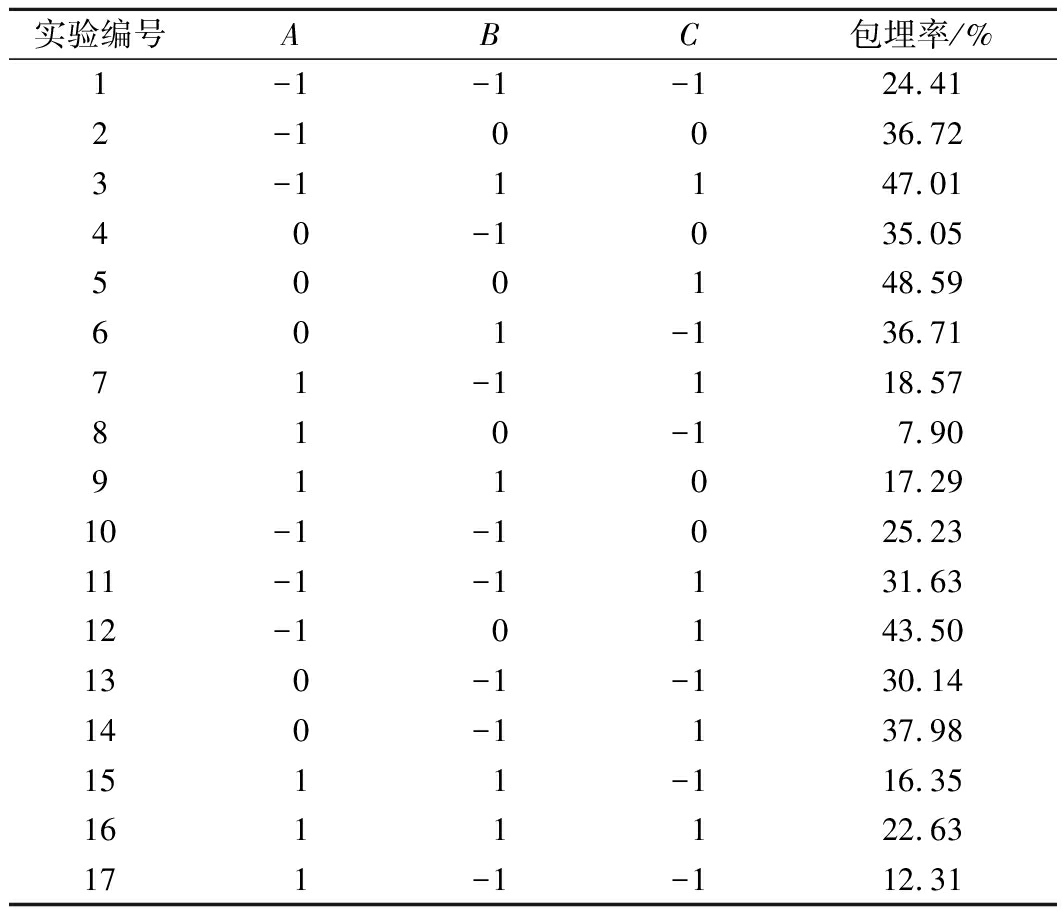
实验编号ABC包埋率/%1-1-1-124.412-10036.723-11147.0140-1035.05500148.59601-136.7171-1118.57810-17.90911017.2910-1-1025.2311-1-1131.6312-10143.50130-1-130.14140-1137.981511-116.351611122.63171-1-112.31
通过表3的方差分析结果可知,此回归模型极显著(P<0.01),模型R2=0.987 9,说明模型拟合程度高,可用于预测白地霉包埋姜黄素的最佳条件。另外,根据F值可以看出,各因素对姜黄素包埋率影响的主次顺序为:包埋环境pH(A)>包埋介质乙醇体积分数(B)>真空处理时间(C)。根据P值可以看出,A和BC对包埋率的影响极显著(P<0.01),B、C和B2对包埋率有显著影响(P<0.05)。
表3 方差分析结果
Table 3 Results of variance analysis
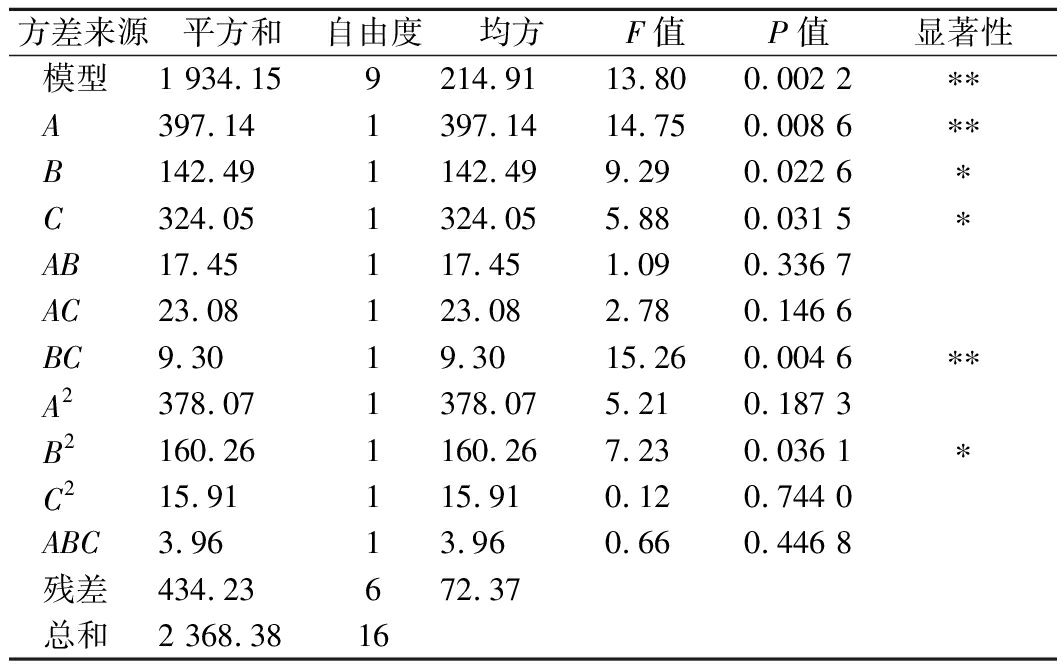
方差来源平方和自由度均方F值P值显著性模型1 934.159214.9113.800.002 2∗∗A397.141397.1414.750.008 6∗∗B142.491142.499.290.022 6∗C324.051324.055.880.031 5∗AB17.45117.451.090.336 7AC23.08123.082.780.146 6BC9.3019.3015.260.004 6∗∗A2378.071378.075.210.187 3B2160.261160.267.230.036 1∗C215.91115.910.120.744 0ABC3.9613.960.660.446 8残差434.23672.37总和2 368.3816
注:*表示显著相关,P<0.05;**表示极显著相关,P<0.01
通过Design Expert 8.0.6软件分析可以得到,最佳包埋条件为:包埋环境pH 6.64,包埋介质乙醇体积分数46.84%,真空处理时间18.38 min,此条件下得到的理论包埋率为56.34%。结合实际操作情况,将最佳包埋条件调整为:包埋环境pH 6.5,包埋介质乙醇体积分数45%,真空处理时间20 min,进行3次重复实验,得到的实际包埋率为(54.12±1.07)%,与理论值接近,说明该回归模型拟合度高,可用于优化白地霉对姜黄素的包埋条件。
2.2 GCEPs的表征
2.2.1 激光共聚焦显微镜分析
图2为白地霉包埋载体、GCEPs和乙醇提取姜黄素处理后的GCEPs的激光共聚焦显微镜图像。在明场下,白地霉的轮廓清晰可见,呈圆柱形或棒状,且在荧光场未看到白地霉,说明白地霉自身没有荧光性质。GCEPs的图像中,在荧光条件下可以观察到姜黄素发出的明显绿色荧光,同时,从合成图像可以看出姜黄素在白地霉包埋载体中分布均匀,说明真空包埋法可以用于制备GCEPs,且保持白地霉包埋载体自身的完整性。用乙醇提取GCEPs中的姜黄素后,白地霉包埋载体的形态未发生明显变化,但荧光条件下观察到的荧光强度明显减弱,表明包埋在GCEPs中的大部分姜黄素都可以通过乙醇处理的方法提取得到,用于姜黄素包埋率的计算。

a-白地霉包埋载体;b-GCEPs;c-乙醇提取
姜黄素处理后的GCEPs
图2 白地霉包埋载体和乙醇处理前后的GCEPs的激光
共聚焦显微镜图像
Fig.2 CLSM images of G.candidum and GCEPs before and after
extraction treatment by ethanol
2.2.2 透射电镜分析
透射电镜的结果如图3所示。观察可知,白地霉的细胞质均匀分布在细胞中,且细胞壁较厚,共有3层,由外到内分别为甘露聚糖、蛋白质分子和葡聚糖[25]。经过真空包埋处理后,白地霉的细胞形态未发生明显变化,切面仍然保持圆形或椭圆形,说明真空包埋法不会对白地霉的细胞形态造成破坏。同时,可以看到姜黄素均匀分散在细胞质中,与激光共聚焦显微镜观察的结果一致,验证了白地霉作为姜黄素包埋载体的可行性。

a-白地霉包埋载体;b-GCEPs
图3 白地霉包埋载体和GCEPs的透射电镜图像
Fig.3 TEM images of G.candidum and GCEPs
2.3 GCEPs的稳定性分析
2.3.1 贮存时间对GCEPs稳定性的影响
随着贮存时间的增加,GCEPs中的姜黄素有一定的损失,但总体来看具有较强的稳定性。在室温条件下避光贮存1 d后,GCEPs中大部分的姜黄素被保留,保留率高达(94.69±1.93)%;随着贮存时间的增加,包埋产物中的姜黄素缓慢流失;30 d时,GCEPs的姜黄素保留率为(70.41±1.17)%,仍处于较高保留水平。然而,未包埋的游离姜黄素表现出了极差的稳定性,仅在1 d时间内就损失了约90%;10 d后,超过99%的姜黄素变性分解。冯甜华[26]的实验结果同样也证实了未包埋姜黄素稳定性差这一特点:自然条件下贮存72 h后,游离姜黄素的残量百分比仅有(1.94±0.58)%。综上所述,白地霉的包埋可以显著提高姜黄素的贮存稳定性。

图4 不同贮存时间下GCEPs中的姜黄素和
游离姜黄素的保留率
Fig.4 Retention rates of curcumin in GCEPs and
free curcumin at different storage time
2.3.2 pH对GCEPs稳定性的影响
姜黄素在生理pH条件下极不稳定,在碱性环境中易发生变性和降解,这都导致了姜黄素的生物利用度极低[27]。因此,探究不同pH条件下GCEPs中姜黄素的稳定性对提高姜黄素的生物利用度具有重要意义。根据图5可知,在酸性和弱碱性环境中,GCEPs中的姜黄素可以在长时间内保持稳定,当pH分别为2、4、6、8时,GCEPs中的姜黄素在5 h后的保留率分别为(93.12±0.56)%、(93.87±0.19)%、(91.08±0.74)%和(87.17±2.42)%,均处于较高水平。然而,pH为10和12时,5 h后GCEPs中的姜黄素保留率仅有(41.82±0.56)%和(29.18±0.56)%,与酸性和弱碱性环境的保留率相比发生显著降低(P<0.05)。因此,GCEPs中的姜黄素在酸性、中性和弱碱性环境下可以保持较好的稳定性,但强碱性环境会加速包埋姜黄素的变性与降解。

图5 不同pH条件下GCEPs中姜黄素的
保留率随时间的变化情况
Fig.5 Retention rates of curcumin in GCEPs at different
pH conditions for various incubation time
3 结论
开菲尔源白地霉(G.candidum LG-8)作为包埋材料,可以有效地包埋姜黄素,在最佳包埋条件下,即包埋环境pH 6.5,包埋介质乙醇体积分数45%,真空处理时间20 min,包埋率高达(54.12±1.07)%,具有优秀的包埋性能。同时,经过白地霉包埋后,姜黄素的贮存稳定性和pH稳定性显著增强,尤其是在酸性和弱碱性环境中的稳定性。本文探究了开菲尔源白地霉作为姜黄素包埋载体的可行性,为提高姜黄素的稳定性和生物利用度提供了新思路。
[1] MEHANNY M, HATHOUT R M, GENEIDI A S, et al.Exploring the use of nanocarrier systems to deliver the magical molecule;Curcumin and its derivatives[J].Journal of Controlled Release, 2016, 225:1-30.
[2] 鲍彩彩, 原铂尧, 孙梦娇, 等.姜黄素对小鼠实验性自身免疫性脑脊髓炎的自噬调节及抗炎作用[J].解放军医学杂志, 2019, 44(7):593-599.
BAO C C, YUAN B Y, SUN M J, et al.Autophagy regulation and anti-inflammatory effect of curcumin on the mouse with experimental autoimmune encephalomyelitis[J].Medical Journal of Chinese People′s Liberation Army, 2019, 44(7):593-599.
[3] BORRA S K, MAHENDRA J, GURUMURTHY P, et al.Effect of curcumin against oxidation of biomolecules by hydroxyl radicals[J].Journal of Clinical and Diagnostic Research, 2014, 8(10):1-5.
[4] 赵轶峰, 魏玉磊, 王萍, 等.姜黄素抑制Wnt/β-catenin信号通路诱导乳腺癌细胞凋亡的机制研究[J].现代中西医结合杂志, 2016, 25(29):3 202-3 204;3 306.
ZHAO Y F, WEI Y L, WANG P, et al.Study on the mechanism of curcumin inhibiting the apoptosis of breast cancer cells induced by Wnt/β- catenin signaling pathway[J].Modern Journal of Integrated Traditional Chinese and Western Medicine, 2016, 25(29):3 202-3 204;3 306.
[5] 谢希, 彭雪英, 王叙煌.姜黄素对2型糖尿病模型大鼠胰腺内质网应激PERK-CHOP信号通路的影响[J].国际中医中药杂志, 2020, 42(9):871-875.
XIE X, PENG X Y, WANG X H.Effect of curcumin on endoplasmic Reticulum stress PERK-CHOP signaling pathway in the pancreas of rats in a type 2 diabetes model[J].International Journal of Traditional Chinese Medicine, 2020, 42(9):871-875.
[6] 夏承来, 罗红彬, 严鹏科, 等.姜黄素对HIV-1患者CD4+T细胞TNF-α表达的影响[J].中药材, 2011, 34(8):1 318-1 320.
XIA C L, LUO H B, YAN P K, et al.Effect of curcumin on TNF-α expression in CD4+T cells of HIV-1 patients[J].Journal of Chinese Medicinal Materials, 2011, 34(8):1 318-1 320.
[7] 马榕祯, 吴岩, 陈秀菊, 等.姜黄素预处理缓解小鼠脓毒症心肌病的作用和机制研究[J].中国体外循环杂志, 2020, 18(1):48-54.
MA R Z, WU Y, CHEN X J, et al.Study of the effect of curcumin pretreatment on septic cardiomyopathy and mechanisms in mice[J].Chinese Journal of Extracorporeal Circulation, 2020, 18(1):48-54.
[8] TØNNESEN H H, M SSON M, LOFTSSON T.Studies of curcumin and curcuminoids.XXVII.Cyclodextrin complexation:Solubility, chemical and photochemical stability[J].International Journal of Pharmaceutics, 2002, 244(1-2):127-135.
SSON M, LOFTSSON T.Studies of curcumin and curcuminoids.XXVII.Cyclodextrin complexation:Solubility, chemical and photochemical stability[J].International Journal of Pharmaceutics, 2002, 244(1-2):127-135.
[9] ANAND P, KUNNUMAKKARA A B, NEWMAN R A, et al.Bioavailability of curcumin:Problems and promises[J].Molecular Pharmaceutics, 2007, 4(6):807-818.
[10] 任爽, 董文霞, 刘锦芳, 等.食品运载体系包埋姜黄素的研究进展[J].食品科学, 2021, 42(9):264-274.
REN S, DONG W X, LIU J F, et al.Research progress on food delivery systems for curcumin encapsulation[J].Food Science, 2021, 42(9):264-274.
[11] CIAMPONI F, DUCKHAM C, TIRELLI N.Yeast cells as microcapsules.Analytical tools and process variables in the encapsulation of hydrophobes in S.cerevisiae[J].Applied Microbiology and Biotechnology, 2012, 95(6):1 445-1 456.
[12] 田会婷, 朱晔, 郭呈斌, 等.姜黄素-明胶纳米复合物改善药物水溶性和稳定性的研究[J].河南大学学报(医学版), 2019, 38(1):10-15.
TIAN H T, ZHU Y, GUO C B, et al.Study on improvement on the solubility and stability of curcumin by nanocomplexation with gelatin[J].Journal of Henan University (Medical Science), 2019, 38(1):10-15.
[13] MATHEW A, FUKUDA T, NAGAOKA Y, et al.Curcumin loaded-PLGA nanoparticles conjugated with Tet-1 peptide for potential use in Alzheimer′s disease[J].PLoS One, 2012, 7(3):e32616.
[14] TENG Z, LUO Y C, WANG Q.Nanoparticles synthesized from soy protein:Preparation, characterization, and application for nutraceutical encapsulation[J].Journal of Agricultural and Food Chemistry, 2012, 60(10):2 712-2 720.
[15] XIANG H, SUN-WATERHOUSE D, CUI C, et al.Modification of soy protein isolate by glutaminase for nanocomplexation with curcumin[J].Food Chemistry, 2018, 268:504-512.
[16] PARAMERA E I, KONTELES S J, KARATHANOS V T.Stability and release properties of curcumin encapsulated in Saccharomyces cerevisiae, β-cyclodextrin and modified starch[J].Food Chemistry, 2011, 125(3):913-922.
[17] FIGUEIREDO S, MOREIRA J N, GERALDES C F G C, et al.Yeast cell wall particles:A promising class of nature-inspired microcarriers for multimodal imaging[J].Chemical Communications, 2011, 47(38):10 635.
[18] BOUTROU R, GUÉGUEN M.Interests in Geotrichum candidum for cheese technology[J].International Journal of Food Microbiology, 2005, 102(1):1-20.
[19] BOUTROU R, KERRIOU L, GASSI J Y.Contribution of Geotrichum candidum to the proteolysis of soft cheese[J].International Dairy Journal, 2006, 16(7):775-783.
[20] MENG L, LI Z Y, LIU L Z, et al.Lead removal from water by a newly isolated Geotrichum candidum LG-8 from Tibet ke fir milk and its mechanism[J].Chemosphere, 2020, 259:127507.
[21] 张文佳. 产朊假丝酵母和白地霉混合固态发酵豆渣生产反刍动物饲料的研究[D].哈尔滨:东北农业大学, 2015.
ZHANG W J.Study on solid-state fermented beandreg by Candida utilis and Geotrichum candidum[D].Harbin:Northeast Agricultural University, 2015.
[22] YOUNG S, DEA S, NITIN N.Vacuum facilitated infusion of bioactives into yeast microcarriers:Evaluation of a novel encapsulation approach[J].Food Research International, 2017, 100:100-112.
[23] ELISKASES-LECHNER F, GUÉGUEN M, PANOFF J M.Yeasts and Molds|Geotrichum candidum[M].2nd ed.Paris:Elsevier, 2011.
[24] WANG Y J, PAN M H, CHENG A L, et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].Journal of Pharmaceutical and Biomedical Analysis, 1997, 15(12):1 867-1 876.
[25] KUHN P J, TRINCI A P J, JUNG M J, et al.Biochemistry of Cell Walls and Membranes in Fungi[M].Berlin:Springer, 1991.
[26] 冯甜华. 姜黄素的提纯、稳定性及抗氧化性研究[D].重庆:重庆大学, 2016.
FENG T H.The research on the extraction, purification, stability and antioxidant of curcumin[D].Chongqing:Chongqing University, 2016.
[27] MOHANTY C, SAHOO S K.The in vitro stability and in vivo pharmacokinetics of curcumin prepared as an aqueous nanoparticulate formulation[J].Biomaterials, 2010, 31(25):6 597-6 611.