辣木(Moringa oleifera Lam.)又名鼓槌树、山葵树,属多年生热带落叶乔木,起源于印度和巴基斯坦,现广泛种植于热带和亚热带地区,在我国广东、云南、广西、海南等地均有引种[1]。辣木营养丰富,每100 g辣木叶中富含的维生素C为鲜橘的7倍、维生素A为胡萝卜的4倍、蛋白质为奶粉的2倍、钙为奶粉的4倍、铁为波菜的3倍、钾为香蕉的3倍[2]。然而,在辣木中存在过敏原、生物碱[3]、草酸、皂角苷、辣木素等不利于人体消化吸收的物质[4]及一些不利于微生物生长的抑菌物质。苏科巧[5]研究发现,乳酸菌发酵的辣木中存在抑制乳酸菌生长的物质,并通过乳酸菌驯化达到了预期目的。另外,IJAROTIMI等[6]和郭志鹏等[7]也发现,通过发酵辣木种子可提高辣木粉中的必需氨基酸、脂肪酸、酸溶蛋白等含量。因此,采用生物发酵法降解粗蛋白、草酸是提高辣木营养物质利用率及生物学价值的有效途径。
酵母菌是一群以芽殖为主的单细胞真核微生物,其结构简单,属于真菌类。酵母菌生长的最适温度为25~37 ℃,最适pH值为4.5~5.0[8]。酵母菌的研究及其产品的开发在国外已有很多报道[9-10],吴超等[11]在不同发酵条件下用酵母菌发酵鱼粉,发现粗蛋白和酸溶蛋白的含量显著提高。冯昕炜等[12]以葡萄渣为主要底物接种酿酒酵母和饲料酵母进行发酵,配比为2∶1,发酵时间30 h,结果表明葡萄渣经酵母菌发酵后,营养成分大幅度增加,纤维含量下降。
因此,本实验利用4株酵母菌对辣木液进行发酵,研究酵母菌在辣木液中的生长情况及对辣木中的蛋白质、草酸的降解作用,筛选降解辣木能力强的菌种,从而提高其利用率,为促进辣木产业的发展提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
辣木干粉:300目辣木粉,购于昆明七彩云花生物科技有限公司。
根据酵母菌的不同种属及发酵特性,初选了4株酵母菌:酿酒酵母CICC 1203(酿酒酵母1)、酿酒酵母CICC 1202(酿酒酵母2)、产朊假丝酵母CICC 31188、热带假丝酵母CICC 1253,购于中国工业微生物菌种保藏中心。
1.1.2 培养基及试剂
MRS培养基、麦芽汁培养基、亚甲基蓝均为分析纯,购于北京陆桥;三氯乙酸、草酸、浓硫酸、考马斯亮蓝R250、水合茚三酮、邻苯二甲酸氢钾、丙烯酰胺、甘氨酸、标准蛋白质Marker均为分析纯,购于Sigma公司。
1.2 仪器与设备
KDY-9810凯氏定氮仪,北京市通润源机电技术有限责任公司;DYY-6C电泳仪,北京六一仪器厂;Agilent1100高效液相色谱仪、Diamonsil C18(4.6 mm×250 mm,5 μm),安捷伦科技有限公司;HI99161 pH计,意大利哈纳;121型氨基酸自动分析仪,Beckman。
1.3 实验方法
1.3.1 辣木叶发酵液对酵母菌的影响分析
将准确称量的300目辣木粉与蒸馏水按1∶15的质量比混合均匀,经胶体磨、均质机均质制成辣木液,分装5组各200 mL,经巴氏杀菌后分别按照4%接种量接种2株酿酒酵母、1株产朊假丝酵母、1株热带假丝酵母进行发酵。
将活化好的4株酵母菌分别接种到辣木液与麦芽汁体积比为0∶10、5∶5、10∶0的生长环境中,初步探究未驯化酵母菌在辣木液中的生长情况,为下一步进行酵母菌驯化提供参考。
1.3.2 菌种的驯化
为了提高酵母菌对辣木环境的适应,本实验采用了酵母菌的梯度驯化法[13]。将活化好的4株酵母菌分别接种到5°Bé麦芽汁与辣木粉液体积比为10∶0的培养基中培养,然后以此发酵液作为菌种接种到5°Bé麦芽汁与辣木液体积比为8∶2的培养基中培养,以此方法逐渐增大辣木液的比例,依次完成5 °Bé麦芽汁与辣木液体积比为10∶0、8∶2、6∶4、4∶6、2∶8、0∶10的移种驯化。每个梯度驯化时均以下面3个指标进行测定:(1)酵母菌活菌的测定:参照GB 47892—2010;(2)产酸能力的测定:pH值的测定[14];(3)糖度检测:将发酵完成的辣木发酵液用孔径为80~120 μm的滤纸过滤,然后用手持糖度仪进行检测,对照组为未发酵的辣木液。
1.3.3 酵母菌对辣木的降解情况分析
为了从4株酵母菌中筛选出对辣木液降解能力强的菌株,选择可溶性蛋白、蛋白降解率、总游离氨基酸、蛋白质电泳条带、草酸的变化为指标进行检测。
(1)可溶性蛋白含量的测定
样品可溶性蛋白含量的测定采用考马斯亮蓝比色法。以标准蛋白质质量(μg)为横坐标(X),吸光值为纵坐标(Y),获得标准曲线方程为Y=0.003 7X+0.012 3(R2=0.997 2)。取辣木发酵液6.5 mL至20 mL具塞试管中,70 ℃水浴20 min,再用中速定性滤纸过滤滤液合并至50 mL容量瓶中,并定容至50 mL。取滤液1 mL至15 mL试管中,加入4 mL考马斯亮蓝染液,摇匀,室温放置3 min,在分光光度计上595 nm处比色。
(2)蛋白质降解率的测定[15]
取混匀的辣木发酵液10 mL于20 mL离心管中,加入等量的10%三氯乙酸溶液终止其反应,室温下沉降蛋白5 min,然后经6 000 r/min离心15 min,采用中速定性滤纸过滤上清液,取滤液在280 nm处测定吸光值。
(3)游离氨基酸总量的测定
游离氨基酸总量的测定采用茚三酮显色法[16]。以谷氨酸含量为横坐标(X),吸光度为纵坐标(Y),获得标准曲线方程为Y=0.004 1X-0.019 4(R2=0.994 2)。取样品6.5 mL 70 ℃水浴加热提取15 min,冷却后转入50 mL容量瓶中定容。用试管取样液1 mL,各加1 mL水合茚三铜溶液,保鲜膜封口,在80 ℃水浴中加热15 min,取出用柠檬酸缓冲液稀释至10 mL,分光光度计比色(620 nm、l cm光径的比色皿)。读出吸光度(A)查标准曲线,求出氨基酸总量。
(4)SDS-PAGE蛋白电泳条带的变化分析
本实验采用巴氏杀菌法(65 ℃,30 min)对辣木液进行灭菌并采用SDS-PAGE技术分析酵母菌发酵对辣木蛋白的影响,蛋白提取及电泳操作步骤具体如下:
4株酵母菌发酵液→4 000 r/min,15 min离心→浓缩(55 ℃ 200 mL浓缩至40 mL)→蛋白沉降V(样品)∶V(冰丙酮)=1∶2.5→10 000 r/min, 20 min→去液留沉→蒸干丙酮→蛋白溶解(2 mL tris-HCl 6.8溶解)→混匀→取1.5 mL样液到2 mL离心管中→放入4 ℃冰箱中备用。
SDS-PAGE:参照陶亮[15]的研究方法,配制5×电泳缓冲液、制备电泳样和分离胶。
电泳:浓缩胶电泳条件:50 V恒压约30 min;分离胶电泳条件:120 V恒压约1 h,溴酚蓝跑至凝胶底部,关闭电源。依次对电泳胶片进行30%甲醇固定、考马斯亮蓝染色、自来水脱色、拍照分析。根据SDS-PAGE检测条带数量和强弱,分析蛋白的降解情况。
(5)草酸降解情况分析
本实验采用HPLC法测定辣木发酵液中的草酸含量。
色谱条件:Agilent C18色谱柱(4.6 mm×250 mm,5 μm)流动相为0.2%磷酸水溶液甲醇[V(甲醇)∶V(磷酸水溶液)=2∶98],流速为0.4 mL/min,检测波长为197 nm,柱温25 ℃。
样品的制备与处理:准确称取辣木粉5份(编号0、1、2、3、4,m=6.670 0 mg),分别加100 mL纯净水溶解,并制备发酵液。从5组样品中分别用移液管准确量取30 mL的混合液,然后分别量取0.5 mL 的浓HCl,加入30 mL的样品中,在50 ℃水浴锅中加热30 min,中间摇动几次,冷却后放入高速匀浆机离心2次,将提取液过滤,吸取过滤液过微孔滤膜(0.45 μm),收集1 mL滤液至HPLC检测瓶中。根据色谱峰与标准品的峰面积比较,最终计算出草酸含量。
1.3.4 数据处理与统计分析
每个处理重复3次,所有试验均进行3次平行实验,并运用绘图软件Origin 2018作图,对测定的数据进行显著性比较分析。
2 结果与分析
2.1 酵母菌对辣木的适应情况
由表1可知,在未添加辣木液的麦芽汁环境中,4株酵母菌的长势较好,均达到了≥1×108 CFU/mL,其中,酿酒酵母1和热带假丝酵母的活菌数相对较高。当等量添加辣木液与麦芽汁作为培养基时,4株酵母菌的活菌数均在一定程度上降低。当100%辣木液作为培养基时,4株酵母菌的活菌数进一步降低,但产朊假丝酵母和热带假丝酵母的活菌数较高,2株酿酒酵母相对较差。可能是因为酵母菌不适应辣木液的生长环境造成的。为保证酵母菌的生长增殖,还需对酵母菌进一步驯化。
表1 适应辣木生长环境的酵母菌活菌数 单位:CFU/mL
Table 1 The number of viable yeasts adapted to the
growth environment of Moringa

V(辣木)∶V(麦芽汁)酿酒酵母1酿酒酵母2产朊假丝酵母热带假丝酵母空白对照0∶104.9×1081.02×1082.83×1084.66×10805∶51.87×1075.04×1063.72×1076.84×107010∶03.7×1042.14×1043.24×1053.35×1050
2.2 酵母菌的驯化
2.2.1 驯化对酵母菌活菌数的影响
由表2可知,随着辣木液占比增加,4株酵母菌的总体生长呈先降低后逐渐增长的趋势。辣木液与麦芽汁的体积比在0∶10时,4株酵母菌的生长均处于顶峰。随着辣木液配比增加,直到体积比为4∶6和6∶4时,酵母菌的生长达到最低,其中产朊假丝酵母和热带假丝酵母的生长略好,达到106 CFU/mL。继续增大辣木液比例至10∶0时,4株酵母菌的长势均≥4×106CFU/mL,与未驯化的酵母菌相比均有较大的提高。推测可能是因为随着梯度驯化的进行,酵母菌对辣木液环境逐步适应,所以酵母菌的活菌数均>4×106 CFU/mL。
表2 酵母菌梯度驯化活菌数
Table 2 The living yeast number of gradient domestication
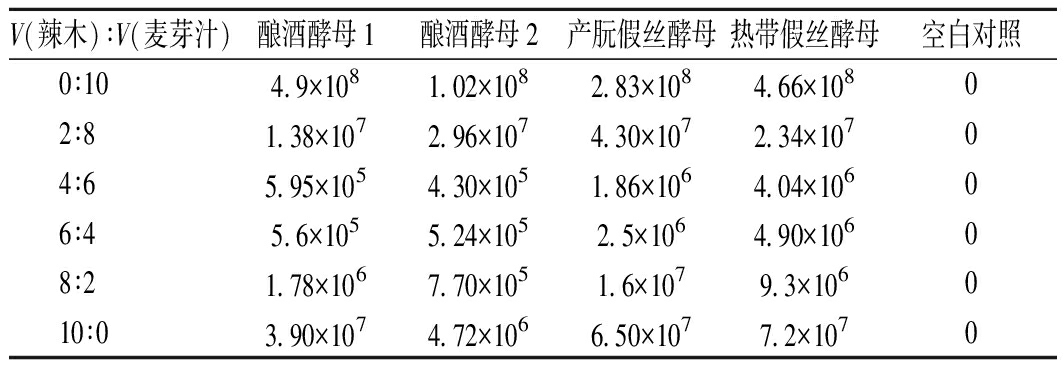
V(辣木)∶V(麦芽汁)酿酒酵母1酿酒酵母2产朊假丝酵母热带假丝酵母空白对照0∶104.9×1081.02×1082.83×1084.66×10802∶81.38×1072.96×1074.30×1072.34×10704∶65.95×1054.30×1051.86×1064.04×10606∶45.6×1055.24×1052.5×1064.90×10608∶21.78×1067.70×1051.6×1079.3×106010∶03.90×1074.72×1066.50×1077.2×1070
2.2.2 产酸能力的变化
由图1可知,酵母菌的发酵对不同梯度比的培养基均有一定的降解作用。随着辣木液占比增加,酵母菌的产酸能力呈现一个上升的趋势。4株酵母菌在体积比0∶10时的产酸能力为产朊假丝酵母>酿酒酵母1>热带假丝酵母>酿酒酵母2,但随着辣木液含量的增加,在体积比10∶0时产酸能力为热带假丝酵母>酿酒酵母1>酿酒酵母2>产朊假丝酵母,产朊假丝酵母由4株酵母菌中产酸能力最强转变到产酸能力最弱,说明产朊假丝酵母不适宜进行辣木发酵,而热带假丝酵母从体积比4∶6开始逐渐适应辣木的环境,表现出产酸能力相对较强的现状。

图1 驯化过程中pH值的变化
Fig.1 Changes of pH value in domesticated group
2.2.3 糖度的影响
由图2可知,4株酵母菌降低糖度的效果大体一致。在体积比0∶10时降低糖度的能力为产朊假丝酵母>酿酒酵母1>热带假丝酵母>酿酒酵母2。在体积比10∶0时降低糖度的能力为热带假丝酵母>产朊假丝酵母>酿酒酵母1>酿酒酵母2。随着辣木液含量的增多,4株酵母菌糖度不同程度的降低,且热带假丝酵母和产朊假丝酵母更有利于辣木中糖度的降解。可能是因为辣木中的糖不足以满足辣木的生长,所以导致不同梯度比的培养基中的糖度都降低。
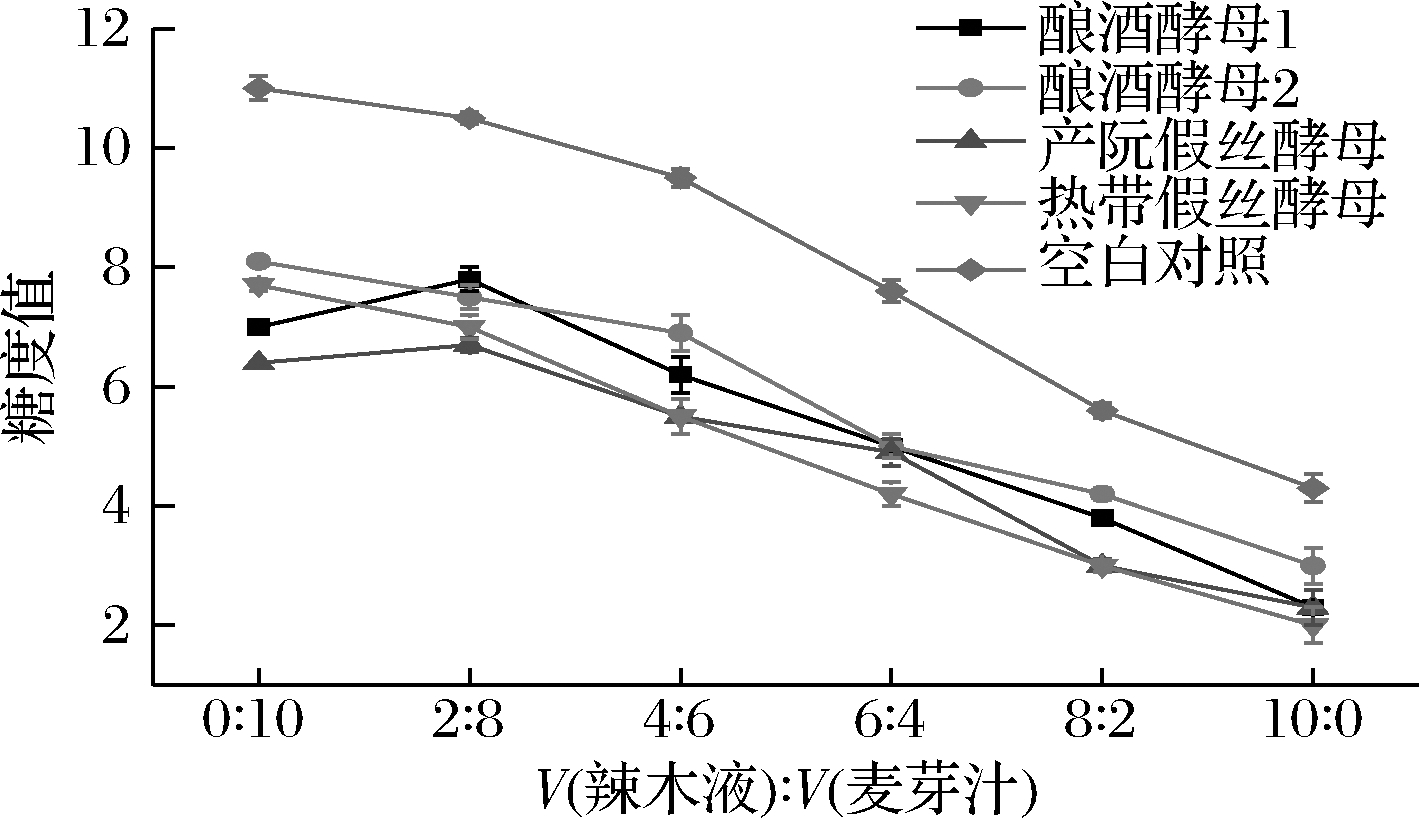
图2 驯化过程中糖度值的变化
Fig.2 Changes of sugar degree value in domesticated group
综上,用增大麦芽汁中辣木液含量比例的方法驯化菌种对酵母菌的生长、产酸及糖度的降解产生了影响,使得原本不适应辣木液环境的菌种逐渐适应,产酸效果较好。
2.3 酵母菌对辣木液的降解情况
2.3.1 可溶性蛋白的含量
由图3可知,未发酵的辣木液中的可溶性蛋白含量在34.51 mg/mL左右,经4株酵母菌发酵的辣木液,其可溶性蛋白的含量均有增加,大体呈现先升高后降低的趋势。1~3 d 4株酵母菌均呈上升趋势,其中热带假丝酵母在第3天时产生的可溶性蛋白最多,为64.41 mg/mL,说明此阶段热带假丝酵母发酵产可溶性蛋白的能力最强。3 d以后,4株可溶性蛋白的含量均有下降的趋势,说明酵母菌溶出蛋白的能力降低或者自身代谢所需的氮源含量增多。SOHAIB等[17]为了改善辣木食品的营养特性,用短小芽孢杆菌CICC 10440发酵辣木叶粉,24 h后发现可溶性蛋白含量达到最大值。这与本研究结论相似,表明微生物发酵可以提高辣木中可溶性蛋白的含量。

图3 酵母菌对可溶性蛋白的降解情况
Fig.3 The degradation of soluble protein for yeast
2.3.2 蛋白质的降解率
由图4可知,4株酵母菌的降解率均大于未处理的辣木液,说明酵母菌对辣木液有不同程度的降解。随着发酵时间的延长,各株酵母菌发酵的辣木液降解率大致呈现逐步升高再降低的趋势。发酵3 d时,酵母菌对辣木液的降解作用达到了顶端,降解作用大小顺序为热带假丝酵母>产朊假丝酵母>酿酒酵母1>酿酒酵母2>空白对照,而酿酒酵母2有降低的趋势。当发酵3 d后,吸光值呈现下降趋势,可能是因为大部分辣木的营养成分及降解的小分子如单糖、氨基酸等作为酵母菌的生长因子而被利用。

图4 酵母菌对蛋白的降解率
Fig.4 The protein degradation for yeast
2.3.3 总游离氨基酸含量
由图5可知,随着酵母菌的生长,4种酵母菌一般在第3天时氨基酸的含量达到最大,热带假丝酵母的氨基酸含量达到398.732 mg/100g;在第7天时氨基酸含量最小,酿酒酵母1的氨基酸含量最低,为105.171 mg/100g。张云娟等[18]的研究表明,不同发酵时间对辣木叶中游离氨基酸总量的影响是显著的,发酵前辣木叶中游离氨基酸总量仅为22.28%,之后一直显著増加(P<0.05),发酵12 d时,其含量增加到34.27%,之后増加趋于平缓。由此可知,不同发酵时间,酵母菌对游离氨基酸的降解情况是不一样的,其中最适酵母菌发酵辣木液的时间为3 d左右。

图5 酵母菌对游离氨基酸的降解情况
Fig.5 The degradation of yeast on free amino acid
2.3.4 蛋白质的降解情况
由图6可知,对比未发酵的辣木液,采用4株酵母菌发酵的辣木液蛋白电泳条带均有不同程度的减弱甚至消失,说明酵母菌发酵对辣木蛋白产生了较好的降解作用。辣木叶中的蛋白种类多,而主要蛋白分子质量集中在70、20、10 kDa及以下。酿酒酵母1和酿酒酵母2的光密度在4株酵母菌中最大,但较未发酵的有所降低,38 kDa附近的蛋白条带完全消失,20 kDa附近的蛋白条带均变浅。产朊假丝酵母的光密度次之,70 kDa附近的2条蛋白条带变浅,38 kDa附近的蛋白条带完全消失,<15 kDa的蛋白条带颜色变深,说明产朊假丝酵母将大分子蛋白降解成了小分子的蛋白。热带假丝酵母的光密度最小,所有蛋白条带颜色均变浅,且20~70 kDa的蛋白条带几乎全部消失,<10 kDa的蛋白条带最少,说明热带假丝酵母的降解能力较强,可以将大分子蛋白降解成小肽和氨基酸。有研究表明,辣木籽经益生菌发酵后,能够显著增加维生素、氨基酸、小肽等营养物质的含量,降解抗营养因子[19-20],提高发酵物的营养价值和口感风味[21-23],这与本研究结论相似。
2.3.5 草酸含量的降解情况
由图7可知,空白组的峰面积为1 037.60 mAU·s,4株酵母菌的峰面积依次为431.78、24.53、313.32、310.37 mAU·s,得出空白组草酸含量5.34 mg/g,发酵组2.25、1.97、1.64、1.62 mg/g。根据数据可知,酵母菌发酵可以明显降低草酸的含量且热带假丝酵母降解草酸的能力最强,降解率达70%左右,降解能力依次为热带假丝酵母>产朊假丝酵母>酿酒酵母菌2>酿酒酵母菌1>空白组。李凌飞等[24]的研究发现,酵母菌对辣木粉中的草酸有很好的降解效果,可运用于降低辣木粉中的草酸含量,进而降低食用辣木而引发的结石风险。因此,可以利用热带假丝酵母发酵辣木,从而最大程度的提高人们对辣木营养成分的消化吸收。

1-蛋白标样(10~170 kDa);2~6-未发酵辣木液、酿酒酵母菌1发酵辣木液、
酿酒酵母菌2发酵辣木液、产朊假丝酵母发酵辣木液、热带假丝酵母辣木发酵液
图6 酵母菌发酵辣木的蛋白电泳图
Fig.6 Protein electrophoresis of Moringa fermented liquid for yeast

A~E-空白组、酿酒酵母菌1、酿酒酵母菌2、产朊假丝酵母、热带假丝酵母4株不同菌种的发酵液在7.421 min时检测的峰值
图7 四株酵母菌对草酸的降解情况
Fig.7 The degradation of oxalic acid for the four strains of yeast
3 讨论与结论
本实验利用酵母菌对辣木进行发酵,发现若将不同的酵母菌直接接种到辣木液中进行发酵,则酵母菌活菌数会大幅度下降,究其原因是辣木中含有4-(a-2-鼠李糖基氧)-苯异硫氛酸盐等抑菌成分,不利于酵母菌的生长。苏科巧[5]的研究证明对菌株进行驯化会提高菌株的适应能力。于是对4株酵母菌进行驯化,发现热带假丝酵母菌在辣木液环境中适应能力优于其他3株酵母菌,且发酵液中的可溶性蛋白、氨基酸含量都有显著增加,另外,发酵第3天时,热带假丝酵母菌对草酸或草酸盐的降解能力最强,可以降解70%以上的草酸。王欣宇[25]的研究表明,利用微生物发酵技术可以将原料中所含的多种难以吸收的营养物质经过降解或合成,产生利于消化、吸收的高营养物质成分。徐丹等[26]对桑叶进行发酵,发现发酵桑叶的营养价值、蛋白含量都得到了提高。王宪波[27]利用酵母对辣木进行发酵,得到辣木基料。当然,发酵不仅仅局限于酵母菌,目前还有利用细菌和霉菌对底物进行发酵的,如王田田等[28]、石鸿辉等[29]、JOUNG等[30]的研究。然而,能够降解辣木中草酸含量的菌种,目前报道的只有酵母菌。
通过对4株酵母菌进行驯化,使其适应辣木液环境,发现热带假丝酵母菌对辣木中蛋白质、草酸的降解效果均优于其他酵母菌,可以降解70%以上的草酸,减轻辣木的苦辣味、改善口感,显著提高辣木营养物质的利用率,有利于促进辣木产业发展。
[1] 周丹蓉, 王小安, 叶新福, 等.辣木氨基酸分析与营养评价研究[J].热带作物学报, 2017, 38(2):278-282.
ZHOU D R, WANG X A, YE X F, et al.Moringa amino acid analysis and nutritional evaluation research[J].Chinese Journal of Tropical Crops, 2017, 38(2):278-282.
[2] 郭妍. 辣木叶植物化学物质分析及体外生物活性研究[D].昆明:昆明理工大学, 2018.
GUO Y.Moringa leaf phytochemical analysis and in vitro biological activity study[D].Kunming:Kunming University of Science and Technology, 2018.
[3] LIU Y, WANG X Y, WEI X M, et al.Values, properties and utility of different parts of Moringa oleifera:An overview[J].Chinese Herbal Medicines,2018,10(4):371-378.
[4] QI N L, GONG X, FENG C P, et al.Simultaneous analysis of eight vitamin E isomers in Moringa oleifera Lam.leaves by ultra performance convergence chromatography[J].Food Chemistry, 2016, 207:157-161.
[5] 苏科巧. 乳酸菌发酵剂对辣木蛋白质的降解作用研究[D].昆明:云南农业大学, 2015.
SU K Q.Study on the degradation of Moringa protein by lactic acid bacteria starter[D].Kunming:Yunnan Agricultural University, 2015.
[6] IJAROTIMI O S, ADEOTI O A, ARIYO O.Comparative study on nutrient composition, phytochemical, and functional characteristics of raw, germinated, and fermented Moringa oleifera seed flour[J].Food Science and Nutrition,2013, 1(6):452-463.
[7] 郭志鹏, 夏学森, 黄文琪, 等.多菌种分步发酵提高辣木籽粕蛋白含量及酶活[J].中国酿造, 2020, 39(6):37-42.
GUO Z P, XIA X S, HUANG W Q, et al.Stepwise fermentation of multi-strains to increase protein content and enzyme activity of Moringa seed meal[J].China Brewing, 2020, 39(6):37-42.
[8] 于景之. 酵母生产与应用手册[M].北京:中国轻工业出版社, 2005:37.
YU J Z.Yeast Production and Application Manual[M].Beijing:China Light Industry Press, 2005:37.
[9] GILL H S.Stimulation of the immune system by lactic cultures [J].International Dairy Science,1998, 8:535-544.
[10] SANDERS M E.Development of consumer probiotics for the US market [J].British Journal of Nutrition, 1998, 80(4):213-218.
[11] 吴超, 韩信, 程茂基.酵母菌发酵劣质鱼粉的工艺参数研究[J].安徽农业大学学报, 2015, 42(2):228-232.
WU C, HAN X, CHENG M J.Study on the process parameters of inferior fishmeal fermentation by yeast[J].Journal of Anhui Agricultural University, 2015, 42(2):228-232.
[12] 冯昕炜, 许贵善, 刘昱成.酵母菌发酵葡萄渣发酵效果研究[J].江苏农业科学, 2012, 40(2):222-223.
FENG T W, XU G S, LIU Y C.Research on the fermentation effect of yeast fermented grape pomace[J].Jiangsu Agricultural Sciences, 2012, 40(2):222-223.
[13] 陈妍, 刘婷, 毛斌, 等.硒浓度梯度驯化结合紫外诱变法选育富硒酵母菌研究[J].粮食与饲料工业, 2016(4):55-59.
CHEN Y, LIU T, MAO B, et al.Study on the selection of selenium-enriched yeast by selenium concentration gradient domestication combined with ultraviolet mutagenesis[J].Cereal and Feed Industry, 2016(4):55-59.
[14] 国家卫生和计划生育委员会. GB 5009.237—2016食品pH值的测定 [S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.237—2016 Determination of food pH value [S].Beijing:China Standard Press, 2016.
[15] 陶亮. 贯筋藤蛋白酶的特性及其凝乳机理初探[D].昆明:云南农业大学, 2014.
TAO L.The characteristics of the protease and the mechanism of curdling the vine protein[D].kunming:Yunnan Agricultural University, 2014.
[16] 刘长姣, 杨越越, 王妮, 等.茚三酮比色法测定秋葵中氨基酸含量条件的优化[J].中国食品添加剂,2018,14:187-193.
LIU C J, YANG Y Y, WANG N, et al.Optimization of ninhydrin colorimetric method for determination of amino acids in Okra[J].China Food Additives, 2018(1):187-193.
[17] SOHAIB M, ANJUM F M, SAHAR A, et al.Antioxidant proteins and peptides to enhance the oxidative stability of meat and meat products:A comprehensive review[J].International Journal of Food Properties, 2017, 20(11):2 581-2 593.
[18] 张云娟, 田洋, 周学, 等.辣木叶毛霉固态发酵过程中主要营养成分及其抗氧化活性的动态变化研究[J].西南农业学报, 2019, 32(8):1 773-1 778.
ZHANG Y J, TIAN Y, ZHOU X, et al.Study on the dynamic changes of main nutrients and antioxidant activity of Moringa oleifera during solid-state fermentation[J].Journal of Southwest Agricultural Sciences, 2019, 32(8):1 773-1 778.
[19] 王飒爽, 庞清刚, 刘倩, 等.菜籽粕发酵脱毒菌种的筛选及在猪饲料中的应用[J].黑龙江畜牧兽医, 2019(16):133-135.
WANG S S, PANG Q G, LIU Q, et al.Screening of detoxified strains of rapeseed meal fermentation and its application in swine feed[J].Heilongjiang Animal Science and Veterinary Medicine, 2019(16):133-135.
[20] 石鸿辉, 廖嘉明, 李悦, 等.木本饲料在猪生产中的饲用价值及其抗营养因子的处理技术[J].草业科学, 2018, 35(6):1 556-1 567.
SHI H H, LIAO J M, LI Y, et al.Feeding value of woody feed in pig production and its anti-nutritional factor treatment technology[J].Pratacultural Science, 2018, 35(6):1 556-1 567.
[21] NAMKUNG H, LI J G M, YU H, et al.Impact of feeding blends of organic acids and herbal extracts on growth performance, gut microbiota and digestive function in newly weaned pigs[J].Canadian Journal of Animal science, 2004, 84(4):697-704.
[22] CHAVEERACH P, KEUZENKAMP D A, URLINGS H A, et al.In vitro study on the effect of organic acids on Campylobacter jejuni/coli populations in mixtures of water and feed[J].Poultry Science, 2002, 81(5):621-628.
[23] PARTANEN K H, MROZ Z.Organic acids for performance enhancement in pig diets[J].Nutrition Research Reviews, 1999, 12(1):117-145.
[24] 李凌飞, 龚加顺, 和劲松, 等.一种辣木叶中草酸的降解方法及应用:中国,CN110024938A[P].2019-07-19.
LI L F, GONG J S, HE J S, et al.Degradation method and application of oxalic acid in Moringa leaves:China:CN110024938A[P].2019-07-19.
[25] 王欣宇. 地衣、枯草芽孢杆菌产酶能力分析及在辣木叶发酵中的应用[D].广州:华南农业大学,2018.
WANG X Y.Analysis of enzyme production capacity of lichen and Bacillus subtilis and their application in Moringa leaf fermentation[D].Guangzhou:South China Agricultural University, 2018.
[26] 徐丹, 唐子婷, 王雪丹, 等.发酵桑叶生物活性成分含量变化研究[J].饲料研究,2017(20):45-49.
XU D, TANG Z T, WANG X D, et al.Study on the changes of bioactive components in fermented mulberry leaves[J].Feed Research,2017(20):45-49.
[27] 王宪波. 一种辣木果酒的制作方法:中国,CN103923806A[P].2015-12-09.
WANG X B.A method of making Moringa oleifera wine:China,CN103923806A[P].2015-12-09.
[28] 王田田, 汪腾蛟, SAYTHON, 等.菌、酶协同发酵对辣木茎叶粉的营养价值及抗氧化活性的影响[J].黑龙江畜牧兽医,2020(12):117-121.
WANG T T, WANG T J, SAYTHON, et al.The effect of synergistic fermentation of bacteria and enzymes on the nutritional value and antioxidant activity of Moringa stalk and leaf powder[J].Heilongjiang Animal Science and Veterinary Medicine, 2020(12):117-121.
[29] 石鸿辉, 苑广伟, 廖正睿, 等.不同菌种发酵对辣木茎叶粉的营养价值及其抗氧化活性的影响[J].食品工业科技,2019,40(9):91-97;104.
SHI H H, YUAN G W, LIAO Z R, et al.Effects of fermentation of different strains on the nutritional value and antioxidant activity of Moringa stalk and leaf powder[J].Science and Technology of Food Industry,2019,40(9):91-97;104.
[30] JOUNG H, KIM B, PARK H, et al.Fermented Moringa oleifera decreases hepatic adiposity and ameliorates glucose intolerance in high-fat diet-induced obese mice[J].Journal of Medicinal Food,2017,20(5):439-447.