聚对苯二甲酸乙二醇酯/低密度聚乙烯(polyethylene terephthalate/low-density polyethylene,PET/LDPE)复合膜具有良好的阻隔性和力学性能,被广泛应用于食品包装,其中LDPE膜因具有良好的热封性被用作复合膜内层基材[1],在包装食品过程中与食品直接接触。塑料包装材料容易氧化而硬化、失去光泽,抗氧化剂的加入可以改善塑料的物理化学性能,延长其使用寿命[2-3]。抗氧化剂1076和抗氧化剂168是最具代表性的主抗氧化剂和辅助抗氧化剂[4],因与塑料的相容性较好且抗氧化效果良好而被广泛应用[5]。2,4-二叔丁基酚(2,4-di-tert-butylphenol,2,4-DTBP)被用作抗氧剂、紫外线吸收剂等的中间体[6],是天然抗氧化剂,具有很好的抗氧化作用[7-8]。
在包装材料与食品接触过程中,抗氧化剂可能会迁移至食品,对人们的健康造成危害[9-10]。目前,食品接触用塑料材料中的抗氧化剂的检测方法主要包括气相色谱法[11-12]、气相色谱-质谱法[13-14]、液相色谱法[2, 15-17]、液相色谱-质谱法[18]等。现存的检测方法存在检出限高的缺点,如LI等[17]建立了抗氧剂和紫外吸收剂的高效液相色谱检测方法,其中抗氧剂1076、抗氧剂168的检出限是300 μg/L;张宁等[18]利用LC-MS/MS检测抗氧剂和塑化剂的迁移水平,其中抗氧剂1076、抗氧剂168、2,4-DTBP的检出限分别是80、80、40 μg/L。另外,大量学者从不同角度研究了单层塑料膜中的抗氧剂的迁移行为[19-24],基于多层复合膜的抗氧剂的迁移行为研究报道较少。
本工作在前期研究的基础上,建立了用LC-MS/MS检测抗氧剂1076、抗氧剂168、2,4-DTBP的方法,3种抗氧剂的检出限(limit of detection,LOD)为0.2 μg/L,定量限(limit of quantification,LOQ)均≤0.8 μg/L,显著低于现有方法;研究了PET/LDPE复合膜中3种抗氧剂向异辛烷及95%(体积分数,后同)乙醇的迁移行为,并基于实验数据计算扩散系数,为后续研究提供依据,完善多层复合材料中抗氧剂的迁移研究。
1 材料与方法
1.1 材料与试剂
标准品:抗氧剂1076(>98.8%),北京曼哈格生物科技有限公司;抗氧剂168(>99.9%),坛墨质检科技股份有限公司;2,4-DTBP(>99%),上海叶源生物科技有限公司。抗氧剂(用于制备复合膜):抗氧剂1076(>98%)、抗氧剂168(>98%)、2,4-DTBP(纯度>97%),上海麦克林生化科技有限公司;LDPE母粒(密度:0.920 g/cm3,熔点:112 ℃),美国陶氏集团;PET膜(密度:1.40 g/cm3;厚度:25 μm),苏州东轩塑料制品有限公司;甲醇、无水乙醇、二氯甲烷(色谱纯),美国Tedia公司;异辛烷(色谱纯),美国Thermo Fisher Scientific公司。
1.2 仪器与设备
DGU-20A液相色谱仪、QP2010plus气相色谱-质谱联用仪(gas chromatography mass spectrometry,GC-MS),日本岛津公司;QTRAP5500三重四级杆质谱仪,美国AB SCIEX公司;MEDU-22/40双螺杆挤出造粒机,广州市普同实验分析仪器有限公司;JYL-30小型流延机,佛山市金中河机械有限公司;K202涂布机,英国RK公司;KQ-400KDV数控超声波清洗仪,昆山市超声仪器有限公司;KL512 J数控恒温水浴氮吹仪,北京康林科技有限公司;ML203T天子分析天平,梅特勒-托利多仪器(上海)有限公司;Milli-Q Integral 10超纯水机,美国密理博公司;SS75不锈钢试验池,福建出入境检验检疫局。
1.3 实验方法
1.3.1 复合膜的制备
将m(LDPE母粒)∶m(抗氧剂1076)∶m(抗氧剂168)∶m(2,4-DTBP)=98.5∶0.5∶0.5∶0.5均匀混合,用双螺杆挤出造粒机进行2次混合造粒,造粒机料筒1~9区的温度分别为150、150、155、155、160、160、165、165、170和170 ℃。造粒完成后,使用小型流延机流延厚度为(25±3) μm的LDPE膜,小型流延机挤出区、合流区和模具区温度分别为185、195和195 ℃。不含3种抗氧剂的空白LDPE膜以同样方法和条件制备,2种膜分别命名为0.5%(质量分数,下同)-LDPE、bk-LDPE。
利用涂布机将水性丙烯酸酯胶粘剂均匀地涂在PET膜上,再利用一定的压力将LDPE膜与PET膜复合,随后放置在45 ℃恒温箱中干燥处理36 h,将制得的2种复合膜命名为0.5%-PET/LDPE和bk-PET/LDPE。
1.3.2 标准溶液的配制
以甲醇为溶剂配制标准溶液:分别准确称取抗氧剂1076、抗氧剂168、2,4-DTBP的标准品10.0 mg(精确至0.1 mg)于10 mL容量瓶中,抗氧剂1076、抗氧剂168用少量二氯甲烷溶解,用甲醇定容,2,4-DTBP用甲醇溶解并定容,配成质量浓度为1 000 mg/L的标准储备溶液,置于冰箱-20 ℃保存。
以异辛烷为溶剂配制标准溶液:分别准确称取抗氧剂1076、抗氧剂168、2,4-DTBP的标准品10.0 mg(精确至0.1 mg)于10 mL容量瓶中,用异辛烷溶解并定容,配成质量浓度为1 000 mg/L的标准储备溶液,置于冰箱-20 ℃保存。
1.3.3 膜中抗氧剂的初始含量测定
将薄膜剪碎并称取0.05 g于锥形瓶,加入20 mL甲醇,在35 ℃条件下进行80 min超声萃取,重复萃取2次,合并两次萃取液,取一定量萃取液用甲醇稀释,用0.22 μm玻璃针式过滤器过滤后,待LC-MS/MS检测。实验设置3个平行,同时做空白对照。3种抗氧剂的初始含量按公式(1)计算。
(1)
式中:m,膜中抗氧剂的初始含量,μg/g;M1,膜中抗氧剂的质量,μg;M2,膜的质量,g;ρ检测,萃取液中抗氧剂的浓度,μg/L;V萃取,萃取液的体积,L;N,稀释倍数。
1.3.4 迁移实验
根据文献报道,研究的3种抗氧剂几乎不向水性模拟物迁移、在低浓度乙醇中迁移量较少,容易向脂性食品模拟物迁移[25-26]。根据GB 31604.1—2015[27],选择异辛烷和95%乙醇作为脂性食品模拟物进行迁移实验。其中,用LC-MS/MS检测异辛烷中抗氧剂的迁移量前需要对异辛烷进行氮吹、复溶处理。由预实验发现,在前处理过程抗氧化剂168的加标回收率只有44.1%~56%,不满足实验要求,因此用GC-MS检测异辛烷中抗氧剂168的迁移量。
将0.5%-LDPE膜和0.5%-PET/LDPE膜安装在直径为75 mm的迁移池上,分别向迁移池中加入74 mL异辛烷或95%乙醇,LDPE层与食品模拟物接触,将迁移池密封好放入预先设置好温度的烘箱。对于0.5%-PET/LDPE膜中3种抗氧剂向2种模拟液迁移的实验,实验温度选择了20、40、60、70 ℃,每隔一定时间从迁移池中取0.5 mL迁移液进行预处理,待LC-MS/MS和GC-MS检测;对于0.5%-LDPE膜、0.5%-PET/LDPE膜中3种抗氧剂的特定迁移实验,实验条件选择40 ℃、10 d和70 ℃、2 h[25],预实验发现,在40 ℃条件下,3种抗氧剂在72 h内就达到了迁移平衡状态,因此实验条件设定为40 ℃、72 h和70 ℃、2 h。迁移结束后,对于95%乙醇迁移液,经甲醇稀释,过滤,待LC-MS/MS检测。对于异辛烷迁移液,将其分为2份,其中200 μL用氮吹仪吹至近干,加入甲醇复溶、稀释,过滤,待LC-MS/MS检测其中的抗氧剂1076、2,4-DTBP的迁移量,剩余300 μL过滤后,待GC-MS检测其中的抗氧剂168的迁移量。每组实验设置3个平行,同时做空白对照。迁移量和迁移率分别按公式(2)和公式(3)计算。
(2)
(3)
式中:Mmigration,抗氧化剂的迁移量,μg/cm2;M3,迁移液中抗氧化剂的质量,μg;S,膜与食品模拟物接触面积,44.15 cm2;ρi,食品模拟物中抗氧化剂的质量浓度,μg/L;Vi,食品模拟物的体积,L;N,稀释倍数;Mr,迁移率,%;M4,面积为44.15 cm2的膜中抗氧化剂的质量,μg;m,膜中3种抗氧剂初始含量,μg/g;m膜,面积为44.15 cm2的膜的质量,g。
1.3.5 LC-MS/MS条件
色谱条件。色谱柱:Shim-pack XR-ODSⅢ(1.6 μm,2.0 mm×75 mm);柱温:40 ℃;流动相A为超纯水,流动相B为甲醇,流速0.3 mL/min;进样量:5 μL;负离子模式洗脱梯度:0~5 min,90%B~100%B;5~9.5 min,100%B;9.5~10 min,100%B~90%B,10~11 min,90%B;正离子模式洗脱梯度:0~6.8 min,100%B。
质谱条件。离子源:电喷雾离子源;电喷雾电压:正离子模式5 500 V,负离子模式4 500 V;雾化气压力:55 kPa;气帘气压力:35 kPa;辅助气流速:55 kPa;离子源温度:600 ℃。扫描方式:正负离子扫描;检测方法:多反应检测;4种添加化合物的碰撞电压、去簇电压和碰撞室出口电压见表1。
表1 三种抗氧化剂的质谱参数
Table 1 Mass spectrometric parameters of three antioxidants

化合物保留时间/min母离子子离子碎裂电压/V碰撞能量/eV碰撞室射出电压/V2,4-DTBP1205.1189.1∗/173.1-160-32.75/-48.01-11.95/-14.68抗氧剂10768.5529.2267.2∗/269.2-90-51.15/-39.39-24.94/-13.05抗氧剂1684.9647.5147.1/291.2∗5053.14/55.8718.65/22.29
注:*为定量离子
1.3.6 GC-MS条件
GC-MS条件参照杨岳平等[14]建立的方法。
1.4 扩散系数计算
利用从Fick第二定律所推导出的Crank数学模型[28][公式(4)、公式(5)],将3种抗氧剂的迁移实验数据进行拟合,计算迁移扩散系数:
(4)
(5)
式中:D,抗氧剂的扩散系数,cm2/s;MF,t,t时刻食品模拟物中抗氧剂的迁移量,μg/cm2;MF,∞,迁移达到平衡状态时食品模拟物中抗氧剂的迁移量,μg/cm2;L,单侧迁移时薄膜的厚度,cm;VP、VF,聚合物、食品模拟物的体积,L;W0,聚合物中抗氧剂的初始含量,μg;WF,∞,迁移达到平衡时食品模拟物中抗氧剂含量,μg;qn,方程tanqn=-αqn的正根;KP,F,抗氧剂在聚合物/食品体系中的分配系数。
1.5 数据统计与分析
利用Microsoft Excel和Origin 8.0软件对数据结果进行统计分析、作图和数据显著性分析(P<0.05),利用MatLab 2018a软件将实验数据拟合于Crank模型,计算扩散系数。
2 结果与分析
2.1 质谱条件优化
用50%(体积分数,后同)甲醇溶液分别配制浓度为500 μg/L的抗氧剂1076、抗氧剂168、2,4-DTBP标准溶液,采用流动注射泵连续进样方式,选择ESI+/ESI-扫描模式分别对3种抗氧剂标准溶液进行全扫描,确定准分子离子峰Q1,优化锥孔电压;然后以Q1为母离子,对其子离子进行扫描,选取丰度最大的2个离子作为子离子,其中丰度较大的作为定量离子,离子丰度相对较小的作为定性离子,并对碰撞能量进行优化,最终参数见表1。
2.2 线性方程、检出限与定量限
用甲醇配制质量浓度分别为5、10、20、40、80、120、240 μg/L的3种抗氧剂混合标准工作溶液,用异辛烷配制质量浓度为0.5、1、2、4、8、16 mg/L的抗氧剂168标准工作溶液,以定量离子峰面积为纵坐标,对应的质量浓度为横坐标,绘制标准曲线。由表2可知,3种抗氧剂定量离子峰面积与其质量浓度在一定范围内呈良好的线性关系,相关系数均大于0.998。以信噪比(S/N)不低于3计算LOD,以S/N≥10计算LOQ,具体数值见表2。
表2 三种抗氧剂的线性参数、检出限与定量限
Table 2 Linear parameter, LOD and LOQ of three antioxidants

化合物溶剂线性方程线性范围/(μg·L-1)相关系数(r)LOD/(μg·L-1)LOQ/(μg·L-1)2,4-DTBP甲醇y=9.15E4x+4.53E45~2400.999 60.20.6抗氧剂1076甲醇y=3.72E4x+8.93E45~2400.999 90.20.8抗氧剂168甲醇y=1.66E4x+71.5E510~160 0.998 90.20.6异辛烷y=7.2E4x+1.2E4 500~16 0000.998 02.58.5
注:用异辛烷配制的抗氧剂168标准溶液用GC-MS检测
2.3 回收率和精密度
为验证抗氧剂提取方法和迁移实验方法的准确性,选取空白bk-PET/LDPE膜进行加标回收实验,加标浓度设置高、中、低3个水平,每个浓度设置6个平行,按照1.3.3和1.3.4对样品进行处理和上机检测,其中迁移实验条件为70 ℃、2 h[模拟欧盟(EU)No.10/2011法规中迁移的条件],计算加标回收率和精密度,由表3可知,3种抗氧剂在3个加标水平下的平均回收率为78.1%~112.3%,RSD(n=6)为1.1%~8.4%,说明实验方法具有良好的准确度和精密度,满足分析方法相关要求。
表3 三种抗氧剂的加标回收率和相对标准偏差(n=6)
Table 3 Recoveries and relative standard deviations of three antioxidants (n=6)

加标条件加标浓度/(μg·L-1)2,4-DTBP抗氧剂1076抗氧剂168回收率/%RSD/%回收率/%RSD/% 回收率/%RSD/%500107.15.3108.36.585.05.6甲醇(超声 160 min)1 000112.36.3102.53.678.13.11 50092.1497.41.1110.07.550096.42.891.44.799.13.395%乙醇(70 ℃、2 h)1 000101.75101.05.894.55.81 50090.15.3101.25.6102.08.450088.16.989.12.589.22.4异辛烷(70 ℃、2 h)1 00089.41.7102.34.291.44.91 500107.81.796.45.988.85.8
2.4 三种抗氧剂的初始含量
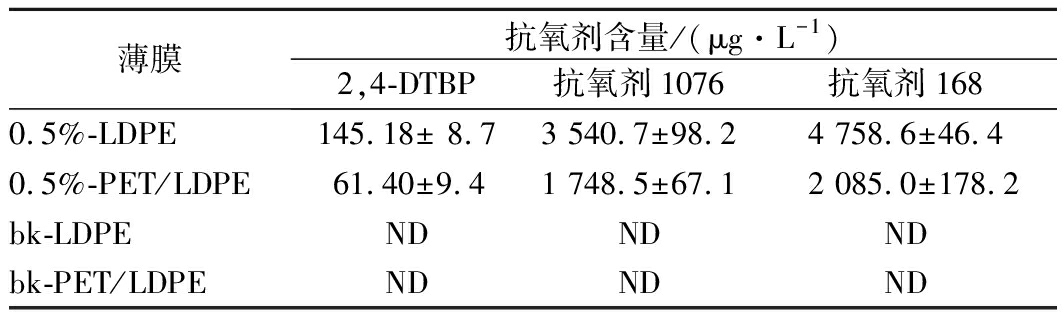
按1.3.3方法对4种膜中3种抗氧剂的初始含量进行测定,结果如表4所示,2,4-DTBP初始含量远低于原始添加量是因为其在造粒及流延的过程中因高温损失[21]。
表4 四种膜中3种抗氧剂的含量
Table 4 Contents of three antioxidants in four films
薄膜抗氧剂含量/(μg·L-1)2,4-DTBP抗氧剂1076抗氧剂1680.5%-LDPE145.18± 8.73 540.7±98.24 758.6±46.40.5%-PET/LDPE61.40±9.41 748.5±67.12 085.0±178.2bk-LDPENDNDNDbk-PET/LDPENDNDND
注:ND表示未检出
2.5 迁移实验结果
3种抗氧剂在20、40、60、70 ℃条件下从0.5%-PET/LDPE膜向95%乙醇和异辛烷迁移的结果如图1所示。
2.5.1 时间和温度对抗氧剂迁移的影响
3种抗氧剂向食品模拟物迁移的迁移量随迁移时间的延长和迁移温度的升高而增加,直至达到迁移平衡,与前人的研究报道结论具有一致性[24, 29],且在同种食品模拟物中,随着迁移温度的升高,达到迁移平衡状态所需时间越短。温度的升高能使聚合物高分子链运动性增加,使其产生更多自由体积[30],从而促进抗氧剂扩散,且高温使抗氧剂具有更高的能量,并提高抗氧剂在食品模拟物中的溶解度,因此升温提高抗氧剂迁移速率的同时也使其迁移量增加。
由图1看出,在相同温度条件下,抗氧剂1076和抗氧剂168向异辛烷迁移的迁移量比向95%乙醇迁移的迁移量大,而2,4-DTBP,在60、70 ℃条件下,其在2种食品模拟中的迁移量是95%乙醇>异辛烷,在20、40 ℃条件下,在达到迁移平衡状态前,其在2种食品模拟物中的迁移量是异辛烷>95%乙醇,达到迁移平衡时,是95%乙醇>异辛烷。这可以用Hansen溶解度参数[31]进行分析,如公式(6)所示:
(6)
式中:δ,Hansen溶解度参数,MPa1/2;δd,色散力溶解度参数,MPa1/2;δp,极性溶解度参数,MPa1/2;δh,氢键溶解度参数,MPa1/2。

a-2,4-DTBP的迁移量;b-抗氧剂1076的迁移量;c-抗氧剂168的迁移量
图1 0.5%-PET/LDPE膜中3种抗氧剂在食品模拟物中的迁移量
Fig.1 Migration of three antioxidants from 0.5% PET/LDPE film to food simulants
2.5.2 食品模拟物对抗氧剂迁移的影响
由表5可知,与乙醇的δ值相比,异辛烷的δ值与聚乙烯的更接近,表明异辛烷与聚乙烯的相溶性更好,也有研究表明,异辛烷能使聚乙烯溶胀[25],此外,抗氧剂1076与抗氧剂168的溶解度更接近于异辛烷。综上原因,在同等温度条件下抗氧剂1076和抗氧剂168在异辛烷中的迁移量均大于在95%乙醇中的迁移量。对于2,4-DTBP,由于其分子质量较小,异辛烷对聚乙烯产生的溶胀效应对其扩散迁移影响较小[25],且其是抗氧剂168的降解产物,在加热条件,乙醇能使迁移液中抗氧剂168发生水解产生2,4-DTBP。ALIN等[25]研究发现,将抗氧剂168标准品分别溶解于乙醇和异辛烷后进行80 ℃加热1 h,乙醇会使抗氧剂168发生水解产生2,4-DTBP,而在异辛烷中则没有检测到2,4-DTBP,因此,2,4-DTBP在95%乙醇中的最终迁移量大于在异辛烷中的最终迁移量,可能是由于迁移液中抗氧剂168与乙醇的相互作用产生2,4-DTBP。
表5 聚合物和溶剂的溶解度参数
Table 5 Solubility parameters of polymer and solvent

物质δ/MPa1/2δd/MPa1/2δP/MPa1/2δh/MPa1/2LDPE16.3160.82.8异辛烷14.314.300乙醇26.515.88.819.4
2.5.3 PET层对抗氧剂迁移的影响
图2为3种抗氧剂在40 ℃、72 h和70 ℃、2 h条件下分别从0.5%-LDPE膜和0.5%-PET/LDPE膜向两种食品模拟物迁移的迁移率。在相同迁移条件下,同种模拟物中,3种抗氧剂分别从两种膜迁移的迁移率差异性不显著(P>0.05),从单层LDPE膜中迁出量略高。经检测,迁移前后复合膜的PET层中均不含所研究的3种抗氧化剂,因此不存在抗氧剂从PET层向LDPE层扩散的现象,PET层对LDPE膜中抗氧剂的含量变化影响较小,且在迁移过程与食品模拟液直接接触的是LDPE层,因此将LDPE层与PET层复合,PET层不会对3种抗氧化剂的迁移产生明显影响。实验重复2次,验证了结果的正确性。

a-2,4-DTBP的迁移率;b-抗氧剂1076的迁移率;c-抗氧剂168的迁移率
图2 三种抗氧剂从0.5%-LDPE膜与0.5%-PET/LDPE膜向95%乙醇及异辛烷迁移的迁移率
Fig.2 Migration ratio of three antioxidants from 0.5%-LDPE film and 0.5%-PET/LDPE film to 95% ethanol and isooctane
2.6 扩散系数的计算
2.6.1 三种抗氧剂的迁移扩散系数
利用Crank模型对迁移实验数据进行最小二乘法非线性拟合,得到3种抗氧剂向2种食品模拟物迁移的扩散系数,见表6。图3为40 ℃条件下3种抗氧剂从0.5%-PET/LDPE膜向95%乙醇迁移的拟合效果,可看出Crank模型对迁移实验数据的拟合效果良好。

a-2,4-DTBP迁移量的拟合效果;b-抗氧剂1076迁移量的拟合效果;c-抗氧剂168迁移量的拟合效果
图3 40 ℃条件下0.5%-PET/LDPE复合膜中3种抗氧剂向95%乙醇迁移的拟合效果
Fig.3 Experimental value and fitting trend of migration of three antioxidants into 95%ethanol
表6 0.5%-PET/LDPE膜中3种抗氧剂向2种食品
模拟物迁移的参数
Table 6 Migration parameters of three antioxidants migrating
from 0.5%-PET/LDPE film to different food simulants at
various temperatures

食品模拟物抗氧剂温度/℃ɑKP,FD/(cm2· s-1)200.421 294.041.03E-112,4-DTBP403.17106.71.54E-116012.452.98.82E-117018.9917.541.06E-10201.19552.259.23E-1295%乙醇抗氧剂1076404.82138.035E-11609.569.41.87E-107023.4728.353.41E-10200.90728.331.62E-10抗氧剂168402.33284.602.34E-10605131.944.03E-10709.8667.445.35E-10200.901 564.934.46E-122,4-DTBP402.33209.643.02E-11607.4588.596.4E-11709.8635.021.05E-10201.85355.962.10E-11异辛烷抗氧剂1076405.07131.271.24E-106012.8951.172.8E-107038.1317.454.80E-10201.33495.101.89E-10抗氧剂168402.92227.543.23E-10606.6499.444.6E-107015.0844.135.27E-10
2.6.2 温度与扩散系数的关系
由表6看出,在同种食品模拟物中,3种抗氧剂的迁移扩散系数随温度的升高而增加,表明温度升高提高了抗氧剂的迁移速率。图4表明扩散系数与温度的关系符合Arrhenius公式,如公式(7)所示,相关系数都在0.9以上。

图4 三种抗氧剂向食品模拟物迁移的扩散系数与温度的关系
Fig.4 Relationship between diffusion coefficients of three
antioxidants migrating to food simulants and temperature
(7)
式中:D,抗氧剂的扩散系数,cm2/s;Ea,抗氧剂的活化能,kJ/mol;R,热力学常数,8.314 J/(mol·K));T,温度,K;D0,指前因子,cm2/s。
3 结论
建立的3种抗氧剂的LC-MS/MS检测方法,检出限均为0.2 μg/L,定量限均小于等于0.8 μg/L,显著低于现有方法,且具有良好的准确度和精密度。3种抗氧剂从PET/LDPE复合膜向95%乙醇和异辛烷的迁移量随时间延长和温度升高而增加,直至达到迁移平衡。在相同温度条件下,达到迁移平衡时,抗氧剂1076和168向异辛烷迁移的量大于向95%乙醇的迁移量,2,4-DTBP则与它们相反;PET膜不会对LDPE膜中的3种抗氧剂的迁移产生显著影响(P>0.05)。Crank模型能较好地拟合PET/LDPE复合膜中3种抗氧剂向异辛烷和95%乙醇的迁移数据,3种抗氧剂的迁移扩散系数与温度的关系符合Arrhenius公式。
[1] TORRES A, GUARDA A, MORAGA N, et al.Experimental and theoretical study of thermodynamics and transport properties of multilayer polymeric food packaging[J].European Food Research & Technology, 2012, 234(4):713-722.
[2] GREEN S,BAI S, CHEATHAM M, et al.Determination of antioxidants in polyolefins using total dissolution methodology followed by RPLC[J].Journal of Separation Science, 2010,33(22):3 455-3 462.
[3] YAN Y, HU C Y, WANG Z W, et al.Degradation of Irgafos 168 and migration of its degradation products from PP-R composite films[J].Packaging Technology and Science, 2018,31(10):679-688.
[4] 马少波, 郑亚兰, 吴晓妮, 等.塑料抗氧剂的研究和发展趋势[J].塑料科技, 2015,43(1):100-103.
MA S B, ZHENG Y L, WU X N, et al.Study and development trend of plastic antioxidants[J].Plastics Science and Technology, 2015,43(1):100-103.
[5] DOPICO-GARC A M S, L
A M S, L PEZ-VILARI
PEZ-VILARI
 J M, GONZ
J M, GONZ LEZ-RODR
LEZ-RODR GUEZ M V.Antioxidant content of and migration from commercial polyethylene, polypropylene, and polyvinyl chloride packages[J].Journal of Agricultural and Food Chemistry, 2007, 55(8):3 225-3 231.
GUEZ M V.Antioxidant content of and migration from commercial polyethylene, polypropylene, and polyvinyl chloride packages[J].Journal of Agricultural and Food Chemistry, 2007, 55(8):3 225-3 231.
[6] 刘志刚, 王志伟.塑料包装材料化学物向食品迁移的模型研究进展[J].高分子材料科学与工程, 2007, 23(5):19-23.
LIU Z G, WANG Z W.Study on mathematical model for predicting migration of chemical substances from plastic packaging materials[J].Polymer Materials Science & Engineering, 2007,23 (5):19-23.
[7] VARSHA K K, DEVENDRA L, SHILPA G, et al.2,4-Di-tert-butyl phenol as the antifungal, antioxidant bioactive purified from a newly isolated Lactococcus sp.[J].International Journal of Food Microbiology, 2015, 211:44-50.
[8] CHOI S J, KIM J K, KIM H K, et al.2,4-Di-tert-butylphenol from sweet potato protects against oxidative stress in PC12 cells and in mice[J].Journal of Medicinal Food, 2013,16(11):977-983.
[9] YANG Y P, HU C Y, ZHONG H N, et al.Effects of ultraviolet (UV) on degradation of irgafos 168 and migration of its degradation products from polypropylene films[J].Journal of Agricultural and Food Chemistry, 2016,64(41):7 866-7 873.
[10] BHUNIA K,SABLANI S S, YANG J M, et al.Migration of chemical compounds from packaging polymers during microwave, conventional heat treatment, and storage[J].Comprehensive Reviews in Food Science and Food Safety, 2013,12(5):523-545.
[11] 熊中强, 王利兵, 李宁涛, 等.气相色谱法测定高分子食品包装材料中抗氧化剂的残留量[J].色谱, 2011,29(3):273-276.
XIONG Z Q, WANG L B, LI N T, et al.Determination of antioxidant residues in polymer food package using.gas chromatography[J].Chinese Journal of Chromatography, 2011, 29(3):273-276.
[12] 国家质量监督检验检疫总局. SN/T 3042—2011 出口食品接触材料 高分子材料中抗氧化剂的测定 气相色谱法[S].北京:中国标准出版社, 2012.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China.SN/T 3042—2011 Food contact materials for export-Determination of antioxidants in polymers-Gas chromatography[S].Beijing:China Standard Press, 2011.
[13] 姚帮本, 王道俊, 储大勇.固相萃取-气相色谱-串联质谱法测定塑料食品包装材料中3种抗氧化剂的残留量[J].化学分析计量, 2014,23(6):20-24.
YAO B B, WANG D J, CHU D Y, Determination of three antioxidant residues in food plastic packaging materials by solid phase extraction-gas chromatography tandem mass spectrometry[J].Chemical Analysis and Meterage, 2014, 23(6):20-24.
[14] 杨岳平, 胡长鹰, 钟怀宁, 等.抗氧剂168的降解及其降解产物的测定[J].现代食品科技, 2016,32(6):304-309.
YANG Y P, HU C Y, ZHONG H N, et al.Degradation of Irgafos 168 and determination of its degradation products[J].Modern Food Science Technology, 2016, 32(6):304-309.
[15] LIN Q B, LI B, SONG H, et al.Determination of 7 antioxidants, 8 ultraviolet absorbents, and 2 fire retardants in plastic food package by ultrasonic extraction and ultra performance liquid chromatography[J].Journal of Liquid Chromatography & Related Technologies, 2011, 34(9):730-743.
[16] 薄艳娜, 林勤保, 吴恩玉, 等.纳米银-聚乙烯复合膜中4种添加剂的检测[J].包装学报, 2017, 9(2):1-5;24.
BO Y N, LIN Q B, WU E Y, et al.Determination of four additives in nano silver polyethylene composite film[J].Packaging Journal, 2017,9(2):1-5;24.
[17] LI B, WANG Z W, LIN Q B, et al.Simultaneous determination of antioxidants and ultraviolet stabilizers in polypropylene food packaging and food simulants by high-performance liquid chromatography[J].Acta Chromatographica, 2017,29(2):173-192.
[18] 张宁, 王彦, 王薇薇,等.高效液相色谱三重四级杆质谱联用法同时测定食品接触材料中12种塑化剂和抗氧化剂[J].现代生物医学进展, 2018, 18(14):2 623-2 630;2 622.
ZHANG N, WANG Y, WANG W W, et al.Simultaneous determination of plasticizers and antioxidants in food contact materials by high performance liquid chromatography/triple quadrupole mass spectrometry[J].Progress in Modern Biomedicine, 2018, 18(14):2 623-2 630;2 622.
[19] CHANG Y, KANG K, PARK S J, et al.Experimental and theoretical study of polypropylene:Antioxidant migration with different food simulants and temperatures[J].Journal of Food Engineering, 2019,244:142-149.
[20] GALOTTO M J, TORRES A, GUARDA A, et al.Experimental and theoretical study of LDPE versus different concentrations of irganox 1076 and different thickness[J].Food Research International, 2011,44(2):566-574.
[21] 徐雨军. 食品聚乙烯包装材料中酚类化合物的测定及迁移研究[D].扬州:扬州大学,2016.
XU Y J.Determination and migration of phenolic compounds in polyethylene packaging materials[D].Yangzhou:Yangzhou University, 2016.
[22] YOO S, SIGUA G, MIN D, et al.The influence of high-pressure processing on the migration of irganox 1076 from polyethylene films[J].Packaging Technology and Science, 2014,27(4):255-263.
[23] KANG K, CHANG Y, CHOI J C, et al.Migration study of butylated hydroxytoluene and irganox 1010 from polypropylene treated with severe processing conditions[J].Journal of Food science, 2018,83(4):1 005-1 010.
[24] 单利君, 林勤保, 韩善辉, 等.纳米银—聚乙烯复合包装中银对2种抗氧化剂向食品模拟物迁移的影响[J].食品科学, 2016, 37(12):182-186.
SHAN L J, LIN Q B, HAN S H, et al.Impact of nanosilver on migration of two antioxidants from nanosilver-plastic food packaging to food simulants [J].Food Science, 2016,37(12):182-186.
[25] ALIN J, HAKKARAINEN M.Microwave heating causes rapid degradation of antioxidants in polypropylene packaging, leading to greatly increased specific migration to food simulants as shown by ESI-MS and GC-MS[J].Journal of Agricultural and Food Chemistry, 2011, 59(10):5 418-5 427.
[26] BELDì G, PASTORELLI S, FRANCHINI F, et al.Time-and temperature-dependent migration studies of irganox 1076 from plastics into foods and food simulants[J].Food Additives & Contaminants:Part A, 2012, 29(5):836-845.
[27] 中华人民共和国国家卫生和计划生育委员会. GB 31604.1—2015食品安全国家标准 食品接触材料及制品迁移试验通则[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 31604.1—2015 National Food Safety Standard Migration test rules for food contact materials and products[S].Beijing:China Standard Press, 2015.
[28] CRANK J.The Mathematics of Diffusion[M].2nd ed.New York:Oxford University Press, 1975.
[29] GARDE J A, CATAL R, GAVARA R, et al.Characterizing the migration of antioxidants from polypropylene into fatty food simulants[J].Food Additives & Contaminants, 2001, 18(8):750-762.
R, GAVARA R, et al.Characterizing the migration of antioxidants from polypropylene into fatty food simulants[J].Food Additives & Contaminants, 2001, 18(8):750-762.
[30] MAITI M, BHOWMICK A K.Effect of polymer-clay interaction on solvent transport behavior of fluoroelastomer-clay nanocomposites and prediction of aspect ratio of nanoclay[J].Journal of Applied Polymer Science, 2007, 105(2):435-445.
[31] HANSEN C M.Hansen Solubility Parameters:A User′s Handbook[M].New York:CRC Press, 2007.