脂肪酸蔗糖酯是一种非离子型表面活性剂,具有安全无毒、生物相容性好、可生物降解等优点,因此被广泛应用于食品、日化品、制药等行业[1-7]。例如,蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品添加剂[8]。
目前工业化生产蔗糖酯主要采用化学法,但是存在高能耗、副产物多、溶剂毒性大等缺点。相比之下,酶法合成蔗糖酯则具有区域选择性好、反应条件温和、产品安全性高等优点,近年来日益引起人们的关注[9]。大部分研究者将叔戊醇/二甲基亚砜(dimethyl sulfoxide,DMSO)二元体系作为反应介质以促进蔗糖的溶解[10-12]。如FERRER等[12]报道了H.lanuginosa在叔戊醇/DMSO(叔戊醇的体积分数为80%)体系中催化月桂酸蔗糖单酯的合成,产量可达到30 g/L。但是,DMSO沸点高且毒性大,不利于月桂酸蔗糖单酯的纯化和应用[9]。因此,使用叔戊醇等低毒性、易处理的溶剂作为反应介质具有重要意义。
酶在非水介质中的电离状态对其催化活性的影响往往会被人们忽视。与水相催化不同,有机介质的介电常数通常较低[13],导致酶中的带电氨基酸与介质中带相反电荷的“反离子”紧密结合,从而改变酶的电离状态,影响酶的催化特性。例如,PARTRIDGE等[14]发现在枯草杆菌蛋白酶催化N-乙酰-L-酪氨酸乙酯与正丙醇的酯交换反应中,在四氢呋喃中加入固态缓冲对-AMPSO/NaAMPSO,可使反应速率从2.2 nmol/(mg·min)提升至52 nmol/(mg·min)[15]。枯草杆菌蛋白酶与脂肪酶同属于丝氨酸水解酶,然而,目前并没有关于调控脂肪酶电离状态以提高其催化合成蔗糖酯活性的报道。
蔗糖由于其较高的晶格能在叔戊醇中的溶解度很低(<1 g/L),极大地限制了蔗糖酯的产量[16]。通过破坏糖类的晶体结构可得到无定形糖类,以提高糖类在有机溶剂中的溶解度和溶解速率[17]。例如,FLORES等[18]发现无定形β-葡萄糖在叔戊醇中的溶解度为21 mmol/L,高于晶体β-葡萄糖(17.9 mmol/L),当采用Novozym 435催化无定形β-葡萄糖合成月桂酸葡萄糖酯时,反应速率可从12 μmol/(g·min)提升至16 μmol/(g·min)。然而,目前并没有关于使用无定形蔗糖合成月桂酸蔗糖单酯的报道。
本研究以叔戊醇为反应介质,以无定形蔗糖和月桂酸乙烯酯为底物,使用去质子化剂活化的Novozym 435催化合成月桂酸蔗糖单酯,并对该体系进行底物添加量、温度、酶添加量等因素的优化,所得月桂酸蔗糖单酯产量从1.04 g/L提高到23.2 g/L,并且对月桂酸蔗糖单酯合成的区域选择性很好,实现了在低毒性有机体系中获得较高蔗糖酯产量的目标。
1 材料与方法
1.1 试验试剂
蔗糖、4Å分子筛、叔戊醇、月桂酸钠、酪蛋白酸钠等,国药集团化学试剂有限公司;月桂酸乙烯酯、月桂酸蔗糖酯,阿拉丁试剂(上海)有限公司;Novozym 435,诺维信(中国)生物技术有限公司。
1.2 仪器与设备
1260 Infinity II型高效液相色谱仪、1260 Infinity II型蒸发光检测器,美国安捷伦公司;Nucleosil C18色谱柱 (5 μm, 250 mm×4.6 mm,100A),济南赛畅科学仪器有限公司;圆底烧瓶(50 mL)、三颈烧瓶(50 mL)、冷凝管、75 mm研钵,国药集团化学试剂有限公司;硅胶GF254薄层板,青岛海洋化工厂;DK-8B恒温水浴锅,浙江明德仪器有限公司;DZF-6050真空干燥箱,上海精宏实验设备有限公司;ADL311/311S喷雾干燥器,浚和(上海)仪器有限公司。
1.3 试验方法
1.3.1 无定形蔗糖的制备
沿用ADHIKARI等[19]报道的喷雾干燥法制备无定形蔗糖:先在500 mL纯水中加入1.25 g酪蛋白酸钠,50 ℃下缓慢搅拌直至彻底溶解,再加入123.75 g蔗糖,完全溶解后制得质量分数为20%的蔗糖溶液(酪蛋白酸钠可防止无定形蔗糖相互粘连及附着在喷雾干燥器器壁上)。将上述蔗糖-酪蛋白酸钠溶液进行喷雾干燥,条件为:水分蒸发速率2 kg/h、进口温度170 ℃、出口温度70 ℃,所得无定形蔗糖在60 ℃真空干燥箱中干燥6 h后备用,最终收率为82.7%。
1.3.2 月桂酸蔗糖单酯的合成
在50 mL圆底烧瓶中加入15 mL叔戊醇、一定量的蔗糖(研磨后的晶体蔗糖或无定形蔗糖)、月桂酸乙烯酯、去质子化剂、Novozym 435和4Å分子筛,在特定温度的水浴锅中反应24 h后,使用薄层色谱法(thin-layer chromatography,TLC)及HPLC分析月桂酸蔗糖单酯的含量。当反应温度≥70 ℃,使用回流反应装置以防止溶剂的逸散。
1.3.3 TLC分析
沿用李延科等[20]报道的方法,以硅胶G板为固定相,V(甲苯)∶V(乙酸乙酯)∶V(甲醇)∶V(水)=10∶5∶4.5∶0.2为展开剂,在蔗糖酯上行展开后,用脲-磷酸-水饱和正丁醇溶液显色,斑点呈蓝色。
1.3.4 HPLC检测
使用美国安捷伦公司的高效液相色谱仪、Nucleosil C18色谱柱 (5 μm, 250 mm×4.6 mm, 100A)、蒸发光检测器进行HPLC检测。以体积分数为90%的甲醇作为流动相,流速1.1 mL/min,柱温为40 ℃。
2 结果与分析
2.1 去质子化剂对酶活性的影响
在酯交换反应中,酰基供体水解产生的少量有机酸会使酶处于质子化状态,大大降低酶的催化活性[14]。因此,推测在反应体系中加入碱性物质作为去质子化剂,可减少酸性副产物对酶活性的抑制作用。
本实验在15 mL叔戊醇中加入3 g/L晶体蔗糖,0.15 mol/L月桂酸乙烯酯,6.7 g/L Novozym 435,20 g/L分子筛,反应温度为60 ℃,同时分别加入2 g/L的月桂酸钠、甲酸钠、乙酸钠、磷酸氢二钠及20 μL的三乙胺作为去质子化剂调控Novozym 435的电离状态,结果如图1所示,相比于对照组,上述去质子化剂对Novozym 435均有明显的活化作用,其中月桂酸钠对酶活性的提升效果最好,反应24 h后,月桂酸蔗糖单酯的产量从1.04 g/L提升至2.1 g/L。

图1 不同类型的去质子化剂对Novozym 435
催化合成月桂酸蔗糖单酯的影响
Fig.1 The effect of different deprotonants on the catalytic
synthesis of sucrose laurate monoester by Novozym 435
随后,在以上催化条件下对月桂酸钠的添加量进行优化。如图2所示,当月桂酸钠的添加量>2 g/L时,Novozym 435的酶活性不再提升,可能是因为月桂酸钠在叔戊醇中的溶解度较低,而只有溶于体系的少量Na+才能起到调控作用[14]。然而,经探究,有机可溶的三乙胺添加量对Novozym 435酶活性的影响也不显著(文中未显示数据)。因此,在之后的研究中均在体系中加入2 g/L的月桂酸钠以活化Novozym 435。

图2 月桂酸钠质量浓度对Novozym 435
催化合成月桂酸蔗糖单酯的影响
Fig.2 The effect of concentration of sodium laurate on the
catalytic synthesis of sucrose laurate monoester by Novozym 435
2.2 晶体蔗糖和月桂酸乙烯酯添加量对月桂酸蔗糖单酯产量的影响
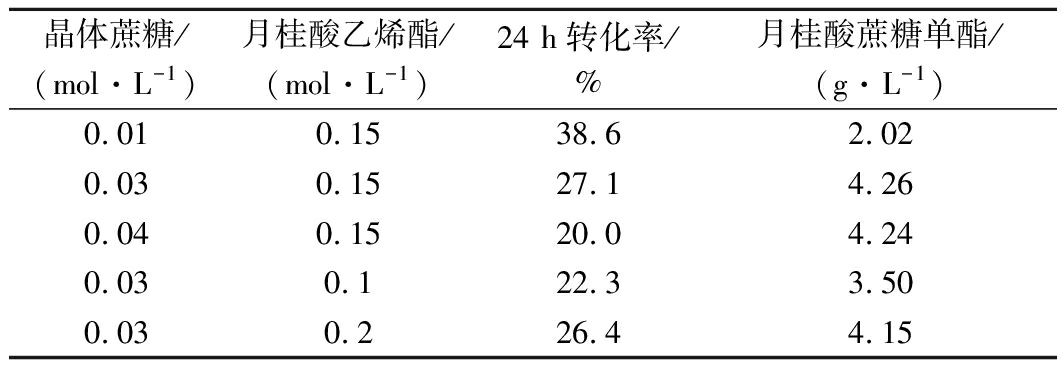
为探究底物添加量对月桂酸蔗糖单酯产量的影响,本实验在15 mL叔戊醇中加入6.7 g/L Novozym 435,2 g/L月桂酸钠,20 g/L分子筛,反应温度为60 ℃,此外分别加入不同浓度的底物。如表1所示。当晶体蔗糖添加量为0.03 mol/L,月桂酸乙烯酯添加量为0.15 mol/L时,反应24 h后月桂酸蔗糖单酯的产量为4.26 g/L,远高于蔗糖添加量为0.01 mol/L时的产量(2.02 g/L)。可能是因为体系中存在较多未溶解的蔗糖,可以及时补充反应所消耗的蔗糖;但当晶体蔗糖添加量>0.03 mol/L时,体系中大量未溶解的蔗糖会增大传质阻力,抑制反应的进行[21]。与蔗糖不同,月桂酸乙烯酯在叔戊醇中的溶解性较好,当乙烯酯浓度<0.15 mol/L时,月桂酸蔗糖单酯的产量随乙烯酯添加量的增加而提高。当乙烯酯浓度进一步增加时,月桂酸蔗糖单酯产量略有下降,可能是因为体系中存在大量的乙烯酯会抑制蔗糖的溶解。
表1 晶体蔗糖和月桂酸乙烯酯加量对月桂酸蔗糖
单酯产量的影响
Table 1 The effect of concentration of crystalline sucrose and
vinyl laurate on the yield of sucrose monolaurate
晶体蔗糖/(mol·L-1)月桂酸乙烯酯/(mol·L-1)24 h转化率/%月桂酸蔗糖单酯/(g·L-1)0.010.1538.62.020.030.1527.14.260.040.1520.04.240.030.122.33.500.030.226.44.15
2.3 温度对月桂酸蔗糖单酯产量的影响
之前的研究表明,Novozym 435对高温的耐受性较强。如Novozym 435可在82 ℃下催化蔗糖与月桂酸乙酯的酯交换反应(叔丁醇回流体系),反应7 d后月桂酸蔗糖单酯的产率达到35%[16]。为探究温度对月桂酸蔗糖单酯产量的影响,本实验在15 mL叔戊醇中加入0.03 mol/L无定形蔗糖,0.15 mol/L月桂酸乙烯酯,6.7 g/L Novozym 435,2 g/L月桂酸钠,20 g/L 分子筛,并在不同温度下反应,结果如图3所示。当反应温度≤75 ℃时,月桂酸蔗糖单酯产量随温度的升高而增加,在75 ℃时,月桂酸蔗糖单酯产量最高,达到6.42 g/L。这是因为温度升高可使蔗糖在叔戊醇中的溶解度增加,促进反应的进行。随着温度进一步上升,月桂酸蔗糖单酯产量逐渐下降,可能是因为温度过高会降低脂肪酶的活性和稳定性,且易使月桂酸蔗糖单酯变性着色,从而降低产量。因此,该反应的最适温度为75 ℃。

图3 温度对Novozym 435催化合成月桂酸蔗糖单酯的影响
Fig.3 Effect of temperature on the catalytic synthesis of
sucrose laurate monoester by Novozym 435
2.4 无定形蔗糖对月桂酸蔗糖单酯产量的影响
蔗糖在反应体系中的溶解度及溶解速率是影响蔗糖酯产量的又一关键因素。糖类在有机溶剂中的溶解度主要取决于其晶格能大小,体现在糖类的熔点上。一般来讲,糖类的熔点越高,晶格能越大,在有机溶剂中的溶解性越差,而蔗糖正是一种晶格能较高的糖类(熔点约为185 ℃)。因此,为验证无定形蔗糖是否具有改善蔗糖在叔戊醇中的溶解特性,实现对月桂酸蔗糖单酯合成的促进作用。本实验在15 mL叔戊醇中加入0.15 mol/L月桂酸乙烯酯,6.7 g/L Novozym 435,2 g/L月桂酸钠,20 g/L分子筛,反应温度为75 ℃,此外,分别加入0.03 mol/L无定形蔗糖和晶体蔗糖,结果如图4所示。使用无定形蔗糖可使月桂酸蔗糖单酯产量(24 h)从6.42 g/L提升至11.1 g/L,因此,在之后的研究中均采用无定形蔗糖作为酰基受体合成月桂酸蔗糖单酯(对照组除外)。
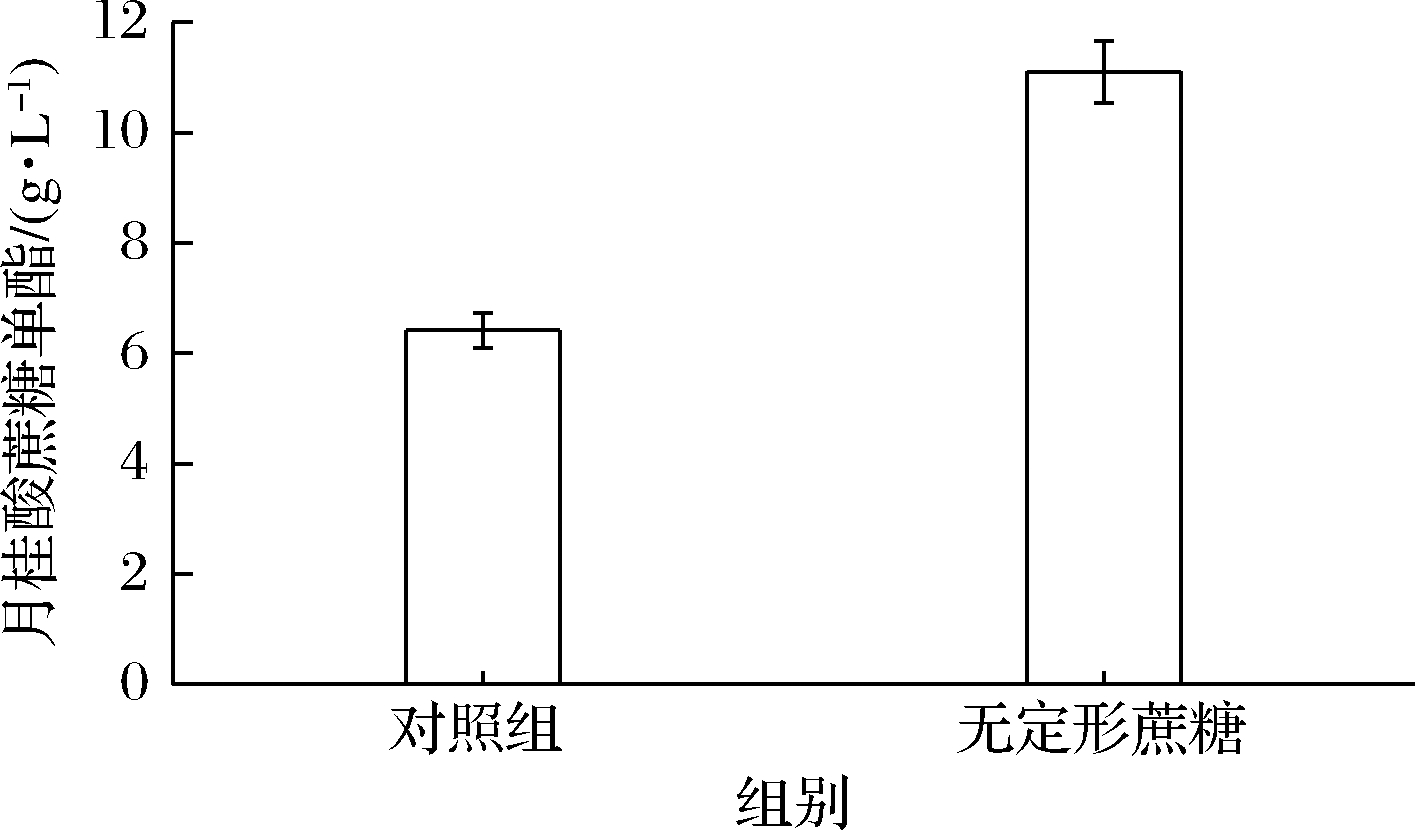
图4 无定形蔗糖对Novozym 435催化合成
月桂酸蔗糖单酯的影响
Fig.4 Effect of amorphous sucrose on the catalytic
synthesis of sucrose laurate monoester by Novozym 435
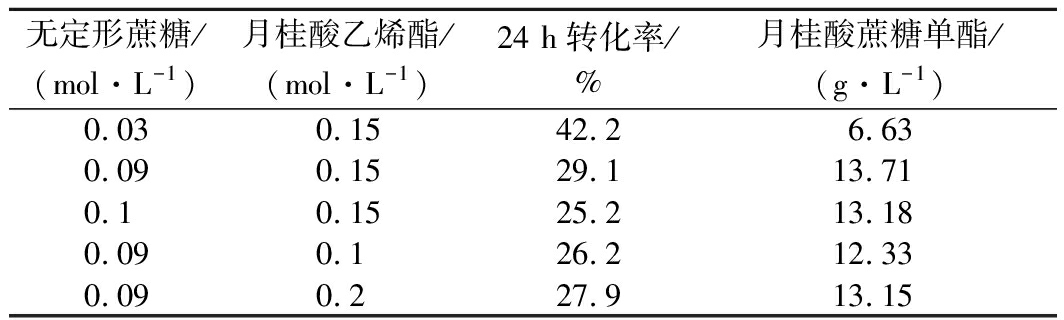
为探索无定形蔗糖和和月桂酸乙烯酯的添加量对月桂酸蔗糖单脂产量的影响,本实验在15 mL叔戊醇中加入6.7 g/L Novozym 435,2 g/L月桂酸钠,20 g/L分子筛,反应温度为75 ℃,此外,分别加入不同浓度的无定形蔗糖和月桂酸乙烯酯,结果如表2所示。由表2可知,当无定形蔗糖添加量为0.09 mol/L,月桂酸乙烯酯添加量为0.15 mol/L时,月桂酸蔗糖单酯产量可达到最高值13.71 g/L,转化率为29.1%(24 h),因此将无定形蔗糖添加量为0.09 mol/L,月桂酸乙烯酯添加量为0.15 mol/L定为最佳底物添加浓度。
表2 无定形蔗糖和月桂酸乙烯酯添加量对月桂酸蔗糖
单酯产量的影响
Table 2 The effect of concentration of amorphous sucrose
and vinyl laurate on the yield of sucrose laurate monoester
无定形蔗糖/(mol·L-1)月桂酸乙烯酯/(mol·L-1)24 h转化率/%月桂酸蔗糖单酯/(g·L-1)0.030.1542.26.630.090.1529.113.710.10.1525.213.180.090.126.212.330.090.227.913.15
2.5 酶添加量对月桂酸蔗糖单酯产量的影响
为探究酶添加量对月桂酸蔗糖单酯产量的影响,本实验在15 mL叔戊醇中加入0.09 mol/L无定形蔗糖,0.15 mol/L月桂酸乙烯酯,2 g/L月桂酸钠,20 g/L分子筛,反应温度为75 ℃,结果如图5所示,当Novozym 435的添加量≤10 g/L时,月桂酸蔗糖单酯产量随酶加量的增加显著提升,继续增大酶添加量,蔗糖酯产量缓慢提升,在Novozym 435 的添加量为16.7 g/L时,月桂酸蔗糖单酯产量达到最大值16.6 g/L(24 h),酶添加量>16.7 g/L时,月桂酸蔗糖单酯产量逐渐下降,主要是因为体系中存在过量的酶会增大传质阻力,抑制反应的进行[22],因此最佳的酶添加量为16.7 g/L。

图5 酶添加量对Novozym 435催化合成
月桂酸蔗糖单酯的影响
Fig.5 Effect of enzyme addition on the catalytic synthesis of
sucrose laurate monoester by Novozym 435
2.6 反应时间对月桂酸蔗糖单酯产量的影响
为探究反应时间对月桂酸蔗糖单酯产量的影响,同时考察无定形蔗糖和晶体蔗糖作为底物时最适转化结果,本实验在15 mL叔戊醇中加入0.15 mol/L月桂酸乙烯酯,16.7 g/L Novozym 435,2 g/L月桂酸钠,20 g/L分子筛,反应温度为75 ℃,再分别加入0.09 mol/L晶体蔗糖和无定形蔗糖,结果如图6所示,使用无定形蔗糖作为底物,在60 h后反应达到平衡,在该反应条件下,可得到最高的产物浓度和最佳的转化率,此时月桂酸蔗糖单酯质量浓度为23.2 g/L,转化率为49.2%;使用晶体蔗糖作为底物,反应平衡时(55 h)月桂酸蔗糖单酯质量浓度为14.9 g/L,转化率为32.5%。

图6 反应时间对Novozym 435催化合成
月桂酸蔗糖单酯的影响
Fig.6 Effect of reaction time on the catalytic synthesis of
sucrose laurate monoester by Novozym 435
3 结论与展望
相比于化学法,脂肪酶催化合成蔗糖酯具有区域选择性高、反应条件温和、产品安全性高等优点[23-24]。然而,绝大部分研究者仍以含少量DMSO的叔戊醇作为反应介质,加大了蔗糖酯纯化的难度并使其在食品等领域中的应用受限。
本研究以低毒性的叔戊醇作为反应介质合成月桂酸蔗糖单酯。通过加入去质子化剂调控Novozym 435的电离状态,以减小酰基供体水解产生的少量月桂酸对酶活性的抑制作用,并以无定形蔗糖作为底物,提高蔗糖在叔戊醇的溶解度及溶解速率,使得反应速率进一步提升。实验表明,在15 mL叔戊醇中,加入0.09 mol/L无定形蔗糖、0.15 mol/L月桂酸乙烯酯、16.7 g/L Novozym 435,2 g/L月桂酸钠及20 g/L分子筛,在75 ℃下反应60 h,月桂酸蔗糖单酯的质量浓度达到23.2 g/L,转化率达到49.2%,已接近报道中在叔戊醇/DMSO(叔戊醇的体积分数为80%)体系中合成蔗糖酯的产量,实现了一种绿色安全、高效、低成本的月桂酸蔗糖单酯生产方式,为今后的工业化应用奠定了基础,也为同类产品的开发提供了一个新的工艺优化思路。
[1] NETA N S, TEIXEIRA J A, RODRIGUES L R.Sugar ester surfactants:Enzymatic synthesis and applications in food industry[J].Critical Reviews in Food Science and Nutrition, 2015, 55(5):595-610.
[2] 张雄, 贾康乐, 文武, 等.蔗糖酯表面活性剂化学合成工艺研究进展[J].精细化工, 2020, 37(11):2 193-2 199.
ZHANG X, JIA K L, WEN W, et al.Research progress of chemical synthesis technology of sucrose esters surfactants[J].Fine Chemicals, 2020, 37(11):2 193-2 199.
[3] SZÜTS A, SZAB -RÉVÉSZ P.Sucrose esters as natural surfactants in drug delivery systems—A mini-review[J].International Journal of Pharmaceutics, 2012, 433(1-2):1-9.
-RÉVÉSZ P.Sucrose esters as natural surfactants in drug delivery systems—A mini-review[J].International Journal of Pharmaceutics, 2012, 433(1-2):1-9.
[4] NAGAI Y, KAWANO S, MOTODA K, et al.Solubility testing of sucrose esters of fatty acids in international food additive specifications[J].Biological and Pharmaceutical Bulletin, 2017, 40(3):284-289.
[5] ![]() S D, et al.Sucrose esters as biocompatible surfactants for penetration enhancement:An insight into the mechanism of penetration enhancement studied using stratum corneum model lipids and Langmuir monolayers[J].European Journal of Pharmaceutical Sciences, 2017, 99:161-172.
S D, et al.Sucrose esters as biocompatible surfactants for penetration enhancement:An insight into the mechanism of penetration enhancement studied using stratum corneum model lipids and Langmuir monolayers[J].European Journal of Pharmaceutical Sciences, 2017, 99:161-172.
[6] LIU Y, BINKS B P.A novel strategy to fabricate stable oil foams with sucrose ester surfactant[J].Journal of Colloid and Interface Science, 2021, 594(15):204-216.
[7] NAKAMURA S, ISHII N, NAKASHIMA N, et al.Evaluation of sucrose fatty acid esters as lubricants in tablet manufacturing[J].Chemical and Pharmaceutical Bulletin, 2017, 65(5):432-441.
[8] 邓伶俐, 刘雨雨, 康雪帆, 等.蔗糖酯对大豆分离蛋白乳化性的影响及作用机理[J].中国食品学报, 2016, 16(12):43-49.
DENG L L, LIU Y Y, KANG X F, et al.Effect of sucrose ester on the emulsifying properties of soy protein isolate[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(12):43-49.
[9] TENG Y L, STEWART S G, HAI Y W, et al.Sucrose fatty acid esters:Synthesis, emulsifying capacities, biological activities and structure-property profiles[J].Critical Reviews in Food Science and Nutrition, 2020:1-21.
[10] FERRER M, SOLIVERI J,PLOU F J, et al.Synthesis of sugar esters in solvent mixtures by lipases from Thermomyces lanuginosus and Candida antarctica B, and their antimicrobial properties[J].Enzyme and Microbial Technology, 2005, 36(4):391-398.
[11] REYES-DUARTE D, L PEZ-CORTÉS N, FERRER M, et al.Parameters affecting productivity in the lipase-catalysed synthesis of sucrose palmitate[J].Biocatalysis and Biotransformation, 2005, 23(1):19-27.
PEZ-CORTÉS N, FERRER M, et al.Parameters affecting productivity in the lipase-catalysed synthesis of sucrose palmitate[J].Biocatalysis and Biotransformation, 2005, 23(1):19-27.
[12] FERRER M, CRUCES M A, BERNABÉ M, et al.Lipase-catalyzed regioselective acylation of sucrose in two-solvent mixtures.[J].Biotechnology and Bioengineering, 1999, 65(1):10-16.
[13] KLIBANOV A M.Improving enzymes by using them in organic solvents[J].Nature, 2001, 409(6 817):241-246.
[14] PARTRIDGE J, HALLING P J, MOORE B D.Solid-state proton/sodium buffers:“chemical pH stats” for biocatalysts in organic solvents[J].Journal of the Chemical Society, Perkin Transactions 2, 2000, (3):465-471.
[15] HALLING P J.Biocatalysis in low-water media:Understanding effects of reaction conditions[J].Current Opinion in Chemical Biology, 2000, 4(1):74-80.
[16] WOUDENBERG-VAN OOSTEROM M, VAN RANTWIJK F, SHELDON R A.Regioselective acylation of disaccharides in tert-butyl alcohol catalyzed by Candida antarctica lipase[J].Biotechnology and Bioengineering, 1996, 49(3):328-333.
[17] MORROW E A, TERBAN M W, THOMAS L C, et al.Effect of amorphization method on the physicochemical properties of amorphous sucrose[J].Journal of Food Engineering, 2019, 243:125-141.
[18] FLORES M V,NARAGHI K,ENGASSER J M, et al.Influence of glucose solubility and dissolution rate on the kinetics of lipase catalyzed synthesis of glucose laurate in 2-methyl 2-butanol[J].Biotechnology and Bioengineering, 2002, 78(7):815-821.
[19] ADHIKARI B, HOWES T, BHANDARI B R, et al.Effect of addition of proteins on the production of amorphous sucrose powder through spray drying[J].Journal of Food Engineering, 2009, 94(2):144-153.
[20] 李延科, 张淑芬,杨锦宗.蔗糖酯的薄层色谱分析[J].色谱, 2002, 20(5):476-478.
LI Y K, ZHANG S F, YANG J Z.Analysis of sucrose esters by thin-layer chromatography[J].Chinese Journal of Chromatography, 2002, 20(5):476-478.
[21] DANG H T,OBIRI O,HAYES D G.H.Feed batch addition of saccharide during saccharide-fatty acid esterification catalyzed by immobilized lipase:time course, water activity, and kinetic model[J].Journal of the American Oil Chemists′ Society, 2005, 82(7):487-493.
[22] SHI Y G, WU Y, LU X Y, et al.Lipase-catalyzed esterification of ferulic acid with lauryl alcohol in ionic liquids and antibacterial properties in vitro against three food-related bacteria[J].Food Chemistry, 2017, 220:249-256.
[23] YE R, HAYES D G, BURTON R.Effects of particle size of sucrose suspensions and pre-incubation of enzymes on lipase-catalyzed synthesis of sucrose oleic acid esters[J].Journal of the American Oil Chemists′ Society, 2014, 91(11):1 891-1 901.
[24] YE R, HAYES D G, BURTON R, et al.Solvent-free lipase-catalyzed synthesis of technical-grade sugar esters and evaluation of their physicochemical and bioactive properties[J].Catalysts, 2016, 6(6):78.