牦牛奶与同体积的普通黑白花牛奶比较,含铁量是其9.8倍,含锌量是其3倍,含钙量和氨基酸含量是其1.15倍,蛋白质含量是其1.1倍,乳脂和乳蛋白率也较高,被称为纯天然的“浓缩乳”[1]。游牧民通常将挤出的鲜牦牛奶不经加热杀菌,直接布袋过滤,置于陶罐中在阴凉处发酵。青海地区特殊的气候环境(高寒、缺氧)、牦牛奶极高的营养价值及游牧民族传统的制作工艺赋予了发酵牦牛乳制品特殊的微生物资源[2]。乳酸菌是一类能使可发酵糖类化合物转化成乳酸的革兰氏阳性细菌的总称,广泛应用于酸奶、奶酪、面包、鱼和肉等发酵食品的加工中,赋予它们独特的风味和质构特点。相当多的乳酸菌是益生菌,能促进动物生长、调节胃肠道正常菌群、维持微生态平衡、提高机体免疫力等[3-4]。对青海传统发酵牦牛乳制品中乳酸菌资源进行发掘及评价具有现实意义和应用价值。
目前对青海传统发酵牦牛乳制品中的乳酸菌尚未有较全面的功能及发酵特性评价。我国成年人饮奶后乳糖吸收不良人群可达80%,乳酸菌可自主合成β-半乳糖苷酶,可以降低乳糖含量,缓解人群中普遍存在的乳糖不耐症[5]。某些乳酸菌会在生长过程中向外部环境中释放具有抑菌活性的细菌素,细菌素具有无毒、无抗药性、无副作用、无残留等优点,已经成为现阶段乃至今后很长一段时间微生物天然防腐剂的研究热点[6]。凝乳时间决定着乳酸菌的凝乳能力,是乳酸菌是否适合作为乳制品发酵剂的一项重要考察指标。
本研究收集整理青海地区传统发酵牦牛乳制品中的乳酸菌资源,并进行全面评价,分别发掘具有产细菌素能力、产β-半乳糖苷酶能力强、凝乳能力好的乳酸菌,为保护和利用我国传统乳制品中乳酸菌资源提供基础数据,为发现新的更安全的食品添加抑菌剂提供素材,为β-半乳糖苷酶的生产和开发具有特色的发酵制品提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 牦牛乳制品
本研究所用牦牛乳制品取自青海省海北藏族自治州、海南藏族自治州、黄南藏族自治州、果洛藏族自治州和玉树藏族自治州牧民家中,共计18份样品。
1.1.2 菌株
单核细胞增生李斯特氏菌(Listeria monocytogenes)ATCC 19111,美国典型菌种保藏中心;大肠埃希菌(Escherichia coli)CMCC 44102、金黄色葡萄球菌(Staphylococcus aureus) CMCC 26003、中国医学微生物菌种保藏管理中心[17]。
1.1.3 培养基
MRS培养基、MRS肉汤,北京陆桥技术股份有限公司;脱脂奶粉,美国BD公司。
1.1.4 主要试剂和仪器
胃蛋白酶、胰蛋白酶、蛋白酶K、过氧化氢酶、溶菌酶、5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷(5-brome-4-chloro-3-indolyl-β-D-galactoside, X-gal)、2-硝基苯基-β-D-吡喃半乳糖苷(2-nitrophenyl-β-D-galactopyranoside, ONPG)、邻硝基苯酚,Sigma有限公司;API50 CH培养基、API50 CHL培养基,梅里埃技术有限公司。其余试剂购自国药集团化学试剂有限公司。
Synergy LX酶标仪,美国BioTek公司;IMH180培养箱,美国Thermo Fisher公司;AC2-6S1生物安全柜,Esco科技有限公司;SX-700高压灭菌锅,日本TOMY公司;5424R台式微量高速冷冻离心机, 艾本德中国有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离及筛选
取10 g牦牛乳制品置于均质袋中,加入100 mL无菌生理盐水,用均质器拍击2 min,取1 mL菌悬液,梯度稀释后分别涂布于质量分数为1%的CaCO3 MRS琼脂平板上,37 ℃静置培养24~48 h。选出菌落周围形成透明圈的菌落,连续划线培养纯化。选出革兰氏染色证实为革兰氏阳性、H2O2酶实验为阴性的菌株保存[7-9]。
1.2.2 菌株鉴定
1.2.2.1 梅里埃API50试剂盒生化鉴定
API 50 CHL试剂盒用于乳酸杆菌和相关菌的鉴定,它是由49种可发酵碳水化合物组成的简易培养基,培养时由于碳水化合物产酸,pH下降,使指示剂变色,显示结果构成菌株的生化图谱,得到的生化谱用API WEB系统读取,得到菌株鉴定结果。操作方法参见梅里埃API50试剂盒使用说明[10]。
1.2.2.2 分子生物学鉴定
提取分离得到菌株的基因组DNA,用细菌16S rRNA 基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGAC-TT-3′)扩增菌株的16S rRNA基因。扩增产物经质量分数为1%琼脂糖凝胶电泳检测,对在 1 500 bp处出现较亮条带的PCR产物进行测序。测序结果与NCBI数据库中序列进行比对分析,用MEGA软件构建进化树[11]。
1.2.3 产β-半乳糖苷酶能力评价
1.2.3.1 产β-半乳糖苷酶乳酸菌筛选
将X-gal配制成20 g/L的N,N-二甲基酰胺溶液(-20 ℃避光保存)。将纯化后的乳酸菌菌株接种至MRS液体培养基进行复壮培养,随后吸取50 μL菌液涂布于MRS琼脂培养基上,于37 ℃培养24~48 h,待所接种的菌株生长成单个菌落时,滴加配制的X-gal 溶液至菌落上,37 ℃培养24 h,观察菌落颜色变化[12-13]。
1.2.3.2 β-半乳糖苷酶活性测定
取1 mL培养液8 000 r/min、4 ℃离心10 min;弃上清液得到菌体沉淀,磷酸盐缓冲液洗涤2次,加入0.2 mL 的质量分数为0.2%的溶菌酶破壁,37 ℃水浴1 h,加0.2 mL 4 mol/L的NaCl混匀,8 000 r/min、4 ℃离心 10 min;取0.25 mL上清液,37 ℃水浴5 min,加入预热至37 ℃的20 mmol/L ONPG 0.25 mL,37 ℃水浴反应30 min;加入0.75 mL的0.5 mol/L的NaCO3溶液,在420 nm处测定OD值,进而换算成β-半乳糖苷酶活性[14]。ONP的标准曲线方程为y=1.885 3x+0.001 6,R2=0.998 1。β-半乳糖苷酶活性单位定义为:1 mL酶液在37 ℃,pH 6.8的条件下,1 min水解ONPG所产生1 μmol ONP的酶量为1个酶活性单位,以U/mL表示[15]。
1.2.4 抑菌能力评价及产细菌素乳酸菌筛选
1.2.4.1 抑菌能力评价
将乳酸菌菌株以体积分数1%的接种量接种于MRS液体培养基中,37 ℃静置培养24 h后,4 ℃、8 000 r/min离心10 min,收集上清液,用1 mol/L NaOH调pH值为6.0[16]。选取食品中常见致病菌单核细胞增生李斯特氏菌(ATCC 19111)、大肠埃希菌(CMCC 44103)、金黄色葡萄球菌(CMCC 26003)[17]为指示菌。先将6 mL MRS固体培养基平铺于双碟中,置于水平台面上静置凝固作为底层,另取MRS固体培养基适量加热融化后,放冷至48~50 ℃,分别加入稀释至约108 CFU/mL的新鲜培养的指示菌适量,摇匀,在每个双碟中分别加入10 mL,使在底层上均匀摊布,作为菌层。放置在水平台上冷却后,将牛津杯轻轻放置于平板上,将离心上清液加入牛津杯后于4 ℃冰箱中扩散5 h,37 ℃ 培养24 h,测量抑菌圈大小[18-19]。
1.2.4.2 产细菌素乳酸菌筛选
选取对3种指示菌均具有明显抑制作用的乳酸菌,分别用过氧化氢酶、胃蛋白酶、胰蛋白酶、蛋白酶K在各自作用的最适pH值下处理发酵上清液,各酶的最终质量浓度为1 g/L,37 ℃水浴2 h后,再调回pH值6.0,比较抑菌圈变化[20]。
1.2.5 凝乳能力评价
将乳酸菌菌株以体积分数1%的接种量接种于MRS液体培养基中,37 ℃静置培养24 h后,稀释至约108 CFU/mL。取108 CFU/ml的菌悬液,以体积分数2%的接种量接种于10 mL脱脂乳中,记录凝乳时间[21]。
1.3 数据处理
使用SPSS 26.0软件对数据进行相关性分析,所有试验均重复3次。
2 结果与分析
2.1 牦牛乳制品中乳酸菌的分离
采用选择性分离方法从牦牛乳制品中共分离培养出32株菌株。根据菌落形态特征,选取22株菌落呈黄白或白色,圆形微隆起,表面光滑,显微镜镜检下革兰氏阳性,无芽孢,长杆状、短杆状或球状,H2O2酶试验阴性的菌株进行保存(表1)。
表1 牦牛乳制品中乳酸菌分离情况统计
Table 1 Statistics on the isolation of lactic acid bacteria from yak dairy products

地区海北藏族自治州海南藏族自治洲黄南藏族自治州果洛藏族自治州玉树藏族自治州海晏县祁连县刚察县西海镇共和县岗格村同仁县泽库县尖扎县玛沁县玛多县玉树市杂多县样品数量1113112221111分离菌数2114113222111
2.2 梅里埃API50试剂盒生化鉴定
使用法国梅里埃公司的API50 CHL试剂盒对选取的22株菌株进行鉴定。所得生化谱用API WEB系统读取,结果见表2。
表2 梅里埃API50试剂盒生化鉴定结果
Table 2 Results of biochemical identification using the API50 kit

菌株鉴定/%T值不一致试验鉴定结果Y1-192.80.8GLU 100%嗜热链球菌Y2-199.21.0嗜热链球菌Y3-199.21.0嗜热链球菌Y4-192.80.8GLU 100%嗜热链球菌Y5-199.21.0嗜热链球菌Y5-299.21.0嗜热链球菌Y6-199.21.0嗜热链球菌Y7-192.80.8GLU 100%嗜热链球菌Y7-299.20.83ESC 5%发酵乳杆菌1Y8-192.80.8GLU 100%嗜热链球菌Y9-185.90.94MAN 80%植物乳杆菌2Y9-399.40.97乳明串珠菌Y10-192.80.8GLU 100%嗜热链球菌Y11-192.80.8GLU 100%嗜热链球菌Y12-199.21.0嗜热链球菌Y12-299.21.0嗜热链球菌Y13-188.00.98乳酸乳球菌乳亚种2Y13-299.61.0发酵乳杆菌1Y14-182.00.67ARB 76%卷曲乳杆菌Y15-199.90.69FRU 80%发酵乳杆菌1Y16-299.21.0嗜热链球菌Y18-299.21.0嗜热链球菌
注:鉴定(%):鉴定百分率,评估了待测菌的测定结果谱与数据库中不同分类的相对接近程度,其结果≥80%则可给出鉴定结果;T值为评估了待测菌的测定结果谱与每一种分类的最典型的反应结果谱的符合程度;不一致试验:如果存在与鉴定结果不一致的试验结果,会同时显示其阳性结果的百分率,GLU为D-葡萄糖,MAN为甘露醇,ESC为七叶灵柠檬酸铁,ARB为ARBULIN,FRU为D-果糖;鉴定结果中数字1,2为菌库分型
Y1-1、Y2-1、Y3-1、Y4-1、Y5-1、Y5-2、Y6-1、Y7-1、Y8-1、Y10-1、Y11-1、Y12-1、Y12-2、Y16-2、Y18-2鉴定为嗜热链球菌,Y7-2、Y13-2、Y15-1鉴定为发酵乳杆菌 1,Y9-1鉴定为植物乳杆菌2,Y9-3鉴定为乳明串珠菌,Y13-1鉴定为乳酸乳球菌乳亚种2,Y14-1鉴定为卷曲乳杆菌。
2.3 菌株的分子生物学鉴定
选择枯草芽孢杆菌(Bacillus subtilis)菌株的相关基因作为外参,以16S rRNA基因的部分序列构建系统发育树(图1)。通过比对菌株的16S rRNA基因序列,确定这22株乳酸菌菌株分别是Streptococcus thermophilus(嗜热链球菌15株),Lactobacillus fermentum(发酵乳杆菌3株),Enterococcus durans(坚忍肠球菌1株),Leuconostoc lactis(乳明串珠菌1株),Enterococcus faecium(粪肠球菌1株),Streptococcus macedonicus(马其顿链球菌1株)。
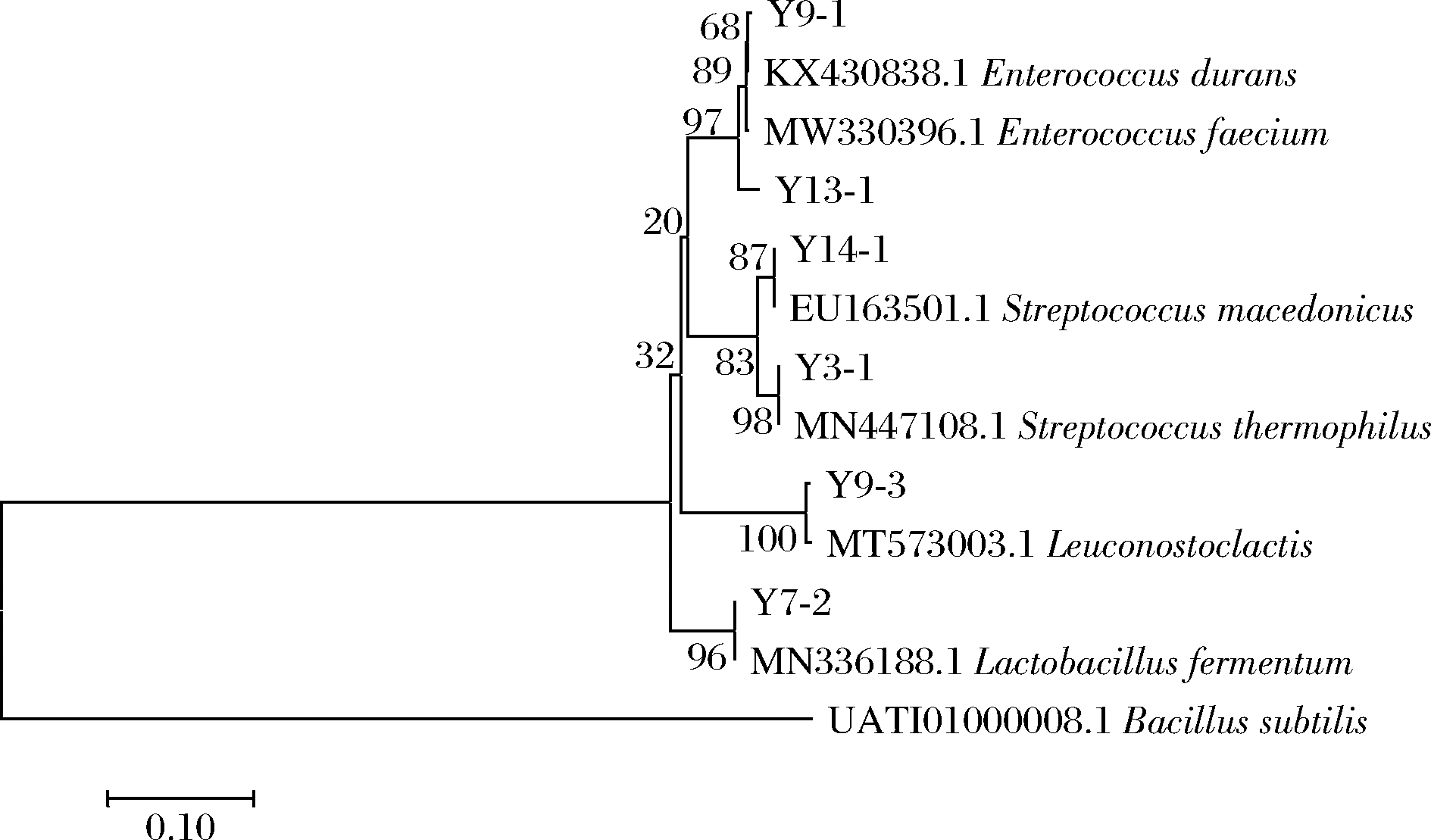
图1 基于16S rRNA基因分析的部分分离菌株
和近源菌株的系统发育树
Fig.1 Phylogenetic trees based on 16S rRNA gene sequencing
results of partial isolates and related strains
对比16S rRNA分子生物学鉴定结果和梅里埃API50试剂盒生化鉴定结果,22株菌株中,19株(86.4%)菌株的鉴定结果完全相同,3株(13.6%)菌株的鉴定结果不同,分别是Y9-1,Y13-1和Y14-1,如表3所示。
表3 菌株鉴定结果汇总
Table 3 The results of strain identification

菌株API50鉴定结果分子生物学鉴定结果Y1-1嗜热链球菌嗜热链球菌Y2-1嗜热链球菌嗜热链球菌Y3-1嗜热链球菌嗜热链球菌Y4-1嗜热链球菌嗜热链球菌Y5-1嗜热链球菌嗜热链球菌Y5-2嗜热链球菌嗜热链球菌Y6-1嗜热链球菌嗜热链球菌Y7-1嗜热链球菌嗜热链球菌Y7-2发酵乳杆菌1发酵乳杆菌Y8-1嗜热链球菌嗜热链球菌Y9-1植物乳杆菌2坚忍肠球菌Y9-3乳明串珠菌乳明串珠菌Y10-1嗜热链球菌嗜热链球菌Y11-1嗜热链球菌嗜热链球菌Y12-1嗜热链球菌嗜热链球菌Y12-2嗜热链球菌嗜热链球菌Y13-1乳酸乳球菌乳亚种2粪肠球菌Y13-2发酵乳杆菌1发酵乳杆菌Y14-1卷曲乳杆菌马其顿链球菌Y15-1发酵乳杆菌1发酵乳杆菌Y16-2嗜热链球菌嗜热链球菌Y18-2嗜热链球菌嗜热链球菌
2.4 产β-半乳糖苷酶能力评价
β-半乳糖苷酶催化无色的X-gal水解呈蓝色,实验测得滴加X-gal溶液后菌株Y9-1、Y9-3、Y13-1呈淡蓝色,Y14-1不变色,其余菌株呈蓝色。
β-半乳糖苷酶活性测定结果见图2,不同乳酸菌具有不同的β-半乳糖苷酶活性,即使是同属不同种,甚至不同亚种的乳酸菌,其β-半乳糖苷酶活性也有所不同。酶活性测定结果与X-gal水解实验结果相印证。结合菌株鉴定结果,嗜热链球菌、发酵乳杆菌普遍具有较好的β-半乳糖苷酶活性。坚忍肠球菌、乳明串珠菌、粪肠球菌和马其顿链球菌几乎不具有产β-半乳糖苷酶能力。

图2 β-半乳糖苷酶活性测定结果
Fig.2 The results of β-galactosidase activity
2.5 抑菌能力评价
采用管碟法,测得Y9-1对金黄色葡萄球菌、大肠埃希菌和单核细胞增生李斯特氏菌均有抑制作用,抑菌圈直径分别为16.30、28.40、22.93 mm,结果见图3。Y13-1对金黄色葡萄球菌、大肠埃希菌和单核细胞增生李斯特氏菌均有抑制作用,抑菌圈直径分别为18.87、25.65、12.30 mm,结果见图4。其余菌株均未表现出对指示菌的抑制能力。结合菌株鉴定结果,嗜热链球菌和发酵乳杆菌普遍不具有抑菌能力,坚忍肠球菌Y9-1和粪肠球菌Y13-1具有较强的抑菌能力。
菌株Y9-1、Y13-1的发酵上清液用H2O2酶处理后,抑菌圈大小和未作处理的上清液抑菌圈大小基本一致,用胃蛋白酶、胰蛋白酶和蛋白酶K处理后抑菌圈完全消失。表明上清液中的抑菌物质不是H2O2,而是细菌素。

a-对金黄色葡萄球菌的抑制能力;b-对大肠埃希菌的抑制能力;
c-对单核细胞增生李斯特氏菌的抑制能力
图3 Y9-1对指示菌的抑菌能力
Fig.3 The bacteriostatic ability of strain Y9-1 to
indicator bacteria

a-对金黄色葡萄球菌的抑制能力;b-对大肠埃希菌的抑制能力;
c-对单核细胞增生李斯特氏菌的抑制能力
图4 Y13-1对指示菌的抑菌能力
Fig.4 The bacteriostatic ability of strain Y13-1 to
indicator bacteria
2.6 凝乳能力评价
测定各菌株的凝乳时间,菌株Y7-2、Y9-3、Y13-2、Y15-1不具有凝乳能力,其余菌株凝乳时间见图5,Y9-1凝乳时间较长达37 h。其余菌株凝乳时间均在8~19 h。结合菌株鉴定结果,发酵乳杆菌和乳明串珠菌不具有凝乳能力。嗜热链球菌、粪肠球菌和马其顿链球菌凝乳时间均<20 h,凝乳能力强。坚忍肠球菌Y9-1凝乳时间长,凝乳能力弱。

图5 18株乳酸菌的凝乳时间
Fig.5 Coagulation time of 18 lactic acid bacteria
3 结论与讨论
现在大多数文献中菌株鉴定采用基因鉴定的方法,忽视了表型鉴定。表型鉴定和基因鉴定属于2个不同方法,对应2种不同的分类学,基因决定蛋白,进而决定表型,两者互为补充。本研究同时采用梅里埃API50试剂盒和16S rRNA分子生物学方法鉴定分离株,19株(86.4%)菌株的鉴定结果完全相同,3株(13.6%)菌株的鉴定结果不同。采用不同的鉴定方法得到不同的鉴定结果是菌株鉴定中时常碰到的[22-23],凡是试验方法均有一定的误差,为了得到更准确的结果,有必要结合多种鉴定方法。
本研究从青海传统发酵牦牛乳制品中分离得到22株菌株,其中嗜热链球菌15株(68.2%),发酵乳杆菌3株(13.6%),坚忍肠球菌1株(4.5%),乳明串珠菌1株(4.5%),粪肠球菌1株(4.5%),马其顿链球菌1株(4.5%)。青海省全省大部分地区海拔在3 000~5 000 m,气温低,昼夜温差大,含氧量随海拔升高而降低。不同采样地的海拔和气候不同,适合生长的菌株不同。
本研究分离得到的15株嗜热链球菌和3株发酵乳杆菌均具有较好的β-半乳糖苷酶活性。而坚忍肠球菌、乳明串珠菌、粪肠球菌和马其顿链球菌几乎不具有产β-半乳糖苷酶能力,与IBRAHIM等[24]发现嗜热链球菌ST3(Streptococcus thermophillus ST3)具有很好的 β-半乳糖苷酶活性的研究结果相一致。β-半乳糖苷酶可以将乳糖转化为葡萄糖和半乳糖,降低乳糖含量,避免乳糖结晶析出,增加乳品甜度,缓解人群中普遍存在的乳糖不耐症[5]。目前不同来源的β-半乳糖苷酶已被应用于低乳糖牛奶的生产当中,乳糖的水解可以增加乳制品的甜度,从而使其适合乳糖不耐症人群的消费[13]。虽然可分泌半乳糖苷酶的生物种类繁多,但目前主要采用微生物发酵的方法来生产β-半乳糖苷酶,主要是因为微生物具有生命力强、繁殖速度快、不受季节影响、无污染及易于分离等优势。因此选育微生物菌种仍是生产β-半乳糖苷酶的主要方式[14]。本研究为β-半乳糖苷酶的生产提供了科学依据。
本研究发现了2株产细菌素的乳酸菌Y9-1和Y13-1,所产细菌素对金黄色葡萄球菌、大肠埃希菌、单核细胞增生李斯特氏菌均有较强抑制作用,具有广谱抑菌活性。细菌素是由某些细菌在发酵过程中通过核糖体合成产生的一类有抑(杀) 菌活性的蛋白或多肽类物质[25-27]。其作用机制特殊,致病菌不会对其产生耐药性,也不会像抗生素一样产生耐药株,由于其本质是多肽,在人体内会被蛋白酶消化,因而不会改变人体肠道正常菌群的存活,已经成为现阶段乃至今后很长一段时间微生物天然防腐剂的研究热点[28],本研究为研究者今后进一步研究这2种细菌素的分子结构、抑菌机制等奠定了基础,为发现新的更安全的食品添加抑菌剂提供了素材。
本研究分离得到的嗜热链球菌、粪肠球菌和马其顿链球菌凝乳能力强,坚忍肠球菌凝乳能力弱,发酵乳杆菌和乳明串珠菌不具有凝乳能力。凝乳时间是指牛乳经乳酸菌发酵凝结呈果冻状且倾斜无液态流动时所需的时间,凝乳时间决定着乳酸菌的凝乳能力[21],凝乳能力是乳酸菌是否适合作为乳制品发酵剂的一项重要考察指标,本研究为开发具有特色的发酵制品提供了理论依据。
[1] 任卫合,徐轶飞,罗龙龙,等.牦牛乳的研究进展[J].食品研究与开发,2020,41(24):219-224.
REN W H, XU Y F, LUO L L, et al.Research progress of yak milk[J].Food Research And Development, 2020,41(24):219-224.
[2] 崔美岩. 青藏高原不同材料来源乳酸菌极端环境耐受性及优良菌株益生性的初步研究[D].郑州:郑州大学,2017.
CUI M Y.Extreme environmental tolerance of LAB from different materials from the Qinghai-Tibet plateau and preliminary study on the probability of excellent strains[D].Zhengzhou:Zhengzhou University, 2017.
[3] JIA H,REN S P,WANG X.Heat-killed probiotic regulates the body′s regulatory immunity to attenuate subsequent experimental autoimmune arthritis[J].Immunology Letters,2019,216:89-96.
[4] 冯光春,陈炼红,李键.自然发酵牦牛酸乳中乳酸菌的研究现状[J].中国乳品工业,2018,46(3):38-40.
FENG G C, CHEN L H, LI J.Research status of lactic acid bacteria in natural fermented yak yogurt[J].China Dairy Industry,2018,46(3):38-40.
[5] 王昕,侯聚敏,付丽丽,等.产β-半乳糖苷酶乳酸菌的筛选及其益生性研究[J].中国乳品工业,2012,40(8):20-23.
WANG X, HOU J M, FU L L, et al.In vitro screening of lactic acid bacteria producing β-galactosidase and their probiotic characteristics[J].China Dairy Industry, 2012,40(8):20-23.
[6] 刘国荣,王成涛,孙宝国.长寿老人源双歧杆菌BL-8产细菌素的提纯及其分子特性[J].中国食品学报,2018,18(5):115-121.
LIU G R, WANG C T, SUN B G.Purification and molecular characteristics of bacteriocin produced by Bifidobacterium BL-8 from centenarians′ intestine[J].Journal of Chinese Institute of Food Science and Technology, 2018,18(5):115-121.
[7] 张兴吉. 中国西部牧区乳源性乳酸菌分离鉴定及其发酵特性研究[D].杨凌:西北农林科技大学,2018.
ZHANG X J.Isolation, identification and fermentation characteristics of lactic acid bacteria isolated from fermented handmade dairy of pastoral areas in western China[D].Yangling:Northwest A&F University, 2018.
[8] 刘丽,郝彦玲,张红星,等.1 株产细菌素植物乳杆菌的筛选及所产细菌素的理化性质分析[J].中国食品学报,2011,11(6):47-52.
LIU L, HAO Y L, ZHANG H X, et al.Study on screening of Lactobacillus plantarum for producing bacteriocin and its physicochemical characteristics[J].Journal of Chinese Institute of Food Science and Technology, 2011,11(6):47-52.
[9] 马国涵,马欢欢,吕欣然,等.大菱鲆肠道中广谱拮抗活性乳酸菌的筛选及其细菌素鉴定[J].食品科学,2019,40(6):159-165.
MA G H, MA H H, LYU X R,et al.Screening for broad-spectrum antagonistic lactic acid bacteria from intestine of turbot and identification of bacteriocin produced by it[J].Food Science, 2019,40(6):159-165.
[10] 张勇,吕嘉枥,闫亚梅,等.传统发酵浆水中乳酸菌和酵母菌的分离与鉴定[J].中国食品学报,2017,17(6):179-186.
ZHANG Y, LYU J L, YAN Y M, et al.Isolation and identification of lactic acid bacteria and yeast from traditional fermentative pickle juice[J].Journal of Chinese Institute of Food Science and Technology, 2017,17(6):179-186.
[11] 李巧玉,陈坚,曾伟主,等.酱醪中魏斯氏菌的分离及特性分析[J].微生物学通报,2018,45(11):2 449-2 462.
LI Q Y, CHEN J, ZENG W Z, et al.Isolation and characterization of Weissella strains from soy sauce moromi mash[J].Microbiology China, 2018,45(11):2 449-2 462.
[12] 王丽军,牟元珍,关波,等.传统奶酪中产转糖基活性β-半乳糖苷酶乳酸菌的筛选鉴定及其合成低聚半乳糖条件[J].食品科学,2019,40(22):88-95.
WANG L J, MOU Y Z, GUAN B, et al.Screening and identification of lactic acid bacteria producing β-galactosidases with transglycosylation activity from traditional cheese, and optimization of conditions for galacto-oligosaccharides synthesis[J].Food Science,2019,40(22):88-95.
[13] JI D W, OEY I, AGYEI D.Purification, characterization and thermal inactivation kinetics of β-galactosidase from Lactobacillus leichmannii 313[J].LWT,2019,116:108545.
[14] 黄倩,李洁,郑晓春,等.奶酪中高产β-半乳糖苷酶菌株的筛选及发酵条件的优化[J].中国调味品,2021,46(2):23-30.
HUANG Q, LI J, ZHENG X C, et al.Screening of high-yield β-galactosidase strains in cheese and optimization of fermentation conditions[J].China Condiment, 2021,46(2):23-30.
[15] 宋园亮,殷建忠,张忠华,等.云南传统发酵豆豉中产β-半乳糖苷酶乳酸菌的筛选及其产酶条件的研究[J].中国微生态学杂志,2011,23(5):398-403.
SONG Y L, YIN J Z, ZHANG Z H, et al.Screening of β-galactosidase producing lactic acid bacteria from yunnan traditional douchi and its enzyme producing condition[J].Chinese Journal of Microecology, 2011,23(5):398-403.
[16] 胡彦新.食品乳杆菌FM-MM4产细菌素的分离纯化及其特性研究[D].南京:南京农业大学,2017.
HU Y X.Purification and Partial Characteriaztiong of Bacteriocin Produced by Lactobacillus alimentarius FM-MM4[D].Nanjing:Nanjing Agricultural University,2017.
[17] 国家食品药品监督管理总局.GB 4789—2016 食品安全国家标准 食品微生物学检验[S].北京:中国标准出版社,2016.
China Food and Drug Administration.GB 4789—2016 National standard for food safety Food microbiology test[S].Beijing:Standard Press of China, 2016.
[18] 郭兴华.益生乳酸细菌:分子生物学及生物技术[M].北京:科学出版社,2017:349-351.
GUO X H.Probiotic Lactic Acid Bacteria: Molecular Biology and Biotechnology[M].Beijing:Science Press, 2017:349-351.
[19] 国家药典委员会.中华人民共和国药典2020年版四部[S].北京:中国医药科技出版社,2020:184-185.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China 2020 edition of four[S].Beijing:China Medical Science Press, 2020:184-185.
[20] 周晏阳,孔雪英,吴梅,等.1株牦牛源产细菌素植物乳杆菌的益生特性分析[J].食品科学,2018,39(14):132-137.
ZHOU Y Y, KONG X Y, WU M, et al.Probiotic characteristics of a bacteriocin-producing Lactobacillus plantarum strain from yak[J].Food Science, 2018,39(14):132-137.
[21] 华鹤良. 乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].扬州:扬州大学,2014.
HUA H L.Isolation, identification, antibacterial peptide activities and fermentation performance of lactic acid bacteria[D].Yangzhou:Yangzhou University, 2014.
[22] CHRIST A P G, RAMOS S R, CAY R, et al.Characterization of Enterococcus species isolated from marine recreational waters by MALDI-TOF MS and Rapid ID API® 20 Strep system[J].Marine Pollution Bulletin,2017,118(1-2):376-381.
R, et al.Characterization of Enterococcus species isolated from marine recreational waters by MALDI-TOF MS and Rapid ID API® 20 Strep system[J].Marine Pollution Bulletin,2017,118(1-2):376-381.
[23] LIN J N,LAI C H,YANG C H, et al.Comparison of four automated microbiology systems with 16S rRNA gene sequencing for identification of Chryseobacterium and Elizabethkingia species.[J].Scientific Reports,2017,7(1):13824.
[24] IBRAHIM S A,O'SULLIVAN D J.Use of chemical mutagenesis for the isolation of food grade beta-galactosidase overproducing mutants of bifidobacteria, lactobacilli and Streptococcus thermophilus[J].Journal of Dairy Science,2000,83(5):923-930.
[25] BOLINTINEANU D, HAZRATI E, DAVISH T,et al.Antimicrobial mechanism of pore-forming protegrin peptides:100 pores to kill E.coli[J].Peptides,2010,31(1):1-8.
[26] SIVARAJ A, SUNDAR R, MANIKKAM R,et al.Potential applications of lactic acid bacteria and bacteriocins in anti-mycobacterial therapy[J].Asian Pacific Journal of Tropical Medicine,2018,11(8):453.
[27] BRÖTZ H,BIERBAUM G,MARKUS A,et al.Mode of action of the lantibiotic mersacidin:Inhibition of peptidoglycan biosynthesis via a novel mechanism?[J].Antimicrobial Agents and Chemotherapy,1995,39(3):714-719.
[28] 刘静,杨富民,白斌芳,等.产细菌素乳酸菌菌株的来源及所产细菌素的分类研究进展[J].中国酿造,2018,37(6):20-24.
LIU J, YANG F M, BAI B F,et al.Research progress on the source of bacteriocin-producing lactic acid bacteria and classification of the bacteriocin[J].China Brewing, 2018,37(6):20-24.