黄瓜果实脆甜清香,营养价值丰富,在我国的种植规模及产量均位居世界第一。但黄瓜在7~10 ℃的低温环境下易发生冷害[1],造成黄瓜在贮运中损失严重。在抑制冷害方面,目前常用的方式有植物生长调节剂、化学物质处理[2]、热处理及控制贮运温度等。前两者的处理方式虽效果显著,但消费者甚至商家由于不具备专业知识,即使是安全的处理技术,也因无法确信其是否安全而影响其推广使用;热处理则由于影响因素较多效果难控制,且处理时间长效率较低[3];控温车贮运成本过高,实际应用困难。
包装是产品流通的必备材料,如果能拓展其功能,成为一种控制农产品冷害的方法,实现在不增加成本的情况下,一物多能,不失为一种很有意义的方式。农产品在采摘后进入冷库贮藏前,为避免发生因温度下降太快而导致的冷害现象,会采用逐渐降温的方式,使产品适应温度变化后,再进入最终目标温度下贮藏。有研究表明李果[4]、猕猴桃[5]、哈密瓜[6]等果实通过恰当的降温处理能够明显减轻其冷害症状,使果蔬保持长期的贮藏品质。根据这一原理,利用泡沫箱材料的温度低传导性,用其包装农产品后,直接放入目标温度环境,泡沫箱内的温度可缓慢降至冷库温度,实现逐渐降温的效果,避免了冷库调温或准备多个冷库进行梯度降温的成本增加及效率降低等问题。此外,“膜脂相变”是冷害机制研究中最被认可的一种机制,其理论认为,在低温下细胞膜脂会由液晶态转变为凝胶态,导致细胞膜的膜相发生分离,进而细胞膜渗透性增大,细胞内的可溶性物质和电解质渗漏加剧,最终造成冷害的产生[7]。但目前有关泡沫包装箱对果蔬冷害作用的研究文献较少。本试验研究了薄膜包装、泡沫箱包装、薄膜泡沫箱复合包装3种不同包装方式对黄瓜冷害的抑制作用,为黄瓜高效低成本贮运提供理论依据和技术支撑。
表面完好无损、无病虫害的长黄瓜,购于天生农贸市场;原生态3号EPS(可发性聚苯乙烯)包装箱泡沫箱,其外尺寸:41.5 cm×31 cm×20 cm,内尺寸:36.5 cm×26 cm×15.5 cm,壁厚:2.4 cm,购于成都泡沫箱工厂店;食品用妙洁PE保鲜膜,购于天生街道永辉超市;化学试剂均为分析纯。
RXZ-8000智能人工气候箱,宁波东南仪器有限公司;UV-2450PC紫外可见分光光度计,日本岛津公司;DDS-307A电导率仪,上海雷磁公司;GY-4数显式果实硬度计,浙江乐清艾德堡仪器有限公司;GSP-6温湿度记录仪,江苏省精创电气股份有限公司;DHG-9245A电热恒温鼓风干燥箱,上海齐欣科学仪器。
1.3.1 样品准备
将长黄瓜的表面附着物及泥土清理干净后备用。本试验黄瓜随机分为4个组,分别进行以下4组处理:(1)对照(CK)组:无包装;(2)A组:聚乙烯(polyethene,PE)薄膜组,用PE薄膜将黄瓜包裹3层;(3)B组:泡沫箱组,将黄瓜置于泡沫箱内,做好密封;(4)C组:PE薄膜泡沫箱复合组,将黄瓜用薄膜包裹3层后放入泡沫箱中密封。每组每箱2 000 g左右,每个处理设置3个重复。将各组包装好的黄瓜置于人工气候箱内,箱中环境设置为4 ℃、相对湿度(relative humidity,RH)85%~95%,在该条件下贮藏6 d,每天随机取样1次,测定各项指标。
1.3.2 指标检测
1.3.2.1 中心温度
参考程曦[8]的方法进行测定,并稍作修改。用温湿度计测定。将探头插入黄瓜中间位置,保证探头在各个黄瓜内位置一致,每1 h记录1次读数,读数稳定后记录测量结果即为黄瓜中心温度。
1.3.2.2 冷害指数
参考艾文婷等[9]的方法进行测定,黄瓜冷害症状一般表现为:表面凹陷或出现水渍斑、褐色斑,果柄一端开始腐烂等。将黄瓜的冷害程度分为4级:1级—冷害面积≤25%;2级—冷害面积25%~50%;3级—冷害面积50%~75%;4级—冷害面积≥75%。冷害指数计算见公式(1):
冷害指数![]()
(1)
1.3.2.3 呼吸强度
参考曹建康等[10]的静置法进行测定。将1 kg左右的黄瓜果实置于干燥器中,底部放入盛有10 mL 0.4 mol/L NaOH的培养皿,封盖密闭1 h后取出培养皿,用0.2 mol/L的草酸溶液进行滴定,根据滴定结果计算黄瓜的呼吸强度,单位以mg CO2/(kg·h)表示。
1.3.2.4 失重率
采用称重法测定,失重率计算如公式(2)所示:
黄瓜失重率![]()
(2)
1.3.2.5 硬度
使用艾德堡GY-4硬度计进行黄瓜硬度的测定,选用的探头直径为11 mm。将黄瓜削去果皮后,在黄瓜的瓜头、瓜身、瓜尾3个部位各随机取3个点进行测定[11]。测定时探头垂直于待测黄瓜表面,匀速将压头压入果实内10 mm,读取电子屏幕示数,即黄瓜的硬度值单位以N表示。计算平均值及标准差。
1.3.2.6 相对电导率
参照曹建康等[10]的方法并稍作修改,先用直径4 mm的打孔器在厚度为5 mm的黄瓜切片横截面上打取圆块,称取3.0 g圆块置于100 mL的烧杯中并加入40 mL蒸馏水进行浸泡,1 h后测定浸泡液中的电导率(γ1)。然后在烧杯上覆盖双层保鲜膜后沸水浴15 min,取出冷却至室温后再次测定其电导率(γ0),根据煮沸前后的电导率计算得出相对电导率(γe),计算见公式(3):
(3)
1.3.2.7 丙二醛(malondialdehyde,MDA)含量
采用硫代巴比妥酸(thiobarbituric acid,TBA)法[10]进行测定。称取1.0 g黄瓜鲜样放于经预冷后的研钵中,其中加入4.0 mL 100 g/L 三氯乙酸溶液,冰浴条件下研磨成匀浆,并于4 ℃、10 000 r/min离心20 min,收集上清液备用。取2.0 mL上清液并向其中加入2.0 mL 6.7 g/L TBA溶液,在沸水浴中处理20 min,取出冷却后再离心1次,分别测定样品在450、532、600 nm处的吸光度。每克黄瓜鲜样中的MDA含量用nmol/g表示。
1.3.2.8 超氧阴离子自由基![]() 产生速率
产生速率
参照邵婷婷等[12]的方法并稍作修改。![]() 生成速率根据亚硝酸钾的标准曲线计算。称取2 g黄瓜鲜样,加入4.0 mL提取缓冲液,冰浴研磨成浆,于4 ℃、12 000 r/min离心20 min,取l mL上清液加入50 mmol/L pH 7.8磷酸缓冲液和1 mmol/L盐酸羟胺溶液各1 mL,摇匀后于25 ℃保温1 h。取出后加入17 mmol/L对氨基苯磺酸溶液及7 mmol/L α-萘胺溶液各1 mL进行20 min显色反应,测定其在530 nm处的吸光度,根据标准曲线计算
生成速率根据亚硝酸钾的标准曲线计算。称取2 g黄瓜鲜样,加入4.0 mL提取缓冲液,冰浴研磨成浆,于4 ℃、12 000 r/min离心20 min,取l mL上清液加入50 mmol/L pH 7.8磷酸缓冲液和1 mmol/L盐酸羟胺溶液各1 mL,摇匀后于25 ℃保温1 h。取出后加入17 mmol/L对氨基苯磺酸溶液及7 mmol/L α-萘胺溶液各1 mL进行20 min显色反应,测定其在530 nm处的吸光度,根据标准曲线计算![]() 的物质的量。以每克黄瓜样品每分钟产生的超氧阴离子的物质的量作为超氧阴离子自由基的产生速率,表示为nmol/(min·g)。
的物质的量。以每克黄瓜样品每分钟产生的超氧阴离子的物质的量作为超氧阴离子自由基的产生速率,表示为nmol/(min·g)。
1.3.2.9 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照曹建康等[10]的方法并稍作修改,称取2.0 g黄瓜鲜样于经预冷后的研钵中,向其中加入3.0 mL提取缓冲液,冰浴研磨成匀浆后于4 ℃、12 000 r/min离心30 min,收集上清液低温保存。利用氮蓝四唑(nitro-blue tetrazolium,NBT)还原法来测定SOD活性,以每克黄瓜鲜样在560 nm处每分钟对NBT光化还原抑制达50%为1个SOD活性单位(U)。
1.3.2.10 过氧化氢酶(catalase,CAT)活性
参照曹建康等[10]的方法,并稍作修改。称取1.0 g黄瓜鲜样于经预冷后的研钵中,向其中加入4.0 mL提取缓冲液,冰浴研磨成浆后于4 ℃、12 000 r/min离心30 min,收集上清液低温保存。往试管中加入100 μL酶液和2.9 mL 0.02 mol/L H2O2溶液,以蒸馏水作参比,测定反应液在240 nm处的吸光度值,以每克黄瓜样品每分钟吸光度变化0.01为1个CAT酶活性单位,表示为0.01ΔOD240/(min·g)。
1.3.2.11 过氧化物酶(peroxidase,POD)活性
参考许婷婷等[13]的方法并稍作修改。称取2.0 g黄瓜鲜样于经预冷后的研钵中,向其中加入4.0 mL提取缓冲液,冰浴研磨成匀浆后于4 ℃、12 000 r/min离心30 min,收集上清液低温保存。向试管中加入3.0 mL 25 mmol/L愈创木酚溶液及500 μL酶提取液,加入200 μL 0.5 mol/L H2O2溶液后启动反应。记录反应在470 nm处的吸光度变化,以每克黄瓜鲜样每分钟吸光度变化1为1个POD活性单位,表示为ΔOD470/(min·g)。
1.3.2.12 游离脯氨酸含量
参考ZENG等[14]的方法并稍作修改。称取2.0 g黄瓜鲜样于经预冷后的研钵中,向其中加4 mL 30 g/L磺基水杨酸,冰浴研磨成匀浆后在沸水浴下提取10 min,冷却后于4 ℃、10 000 r/min离心20 min,收取上清液备用。吸取2.0 mL上清液于试管中,向其中加入2.0 mL冰醋酸和3.0 mL酸性茚三酮溶液后沸水浴提取30 min,冷却后加入4.0 mL甲苯并摇匀振荡 30 s,待静置分层后于520 nm下测定上清液吸光度,根据标准曲线查询计算游离脯氨酸含量,单位为μg/g。
采用Microsoft Excel 2016对试验数据进行整理计算,使用SPSS 18.0单因素方差分析(One-way ANOVA)和Duncan多重比较分析对各项指标进行显著性分析,P<0.05表示有显著性差异,P<0.01表示有极显著性差异,P>0.05表示差异不显著;用Origin 8.6对数据结果进行作图。
如图1所示,各组的中心温度随着贮藏时间的延长均在逐渐下降,其中,CK组下降速度最快,在第10小时温度降为2.2 ℃;A组温度下降速度较CK组慢,在第14 h温度降为2.4 ℃;而B、C组温度下降较平缓,在第36 h温度分别降为4.2和4.3 ℃,2组间差异不大,并且经包装后的黄瓜最终中心温度稍高于未包装的CK组。表明包装处理可以延缓箱内黄瓜中心温度的变化,其中泡沫箱保温效果最好,这与折弯弯等[15]的研究结果一致。而薄膜包装虽然对温度下降有延缓作用,但温度控制能力较弱。

图1 不同包装材料对黄瓜低温贮藏下中心温度的影响
Fig.1 Effect of different packaging materials on the central
temperature of cucumbers under low temperature storage
冷害指数是果实内部一系列冷害相关生理生化反应的综合体现,可以较为直观地判断果实冷害发生的程度[9]。如图2所示,在低温贮藏环境下,CK、A组在第3天就发生了轻微的冷害症状,并且随着贮藏时间的延长,2组的冷害程度逐渐加深,到贮藏第6天,CK组的冷害指数达到了0.35,A组冷害指数也达到了0.15。而B、C组则在整个贮藏期间均未出现冷害症状。原因可能是B、C组由于泡沫箱的保温作用,箱内温度下降缓慢,并且在缓慢降温期间2组对低温有了一定的抵抗能力,即完成了冷驯化。而A组虽然对于冷害有一定的抑制作用,但效果并不理想,可能是因为薄膜包装对减缓温度下降的效果不明显。因此,B、C组对于抑制冷害具有显著作用,说明泡沫箱包装可以明显抑制冷害症状的出现。

图2 不同包装材料对黄瓜低温贮藏下冷害指数的影响
Fig.2 Effect of different packaging materials on cold injury
index of cucumber under low temperature storage
LYONS[7]指出,当果蔬受到冷害后,呼吸会异常升高,并且随着冷害的发展,其呼吸强度又会出现显著的下降,这是其不可逆生理伤害的开始。如图3所示,由于在贮藏第3天前各组中心温度逐渐降低,且冷害症状尚未出现,各组呼吸强度随时间延长均在降低,并且CK、A组由于中心温度下降更快而呼吸强度略低于B、C组。而由于CK、A组在贮藏后期发生冷害,因此第3天后呼吸强度急剧上升,第4天到达最高峰26.41 mg CO2/(kg·h);A组较CK组上升较慢,在第5天到呼吸最高峰22.72 mg CO2/(kg·h);而B、C两组在第3天后呼吸强度继续降低并逐渐趋于平缓,与CK、A组差异极显著(P<0.01),但2组间差异并不显著(P>0.05),可能是由于2组并未发生冷害症状,使得2组泡沫箱箱内黄瓜呼吸受到抑制。因此,泡沫箱包装能够明显抑制黄瓜呼吸强度的急速上升,保持黄瓜品质。这与李跃红等[16]的研究结论一致。

图3 不同包装材料对黄瓜低温贮藏下呼吸强度的影响
Fig.3 Effects of different packaging materials on the respiration
intensity of cucumber under low temperature storage
采后果蔬的生命活动仍然在继续,并且随着蒸腾作用及呼吸作用的进行,果蔬中的水分及营养物质也会随之消耗,从而造成果蔬的重量损失[17]。如图4所示,各组黄瓜失重率随贮藏时间的延长而增大,其中CK组失重率上升最快,从第1天起就与其他各组就形成了极显著差异(P<0.01),至第6天时CK组失重率达到8.88%;A组失重率上升幅度较CK组明显减弱,但第3天后与B、C组有显著差异(P<0.05),至贮存期结束失重率达到1.14%;而B、C组失重率增加最为缓慢,且2组差异不显著(P>0.05),至贮藏期结束失重率仅分别为0.12%和0.058%。表明包装可以明显抑制失重率的上升,减少了黄瓜重量的损失,这与TEKALE等[18]的研究结论一致。原因可能是包装降低了黄瓜呼吸速率的上升,减弱了蒸腾作用,而且泡沫箱包装和泡沫箱薄膜复合包装效果最好。
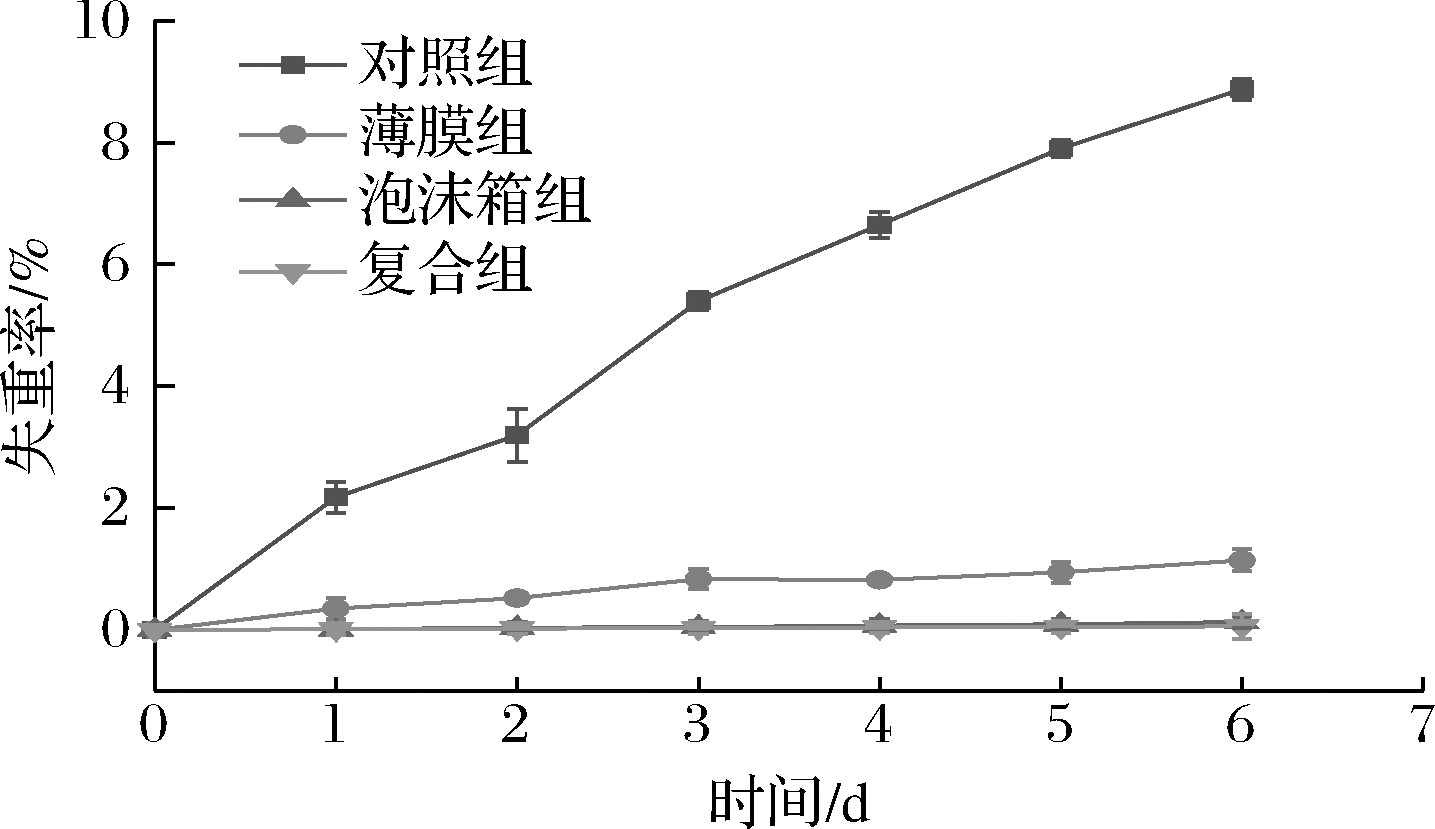
图4 不同包装材料对黄瓜低温贮藏下失重率的影响
Fig.4 Effect of different packaging materials on weight
loss rate of cucumber under low temperature storage
果蔬的硬度与细胞壁中纤维素、果胶和半纤维素形成的交联结构紧密相关,在低温胁迫下,细胞壁结构会发生降解[19],进而果蔬硬度就会下降。如图5所示,各组黄瓜随贮藏时间的延长硬度逐渐降低。在第2天开始,CK组与其他组差异显著(P<0.05),并且在第5天后差异极显著(P<0.01),至贮藏期结束硬度降为初始值的73%。其原因可能是CK组失重率的持续增大及后期呼吸速率的急剧上升,使得黄瓜内水分及干物质迅速被消耗[17],并且冷害产生后细胞壁结构发生降解,导致硬度下降;A、B、C 3组硬度降低速度较CK组明显减弱,但A组仍下降较快,贮藏期结束时硬度降为初始值的87%;而B、C组至贮藏结束硬度仍保持在初始硬度的90%以上。综合而言,泡沫箱包装组和泡沫箱薄膜复合包装组硬度下降最慢,对硬度的保持最好,延缓了黄瓜的软化。

图5 不同包装材料对黄瓜低温贮藏下硬度的影响
Fig.5 Effect of different packaging materials on the
hardness of cucumber under low temperature storage
在低温逆境时,植物膜透性会增加,导致电解质大量外渗[20],因此,相对电导率可直接反映出细胞膜透性的改变以及细胞被破坏情况。如图6所示,各组相对电导率随贮藏时间的延长而增大,其中CK组上升速度最快,至贮藏结束相对电导率达到57.55%,并且在贮藏期间与B、C组差异极显著(P<0.01);A组较CK组相对电导率相对较小,贮藏结束达到47.68%,并且在第2天~第5天与B、C组差异显著(P<0.05);B、C组相对电导率增加幅度最小,在贮藏结束时数值分别为40.71%、41.46%,且2组差异不显著(P>0.05)。综合而言,包装能够明显降低细胞电解质的泄露,保护细胞不被破坏[21],其中,泡沫箱包装组和泡沫箱薄膜复合包装组保护效果最佳。

图6 不同包装材料对黄瓜低温贮藏下相对电导率的影响
Fig.6 Effect of different packaging materials on the relative
conductivity of cucumber under low temperature storage
MDA是膜脂过氧化作用的主要产物之一,通常将其含量作为脂脂过氧化指标,反应细胞膜脂过氧化的程度[10,22]。如图7所示,各组在低温环境下MDA含量随贮藏时间的延长而增大,并且CK组上升最快,至贮藏期结束MDA含量达到2.06 nmol/g;A组MDA含量上升较CK组慢,至贮藏期结束含量也达到了1.87 nmol/g,并且贮藏期间与CK组差异显著(P<0.05);B、C则至贮藏期结束MDA含量分别仅为1.20、1.35 nmol/g,与CK组差异极显著(P<0.01)。结果表明包装可以显著降低MDA含量,降低细胞膜脂过氧化的程度,其中,泡沫箱包装组和泡沫箱薄膜复合包装组效果最好。

图7 不同包装材料对黄瓜低温贮藏下MDA的影响
Fig.7 Effect of different packaging materials on
cucumber MDA under low temperature storage
植物体遭受逆境胁迫后首先出现的活性氧就是![]() 而其他的活性氧也主要来源于
而其他的活性氧也主要来源于![]() 含量的高低是决定机体受到逆境胁迫损害的重要因素之一[23]。如图8所示,各组在低温环境下
含量的高低是决定机体受到逆境胁迫损害的重要因素之一[23]。如图8所示,各组在低温环境下![]() 产生速率随贮藏时间的延长呈先下降后上升的趋势。由于前期冷害尚未发生,并且温度较低,各组黄瓜的呼吸强度也在逐渐降低,因此
产生速率随贮藏时间的延长呈先下降后上升的趋势。由于前期冷害尚未发生,并且温度较低,各组黄瓜的呼吸强度也在逐渐降低,因此![]() 产生速率也呈下降趋势,并且CK、A组下降程度要强于B、C组,在第2天差异显著(P<0.05)。自第2天后,CK、A组
产生速率也呈下降趋势,并且CK、A组下降程度要强于B、C组,在第2天差异显著(P<0.05)。自第2天后,CK、A组![]() 产生速率开始逐渐上升,且CK组与B、C组差异极显著(P<0.01),与A组差异显著(P<0.05),至第6天时CK组
产生速率开始逐渐上升,且CK组与B、C组差异极显著(P<0.01),与A组差异显著(P<0.05),至第6天时CK组![]() 产生速率达到0.39 μmol/(min·g),但仍低于初始的0.61 μmol/(min·g);而B、C组在第4天后
产生速率达到0.39 μmol/(min·g),但仍低于初始的0.61 μmol/(min·g);而B、C组在第4天后![]() 产生速率才开始上升,上升速度明显低于CK、A组,并且2组差异不显著(P>0.05),应该是由于B、C组并无冷害症状产生,受到的低温胁迫相对较弱。说明包装明显可以降低
产生速率才开始上升,上升速度明显低于CK、A组,并且2组差异不显著(P>0.05),应该是由于B、C组并无冷害症状产生,受到的低温胁迫相对较弱。说明包装明显可以降低![]() 产生速率,并且泡沫箱包装还可以推迟低温下
产生速率,并且泡沫箱包装还可以推迟低温下![]() 产生速率上升的时间,因此,泡沫箱包装和泡沫箱薄膜复合包装可以明显抑制
产生速率上升的时间,因此,泡沫箱包装和泡沫箱薄膜复合包装可以明显抑制![]() 的产生,保护黄瓜免受低温损害。
的产生,保护黄瓜免受低温损害。

图8 不同包装材料对黄瓜低温贮藏下![]() 的影响
的影响
Fig.8 Effects of different packaging materials on ![]() under
under
low temperature storage of cucumber
SOD被誉为对氧化胁迫的第一防线[24],能通过歧化反应清除生物细胞中的超氧阴离子自由基,生成H2O2,H2O2进而可以被CAT、POD等协同清除,分解H2O2为O2和H2O[25]。如图9所示,各组SOD活性在第1天均上升,并且CK组的上升幅度最大,这可能是黄瓜对低温的一种应激反应[26]。之后随贮藏时间的延长SOD活性呈先下降后上升的趋势,并且CK组下降速度最快,在第3天~第5天与其他3组有显著差异(P<0.05);而所有包装组均能抑制SOD活性的降低,其中B组始终维持着最高的SOD活性,在第5天时B组活性是CK组的1.27倍。各组在第6天时SOD活性全都增大可能是由于贮藏后期![]() 产生速率的上升。结果说明包装可以显著抑制SOD活性的降低,增强了黄瓜清除氧自由基的能力,保护了黄瓜的品质,其中泡沫箱包装和泡沫箱薄膜复合包装组效果最好。
产生速率的上升。结果说明包装可以显著抑制SOD活性的降低,增强了黄瓜清除氧自由基的能力,保护了黄瓜的品质,其中泡沫箱包装和泡沫箱薄膜复合包装组效果最好。

图9 不同包装材料对黄瓜低温贮藏下SOD活性的影响
Fig.9 Effect of different packaging materials on SOD of
cucumber under low temperature storage
CAT是植物生物防御系统的关键酶,能通过催化过氧化物使其分解。CAT活性增加是清楚多余H2O2对代谢组织伤害的适应特征[27]。如图10所示,各组CAT活性整体呈现先上升后下降的趋势,并且CK、A组与B、C组差异显著(P<0.05),而在贮藏前2 d,各组CAT活性有应激下降的趋势,可能是因为各组外部环境温度降低,使得![]() 产生速率下降。从第3天起各组活性呈现上升趋势,并且CK组与其他各组产生显著差异(P<0.05);从图中可以看出,各组CAT活性在第4天均到达峰值,CK、A、B、C组数值分别为35.58、38.37、42.47、44.62,B、C组差异不显著(P>0.05)。因此,包装可以明显提升贮藏后期CAT活性,消除黄瓜内的
产生速率下降。从第3天起各组活性呈现上升趋势,并且CK组与其他各组产生显著差异(P<0.05);从图中可以看出,各组CAT活性在第4天均到达峰值,CK、A、B、C组数值分别为35.58、38.37、42.47、44.62,B、C组差异不显著(P>0.05)。因此,包装可以明显提升贮藏后期CAT活性,消除黄瓜内的![]() 及其他活性氧物质,维持黄瓜的品质,其中B、C组提升效果最好。
及其他活性氧物质,维持黄瓜的品质,其中B、C组提升效果最好。

图10 不同包装材料对黄瓜低温贮藏下CAT活性的影响
Fig.10 Effect of different packaging materials on CAT of
cucumber under low temperature storage
POD是通过催化一些底物与H2O2发生氧化还原反应,在底物被氧化的同时H2O2也被分解[28],与SOD、CAT等酶可以相互协调,及时清除植物体内过多的活性氧和自由基。如图11所示,各组POD活性随贮藏时间的延长整体呈现先上升后下降的趋势,其中B、C组活性始终高于CK、A组,除第2天外差异显著(P<0.05),且第3天起2组与CK组差异极显著(P<0.01)。在第1天时B、C组的POD活性上升,可能是由于2组黄瓜中心温度较高,呼吸强度也较强,而后黄瓜中心温度降低使得POD活性下降。第2天后各组活性逐渐上升,并在先后到达高峰后开始下降,其中B、C组无显著差异(P>0.05)且下降速度明显低于CK、A组。表明包装可以明显提升POD活性并延缓贮藏后期的下降,维持黄瓜内较高的POD活性,与CAT、SOD协同清除黄瓜内自由基,保持黄瓜免受冷害,并且B、C组效果最佳。
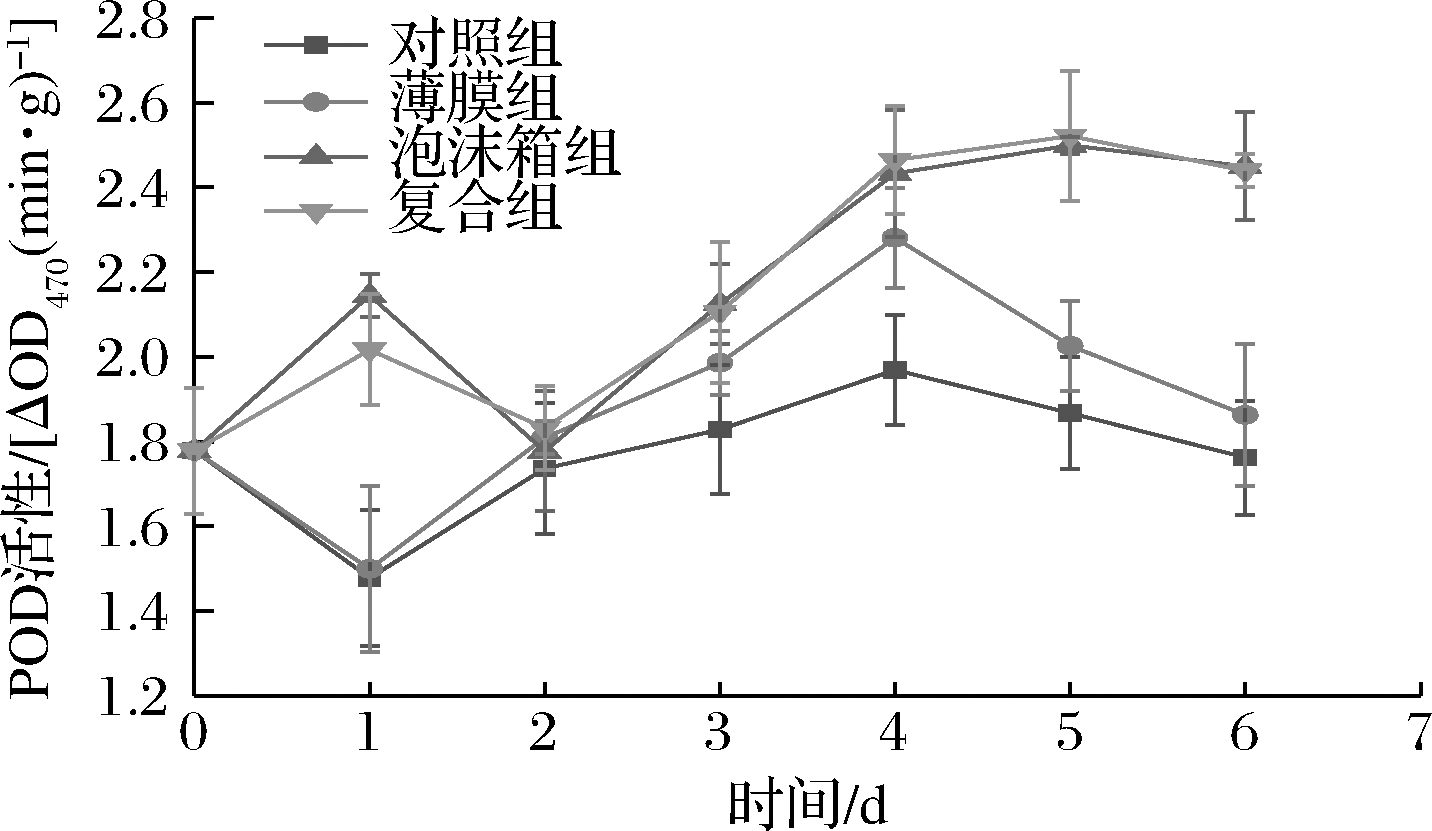
图11 不同包装材料对黄瓜低温贮藏下
POD活性的影响
Fig.11 Effect of different packaging materials on POD of
cucumber under low temperature storage
植物脯氨酸的积累同其对逆境的耐受能力呈正相关[29]。当植物面对低温等非生物胁迫时,会使脯氨酸大量合成和积累[30]。如图12所示,在第1天时,各组游离脯氨酸的含量都会出现上升现象,并且由于CK组温度下降最快而使得游离脯氨酸含量上升最高,达到42.22 μg/g,与其他组差异显著(P<0.05);从第2天起,各组游离脯氨酸含量呈现先上升后下降的趋势,这与殷建东[19]的研究结果一致。在贮藏前期,各组游离脯氨酸含量持续升高,在第4天到达高峰,之后开始逐渐下降,包装可以促进贮藏期间游离脯氨酸的合成和积累,各组间差异显著(P<0.05),并且B、C组与CK组差异极显著(P<0.01)。说明包装处理可有效促进黄瓜游离脯氨酸的合成与积累,并能抑制其在冷藏后期的降解,其中,泡沫箱包装和泡沫箱薄膜复合包装组效果最好。

图12 不同包装材料对黄瓜低温贮藏下游离脯氨酸含量
的影响
Fig.12 Effect of different packaging materials on free proline in
cucumber under low temperature storage
本实验探究了泡沫箱对抑制黄瓜冷害的影响,结果表明,所有包装处理都能够延缓箱内黄瓜中心温度的变化,减弱其蒸腾作用和呼吸速率,抑制失重率增大和硬度下降。但薄膜包装对温度控制能力较弱,导致黄瓜在后期遭受低温胁迫,呼吸速率升高又下降。泡沫箱组和泡沫薄膜复合组都能更好地抑制黄瓜相对电导率及MDA含量增加,说明泡沫箱作为隔热材料能使产品实现逐渐降温的作用,增强黄瓜抗冷性,减少瞬间低温对细胞膜的伤害,降低细胞膜脂过氧化程度及细胞电解质的泄露[31],保护了细胞,使其细胞膜脂不会由液晶态转变为凝胶态,避免了细胞膜膜相发生分离[7],以及膜和膜相关蛋白功能的下降[32],达到抑制冷害发生的目的。
在正常情况下,植物体内活性氧(reactive oxygen species,ROS)的产生和清除维持在动态平衡之中,植物体内遭受逆境胁迫后会首先产生![]() 能迅速氧化生物分子,激活反应性更高的ROS(如羟自由基或1O2)的形成,导致膜脂质、蛋白质的过氧化,从而破坏细胞膜的结构与功能[33]。而泡沫箱组和泡沫薄膜复合组能更好地延缓温度的快速降低,使黄瓜免受低温损害,减弱了
能迅速氧化生物分子,激活反应性更高的ROS(如羟自由基或1O2)的形成,导致膜脂质、蛋白质的过氧化,从而破坏细胞膜的结构与功能[33]。而泡沫箱组和泡沫薄膜复合组能更好地延缓温度的快速降低,使黄瓜免受低温损害,减弱了![]() 的产生速率,提高黄瓜抗氧化酶(CAT、POD、SOD)活性,增加游离脯氨酸含量,两者共同清除ROS,从而稳定植物细胞膜,增强采后果蔬的抗冷性及控制冷害的程度[29,34-36]。
的产生速率,提高黄瓜抗氧化酶(CAT、POD、SOD)活性,增加游离脯氨酸含量,两者共同清除ROS,从而稳定植物细胞膜,增强采后果蔬的抗冷性及控制冷害的程度[29,34-36]。
综上所述,泡沫箱的隔热作用,使箱内温度下降缓慢,黄瓜对低温有了一定的抵抗能力,完成了黄瓜的冷驯化,从而抑制了冷害症状的产生,所以泡沫箱组和泡沫薄膜复合组都能更好地抑制黄瓜冷害,具有良好的保鲜效果,其中泡沫箱的性价比更高,可优先考虑采用。泡沫箱是一般情况下产品流通的必需品,本研究表明,只要使用得当,完全可以在不增加成本的情况下,增加防止冷害的功能,更好地保持易冷害果蔬流通时的品质。
[1] WANG B, ZHU S J.Pre-storage cold acclimation maintained quality of cold-stored cucumber through differentially and orderly activating ROS scavengers[J].Postharvest Biology and Technology, 2017, 129:1-8.
[2] LI J Y, HAN Y, HU M, et al.Oxalic acid and 1-methylcyclopropene alleviate chilling injury of ‘Youhou’ sweet persimmon during cold storage [J].Postharvest Biology and Technology, 2018, 137:134-141.
[3] HUSSAIN I, RAB A, KHAN N U, et al.Heat treatment effects on chilling injury and disease incidence in sweet orange fruits stored at chilling and non-chilling temperatures[J].Journal of Consumer Protection and Food Safety, 2019, 14(4):365-375.
[4] 魏宝东,周爽,郝义.逐步降温结合1-MCP处理对李果冷害及品质影响[J].食品工业科技, 2017, 38(6):319-323.
WEI B D, ZHOU S, HAO Y.Effects of gradually cooling binding 1-MCP treatment on chilling injury and storage quality of Angeleno plums[J].Science and Technology of Food Industry, 2017, 38(6):319-323.
[5] YANG Q Z, RAO J P, YI S C, et al.Antioxidant enzyme activity and chilling injury during low-temperature storage of Kiwifruit cv.Hongyang exposed to gradual postharvest cooling [J].Horticulture, Environment and Biotechnology, 2012, 53(6):505-512.
[6] 张婷,车凤斌,潘俨,等.逐步降温对哈密瓜果实采后冷害、品质及内源激素的影响[J].西北农林科技大学学报(自然科学版),2016,44(12):143-149.
ZHANG T, CHE F B, PAN Y, et al.Effects of gradual cooling treatment on chilling injury, quality and endogenous hormones of Hami melon(Cucumis melo L.) fruits [J].Journal of Northwest A & F University(Natural Science Edition), 2016, 44(12):143-149.
[7] LYONS J M.Chilling injury in plants [J].Annual Review of Plant Physiology and Plant Molecular Biology, 1973, 24(1): 445-466.
[8] 程曦.控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学, 2017.
CHENG X.Study on the fresh-keeping mechanism and optimization of temperature-controlled packaging in the logistics process of lettuce tip at room temperature[D].Chongqing:Southwest University, 2017.
[9] 艾文婷,张敏,郝爽,等.热激温度对采后黄瓜冷害及活性氧代谢的影响[J].河南农业大学学报, 2019, 53(2):244-250.
AI W T, ZHANG M, HAO S, et al.Effects of heat shock temperature on chilling injury and active oxygen metabolism of postharvest cucumber fruits[J].Journal of Henan Agricultural University, 2019, 53(2):244-250.
[10] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Physiological and Biochemical Experiment Guidance for Fruits and Vegetables after Harvest[M].Beijing:China Light Industry Press, 2007.
[11] 胡红芹,张明玉.燕麦β-葡聚糖对迷你黄瓜保鲜研究[J].粮食与油脂, 2018, 31(11):48-51.
HU H Q, ZHANG M Y.Study on preservation of mini cucumber by oat β-glucan[J].Cereals & Oils, 2018, 31(11):48-51.
[12] 邵婷婷,张敏,刘威,等.采后热水处理对青椒果实低温贮藏期间活性氧代谢及抗氧化物质的影响[J].食品与发酵工业, 2019, 45(12):133-139.
SHAO T T, ZHANG M, LIU W, et al.Effects of postharvest hot water treatment on active oxygen metabolism and antioxidative substances in green peppers during low temperature storage[J].Food and Fermentation Industries, 2019, 45(12):133-139.
[13] 许婷婷,张婷婷,姚文思,等.热处理对低温胁迫下黄瓜活性氧代谢和膜脂组分的影响[J].核农学报, 2020, 34(1):85-93.
XU T T, ZHANG T T, YAO W S, et al.Effect of heat treatment on reactive oxygen species metabolism and membrane lipid constituents of cucumber fruit under low temperature stress[J].Journal of Nuclear Agricultural Sciences, 2020, 34(1):85-93.
[14] ZENG F F, JIANG T J, WANG Y S, et al.Effect of UV-C treatment on modulating antioxidative system and proline metabolism of bamboo shoots subjected to chilling stress[J].Acta Physiologiae Plantarum, 2015, 37(11):1-10.
[15] 折弯弯,程曦,张洪翠,等.蓄冷剂控温泡沫箱对常温物流莴笋尖的保鲜机理[J].食品与发酵工业, 2018,44(3):170-178.
SHE W W, CHENG X, ZHANG H C, et al.Mechanism of coolant controlled temperature foam box in lettuce fresh keeping under normal temperature logistics and transportation[J].Food and Fermentation Industries, 2018, 44(3):170-178.
[16] 李跃红,李伟岸,张东亚,等.不同包装对番茄采后生理及保鲜效果的影响[J].包装与食品机械, 2017,35(6):1-6.
LI Y H, LI W A, ZHANG D Y, et al.Effect of packaging on postharvest physiology and preservation of tomato[J].Packaging and Food Machinery, 2017, 35(6):1-6.
[17] 李富军,张新华.果蔬采后生理与衰老控制[M].北京:中国环境科学出版社, 2004.
LI F J, ZHANG X H.Postharvest Physiology and Senescence Control of Fruits and Vegetables[M].Beijing:China Environmental Press, 2004.
[18] TEKALE G S, AHLAWAT T R, CHAWLA S L, et al.Effect of packaging and storage temperature on shelf-life of okra pods[J].Indian Journal of Horticulture, 2016,73(1):145.
[19] 殷健东. 1-MCP和乙烯对水蜜桃采后冷害发生的生理调控机制研究[D].扬州:扬州大学, 2018.
YIN J D.Studies on the physiological regulation mechanism of 1-MCP and ethylene on postharvest chilling injury of peach[D].Yangzhou:Yangzhou University, 2018.
[20] LIU Y F, YANG X X, ZHU S J, et al.Postharvest application of MeJA and NO reduced chilling injury in cucumber (Cucumis sativus) through inhibition of H2O2 accumulation[J].Postharvest Biology and Technology, 2016,119:77-83.
[21] VENKATACHALAM K.Enzymatic activities of curry leaves (Murraya koenigii L.) during storage in chilling temperature[J].Acta Horticulturae, 2019, 21(1 245):145-152.
[22] PAN Y G, ZHANG S Y, YUAN M Q, et al.Effect of Glycine betaine on chilling injury in relation to energy metabolism in Papaya fruit during cold storage[J].Food Science & Nutrition.2019, 7(3):1 123-1 130.
[23] PARKIN K L, KUO S J.Chilling-induced lipid degradation in cucumber (Cucumis sativa L.cv hybrid C) fruit [J].Plant Physiology, 1989, 90(3):1 049-1 056.
[24] ZHU S H, SUN L N, ZHOU J.Effects of different nitric oxide application on quality of kiwifruit during 20 ℃ storage [J].International Journal of Food Science & Technology, 2010, 45(2):245-251.
[25] JING G Q, ZHOU J, ZHU S H.Effects of nitric oxide on mitochondrial oxidative defence in postharvest peach fruits[J].Journal of the Science of Food and Agriculture, 2016, 96(6):1 997-2 003.
[26] 沈丽雯.热激处理对黄瓜品质影响及诱导抗冷性机理的研究[D].雅安:四川农业大学, 2015.
SHEN L W.Studies on mechanism of inducing chilling tolerance by heat shock treatment in cucumber[D].Yaan:Sichun Agricutural University, 2015.
[27] 史海莉,刘利鸿,陈攀红,等.叶面喷施天然矿物肥对“巨峰”葡萄品质和抗氧化酶活性的影响[J].北方园艺,2016(3):13-16.
SHI H L, LIU L H, CHEN P H, et al.Effect of natural mineral fertilizer on fruit quality and activities of antioxidant enzymes of‘Kyoho’ grape[J].Northern Horticulture, 2016(3):13-16.
[28] BRENNAN T,FRENKEL C.Involvement of hydrogen peroxide in the regulation of senescence in pear [J].Plant Physiology, 1977, 3(59):411-416.
[29] LIU G S, ZHANG Y X, YUN Z, et al.Melatonin enhances cold tolerance by regulating energy and proline metabolism in Litchi fruit[J].Foods, 2020, 9(4):454-467.
[30] GAO H, ZHANG Z K, LYU X G, et al.Effect of 24-epibrassinolide on chilling injury of peach fruit in relation to phenolic and proline metabolisms[J].Postharvest Biology & Technology, 2016, 111:390-397.
[31] PAN Y F, CHEN L, CHEN X T, et al.Postharvest intermittent heat treatment alleviates chilling injury in cold-stored sweet potato roots through the antioxidant metabolism regulation[J].Journal of Food Processing and Preservation, 2019, 43(12):e14274.
[32] MARANGONI A G, PALMA T, STANLEY D W.Membrane effects in postharvest physiology [J].Postharvest Biology and Technology, 1996, 7(3):193-217.
[33] WANG Z, MA L, ZHANG X F, et al.The effect of exogenous salicylic acid on antioxidant activity, bioactive compounds and antioxidant system in apricot fruit[J].Scientia Horticulturae, 2015, 181:113-120.
[34] WANG S Q, TANG J, HU K D, et al.Antioxidative system in sweet potato root is activated by low temperature storage[J].Journal of the Science of Food and Agriculture, 2019, 99(8):3 894-3 833.
[35] YANG Q, WANG F, RAO J.Effect of putrescine treatment on chilling injury, fatty acid composition and antioxidant system in kiwifruit[J].Plos One, 2016, 11(9).DOI:10.1371/journal.poen.0162159.
[36] LUO Z S, LI D D, DU R X, et al.Hydrogen sulfide alleviates chilling injury of banana fruit by enhanced antioxidant system and proline content[J].Scientia Horticulturae, 2015, 183:144-151.