三萜类化合物是一类由多个异戊二烯单位(C5H8)构成的烃类及其含氧衍生物,通常是由30个碳原子组成。结构上多为四环三萜或五环三萜,其中,五环三萜化合物种类较多,而且结构复杂,广泛存在于植物中,具有多种药理学功能,如齐墩果酸片等药品已在临床应用于肝脏保护[1-2]。根据构型不同,五环三萜化合物可分为乌苏烷型(ursane group)、羽扇豆烷型(lupane group)和齐墩果烷型(oleanane group)等。α-香 树脂醇(α-amyrin)及其衍生物是重要的乌苏烷型五环三萜,具有抗氧化[3]、抗肿瘤[4]、抗真菌[5]等功效;羽扇豆醇(lupeol)及其衍生物是羽扇豆烷型五环三萜的代表,在抗炎[6]、抗癌[7]等方面具有非常重要的作用;计曼尼醇(germanicol)及其衍生物属于齐墩果烷型五环三萜,被广泛应用于食品、医药和精细化工品等领域[8]。目前五环三萜化合物主要从植物中提取得到,此方法耗时、成本高、环境不友好,随着合成生物学的快速发展,利用微生物实现萜类化合物的异源生产得到了越来越多的关注[9-10]。
酿酒酵母(Saccharomyces cerevisiae)为一种安全的真核模式微生物,遗传背景清晰,遗传操作技术成熟,具有生物合成萜类物质的甲羟戊酸(mevalonate,MVA)途径,其完整的细胞内膜系统更加有利于萜类合成相关环化酶和细胞色素P450氧化酶的表达,已被广泛用于构建生产天然萜类活性物质的底盘工程菌株[11-13]。YU等[14]将α-香树脂醇合酶(α-amyrin synthase,αAS)MdOSC1引入酿酒酵母中,通过代谢工程改造增加前体物质2,3-氧化鲨烯(2,3-oxidosqualene)的供应,α-香树脂醇的摇瓶产量达到12.0 mg/L。QIAO等[15]将羽扇豆醇合酶(lupeol synthase,LUS)OeLUP在酿酒酵母进行异源表达,实现了羽扇豆醇的生物合成。ZHANG等[16]在酿酒酵母中构建了β-香树脂醇合成途径,并对其合成途径进行调控和发酵优化,β-香树脂醇产量达138.8 mg/L。在重组酿酒酵母中,五环三萜化合物是以MVA途径产生的异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)为前体,依次在法尼基焦磷酸合酶(ERG20)、鲨烯合酶(ERG9)和鲨烯环氧酶(ERG1)的催化作用下生成2,3-氧化鲨烯,2,3-氧化鲨烯进一步在α-香树脂醇合酶、羽扇豆醇合酶和计曼尼醇合酶(germanicol synthase,GES)的作用下生成相应的三萜母核[8]。
本研究以KEASLING教授惠赠的高效积累IPP和DMAPP的酿酒酵母菌株JWy601[17]为出发菌株,运用CRISPR/Cas9技术[18],整合长春花来源的α-香树脂醇合酶,构建得到α-香树脂醇生物合成途径;异源表达洋甘草来源的羽扇豆醇合酶,获得产羽扇豆醇酿酒酵母工程菌株;引入羊蹄甲来源的计曼尼醇合酶,实现计曼尼醇的生物合成。进一步通过代谢工程策略过表达MVA代谢途径中的关键酶ERG1,增加前体物质2,3-氧化鲨烯的供应,提高五环三萜的产量。本研究建立了三萜微生物合成平台,为构建五环三萜酸及其衍生物酿酒酵母细胞工厂奠定了理论和技术基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
实验所用质粒和菌株信息详见表1。
表1 本研究所用质粒和菌株
Table 1 Plasmids and strains used in this study

质粒和菌株性质来源质粒pCut-308a表达Cas9蛋白,sgRNA靶向III号染色体308a位点,URA3筛选标记,AmpRKEASLING教授惠赠[18]pCut-1622b表达Cas9蛋白,sgRNA靶向XVI号染色体1622b位点,URA3筛选标记,AmpRKEASLING教授惠赠[18]pET28a-CrαAS携带来源于Catharanthus roseus经过密码子优化的CrαAS基因,KanR金唯智合成pET28a-GgLUS携带来源于Glycyrrhiza glabra经过密码子优化的GgLUS基因,KanR金唯智合成pET28a-BfGES携带来源于Bauhinia forficata经过密码子优化的BfGES基因,KanR金唯智合成菌株S.cerevisiaeJWy601高效积累IPP和DMAPP,尿嘧啶营养缺陷型KEASLING教授惠赠[17]S01菌株JWy601基础上整合CrαAS基因本研究构建S02菌株JWy601基础上整合GgLUS基因本研究构建S03菌株JWy601基础上整合BfGES基因本研究构建S04菌株S01基础上过表达ERG1基因本研究构建S05菌株S02基础上过表达ERG1基因本研究构建S06菌株S03基础上过表达ERG1基因本研究构建
注:AmpR表示氨苄青霉素(Ampicillin)抗性,KanR表示卡那霉素(Kanamycin)抗性
1.1.2 引物
实验所用引物均由苏州金唯智生物科技有限公司合成,如表2所示。
表2 本研究所用引物
Table 2 Primers used in this study

引物序列(5′-3′)308a-up-F1TATTTCAGAAAAATTATTCAAAACTAAGAAGAATGAGATG308a-up-R1ATGGTGGTAATGCCATGTTTAGATAAAAAGAAAAAAATTCGAAGTTAATGTTGAAATTTC1622b-up-F1AACATTTAAGTCACAAGGAGGAATATCAGTT1622b-up-R1TGGATATGTATATGGTGGTAATGCCATGTAACTACTTTTCTTAAACTGTCAACAGCCAGAL1-308a-F2TAACTTCGAATTTTTTTCTTTTTATCTAAACATGGCATTACCACCATATACATATCCAGAL1-CrαAS-R2CCTCGGCGATTTTTAGTTTCCACATTATAGTTTTTTCTCCTTGACGTTAAAGTATAGAGGGAL1-GgLUS-R2CCTCGCCAATTTTTAGCTTCCACATTATAGTTTTTTCTCCTTGACGTTAAAGTATAGAGGGAL1-BfGES-R2CCTCTGCAATCTTCAACCTCCACATTATAGTTTTTTCTCCTTGACGTTAAAGTATAGAGGGAL1-ERG1-F2TGGCTGTTGACAGTTTAAGAAAAGTAGTTACATGGCATTACCACCATATACATATCCAGAL1-ERG1-R2CAGGTGCAACGTTAACAGCAGACATTATAGTTTTTTCTCCTTGACGTTAAAGTATAGAGGCrαAS-F3ACTTTAACGTCAAGGAGAAAAAACTATAATGTGGAAACTAAAAATCGCCGAGGGCACrαAS-R3AAATCATAAATCATAAGAAATTCGCCTACAAGGCCTTAGTCGGCCAGACACGCTTACGATGgLUS-F3ACTTTAACGTCAAGGAGAAAAAACTATAATGTGGAAGCTAAAAATTGGCGAGGGCGGgLUS-R3AAATCATAAATCATAAGAAATTCGCTCAGTAGGAATGTGCGCACAAAACTTGACGCCTATBfGES-F3ACTTTAACGTCAAGGAGAAAAAACTATAATGTGGAGGTTGAAGATTGCAGAGGGTGBfGES-R3AAATCATAAATCATAAGAAATTCGCTTAAACCTTCTTTGAATTAGACAGAAGAGGAACTTERG1-F3AACGTCAAGGAGAAAAAACTATAATGTCTGCTGTTAACGTTGCACCERG1-R3ATAAAAATCATAAATCATAAGAAATTCGCTTAACCAATCAACTCACCAAACAAAAATGGADH1-CrαAS-F4CCTTGTAGGCGAATTTCTTATGATTTATGATTTTTATTATTAAATAAGTTATAAAAAAAAADH1-GgLUS-F4CCTACTGAGCGAATTTCTTATGATTTATGATTTTTATTATTAAATAAGTTATAAAAAAAAADH1-BfGES-F4AGGTTTAAGCGAATTTCTTATGATTTATGATTTTTATTATTAAATAAGTTATAAAAAAAAADH1-308a-R4TAGAAGTGGTAGCAATATGTAGCAAAGAGGAGTTAGCATATCTACAATTGGGTGAAADH1-ERG1-F4TTGGTTAAGCGAATTTCTTATGATTTATGATTTTTATTATTAAATAAGTTATAAAAAAAAADH1-ERG1-R4TATCCAATTTCGTAAGACGAGTATCTACGGAGTTAGCATATCTACAATTGGGTGAA308a-down-F5TTCACCCAATTGTAGATATGCTAACTCCTCTTTGCTACATATTGCTACCACTTCTATTAC308a-down-R5TGATAGAACGAGTACAACACCCGA1622b-down-F5TCACCCAATTGTAGATATGCTAACTCCGTAGATACTCGTCTTACGAAATTGGATATAGTT1622b-down-R5ACTTTGGAAAAGAAGGTACGGACTACT
1.1.3 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠10。培养大肠杆菌时向培养基中加入终质量浓度为100 μg/mL的Amp或50 μg/mL的Kan。
酵母尿嘧啶营养缺陷型培养基(g/L):酵母SC-URA培养基7.9,葡萄糖20。
YPD培养基(g/L):蛋白胨20,酵母粉10,葡萄糖20。
YPG培养基(g/L):蛋白胨20,酵母粉10,半乳糖20。
若需要固体培养基,向上述液体培养基中加入20 g/L琼脂粉。
1.1.4 试剂和仪器
Green Taq Mix、2×Phanta Max Master Mix,南京诺唯赞生物科技股份有限公司;酵母基因组DNA提取试剂盒,天根生化科技(北京)有限公司;质粒小量制备试剂盒、琼脂糖凝胶DNA回收试剂盒,上海捷瑞生物工程有限公司;Amp、Kan,生工生物工程(上海)股份有限公司;酵母SC-URA培养基,艾礼生物科技(上海)有限公司;α-香树脂醇和羽扇豆醇标准品,上海源叶生物科技有限公司;计曼尼醇标准品,云南西力生物技术股份有限公司。
Bio-Rad C1000 TOUCH型PCR仪,美国伯乐公司;EPS 300型核酸电泳系统,上海天能科技有限公司;LDZM-80KCS-II型立式压力蒸汽灭菌器,上海申安医疗器械厂;CT15RE型高速冷冻离心机,日本日立公司;ZQZY-HC型振荡培养箱,上海知楚仪器有限公司;Pegasus BT型气相-高通量飞行时间质谱仪,美国力可公司。
1.2 实验方法
1.2.1 五环三萜合成途径的构建
本实验所选取的表达五环三萜合成途径相关酶的编码基因来源情况如下:α-香树脂醇合酶编码基因CrαAS来源于长春花(Catharanthus roseus),羽扇豆醇合酶编码基因GgLUS来源于洋甘草(Glycyrrhiza glabra),计曼尼醇合酶编码基因BfGES来源于羊蹄甲(Bauhinia forficata)。以上基因由苏州金唯智生物科技有限公司按照酿酒酵母密码子偏好性进行优化、合成并克隆至质粒pET28a上,得到重组质粒:pET28a-CrαAS、pET28a-GgLUS和pET28a-BfGES。在此基础上,以菌株JWy601基因组为模板,通过表2中所示的引物,分别扩增获得ERG1、PGAL1、TADH1和不同位点的上下游同源臂片段;以质粒pET28a-CrαAS、pET28a-GgLUS和pET28a-BfGES为模板,表2中所示的序列为引物,分别扩增获得CrαAS、GgLUS和BfGES基因片段;同时,提取pCut-308a和pCut-1622b质粒,用于构建酿酒酵母五环三萜合成途径。
1.2.2 工程菌株的筛选
本研究利用的CRISPR-Cas9基因编辑系统[18]是一个单质粒系统,pCut-308a和pCut-1622b质粒携带有表达Cas9蛋白的基因和靶向相应位点的sgRNA,用来进行基因的靶向整合。首先将CrαAS、GgLUS和BfGES基因分别整合至酿酒酵母基因组308a位点,获得菌株S01、S02和S03;进一步整合ERG1基因至菌株S01、S02和S03的1622b位点,分别获得菌株S04、S05和S06。具体筛选方法如下:首先通过酿酒酵母醋酸锂转化法,分别把1.2.1中得到的基因片段与上下游同源臂、PGAL1、TADH1和pCut质粒共转化至酿酒酵母,利用同源重组机制实现PGAL1-目的基因-TADH1表达盒的组装;接下来将转化平板倒置于30 ℃培养箱中培养,待长出转化子后对其进行PCR验证,完成第1次筛选;最后对验证成功的转化子进行传代培养,待质粒成功消除后进行第2次PCR验证,进一步测序确认最终获得整合表达氧化鲨烯环化酶和ERG1的工程菌株。
1.2.3 工程菌株的发酵
冻管菌经YPD平板划线活化后,接种于10 mL YPD培养基中,于30 ℃、200 r/min条件下振荡培养24 h;随后转接至50 mL YPD培养基中,使其初始菌体浓度OD600=0.2,30 ℃、200 r/min振荡培养24 h;然后离心收集菌体,更换50 mL YPG培养基诱导表达,定时取样,对重组菌生长趋势、α-香树脂醇、羽扇豆醇和计曼尼醇产量进行测定。
1.2.4 工程菌株产物的提取
对发酵过程中的样品进行快速提取,具体方法如下:取1 mL发酵液,12 000 r/min室温离心1 min收集菌体,用等体积20%氢氧化钾溶液(50%乙醇配制)重悬,沸水浴10 min;加入等体积正己烷萃取3次,离心取上清液;用无水硫酸钠除水后对样品进行硅烷化处理,转移至气相小瓶中用气相-高通量飞行时间质谱仪分析。
1.2.5 产物的分析与检测
气相-高通量飞行时间质谱仪测定:色谱柱为DB-5MS,载气氦气的流速为1.0 mL/min;进样口温度300 ℃,分流进样,进样量1 μL,分流比10∶1;升温起始温度180 ℃,保持1 min,然后以20 ℃/min升至300 ℃,保持14 min;质谱扫描为50~600 m/z。α-香树脂醇、羽扇豆醇和计曼尼醇标准品用于定性和定量分析。
2 结果与分析
2.1 α-香树脂醇细胞工厂构建及产物分析
在酿酒酵母中引入植物来源的α-香树脂醇合酶可催化2,3-氧化鲨烯生成α-香树脂醇[14]。本研究选取来源于长春花的α-香树脂醇合酶CrαAS(GenBank ID:JQ027033.1)用于构建α-香树脂醇细胞工厂。在酿酒酵母JWy601中整合CrαAS基因,琼脂糖凝胶电泳结果如图1所示,PCR产物大小与表达盒理论值大小3 139 bp一致,测序结果进一步表明,本实验成功构建得到整合有α-香树脂醇合酶CrαAS的酿酒酵母工程菌株S01。
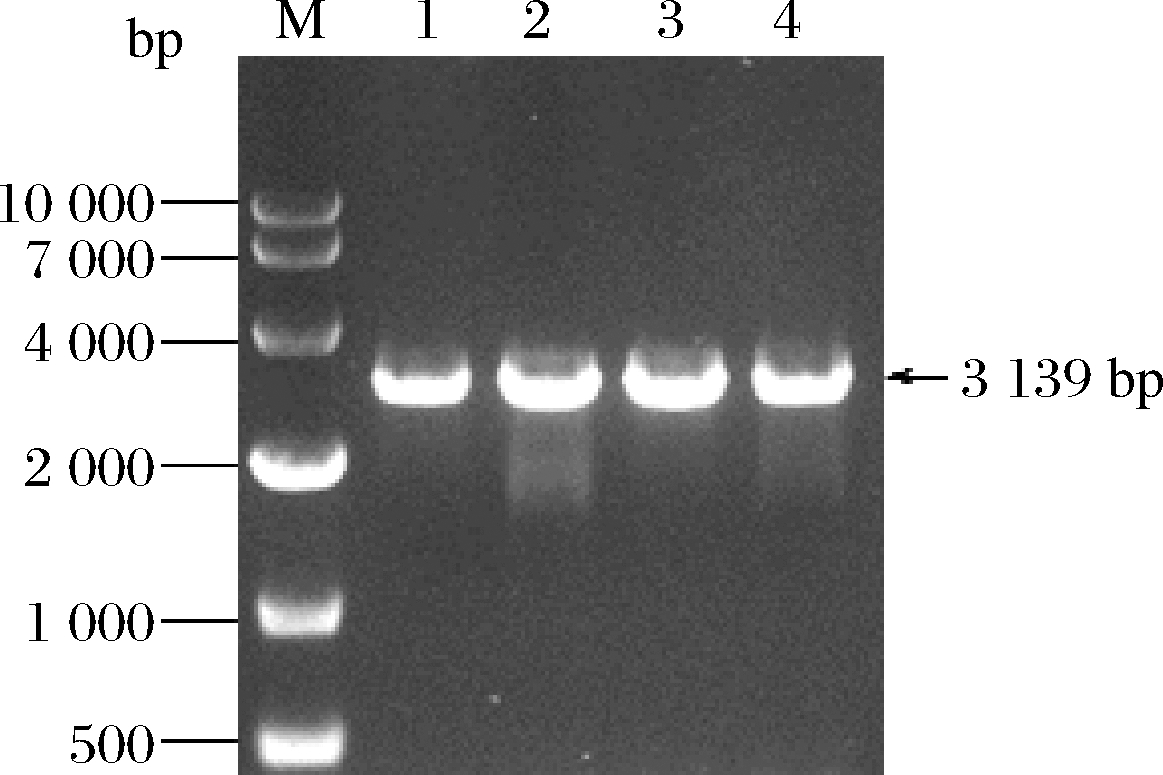
M-DL 10000 DNA marker;泳道1~4-工程菌株S01验证
图1 整合α-香树脂醇合酶编码基因CrαAS PCR验证
Fig.1 PCR verification of integrating CrαAS gene
encoding α-amyrin synthase
工程菌株S01在YPG培养基中发酵96 h,利用GC-MS对发酵产物进行分析。结果如图2-a所示,工程菌株S01发酵产物在14.24 min时出现与α-香树脂醇标准品保留时间一致的峰,实现了酿酒酵母发酵生产α-香树脂醇。工程菌株S01菌体生长曲线和α-香树脂醇产量变化曲线如图2-b所示,诱导发酵48 h时产量最高,达到50.7 mg/L。
2.2 羽扇豆醇细胞工厂构建及产物分析
羽扇豆醇合酶可以将2,3-氧化鲨烯环化生成羽扇豆烷型三萜母核羽扇豆醇[15]。本研究把洋甘草来源的羽扇豆醇合酶GgLUS(GenBank ID:AB116228.1)整合到酿酒酵母中,用于构建生产羽扇豆醇的工程菌株。以酿酒酵母JWy601为出发菌株,把GgLUS基因整合至其基因组上,PCR验证结果如图3所示,所得条带大小3 127 bp,与表达盒理论值大小相符,测序结果也显示表达盒构建成功,获得表达羽扇豆醇合酶GgLUS的酿酒酵母工程菌株S02。

a-GC-MS检测的总离子流色谱图;b-工程菌株S01菌体
生长曲线和α-香树脂醇产量变化曲线
图2 工程菌株S01发酵生产α-香树脂醇
Fig.2 Production of α-amyrin by engineered strain S01

M-DL 10000 DNA marker;泳道1~4-工程菌株S02验证
图3 整合羽扇豆醇合酶编码基因GgLUS PCR验证
Fig.3 PCR verification of integrating GgLUS gene
encoding lupeol synthase
对工程菌株S02进行摇瓶发酵实验,提取发酵液样品,萃取后用GC-MS进行定性和定量分析。总离子流色谱图如图4-a所示,羽扇豆醇标准品在14.30 min时出峰,工程菌株S02发酵产物在该时间点也出峰,表明成功构建产羽扇豆醇酿酒酵母细胞工厂。工程菌株S02在YPG培养基中诱导表达48 h时,羽扇豆醇产量高达45.8 mg/L(图4-b)。
2.3 计曼尼醇细胞工厂构建及产物分析
齐墩果烷型三萜母核计曼尼醇是以2,3-氧化鲨烯为前体物质,在计曼尼醇合酶的作用下环化而成的[8]。本研究将来源于羊蹄甲的计曼尼醇合酶BfGES(GenBank ID:LC464979.1)在酿酒酵母中异源表达,构建计曼尼醇生物合成途径。把BfGES基因整合至酿酒酵母JWy601底盘细胞中,PCR验证结果如图5所示,所得DNA片段大小与表达盒大小理论值一致(3 148 bp),进一步测序确认计曼尼醇合成途径构建成功,获得酿酒酵母工程菌株S03。
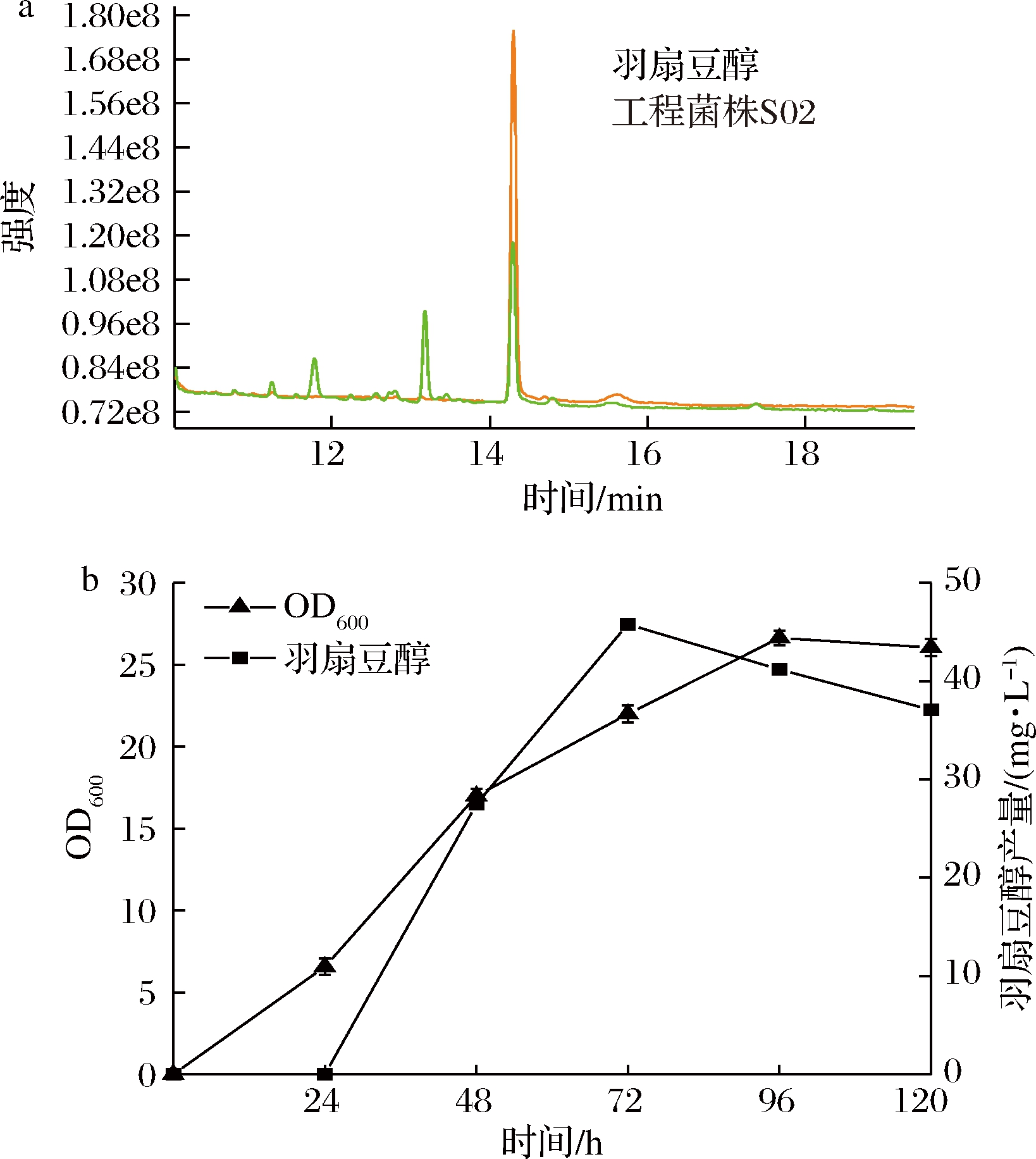
a-GC-MS检测的总离子流色谱图;b-工程菌株S02
菌体生长曲线和羽扇豆醇产量变化曲线
图4 工程菌株S02发酵生产羽扇豆醇
Fig.4 Production of lupeol by engineered strain S02

M-DL 10000 DNA marker;泳道1~4-工程菌株S03验证
图5 整合计曼尼醇合酶编码基因BfGES PCR验证
Fig.5 PCR verification of integrating BfGES
gene encoding germanicol synthase
工程菌株S03在YPD培养基中培养24 h后,更换YPG培养基进行诱导表达,提取发酵液样品,用GC-MS对其进行检测。产物检测结果如图6-a所示,在14.36 min时,计曼尼醇标准品和工程菌株S03发酵产物均出峰,表明产计曼尼醇酿酒酵母工程菌株构建成功。由工程菌株S03菌体生长曲线和计曼尼醇产量变化曲线图(图6-b)可以看出,计曼尼醇产量先快速升高,后缓慢下降,在诱导48 h 时达到最高17.6 mg/L。

a-GC-MS检测的总离子流色谱图;b-工程菌株S03菌体
生长曲线和计曼尼醇产量变化曲线
图6 工程菌株S03发酵生产计曼尼醇
Fig.6 Production of germanicol by engineered strain S03
2.4 过表达ERG1基因对酿酒酵母五环三萜产量的影响
MVA途径作为细胞中乙酰辅酶A转化为萜类化合物的第1个关键模块,其活性会直接影响到细胞中萜类产量,其中,ERG1是酿酒酵母MVA代谢途径中的关键酶。ERG1基因编码鲨烯环氧酶,其作用是把鲨烯氧化生成2,3-氧化鲨烯。张学礼等[19]用同源重组的方法过表达ERG1基因,提高了酿酒酵母工程菌株中达玛二烯和原人参二醇的产量。
因此,为进一步提高本研究构建得到的酿酒酵母工程菌株产五环三萜能力,本研究在先前工作的基础上,通过代谢工程策略对菌株S01、S02和S03进行了改造。即在菌株S01、S02和S03中过表达ERG1基因,分别得到菌株S04、S05和S06。工程菌株在YPG培养基中发酵48 h,结果如图7所示,菌株S04中α-香树脂醇的产量为96.3 mg/L,是菌株S01的1.9倍;菌株S05中羽扇豆醇的产量达到91.6 mg/L,是菌株S02的2倍;菌株S06中计曼尼醇产量达到了38.7 mg/L,是菌株S03的2.2倍。研究结果表明增加前体物质的供应可显著增强工程菌株五环三萜的生产能力。本研究获得的菌株S04中α-香树脂醇的产量和菌株S05中羽扇豆醇的产量与已有报道水平相当,菌株S06中计曼尼醇产量是已报道的4.7倍,后续会开展合成途径与发酵工艺优化工作提高五环三萜的产量。

图7 过表达ERG1基因提高五环三萜的产量
Fig.7 Enhanced production of pentacyclic triterpenoids
by overexpressing ERG1 gene
3 讨论
目前三萜类化合物的合成主要是通过植物提取,成本高效率低,本研究以安全的真核模式微生物酿酒酵母为底盘细胞,分别整合不同来源的氧化鲨烯环化酶并利用代谢工程策略提高其产量,构建产五环三萜的微生物细胞工厂。本研究获得的工程菌株S04 α-香树脂醇产量达到96.3 mg/L,α-香树脂醇是乌苏烷型三萜的前体,在氧化还原反应、酰基化、糖基化等修饰作用下,能形成结构和功能各异的乌苏烷三萜,其C-28位连续氧化产物熊果酸有抗癌、抗糖尿病及抗溃疡降血脂的作用[20]。工程菌株S05羽扇豆醇产量可达91.6 mg/L,羽扇豆醇属于羽扇豆烷型三萜化合物,其衍生物白桦脂酸被认为是很有前景的抗肿瘤及抗艾滋病病毒的候选药物[21]。工程菌株S06可生产38.7 mg/L计曼尼醇,计曼尼醇属于齐墩果烷型三萜,齐墩果烷型三萜化合物具有广泛的药理活性,齐墩果酸[20]和甘草酸类[22]药物制剂已在临床应用于肝脏保护。随着三萜类化合物合成途径的解析,后续研究可在产五环三萜骨架酿酒酵母合成途径与发酵工艺优化的基础上,进一步整合氧化三萜骨架的细胞色素P450氧化酶[23-25],用于生产活性更高的三萜化合物。本研究建立了三萜微生物合成平台,为构建五环三萜酸及其衍生物酿酒酵母细胞工厂奠定了理论和技术基础。
[1] POLLIER J, GOOSSENS A.Oleanolic acid [J].Phytochemistry, 2012, 77:10-15.
[2] WEI J T, LIU H Z, LIU M, et al.Oleanolic acid potentiates the antitumor activity of 5-fluorouracil in pancreatic cancer cells [J].Oncology Reports, 2012, 28(4):1 339-1 345.
[3] D′ABROSCA B, FIORENTINO A, MONACO P, et al.Annurcoic acid:A new antioxidant ursane triterpene from fruits of cv.Annurca apple [J].Food Chemistry, 2006, 98(2):285-290.
[4] HE X J, LIU R H.Triterpenoids isolated from apple peels have potent antiproliferative activity and may be partially responsible for apple′s anticancer activity [J].Journal of Agricultural and Food Chemistry, 2007, 55(11):4 366-4 370.
[5] BATOVSKA D I, TODOROVA I T, NEDELCHEVA D V, et al.Preliminary study on biomarkers for the fungal resistance in Vitis vinifera leaves [J].Journal of Plant Physiology, 2008, 165(8):791-795.
[6] FERN NDEZ M A, DE LAS HERAS B, GARCIA M D, et al.New insights into the mechanism of action of the anti-inflammatory triterpene lupeol [J].Journal of Pharmacy & Pharmacology, 2010, 53(11):1 533-1 539.
NDEZ M A, DE LAS HERAS B, GARCIA M D, et al.New insights into the mechanism of action of the anti-inflammatory triterpene lupeol [J].Journal of Pharmacy & Pharmacology, 2010, 53(11):1 533-1 539.
[7] SETZER W N, SETZER M C.Plant-derived triterpenoids as potential antineoplastic agents [J].Mini Reviews in Medicinal Chemistry, 2003, 3(6):540-556.
[8] SRISAWAT P, FUKUSHIMA E O, YASUMOTO S, et al.Identification of oxidosqualene cyclases from the medicinal legume tree Bauhinia forficata:A step toward discovering preponderant a-amyrin-producing activity [J].New Phytologist, 2019, 224(1):352-366.
[9] FACCHINI P J, BOHLMANN J, COVELLO P S, et al.Synthetic biosystems for the production of high-value plant metabolites [J].Trends in Biotechnology, 2012, 30(3):127-131.
[10] 张艳, 卢文玉.酿酒酵母细胞表达异源萜类化合物的研究进展[J].化工进展, 2014, 33(5):1 265-1 270.
ZHANG Y, LU W Y.Progress of heterologous expression of terpenes in Saccharomyces cerevisiae [J].Chemical Industry and Engineering Progress, 2014, 33(5):1 265-1 270.
[11] DAI Z B, LIU Y, ZHANG X N, et al.Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides [J].Metabolic Engineering, 2013, 20:146-156.
[12] 杨金玲, 高丽丽, 朱平.人参皂苷生物合成研究进展[J].药学学报, 2013, 48(2):170-178.
YANG J L, GAO L L, ZHU P.Advances in the biosynthesis research of ginsenosides [J].Acta Pharmaceutica Sinica, 2013, 48(2):170-178.
[13] PADDON C J, WESTFALL P J, PITERA D J, et al.High-level semi-synthetic production of the potent antimalarial artemisinin [J].Nature, 2013, 496(7 446):528-532.
[14] YU Y, CHANG P C, YU H, et al.Productive amyrin synthases for efficient α-amyrin synthesis in engineered Saccharomyces cerevisiae [J].ACS Synthetic Biology, 2018, 7(10):2 391-2 402.
[15] QIAO W B, LI C F, MOSONGO I, et al.Comparative transcriptome analysis identifies putative genes involved in steroid biosynthesis in Euphorbia tirucalli [J].Genes, 2018, 9(1):38.
[16] ZHANG G L, CAO Q, LIU J Z, et al.Refactoring β-amyrin synthesis in Saccharomyces cerevisiae [J].AIChE Journal, 2015, 61(10):3 172-3 179.
[17] WONG J, D′ESPAUX L, DEV I, et al.De novo synthesis of the sedative valerenic acid in Saccharomyces cerevisiae [J].Metabolic Engineering, 2018, 47:94-101.
[18] REIDER APEL A, D′ESPAUX L, WEHRS M, et al.A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae [J].Nucleic Acids Research, 2017, 45(1):496-508.
[19] 张学礼, 黄璐琦, 戴住波, 等.生产达玛二烯和原人参二醇的重组微生物及其构建方法:中国, 102925376A [P].2013-02-13.
ZHANG X L, HUANG L Q, DAI Z B, et al.Production of recombinant microorganism Darma diene and protopanaxadiol of its construction method:China, 102925376A [P].2013-02-13.
[20] LU C Z, ZHANG C B, ZHAO F L, et al.Biosynthesis of ursolic acid and oleanolic acid in Saccharomyces cerevisiae [J].AIChE Journal, 2018, 64(11):3 794-3 802.
[21] URANO E, ABLAN S D, MANDT R, et al.Alkyl amine bevirimat derivatives are potent and broadly active HIV-1 maturation inhibitors [J].Antimicrobial Agents and Chemotherapy, 2016, 60(1):190-197.
[22] ZHU M, WANG C X, SUN W T, et al.Boosting 11-oxo-β-amyrin and glycyrrhetinic acid synthesis in Saccharomyces cerevisiae via pairing novel oxidation and reduction system from legume plants [J].Metabolic Engineering, 2018, 45:43-50.
[23] HUANG L L, LI J, YE H C, et al.Molecular characterization of the pentacyclic triterpenoid biosynthetic pathway in Catharanthus roseus [J].Planta, 2012, 236(5):1 571-1 581.
[24] MISRA R C, SHARMA S, SANDEEP, et al.Two CYP716A subfamily cytochrome P450 monooxygenases of sweet basil play similar but nonredundant roles in ursane-and oleanane-type pentacyclic triterpene biosynthesis[J].New Phytologist, 2017, 214(2):706-720.
[25] 朱明, 王彩霞, 李春.工程化酿酒酵母合成植物三萜类化合物[J].化工学报, 2015, 66(9):3 350-3 356.
ZHU M, WANG C X, LI C.Engineered Saccharomyces cerevisiae for biosynthesis of plant triterpenoids[J].CIESC Journal, 2015, 66(9):3 350-3 356.