血红素过氧化物酶属于氧化还原酶类,通常使用过氧化氢作为电子受体催化底物的氧化[1],这类酶需要结合血红素作为辅基以全酶的形式才具有活性。染料脱色过氧化物酶(dye-decolorizing peroxidase,DyP)属于血红素过氧化物酶超家族中新的一类,基因组分析显示,DyP广泛存在于真菌和细菌中,与植物来源的血红素过氧化物酶类似,需要结合血红素辅因子形成全酶[2]。然而结构分析表明,DyP具有类似于亚氯酸盐歧化酶的铁氧还原蛋白折叠,因此属于与植物型过氧化物酶不同的超家族[3]。依据系统发育分析可将DyP分为4个亚科(A~D):A类酶含有Tat依赖的信号序列,表明其参与胞质外或细胞外的生理活动[4-6];B类和C类被推定为胞质酶,参与细胞内代谢[7];D类主要包含真菌变体,具体功能还需进一步研究[8]。本研究使用的DyP(RhDypB)来自红球菌(Rhodococcus jostii),该酶在Mn2+存在下活性有所提高[9],并且能够催化木质素模型分子的β-芳基醚的Cα—Cβ键的裂解[10]。为了更好地发挥DyP在工业中的应用价值,通常采用基因工程的方法生产DyP重组蛋白。大肠杆菌由于其繁殖快、成本低、操作简便、可大规模高密度发酵培养等优点是最常用的表达宿主之一。
大肠杆菌通常以C5途径合成血红素[12]。关于重组血红蛋白最新研究表明,血红素辅因子的充足供应是血红蛋白形成的重要因素,血红素掺入到蛋白形成全酶对后续酶的溶解度及活性至关重要[13]。通常对大肠杆菌血红素生物合成的调节是生产重组血红素蛋白的最主要因素[14]。例如,顾鹏帅等[15]将来源于褐色嗜热裂孢菌(Thermobifida fusca)的染料脱色过氧化物酶基因(TfuDyP)与大肠杆菌(Escherichia coli BL21)谷氨酰-tRNA还原酶基因(hemA)共表达,使酶活性提高了110%;RAMZI等[16]将来自枯草芽孢杆菌(Bacillus subtilis)的DyP与来自鼠伤寒沙门氏菌LT2(Salmonella typhimurium LT2)的hemA和来自E.coli BL21的hemL共表达使酶活性由39.0 U/mg增加至66.7 U/mg;朱竹兵等[17]在重组TfuDyP发酵培养基中添加氯高铁血红素、5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)、谷氨酸、FeCl2发现均可提高酶活性,5-ALA添加量为400 μmol/L,酶活性最大达到65 U/L。目前DyP的晶体结构有些已被解析出来,越来越多来自不同菌株的染料脱色过氧化物酶基因被克隆出来,在大肠杆菌中表达,性质也被表征,同时该酶在处理染料废水、造纸工业纸浆漂白以及农业小麦秸秆的水解方面具有较好的潜能,虽然已经有许多关于染料脱色过氧化物酶的研究,但是该酶的生理作用还尚不明确。
目前关于来自细菌红球菌DypB的研究是比较具体和深入的,有研究表明用丙氨酸代替第246位的天冬酰胺,该酶的催化活性有所提高,氧化Mn2+的Kcat和Kcat/Km值分别提高80和15倍[9],因此,本研究以第246位的天冬酰胺被丙氨酸替代后的DypB基因序列来克隆重组,pET-24b (+)为载体,将RhDypB基因在E.coli BL21(DE3)中进行了异源表达,并比较了外源添加5-ALA和内源过表达5-ALA合成关键酶基因hemA对胞内血红素浓度以及RhDypB活性的影响,揭示了重组血红素蛋白的可行性,同时为该酶进一步的相关研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
本实验中所用菌株和质粒见表1。
表1 本研究中使用的质粒和菌株
Table 1 Strains and plasmids used in this study
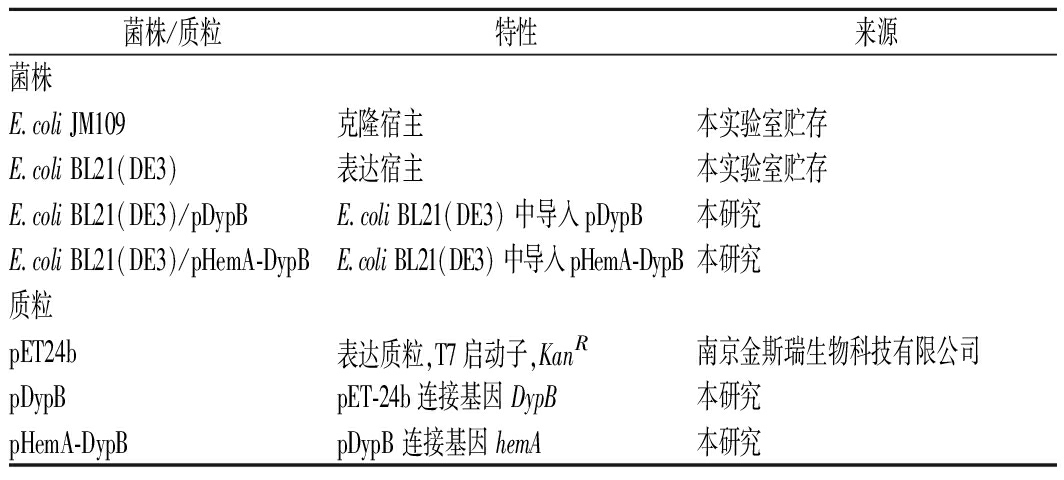
菌株/质粒特性来源菌株E.coli JM109克隆宿主本实验室贮存E.coli BL21(DE3)表达宿主本实验室贮存E.coli BL21(DE3)/pDypBE.coli BL21(DE3) 中导入pDypB本研究E.coli BL21(DE3)/pHemA-DypBE.coli BL21(DE3) 中导入pHemA-DypB本研究质粒pET24b表达质粒,T7启动子,KanR南京金斯瑞生物科技有限公司pDypBpET-24b连接基因 DypB本研究pHemA-DypBpDypB 连接基因 hemA本研究
1.1.2 试剂和仪器
ABTS,Sigma 公司;活性蓝19(reactive blue 19,RB19),国药集团;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素(kanamycin sulfate,Kan),上海生工;质粒提取、纯化试剂盒,Bradford Protein Assay Kit,TaKaRa公司;5-氨基乙酰丙酸,梯希爱化成工业发展有限公司;ClonExpress II One Step Cloning Kit,南京诺唯赞生物科技股份有限公司;AKTA avant 25蛋白纯化仪,美国GE公司;蛋白电泳仪、凝胶成像仪,Bio-Rad公司;多功能酶标仪,美国伯腾仪器有限公司。
1.1.3 培养基
LB液体培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,pH 7.0。
LB固体培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,琼脂20,pH 7.0。
TB液体培养基:酵母提取物24 g/L,胰蛋白胨12 g/L,甘油8 mL/L,K2HPO4 9.4 g/L,KH2PO42.2 g/L。
1.2 实验方法
1.2.1 质粒的构建
RhDypB (NCBI accession number MH292860)的全长核酸序列由南京金斯瑞有限公司优化并合成,并将其插入对应于Nde I(CATATG)和Xho I(CTCGAG)限制性酶切位点的质粒pET-24b(+),得到重组质粒(pDypB),将载体上的6个密码子(编码6个组氨酸)与RhDypB基因的3′-末端融合以进行后续纯化。hemA基因利用NCBI 上已公开的序列(https://www.ncbi.nlm.nih.gov/nuccore/AM946981.2)设计引物:hemA F GGATAACAATTCCCCTCTAGAATGACCCTTTTAGTAGCACTCGGTATC和hemA R TTAAACAAAATTATTTCTAGACT-ACTCCAGCCCGAGGCTG进行PCR,使用 ClonExpress II One Step Cloning Kit,将PCR纯化后产物与Xba I酶切后的线性化载体,按照说明书上的操作步骤进行连接,得到重组质粒(pHemA-DypB)(图1)。将重组质粒转入大肠杆菌JM109感受态细胞中,挑取卡那霉素抗性平板上的单菌落,经 LB液体培养基培养,并取适量菌液提取质粒进行酶切验证和基因测序(天霖生物科技无锡有限公司)。引物中的酶切位点用下划线标出,斜体表示同源序列。

a-重组质粒pDypB;b-重组质粒pHemA-DypB
图1 重组质粒示意图
Fig.1 Schematic representation of recombinant plasmids
1.2.2 重组质粒的诱导表达
将重组质粒pDypB和pHemA-DyPB分别转入E.coli BL21(DE3)感受态细胞中,挑取卡那霉素抗性平板上的单菌落,菌落PCR验证正确后,在LB液体培养基中培养,以4%接种量接种于含有50 mg/L Kan的TB液体培养基中。当OD600达到1.0时,在培养基中添加0.25 mmol/L IPTG进行诱导,在20 ℃下培养18 h后,离心收集菌体,将菌体悬浮在50 mmol/L磷酸盐缓冲液(pH 7.4)中,超声破碎后,以8 000 r/min离心30 min收集上清液,用0.22 μm膜过滤,得到RhDypB的粗酶液。
1.2.3 染料脱色过氧化物酶的纯化
使用HisTrap HP 镍柱亲和层析纯化粗酶液,用含20 mmol/L咪唑的磷酸盐缓冲液(pH 7.4)平衡后上样,然后用含500 mmol/L咪唑的磷酸盐缓冲液(pH 7.4)进行线性洗脱。根据洗脱曲线,收集与洗脱峰相对应的酶溶液,使用12% SDS-PAGE对酶液中的蛋白进行定性分析。
1.2.4 染料脱色过氧化物酶的光谱分析
利用荧光法分析重组菌株的胞内血红素浓度[14]。
通过多功能酶标仪分析所纯化的酶在280~700 nm的吸收光谱,RhDypB在408 nm处有特征吸收峰,用A408/A280值来表征酶与血红素的结合程度。
1.2.5 染料脱色过氧化物酶活性检测
酶活性利用ABTS来检测,反应体系包括1 mmol/L ABTS,6 mmol/L MnCl2以及50 mmol/L丙二酸钠缓冲液 (pH 5.0),2 μL酶液在25 ℃温育5 min后,加入1 mmol/L H2O2启动反应,反应5 min后加入200 μL SDS终止反应。利用紫外分光光度计检测420 nm(ε=36 000 M-1 cm-1)处的吸光值变化。1个酶活力单位定义为在25 ℃、pH 5.0 条件下,氧化1 μmol/L ABTS 所需要的酶量。蛋白质浓度测定采用Bradford Protein Assay Kit试剂盒,对RhDypB蛋白浓度进行测定。比酶活性计算如公式(1)所示:
比酶活性![]()
(1)
1.2.6 染料脱色过氧化物酶对染料脱色率的测定
通过检测在300~700 nm处的染料光谱吸收,确定RB19的最大吸收波长为620 nm, 为了评估酶处理的效率,建立了3 mL反应体系包括0.1 mmol/L RB19,6 mmol/L MnCl2,0.2 mmol/L H2O2, 50 mmol/L醋酸缓冲液 (pH 4.0),10 μL RhDypB,在25 ℃处理24 h后检测RB19在620 nm处的吸光度,利用染料的脱色率来反映染料的脱色情况,计算如公式(2)所示:
脱色率![]()
(2)
式中:A0为对照组吸光值,Ai为酶处理24 h后吸光值。
2 结果与分析
2.1 重组菌株的构建及鉴定
2.1.1 pDypB重组菌株的构建
将全长1 077 bp的目的基因RhDypB与载体pET-24b (+)连接得到重组质粒pDypB,用Nde I与Xho I双酶切并用琼脂糖凝胶电泳进行验证(图2-a),双酶切验证得到2条条带,分别为pET-24b (+)载体5 303 bp和RhDypB 1 077 bp,由天霖生物科技无锡有限公司测序,结果正确,重组质粒构建成功,命名为pDypB。
2.1.2 hemA与RhDypB共表达菌株的构建
在大肠杆菌中,hemA基因编码的谷氨酰-tRNA还原酶催化谷氨酰-tRNA生成谷氨酰-1-半醛,该步骤会受到终产物血红素的反馈抑制,是细菌血红素合成中的限速步骤之一[18],因此考虑将大肠杆菌的hemA基因与RhDypB 共表达。以NCBI上获得的E.coli BL21 基因组序列,利用Xba I酶切位点设计与载体具有同源序列的特异性引物,利用PCR扩增将hemA与pET-DypB进行连接,并进行双酶切验证,结果如图2-b所示。载体连接后进行酶切验证得到2条条带,分别为pET-DypB 6 302 bp和hemA 1 257 bp,由天霖生物科技无锡有限公司测序,结果正确,重组质粒构建成功,命名为pHemA-DypB。

M-Marker;1-重组质粒pDypB酶切验证;
2~3-重组质粒pHemA-DypB酶切验证
图2 重组质粒构建的凝胶电泳
Fig.2 Gel electrophoresis for recombinant plasmid
2.2 RhDypB的表达与纯化
将含有全长1 077 bp RhDypB的pET24b-DypB在E.coli BL21 中进行异源表达,经 IPTG在20 ℃诱导18 h,收集菌体,超声破碎后离心收集上清液,得到粗酶液,利用镍柱亲和层析,纯化后用SDS-PAGE对蛋白进行分析,结果如图3所示,在40 kDa处有明显的目的条带,与理论计算结果一致。以上结果表明重组表达载体经IPTG诱导后在大肠杆菌中成功表达了染料脱色过氧化物酶基因。同时对蛋白浓度进行测定,纯化后蛋白质量浓度可达到100 mg/L。

插图为收集液的 SDS-PAGE分析;M-蛋白Marker;
A1~A4-收集的洗脱峰样品
图3 DypB的色谱纯化
Fig.3 DypB purification by chromatography
2.3 重组菌株胞内血红素浓度测定
染料脱色过氧化物酶需要结合血红素辅因子成为全酶,才具有催化活性,因此大肠杆菌胞内血红素浓度对酶活影响至关重要。血红素浓度测定结果如图4所示,单独过表达RhDypB菌株pDypB血红素浓度1.5 μmol/L,而共表达的pHemA-DyPB重组菌株血红素浓度为2.4 μmol/L,相比于单独表达RhDypB的菌株血红素浓度增加了约1.6倍,在菌株pDypB培养基中添加400 μmol/L 5-ALA后,血红素浓度增加至8.9 μmol/L,与未添加5-ALA的pDypB菌株相比增加了6倍,说明5-ALA的添加有利于血红素的合成。

图4 重组大肠杆菌胞内血红素含量
Fig.4 Intracellular heme concentration in
recombinant E.coli
2.4 RhDypB的光谱分析
重组血红蛋白的血红素和蛋白质含量分别在408 nm(Soret峰)和280 nm处表示[6]。此外,Rz(Reinheit Zahl)值确定为A408/A280值[3],以进一步表征血红素在重组RhDypB中的掺入。将纯化后的RhDypB进行光谱扫描,结果如图5所示,所有重组RhDypB均在A408处显示1个Soret峰,说明均有一定的血红素掺入到RhDypB中。单独表达的RhDypB菌株Rz值为0.15,pHemA-DyPB共表达重组菌株的Rz值约为0.31,可知将hemA与RhDypB共表达加强了血红素与RhDypB的结合。此外,添加5-ALA后Rz值提高至0.37,根据图4的结果,说明5-ALA的添加增加了血红素的浓度,从而使RhDypB与血红素结合度增加,与文献[15]报道结果一致。
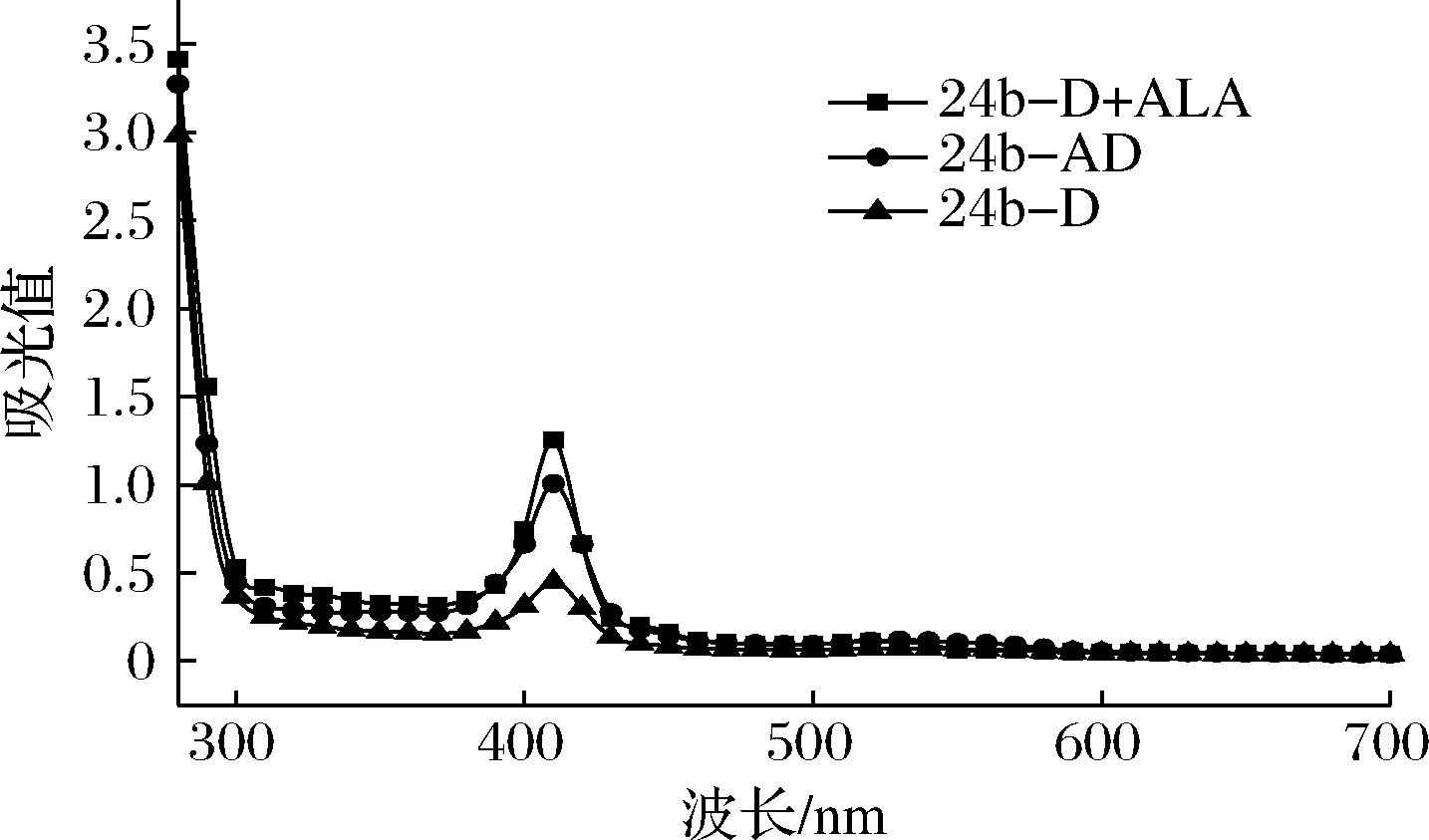
图5 RhDypB的吸收光谱
Fig.5 UV-Vis spectrum of recombinant RhDypB
2.5 RhDypB的过氧化物酶活性测定
RhDypB酶活性测定结果如图6所示,共表达hemA后的菌株酶活性为3.24 U/mg,与pDypB菌株(1.68 U/mg)相比约提高了93%,pHemA-DypB菌株酶活性的提高可能是由于hemA基因的过表达,增加了血红素与酶的结合度,继而增加了酶对ABTS的氧化活性。与文献[16]共表达血红素合成途径中的2个基因hemA与hemL相比,本研究共表达hemA基因后达到了相同的效果,即酶活性均得到约2倍的提高。添加5-ALA的菌株显示出最高的过氧化物酶活性为3.40 U/mg,与pDypB菌株(1.68 U/mg)相比提高了约102%,说明5-ALA的添加促进了血红素的合成,使RhDypB能够结合更多血红素形成全酶的形式,从而提高了酶活性。

图6 不同重组菌株的RhDypB酶活性
Fig.6 RhDypB enzyme activity of different
recombinant strains
2.6 RhDypB对RB19脱色率测定
为了更好的表征过氧化物酶的活性,本研究测定了RhDypB对RB19的脱色情况,结果如图7所示,RhDypB处理24 h后能有效的降解RB19,添加5-ALA 以及共表达hemA的菌株的脱色效果相近,曲线几乎重合,脱色率分别为53%、51%,约是pDypB菌株(25%)的2倍。脱色效率与酶活性高低呈正相关,与RAMZI等[16]的研究结果一致。

a-吸收光谱;b-脱色率
图7 RhDypB对染料RB19脱色的吸收光谱与脱色率
Fig.7 Spectrum of RB19 absorption and decolorization
rate by RhDypB
3 结论
目前DyP已经在染料脱色以及木质素降解方面展现出良好的潜力[9, 19-21]。酶活性的高低仍然是后续工业生产中一个重要因素。在本研究中,将来自红球菌的DypB成功地在大肠杆菌中表达,并且通过共表达血红素合成途径关键基因hemA,以及外源添加5-ALA的方式均使酶活有所提高,且利用共表达的方式与外源添加5-ALA效果相近,考虑到成本问题,利用代谢工程策略在生产应用中更经济有效,同时在处理蒽醌染料RB19时,脱色率达到了53%,揭示了代谢工程策略的可行性,为今后酶的催化活性以及生产应用的研究奠定了一定的基础。
[1] COLPA D I, FRAAIJE M W, BLOOIS E.DyP-type peroxidases:A promising and versatile class of enzymes[J].Journal of Industrial Microbiology & Biotechnology, 2014, 41(1):1-7.
[2] ROBERTS J N, SINGH R, GRIGG J C, et al.Characterization of dye-decolorizing peroxidases from Rhodococcus jostii RHA1[J].Biochemistry, 2011, 50(23):5 108-5 119.
[3] SUGANO Y, MURAMATSU R, ICHIYANAGI A, et al.DyP, a unique dye-decolorizing peroxidase, represents a novel heme peroxidase family:ASP171 replaces the distal histidine of classical peroxidases[J].Journal of Biological Chemistry, 2007, 282(50): 36 652-36 658.
[4] STURM A, SCHIERHORN A, LINDENSTRAUSS U, et al.YcdB from Escherichia coli reveals a novel class of Tat-dependently translocated hemoproteins[J].Journal of Biological Chemistry, 2006, 281(20):13 972-13 978.
[5] JONGBIOED J D H, GRIEGER U, ANTELMANN H, et al.Two minimal Tat translocases in Bacillus[J].Molecular Microbiology, 2004, 54(5):1 319-1 325.
[6] BLOOIS E, TORRES PAZMI O D E, WINTER R T, et al.A robust and extracellular heme-containing peroxidase from Thermobifida fusca as prototype of a bacterial peroxidase superfamily[J].Applied Microbiology and Biotechnology, 2010, 86(5):1 419-1 430.
O D E, WINTER R T, et al.A robust and extracellular heme-containing peroxidase from Thermobifida fusca as prototype of a bacterial peroxidase superfamily[J].Applied Microbiology and Biotechnology, 2010, 86(5):1 419-1 430.
[7] OGOLA H J O, KAMLLKE T, HASHIMOTO N, et al.Molecular characterization of a novel peroxidase from the Cyanobacterium Anabaena sp.Strain PCC 7120[J].Applied and Environmental Microbiologys, 2009, 75(23):7 509-7 518.
[8] SUGANO Y.DyP-type peroxidases comprise a novel heme peroxidase family[J].Cellular and Molecular Life Sciences, 2009, 66(8):1 387-1 403.
[9] SINGH R, GRIGG J C, QIN W, et al.Improved manganese-oxidizing activity of DypB, a peroxidase from a lignolytic bacterium[J].ACS Chemical Biology, 2013, 8(4):700-706.
[10] AHMAD M, ROBERTS J N, HARDIMAN E M, et al.Identification of DypB from Rhodococcus jostii RHA1 as a lignin peroxidase [J].Biochemistry, 2011, 50(23):5 096-5 107.
[11] 李晓涵, 郝建华, 郭姣梅, 等.环糊精葡萄糖基转移酶高效异源表达研究进展[J].微生物学通报, 2020, 47(2):615-622.
LI X H, HAO J H, GUO J M, et al.Advance in high-level heterologous expression of cyclodextrin glycosyltransferase [J].Microbiology China, 2020, 47(2):615-622.
[12] 杨燕, 郑珂, 潘梅,等.大肠杆菌rhtA缺失对血红素合成的影响[J].微生物学通报, 2019, 46(12):3 216-3 224.
YANG Y, ZHENG K, PAN M, et al.The effect of rhtA deletion on heme synthesis in Escherichia coli [J].Microbiology China, 2019, 46(12):3 216-3 224.
[13] AKHTAR M K, JONES P R.Cofactor engineering for enhancing the flux of metabolic pathways[J].Frontiers in Bioengineering and Biotechnology, 2014.DOI:10.3389/fbioe.2014.00030.
[14] JUNG Y, KWAK J, LEE Y.High-level production of heme-containing holoproteins in Escherichia coli[J].Applied Microbiology and Biotechnology, 2001, 55(2):187-191.
[15] 顾鹏帅, 潘梅, 丁亮亮, 等.共表达谷氨酰-tRNA还原酶增强染料脱色过氧化物酶在大肠杆菌中的表达活性[J].食品与发酵工业, 2020, 46(4):45-50.
GU P S, PAN M, DING L L, et al.Co-expression of glutamyl tRNA reductase improves catalytic activities of a dye-decolorizing peroxidase in Escherichia coli [J].Food and Fermentation Industries, 2020, 46(4):45-50.
[16] RAMZI A B, HYEON J E, HAN S O.Improved catalytic activities of a dye-decolorizing peroxidase (DyP)by overexpression of ALA and heme biosynthesis genes in Escherichia coli[J].Process Biochemistry, 2015, 50(8):1 272-1 276.
[17] 朱竹兵, 孙亚武, 唐蕾.褐色嗜热裂孢菌脱色过氧化物酶的表达及发酵条件优化[J].食品与发酵工业, 2019 45(13):23-30.
ZHU Z B, SUN Y W, TANG L.Expression and fermentation optimization of dye-decolorizing peroxidase from Thermobifida fusca[J].Food and Fermentation Industries, 2019, 45(13):23-30.
[18] ZHANG J L, KANG Z, CHEN J, et al.Optimization of the heme biosynthesis pathway for the production of 5-aminolevulinic acid in Escherichia coli[J/OL].Scientific Reports, 2015.https://doi.org/10.1038/srep08584.
[19] LU R Y, MA L, HE F, et al..White-rot fungus Ganoderma sp.En3 had a strong ability to decolorize and tolerate the anthraquinone, indigo and triphenylmethane dye with high concentrations[J].Bioprocess and Biosystems Engineering, 2016, 39(3):381-390.
[20] OSMA J F, TOCA-HERRERA J L, RODR GUEZ-COUTO S.Transformation pathway of Remazol Brilliant Blue R by immobilised laccase[J].Bioresource Technology, 2010, 101(22):8 509-8 514.
GUEZ-COUTO S.Transformation pathway of Remazol Brilliant Blue R by immobilised laccase[J].Bioresource Technology, 2010, 101(22):8 509-8 514.
[21] HUSAIN Q.Potential of the oxidoreductive enzymes in the decolorization and detoxification of textile and other synthetic dyes from polluted water:A review[J].Critical Reviews in Biotechnology, 2006, 26(4):201-221.