酒是各种应酬中必不可少的饮品,但长期大量饮酒会引起酒精性脂肪肝、酒精性肝炎、肝纤维化及肝硬化等不同程度的肝损伤[1]。酒精性肝病受损的主要发病机制之一是氧化应激[2],酒精进入机体被吸收并过量代谢,使肝细胞产生大量的氧自由基和代谢产物,影响肝脏正常的氧化还原反应,引起脂质过氧化并损害细胞膜通透性,进而损害肝细胞的完整性和功能,破坏细胞器,降低细胞器的修复能力,最终导致肝损伤[3-6]。多酚类化合物广泛存在于植物体内,是一类具有1个或多个酚羟基的化合物[7]。人体自身不能合成多酚类化合物,因此需要从食物中摄取。研究表明多酚类化合物不仅具有较强的抗氧化作用,还具有抗肿瘤、保护肝脏、抗感染、增强免疫力、降低胆固醇及预防心血管疾病等功能[8]。4-甲基愈创木酚是一种天然存在于咖啡、可可、啤酒、雪利酒、威士忌酒中的多酚类化合物,具有辛香、药香、丁香、香荚兰香气,多用于调配食用香精,也可用于威士忌的增香剂。近年来研究表明,在中国白酒中也可检测到4-甲基愈创木酚[9],并发现其具有抗氧化的生物活性[10]。有研究报道,其他多酚类物质,诸如茶多酚、姜黄素、槲皮素等对小鼠酒精性肝损伤有保护作用[11-13],但尚未见4-甲基愈创木酚对酒精性肝损伤有保护作用。本研究旨在通过4-甲基愈创木酚对酒精性小鼠肝组织病理损伤的影响,观察其对酒精性肝损伤的保护作用。
1 材料与方法
1.1 实验动物及环境
C57BL/6J小鼠(雄性,49~56日龄,体重18~22 g),斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019—0010,饲养于(22±2) ℃、相对湿度(55±5)%的清洁级动物房,合笼饲养,5只/笼,控制照明时间为每天12 h,自由进食与饮水。实验的相关操作严格遵守实验动物福利伦理与保护相关规定,随时接受实验动物伦理委员会的监督与检查。
1.2 药品与试剂
4-甲基愈创木酚(分析纯,纯度>95%),吉尔生化(上海)有限公司;BCA蛋白浓度测定试剂盒(货号 PC0020),北京索莱宝科技有限公司;总胆固醇(total cholesterol,TC)测定试剂盒(COD-PAP法)(货号 A111-2-1)、甘油三酯(triglyceride,TG)测定试剂盒(GPO-PAP酶法)(货号 A110-2-1)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)测定试剂盒(货号 A112-2-1)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒(货号 A113-2-1)、谷丙转氨酶(alanine aminotransferase,ALT)测定试剂盒(货号 C009-1-1)、谷草转氨酶(aspartate aminotransferase,AST)测定试剂盒(货号 C010-1-1)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号A001-1-2)、还原型谷胱甘肽(glutathione,GSH)测定试剂盒(货号 A006-1-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒(货号 A005-1-2)、过氧化氢酶(catalase,CAT)测定试剂盒(货号A007-1-1)、丙二醛(malondialdehyde,MDA)测定试剂盒(货号 A003-1-2),南京建成生物工程研究所。
1.3 仪器与设备
LDZX-50KBS高压灭菌锅,上海申安医疗器械厂;SpectraMax® iD3多功能酶标仪,美国Molecular Devices公司;Micro 21R小型台式离心机,美国Thermo公司;2-16 N高速微量离心机,湖南恒诺仪器设备有限公司。
1.4 实验方法
1.4.1 小鼠肝损伤模型的建立与实验设计
50只小鼠适应喂养1周后,随机分为5组,分别为空白组,模型组,4-甲基愈创木酚低、中、高剂量组,每组10只。除空白组小鼠灌胃0.9%的生理盐水,模型组灌胃50%食用酒精外,其余各组小鼠均进行损伤和给药处理,具体处理方式如表1所示,连续灌胃56 d。每周记录小鼠体重变化,末次给药后,小鼠禁食不禁水12 h后内眦取血,麻醉处死小鼠。迅速取出肝脏并称重,计算肝脏指数(肝脏质量/体质量×100%);同时取部分肝脏组织,4%中性甲醛固定制备石蜡切片,肝脏组织病理学变化采用苏木精-伊红染色后观察;其余肝脏于-80 ℃低温冰箱保存备用。
表1 各组小鼠实验处理
Table 1 Treatment of mice in each group
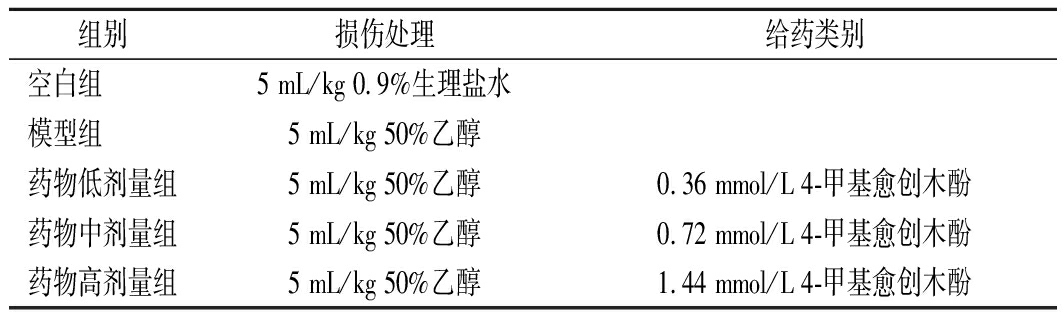
组别损伤处理给药类别空白组 5 mL/kg 0.9%生理盐水模型组 5 mL/kg 50%乙醇药物低剂量组5 mL/kg 50%乙醇0.36 mmol/L 4-甲基愈创木酚药物中剂量组5 mL/kg 50%乙醇0.72 mmol/L 4-甲基愈创木酚药物高剂量组5 mL/kg 50%乙醇1.44 mmol/L 4-甲基愈创木酚
1.4.2 小鼠肝脏指数及肝功能检测
末次给药后,小鼠内眦取血,静置30 min,3 000 r/min离心10 min,分离得到血清。采用赖氏法检测血清转氨酶AST和ALT水平,具体操作步骤严格按照试剂盒说明书进行。
1.4.3 小鼠血脂水平检测(TC/TG/HDL-C/LDL-C)
采用COD-PAP法检测血清中TC水平,采用GPO-PAP酶法检测血清中TG水平,采用直接法检测血清中HDL-C和LDL-C水平,具体操作步骤严格按照试剂盒说明书进行。
1.4.4 小鼠肝脏中抗氧化酶活性和GSH含量的检测
采用黄嘌呤氧化酶法测定SOD的活力,采用钼酸铵法测定CAT的活力,采用比色法测定GSH-Px活力、GSH含量,具体操作步骤严格按照试剂盒说明书进行。
1.4.5 小鼠肝脏中过氧化产物MDA含量的检测
采用硫代巴比妥酸(thiobarbituric acid,TBA)测定MDA的含量,具体操作步骤严格按照试剂盒说明书进行。
1.4.6 小鼠肝脏组织病理学检查
肝脏组织用4%中性多聚甲醛固定24 h后转入70%酒精溶液中脱水24 h,然后常规石蜡包埋后制作厚度约4~5 μm的切片。用二甲苯脱蜡制备好的切片,酒精梯度(95%、90%、80%、75%)脱水;苏木精染色;盐酸乙醇分化;0.5%伊红染色;常规梯度酒精(75%、80%、90%、95%)脱水;经100%酒精I(10 min),100%酒精Ⅱ(10 min);最后经二甲苯透明后中性树胶封片,在Olympus光学显微镜下,选取不同的视野拍照并分析肝脏组织病理学变化。
1.4.7 数据分析
本实验采用SPSS 25.0分析处理数据,所有实验数据为至少3个平行试验的平均值,用平均值±标准误表示;图表由Origin 2017绘制,P<0.05时表示差异具有统计学意义。
2 结果与分析
2.1 4-甲基愈创木酚对小鼠体质量及肝脏指数的影响
实验期间,各组小鼠体质量增长正常。小鼠体质量和肝脏指数如表2所示,与正常对照组相比,模型组的小鼠体质量明显减轻(P<0.05),但肝脏质量和肝脏指数明显増加(P<0.05)。4-甲基愈创木酚干预可明显降低小鼠的肝脏指数,与模型组相比,4-甲基愈创木酚各剂量组小鼠的肝脏指数分别降低了7.3%(P<0.05)、12.7%和14.5%(P<0.05)。
表2 各组小鼠体质量与肝脏指数
Table 2 Body weight and liver index of mice in each group

组别体质量/g1周2周4周6周8周肝脏质量/g肝脏指数/%空白组20.3±1.120.8±1.521.0±1.422.9±1.423.8±1.61.07±0.14.5±0.6模型组20.5±1.620.9±1.921.3±1.520.8±1.320.5±1.41.13±0.25.5±0.54-甲基愈创木酚低剂量组20.7±1.220.5±1.421.1±1.522.3±1.723.2±1.81.18±0.25.1±0.44-甲基愈创木酚中剂量组20.6±1.520.5±1.621.1±1.922.0±1.624.1±1.91.16±0.44.8±0.34-甲基愈创木酚高剂量组20.1±2.020.9±2.021.6±1.922.4±2.223.8±2.31.12±0.34.7±0.6
2.2 4-甲基愈创木酚对小鼠肝脏功能的影响
如图1所示,与空白组比较,模型组小鼠血清中AST、ALT水平明显升高 (P<0.05),分别是空白组的1.15、1.25倍;与模型组比较,4-甲基愈创木酚低、中剂量组小鼠血清中的AST水平降低,但无显著性差异,而高剂量组小鼠血清中AST水平降低了22% (P<0.05);与模型组比较,4-甲基愈创木酚低剂量组小鼠血清中的ALT水平降低,但无显著性差异,而中、高剂量组小鼠血清中ALT水平分别降低了17%和37%,且具有统计学差异 (P<0.05)。AST、ALT是临床上常用的肝功能评价指标,它们水平的高低可以反应肝细胞所受损伤程度的轻重,AST主要存在于肝细胞线粒体中,ALT主要存在于肝细胞的胞浆内,肝细胞受损时,这2种酶可释放到血液中,引起血液中肝功能酶学指标异常升高[14-15]。肝脏是酒精代谢的主要场所,而代谢过程中的活性氧和有毒产物会破坏肝细胞膜和线粒体膜,导致这2种膜的通透性增加,转氨酶AST、ALT便释放入血[16]。上面的实验结果显示,模型组小鼠血清中AST、ALT水平均明显升高,表明小鼠酒精性肝损伤模型建立成功。4-甲基愈创木酚高剂量组可明显降低小鼠血清中AST的水平,4-甲基愈创木酚中、高剂量组可明显降低小鼠血清中的ALT水平,表明4-甲基愈创木酚高剂量可有效保护肝细胞膜和线粒体膜,维持肝功能正常。

图1 4-甲基愈创木酚对小鼠血清中AST、ALT活性的影响
Fig.1 Effect of 4-methyl guaiacol on serum AST,ALT
activity in mice
注:*代表与空白组相比有显著性差异(P<0.05);
#代表与模型组相比有显著性差异(P<0.05)(下同)
2.3 4-甲基愈创木酚对小鼠血脂水平的影响
如图2所示,与空白组比较,模型组小鼠血清中TC、TG、LDL-C水平明显升高 (P<0.05),分别是空白组的1.19、1.16、1.54倍,而HDL-C水平明显下降(P<0.05),比空白组降低了13.5%(P<0.05);与模型组比较,4-甲基愈创木酚低、中、高剂量组小鼠血清中TC水平分别降低了17.5%、20.1%和25.6% ;TG水平分别降低了14.9%、43.7%和63.1% ;LDL-C水平分别降低了57.4%、52.9%和18.3%;HDL-C水平分别升高了26.5%、30.9%和73.5%,且具有统计学差异(P<0.05)。脂质代谢紊乱是酒精性肝损伤的另一重要表现,主要表现为肝细胞内TG的沉积,同时酒精影响了肝脏脂质代谢和血清脂质的转运导致出现血脂水平异常[17]。LDL-C和HDL-C是在体内转运血脂的2种载脂蛋白,其中LDL-C的功能是转运内源性胆固醇,是将脂类由肝脏向外周转运,HDL-C的功能是逆向转运胆固醇,是将脂类由外周转运至肝脏分解代谢[18]。LDL-C增高则会引起血浆TC和TG增高,形成高血脂,酒精肝损伤会导致脂质代谢紊乱,TC、TG代谢受到抑制,脂肪在肝细胞中过多沉积的同时,肝脏代偿功能丧失,体内存储的大量脂肪被动转移,导致血清中TG水平明显升高[19]。已有的研究表明,动物摄入酒精后,血清中的TC、TG水平均升高,且血清LDL-C水平升高而HDL-C水平降低[20]。研究结果显示,小鼠摄入酒精后可导致机体脂质代谢紊乱,血清的TC、TG和LDL-C水平升高,而血清HDL-C水平降低,4-甲基愈创木酚干预可明显减轻酒精性肝损伤所致的血脂水平异常。

a-TC;b-TG;c-LDL-C;d-HDL-C
图2 4-甲基愈创木酚对小鼠血清中TC、TG、LDL-C、HDL-C含量的影响
Fig.2 Effect of 4-methyl guaiacol on serum TC,TG,LDL-C,HDL-C content in mice
2.4 4-甲基愈创木酚对小鼠抗氧化酶活性和还原型谷胱甘肽含量的影响
由图3可如,模型组小鼠肝脏组织匀浆中SOD、CAT、GSH、GSH-Px活力均下降,且与空白对照组比较,差异有统计学意义(P<0.05),说明酒精诱导的氧化损伤降低了小鼠体内SOD、CAT、GSH、GSH-Px的活力。4-甲基愈创木酚各剂量组小鼠肝脏组织匀浆中SOD活力均高于模型对照组,且低、中、高剂量组实验小鼠肝脏组织匀浆中SOD活力与空白组比较,无显著性差异,说明4-甲基愈创木酚起到维持肝脏中SOD活力稳定的作用。4-甲基愈创木酚各剂量组小鼠肝脏组织匀浆中CAT活力均高于模型组,且与模型组比较差异有统计学意义(P<0.05),其中高剂量组实验小鼠肝脏组织匀浆中CAT活力与空白组基本一致。GSH-Px、GSH活力均高于空白组和模型组,且差异有统计学意义(P<0.05)。SOD、CAT、GSH、GSH-Px均属正常机体的抗氧化系统,它们共同维持机体氧化平衡[21]。已有的研究表明,肝损伤会导致肝脏中的SOD、CAT、GSH、GSH-Px水平降低[22],本实验建立的酒精性肝损伤模型显示与其基本一致。小鼠酒精灌胃后,4-甲基愈创木酚干预后,各剂量组肝脏中的SOD、CAT、GSH、GSH-Px水平升高或与正常状态保持一致,说明4-甲基愈创木酚可提高机体抗氧化酶活性,改善酒精性肝损伤。

a-SOD;b-CAT;c-GSH-Px;d-GSH
图3 4-甲基愈创木酚对小鼠肝脏中SOD、CAT、GSH-Px、GSH活性的影响
Fig.3 Effect of 4-methyl guaiacol on SOD,CAT,GSH-Px,GSH activity in mouse liver
2.5 4-甲基愈创木酚对小鼠过氧化产物的影响
由图4可知,模型组小鼠与空白对照组比较,肝组织中过氧化物指标MDA升高,差异性具有统计学意义(P<0.05),提示酒精氧化损伤模型建立成功。4-甲基愈创木酚各剂量组小鼠与模型组比较,MDA浓度均有不同程度降低,均低于模型组,差异有统计学意义(P<0.05)。MDA是脂质过氧化反应的小分子产物之一,其含量的高低反映了细胞脂质过氧化程度,因此常被作为生物脂质过氧化反应的检测指标。已有的研究表明,酒精性肝损伤小鼠肝脏中过氧化产物MDA含量大量增加,我们的研究与其基本一致,小鼠灌胃酒精后,在4-甲基愈创木酚的干预下肝脏中MDA含量明显减少,说明4-甲基愈创木酚可减轻肝脏由酒精导致的脂质过氧化反应[23]。

图4 4-甲基愈创木酚对小鼠肝脏中MDA含量的影响
Fig.4 Effect of 4-methyl guaiacol on MDA
content in mouse liver
2.6 4-甲基愈创木酚对小鼠肝组织病理形态的影响
如图5所示,空白组显示肝组织结构正常,肝细胞排列整齐、结构清晰,无水肿现象及炎性细胞;模型组小鼠肝组织结构、肝细胞排列紊乱,大多数肝细胞呈水肿现象,炎症细胞浸润,肝细胞纤维化,肝组织中有大小不一的脂肪滴空泡;4-甲基愈创木酚低、中剂量组小鼠肝组织结构、肝细胞排列较整齐,肝细胞水肿现象、肝组织内炎性细胞、脂肪滴空泡较模型组有所减轻;4-甲基愈创木酚高剂量组小鼠肝组织结构清晰,肝细胞排列整齐、大小均一,炎性细胞、脂肪滴空泡较模型组显著减轻。酒精性肝损伤的组织学特征主要包括肝细胞脂肪滴空泡的积累、脂肪肝 (脂肪变性和炎性细胞) 及肝硬化[24]。通过苏木精-伊红染色发现,本实验模型组小鼠的肝组织发现有大量炎性细胞和脂肪滴空泡,4-甲基愈创木酚给药后此现象显著减轻,说明4-甲基愈创木酚可能对肝脏具有保护作用。

a-空白组;b-模型组;c~e-4-甲基愈创木酚低、中、高剂量组
图5 各组小鼠肝组织病理形态
Fig.5 Hepatic histological morphology of mice in each group
3 结论
本实验采用50%食用酒精对小鼠进行灌胃,成功建立酒精性肝损伤的模型, 4-甲基愈创木酚给药后小鼠血清中AST和ALT活性降低,小鼠肝脏中SOD、CAT、GSH-Px和 GSH 的活性明显强于模型组,或与正常小鼠一致,MDA 水平低于模型组,说明4-甲基愈创木酚可以保护肝脏中的抗氧化酶活性,并减少脂质过氧化物MDA的产生,进而保护肝脏,并减轻酒精性肝脏损伤。通过苏木精-伊红染色发现,4-甲基愈创木酚给药后酒精性肝损伤病理特征显著减轻。综上所述,4-甲基愈创木酚对肝脏具有保护作用,可以在一定程度上减轻酒精对肝脏所造成的损伤,其机制可能与增加肝组织抗氧化酶的活性、降低脂质过氧化水平有关。
[1] 吴展,钟伏弟,袁观斗,等.酒精性肝病与微小RNAs关系的研究进展[J].中华实验外科杂志,2020,37(1):194-198.
WU Z, ZHONG F D, YUAN G D, et al.Research progress in relationship between microRNAs and alcoholic liver disease[J].Chinese Journal of Experimental Surgery, 2020,37(1):194-198.
[2] 赵雪珂,穆茂,程明亮.酒精性肝病与氧化应激[J].临床肝胆病杂志,2014,30(2):118-120.
ZHAO X K, MU M, CHENG M L.Alcoholic liver disease and oxidative stress [J].Journal of Clinical Hepatobiliary, 2014,30(2):118-120.
[3] 魏芬芬,王文娟,张波.枸杞多糖对酒精性肝损伤小鼠肾脏的保护作用[J].癌变·畸变·突变,2019,31(2):148-152.
WEI F F, WANG W J, ZHANG B. Protective effects of Lycium barbarum polysaccharide on kidney in alcohol-induced liver injury in mice[J]. Carcinogenesis,Teratogenesis & Mutagenesis, 2019, 31(2):148-152.
[4] ZENG T, XIE K Q.Ethanol and liver:Recent advances in the mechanisms of ethanol-induced hepatosteatosis[J].Archives of Toxicology, 2009,83(12):1 075-1 081.
[5] HOEK J B, PASTORINO J G.Ethanol oxidative stress and cytokine-induced liver cell injury[J].Alcohol, 2002,27(1):63-68.
[6] 程云飞,吕晓君.三七护肝胶囊对小鼠酒精性肝损伤的保护作用[J].中国现代医学杂志,2018,28(8):13-17.
CHENG Y F, LYU X J.Study on protective effect of Sanqi Hugan Capsules against alcoholic liver injury in mice[J].China Journal of Modern Medicine, 2018, 28(8):13-17.
[7] 吴建华,吴志瑰,裴建国,等.多酚类化合物的研究进展[J].中国现代中药,2015,17(6):630-636.
WU J H, WU Z G, PEI J G, et al.Advances in studies on polyphenols [J].Modern Chinese Medicine, 2015,17(6):630-636.
[8] 牛俊瑞,吕瑞霞.多酚类物质潜在药理活性及其研究进展[J].内蒙古中医药,2013,32(9):128-129.
NIU J R, LYU R X.Potential pharmacological activities and research progress of polyphenols [J].Nei Mongol Jorunal of Traditional Chinese Medicine, 2013,32(9):128-129.
[9] 史冬梅,王松,赵东瑞,等.GC-MS/SIM法检测103种白酒中6种酚类化合物[J].中国食品学报,2019,19(4):235-248.
SHI D M, WANG S, ZHAO D R, et al.Determination of 6 phenols in 103 kinds of Chinese Baijiu by GC-MS/SIM [J].Journal of Chinese Institute of Food Science and Technology, 2019,19(4):235-248.
[10] 赵东瑞.古井贡酒风味物质及酚类风味物质的抗氧化性和抗炎性的研究[D].广州:华南理工大学,2019.
ZHAO D R.Research on the aroma compounds of gujinggong Chinese baijiu and evaluation of the antioxidant and anti-inflammatory effects of phenolic aroma compounds[D].Guangzhou:South China University of Technology, 2019.
[11] 路宏朝,张涛,高佩佩.茶多酚对酒精性肝损伤的保护作用[J].时珍国医国药,2010,21(1):134-135.
LU H C, ZHANG T, GAO P P.Protective effect of tea polyphenols on alcoholic liver injury [J].Lishizhen Medicine and Materia Medica Research, 2010,21(1):134-135.
[12] 刘利萍,卢秋静,宣亮,等.姜黄素协同氨基葡萄糖对小鼠急性酒精性肝损伤的保护作用[J].中国新药杂志, 2014,23(23):2 794-2 797.
LIU L P, LU Q J, XUAN L, et al.Synergistic protective effects of curcumin and glucosamine on acute alcoholic liver injury in mice [J].Chinese Journal of New Drugs, 2014,23(23):2 794-2 797.
[13] 刘姝.急性酒精性肝损伤中槲皮素抗氧化应激及抗炎作用交互影响的机制研究[D].沈阳:中国医科大学, 2019.
LIU S.The study on the mechanism of the crosstalk between the anti-oxidative and anti-inflammatory effects of quercetin in acute alcoholic liver injury[D].Shenyang:China Medical University, 2019.
[14] 张乾伟.AST/ALT比值的临床价值[J].重庆医学,2002,31(2):108.
ZHANG Q W.Clinical value of AST/ALT ratio [J].Chongqing Medical Journal, 2002,31(2):108.
[15] 仝静.血清ALT、AST和GGT水平检测在肝脏疾病诊断中的应用价值[J].河南医学研究,2017,26(22):4 064-4 065.
TONG J.The application value of serum ALT, AST and GGT in the diagnosis of liver diseases [J].Henan Medical Research, 2017,26(22):4 064-4 065.
[16] SOZIO M, CRABB D W.Alcohol and lipid metabolism[J].American Journal of Physiology-Endocrinology and Metabolism, 2008, 295(1):10-16.
[17] KIM J S.Investigation of phenolic, flavonoid, and vitamin contents in different parts of Korean ginseng (Panax ginseng C.A.Meyer)[J].Preventive Nutrition & Food Science, 2016, 21(3):263-270.
[18] MOHAMMADI M, ALAEI M, BA JALAN I.Phytochemical screening, total phenolic and flavonoid contents and antioxidant activity of Anabasis setifera and Salsola tomentosa extracted with different extraction methods and solvents[J].Oriental Pharmacy & Experimental Medicine, 2016, 16(1):31-35.
[19] HSIEH P S, CHEN C W, KUO Y W, et al.Lactobacillus spp.reduces ethanol-induced liver oxidative stress and inflammation in a mouse model of alcoholic steatohepatitis[J].Experimental and Therapeutic Medicine, 2021,21(3):188.
[20] KANG M C, KANG S M, AHN G, et al.Protective effect of a marine polyphenol, dieckol against carbon tetrachloride-induced acute liver damage in mouse[J].Environ Toxicol Pharmacol, 2013,35(3):517-523.
[21] YI R, WEI Y, TAN F, et al.Antioxidant capacity-related preventive effects of Shoumei (Slightly Fermented Camellia sinensis) polyphenols against hepatic injury[J].Oxidative Medicine and Cellular Longevity, 2020(19):1-17.
[22] 周慧友,郑万玲,江成,等.海南鲜椰子水对酒精性肝损伤大鼠的保护作用研究[J].实用肝脏病杂志,2016, 19(5):570-573.
ZHOU H Y, ZHENG W L, JIANG C, et al.Protective effect of Hainan fresh coconut water on alcoholic liver injury in rats [J].Journal of Practical Hepatology, 2016, 19(5):570-573.
[23] 颜志婷,肖冬梅,陈杰.南五味子多糖急性毒性及对小鼠肝损伤保护作用机理探讨[J].江西医药,2018, 53(2):147-149.
YAN Z T, XIAO D M, CHEN J.Acute toxicity of polysaccharide from Schisandra chinensis and its protective mechanism on liver injury in mice [J].Jiangxi Medical Journal, 2018, 53(2):147-149.
[24] 周建利,周少明.脂肪肝的影像学定量评估研究进展[J].实用医学杂志, 2015(18):3 097-3 099.
ZHOU J L, ZHOU S M.Research progress of imaging quantitative evaluation of fatty liver [J].The Journal of Practical Medicine, 2015(18):3 097-3 099.