包包曲,是浓香型白酒酿造过程中重要的糖化发酵剂[1],因其块状结构一侧具有较大凸起而得名。独特的“包包”结构使包包曲比一般大曲拥有更大的比表面积,更有利于霉菌等的生长[2]。同时,其外紧内松的结构特点[2],增大了物料的孔隙率,更有利于大曲内部和外部的物质能量交换和微生物的生长繁殖。包包曲独特的结构使热量、水分和氧气含量等参数从曲块外部到内部呈梯度分布[3],造成大曲不同部位微生物群落多样性,从而导致了曲皮、曲心微生物群落的差异。
研究表明,大曲不同部位往往具有不同的质量[4]和微生物群落结构,其差异甚至大于同一环境下不同制曲方式[5]。不同部位大曲的研究对加深大曲微生物群落的理解有着重要作用。曲皮、曲心的理化、生化特性和基于传统可培养方式的微生物群落特征及差异已经取得了一定的研究成果[4,6]。随着高通量测序技术被普遍应用于白酒酿造研究[7],曲皮、曲心微生物群落结构与差异被进一步解析。JIN等[8]通过Illumina MiSeq平台测序发现酱香型大曲中乳杆菌目(Lactobacillales)在曲皮中丰度更高,而芽孢杆菌目(Bacillales)则在曲心中丰度更高。近期,CHEN等[9]也通过不可培养的手段得出特香型大曲曲皮和曲心微生物间存在显著差异的结论。然而,运用高通量测序技术对曲皮、曲心在大曲发酵过程中的微生物群落变化情况和差异的报道目前几乎没有。
本研究采用高通量测序技术探究了包包曲发酵过程中的曲皮和曲心微生物群落结构变化规律,并与理化因子相关联,旨在比较大曲发酵过程中曲皮、曲心微生物群落的差异及与理化因子的关系,有助于进一步认识浓香型白酒包包曲微生物种群多样性,探明其形成机制。
1 材料与方法
1.1 材料与试剂
样品:浓香型包包曲样品源自四川某浓香型白酒厂,分别在发酵第0、1、2、3、4、5、6、7、8、9、10、11、12、13、15、16、20、23、29天取样。每次取样选择3块大曲,将大曲表面约1 cm的部分划为曲皮(QP),其余部分为曲心(QX),分别粉碎、混匀、装袋后,于4 ℃和-80 ℃保存。
试剂:NaOH(分析纯),成都市科龙化工试剂厂;乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,Na2EDTA)、Na2HPO4、NaH2PO4、蜗牛酶、溶菌酶、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),生工生物工程(上海)股份有限公司;CHCl3(分析纯),成都市科隆化学品有限公司。
1.2 仪器与设备
PT100温度传感器,华巨温度传感器有限公司;DHG-9245电热干燥箱,上海一恒科学仪器有限公司;QL-861漩涡振荡器,江苏海门市麒麟医用仪器厂;LYNX 6000高速冷冻离心机,美国Thermo公司。
1.3 包包曲理化指标的测定
包包曲的水分、总酸、pH值采用大曲通用分析方法QB/T 4257—2011[10]测定。包包曲温度采用温度传感器实时测定。
1.4 包包曲总DNA提取和测序
采用CTAB改良法提取大曲总DNA[11]。使用引物338F/806R(5′-ACTCCTACGGGAGGCAGCA-3′/5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3~V4高变区进行扩增,内部转录间隔区(internal transcribed spacer,ITS)5F/ITS1R(5′-GGAAGTAAAAGTCGTAACAAGG-3′/5′-GCTGCGTTC TTCATCGATGC-3′)对真菌的ITS1进行扩增。由上海派森诺生物科技有限公司在Illumina MiSeq 2500平台上进行双端测序。
1.5 包包曲微生物群落结构分析
按照QIIME 2标准流程对原始序列进行处理。使用DADA2对序列进行质量过滤、去噪、合并和去除嵌合体[12],使用多样性插件计算α多样性指数。在R(version 4.0.3)的vegan(version 2.5-7)软件包中进行了层次聚类分析、相似性分析(analysis of similarities,ANOSIM)、mantel检验和理化因子与优势微生物的Pearson相关性分析。mantel test分析了基于bray-curtis距离的细菌、真菌ASV(amplicon sequence variant)相对丰度的距离矩阵和基于欧几里得距离的理化因子相异性矩阵的Spearman相关性。使用canoco 4.5进行包包曲微生物群落与环境因子的冗余分析(redundancy analysis,RDA)。通过STAMP(2.1.3)进行Fisher′s精确检验得到两样本的显著差异微生物。而线性判别分析效应值(linear discriminant analysis effect size,LEfSe)是通过http://huttenhower.sph.harvard.edu/galaxy/root?tool_id=PICRUSt_normalize网站完成的。
2 结果与分析
2.1 包包曲发酵过程中曲皮、曲心理化因子的变化特点
温度、水分、酸度、pH值是大曲发酵过程的重要参数,在一定程度上可以反映大曲微生物的生长环境或代谢情况。曲心温度符合“前缓中挺后缓落”的变化特点;曲皮温度受到翻曲的影响,在第7~12天和第16~18 天有明显的降低(图1-a)。曲皮、曲心水分含量呈降低趋势,并分别在第13~29天和第1~6天变化较小;出房时,曲皮、曲心水分含量分别为12.32%和16.23%。发酵初期,曲块水分含量较高,霉菌菌丝没有大量形成,曲块处于缺氧环境。因此,微生物无氧发酵产生大量酸,尤其是曲心中总酸含量较高,曲皮、曲心pH值在第0~2天迅速下降,之后由于有机酸参与合成酯类及原料中蛋白质的降解,导致了pH值的增加[13]。包包曲的块状结构导致其水分、温度等理化指标从内到外呈梯度变化,进而导致大曲发酵过程中,曲皮、曲心的理化因子存在明显差异,并且这种差异是从发酵第2天开始的。

a-包包曲温度和水分含量;b-包包曲总酸和pH值
图1 包包曲发酵过程中理化因子的变化规律
Fig.1 Dynamics of physicochemical factors during
Baobaoqu fermentation process
2.2 曲皮、曲心微生物群落测序深度评价和α多样性分析
2.2.1 包包曲样本微生物群落测序深度评价
Shannon指数稀释曲线显示在10 000条序列时趋于饱和(图2),表明所有样本的测序深度均满足分析要求。

a-细菌;b-真菌
图2 包包曲样品稀释曲线
Fig.2 Rarefaction curves of Baobaoqu samples
2.2.2 包包曲发酵过程中曲皮、曲心微生物群落α多样性分析
包包曲发酵过程中,曲皮、曲心细菌群落丰富度指数Chao1和群落多样性指数Shannon具有先降低再增高趋势(图3-a、图3-b)。曲皮细菌丰富度和多样性与曲心没有显著差异(P>0.05)。曲皮真菌丰富度和多样性在第1~9天持续下降;而曲心真菌丰富度和多样性在发酵第1~3天迅速上升,在第3天达到最大值(165.56和5.90);第7~29天,曲皮真菌丰富度和多样性变化趋势与曲心一致,且显著高于曲心(P<0.05)(图3-c、图3-d)。
2.3 包包曲发酵过程中曲皮、曲心微生物群落演替规律
细菌16S rRNA和真菌ITS测序分别获得了1 467 670 个和1 350 213个高质量序列,按100%相似度聚类分别得到4 454个和504个ASV,覆盖率均在99%以上。细菌、真菌ASV特征序列分别与Greengenes数据库、UNITE数据库比对进行物种注释,共检测到475个细菌属和69个真菌属。
包包曲发酵过程中,曲皮、曲心的主要细菌目为Bacillales、Lactobacillales、假单胞菌目(Pseudomonadales)(平均相对丰度>10%)。如图4-a和图4-b所示,曲皮、曲心优势细菌属(平均相对丰度>1%)在包包曲发酵过程中的变化趋势较为相似,但丰度具有明显差异,特别是在第13~29天。发酵第1~6天,Lactobacillales各属和假单胞菌属(Pseudomonas)在群落中占优势;随着温度升高,嗜热菌芽孢杆菌属(Bacillus)、热放线菌属(Thermoactinomyces)在第7~12天丰度最高,相对丰度占70%以上;第13天之后,曲皮群落优势微生物为Bacillus、Thermoactinomyces、Pseudomonas、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、不动杆菌属(Acinetobacter)、未分类的根瘤菌属(unclassified Rhizobiaceae)等,而曲心中仍以Bacillus、Thermoactinomyces和Pseudomonas为主。并且,曲皮、曲心中的Bacillus分别在第3天和第8天达到优势丰度(相对丰度>1%),这可能是由于曲心中高酸度、高水分的环境抑制了酸敏感的Bacillus[14]的生长繁殖。
包包曲发酵过程中,曲皮、曲心的主要真菌目为散囊菌目(Eurotiales)和毛霉目(Mucorales)。而优势真菌属在曲皮、曲心中的分布具有明显差异,如图4-c 和图4-d所示。嗜热子囊菌属(Thermoascus)在曲心中更早出现优势,曲皮中根霉属(Rhizopus)的丰度在第1~6天远大于曲心。发酵第13~29天,曲皮中优势微生物除Thermoascus外,还有Rhizopus、根毛霉属(Rhizomucor)、曲霉属(Aspergillus)、毕赤酵母属(Pichia)、嗜热真菌属(Thermomyces),而曲心中仅Thermoascus和Thermomyces在群落中占优势。
由图4可知,出房时,曲皮、曲心微生物群落具有不同的结构特点,曲皮微生物群落由多菌主导,而曲心微生物群落主要由Pseudomonas和嗜热菌Thermoactinomyces、Thermoascus、Thermomyces主导。Bacillus、Rhizopus、Rhizomucor是大曲中主要糖化酶和淀粉酶产生菌[15],其在曲皮中的优势可能导致了曲皮糖化力、液化力大于曲心。同时,这些优势微生物也是白酒酿造过程中的重要功能微生物。其中,Bacillus普遍具有良好的产淀粉酶和蛋白酶的功能,能够代谢多种风味物质[16]。Thermoascus具有产热稳定性和高活力纤维素酶、蛋白酶的功能,具有产酒生香作用[11]。而Pseudomonas是大曲和糟醅的优势微生物[17],可以产生嗜热脂肪酶[18]并抑制谷物病原体[19],也可能对发酵产生负面影响[20],其在酿造系统中的功能及影响需要进一步研究。曲皮、曲心中这些重要优势微生物的丰度差异,赋予了曲皮、曲心不同的微生物群落及代谢特点,也是曲皮、曲心理化因子存在较大差异的原因之一。

a,b-细菌多样性指数;c,d-真菌多样性指数
图3 包包曲发酵过程中曲皮、曲心微生物群落α多样性指数
Fig.3 Microbial communities αdiversity index during Baobaoqu fermentation

a-属水平曲皮细菌群落结构;b-属水平曲心细菌群落结构;c-属水平曲皮真菌群落结构;d-属水平曲心真菌群落结构
图4 包包曲发酵过程中微生物群落演替规律
Fig.4 Succession of microbial community during Baobaoqu fermentation
2.4 包包曲发酵过程中曲皮、曲心微生物群落的差异
2.4.1 包包曲发酵过程中曲皮、曲心样品间微生物群落结构的差异性和相似性
ANOSIM分析表明曲皮、曲心细菌群落(R=0.161,P=0.004)和真菌群落(R=0.131,P=0.01)存在显著差异。基于bray-curtis距离对曲皮、曲心细菌和真菌微生物群落结构的聚类分析,直观展现了样本间的差异性和相似性,如图5-a和图5-b所示。第1~6天和第7~29天包包曲细菌群落分别聚为2支(图6-a),表明第1~6天和第7~29天大曲细菌群落结构差异较大;而第1~5天和第6~29天大曲真菌群落结构差异也较大(图6-b)。从包包曲不同部位来看,曲皮、曲心细菌群落在第1~4天较为相似;而第7~12天的曲皮微生物群落结构和第8~29天曲心微生物群落结构较为相似。而QX7、QP13、QP15、QP29的细菌群落结构和QP15真菌群落结构与发酵前期样品较为接近。曲皮、曲心微生物群落结构聚类结果与理化因子变化具有相似的阶段性,反映了理化因子与微生物群落间存在密切的相互影响关系,这种关系可能是包包曲微生物种群多样性形成的重要原因。
2.4.2 包包曲发酵过程中曲皮、曲心微生物群落的差异微生物
利用LEfSe对包包曲发酵过程中曲皮、曲心间显著差异微生物进行分析(阈值为4),结果如图5-c和图5-d所示。乳杆菌属(Lactobacillus)、Weissella、Rhizopus、Rhizomucor、Pichia、Aspergillus的丰度在曲皮中更高,Thermoascus、Pseudomonadales、根瘤菌目(Rhizobiales)、酵母菌目(Saccharomycetales)、锁掷酵母目(Sporidiobolales)的丰度在曲心中更高。曲心温度更高可能导致了Thermoascus在曲心真菌群落中丰度更高、主导时间更长[21]。霉菌的好氧特性可能直接导致了其在曲皮中占优势。Lactobacillales的丰度变化趋势与温度一致,温度可能是Lactobacillales在曲皮中丰度更高的重要原因。掷孢酵母属(Sporobolomyces)的相对丰度极小,其相对丰度在曲皮中总是为0可能导致了Sporobolomyces在曲心中丰度显著更大。而酵母菌易受环境因素影响,如低水分(<15%)和高温(>50 ℃)[9],这可能导致了Pichia在曲皮中更丰富。

a-细菌群落结构的聚类分析;b-真菌群落结构的聚类分析;c-细菌显著差异物种LDA得分值分布柱状图;d-真菌显著差异物种LDA得分值分布柱状图
图5 包包曲发酵过程中曲皮、曲心微生物群落的差异
Fig.5 Differences in microbial communities between QP and QX during Baobaoqu fermentation
注:LDA-linear discriminant analysis
此外,包包曲出房时,曲皮、曲心优势微生物的丰度也具有显著差异(P<0.05)。来自于大曲的Bacillus、Saccharomycetales、Aspergillus和Thermoascus等,是白酒主发酵前期的优势微生物,对白酒发酵过程的乙醇或风味代谢有重要贡献[20]。大曲中的Lactobacillales可直接参与白酒发酵[22],是白酒主发酵的主导菌群,还是酯类化合物积累的关键因素[23]。而大曲微生物代谢物质也是白酒风味的重要来源。因此,大曲微生物组成对白酒主发酵过程的微生物菌群结构、丰度及微生物生长代谢都具有重要影响[24],认识和揭示包包曲多样性及形成机制,对浓香型白酒主发酵过程具有重要意义。
2.5 包包曲发酵过程中曲皮、曲心微生物类群与理化因子的关系
利用RDA对包包曲发酵过程中曲皮、曲心细菌和真菌属水平微生物群落与理化因子的关系进行分析,结果如图6所示。曲皮、曲心细菌和真菌群落在第1~4天与水分、总酸呈正相关,与温度、pH值呈负相关;而在第7~12天与温度、pH值呈正相关,与水分、总酸呈负相关。但第13~29天,曲心微生物群落主要受pH和温度影响;而曲皮微生物群落在第15~20天仍主要受温度和总酸含量的影响,在第23~29天主要受pH影响,曲皮、曲心样本总是沿pH值的轴分布和聚集,表明pH值对曲皮、曲心微生物群落的影响较大。

a-曲皮细菌;b-曲皮真菌;c-曲心细菌;d-曲心真菌
图6 包包曲发酵过程中微生物群落与理化因子的冗余分析
Fig.6 Redundancy analysis of microbial communities and physicochemical factors during Baobaoqu fermentation
mantel test分析进一步表明,包包曲发酵过程中,pH值、总酸对曲皮、曲心的细菌和真菌组成具有显著影响,温度仅对真菌组成有显著影响,而水分仅对曲皮微生物群落组成具有显著影响(表1)。包包曲发酵过程中平均相对丰度前25的微生物属与理化因子的Pearson相关性分析也表明pH值与优势微生物存在大量显著正或负相关关系(图7)。且pH值是影响微生物生长代谢的重要因素。Bacillus在曲心中与总酸呈负相关,与2.3的结论一致,酸度可能是导致发酵前期Bacillus在曲皮中丰度更高的主要原因。曲皮、曲心的微环境差异是导致其微生物群落结构差异的重要原因[4],如曲心中更高的温度可能导致了嗜热菌相对丰度在曲心中更具优势、更稳定[25];而微生物群落代谢也会反过来影响环境因子,特别是酸度、温度等理化特性[9]。pH值、总酸、温度、水分是与曲皮、曲心微生物组成密切相关的重要影响因素。

a-曲皮;b-曲心
图7 优势微生物与理化因子的Pearson相关性分析
Fig.7 Pearson correlation analysis of dominant
microorganisms and physicochemical factors
注:*表示显著相关(P <0.05);**表示极显著相关(P<0.01);
Rhizobium :Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium
表1 包包曲发酵过程中细菌和真菌群落与理化因子的mantel test分析
Table 1 Mantel test analysis of bacteria and fungi communities and physicochemical factors during Baobaoqu fermentation
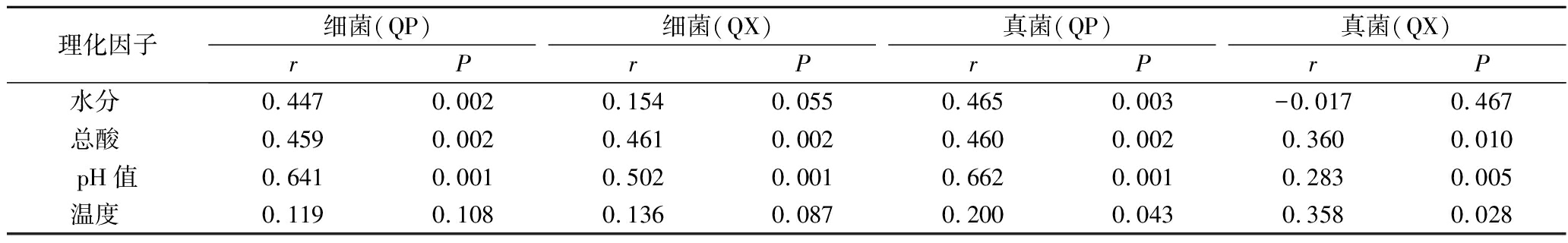
理化因子细菌(QP)细菌(QX)真菌(QP)真菌(QX)rPrPrPrP水分 0.4470.0020.1540.0550.4650.003-0.0170.467总酸 0.4590.0020.4610.0020.4600.0020.3600.010pH值0.6410.0010.5020.0010.6620.0010.2830.005温度 0.1190.1080.1360.0870.2000.0430.3580.028
3 结论与讨论
通过研究浓香型包包曲发酵过程中曲皮、曲心理化特性和微生物群落组成,讨论理化因子对微生物群落的影响,得出以下结论:曲皮、曲心的理化特性从发酵第2天开始出现差异,并且曲皮pH值高于曲心,水分、温度和总酸低于曲心;高通量测序结果表明曲皮、曲心优势微生物类群相似,为Lactobacillales、Pseudomonadales、肠杆菌目(Enterobacteriales)、Bacillales、Eurotiales、Mucorales、Saccharomycetales,但曲皮、曲心优势微生物在发酵过程中的分布和丰度具有明显区别;ANOSIM分析表明曲皮、曲心微生物群落存在显著差异;LEfSe分析得出Lactobacillus、Weissella、Rhizopus、Rhizomucor、Pichia、Aspergillus的丰度在曲皮中显著更高,Thermoascus、Pseudomonadales、Rhizobiales、Saccharomycetales、Sporidiobolales的丰度在曲心中显著更高;RDA、mantel test分析及Pearson相关性分析共同表明,pH值、总酸、温度、水分是与曲皮、曲心微生物组成密切相关的重要影响因素。本研究揭示了包包曲发酵过程中曲皮、曲心微生物群落多样性差异及与大曲理化因子的相关性,有助于解析包包曲微生物种群多样性的形成机制。
研究结果发现包包曲发酵过程中曲皮、曲心的理化性质、微生物群落结构、理化因子与微生物类群的关系间的差异都存在较明显的阶段性,这些阶段间存在一定规律但尚不明晰。进一步通过引入其他与大曲微生物类群生长相关的因素,如氧气浓度或加大样本量等方式,可能有助于包包曲发酵过程中微生物群落变化规律的探究。而各环境因子是协调影响微生物群落的,微生物群落代谢也会反过来影响环境因子,量化的复合因素对微生物群落的研究或许能够进一步解析包包曲微生物种群变化规律。
[1] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[2] 赵东, 杨蓉.白酒酿造微生物培养技术研究[J].酿酒, 2014, 41(6):21-25.
ZHAO D, YANG R.The research on the techniques of cultivation liquor-making microbes[J].Liquor Making, 2014, 41(6):21-25.
[3] WANG Z M, WANG C T, SHEN C H, et al.Microbiota stratification and succession of amylase-producing Bacillus in traditional Chinese Jiuqu (fermentation starters)[J].Journal of the Science of Food and Agriculture, 2020, 100(8):3 544-3 553.
[4] 明红梅, 陈晓旭, 刘清斌, 等.泸型大曲曲表与曲心理化生化特性的对比研究[J].湖北农业科学, 2015, 54(6):1 445-1 447;1 451.
MING H M, CHEN X X, LIU Q B, et al.Comparative studies on physicochemical and biochemical indicators between surface and inner about Luzhou Laojiao Daqu[J].Hubei Agricultural Sciences, 2015, 54(6):1 445-1 447;1 451.
[5] 李家民, 王海英, 张文学, 等.用DGGE方法初步解析浓香型大曲微生物群落结构[J].酿酒科技, 2012(11):32-35.
LI J M, WANG H Y, ZHANG W X, et al.Preliminary analysis of microbial communities structure in Luzhou-flavor Daqu by DGGE[J].Liquor-Making Science & Technology, 2012(11):32-35.
[6] 姚万春, 唐玉明, 任道群, 等.泸州老窖国窖曲曲坯层次间微生物差异研究[J].酿酒, 2005,32(5):35-37.
YAO W C, TANG Y M, REN D Q, et al.Study on the differences of microbes in the different layers of Guojiao Daqu[J].Liquor Making, 2005,32(5):35-37.
[7] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Frontiers in Microbiology, 2018, 9:671.
[8] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[9] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor baijiu Daqu[J].Frontiers in Microbiology, 2021.DOI:10.3389/fmicb.2020.592421.
[10] 中国轻工业联合会. QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中华人民共和国工业和信息化部, 2011.
China National Light Industry Council.QB/T 4257—2011 General analysis method for brewing Daqu[S].Beijing:Ministry of Industry and Information Technology of the People′s Republic of China, 2011.
[11] 夏玙, 罗惠波, 周平, 等.不同处理方式的大曲真菌群落差异分析[J].食品科学, 2018, 39(22):166-172.
XIA Y, LUO H B, ZHOU P, et al.Comparison of fungal communities in Daqu with different treatments[J].Food Science, 2018, 39(22):166-172.
[12] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al.DADA2:High-resolution sample inference from Illumina amplicon data[J].Nature Methods, 2016, 13(7):581-583.
[13] LI P, LIN W F, LIU X, et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Frontiers in Microbiology, 2016, 7:1 237.
[14] GUAN T W, LIN Y J, CHEN K B, et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese strong-flavor Baijiu[J].Frontiers in Microbiology, 2020, 11:2 090.
[15] CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology, 2014, 179:80-84.
[16] SOCCOL C R, COSTA E S F D, LETTI L A J, et al.Recent developments and innovations in solid state fermentation[J].Biotechnology Research and Innovation, 2017, 1(1):52-71.
[17] TANG J, TANG X X, TANG M, et al.Analysis of the bacterial communities in two liquors of soy sauce aroma as revealed by high-throughput sequencing of the 16S rRNA V4 hypervariable region[J].BioMed Research International, 2017.DOI:10.1155/2017/6271358.
[18] ZHAO Y Y, YANG Y Z, HE F, et al.Pseudomonas xionganensis sp.nov., isolated from Baiyangdian Lake in Xiong′an New Area[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(12):6 052-6 059.
[19] HAAS D, DÉFAGO G.Biological control of soil-borne pathogens by fluorescent Pseudomonads[J].Nature Reviews Microbiology, 2005, 3(4):307-319.
[20] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018, 84(4).DOI:10.1128/AEM.02369-17.
[21] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588 117.
[22] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].International Journal of Food Microbiology, 2019, 311:108 350.
[23] LI K M, CHEN Y R, LIU T, et al.Analysis of spatial distribution of bacterial community associated with accumulation of volatile compounds in Jiupei during the brewing of special-flavor liquor[J].LWT, 2020, 130:109620.
[24] 王柏文, 吴群, 徐岩, 等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报,2021,48(5):1 737-1 746.
WANG B W, WU Q, XU Y, et al.Recent advances and perspectives in study of microbiome in Chinese Jiuqu starter[J].Microbiology China,2021,48(5):1 737-1 746.
[25] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology, 2017, 83(23).DOI:10.1128/AEM.01550-17.