Millerozyma (Pichia) farinosa CBS 7064属于毕赤酵母属[1],对生物胺有降解作用[2],在白酒酒醅[3]、酱油[4]、泡菜[5]、大豆酱[6]中均有发现。目前,关于M.farinosa的性质与应用研究较少。酒类的发酵,会带来高乙醇含量和高渗透压等环境,引起细胞活力和发酵性能的改变[7-8]。研究发现,5%的乙醇便会使酵母降解生物胺能力大幅下降[9]。过高的乙醇含量会破坏离子平衡,导致蛋白质聚集和功能障碍,对线粒体中酶活性、细胞膜的组分和细胞结构产生影响,抑制细胞的生长甚至导致细胞死亡[10-11]。
目前,提高酵母乙醇耐受性的方法有诱变菌株、基因工程、基因组改造等手段[12],或是提供营养底物和生物活性成分改善酵母菌株的环境耐受性[13-14]。其中适应性实验室进化技术是预先将微生物暴露于胁迫环境中,以提高其适应性。目前已被广泛应用于对菌株表型特征、生理生化特性、发酵性能的影响及其分子机制的研究[15]。如TOM S-PEJ
S-PEJ 等[16]研究发现,短期适应抑制剂的酿酒酵母生长延滞期明显缩短,比生长速率显著提高,菌株的乙醇生产能力提高了80%。
等[16]研究发现,短期适应抑制剂的酿酒酵母生长延滞期明显缩短,比生长速率显著提高,菌株的乙醇生产能力提高了80%。
本研究以实验室保藏菌株M.farinose NCUF 304.1进行适应性进化,以期获得乙醇耐受性得到提高的酵母菌株,并研究其与原始菌株间生长与性能的差异,为后续探究M.farinosa NCUF 304.1耐乙醇的内在机制奠定前期基础,对其更好应用于酒类酿造降解生物胺,提高酒类质量安全有深远意义。
1 材料与方法
1.1 菌株与培养基
菌株:实验室保藏的从特香型白酒酒醅中筛选所得菌株Millerozyma farinosa NCUF304.1。
培养基:酵母膏胨葡萄糖(yeast peptone dextrose,YPD)培养基。
1.2 试剂和仪器设备
试剂均购于西陇科学。
MMC-1全自动高通量微生物液滴培养仪,洛阳华清天木生物科技有限公司;SP-756P型紫外可见分光光度计,上海光谱仪器有限公司;DDS-307型电导率仪,上海雷磁仪器有限公司;日立SU8100型场发射扫描电镜, 日本日立集团。
1.3 实验方法
1.3.1 菌株适应性进化
适应性进化:M.farinosa NCUF304.1菌液按5%接种量接入新的YPD培养基中,混匀后将培养液转移至进样瓶,接入MMC-1全自动高通量微生物液滴培养仪,设置培养温度28 ℃、起始乙醇体积分数为5%,以1%递加,每一个梯度传代驯化5~10代,收集最后一个梯度下生长状况最优的菌株。
1.3.2 耐乙醇能力测定
参照MO等[17]的方法,以不同乙醇体积分数梯度(0%、5%、6%、7%、8%、9%、10%、11%、12%和13%)培养M.farinosa,进行平板点种实验。
1.3.3 高乙醇胁迫下酵母菌株生长的测定
向灭菌的50 mL YPD培养基(乙醇体积分数分别为0%、8%),接种2%酵母种子液,28 ℃、180 r/min培养,每4 h取样,测定OD600值,计算平均值,绘制酵母生长趋势曲线。
1.3.4 乙醇胁迫培养和样液处理
乙醇胁迫培养:基于生长曲线的结果,向灭菌的50 mL YPD培养基(乙醇体积分数分别为0%、8%),接种2%酵母种子液,于28 ℃、180 r/min分别培养28、36、44 h。
样液处理:收集5 mL酵母种子液,4 ℃,6 000 r/min,离心5 min,相同体积的无菌生理盐水洗涤2次,加入5 mL蒸馏水,28 ℃水浴15 min,按上述条件离心5 min,保留上清液为实验样液,菌体沉淀烘干至恒重,测其干重。
1.3.5 细胞泄漏内容物含量测定
可溶性蛋白含量测定采用考马斯亮蓝法[18],单位为 μg/g DCW;总糖含量测定采用蒽酮-硫酸法[19],单位为mg/g DCW。
1.3.6 电导率测定
参照李冲伟等[20]的方法,单位为 μg/(cm·g DCW)。
1.3.7 丙二醛含量
参照文献[21-22]的方法,单位为mmol/g DCW。
1.3.8 海藻糖含量
参照李艳玲[19]的方法提取海藻糖并测定其含量,单位为mg/g DCW。
1.3.9 菌体表面结构观察
参照LI等[14]的实验方法,使用扫描电子显微镜系统对酵母在不同乙醇含量下的酵母细胞表面形态进行观察。收集菌体,0.1 mol/L磷酸缓冲液(pH 7.2)洗涤菌体3次,加入2.5%的戊二醛固定液(pH 7.2)于4 ℃冰箱固定12 h,0.1 mol/L磷酸缓冲液洗涤菌体2次。乙醇体积分数依次为30%、50%、70%、90%,脱水15 min,100%乙醇3次洗脱(每次20 min),叔丁醇置换乙醇2次,每次20 min。样品冷冻干燥,喷金后用场发射扫描电镜进行分析。
1.3.10 数据统计分析
上述实验均进行3次平行重复,用Excel 2013软件计算数据标准偏差和均值,用 SPSS 17.0软件进行显著性分析(P<0.05),用Origin 9软件制作图像。
2 结果与分析
2.1 适应性进化体系下酵母驯化结果
原始菌株自乙醇体积分数超过5%,生长开始受抑制(图1)。之后,对原始菌株进行时间长达18 d的乙醇耐受适应性进化。最后在8%乙醇体积分数下驯化10代后,分离纯化得到2株生长量有明显提升的菌株,分别命名为M.farinosa NCUF 304.1-1,M.farinosa NCUF 304.1-2。
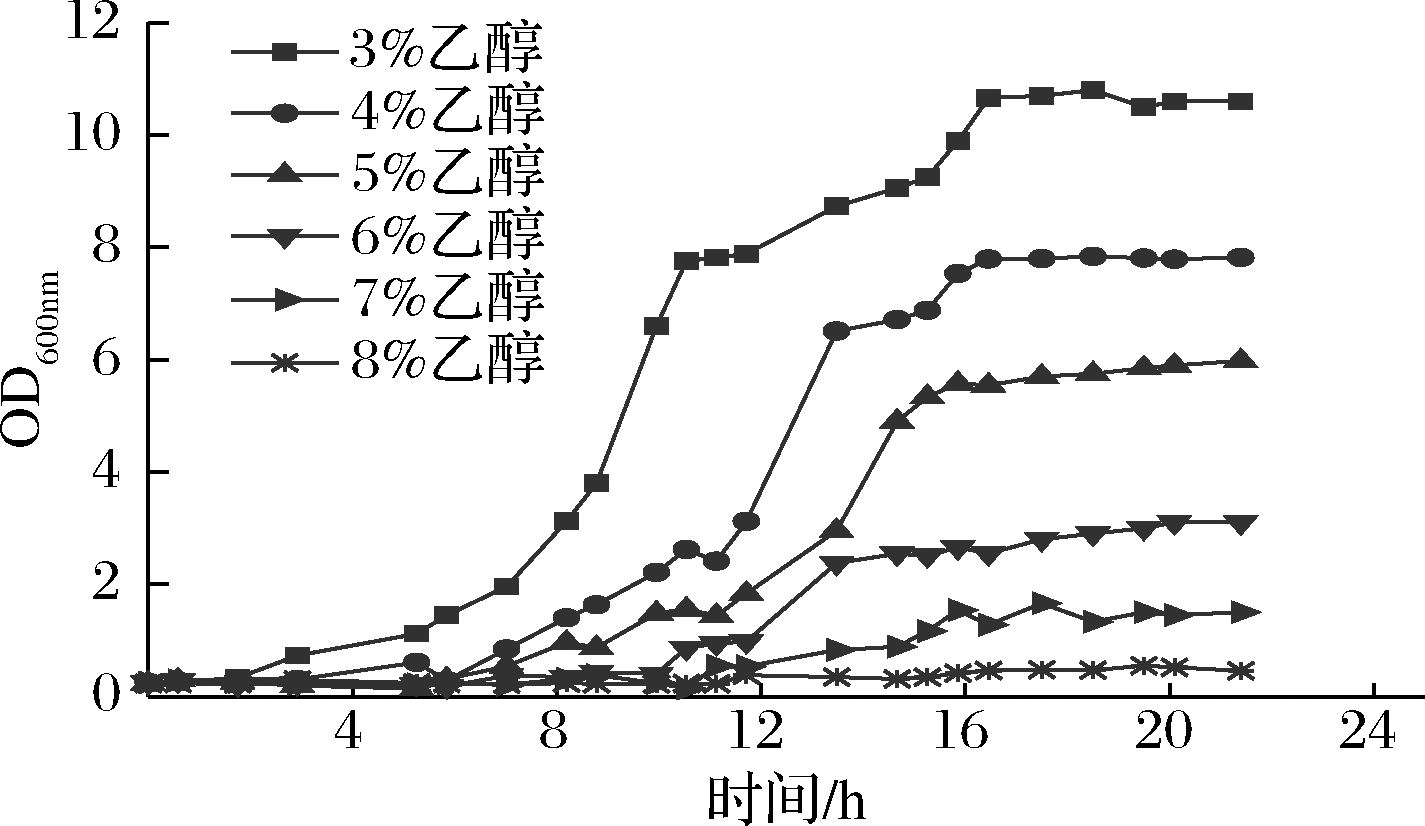
图1 乙醇含量对M.farinosa NCUF 304.1生长的影响
Fig.1 Effects of ethanol concentration on growth of M.farinosa NCUF 304.1
图2表明在8%乙醇体积分数下,2株适应性进化菌株NCUF 304.1-1、NCUF 304.1-2相比原始菌株,生物量有显著差异。24 h时,M.farinosa NCUF 304.1-1的OD值约为6.60,比原始菌株高1.5。进行生长量验证实验,结果表明驯化菌株NCUF 304.1-1、NCUF 304.1-2相比原始菌株,在8%乙醇体积分数下培养24 h后生长量分别提高了12.18%和7.98%(表1)。后续使用M.farinosa NCUF 304.1-1和原始菌株作为实验菌株。
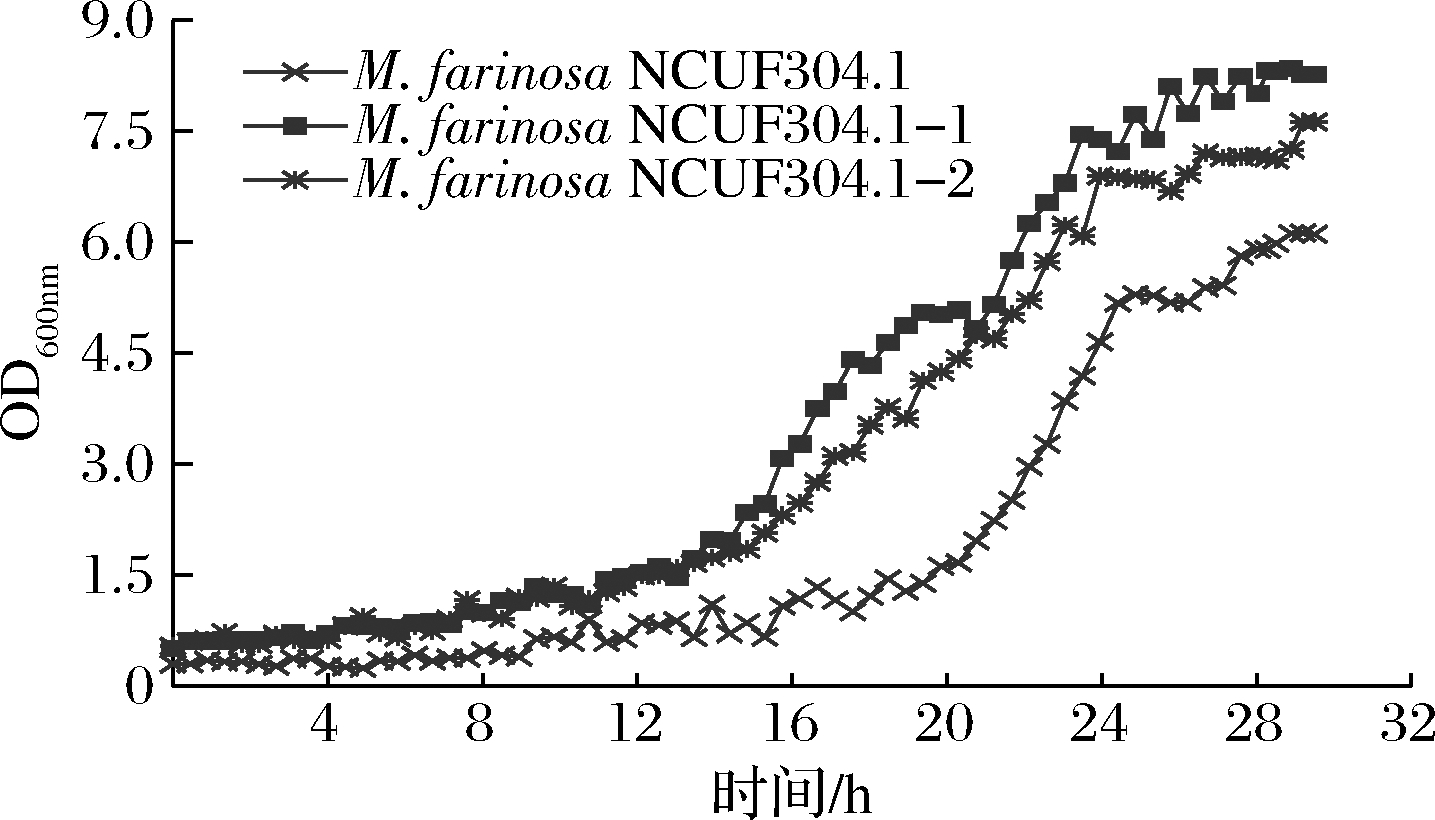
图2 8%乙醇对出发菌株和进化菌株生长的影响
Fig.2 Effect of 8% ethanol on growth of original and evolved strains
表1 8%乙醇对出发菌株和进化菌株OD值的影响
Table 1 Effect of 8% ethanol on OD value of original and evolved strains
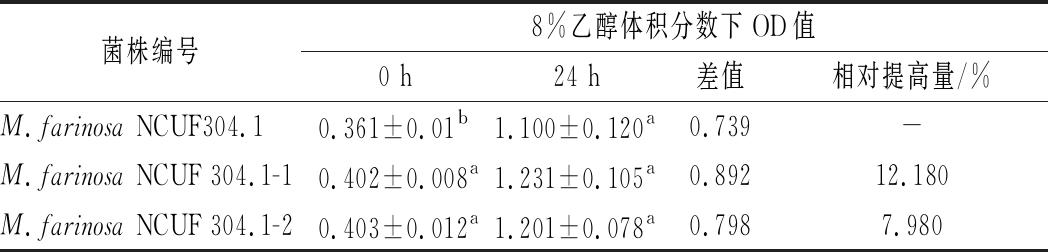
菌株编号8%乙醇体积分数下OD值0 h24 h差值相对提高量/%M.farinosa NCUF304.10.361±0.01b1.100±0.120a0.739-M.farinosa NCUF 304.1-10.402±0.008a1.231±0.105a0.89212.180M.farinosa NCUF 304.1-20.403±0.012a1.201±0.078a0.7987.980
注:同一列中不同的小写字母表示差异显著(P<0.05)
2.2 菌株与原始菌株耐受乙醇能力对比
不同乙醇含量下酵母生长情况如图3所示。M.farinosa NCUF304.1和M.farinosa NCUF 304.1-1对乙醇的最大耐受体积分数达到12%~13%,相比之下,NCUF 304.1-1有较好的乙醇耐受性,耐受度比原始菌株高出1%(体积分数),在13%乙醇体积分数,菌液稀释10倍后仍能形成较明显的菌落,表明适应性进化后的菌株NCUF 304.1-1,提高了对乙醇的耐受性。

1-原菌液;10-稀释10倍后的菌液
图3 出发菌株和进化菌株耐受乙醇能力
Fig.3 Ability of original and evolved strains to tolerate ethanol
2.3 乙醇胁迫对菌株生长的影响
图4表明,0%乙醇体积分数下,出发菌株和进化菌株较快进入生长期,而在8%乙醇下,酵母具有16~20 h的生长延滞期。M.farinosa NCUF 304.1-1显示出更高的生长速率,并且最终生长量高于M.farinosa
NCUF 304.1,结果表明高体积分数乙醇(8%)对酵母具有延缓生长,降低生物量的负面作用,但适应性进化后的M.farinosa NCUF 304.1-1受到的消极影响较少。
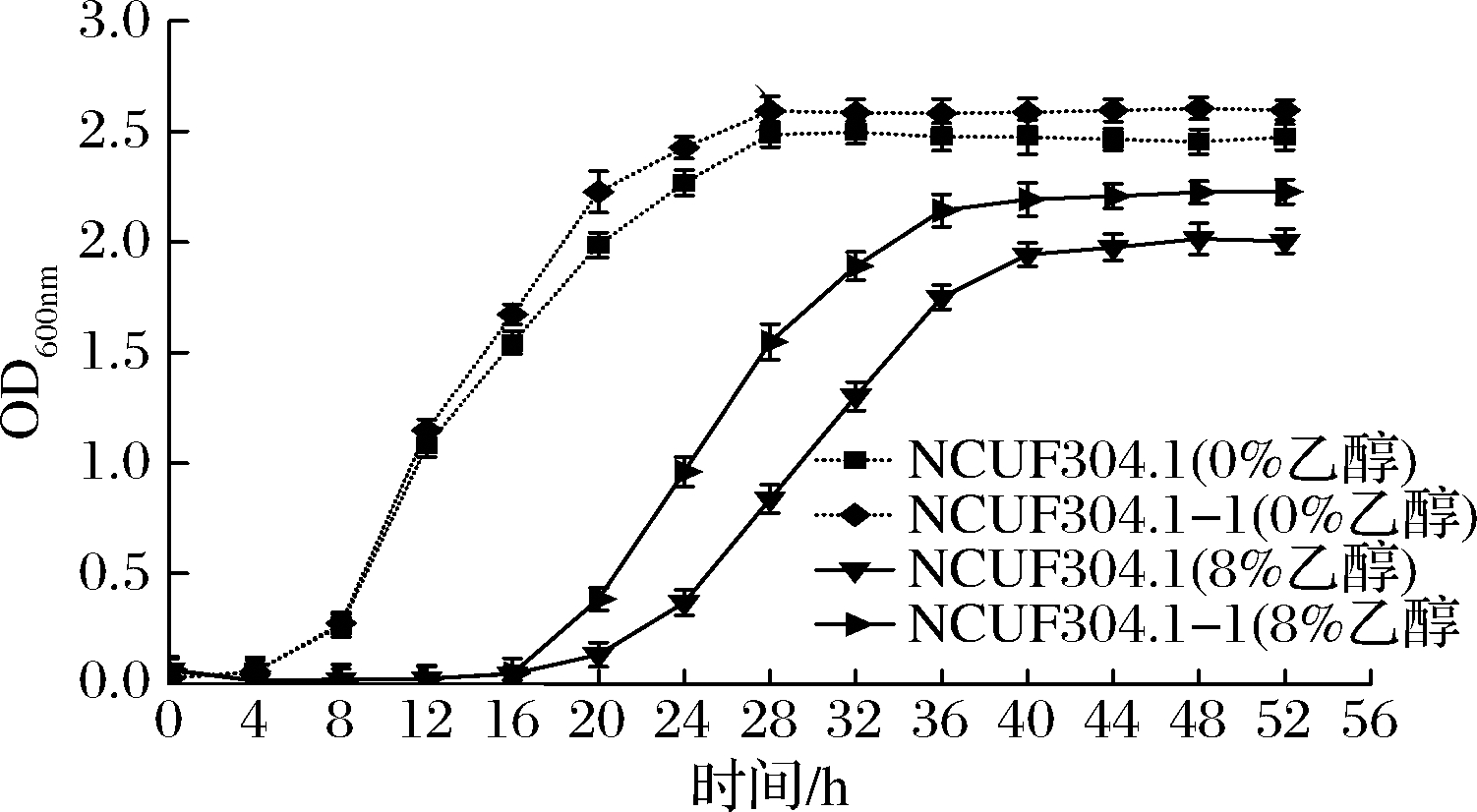
图4 乙醇对酵母生长的影响
Fig.4 Effect of ethanol on yeast growth
2.4 乙醇胁迫对菌株细胞膜的影响
酵母细胞膜是乙醇毒性作用的主要靶标。乙醇对脂质双层具有扰动作用,破坏膜的结构并抑制膜蛋白的活性[23],导致离子泄漏和电化学梯度的耗散,抑制营养物质在膜上的转运和吸收[24]。选择8%乙醇下M.farinosa NCUF304.1和M.farinosa NCUF 304.1-1的指数生长期中期、稳定期初期、稳定期后期,分别为28、36和44 h,测定酵母的可溶性蛋白含量、总糖含量和电导率[25]以显示膜通透性的变化,研究高体积分数乙醇对酵母细胞膜的损害作用。如图5-a所示,8%乙醇下,M.farinosa NCUF304.1和M.farinosa NCUF 304.1-1胞内泄漏可溶性蛋白质的含量呈现随时间增加而降低,36 h后含量降低。可能是细胞长期受到高体积分数乙醇胁迫,膜破损较为严重,细胞内容物有较大程度的泄漏。相比原始菌株,M.farinosa NCUF 304.1-1的泄漏量明显减少(P<0.05)。总糖含量变化与可溶性蛋白含量变化趋势相似(图5-b)。

a-可溶性蛋白质含量;b-总糖含量;c-电导率
图5 乙醇含量对细胞泄漏可溶性蛋白质含量、总糖含量和电导率的影响
Fig.5 Effect of ethanol concentration on the protein content,total sugar and electric conductivity of cell
注:图中各组中不同的小写字母表示含量具有显著性差异(P<0.05)(下同)
电导率是衡量细胞膜通透性的重要指标,其值越大,细胞膜受害程度越重[20]。巩林林等[26]研究发现,高体积分数乙腈会使酵母菌液电导率值不断增加。图5-c显示,在28 h时,2株菌电导率有显著差异(P<0.05),且都高于无乙醇胁迫组。这一结果也论证8%乙醇使得酵母细胞膜通透性增加。NCUF 304.1-1在适应性进化过程中,可能激发了抵御乙醇损伤的机制,表现出较好的细胞膜完整性,获得了优于出发菌株的乙醇耐受性。
2.5 乙醇胁迫对菌株丙二醛含量的影响
丙二醛(malondialdehyde,MDA)常作为脂质过氧化的指标,反映细胞膜脂过氧化的程度[27]。图6表明,随着乙醇胁迫时间的增加,8%的乙醇体积分数下,出发菌株和进化菌株的MDA的含量呈现先增加后减少的趋势,28~36 h时,细胞受到乙醇引发的氧化胁迫,MDA含量因此增加,显著高于无乙醇胁迫组(P<0.05)。赵素娟[28]研究表明乙醇胁迫下酵母细胞MDA含量几乎为对照的3倍。M.farinosa NCUF 304.1的MDA含量高达10.147 mmol/g,细胞受到较严重的膜氧化损伤。进化菌株M.farinosa NCUF 304.1-1减少了19.5% MDA生成量,表明其细胞受到的氧化伤害减少,自身抗氧化体系的增强,提高了细胞膜的完整性。

图6 乙醇含量对MDA含量的影响
Fig.6 Effect of ethanol concentrations on MDA content
2.6 乙醇胁迫对菌株海藻糖含量的影响
酵母面临高温、乙醇等胁迫时,会引起细胞内海藻糖含量不同程度的上升[11]。海藻糖可保护蛋白质避免其发生变性[29]。28 h时8%体积分数下出发菌株和进化菌株海藻糖积累较少,细胞处于指数生长期,分配给海藻糖合成的能量较低。44 h时8%乙醇下海藻糖积累量下降,可能是由于酵母细胞长时间处于胁迫环境下,细胞死亡量增加,海藻糖含量显著降低(图7)(P<0.05)。值得注意的是,M.farinosa应对高乙醇胁迫环境时,海藻糖含量并没有显著的上升。相类似的是,MO等[17]发现Kluyveromyces marxianus处于高浓度乙醇胁迫环境时,海藻糖代谢基因并没有出现上调(低乙醇浓度胁迫时出现),而固醇生物合成和分泌的途径均被激活,K.marxianus激发了独特的途径抵抗不同乙醇浓度造成的细胞损伤。M.farinosa NCUF 304.1-1海藻糖的积累量低于M.farinosa NCUF304.1,可能原因是M.farinosa NCUF 304.1-1在适应性进化中,诱导了除海藻糖外的其他自身抗氧化体系的增强。然而,具体的途径还有待进一步的研究。

图7 乙醇含量对出发菌株和进化菌株海藻糖含量的影响
Fig.7 Effect of ethanol concentrations on trehalose content of original and evolved strains
2.7 乙醇胁迫对菌株表面结构的影响
如图8-a和8-b所示,无乙醇胁迫时,出发菌株和进化菌株的菌体为椭圆形,细胞表面光滑,菌体饱满。28和36 h时,8%乙醇下2株菌都出现明显的表面凹陷和褶皱,细胞形态出现严重的变形(图8-c、8-d、8-e和8-f)。相比之下,进化菌株NCUF 304.1-1相比出发菌株NCUF304.1菌体损伤较小,受损细胞数的比例降低。8%乙醇胁迫酵母44 h后,出发菌株NCUF304.1变形严重,细胞表面出现明显裂缝,进化菌株NCUF 304.1-1变形程度较轻,细胞表面可观察到的裂缝较少,相比原始菌株具有较好的膜完整性(图8-g,8 h)。
3 结论
本研究结果表明,适应性进化获得的进化菌株M.farinosa NCUF 304.1-1,在8%乙醇体积分数下,相比原始菌株,缩短了4 h的生长延滞期,增加了生物量,其耐受乙醇能力提高至13%乙醇。细胞内物质泄漏减少,细胞膜完整性提高,细胞表面结构破损较少,细胞内丙二醛含量显著降低19.5%,抵抗氧化损伤能力有所增加,但其海藻糖含量的积累量降低。

a-NCUF304.1(0%乙醇);b-NCUF 304.1-1(0%乙醇);c-NCUF304.1(8%乙醇,28 h);d-NCUF 304.1-1(8%乙醇,28 h);e-NCUF304.1(8%乙醇,36 h);f-NCUF 304.1-1(8%乙醇,36 h);g-NCUF304.1(8%乙醇,44 h);h-NCUF 304.1-1(8%乙醇,44 h)
图8 不同乙醇含量下酵母菌株扫描电子电镜观察图(5 000×)
Fig.8 SEM examination of yeast in different ethanol concentrations (5 000×)
适应性进化菌株M.farinosa NCUF 304.1-1的乙醇耐受性显著提高,其细胞膜完整性和抗氧化性及表面结构完整性都优于原始菌株,对于M.farinosa NCUF 304.1-1应用于白酒、果酒酿造,提高其生存性及降低酒体生物胺能力,提高酒品安全质量有重要意义。
[1] MALLET S,WEISS S,JACQUES N,et al.Insights into the life cycle of yeasts from the CTG clade revealed by the analysis of the Millerozyma (Pichia) farinosa species complex[J].PLoS One,2012,7(5):e35842.
[2] CHENG S M,XU Y,LAN X.Isolation,characterization,and application of biogenic amines-degrading strains from fermented food[J].Journal of Food Safety,2020,40(1):e12716.
[3] 杨建刚, 苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
YANG J G,SU C,DOU X,et al.Analysis of yeast succession during the fermentation of Luzhou-flavor liquor and its effect on the formation of selected flavor components[J].Food Science,2018,39(18):166-172.
[4] WEI Q Z,WANG H B,CHEN Z X,et al.Profiling of dynamic changes in the microbial community during the soy sauce fermentation process[J].Applied Microbiology and Biotechnology,2013,97(20):9 111-9 119.
[5] 魏雯丽, 宫尾茂雄,吴正云,等.基于宏转录组学技术解析工业豇豆泡菜发酵过程中活性微生物群落结构变化[J].食品与发酵工业,2020,46(10):65-70.
WEI W L,MIYAO S,WU Z Y,et al.Analysis of active microbial community structure changes in industrial cowpea pickle fermentation based on meta-transcriptomics technology[J].Food and Fermentation Industries,2020,46(10):60-65.
[6] THANH V N,DUC HIEN D,YAGUCHI T,et al.Moniliella sojae sp nov.a species of black yeasts isolated from Vietnamese soy paste (tuong),and reassignment of Moniliella suaveolens strains to Moniliella pyrgileucina sp.nov.Moniliella casei sp.Nov.and Moniliella macrospora emend.comb.nov[J].International Journal of Systematic and Evolutionary Microbiology,2018,68(5):1 806-1 814.
[7] 李莉莉, 叶美莉,叶燕锐,等.酿酒酵母乙醇发酵性能与胁迫耐性的相关性[J].华南理工大学学报,2011,39(9):134-139.
LI L L,YE M L,YE Y R,et al.Correlation between stress tolerance and fermentation behavior of Saccharomyces cerevisiae[J].Journal of South China University of Technology,2011,39(9):134-139.
[8] GIBSON B R,LAWRENCE S J,LECLAIRE J P R,et al.Yeast responses to stresses associated with industrial brewery handling[J].FEMS Microbiology Reviews,2007,31(5):535-569.
[9] 姜维. 一株耐盐性高效生物胺降解新菌的筛选,分类鉴定及应用研究[D].青岛:中国海洋大学,2014.
JIANG W.Study on the screening,taxonomic analysis and application of one novel,salt-tolerant and high efficient biogenic amines degrading bacterium[D].Qingdao:Ocean University of China,2014.
[10] PRATT P L,BRYCE J H,STEWART G G.The effects of osmotic pressure and ethanol on yeast viability and morphology[J].Journal of the Institute of Brewing,2003,109(3):218-228.
[11] MA M G,LIU Z L.Mechanisms of ethanol tolerance in Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology,2010,87(3):829-845.
[12] SAUER U.Evolutionary engineering of industrially important microbial phenotypes[J].Advanced in Biochemical Engineering Biotechnology.2001,73:129-169.
[13] LAM F H,GHADERI A,FINK G R,et al.Engineering alcohol tolerance in yeast[J].Science,2014,346(6 205):71-75.
[14] LI Y C,DU W,MENG F B,et al.Tartary buckwheat protein hydrolysates enhance the salt tolerance of the soy sauce fermentation yeast Zygosaccharomyces rouxii[J].Food Chemistry,2021,342:128382.
[15] 李建, 孔婧,李圣龙,等.适应性实验室进化技术在微生物育种中的应用进展[J].生物工程学报,2021,37(1):130-141.
LI J,KONG J,LI S L,et al.Advances in adaptive laboratory evolutionary engineering to microbial breeding[J].Journal of Biological Engineering,2021,37(1):130-141.
[16] TOM S-PEJ
S-PEJ E,OLSSON L.Influence of the propagation strategy for obtaining robust Saccharomyces cerevisiae cells that efficiently co-ferment xylose and glucose in lignocellulosic hydrolysates[J].Microbial Biotechnology,2015,8(6):999-1 005.
E,OLSSON L.Influence of the propagation strategy for obtaining robust Saccharomyces cerevisiae cells that efficiently co-ferment xylose and glucose in lignocellulosic hydrolysates[J].Microbial Biotechnology,2015,8(6):999-1 005.
[17] MO W J,WANG M Z,ZHAN R R,et al.Kluyveromyces marxianus developing ethanol tolerance during adaptive evolution with significant improvements of multiple pathways[J].Biotechnology for Biofuels,2019,12:63.
[18] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[19] 李艳玲, 张显忠,苗苗,等.蒽酮-硫酸法测定海藻糖含量显色条件的改进[J].食品工业科技,2009,30(2):296-298.
LI Y L,ZHANG X Z,MIAO M,et al.Improvement of chromogenic conditions on trehalose determination by anthrone-sulphuric acid method[J].Science and Technology of Food Industry,2009,30(2):296-298.
[20] 李冲伟, 宋永,李燕利,等.野生葡萄酒酵母的选育及其发酵过程中电导率的研究[J].食品工业科技,2008,29(9):138-139.
LI C W,SONG Y,LI Y L,et al.Study on the breeding of wild wine yeast and its conductivity during fermentation[J].Science and Technology of Food Industry,2008,29(9):138-139.
[21] 王成, 战吉宬,刘兴艳,等.外源褪黑素对酿酒酵母发酵及抗氧化体系的影响[J].现代食品科技,2015,31(4):102-108.
WANG C,ZHAN J C,LIU X Y,et al.Effect of exogenous melatonin on ethanol fermentation and antioxidant activity of Saccharomyces cerevisiae[J].Modern Food Science and Technology,2015,31(4):102-108.
[22] 丁坤峰. 镉对酿酒酵母及植物的损伤机制研究[D].郑州:河南工业大学,2011.
DING K F.The mechanism of cadmium damage in Saccharomyces cerevisiae and plant[D].Zhengzhou:Henan University of Technology,2011.
[23] HENDERSON C M,BLOCK D E.Examining the role of membrane lipid composition in determining the ethanol tolerance of Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2014,80(10):2 966-2 972.
[24] CASEY G P,INGLEDEW W M M.Ethanol tolerance in yeasts[J].CRC Critical Reviews in Microbiology,1986,13(3):219-280.
[25] DIAO W R,HU Q P,ZHANG H,et al.Chemical composition,antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J].Food Control,2014,35(1):109-116.
[26] 巩林林, 杨波,杨光,等.有机溶剂乙腈对酵母菌细胞膜透性的影响[J].工业微生物,2019,49(6):44-49.
GONG L L,YANG B,YANG G,et al.Effects of organic solvent acetonitrile on cell membrane permeability of yeast[J].Industrial Microbiology,2019,49(6):44-49.
[27] 郑荣梁, 黄中洋.自由基生物学[M].3版.北京:高等教育出版社,2007.
LIU R L,HUANG Z Y.Free Radical Biology[M].Beijing:Higher Education Press,2007.
[28] 赵素娟. 活性氧在酿酒酵母乙醇胁迫中的作用[D].郑州:河南工业大学,2012.
ZHAO S J.The role of ROS in ethanol stress of Saccharomyces cerevisiae[D].Zhengzhou:Henan University of Technology,2012.
[29] JUNG Y J,PARK H D.Antisense-mediated inhibition of acid trehalase (ATH1) gene expression promotes ethanol fermentation and tolerance in Saccharomyces cerevisiae[J].Biotechnology Letters,2005,27(23-24):1 855-1 859.