中国是肉类生产及消费大国,随着经济的发展,肉制品的生产与消费呈持续增长态势。冻藏是肉类食品原料及产品最常用和有效的保藏方式,但在实际生产、贮藏、运输和销售的过程中,由于冷链系统的不完善甚至缺失,肉及肉制品反复经历冻融,导致品质劣变。肉糜作为肉丸、肉馅、肉肠等众多肉制品的主要原料,占比在50%以上,年需求量约530万t,且逐年增加,但肉糜制品在冻藏过程的反复冻融易导致其品质下降[1-4]。
肉类在冻藏及反复冻融过程中可发生大量的理化反应,如脂肪氧化生成丙二醛等小分子醛类物质,蛋白发生氧化导致羰基增加和巯基减少等[5-7],从而引起肉制品风味、色泽和质构等品质的劣化[8-9]。余小领等[10]研究常规冷冻冻藏对猪肉保水性影响时发现,随着冻藏时间的增加,猪肉保水性下降;LIU等[11]研究氧化对猪背最长肌性质的影响时发现,随着氧化的加深,肌肉的持水性下降;MIGNINO等[12]发现使用冷冻肉制作的肉制品,其凝胶性能降低。这些性质的下降都与肌原纤维蛋白有关,肌原纤维蛋白质不仅是肉制品中重要的营养组分,还决定着肉制品的理化性质。肌原纤维蛋白约占猪肉总蛋白质的50%~60%,是一种重要的盐溶性蛋白质。冻融过程中的氧化和冷冻变性会使肌原纤维蛋白结构发生变化[13]。ZHANG等[14]研究发现,随着冻融次数的增加,未加盐猪肉糜的肌原纤维蛋白Ca2+-ATP酶活性下降,导致其持水性下降,表面疏水性增加;ARSLAN[15]研究发现,冻藏使肌肉蛋白乳化能力和乳化稳定性下降;XIA等[16]研究冻融后的猪背最长肌发现,肌原纤维蛋白变性和聚集使其凝胶性质下降。肌红蛋白赋予了肉制品诱人的色泽,但随着氧化的加深,肉色会呈现令消费者难以接受的深褐色。同时,脂肪的氧化也会对肉制品的色泽产生一定的影响[17]。肌原纤维蛋白在NaCl 浓度>0.5 mol/L时可以充分溶解[18-19],工业上制作一些肉糜时会加入盐和冰水并且经过斩拌,此时肌原纤维蛋白已经充分溶出,由此形成的体系即为肌原纤维蛋白溶出的肉糜体系。然而,目前研究大多针对原料肉或加盐未经斩拌的肉馅等,此时的肌原纤维蛋白仍被包裹在肌束膜中,并没有溶出,很少有研究报道肌原纤维蛋白在加工过程中已经溶出的肉糜体系。
本文通过考察不同冻融次数对肉糜肌原纤维蛋白变性的影响,以及肌红蛋白的含量与不同价态肌红蛋白的比例变化情况,分析不同冻融次数肉馅蒸煮后的感官品质,旨在研究蛋白质变性对肉糜体系质构等感官品质的影响,为工业生产此类冷冻肉馅原料的品质保持和提升提供依据。
1 材料与方法
1.1 材料与仪器
猪背最长肌肉(壹号土猪,11个月,公猪,屠宰后24 h内),无锡华润万家超市;L-亮氨酸标品,美国SIGMA公司;其余试剂均为分析纯。
CK22绞肉机,意大利La Minerva公司;CM-14斩拌机,西班牙MAINCA公司;VF620真空灌肠机,德国汉德曼公司;AL-104精密电子天平,梅特勒-托利多有限公司;Sigma3K 15离心机,德国SIGMA公司;IKA T18 digital均浆机,德国IKA公司;Spectra Max 190全波长酶标仪,美国Molecular Devices公司;MesoMR23-060V-I低场核磁共振仪,中国纽迈公司;UltraScan Pro1166高精度分光测色仪,美国Hunterlab公司;Q2000 差示扫描量热仪,美国TA仪器公司;SCC61型万能蒸烤箱,德国RATIONAL公司;TA.XT plus质构仪,英国Stable Micro Systems公司。
1.2 实验方法
1.2.1 肉糜样品的制备
取新鲜猪背最长肌,去除可见肥肉和结缔组织,加入盐、水等,经过斩拌制作成肌原纤维蛋白充分溶出的肉馅[18-19]。将制作好的肉馅用灌肠机灌入直径6 cm的PE膜肠衣中,每根500 g。处理好的预调理肉馅放入-18 ℃冰箱冷冻36 h,4 ℃解冻12 h,此为1次冻融。以此类推,将肉馅冻融0~7次。肉馅的配方及工艺由厦门银祥集团有限公司肉食品安全生产技术国家重点实验室提供。
基本配方:以猪背最长肌肉1 000 g计,纯碱6.5 g,小苏打10 g,食盐30 g,味精10 g,生抽20 g,鸡精10 g,冰水550 g。
整个工艺控制肉的温度在4~6 ℃。工艺流程:
原料肉处理(猪背最长肌剔除可见脂肪和结缔组织,切成2 cm×2 cm×2 cm方块)→绞肉机绞碎(8 mm孔板)→加入盐和20%冰水中速1 500 r/min斩拌20 s→加入纯碱和小苏打,20%冰水中速1 500 r/min斩拌20 s→加入剩下调味料和冰水高速3 500 r/min斩拌2 min→灌肠→冷藏
1.2.2 肉糜的解冻与蒸煮损失
肉糜在解冻前和解冻后质量分别为m0、m1,按公式(1)计算解冻损失率:
解冻损失率![]()
(1)
将上述经过不同冻融次数的肉糜用不锈钢圆柱型模具(d=2.72 cm,h=0.84 cm)制成圆柱体后称其质量(m3),放入万能蒸烤箱中,采用蒸煮模式,85 ℃蒸煮20 min后用滤纸擦干表面的水分后称其质量为m2)。蒸煮损失率按公式(2)计算[10]:
蒸煮损失率![]()
(2)
1.2.3 肉糜蛋白溶解度的测定
参照贡汉坤等[20]的方法,测量蛋白浓度。取0.5 g上述经过不同冻融次数的肉糜样品,加入20 mL 0.05 mol/L的磷酸盐缓冲液(含0.5 mol/L NaCl,pH 7.2),匀浆60 s后离心(10 000×g,10 min)。取上清液测量蛋白浓度,使用双缩脲法。
1.2.4 肉糜低场核磁共振分析
称取15 g肉糜样品用保鲜膜包住放入核磁管中,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲程序进行扫描,设置参数为采样间隔时间TW=4 500 ms,回波个数Echo Count=3 000,累加次数NS=8。
1.2.5 肉糜肌原纤维蛋白的提取
肌原纤维蛋白的提取参照PARK等[21]的方法并稍作修改,将经过不同冻融次数的猪肉糜样品置于5倍体积的僵直液[0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),10 mmol/L K2HPO4,pH 7.0]中均质1 min,然后4 ℃ 2 000×g 离心10 min,弃去上清液,此过程重复3次。向离心后的沉淀加入4倍体积0.1 mol/L NaCl均质30 s,离心(4 ℃,2 000×g,10 min),重复3次。最后一次匀浆液调节pH 6.25,用4层纱布过滤后离心(4 ℃,2 000×g,10 min),弃去上清液,所得沉淀即是肌原纤维蛋白。以上所有操作均在4 ℃下完成。提取后的蛋白膏置于冰盒中保存,48 h内用完,蛋白的浓度采用双缩脲法测定。
1.2.6 肌原纤维蛋白羰基值的测定
羰基值的测定参考LEVINE等[22]的方法并稍有改变,用2,4-二硝基苯肼(2,4-dinitrophenyl hydrazine,DNPH)衍生后比色测定。取上述所提取的蛋白,用缓冲液稀释至20 mg/mL,取200 μL与2 mL 10 mmol/L DNPH混匀,室温下避光反应1 h,每隔10 min涡旋振荡1次。加入2 mL质量分数20% TCA中止反应,10 000×g离心5 min,沉淀用4 mL V(乙醇)∶V(乙酸乙酯)=1∶1溶液洗涤,重复3次后沉淀用N2吹干,加入1.5 mL 6 mol/mL的盐酸胍(溶解在20 mmol/L KH2PO4),37 ℃反应30 min后离心(10 000×g,10 min)。上清液在370和280 nm处比色。羰基的含量(nmol/mg)按公式(3)计算:
羰基值![]()
(3)
1.2.7 肌原纤维蛋白自由氨基值的测定
自由氨基值采用李春强[23]的方法并稍加改动,将上述肌原纤维蛋白溶液用磷酸盐缓冲液稀释至4 mg/mL,取200 μL溶解在0.2 mol/L 的磷酸盐缓冲液[含质量分数1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),pH 8.2]中,加入1 mL质量分数0.01%三硝基苯磺酸(3-nitrobenzenesulfonic acid,TNBS)于37 ℃避光60 min。用2.0 mL 0.1 mol/L Na2SO3终止反应,室温放置15 min冷却后在420 nm处测吸光值。自由氨基的含量根据L-亮氨酸做标准曲线确定。
1.2.8 肌原纤维蛋白巯基和二硫键的测定
巯基值测定采用LIU等[24]的方法,用pH 6.25,25 mmol/L的磷酸盐缓冲液,其中含0.6 mol/L的NaCl,将肌原纤维蛋白样品稀释到约2 mg/mL,取0.5 mL上述稀释后的肌原纤维蛋白样品加入棕色的离心管中,空白样品用缓冲液代替。加入2 mL pH 7.4 0.1 mol/L磷酸盐缓冲液,其中含有8 mol/L尿素,3% SDS,混合均匀。加入0.5 mL 10 mmol/L的5,5′-二硫代双(2-硝基苯甲酸) (5,5-dithiobis-2-nitrobenzoic acid,DTNB),室温下反应15 min,在412 nm处比色,摩尔消光系数为13 600 L/(mol·cm)。巯基的含量(nmol/mg)按照公式(4)计算:
(4)
二硫键的测定采用THANNHAUSER等[25]的方法,用pH 6.0,25 mmol/L的磷酸盐缓冲液(含0.6 mol/L的NaCl)将肌原纤维蛋白稀释到约5 mg/mL,取0.1 mL上述稀释后的肌原纤维蛋白溶液,加入1.5 mL现配的disodium 2-nitro-5-thiosulfobenzoate(NTSB)溶液,室温下反应25 min后于412 nm处比色,空白组加入0.1 mL的磷酸盐缓冲液。二硫键含量(nmol/g)按照公式(5)计算:
(5)
1.2.9 DSC测定
肌原纤维的热变性温度用差示扫描量热仪(differential scanning calorimetry,DSC)测量,在专用的坩埚中称取肉糜约15 mg,以空坩埚作为参照进行测量。在25 ℃下平衡1 min,升温速率5 ℃/min,从25 ℃扫描到95 ℃。使用Universal Analysis 2000软件计算样品的变性温度和焓变值。
1.2.10 肌红蛋白含量的变化
参考陈骋[26]的方法,解冻后取2.0 g样品加入20 mL的缓冲液,10 000 r/min匀浆30 s,然后4 ℃、5 000×g离心15 min,上清液用滤纸过滤后在576 nm处测量吸光值,摩尔消光系数为12.8 L/(mmol·cm)。
1.2.11 氧合肌红蛋白、高铁肌红蛋白含量测定
参考KIM等[27]的方法。称取解冻后样品5.0 g,加入25 mL 磷酸缓冲液(40 mmol/L,pH 6.8,4 ℃),1 000 r/min 匀浆25 s 后冰浴静置1 h,然后离心(3 000×g,25 min,4 ℃),上清液经滤纸过滤后于450~650 nm进行扫描,分析肌红蛋白吸收光谱的变化,同时记录525、545、565、572 nm波长下的吸光值,按照 KRZYWICKI[28]的方法计算氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白(metmyoglobin,MMb)的相对含量,分别按公式(6)(7)计算:
OMb/%=(0.882R1-1.267R2+0.809R3-0.361)×100
(6)
MMb/%=(-2.514R1+0.777R2+0.800R3+1.098)×100
(7)
式中:R1、R2、R3分别为 572、565、545与 525 nm 吸光值的比值。
1.2.12 颜色的测定
使用高精度分光测色仪(光源D65,视角10°)观察冻融不同次数的肉糜的颜色(亮度值L*,红度值a*和黄度值b*),使用反射模式,测试前使用标准的白板和黑板对仪器进行校准。对于每块样品随机选取5个位置进行测量,然后取平均值。
1.2.13 肉糜全质构测定
肉糜制品85 ℃蒸煮20 min,然后用模具切成直径为2.72 cm,高为0.84 cm的圆柱体。使用质构仪应用质构剖面分析法对其硬度、弹性、内聚性和咀嚼性进行分析。使用P/36R型探头,设置测前速度为3.0 mm/s,测试速度为5.0 mm/s,测试后速度为5.0 mm/s,压缩比为60%,触发类型自动,触发力10 g。
1.2.14 肉馅的感官评价
取30 g冻融不同次数的肉馅样品,解冻后放入烤箱中,100 ℃蒸20 min。将样品打乱随机编号,放入相同的容器中进行感官评价。感官评价小组由15名食品专业的研究生组成,分别从肉馅的色泽、气味、口感、硬度、弹性和内部结构6个方面进行评价,感官最高得分为10分,最低为1分。感官评价标准如表1所示。
表1 肉馅感官评价标准
Table 1 Criteria for sensory evaluation of minced meat

指标感官特性及评分色泽淡红色,有光泽9~10;白色有轻微淡红色,微有光泽7~9;苍白色,无光泽4~7;黄褐色1~4气味有肉馅固有的香气,浓郁,无其他异味9~10;肉馅固有香气明显,无酸败味及其他异味7~9;肉馅固有香气平淡,稍有酸败味及其他异味4~7;有严重的酸败味及其他异味1~4口感鲜嫩多汁9~10;较多汁7~9;汁液较少4~6;口感干柴1~4硬度硬度适中,软脆适宜9~10;较硬或较软7~9;硬,劲嚼或软烂4~7;很硬,难嚼或稀稠1~4弹性脆弹可口9~10;有一定的弹性7~9;松酥,基本无弹性4~7;糊状,无弹性1~4内部结构断向细腻,气泡细小且分布均匀9~10;断向略粗糙,气泡大小不一,分布较均匀7~9;结构疏松4~7;结构松散1~4
1.3 数据处理
除感官评价外,所有实验均重复3次,结果用平均值±标准偏差表示,感官评价由15名感官评价员打分的平均值表示。平均值和方差使用Microsoft Excel计算,显著性分析使用Statistix 9.0中的Linear Models进行分析,采用LSD全配对多重比较方法进行差异显著性分析(P<0.05,差异显著)。使用IBM SPSS Statistics 22进行相关性分析(*表示P<0.05水平上相关,**表示P<0.01水平上相关),SIMCA+13.0软件用于主成分分析,使用Origin 8.5软件作图。
2 结果与分析
2.1 冻融对猪肉糜水分和蛋白溶解度的影响
如表2所示,肉糜解冻后并未出现汁液流失和质量减轻,低场核磁共振分析显示,解冻后的猪肉糜中的水分有2种分布形态,分别是T2b=1~10 ms,反映与大分子紧密结合的水,T21=10~100 ms,反映被束缚在蛋白结构内部的水。随着冻融次数的增加,结合水的出峰时间显著减小,比例显著下降(P<0.05),不易移动水的出峰时间和比例均未发生显著的变化(P>0.05),并未发现自由水,可能是因为肉糜斩拌的过程中肌原纤维蛋白溶出,形成蛋白网状结构,肉糜中的水分被束缚在其间隙之中,这与解冻过程中未出现解冻损失的结果一致。猪肉糜的蒸煮损失率随着冻融次数的增加显著上升(P<0.05),未经过冻融的猪肉糜的蒸煮损失最小为6.67%,而经过1次冻融后蒸煮损失上升至7.19%。经过7次冻融后,猪肉糜的蒸煮损失比未冻融时上升了30.28%。蒸煮损失和猪肉糜加热过程中形成的蛋白凝胶有着密切的关系,凝胶结构越紧密,保留的水分越多。未经冻融猪肉糜中的肌原纤维蛋白保持天然的构象,在加热的过程中,可以更好地形成蛋白间的聚集物,从而形成均一致密的凝胶网络结构,更好地保留猪肉糜中的水分。经冻融后的猪肉糜,由于蛋白存在冷冻和氧化变性,蛋白质结构打开,或形成不溶的蛋白质聚集体,导致凝胶结构无序粗糙,持水能力下降。同时,冻融过程中脂肪氧化产生丙二醛,与肌原纤维蛋白相互作用形成复合物,使蛋白变性,降低蛋白的溶解性[29-30],从而使加热后蛋白持水能力下降。
表2 不同冻融次数猪肉糜水分和蛋白溶解度的变化
Table 2 Changes of moisture and protein solubility of minced pork with different freeze-thaw cycles
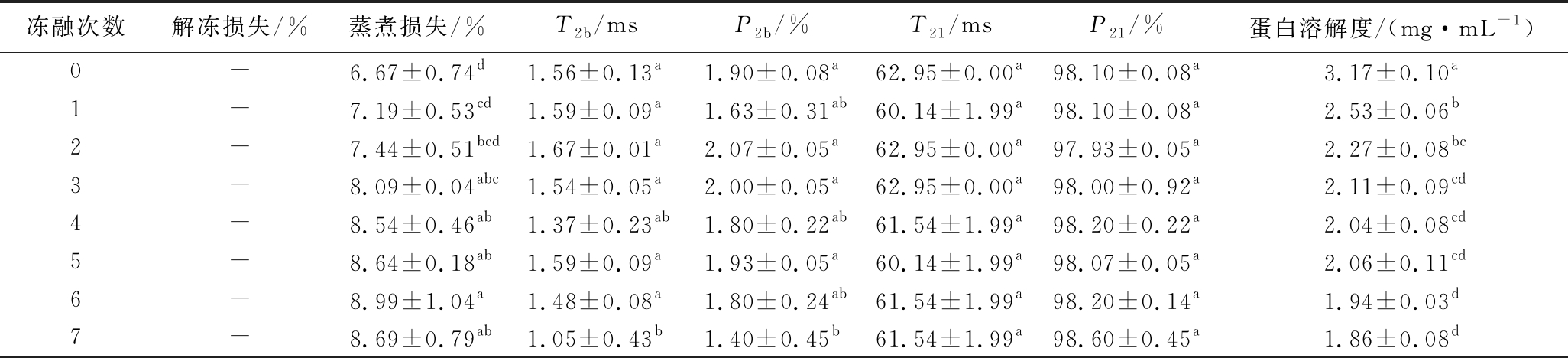
冻融次数解冻损失/%蒸煮损失/%T2b/msP2b/%T21/msP21/%蛋白溶解度/(mg·mL-1)0-6.67±0.74d1.56±0.13a1.90±0.08a62.95±0.00a98.10±0.08a3.17±0.10a1-7.19±0.53cd1.59±0.09a1.63±0.31ab60.14±1.99a98.10±0.08a2.53±0.06b2-7.44±0.51bcd1.67±0.01a2.07±0.05a62.95±0.00a97.93±0.05a2.27±0.08bc3-8.09±0.04abc1.54±0.05a2.00±0.05a62.95±0.00a98.00±0.92a2.11±0.09cd4-8.54±0.46ab1.37±0.23ab1.80±0.22ab61.54±1.99a98.20±0.22a2.04±0.08cd5-8.64±0.18ab1.59±0.09a1.93±0.05a60.14±1.99a98.07±0.05a2.06±0.11cd6-8.99±1.04a1.48±0.08a1.80±0.24ab61.54±1.99a98.20±0.14a1.94±0.03d7-8.69±0.79ab1.05±0.43b1.40±0.45b61.54±1.99a98.60±0.45a1.86±0.08d
注:同列不同字母表示差异显著(P<0.05);“-”表示未检测出相应数值;T2b、P2b表示结合水的出峰时间与峰面积比;T21、P21表示不易流动水的出峰时间和峰面积比
如表2所示,与未冻融组相比,在冻融1次之后肉糜蛋白的溶解度下降了20.19%(P<0.05),随着冻融次数的增加,肉糜蛋白的溶解度仍然持续地降低,在冻融7次的时候降至最低(1.86 mg/mL)。这可能是因为在第1次冻融的时候,由于肌原纤维蛋白溶出,蛋白质发生了冷冻变性,分子结构发生改变,使包埋在蛋白质分子内部的疏水基团暴露,蛋白质的溶解度发生显著地下降。随着冻融次数地增加,蛋白质分子进一步发生冷冻变性,同时发生氧化变性,蛋白质分子间氢键和表面电荷发生改变,氧化生成聚集物,溶解度进一步下降。
2.2 冻融对肌原纤维蛋白羰基值的影响
羰基是蛋白质氧化的标志性产物。如图1所示,随着冻融次数的增加,羰基值呈现逐渐增加的趋势,从未冻融的羰基含量2.51 nmol/mg 蛋白上升至5.14 nmol/mg 蛋白,说明冻融的过程中氧化持续存在。未冻藏样品的羰基值略高于其他研究中未经斩拌的肉制品[21-23],这可能是因为在斩拌的过程中大量氧气混入肉糜体系,加速了肌原纤维蛋白的氧化。冻融1次和2次时,羰基值缓慢地上升,但不显著(P>0.05);冻融3~5次时,肌原纤维蛋白羰基值显著地上升(P<0.05);冻融5~7次肌原纤维蛋白羰基值变化不显著(P>0.05)。研究表明,新生成的羰基会与蛋白质中的亲核物质,如ε-氨基,发生反应,使得后期羰基含量变化不显著[31]。
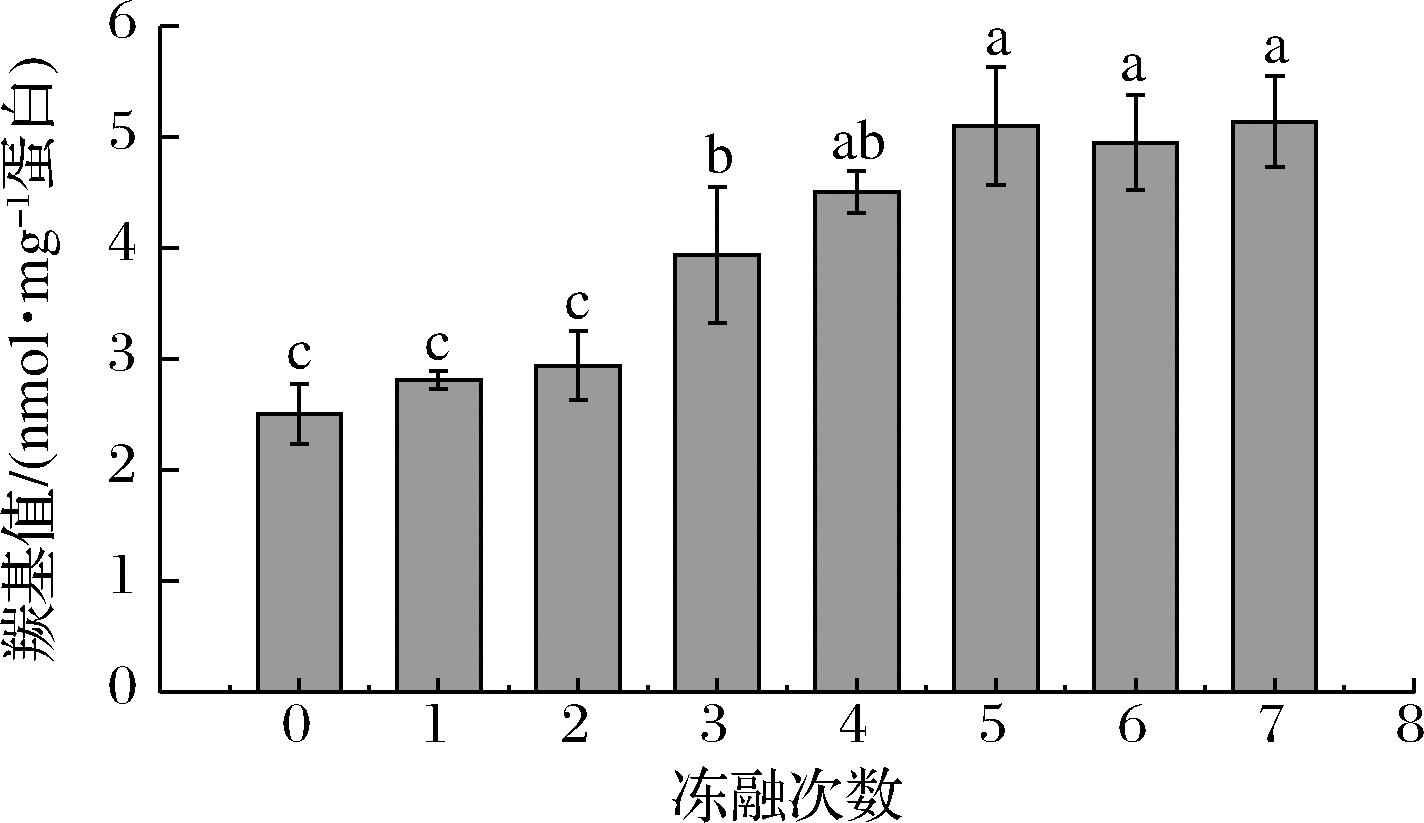
图1 不同冻融次数猪肉糜蛋白羰基含量的变化
Fig.1 Changes in carbonyl content of minced pork protein with different freeze-thaw cycles
注:组间不同字母表示差异显著(P<0.05)(下同)
2.3 冻融对肌原纤维蛋白自由氨基值的影响
图2反映了不同冻融次数肉糜肌原纤维蛋白自由氨基含量的变化。未冻融前自由氨基的含量最低为42.82 nmol/mg 蛋白,在冻融1次和2次的时候显著地升高(P<0.05),最高升至55.29 nmol/mg 蛋白,在冻融5~7次的时候,自由氨基的含量变化不显著(P>0.05)。这说明冻融前期肌原纤维蛋白结构展开,更多的自由氨基暴露。随着冻融次数的增加,氧化的加深使得蛋白聚集自由氨基含量减少,同时生成的羰基也可以和自由氨基反应,使其减少[27]。
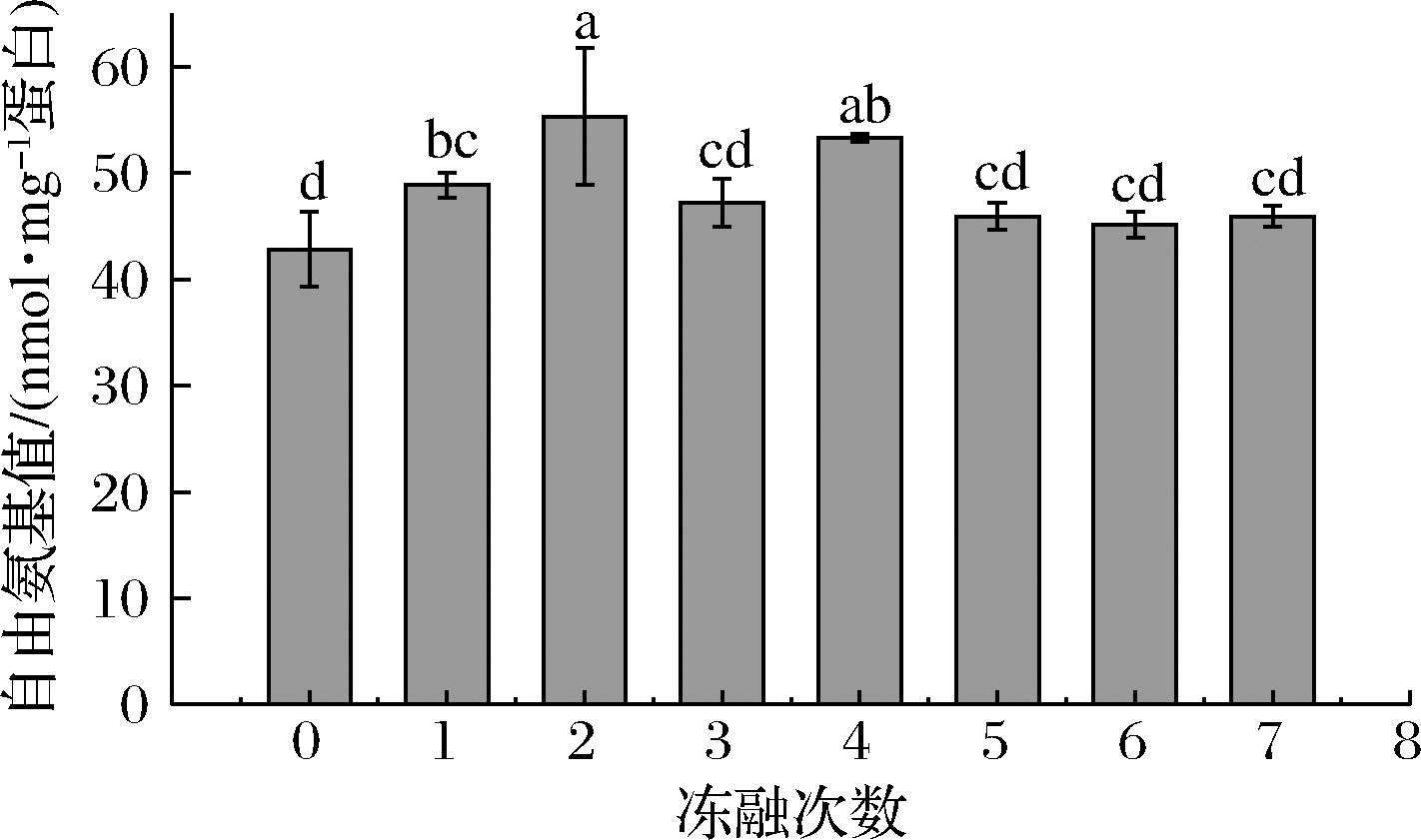
图2 不同冻融次数猪肉馅自由氨基含量的变化
Fig.2 Changes of free amino content of minced pork protein with different freeze-thaw cycles
2.4 冻融对肌原纤维蛋白巯基和二硫键的影响
肌原纤维蛋白中含有大量的巯基,如图3所示,随着冻融次数的增加巯基含量显著减小(P<0.05)。未经过冻融的肌原纤维蛋白巯基含量为104.85 μmol/g 蛋白,第7次冻融后含量下降至62.55 μmol/mg 蛋白,下降了40.34%。二硫键的含量从1.42 μmol/g 上升至9.03 μmol/g。说明冻融的过程中肉糜肌原纤维蛋白巯基被氧化生成分子内和分子间的二硫键,这也是肌原纤维蛋白氧化聚集的主要途径[32]。
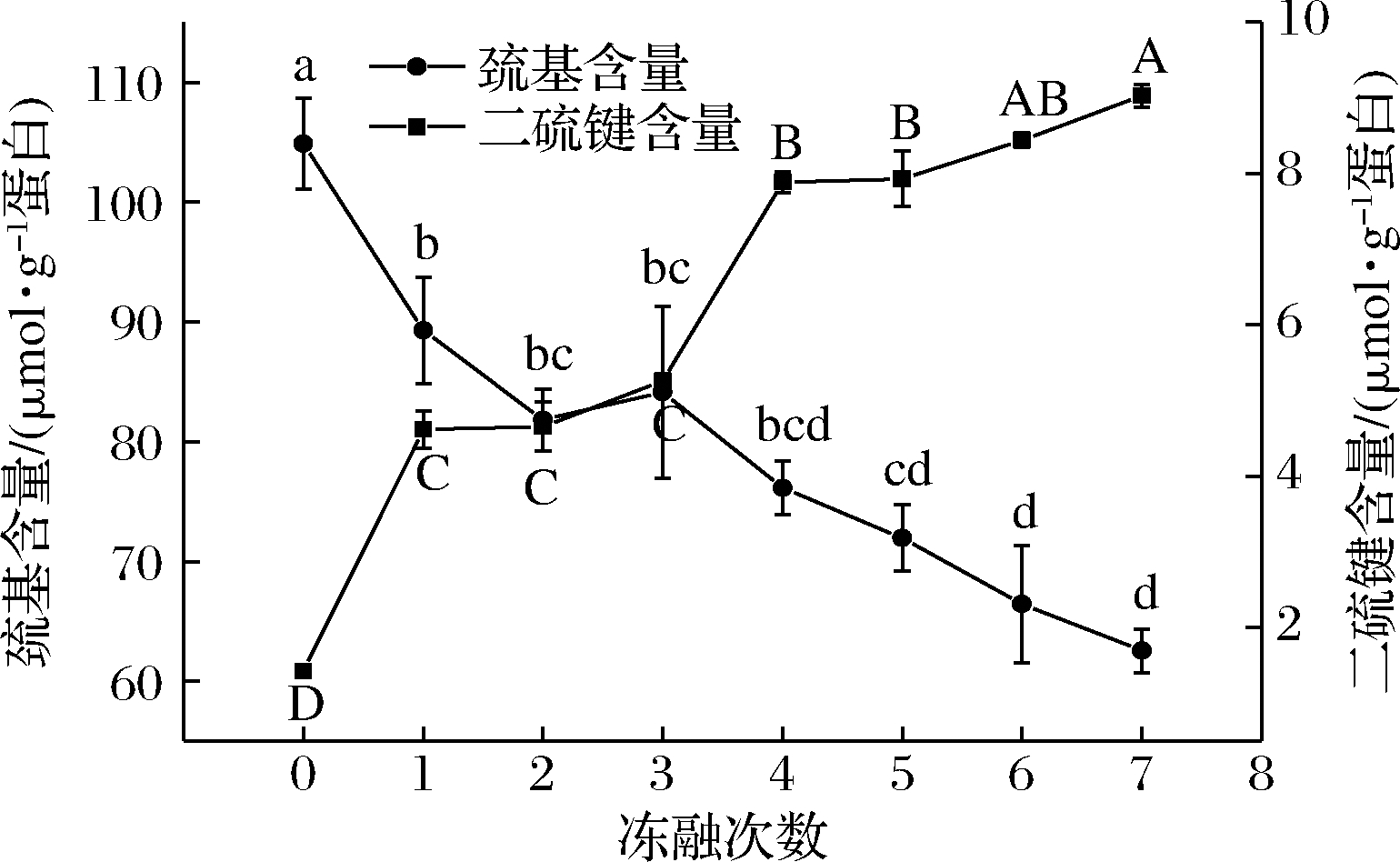
图3 不同冻融次数猪肉糜蛋白巯基和二硫键含量的变化
Fig.3 Changes of sulfhydryl and disulfide bond content of minced pork protein with different freeze-thaw cycles
XU等[33]研究鲢鱼肌动球蛋白凝胶形成的过程,猜测二硫键的增加可能是因为巯基基团的氧化,但本文中巯基的下降速率远高于二硫键的生成速率,说明肌原纤维蛋白氧化的过程中除了生成二硫键以外,还生成了其他的含硫衍生物。由于肌原纤维蛋白加热过程中巯基可生成二硫键,促使肌原纤维蛋白凝胶的形成[34]。冻融的过程中由于氧化聚集,巯基含量减少,二硫键含量增加,使得肌原纤维蛋白凝胶强度变弱,肉糜制品的弹性、脆度下降,感官品质下降。
2.5 冻融对蛋白热变性的影响
由表3可知,猪肉糜有2个吸热峰,分别在59.02~59.48 ℃和71.37~72.00 ℃,随着冻融次数的增加,肉糜吸热峰的位置并没有发生显著的偏移(P>0.05)。猪肉糜的总焓变随着冻融次数的增加呈现逐渐下降的趋势(P<0.05),未冻融组的总焓变为0.38 J/g,经过7次冻融之后的总焓变为0.25 J/g,下降了34.21%。ZHANG等[35]发现新鲜的猪肉样品有3个明显的吸热峰,分别在53、64和77 ℃,且总焓变随着冷冻解冻减小。这3个吸热峰分别对应肌球蛋白重链、肌球蛋白和肌动蛋白的变性温度,而本文中测得的猪肉糜样品只有2个吸热峰,且吸热峰的温度降低。这可能是因为斩拌肉糜的过程中NaCl的加入使得猪肉中肌原纤维蛋白溶出,热稳定性降低。
表3 不同冻融次数对猪肉糜蛋白变性温度和总焓变的影响
Table 3 Effect of denaturation temperature and total enthalpy change of minced pork proteins in different freeze-thaw cycles
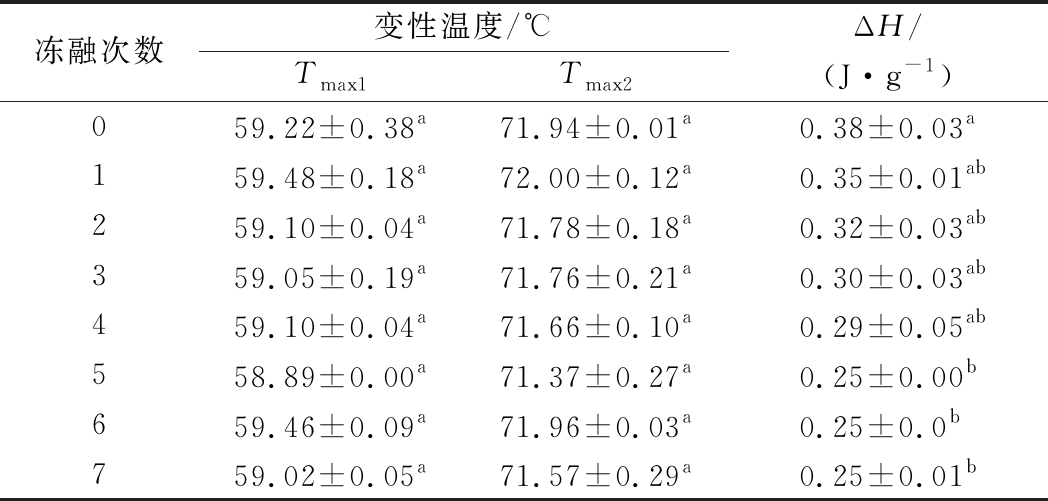
冻融次数变性温度/℃Tmax1Tmax2ΔH/(J·g-1)059.22±0.38a71.94±0.01a0.38±0.03a159.48±0.18a72.00±0.12a0.35±0.01ab259.10±0.04a71.78±0.18a0.32±0.03ab359.05±0.19a71.76±0.21a0.30±0.03ab459.10±0.04a71.66±0.10a0.29±0.05ab558.89±0.00a71.37±0.27a0.25±0.00b659.46±0.09a71.96±0.03a0.25±0.0b759.02±0.05a71.57±0.29a0.25±0.01b
注:同一指标同列字母不同表示差异显著(P<0.05)(下同)
因为盐离子与肌原纤维蛋白发生相互作用,导致蛋白链伸展或者去折叠结构等空间结构发生变化,使蛋白质之间相互作用减弱,蛋白质的变性温度减小[36]。由于Na+和Cl-通过水合作用形成水分子层,减弱蛋白质与水之间的相互作用,导致蛋白质亲水性降低,从而使得蛋白质变性温度减小。孟祥忍等[37]研究发现,随着食盐添加量的增加,鸡肉糜变性温度逐渐降低,这也与本文的研究结果一致。
2.6 冻融对肌红蛋白含量变化的影响
血红蛋白、肌红蛋白和细胞色素赋予肌肉诱人的红色,在动物被宰杀放血后,大量的血红蛋白流失,此时肌红蛋白是肉及肉制品呈现红色的主要原因。图4是冻融过程中肌红蛋白含量的变化,未经过冻融的肉糜肌红蛋白的含量最高为59.38 μmol/g,在1次冻融之后即显著下降(P<0.05)至53.01 μmol/g,随后逐渐降低,第7次冻融后含量下降至46.92 μmol/g。由此可知,第1次解冻后肉糜中的肌红蛋白便出现了氧化,使其含量减少。随着冻融次数的增加,肉糜的氧化加剧。脂肪氧化过程中产生的自由基也会攻击肌红蛋白血红素辅基,生成Fe3+,同时自由基会影响高铁肌红蛋白还原酶活力,使生成的Fe3+不能及时还原,肉色劣化,肉糜的肌红蛋白含量呈现逐渐降低的趋势。
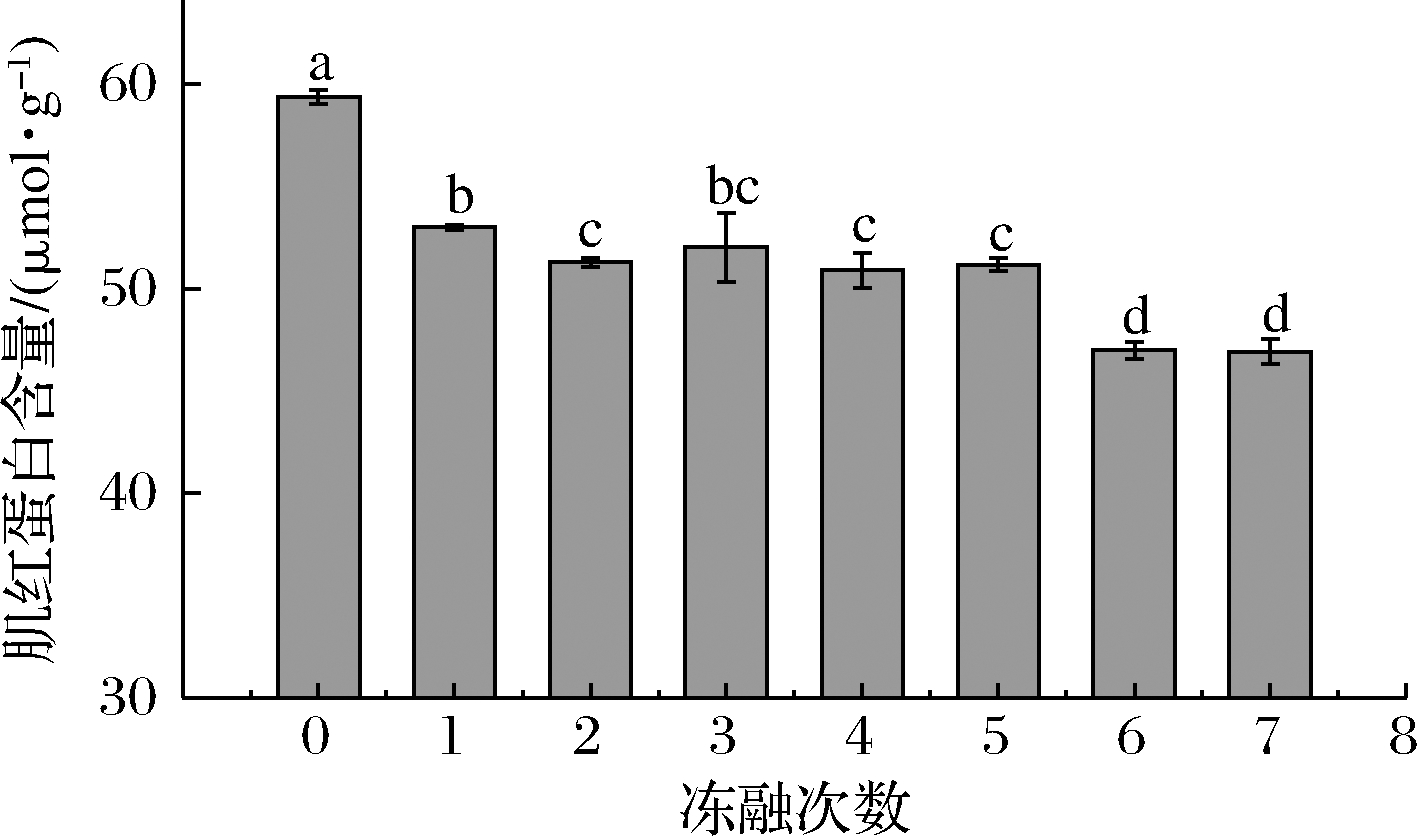
图4 不同冻融次数猪肉糜肌红蛋白含量的变化
Fig.4 Changes of myoglobin content in minced pork protein with different freeze-thaw cycles
2.7 冻融对氧合肌红蛋白、高铁肌红蛋白含量的影响
除了肌红蛋白含量决定了肉制品的色泽之外,肌红蛋白的价态也是影响颜色的另一个重要因素。图5 显示了氧合肌红蛋白和高铁肌红蛋白随冻融次数比例的变化,与空白组相比,第1次冻融之后肉糜的氧合肌红蛋白比例显著上升,高铁肌红蛋白比例显著下降(P<0.05);冻融2、3次的时候变化不明显;冻融4~7次时,氧合肌红蛋白的比例显著地下降,高铁肌红蛋白的比例显著地上升(P<0.05)。新鲜肉中肌红蛋白以暗紫色的脱氧肌红蛋白形式存在,当接触O2时,O2迅速和脱氧肌红蛋白上的铁离子配位键结合形成氧合肌红蛋白,氧合肌红蛋白的比例上升,肉制品呈现诱人的鲜红色。但随着冻融次数的增加,氧化加深,氧合肌红蛋白和脱氧肌红蛋白中的Fe2+被氧化成Fe3+,形成高铁肌红蛋白,肉制品颜色劣变成褐色。冻融初期高铁肌红蛋白还原酶可将生成的Fe3+还原,从而抑制了颜色的劣变,但随着氧化的加深,还原系统被破坏,高铁肌红蛋白的比例上升,肉糜颜色加深劣变。
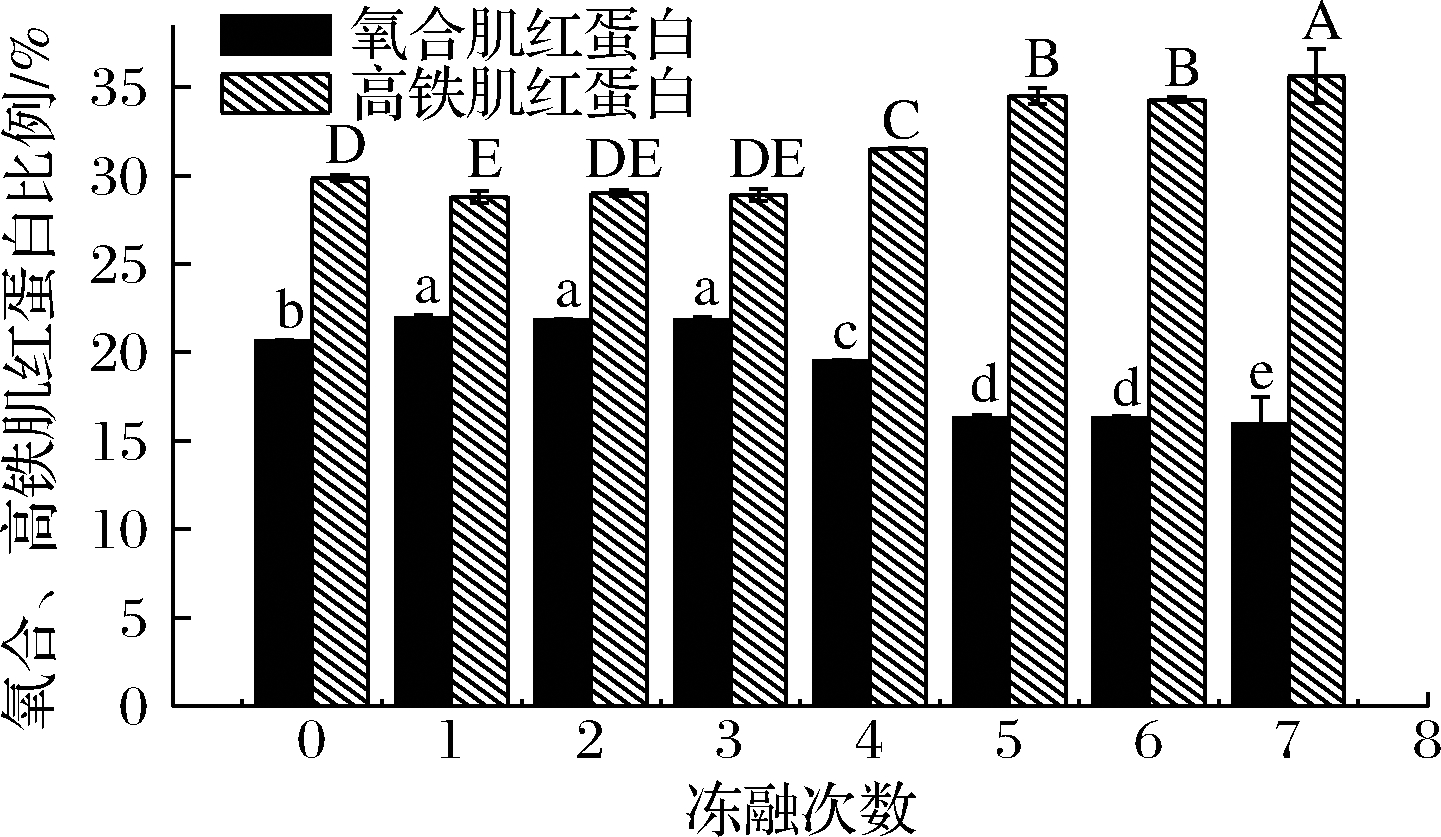
图5 不同冻融次数猪肉糜氧合肌红蛋白和高铁肌红蛋白比例的变化
Fig.5 Changes of the ratio of OMb and MMb in minced pork with different freeze-thaw cycles
2.8 冻融对肉馅颜色的影响
表4显示不同冻融次数肉糜L*、a*和b*值的变化情况。新鲜的肉糜(未经过冻融的)a*值最高,冻融1次后显著下降(P<0.05),随后变化不显著。这是由于肉在斩拌过程中大量的O2混入,肌红蛋白上的铁离子与O2结合生成鲜红的氧合肌红蛋白,使得a*值升高。L*值和b*值主要和脂肪氧化有关[38],L*值、b*值变化均不显著,可能是因为原料采用猪背最长肌肉,脂肪含量低。冻融1次后L*值有一定的上升,这可能是因为解冻之后部分水在肉糜的表面,使得肉糜的L*值升高。
表4 不同冻融次数猪肉糜颜色的变化
Table 4 Color changes of minced pork with different freeze-thaw cycles
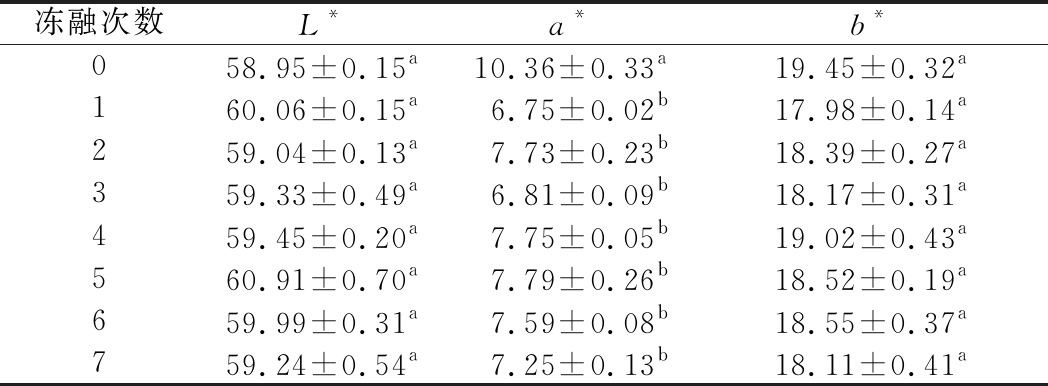
冻融次数L*a*b*058.95±0.15a10.36±0.33a19.45±0.32a160.06±0.15a6.75±0.02b17.98±0.14a259.04±0.13a7.73±0.23b18.39±0.27a359.33±0.49a6.81±0.09b18.17±0.31a459.45±0.20a7.75±0.05b19.02±0.43a560.91±0.70a7.79±0.26b18.52±0.19a659.99±0.31a7.59±0.08b18.55±0.37a759.24±0.54a7.25±0.13b18.11±0.41a
2.9 冻融对肉馅质构的影响
如表5所示,随着冻融次数的增加,猪肉糜的质构发生了显著的变化。其中未经过冻融的猪肉糜样品硬度为7 756 g,经7次冻融后,硬度降至最低(6 827 g)。弹性、内聚性和咀嚼性冻融7次后,分别下降了6.0%、7.4%和21.0%(P<0.05)。内聚性是咀嚼肉糜时,肉糜内部紧密相连抵抗受损的性质,它反映了肉糜内部结合程度的大小,冻融过程中肉糜内部凝胶结构由于受到冰晶的破环,或者蛋白质氧化聚集使得内部结构变得松散[39],内聚性降低。XIA等[16]研究指出,冻融循环降低肉糜的凝胶性质和乳化能力,冻融循环次数越多,下降越明显。咀嚼性是硬度、内聚性和回复性的乘积,它综合地反映了肉糜的感官品质。由表5可知,未经冻融的肉糜的咀嚼性最好,冻融1~4次后发生劣变,冻融5~7次后咀嚼性下降显著(P<0.05),说明冻融5次后肉糜感官品质下降明显,这也与感官评价结果相近。
表5 不同冻融次数猪肉糜质构的变化
Table 5 Changes in texture of pork mince with different freeze-thaw cycles

冻融次数01234567硬度/g7 756±1 115a6 983±661a7 531±681a7 801±390a7 229±1 027a7 219±346a6 863±1 446a6 827±146a弹性/mm0.90±0.03a0.84±0.05b0.86±0.04ab0.86±0.05ab0.86±0.04ab0.85±0.02ab0.85±0.01ab0.84±0.00ab内聚性0.68±0.02ab0.68±0.01a0.67±0.03abc0.63±0.03abc0.64±0.02abc0.62±0.05c0.65±0.04abc0.63±0.03bc咀嚼性/mJ4 675±465a3 989±461ab4 303±444ab4 254±580ab3 952±490ab3 787±217b3 769±507b3 693±236b
2.10 冻融对肉馅感官品质的影响
由表6可知,未冻融的肉馅色泽感官评分最高,随后感官评分降低,这说明在1次冻融后肉糜的颜色发生了肉眼可辨的变化,随冻融次数的增加,虽然肉糜的颜色仍然在劣变,但肉眼几乎分辨不出。新鲜肉糜与冻融后的肉糜在气味上没有显著差异(P>0.05),而口感却发生了变化,未经过冻融的口感得分最高为7.273分,而冻融7次后降为6.82分。同时质地方面,硬度、弹性和内部结构的感官得分均显著降低,硬度从19.09 g下降到16.14 g(P<0.05),弹性从19.32 mm下降到16.14 mm(P<0.05),内部结构从15.46下降到13.09(P<0.05)。感官评价的结果与质构结果相近,质构结果也显示随着冻融次数的增加,肉糜在硬度、弹性和内聚性方面下降。
表6 不同冻融次数猪肉糜感官品质评价得分
Table 6 Sensory quality evaluation scores of minced pork with different freeze-thaw cycles
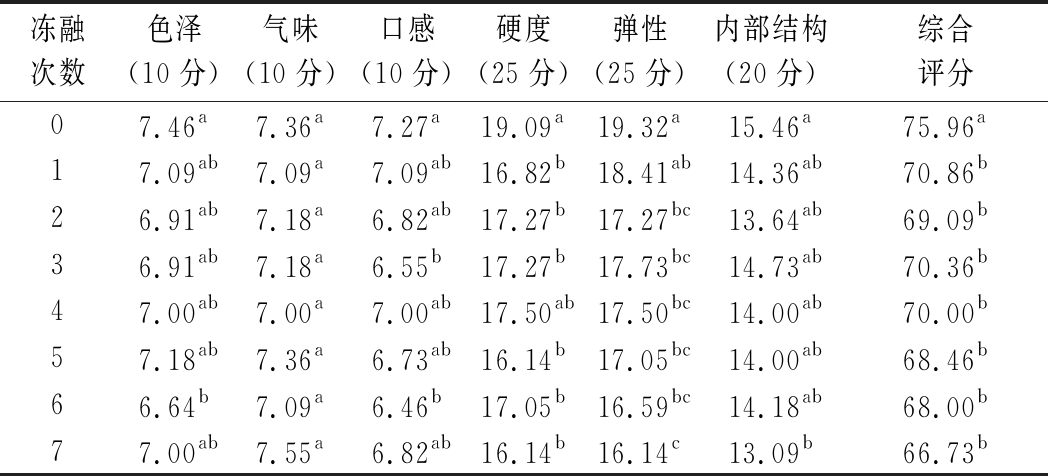
冻融次数色泽(10分)气味(10分)口感(10分)硬度(25分)弹性(25分)内部结构(20分)综合评分07.46a7.36a7.27a19.09a19.32a15.46a75.96a 17.09ab7.09a7.09ab16.82b18.41ab14.36ab70.86b 26.91ab7.18a6.82ab17.27b17.27bc13.64ab69.09b 36.91ab7.18a6.55b17.27b17.73bc14.73ab70.36b 47.00ab7.00a7.00ab17.50ab17.50bc14.00ab70.00b 57.18ab7.36a6.73ab16.14b17.05bc14.00ab68.46b 66.64b7.09a6.46b17.05b16.59bc14.18ab68.00b 77.00ab7.55a6.82ab16.14b16.14c13.09b66.73b
肉糜的质地和加热过程中肉糜形成的蛋白凝胶结构有着密切的关系,蛋白凝胶形成的越紧密,肉糜宏观上表现出越好的质地。但是在冻藏的过程中由于肌原纤维蛋白冷冻和氧化变性[16,40],导致肌原纤维蛋白所形成的凝胶强度也下降。
2.11 不同冻融次数猪肉糜各指标相关性及主成分分析
如表7所示,蒸煮损失与蛋白质氧化指标(羰基值),蛋白质结构变化(巯基和二硫键)以及蛋白质的变性程度指标(总焓变)都呈现极强的相关性(P<0.01),意味着在冻融的过程中蛋白质变性是导致蒸煮后肉糜持水性变化的关键因素。蛋白质变性程度越大,形成肉糜结构越粗糙,肉糜的保水能力越差。质构指标和蛋白质变性指标都有不同程度的相关性,其中巯基和二硫键与肉糜的硬度、弹性和内聚性都呈现了显著相关性(P<0.05),和肉糜的咀嚼性和感官评价得分呈现极强相关性(P<0.01),总焓变和咀嚼性以及感官评分也呈现极强相关性(P<0.01),说明猪肉糜在冻融的过程中由于冷冻或者氧化变性,促使蛋白质结构发生改变,从而加热过程中凝胶网络结构劣化,表现出肉糜的质构随着冻融次数的增加劣化,感官评分降低。所以说蛋白质变性指标一定程度上可以反应肉糜体系蒸煮后的感官品质。
表7 不同冻融次数猪肉糜各个指标之间的相关性
Table 7 Correlation among various indexes of minced pork with different freeze-thaw cycles
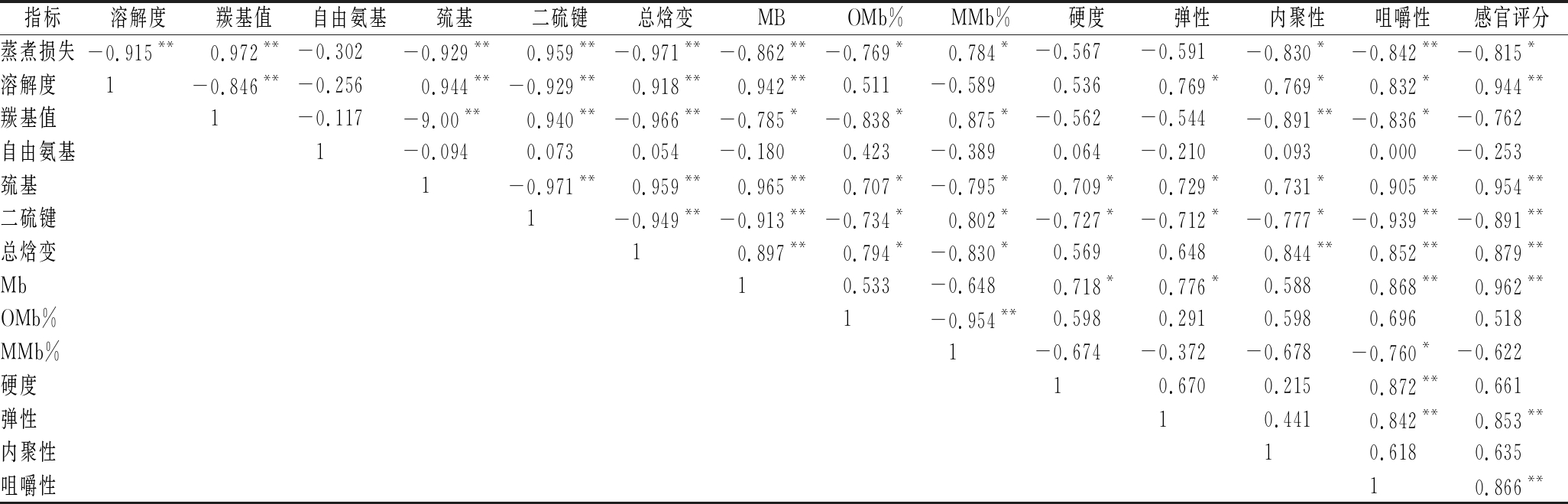
指标溶解度羰基值自由氨基巯基二硫键总焓变MBOMb%MMb%硬度弹性内聚性咀嚼性感官评分蒸煮损失-0.915** 0.972**-0.302-0.929** 0.959**-0.971**-0.862**-0.769* 0.784*-0.567-0.591-0.830*-0.842**-0.815*溶解度 1-0.846**-0.256 0.944**-0.929** 0.918** 0.942** 0.511-0.589 0.536 0.769* 0.769* 0.832* 0.944**羰基值 1-0.117-9.00** 0.940**-0.966**-0.785*-0.838* 0.875*-0.562-0.544-0.891**-0.836*-0.762自由氨基 1-0.094 0.073 0.054-0.180 0.423-0.389 0.064-0.210 0.093 0.000-0.253巯基 1-0.971** 0.959** 0.965** 0.707*-0.795* 0.709* 0.729* 0.731* 0.905** 0.954**二硫键 1-0.949**-0.913**-0.734* 0.802*-0.727*-0.712*-0.777*-0.939**-0.891**总焓变 1 0.897** 0.794*-0.830* 0.569 0.648 0.844** 0.852** 0.879**Mb 1 0.533-0.648 0.718* 0.776* 0.588 0.868** 0.962**OMb% 1-0.954** 0.598 0.291 0.598 0.696 0.518MMb% 1-0.674-0.372-0.678-0.760*-0.622硬度 1 0.670 0.215 0.872** 0.661弹性 1 0.441 0.842** 0.853**内聚性 1 0.618 0.635咀嚼性 1 0.866**
注:*表示P<0.05水平上相关;**表示P<0.01水平上相关;MB-肌红蛋白含量
如图6所示,对冻融7次的猪肉糜各项指标做主成分分析,第1主成分(PC1)的贡献率为74.0%,第2主成分(PC2)的贡献率为12.9%,累加贡献率为86.9%,可充分反应不同冻融次数肉糜各指标的信息。
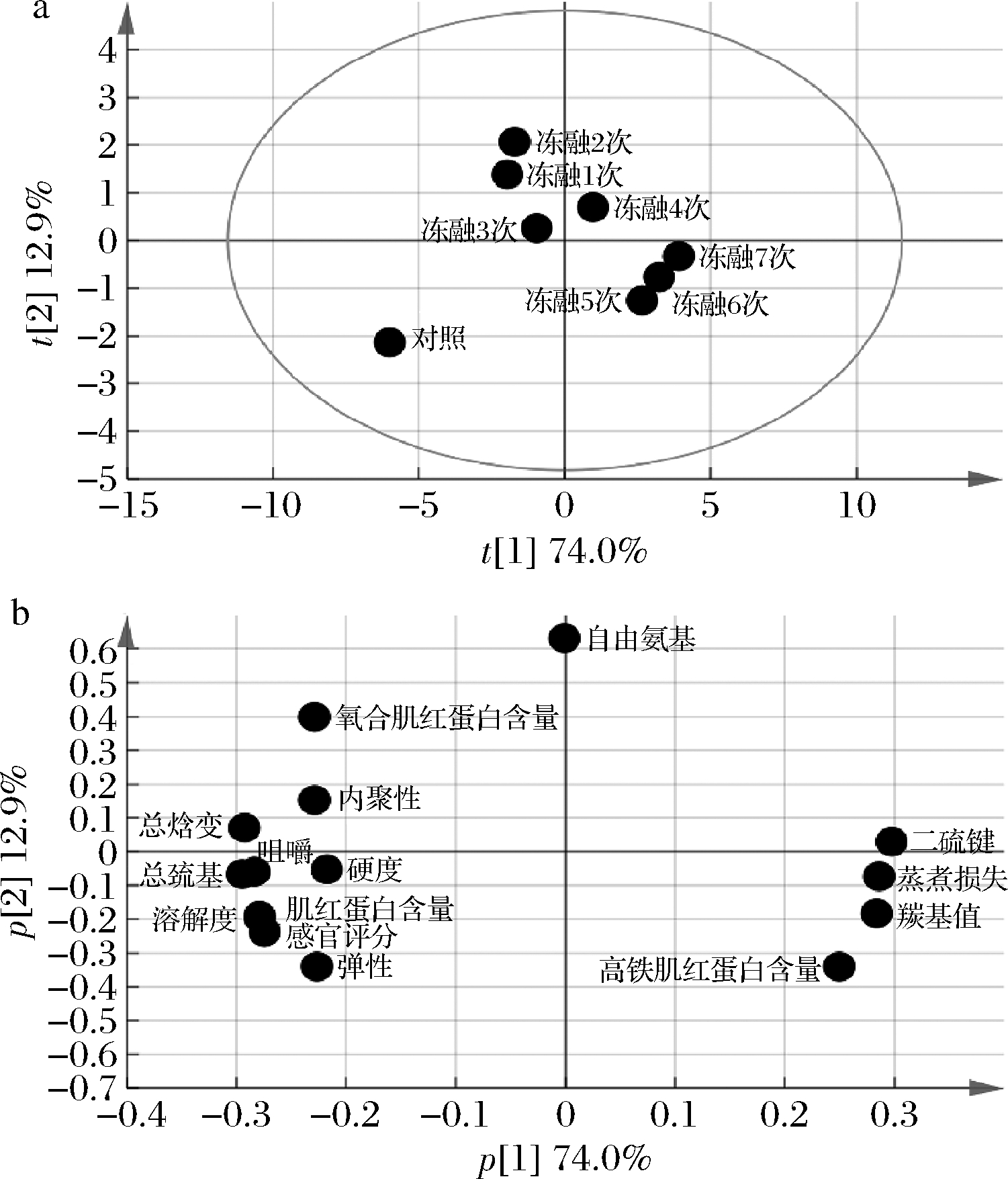
图6 不同冻融次数猪肉糜各指标的主成分分析
Fig.6 PCA of various indexes of minced pork with different freeze-thaw cycles
由得分图6-a可知,肉糜冻融1~3次和冻融4~7次分别位于纵轴的两侧,说明在冻融4次时肉糜品质发生了显著变化(P<0.05),在冻融5~7次时样品点比较聚集,说明此阶段变化程度减小。综合载荷图6-b分析,随冻融次数的增加,样品点沿PC1的方向向右的移动是二硫键、羰基值、高铁肌红蛋白和蒸煮损失升高造成的,而对照组在PC1方向左方和PC2方向下方主要是因为巯基、溶解度、硬度和弹性等指标值较高,所以说在冻融的过程中肉糜品质在持续的劣变。
3 结论
冻融会导致肌原纤维蛋白溶出的猪肉糜体系蛋白质变性,感官品质下降。具体表现在随着冻融次数的增加肌原纤维蛋白羰基值和二硫键含量显著地上升(P<0.05),巯基含量显著地下降,肌红蛋白含量显著地下降,氧合肌红蛋白比例呈现先升高后降低的趋势,高铁肌红蛋白则相反。猪肉糜的硬度、弹性、内聚性等质构特征均下降,感官评分降低。相关性分析表明,蛋白质变性和肉糜的质构以及感官评价存在强相关性,所以一定程度上可用蛋白质变性指标来表征猪肉糜的品质,主成分分析显示,在冻融4次后,猪肉糜的品质发生了显著地劣变(P<0.05),所以实际生产和销售过程中应避免发生超过3次以上的冻融,此研究为工业生产冷冻猪肉糜产品品质的保持和提升提供一定的理论依据。
[1] 陈茜茜, 黄明,邹玉峰,等.辐照和反复冻融对牛肉蛋白质氧化及食用品质的影响[J].食品科学,2014,35(19):1-5.
CHEN Q Q,HUANG M,ZOU Y F,et al.Influence of irradiation and freeze-thawing cycles on myofibrillar protein oxidation and eating quality of beef[J].Food Science,2014,35(19):1-5.
[2] 戚军. 反复冻融对羊肉品质的影响研究[D].南京:南京农业大学,2009.
QI J.Effect of repeated freeze-thaw cycles on goat meat quality[D].Nanjing:Nanjing Agricultural University,2009.
[3] QI J,LI C B,CHEN Y J,et al.Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J].Meat Science,2012,92(4):619-626.
[4] ALI S,ZHANG W G,RAJPUT N,et al.Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J].Food Chemistry,2015,173:808-814.
[5] PAN N,DONG C H,DU X,et al.Effect of freeze-thaw cycles on the quality of quick-frozen pork patty with different fat content by consumer assessment and instrument-based detection[J].Meat Science,2021,172:108313.
[6] ZHANG M C,LI F F,DIAO X P,et al.Moisture migration,microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles[J].Meat Science,2017,133:10-18.
[7] HENRIOTT M L,HERRERA N J,RIBEIRO F A,et al.Impact of myoglobin oxygenation state prior to frozen storage on color stability of thawed beef steaks through retail display[J].Meat Science,2020,170:108232.
[8] LEELAPONGWATTANA K,BENJAKUL S,VISESSANGUAN W,et al.Physicochemical and biochemical changes during frozen storage of minced flesh of lizardfish (Saurida micropectoralis)[J].Food Chemistry,2005,90(1-2):141-150.
[9] SAEED S,HOWELL N K.Effect of lipid oxidation and frozen storage on muscle proteins of Atlantic mackerel (Scomber scombrus)[J].Journal of the Science of Food and Agriculture,2002,82(5):579-586.
[10] 余小领, 李学斌,赵良,等.常规冷冻冻藏对猪肉保水性和组织结构的影响[J].农业工程学报,2008,24(12):264-268.
YU X L,LI X B,ZHAO L,et al.Effects of conventional freezing processing and frozen storage on pork water-holding capacity and structure[J].Transactions of the Chinese Society of Agricultural Engineering,2008,24(12):264-268.
[11] LIU Z L,XIONG Y L,CHEN J.Protein oxidation enhances hydration but suppresses water-holding capacity in porcine longissimus muscle[J].Journal of Agricultural and Food Chemistry,2010,58(19):10 697-10 704.
[12] MIGNINO L A,CRUPKIN M,PAREDI M E.Surface hydrophobicity and functional properties of myofibrillar proteins of mantle from frozen-stored squid (Illex argentinus) caught either jigging machine or trawling[J].LWT-Food Science and Technology,2008,41(4):678-685.
[13] 邓思杨,王博,李海静,等.冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J].食品科学,2019,40(11):95-101.
DENG S Y,WANG B,LI H J,et al.Effect of freeze-thaw cycles on changes in functional and structural properties of myofibrillar protein from mirror carp(Cyprinus carpio var.specularis)[J].Food Science,2019,40(11):95-101.
[14] ZHANG Y M,PUOLANNE E,ERTBJERG P.Mimicking myofibrillar protein denaturation in frozen-thawed meat:Effect of pH at high ionic strength[J].Food Chemistry,2021,338:128017.
[15] ARSLAN S.Effects of salt and phosphate levels on the emulsion properties of fresh and frozen hen meats[J].African Journal of Biotechnology,2006,5(10):1 006-1 012.
[16] XIA X F,KONG B H,XIONG Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85(3):481-486.
[17] 霍晓娜,李兴民,刘毅,等.光源和光照度对猪肉脂肪氧化程度和色泽变化的影响[J].中国农业大学学报,2006,11(4):47-50.
HUO X N,LI X M,LIU Y,et al.Inflence of light sources and intensity on lipid oxidation and color changes in pork[J].Journal of China Agricultural University,2006,11(4):47-50.
[18] LIU Z L,XIONG Y L,CHEN J.Identification of restricting factors that inhibit swelling of oxidized myofibrils during brine irrigation[J].Journal of Agricultural and Food Chemistry,2009,57(22):10 999-11 007.
[19] XING T,ZHAO X,HAN M Y,et al.A comparative study of functional properties of normal and wooden breast broiler chicken meat with NaCl addition[J].Poultry Science,2017,96(9):3 473-3 481.
[20] 贡汉坤, 焦云鹏.鮰鱼下脚料蛋白质的回收及其凝胶特性研究[J].食品与机械,2012,28(5):107-110.
GONG H K,JIAO Y P.Protein recovered from channel catfish processing by-products via isoelectric solubilization/precipitation and its gelation properties[J].Food & Machinery,2012,28(5):107-110.
[21] PARK D,XIONG Y L,ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry,2007,101(3):1 239-1 246.
[22] LEVINE R L,WILLIAMS J A,STADTMAN E P,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods in Enzymology,1994,233:346-357.
[23] 李春强. 肌原纤维蛋白的氧化程度对谷氨酰胺转移酶催化交联作用的影响及其机理研究[D].无锡:江南大学,2013.
LI C Q.Mechanism of transglutaminase-catalyzed cross-linking of oxidatively stressed myofibrillar protein[D].Wuxi:Jiangnan University,2013.
[24] LIU G,XIONG Y L,BUTTERFIELD D A.Chemical,physical,and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates[J].Journal of Food Science,2000,65(5):811-818.
[25] THANNHAUSER T W,KONISHI Y,SCHERAGA H A.Analysis for disulfide bonds in peptides and proteins[J].Methods in Enzymology,1987,143:115-119.
[26] 陈骋. 脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D].兰州:甘肃农业大学,2016.
CHEN C.Effects of lipid oxidation and antioxidant factors on color stability and metmyoglobin reducing ability of yak muscle[D].Lanzhou:Gansu Agricultural University,2016.
[27] KIM H W,CHOI Y S,CHOI J H,et al.Antioxidant effects of soy sauce on color stability and lipid oxidation of raw beef patties during cold storage[J].Meat Science,2013,95(3):641-646.
[28] KRZYWICKI K.The determination of haem pigments in meat[J].Meat Science,1982,7(1):29-36.
[29] SOYER A,ÖZALP B,DALMI Ü,et al.Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J].Food Chemistry,2010,120(4):1 025-1 030.
Ü,et al.Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J].Food Chemistry,2010,120(4):1 025-1 030.
[30] SAEED S,FAWTHROP S A,HOWELL N K.Electron spin resonance (ESR) study on free radical transfer in fish lipid-protein interaction[J].Journal of the Science of Food and Agriculture,1999,79(13):1 809-1 816.
[31] ESTÉVEZ M.Protein carbonyls in meat systems:A review[J].Meat Science,2011,89(3):259-279.
[32] XIONG Y L,PARK D,OOIZUMI T.Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J].Journal of Agricultural and Food Chemistry,2009,57(1):153-159.
[33] XU Y S,XIA W S,JIANG Q X,et al.Acid-induced aggregation of actomyosin from silver carp (Hypophthalmichthys molitrix)[J].Food Hydrocolloids,2012,27(2):309-315.
[34] KO W C,YU C C,HSU K C.Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J].LWT-Food Science and Technology,2007,40(8):1 316-1 320.
[35] ZHANG Y M,ERTBJERG P.On the origin of thaw loss:Relationship between freezing rate and protein denaturation[J].Food Chemistry,2019,299:125 104.
[36] AKTA N,KAYA M.Influence of weak organic acids and salts on the denaturation characteristics of intramuscular connective tissue.A differential scanning calorimetry study[J].Meat Science,2001,58(4):413-419.
N,KAYA M.Influence of weak organic acids and salts on the denaturation characteristics of intramuscular connective tissue.A differential scanning calorimetry study[J].Meat Science,2001,58(4):413-419.
[37] 孟祥忍, 王恒鹏,杨章平.食盐添加量对鸡肉糜热性质及流变性的影响[J].中国家禽,2015,37(16):39-43.
MENG X R,WANG H P,YANG Z P.Effect of salt supplementation on thermal and rheological properties of chicken meat paste[J].China Poultry,2015,37(16):39-43.
[38] THANONKAEW A,BENJAKUL S,VISESSANGUAN W,et al.The effect of metal ions on lipid oxidation,colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles[J].Food Chemistry,2006,95(4):591-599.
[39] LIU Q,CHEN Q,KONG B H,et al.The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J].LWT,2014,57(2):603-611.
[40] CHANARAT S,BENJAKUL S.Effect of formaldehyde on protein cross-linking and gel forming ability of surimi from lizardfish induced by microbial transglutaminase[J].Food Hydrocolloids,2013,30(2):704-711.