长双歧杆菌(Bidifobacterium longum)广泛分布于人体肠道中,具有改善肠道微生物群、调节肠道通透性、提高肠道免疫力、缓解肠道易激综合征和抵抗肠道炎症等益生作用[1-4]。提高长双歧杆菌的生产效率,拓展其应用是益生菌行业亟需解决的问题之一[5]。但是,由于生物合成缺陷及严格厌氧等特性,长双歧杆菌的培养密度较低,制约了其工业化生产的升级[6]。
优化培养基和培养工艺是提高长双歧杆菌生长密度的主要手段。目前,有关碳源对菌株生长的影响研究相对成熟,葡萄糖以其低廉的价格和高效的增殖效率,常被用作双歧杆菌的首选碳源;乙酸盐、磷酸盐、柠檬酸盐等缓冲盐已被证实在分批培养时主要通过减缓pH的降低从而提高生物量,在恒pH培养时不会促进菌体的生长,在此条件下培养双歧杆菌可不添加缓冲盐[7]。而氮源的选择尚无得出规律性结论,双歧杆菌因其种属、生境等的差异,对氮源的利用并无显著的偏好性;双歧杆菌的主要微量元素虽然已明确是镁和锰,但是在高密度培养时随着生物量的大幅提高,菌体浓度与微量元素浓度之间的关系尚不明确。因此在长双歧杆菌的培养基优化中还需解决氮源和微量元素的问题。
前期研究已经证实,双歧杆菌在恒pH分批培养过程中,酸根积累引起的渗透压升高是其生长的主要抑制因素[8],这也解释了为什么初始培养基底物浓度过高会影响菌株的生长。但是菌株生长的最高生物量又与底物浓度呈正相关[9],底物浓度低,达不到最优的培养效果;底物浓度高,又会抑制菌体生长。如何控制底物浓度是双歧杆菌恒pH分批培养亟需解决的难题。此外,底物的碳氮比在很大程度上会影响菌体的生长代谢[7],基于什么原则设定碳氮比亦是需要重点解决的问题。
本研究通过解析长双歧杆菌对氮源利用的偏好性与限制性微量元素,优化培养基组分;并进一步探索最高生物量与渗透压、底物浓度三者之间的关系,优化培养工艺,以期确定长双歧杆菌高密度培养策略。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株
长双歧杆菌(Bifidobacterium longum)CCFM 687、长双歧杆菌CCFM 1029、长双歧杆菌FGSZY 17L7,来源于江南大学食品生物中心菌种保藏中心。
1.1.2 试剂
胰蛋白胨(CT)、牛肉浸膏(BEF)、酵母浸膏粉(YEF)、D(+)-无水葡萄糖、无水乙酸钠、MgSO4·7H2O、MnSO4·H2O、柠檬酸氢二钠、K2HPO4、Na2HPO4、吐温80、L-半胱氨酸盐酸盐、NaOH、NaCl、琼脂粉,国药集团化学试剂有限公司;牛肉膏(BE),北京奥博星生物技术有限责任公司;牛肉蛋白胨(BEP),上海士锋生物科技有限公司;葡萄糖测定试剂盒,上海荣盛生物药业有限公司;酵母蛋白胨FP103(FP103)、酵母浸粉FM803(FM803)、酵母浸粉FM528(FM528)、酵母提取物FD00-A(YE)、大豆蛋白胨FP410(SP)、安琪蛋白胨FP351(FP351)、安琪蛋白胨FP326(FP326),安琪酵母股份有限公司。
1.2 仪器与设备
高速冷冻离心机,Eppendorf公司;löser-om806 m型冰点渗透压测定仪,德国löser公司;BIOTECH—3000发酵罐,上海保兴生物设备工程有限公司;AW500SG 厌氧工作站;分光光度计,赛默飞世尔科技公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;UV-2450紫外分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 菌种活化
将3株长双歧杆菌接种于MRS固体培养基中,倒置于厌氧工作站中37 ℃恒温恒湿培养48 h。挑取单菌落接液体管继续厌氧培养24 h。重复上述操作2次可得到活化后的种子液。
1.3.2 氮源利用的偏好性分析
按照氮源快速筛选培养基:1 g/L氮源、6 g/L葡萄糖、7 g/L K2HPO4、7 g/L Na2HPO4、0.25 g/L MgSO4·7H2O、0.05 g/L MnSO4·H2O、1 g/L半胱氨酸盐酸盐配制培养基,调pH 6.4,115 ℃灭菌20 min。其中氮源分别为:酵母类氮源、胰蛋白胨、牛肉类氮源、鱼蛋白胨、大豆蛋白胨;对照组采用0.2 g/L酵母提取物、0.4 g/L牛肉膏和0.4 g/L鱼蛋白胨作为氮源。培养基于超净工作台以5%接入种子液,置于厌氧工作站37 ℃培养,测定18、20 h的OD600值。
1.3.3 生长限制性微量元素(Mg和Mn)分析
采用限制性微量元素筛选培养基:1 g/L最佳氮源、6 g/L葡萄糖、7 g/L K2HPO4、7 g/L Na2HPO4、半胱氨酸1 g/L配制成4组不同微量元素比例的培养基(A组:无Mg、Mn;B组:0.087 g/L MgSO4·7H2O;C组:0.060 g/L MnSO4·H2O;D组:0.043 g/L MgSO4·7H2O,0.030 g/L MnSO4·H2O),调pH 6.4,115 ℃灭菌20 min。将种子液用PBS洗涤2次后,以5%的接种量接入以上4组培养基中,于厌氧工作站中37 ℃发酵,取18、20 h发酵液测定OD600值。
1.3.4 不同渗透压条件下生长曲线的测定
用NaCl调节培养基渗透压,配制不同渗透压梯度(350~1 350 mOsm/kg)的MRS培养基。取不同渗透压梯度的培养基添加至24孔板,设置3个平行。将活化好的种子液以5%的接种量接种于24孔板中,置于厌氧工作站中37 ℃恒温培养20 h,每隔2 h振匀后测定OD600值。以发酵时间(h)为横坐标,悬浊液的OD600值为纵坐标,绘制长双歧杆菌在不同渗透压条件下的生长曲线。
相比较于初始OD600,培养20 h无显著增长的渗透压即为完全抑制渗透压。
在对数生长期内,长双歧杆菌的生长规律如公式(1)所示:
(1)
式中:A0,进入对数生长期时长双歧杆菌的初始数量;At,t时刻长双歧杆菌的数量;G,长双歧杆菌的代时。由公式(1)可知,在对数生长期内,log2At与时间t成线性,且代时为斜率的倒数。
根据不同渗透压条件下的生长曲线判断长双歧杆菌对数生长期的时间,分别以对数生长期的时间为自变量,对应的OD600为应变量,基于SPSS一元线性回归分析求得长双歧杆菌在不同渗透压下的代时。采用多重比较对不同渗透压下的代时进行差异分析,与350 mOsm/kg对应的代时相比有显著增长的渗透压即为生长速率被抑制渗透压。
1.3.5 碳氮消耗比的测定
选用最适氮源按方法1.3.2方法配制优化培养基,发酵过程中每隔2 h测定样本中悬浊液在600 nm波长处的吸光度和葡萄糖含量,测定生长曲线。根据生长曲线分别测定菌株在生长速率被抑制和生长完全被抑制时的碳氮消耗比。
1.3.6 最适生长pH的测定
根据初始抑制渗透压和碳氮消耗比确定培养基的初始碳氮浓度(吐温80 1 mL/L,MgSO4·7H2O 0.25 g/L,MnSO4·H2O 0.05 g/L,半胱氨酸1 g/L),取3.5 L发酵液添加至平行发酵罐,灭菌后氮气保压0.1 MPa。按5%的接种量接菌,在37 ℃恒温下,分别在pH为5.00、5.75、6.50的发酵液中恒pH发酵。每隔2 h测定OD600,在生长稳定期计数发酵液中的活菌数。
1.3.7 生长限制性微量元素的最适添加量
参照方法1.3.6的培养基配方,其中微量元素按照最佳比例,总量由0.70、1.05、1.40 mmol/L配制成发酵液,依次取3.5 L发酵液添加至平行发酵罐,灭菌后通入氮气并保压0.1 MPa。接入5%的种子液,于最适生长pH、37 ℃发酵。对数期开始每隔2 h取样测定OD600,取稳定期发酵液计数。
1.3.8 测定方法
将待测液以对应培养基作为空白,用紫外分光光度计测定波长600 nm下菌悬液的OD600值;采用葡萄糖试剂盒测定葡萄糖含量;采用标准平皿法对样品中的总菌落进行计数;使用冰点渗透压仪测渗透压。
1.4 数据统计与分析
试验中每个实验值均是3次平行实验的平均值。不同组间的差异显著性采用IBM SPSS Statistics 22.0软件进行ANOVA分析(DUNCAN检验),P<0.05则认为差异显著;采用Graphpad 8.01进行生长曲线和柱形图的绘制。
2 结果与分析
2.1 限制性底物的分析和优化
2.1.1 氮源利用的偏好性
本研究首先比较长双歧杆菌对不同单一氮源的利用率。长双歧杆菌在培养基中生长易受到酸性和碳源不足的抑制,导致进入稳定期时培养基中仍存在很多氮源未被利用,因此传统培养基无法衡量长双歧杆菌对氮源的利用率。因此,采用方法1.3.2,在传统培养基的基础上,减碳氮添加量,同时增加碳氮比,且通过增加无机盐浓度使长双歧杆菌在氮源耗尽前解除pH和碳源不足的抑制。图1显示了不同氮源(1 g/L)对长双歧杆菌生物量的影响。

a-长双歧杆菌CCFM 687;b-长双歧杆菌CCFM 1029;c-长双歧杆菌FGSZY 17L7(下同) YE-酵母提取物;FP103-酵母蛋白胨FP103;FM803-酵母浸粉FM803;FM528-酵母浸粉FM528;YEF-酵母浸膏粉;CT-胰蛋白胨;SP-大豆蛋白胨;FP351-安琪蛋白胨FP351;BE-牛肉膏;FP326-安琪蛋白胨FP326;BEF-牛肉浸膏;BEP-牛肉蛋白胨;MRS-MRS氮源筛选培养基(下同)
图1 长双歧杆菌氮源筛选
Fig.1 The cells concentration of B.longum growing with different nitrogen source
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
长双歧杆菌普遍对酵母提取物、酵母蛋白胨FP103、酵母浸粉FM803、酵母浸粉FM528利用率较高,其次是大豆蛋白胨、安琪蛋白胨FP351(鱼)、安琪蛋白胨FP326(牛骨)。长双歧杆菌CCFM 687、长双歧杆菌CCFM 1029、长双歧杆菌FGSZY 17L7最佳氮源分别是安琪蛋白胨FM103、酵母提取物、酵母浸粉FM803,由此可知长双歧杆菌对酵母类氮源利用率最高。LIU等[10]研究表明,乳酸菌对酵母提取物利用程度高是因为酵母提取物富含含氮化合物、维生素、嘌呤碱和嘧啶碱;在酵母提取物中发现的维生素中,烟酸、泛酸、核黄素、叶酸和吡哆醇是刺激乳酸菌生长所必需的B族维生素[11]。此外,有研究表明两歧双歧杆菌对酵母类氮源的利用率较低,推测影响双歧杆菌对氮源利用程度的因素,除了氮源是否富含生长因子,还有菌株对氮源种类的偏好性。
朱丹凤等[12]采用液相色谱分析,发现安琪蛋白胨FP351(鱼)和大豆蛋白胨可利用肽分子量区间比酵母提取物高,但长双歧杆菌对鱼蛋白胨或大豆蛋白胨作为单一氮源的利用效果却显著低于酵母提取物,猜测它们单独作为氮源时未被充分利用;为进一步探究氮源中的生长因子是否为影响增殖浓度差异的主要因素,将富含生长因子的酵母浸粉与其他氮源1∶1复配,比较长双歧杆菌在复合氮源生长的活菌浓度是否大于单一氮源的叠加。
表1 氮源复配对长双歧杆菌生长的影响(OD600)
Table 1 Effect of nitrogen source combination on the growth of B.longum(OD600)

长双歧杆菌FM803+FP351FM803+BEPFM803+SPFM803FP351(鱼)BEPSPB.longum CCFM6871.04±0.03b1.05±0.02e0.82±0.07b1.25±0a0.79±0.03c0.75±0.01d0.68±0.04eB.longum CCFM10290.98±0.05b1±0.06c0.75±0.02b1.14±0.02a0.56±0.01e0.65±0.04d0.5±0.02fB.longum FG-SZY17L71.15±0.1a1.05±0.05d1.06±0.00b1.15±0.01a0.47±0.1e0.48±0.01e0.97±0.02c
注:不同小写字母表示具有显著性差异(P<0.05);理论值由以上初筛结果计算得出,数值未显示
经计算比较,长双歧杆菌CCFM 687和CCFM 1029对复配氮源的利用率与理论值相比无显著差异,即复配不能提高长双歧杆菌CCFM 687和CCFM 1029对鱼、大豆蛋白胨及牛肉浸膏的利用率。长双歧杆菌FGSZY 17L7对鱼蛋白胨和牛肉浸膏的复配氮源利用率显著高于理论的叠加值,表明长双歧杆菌FGSZY 17L7可利用鱼蛋白胨与牛肉浸膏,但作为单一氮源时,因缺少生长因子而利用率较低;而酵母类氮源与大豆蛋白胨在复配后,实际生长值未显著高于理论值,说明大豆蛋白胨作为单一氮源时已被充分利用,或者未能利用的部分是不可利用氮源。因此长双歧杆菌对氮源的利用程度取决于氮源是否富含生长因子和自身对氮源的偏好性。
综上,长双歧杆菌对酵母类氮源利用性最佳,鱼蛋白胨和牛肉类氮源次之,胰蛋白胨和大豆蛋白胨最差;酵母浸粉FM803能够促进长双歧杆菌FGSZY 17L7对鱼蛋白胨和牛肉浸膏的利用,但复配后的增殖效果与单一的酵母类氮源无显著差异;酵母浸粉对长双歧杆菌CCFM 687和CCFM 1029利用其他氮源无促进效果。因此选用安琪酵母浸粉FM803作为最佳氮源进行试验。
2.1.2 生长限制性微量元素分析
在培养基中添加矿物质和其他微量元素起到酶激活剂的作用,对微生物的繁殖至关重要。Mn2+是多数乳杆菌生长和繁殖所必需的[13-15],不同于乳杆菌,长双歧杆菌有其独特的双歧代谢途径[16]。其中,果糖-6-磷酸酮糖酶作为双歧杆菌特有的酶,被认为是双歧杆菌的科的分类学标记,需要Mg2+、Ca2+或Mn2+等作为辅助因子与活性位点结合使酶正常工作。其中,果糖-6-磷酸酮糖酶与Mg2+结合具有更高的转化效率。
根据图2可知,对比A组和C组,长双歧杆菌CCFM 687、长双歧杆菌FGSZY 17L7和长双歧杆菌CCFM 1029的单独添加MnSO4组相对于空白组对细胞浓度无显著性提升,所以Mn不是长双歧杆菌的生长限制性微量元素;对比B组、C组和D组,发现低浓度且Mg、Mn总物质的量一定时,长双歧杆菌的细胞浓度随Mg2+浓度增加而显著增长,单独添加MgSO4时最高。因此长双歧杆菌的限制性微量元素是Mg。

A-无Mg、Mn;B-Mg;C-Mn;D-m(Mg)∶m(Mn)=1∶1
图2 不同微量元素比例对长双歧杆菌生长影响
Fig.2 Effect of different trace element ratio on B.longum growth
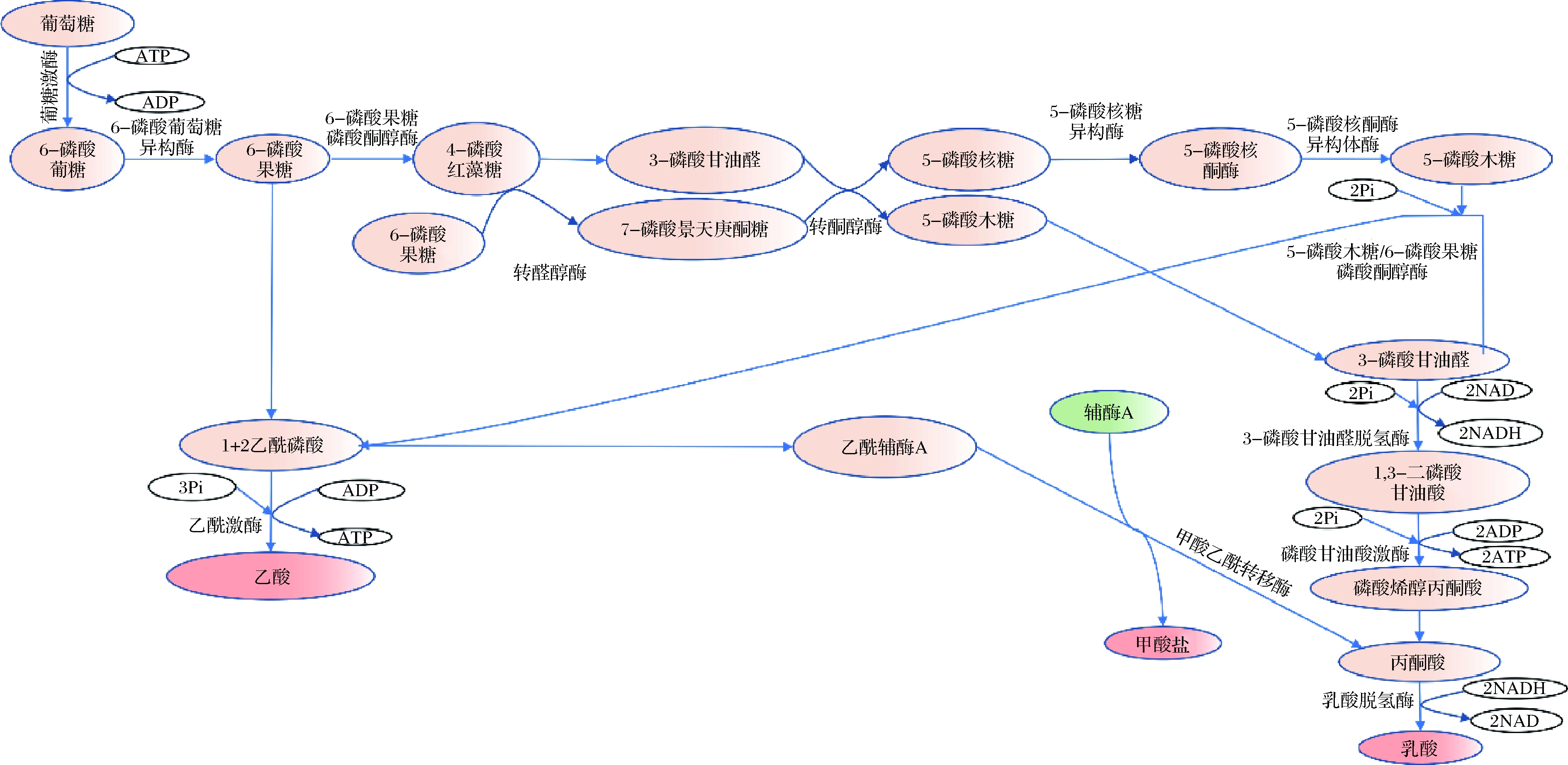
图3 双歧杆菌葡萄糖代谢途径示意图
Fig.3 Schematic representation of glucose degradation through “bifid shunt” in Bifidobacteria
双歧杆菌葡萄糖代谢途径及关键酶如图3[17-18],通过查询Universal Protein数据库(https://www.uniprot.org/)可得关键酶的辅助因子(表2)。由表2可知,乙酸激酶和转酮醇酶的辅助因子可以是Mg2+或Mn2+[19],两者可相互替代;葡糖激酶和半乳糖激酶则需要ATP与Mg2+络合为MgATP2+的形式作为辅助因子参与反应[19-20];磷酸甘油酸激酶只能以Mg2+作为辅助因子;Mg2+不是5-磷酸核糖异构酶的辅助因子[21],但长双歧杆菌在实际发酵过程中单独添加Mg2+活菌量最高,归因于酵母含有丰富的Co2+、Fe2+、Mn2+、Zn2+[22],而过量的Mn2+会抑制长双歧杆菌生长。
表2 双歧杆菌葡萄糖代谢途径中的关键酶及其辅助因子
Table 2 The key enzymes and cofactors in the glucose metabolism pathway of Bifidobacteria

关键酶辅助因子乙酸激酶Mg2+,Mn2+半乳糖激酶MgATP2+3-磷酸甘油醛脱氢酶NAD葡糖激酶MgATP2+6-磷酸葡萄糖Fe2+果糖-6-磷酸酮糖酶Mg2+>Ca2+,Co2+,Mn2+,Ni2+乳酸脱氢酶FAD磷酸甘油酸激酶Mg2+5-磷酸核糖异构酶Co2+,Fe2+,Mn2+,Zn2+转酮醇酶Mg2+,Mn2+5-磷酸木酮糖磷酸转酮酶Ca
注:Mg2+ >Mn2+表示该酶与Mg2+结合具有更高效率
2.1.3 最适生长渗透压和完全抑制渗透压
中性条件下,双歧杆菌代谢产生的醋酸和乳酸对细胞无显著毒害作用,对其生长的抑制归因于渗透压升高[16]。因此可通过分析双歧杆菌在不同渗透压下的生长曲线,获得初始抑制渗透压和完全抑制渗透压,进而估算出初始添加多少的碳氮源总量经过双歧代谢途径,在发酵终点可达到完全抑制渗透压。
由图4可知,长双歧杆菌CCFM 687和CCFM 1029初始抑制渗透压都为750 mOsm/kg,长双歧杆菌FGSZY17L7初始抑制渗透压为550 mOsm/kg;长双歧杆菌687在渗透压为1 250 mOsm/kg时被完全抑制生长;长双歧杆菌CCFM 1029在渗透压为1 050 mOsm/kg时被完全抑制,长双歧杆菌FGSZY 17L7在渗透压为850 mOSM/kg时被完全抑制。
2.2 长双歧杆菌培养工艺优化
2.2.1 最适碳氮比
在进行恒pH培养时,碳源或氮源不足,都会抑制长双歧杆菌增殖。为了进一步探究补料和初始培养基中的碳氮源最适添加比例,根据方法1.3.7计算长双歧杆菌生长速率被抑制和生长被完全抑制时的碳氮消耗比。王玉林等[7]发现,按生长速率被抑制时的碳氮消耗比配制培养基,菌株增值效率最高。
由图5可知,长双歧杆菌CCFM 687碳氮消耗比为(3.02±0.38),长双歧杆菌CCFM 1029为(2.78±0.25),长双歧杆菌FGSZY 17L7为(3.04±0.34)。考虑到实验误差和菌株之间的代谢差异,为保证长双歧杆菌在生长过程提供充足的氮源,本实验按碳氮消耗比为2.50进行培养基配制和补料。
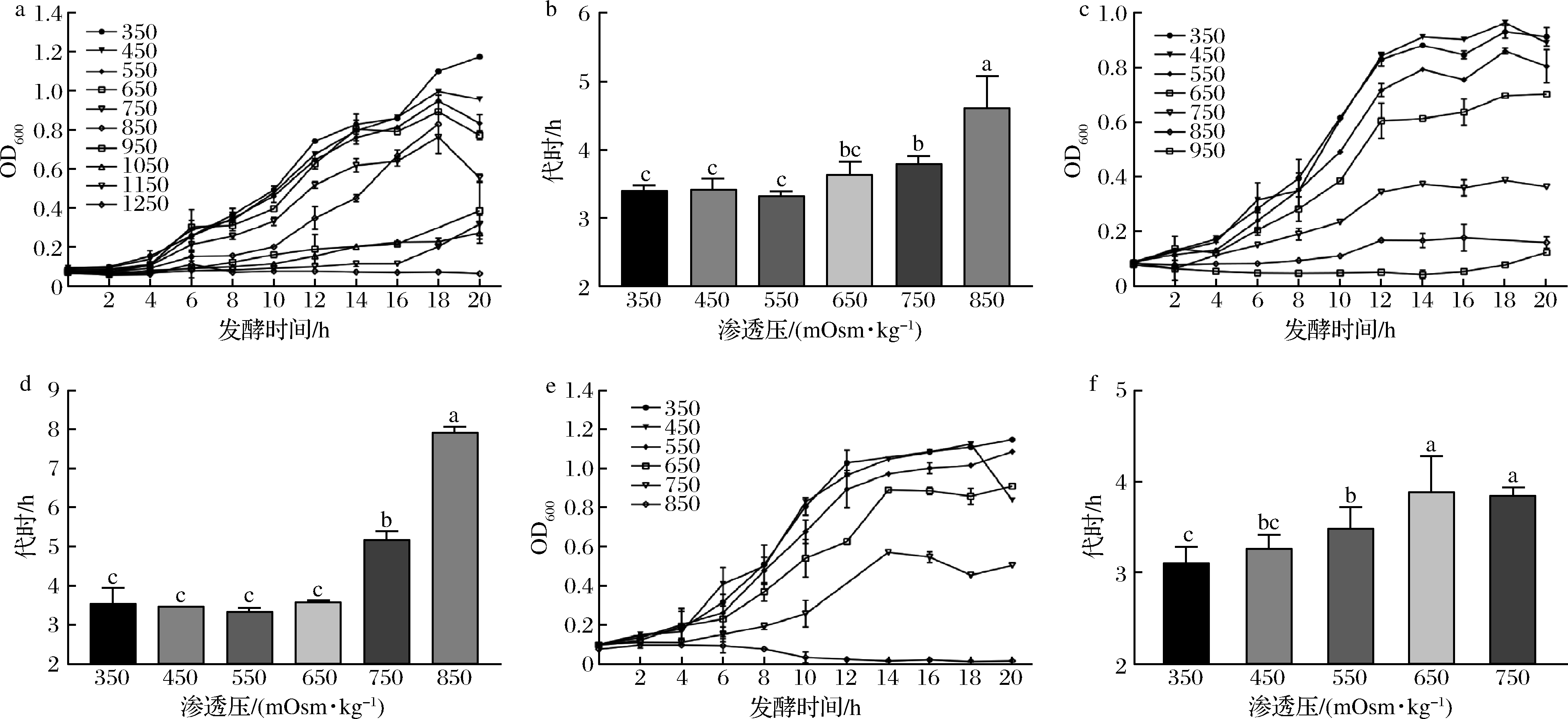
a、b-长双歧杆菌CCFM 687;c、d-长双歧杆菌CCFM 1029;e、f-长双歧杆菌FGSZY 17L7
图4 长双歧杆菌在不同渗透压条件下的生长曲线及代时
Fig.4 Growth curve and generation time of B.longum under different osmotic pressure

图5 长双歧杆菌生长速率被抑制时的消耗碳氮比
Fig.5 The consumption ratio of carbon and nitrogen when the growth rate of B.longums is suppressed
2.2.2 最适生长pH
双歧杆菌生长过程中会不断积累醋酸和乳酸,低pH乳酸以未解离形式存在,易转运到细胞内部,对菌体具有强烈抑制作用[16];通过调节pH可控制乳酸菌产生最大生物量或最多代谢产物。因此,探索双歧杆菌最适pH,进行恒pH培养对提高双歧杆菌的最高活菌数具有重要意义。根据1.3.5对双歧杆菌进行不同pH培养,表3显示了长双歧杆菌在不同恒pH培养的最高活菌数以及每组对比另外两组差异的显著性。长双歧杆菌在恒pH 5.00的条件下发酵所得的最高活菌数最高,与恒pH 5.75和恒pH 6.50条件发酵的最高活菌数有极显著差异,说明恒pH 5.00是长双歧杆菌的最适发酵pH。
表3 长双歧杆菌不同恒pH培养的最高活菌数(×108) 单位: CFU/mL
Table 3 Concentration of B.longum cultured in various pH

长双歧杆菌pH 6.50pH 5.75pH 5.00B.longum CCFM 68710.2±0.5c43.6±1.3b121.5±3.2aB.longum CCFM 10294.3±0.7c15.7±2.4b126.5±9.0aB.longum FGSZY 17L71.4±0.1c29.4±0.6b88.8±13.5a
2.3 恒pH分批培养
2.3.1 碳氮浓度的优化
根据范氏渗透压公式,培养基的渗透压和溶质的浓度可根据公式(2)关联:
π=icRT
(2)
式中:π,渗透压;i,无量纲范氏常数;c,溶液浓度;R,摩尔气体常数;T,热力学温度。在一定培养条件下,温度为37 ℃,氮气保压0.1 MPa,则摩尔气体常数和热力学温度一定;忽略溶液中分子和离子间相互作用力,则渗透压与溶液中能产生渗透效应的分子和离子总浓度(即渗透物质浓度)成正比。
双歧杆菌在发酵前后培养基所含氮源的各分子量肽总量几乎不变[12],因此氮源发酵前后提供的渗透压不变。假设在恒pH分批培养过程中醋酸与乳酸经NaOH溶液中和,pH恒定为5.00。电解质乙酸在水溶液中达到电离平衡时:
CH3COOH=CH3COO-+H+,
则有公式(3):
(3)
式中:c[CH3COO-]、c[H+]、c[CH3COOH]分别表示CH3COO-、H+、CH3COOH在电离平衡时的浓度,Ka1,乙酸的离子平衡常数。为确定37 ℃、pH 5.0时,c[CH3COO-]和c[CH3COOH]的比值,将公式(3)调整为公式(4):
(4)
经调研可知,醋酸常温下电离平衡常数为1.810-5,pH为5.0时H+浓度约为10-5mol/L,将其代入公式(4)得到式(5):
![]() =1.8
=1.8
(5)
CH3COO-来源于CH3COOH或者CH3COONa的电离,因此根据式(1)的分析,1分子CH3COO-提供两倍于CH3COOH的渗透压;结合公式(5)可以推导算出1分子乙酸经NaOH中和,再水解电离后渗透压约变为原来的1.65倍。
同理,参考公式(2)和公式(4),可得公式(6):
(6)
式中:c[CH3CH(OH)COO-]、c[CH3CH(OH)COOH]、c[H+]分别表示CH3CH(OH)COO-、CH3CH(OH)COOH、H+在离子平衡时物质的量浓度,Ka2表示乳酸的离子平衡常数。将乙酸常温下电离平衡常数1.3810-4代入公式(6)可得:
![]() =13.8
=13.8
(7)
类似的可以推算出1分子乳酸经NaOH中和,再水解电离后渗透压约变为原来的1.93倍。综上,理论上1分子葡萄糖经双歧代谢产生1分子乳酸和1.5分子醋酸,在NaOH调节pH 5.00时,葡萄糖经双歧杆菌代谢产酸渗透压变为原来的4.4倍;根据高于90%以上的葡萄糖被转换为有机酸以及完全抑制渗透压,可计算出初始需添加的碳氮源总量。
参照上述推导结果,得出所需添加的碳氮含量(表4)。基于前面选取的最优氮源、限制性微量元素Mg的添加量以及最适pH,根据1.3.7比较添加理论所需碳氮和过量碳氮发酵至稳定期,最高活菌数是否存在差异。
表4 长双歧杆菌生长至完全抑制渗透压理论所需碳氮添加量
Table 4 Amount of glucose and nitrogen needed by B.longum to reach theoretical maximum osmotic pressure
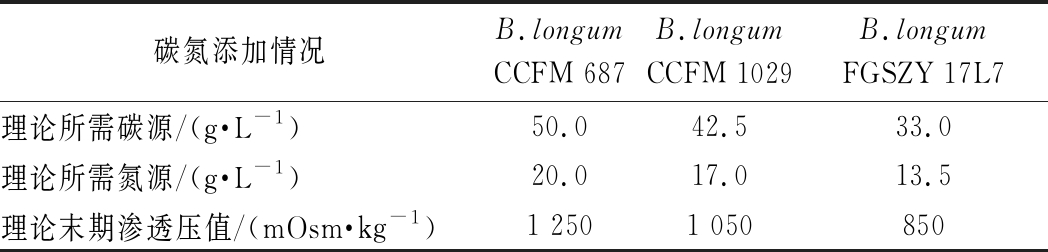
碳氮添加情况B.longumCCFM 687B.longumCCFM 1029B.longumFGSZY 17L7理论所需碳源/(g·L-1)50.042.533.0理论所需氮源/(g·L-1)20.017.013.5理论末期渗透压值/(mOsm·kg-1)1 2501 050850
2.3.1.1 长双歧杆菌CCFM 687的碳氮浓度优化
为验证上述推导得出的理论碳氮需求量能够满足长双歧杆菌生长至稳定期,且长双歧杆菌最高活菌数能够到达最高值。以表4的理论所需碳氮量配制培养基为A组;以初始培养基渗透压为500 mOsm/kg,按照碳氮消耗比添加过量底物,配制的培养基设为B组。
A组:按照葡萄糖50 g/L、酵母浸粉FM803 20 g/L配制成3.5 L培养基不补料;B组:按照葡萄糖60 g/L、酵母浸粉FM803 24 g/L配制成3.5 L培养基,不补料。稳定期收菌时,测得A组培养基中仍剩余2.17 g/L葡萄糖,渗透压稳定在1 094 mOsm/kg,说明长双歧杆菌CCFM 687的理论碳氮源添加量(表4)与实际需求量一致。根据图6可知,A组和B组则无显著性差异,但在实际收菌过程中发现A组在20 h达到稳定期,相比B组的发酵周期(22 h)更短,可能是初始渗透压较高导致延滞期较长所致。综上所述,选择使用A组培养方式发酵长双歧杆菌CCFM 687具备更显著的优势。
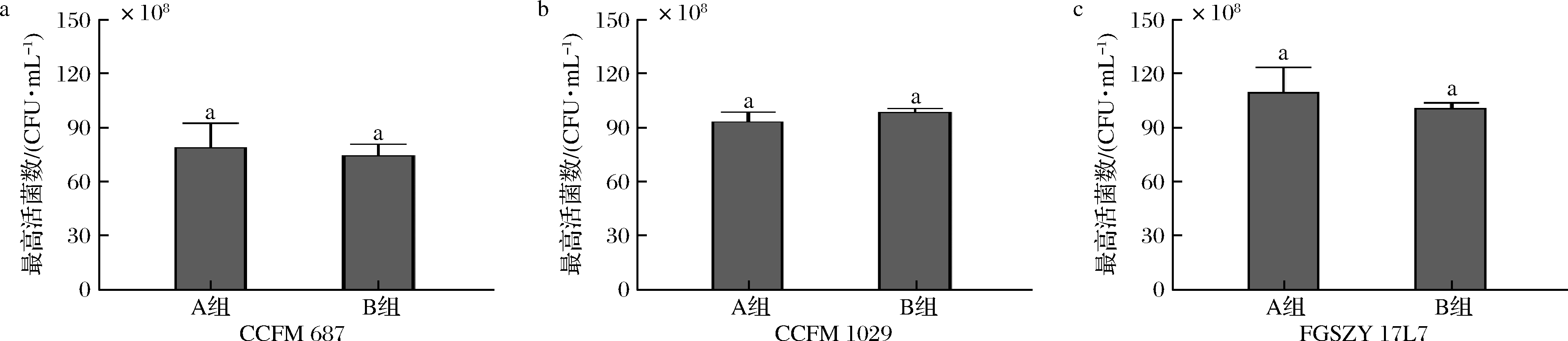
图6 长双歧杆菌不同培养工艺的最高活菌数
Fig.6 Cells concentration of B.longum fermented in different culture processes
2.3.1.2 长双歧杆菌CCFM 1029的碳氮浓度优化
A组:按照葡萄糖42.5 g/L、酵母浸粉FM803 17 g/L配制成3.5 L培养基不补料;B组同上。在稳定期测得A组葡萄糖含量为3.58 g/L,渗透压为1 032 mOsm/kg,与理论推导结果相接近。根据图6可知,2个组最高活菌数没有显著性差异;测得A组稳定期剩余葡萄糖含量为0.34 g/L,A组稳定期渗透压为1 032 mOsm/kg,B组稳定期渗透压为1 053 mOsm/kg,与理论完全抑制渗透压接近,说明长双歧杆菌FGSZY 17L7根据公式推导出表4的理论碳氮源添加量与实际需求量一致。在实际培养过程中B组培养至稳定期时间长于A组2 h,因此实际生产过程中选择A组作为长双歧杆菌CCFM 1029的发酵工艺。
2.3.1.3 长双歧杆菌FGSZY 17L7的碳氮浓度优化
A组:按照葡萄糖33 g/L、酵母浸粉FM803 14 g/L配制成3.5 L培养基不补料;B组同上。测得A组稳定期葡萄糖含量为0.26 g/L,渗透压为688 mOsm/kg,远低于理论完全抑制渗透压。在收菌时发现长双歧杆菌FGSZY 17L7不能离心到菌泥,可能是由于该菌种在发酵过程中消耗了部分葡萄糖而产生了较多的荚膜多糖。结合公式(1)所推导的结论可知:多分子葡萄糖结合成为荚膜多糖,则溶液中能产生渗透效应的分子总物质的量浓度变低,导致实际渗透压值与理论值偏差较大。根据图6可知,长双歧杆菌FGSZY 17L7在A组和B组的最高活菌数无显著性差异,但A组的发酵工艺更经济。
综上可知,根据长双歧杆菌的完全抑制渗透压计算所需碳氮源总量,将全部碳氮源加入培养基进行恒pH不补料分批培养是最佳发酵工艺。
2.3.2 最适微量元素浓度的优化
根据2.1.2可知,Mg2+作为长双歧杆菌的限制性微量元素,添加量不足会直接影响双歧杆菌的最高活菌数。通过计算得出常规MRS培养基中所含的微量元素浓度为0.70 mmol/L,因此分别以含0.70、1.05和1.40 mmol/L(即0.17、0.26和0.35 g/L) MgSO4的MRS进行三联罐恒pH分批发酵试验。由图7可知,厌氧发酵18~22 h后,长双歧杆菌CCFM 687和CCFM 1029在C组中的最高活菌数相比于A组均显著增长;而长双歧杆菌FGSZY 17L7虽然C组的最高活菌数最多,但三组间无显著性差异,据此推测长双歧杆菌所能达到的最高活菌数决定了不同株对微量元素需求的差异。所以培养基中MgSO4的最适添加量确定为0.35 g/L(即1.40 mmol/L)。
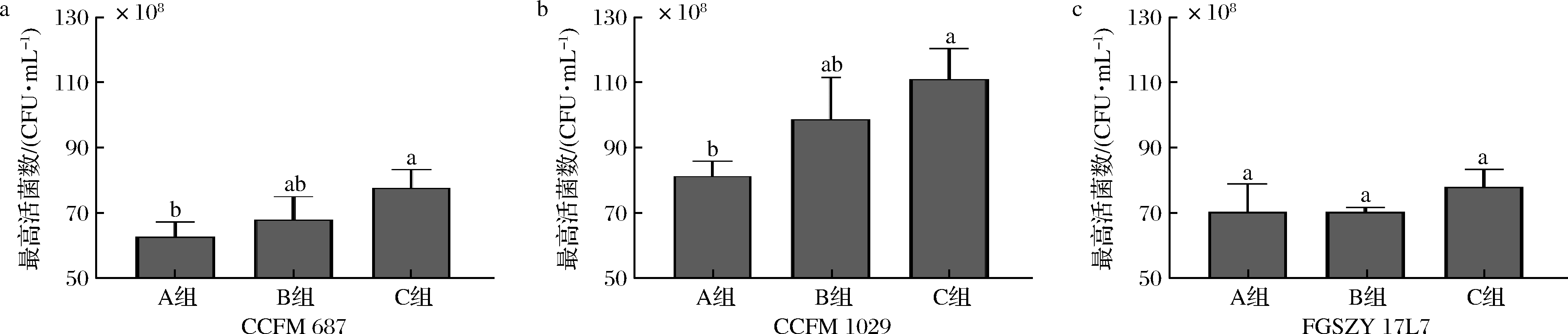
A组-MgSO4浓度0.70 mmol/L;B组-MgSO4浓度1.05 mmol/L;C组-MgSO4浓度1.40 mmol/L
图7 微量元素添加量对长双歧杆菌最高活菌数的影响
Fig.7 Effects of trace element dosages on the highest viable count of B.longum
3 结论
(1)长双歧杆菌对酵母类氮源利用效率较高,安琪(鱼)蛋白胨FP351、胰蛋白胨和牛肉类氮源次之;大豆蛋白胨最差。长双歧杆菌的限制性微量元素是Mg,在一定范围内菌浓与其添加量呈正相关。
(2)长双歧杆菌CCFM 687、长双歧杆菌CCFM 1029与长双歧杆菌FGSZY 17L7生长速率被抑制渗透压分别是750、750和550 mOsm/kg,完全抑制渗透压分别是1 250、1 050和850 mOsm/kg。
(3)以酵母浸粉FM803作为氮源、葡萄糖作为碳源时,培养长双歧杆菌的最适碳氮比为菌株生长过程中生长速率被抑制时的碳氮消耗比。根据理论推导1分子葡萄糖经双歧途径产酸被NaOH溶液中和后,发酵液中渗透压提高到初始值的4.4倍,基于发酵结束发酵液渗透压为完全抑制渗透压推算得到的底物浓度最有利于长双歧杆菌的高效增殖。
(4)长双歧杆菌CCFM 687添加50.0 g/L葡萄糖、20.0 g/L酵母浸粉FM803、0.35 g/L MgSO4·7H2O,恒pH 5.00培养18 h的最高活菌数达(7.9±1.1)×109 CFU/mL;长双歧杆菌CCFM 1029添加42.5 g/L葡萄糖、17.0 g/L酵母浸粉FM803、0.35 g/L MgSO4·7H2O,恒pH 5.00培养18 h的最高活菌数达(9.3±0.5)×109 CFU/mL;长双歧杆菌FGSZY 17L7添加33.0 g/L葡萄糖、13.5 g/L酵母浸粉FM803、0.35 g/L MgSO4·7H2O,恒pH 5.00培养18 h的最高活菌数达(1.1±0.1)×1010 CFU/mL,是MRS恒pH分批培养的40~80倍。
[1] MENG D,SOMMELLA E,SALVIATI E,et al.Indole-3-lactic acid,a metabolite of tryptophan,secreted by Bifidobacterium longum subspecies infantis is anti-inflammatory in the immature intestine[J].Pediatric Research,2020,88(2):209-217.
[2] FINAMORE A,ROSELLI M,DONINI L,et al.Supplementation with Bifidobacterium longum Bar33 and Lactobacillus helveticus Bar13 mixture improves immunity in elderly humans (over 75 years) and aged mice[J].Nutrition,2019,63-64:184-192.
[3] FANG Z F,LI L Z,LIU X Y,et al.Strain-specific ameliorating effect of Bifidobacterium longum on atopic dermatitis in mice[J].Journal of Functional Foods,2019,60:103 426.
[4] BONFRATE L,DI PALO D M,CELANO G,et al.Effects of Bifidobacterium longum BB536 and Lactobacillus rhamnosus HN001 in IBS patients[J].European Journal of Clinical Investigation,2020,50(3):e13201.
[5] CHEN H,TIAN M Q,CHEN L,et al.Optimization of composite cryoprotectant for freeze-drying Bifidobacterium bifidum BB01 by response surface methodology[J].Artificial Cells,Nanomedicine,and Biotechnology,2019,47(1):1 559-1 569.
[6] SCHELL M A,KARMIRANTZOU M,SNEL B,et al.The genome sequence of Bifidobacterium longum reflects its adaptation to the human gastrointestinal tract[J].Proceedings of the National Academy of Sciences,2002,99(22):14 422-14 427.
[7] 王玉林, 黄洁,崔树茂,等.植物乳杆菌最适生长底物解析及高密度培养工艺[J].食品与发酵工业,2020,46(4):19-27.
WANG Y L,HUANG J,CUI S M,et al.Analysis of optimal growth substrate and high-density culture process of Lactobacillus plantarum[J].Food and Fermentation Industries,2020,46(4):19-27.
[8] CUI S M,ZHAO J X,LIU X M,et al.Maximum-biomass prediction of homofermentative Lactobacillus[J].Journal of Bioscience and Bioengineering,2016,122(1):52-57.
[9] CUI S M,ZHAO J X,LIU X M,et al.Maximum-biomass concentration prediction for Bifidobacteria in the pH-controlled fed-batch culture[J].Letters in Applied Microbiology,2016,62(3):256-263.
[10] LIU B B,YANG M H,QI B K,et al.Optimizing l-(+)-lactic acid production by thermophile Lactobacillus plantarum As.1.3 using alternative nitrogen sources with response surface method[J].Biochemical Engineering Journal,2010,52(2-3):212-219.
[11] YOO I-K,CHANG H N,LEE E G,et al.Effect of B vitamin supplementation on lactic acid production by Lactobacillus casei[J].Journal of Fermentation and Bioengineering,1997,84(2):172-175.
[12] 朱丹凤, 王园园,崔树茂,等.罗伊氏乳杆菌氮源利用的选择性与特征分析[J].食品与发酵工业,2018,44(11):35-41.
ZHU D F,WANG Y Y,CUI S M,et al.Selectivity and characteristic analysis of nitrogen source utilized by Lactobacillus reuteri[J].Food and Fermentation Industries,2018,44(11):35-41.
[13] FITZPATRICK J J,AHRENS M,SMITH S.Effect of manganese on Lactobacillus casei fermentation to produce lactic acid from whey permeate[J].Process Biochemistry,2001,36(7):671-675.
[14] GROOT M N N,KLAASSENS E,DE VOS W M,et al.Genome-based in silico detection of putative manganese transport systems in Lactobacillus plantarum and their genetic analysis[J].Microbiology (Reading,England),2005,151(Pt 4):1 229-1 238.
[15] WEGKAMP A,DE VOS W M,SMID E J.Folate overproduction in Lactobacillus plantarum WCFS1 causes methotrexate resistance[J].FEMS Microbiology Letters,2009,297(2):261-265.
[16] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D].无锡:江南大学,2017.
CUI S M.The impact factors and rules of growth inhibition and freeze-drying survival for Lactic acid bacteria[D].Wuxi:Jiangnan University,2017.
[17] DE VRIES W,STOUTHAMER A H.Pathway of glucose fermentation in relation to the taxonomy of bifidobacteria[J].Journal of Bacteriology,1967,93(2):574-576.
[18] POKUSAEVA K,FITZGERALD G F,VAN SINDEREN D.Carbohydrate metabolism in Bifidobacteria[J].Genes & Nutrition,2011,6(3):285-306.
[19] GULBINSKY J S,CLELAND W W.Kinetic studies of Escherichia coli galactokinase[J].Biochemistry,1968,7(2):566-575.
[20] MATSCHINSKY F M,MAGNUSON M A.Glucokinase and Glycemic Diseases:From Basics to Novel Therapeutics[M].Basel:Karger Medical and Scientific Publishers,2004.
[21] LEE L V,POYNER R R,VU M V,et al.Role of metal ions in the reaction catalyzed by l-ribulose-5-phosphate 4-epimerase[J].Biochemistry,2000,39(16):4 821-4 830.
[22] VENKATESHWAR M,CHAITANYA K,ALTAF M,et al.Influence of micronutrients on yeast growth and β-d-fructofuranosidase production[J].Indian Journal of Microbiology,2010,50(3):325-331.