葡萄酒酿造是多种微生物参与代谢的过程[1],其中细菌、酵母菌、霉菌等微生物在其生产及风味形成过程中发挥了至关重要的作用[2]。不同微生物之间共生和代谢的相互作用形成了一个复杂的微生物群落,并在一定程度上影响葡萄酒的香气[3-4]和风味。而酿酒原料、酿造工艺、地理位置及气候条件等因素会影响酿酒微生物群落结构[5]。
近年来,由于高通量测序技术具有测序时间短、测序通量高的优势,国内外研究者将该技术应用于对酿酒微生物进行分类鉴定、监测发酵过程中酿酒微生物群落动态变化、追溯酒类风味物质以及辨别酒类产品是否掺假等方面。在葡萄酒领域,高通量测序用于对葡萄表面的微生物多样性进行研究,发酵过程中微生物的多样性及动态变化也有相关报道。PORTILLO等[6]使用高通量测序分析,研究了歌海娜和卡里尼亚葡萄浆果上的细菌多样性,表明不同品种葡萄浆果上的微生物具有差异。ZHANG等[7]利用16S rRNA和内部转录的间隔区(internal transcribed spacer,ITS)测序对葡萄果皮上微生物的组成进行研究,发现葡萄品种在塑造细菌和真菌群落方面起着重要作用,几种重要的细菌和真菌类群的丰富性有所区别。SETATI等[8]选取整个ITS对南非3个相邻葡萄园的赤霞珠葡萄浆果真菌群落进行测序,得出相邻葡萄园之间真菌群落的构成存在极显著差异。
大多数研究集中在不同品种酿酒葡萄果皮的细菌、真菌群落的构成,对不同品种、不同发酵阶段真菌群落的组成与差异研究较少,且针对昌黎产区不同葡萄品种发酵过程中真菌群落的研究未见报道。本研究采用ITS—ITS2区高通量测序方法,分析昌黎产区不同酿酒葡萄品种在自然发酵过程中真菌群落的差异与变化;评估真菌群落的组成和丰度,为日后深入研究河北昌黎产区葡萄酒中的微生物群落结构及其在发酵中的作用提供参考。
1 材料和方法
1.1 实验材料
本研究所用酿酒葡萄来自昌黎县茅台葡萄园,茅台葡萄园位于凤凰山脚下,基地建于2012年。随机采摘成熟期时的蛇龙珠、赤霞珠、马瑟兰3个葡萄品种,用手套从植物上手工收获并保存在无菌袋,放在冰盒中运往实验室。新鲜葡萄果实破碎压榨后进行自然发酵。每天使用密度计对所有发酵过程进行监测,并在3个不同的发酵阶段采集50 mL样品:发酵初期(第 2 天)、发酵中期(第 4 天)、发酵末期(第 6 天)。
1.2 实验方法
1.2.1 基因DNA的提取
按照DNA提取试剂盒:MOBIO PowerSoil® DNA Isolation Kit的步骤进行。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
1.2.2 PCR扩增和测序
PCR扩增体系:DNA模板30 ng,正反向引物(5′-CTTGGTCATTTAGAGGAAGTAAA-3′和3′-TGCGTTC-TTCATCGATGC-5′,5 μmol/L)各1 μL,3 μL 2 ng/μL 牛血清白蛋白溶液,12.5 μL 2×Taq Plus Master Mix,7.5 μL ddH2O。扩增程序如下:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,28个循环,最后72 ℃延伸10 min,每个样品3个重复。PCR产物使用1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化。后续文库构建和测序委托北京奥维森生物科技股份有限公司南京分公司进行,测序平台为Illumina MiSeq PE300。
1.3 数据分析
1.3.1 数据质控及操作分类单元(operational taxonomic unit,OTU)基础分析
MiSeq测序得到的是Pair-End(PE)双端序列数据,利用Trimmomatic、Pear对测得的Fastq数据进行质控处理,得到Fasta序列;再利用Flash、Pear根据PE的overlap关系对两端序列进行拼接(merge)处理,最终得到raw-tags;根据已知数据库用UCHIME方法比对去除Fasta序列的嵌合体,对于未知数据库使用自比对(de novo)方法进行去除,同时去除不合要求的短序列,得到优质序列clean-tags。
根据不同的相似度水平,对所有序列进行OTU划分,对97%相似水平的OTU进行生物信息统计分析。将clean-tags用聚类方式生成OTUs[9]。采用RDP Classifier算法对OTU代表序列进行比对分析,并在门、属、种水平注释其群落的物种信息,得到每个OTU对应的物种分类信息。利用MAFFT进行序列对齐,FastTree进行建树,根据Python语言把物种(属)进化关系进行可视化展示。利用R语言进行主成分统计分析并作图。
2 结果与分析
2.1 丰富性和多样性分析
稀释性曲线[10]可说明样本的测序数据量是否合理。当曲线趋向平坦时,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU。因此,通过作稀释性曲线,可得出样品的测序深度情况。图1为相似度在97%条件下不同品种酿酒葡萄发酵前、中、后期真菌ITS1—ITS2区的稀释曲线,当真菌OTU数量达到70个左右时,曲线开始趋于平缓,说明本研究中样品的取样深度足够,测序数量足以覆盖所有类群。

CGE1-蛇龙珠发酵前期;CGM2-蛇龙珠发酵中期;CGL3-蛇龙珠发酵后期;-赤霞珠发酵前期; CSM2-赤霞珠发酵中期;CSL3-赤霞珠发酵后期;ME1-马瑟兰发酵前期;MM2-马瑟兰发酵中期;ML3-马瑟兰发酵后期(下同)
图1 不同样品稀释曲线
Fig.1 Dilution curves of different samples
Chao1反映菌种丰富度,丰富度即样本中的物种数,样本中物种越多,样本越丰富。物种丰富度不考虑每个物种的相对丰度,它给于相对丰度低的物种与相对丰度高物种相同的权重。如表1所示,不同品种酿酒葡萄发酵前、中、后期真菌的丰富度指数Chao1最大的为发酵中期的马瑟兰,Chao1指数最小的为发酵前期的蛇龙珠,说明这9个样品中发酵中期的马瑟兰物种最丰富,发酵前期的蛇龙珠最少。
表1 不同样品真菌群落的丰富度和多样性指数
Fig.1 Fungi community richness and diversity index of different samples
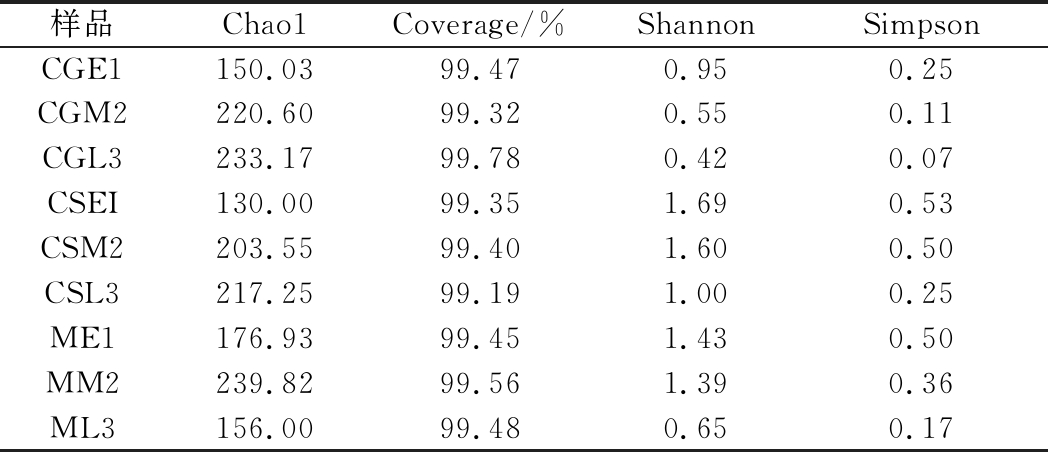
样品Chao1Coverage/%ShannonSimpsonCGE1150.0399.470.950.25CGM2220.6099.320.550.11CGL3233.1799.780.420.07CSEI130.0099.351.690.53CSM2203.5599.401.600.50CSL3217.2599.191.000.25ME1176.9399.451.430.50MM2239.8299.561.390.36ML3156.0099.480.650.17
均匀度反映不同物种的相对丰度。多样性随物种丰富度和均匀度的增加而增加。多样性指数 Shannon 和Simpson,是反映样品中物种丰富度和均匀度的综合指标。Shannon 和Simpson值越高说明群落物种的多样性越高。由表1可知,同一发酵阶段不同品种中,赤霞珠的真菌群落多样性最高,其次是马瑟兰,蛇龙珠最低。同一品种不同发酵阶中,均为发酵前期真菌群落多样性最高,其次是中期,发酵后期真菌群落多样性最低。
2.2 葡萄酒酿造生境真菌系统发育学分析
基于ITS1—ITS2区对真菌种类的区分度,利用MAFFT和FastTree法,以属为单位选取对应丰度最大的OTU的代表序列进行建树。由图2可知,干红葡萄酒酿造生境中主要有114个属,分属7个门,分别是子囊菌门、担子菌门、球囊菌门、壶菌门、梳霉门、油壶菌门和被孢霉门,其中83个为子囊菌门,24个为担子菌门,2个为球囊菌门,2个为壶菌门,1个为梳霉门,1个为油壶菌门,1个为被孢霉门。这表明干红葡萄酒酿造生境中的真菌多样性非常丰富,干红葡萄酒的酿造是多种微生物共同作用的结果,子囊菌门为优势门。
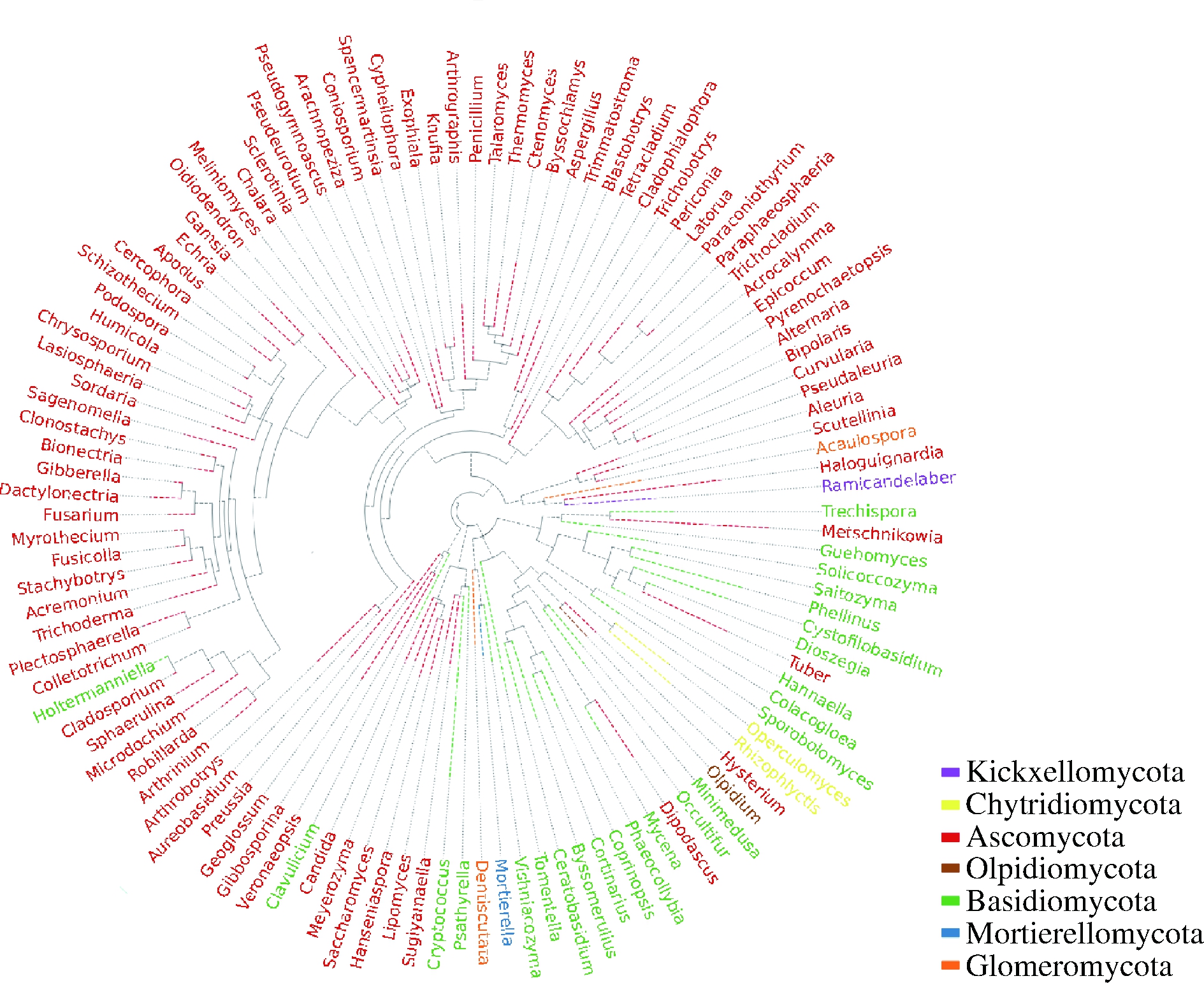
图2 昌黎产区葡萄酒酿造生境真菌系统发育树
Fig.2 Phylogenetic tree of fungi in the winemaking habitat of Changli region
2.3 真菌种类和丰度分析
可视化对比多个样本的群落结构,可以观测其变化情况[11]。如图3-a所示,在门水平,9个样品发酵前中后期真菌群落均以子囊菌门为主,蛇龙珠、赤霞珠、马瑟兰发酵前期子囊菌门的相对丰度分别为92.35%、93.67%、92.92%,随着发酵的进行,相对丰度增加,到蛇龙珠、赤霞珠、马瑟兰发酵后期,分别为98.85%、99.06%、99.36%;其次是未被鉴定的菌门;再次是担子菌门,蛇龙珠、赤霞珠、马瑟兰发酵前期担子菌门的相对丰度分别为0.28%、0.28%、0.69%,随着发酵的进行,丰度逐渐下降,到后期时,分别只有0.22%、0.25%、0.11%。
如图3-b所示,在属水平,9个样品的真菌分布在7个属,分别为汉逊酵母属、酿酒酵母属、未被鉴定的属、短梗霉属、青霉属、被孢霉属、炭疽菌属。发酵前期的蛇龙珠、赤霞珠、马瑟兰样品中汉逊酵母属的相对丰度最大,分别为84.72%、80.26%、81.50%;其次是酿酒酵母属,分别为10.23%、4.97%、3.43%。发酵中期的蛇龙珠、赤霞珠、马瑟兰样品中酿酒酵母属的相对丰度最大,分别为90.40%、63.84%、62.92%;其次是汉逊酵母属,分别为2.62%、33.70%、33.87%。发酵后期的蛇龙珠、赤霞珠、马瑟兰样品中酿酒酵母属的相对丰度最大,分别为96.18%、92.40%、90.62%,其次为汉逊酵母属,分别为1.22%、3.55%、7.87%。由第4天酿酒酵母的相对丰度可知,蛇龙珠的发酵速度较赤霞珠和马瑟兰快,在第4天时酿酒酵母已占绝对优势。

a-门水平;b-属水门
图3 在门和属水平上,不同酿酒葡萄品种发酵前、中、后期真菌群落的差异
Fig.3 Fungal communities early,middle and late fermentation of different wine grape varieties at phylum and genus levels
整体而言,酿酒酵母属在发酵初期开始存在,在发酵中期数量迅速增加,在发酵中后期占绝对优势;而汉逊酵母属在发酵初期大量存在,占绝对优势,随着发酵的进行,中期相对丰度迅速减少,到后期时更低。由此可见,在昌黎产区蛇龙珠、赤霞珠、马瑟兰葡萄酒发酵过程中,早期汉逊酵母属最先发展起来,中后期逐渐让位于酿酒酵母。
2.4 不同酿酒葡萄品种发酵前、中、后期真菌OTUs分析
花瓣图是一种表示样本或组间特有和共有OTU数目的展示方式。每个花瓣代表一个样品,中间的core数字代表的是所有样品共有的OTU数目,花瓣上的数字代表该样品特有的OTU数目。由图4可知,蛇龙珠、赤霞珠、马瑟兰发酵前、中、后期9个样品中共有的OTU数为32。蛇龙珠发酵前中后期的OTU个数分别为133、159、177,赤霞珠发酵前中后期的OTU个数分别为79、132、141,马瑟兰发酵前中后期的OTU个数分别为135、186、109。由此可见,同一产区不同品种酿酒葡萄在发酵过程中菌群既有相同又存在差异。
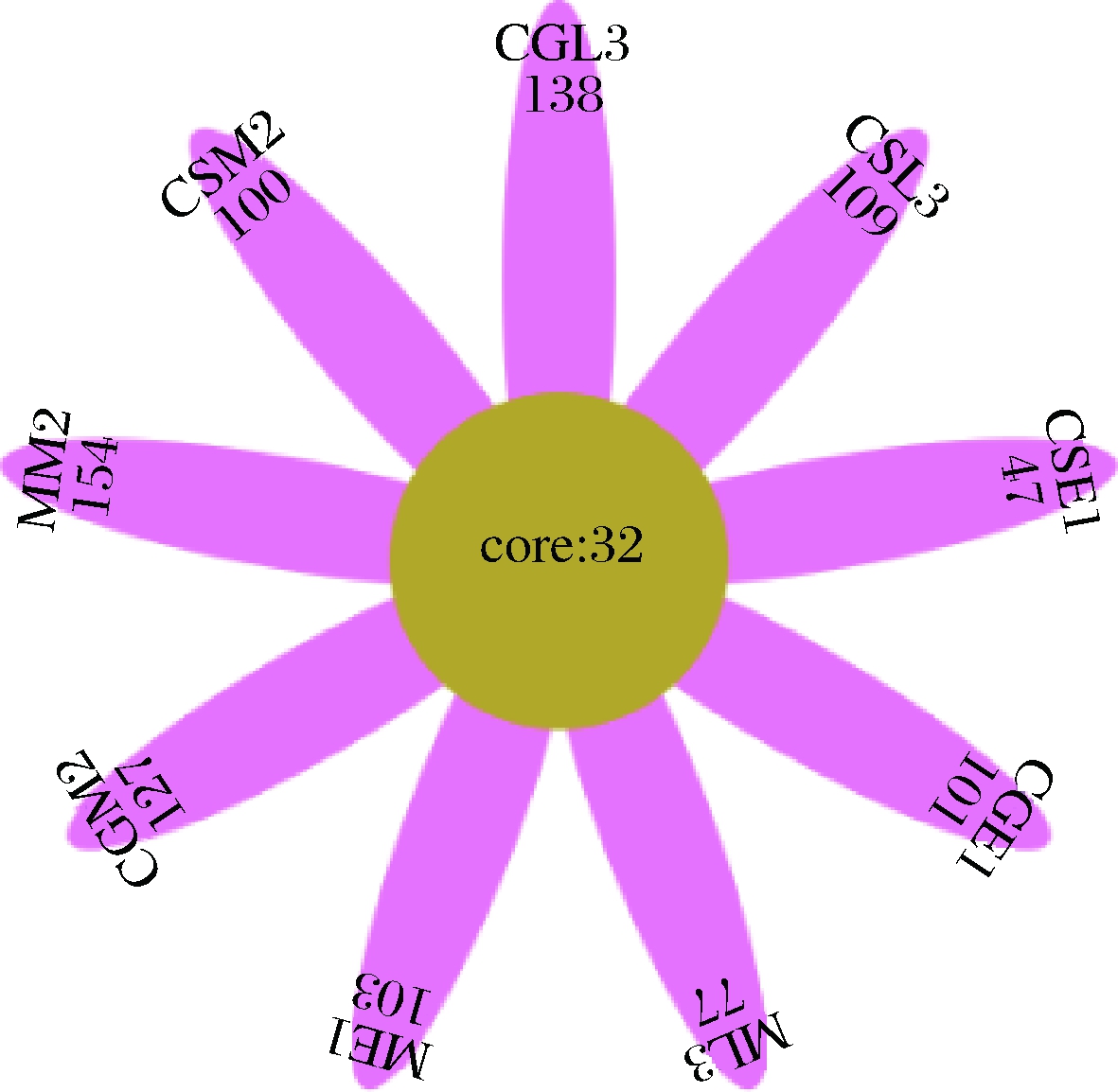
图4 蛇龙珠、赤霞珠、马瑟兰发酵不同时期真菌群落的OTU分布花瓣图
Fig.4 OTU petal distribution of fungal communities in different stages of fermentation in Cabernet Gernischt, Cabernet Sauvignon and Marselan
将32个共有OTU进行丰度分析,得出丰度前20的OTU(表2)分别是:酿酒酵母(Saccharomyces cerevisiae)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、耐渗透压有孢汉逊酵母(Hanseniaspora osmophila)、葡萄园有孢汉逊酵母(Hanseniaspora vineae)、Pseudaleuria sp.、出芽短梗霉(Aureobasidium pullulans)、高山被孢霉(Mortierella alpina)、长被孢霉(Mortierella elongata)、球状小孢葡萄穗霉(Stachybotrys microspora)和普鲁蓝久浩酵母(Guehomyces pullulans)等。
S.cerevisiae是传统的乙醇生产菌株,具有较高的乙醇和其他抑制物耐受性[12-13]。S.cerevisiae作为发酵中后期的主导菌种,通过自身代谢活动和非香型前体物质的释放等方式促进醇类、酯类、萜类、挥发性硫醇等挥发性香气物质的产生[14]。H.uvarum是葡萄园和葡萄酒酿造环境中常见的含量最丰富的非酿酒酵母[15]。H.uvarum促进去甲类异戊二烯类和一些萜烯类糖苷的水解,增加葡萄酒的温带水果和花香特征[16]。H.osmophila可发酵产生乙酸酯类化合物[17]。ZHANG等[18]研究发现H.vineae和S.cerevisiae混合发酵对2-苯基乙酸乙酯的产生具有协同作用,2-苯基乙酸乙酯具桃子香气。
A.pullulans是一类类酵母真菌,存在于葡萄汁和发酵前期。研究发现其能提高葡萄酒中的总花色苷含量、总多酚指数[19]。M.alpina是一种具有很强脂质合成能力的产油丝状真菌。M.elongata、M.alpina等菌种均含有γ-亚油酸、EPA、DHA。S.microspora是一种丝状真菌,该菌在葡萄酒中具有一定的水解纤维素、促进红葡萄汁浸提等的作用[20]。研究发现G.pullulans在低温(8 ℃)下仍能产果胶酶[21]。果胶酶具有提高葡萄出汁率、澄清果汁、提高果皮中花色素苷等多重效果[22-24]。宁亚丽等[25]发现G.pullulans是朝鲜族传统米酒酒曲中的优势菌。虽然这几种菌相对丰度很低,但它们协同的作用,在提高葡萄酒质量和香气塑造等方面同样发挥作用。
表2 不同样品共有OTU
Table 2 Common OTU of different samples
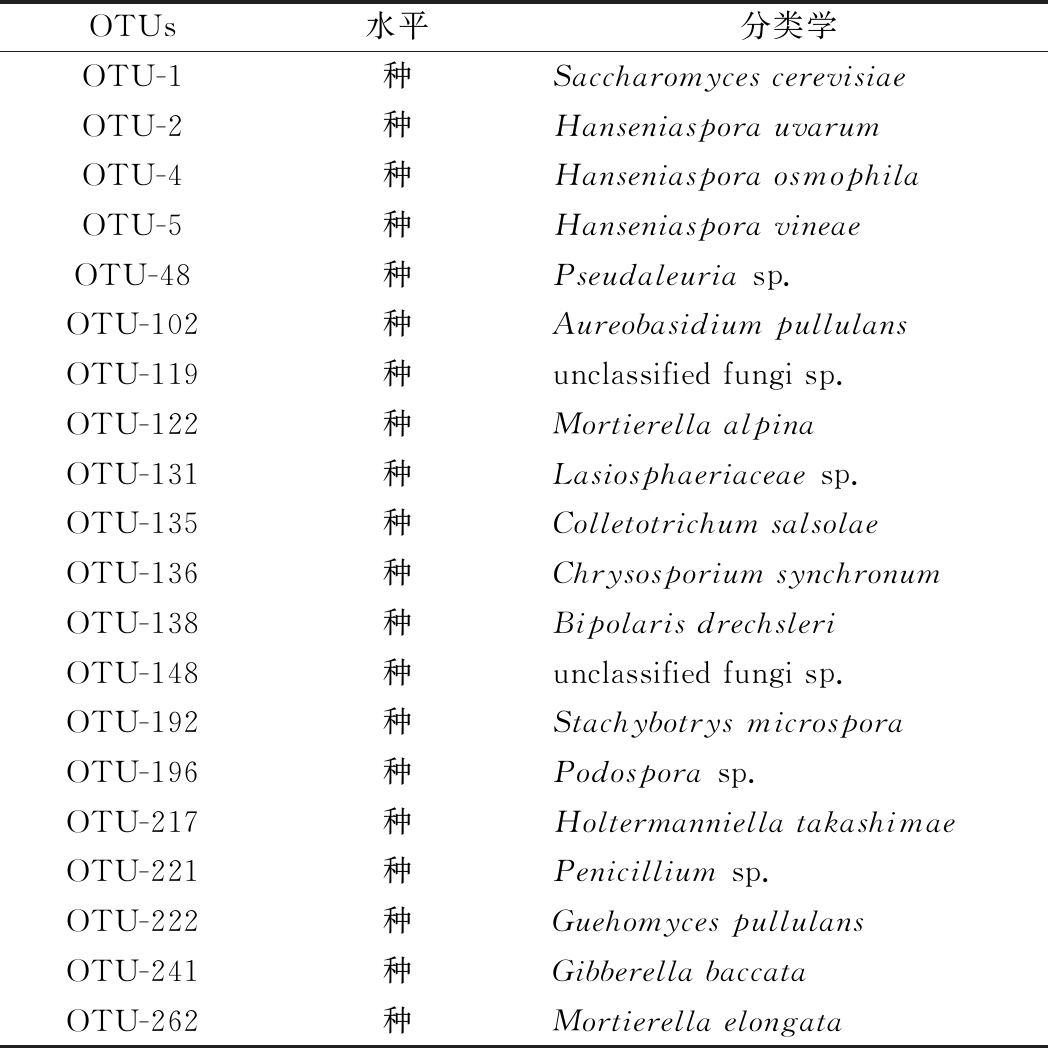
OTUs水平分类学OTU-1种Saccharomyces cerevisiaeOTU-2种Hanseniaspora uvarumOTU-4种Hanseniaspora osmophilaOTU-5种Hanseniaspora vineaeOTU-48种Pseudaleuria sp.OTU-102种Aureobasidium pullulansOTU-119种unclassified fungi sp.OTU-122种Mortierella alpinaOTU-131种Lasiosphaeriaceae sp.OTU-135种Colletotrichum salsolaeOTU-136种Chrysosporium synchronumOTU-138种Bipolaris drechsleriOTU-148种unclassified fungi sp.OTU-192种Stachybotrys microsporaOTU-196种Podospora sp.OTU-217种Holtermanniella takashimaeOTU-221种Penicillium sp.OTU-222种Guehomyces pullulansOTU-241种Gibberella baccataOTU-262种Mortierella elongata
2.5 不同酿酒葡萄发酵过程中真菌群落相似性分析
如图5所示,主成分1和主成分2分别解释了不同品种样品发酵前中后期真菌群落88.94%和5.52%的信息,两主成分之和大于90%,则表明2个成分较好地代表了样品中的真菌群落信息。9份样品之间有一定距离,说明9份样品的真菌群落有一定差异;相比之下,蛇龙珠的3个样品距离较近,差异不大,说明不同发酵时期的蛇龙珠样品真菌群落相似性高;不同发酵时期的赤霞珠样品间距离较大,差异显著,说明发酵前中后期的赤霞珠样品间真菌群落有很大差异;不同发酵时期的马瑟兰样品间距离较大,差异显著,说明发酵前中后期的马瑟兰样品间真菌群落有很大差异。整体来说,不同发酵时期蛇龙珠样品间真菌群落相似性高,赤霞珠和马瑟兰样品间真菌群落差异性高。

图5 不同样品真菌群落主成分分析图
Fig.5 Principal component analysis of fungal communities in different samples
3 结论
通过高通量测序技术对昌黎产区3种酿酒葡萄品种发酵过程中真菌群落进行分析,得出发酵前期葡萄醪中主要优势菌为汉逊酵母属,发酵中后期优势菌为酿酒酵母;不同品种不同发酵阶段样品中均有酿酒酵母、葡萄汁有孢汉逊酵母、耐渗透压有孢汉逊酵母、葡萄园有孢汉逊酵母、出芽短梗霉、高山被孢霉、长被孢霉、球状小孢葡萄穗霉、普鲁蓝久浩酵母等;相对于汉逊酵母属和酿酒酵母,其他几种菌的相对丰度很小,分别仅占0.001%~1.300%左右;除蛇龙珠样品外,同一品种不同发酵阶段真菌组成差异显著。本实验结果为深入研究河北昌黎地区葡萄酒中微生物群落结构及其对葡萄酒风格塑造方面的影响提供了理论基础。
[1] 张世伟,陈曦,钟其顶,等.不同品种酿酒葡萄表皮微生物群落多样性分析[J].生物技术通报,2017,33(3):128-137.
ZHANG S W,CHEN X,ZHONG Q D,et al.Microbial communities on the wine grape surfaces of different cultivars[J].Biotechnology Bulletin,2017,33(3):128-137.
[2] 吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
WU C,WANG C X,WANG X D,et al.A review of the application of high-throughput sequencing technology in analysis of the diversity of microbial communities involved in the fermentation of alcoholic beverages[J].Food Science,2019,40(3):348-355.
[3] 胡博然,李华.不同酿酒葡萄品种浆果香味成分的GC-MS分析[J].食品与发酵工业,2005,31(12):89-92.
HU B R,LI H.Analysis of aromatic composition in the different wine-grapes by gas chromatography-mass spectrometry[J].Food and Fermentation Industries,2005,31(12):89-92.
[4] 胡博然,杨新元,汪志君,等.贺兰山东麓地区葡萄酒香气成分分析研究[J].农业机械学报,2005,36(12):87-90;113.
HU B R,YANG X Y,WANG Z J,et al.Analysis of aromatic composition in different mono-varietal dry wines from eastern region of Ningxia Helan mountain[J].Transactions of the Chinese Society for Agricultural Machinery,2005,36(12):87-90;113.
[5] JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science and Technology,2017,63:18-28.
[6] PORTILLO M D C,FRANQUÉS J,ARAQUE I,et al.Bacterial diversity of Grenache and Carignan grape surface from different vineyards at Priorat wine region (Catalonia,Spain)[J].International Journal of Food Microbiology,2016,219:56-63.
[7] ZHANG S W,CHEN X,ZHONG Q D,et al.Microbial community analyses associated with nine varieties of wine grape carposphere based on high-throughput sequencing[J].Microorganisms,2019,7(12):E668.
[8] SETATI M E,JACOBSON D,BAUER F F.Sequence-based analysis of the Vitis vinifera L.cv Cabernet Sauvignon grape must mycobiome in three South African vineyards employing distinct agronomic systems[J].Frontiers in Microbiology,2015,6:1 358.
[9] EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[10] AMATO K R,YEOMAN C J,KENT A,et al.Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J].The ISME Journal,2013,7(7):1 344-1 353.
[11] OBERAUNER L,ZACHOW C,LACKNER S,et al.The ignored diversity:Complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J].Scientific Reports,2013,3(1).DOI:10.1038/srep01413.
[12] 赵雪平, 郑海武,雷蕾,等.本土酿酒酵母发酵梅鹿辄干红动态变化研究[J].食品与发酵工业,2020,46(8):105-110.
ZHAO X P,ZHENG H W,LEI L,et al.Study on the dynamic change of Merlot red fermented by local Saccharomyces cerevisiae[J].Food and Fermentation Industries,2020,46(8):105-110.
[13] HU B R,CAO Y,ZHU J Y,et al.Analysis of metabolites in chardonnay dry white wine with various inactive yeasts by 1H NMR spectroscopy combined with pattern recognition analysis[J].AMB Express,2019,9(1):1-14.
[14] 杨婕, 王玉华,米兰,等.耐热克鲁维酵母与酿酒酵母顺序接种发酵对霞多丽干白葡萄酒感官品质的影响[J].食品与发酵工业,2019,45(18):144-154.
YANG J,WANG Y H,MI L,et al.Effects of sequential fermentation of Lachancea thermotolerans and Saccharomyces cerevisiae on the quality of Chardonnay dry white wine[J].Food and Fermentation Industries,2019,45(18):144-154.
[15] 赵悦,孙庆扬,杨宽,等.香格里拉产区特色非酿酒酵母及自然发酵葡萄酒香气成分的研究[J].中国酿造,2018,37(10):93-100.
ZHAO Y,SUN Q Y,YANG K,et al.Characteristic non-Saccharomyces from Shangri-La wine producing regions and aroma components of spontaneously fermented wine[J].China Brewing,2018,37(10):93-100.
[16] 陶永胜,朱晓琳,马得草,等.葡萄汁有孢汉逊酵母糖苷酶增香酿造葡萄酒的潜力分析[J].农业机械学报,2016,47(10):280-286.
TAO Y S,ZHU X L,MA D C,et al.Application of glycosidase from Hanseniaspora uvarum on wine aroma enhancement[J].Transactions of the Chinese Society for Agricultural Machinery,2016,47(10):280-286.
[17] VIANA F,GIL J V,VALLÉS S,et al.Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J].International Journal of Food Microbiology,2009,135(1):68-74.
[18] ZHANG B Q,XU D D,DUAN C Q,et al.Synergistic effect enhances 2-phenylethyl acetate production in the mixed fermentation of Hanseniaspora vineae and Saccharomyces cerevisiae[J].Process Biochemistry,2020,90:44-49.
[19] MER N M G,MORATA DE AMBROSINI V I.Application of a grape surface majority pectinolytic species,Aureobasidium pullulans,to low-temperature red winemaking:Development and stability of wine colour[J].Journal of Wine Research,2020,31(3):218-239.
N M G,MORATA DE AMBROSINI V I.Application of a grape surface majority pectinolytic species,Aureobasidium pullulans,to low-temperature red winemaking:Development and stability of wine colour[J].Journal of Wine Research,2020,31(3):218-239.
[20] ABDELJALIL S,BEN HMAD I,SAIBI W,et al.Investigations on hydrolytic activities from Stachybotrys microspora and their use as an alternative in yeast DNA extraction[J].Applied Biochemistry and Biotechnology,2014,172(3):1 599-1 611.
[21] CAVELLO I,ALBANESI A,FRATEBIANCHI D,et al.Pectinolytic yeasts from cold environments:Novel findings of Guehomyces pullulans,Cystofilobasidium infirmominiatum and Cryptococcus adeliensis producing pectinases[J].Extremophiles,2017,21(2):319-329.
[22] 梁彬, 孙婵婵,张民.澄清型葡萄汁工艺研究[J].食品研究与开发,2018,39(23):75-81.
LIANG B,SUN C C,ZHANG M.Research on technology of clarified grape juice[J].Food Research and Development,2018,39(23):75-81.
[23] LIU P T,LU L,DUAN C Q,et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Science and Technology,2016,71:356-363.
[24] RENAULT P,COULON J,DE REVEL G,et al.Increase of fruity aroma during mixed T.delbrueckii/S.cerevisiae wine fermentation is linked to specific esters enhancement[J].International Journal of Food Microbiology,2015,207:40-48.
[25] 宁亚丽, 吴跃,何嫱,等.基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J].食品科学,2019,40(16):107-114.
NING Y L,WU Y,HE Q,et al.Analysis of microbial community diversity in Chinese Korean traditional rice wine and its starter culture using high-throughput sequencing[J].Food Science,2019,40(16):107-114.