酒酒球菌(Oenococcus oeni)作为启动MLF的优良菌种,可将来源于葡萄果实的L-苹果酸转化为圆润的L-乳酸,改善口感、增加微生物稳定性[1-2],并通过自身代谢释放挥发性香气物质,修饰葡萄酒的风味,提高感官品质[3]。虽然MLF在适宜条件下可自发启动,但过程缓慢且结果难以预测,往往不能得到令人满意的结果[4-5],而人工接种优良的酒酒球菌快速启动MLF不仅可以提高酒质,而且可以缩短发酵周期,降低生产成本。
在实际生产中,为防止商业菌株大量使用而导致的葡萄酒同质化问题,筛选产区O.oeni菌种是增强葡萄酒地域特征的有效方法。张春晖[6]对我国葡萄酒主产区的苹果酸-乳酸菌进行分离和鉴定,获得了发酵性能优良的O.oeni菌株。薛雪[7]从宁夏银川葡萄酒样中分离出1株具有良好降酸能力和产香能力的O.oeni菌株。在酿造过程中,由于酵母与乳酸菌可能存在协同、拮抗等相互作用,因此传统的MLF接种方式主要以酒精发酵(alcohol fermentation,AF)结束后的顺序接种为主[8]。有学者认为,与顺序接种相比,同时接种O.oeni菌株混合发酵过程中对酒精浓度的逐渐适应,以及葡萄汁中更高的有效性营养,可使MLF更容易成功[9-10]。KNOLL等[8]在研究中没有观察到同时发酵对葡萄酒挥发性香气成分的负面影响,且发酵酒样中乙酯和乙酸酯浓度更高。同时接种在节约了更多的发酵时间的同时降低了腐败微生物生长的风险[11-12]。赵现华等[13]通过不同的MLF接种方式酿造蛇龙珠葡萄酒,发现顺序接种发酵的葡萄酒中挥发性物质总量较高。TRISTEZZA等[14]发现同时接种在减少发酵时间的同时可降低挥发酸,且葡萄酒体显示出与酯相关的红色水果味以及与琥珀酸二乙酯和乳酸乙酯相关的黄油和奶油味。李凭等[15]在AF不同时间接入植物乳杆菌与酵母混合发酵,证实AF第1天接入植物乳杆菌的发酵方式在加快了发酵速率的同时,其酒样酸度、高级醇含量降低,酯类含量有明显的提高。
甘肃河西走廊作为我国葡萄酒特色产区之一,具有生产高品质葡萄酒的天然优势。本研究以赤霞珠酿酒葡萄为原料,以酿酒酵母纯种发酵为对照,采用甘肃河西走廊葡萄酒产区本土O.oeni菌株GF-2、ZX-1,及商业菌VP41,按照不同接种方式进行MLF,分析其对干红葡萄酒的主要挥发性香气物质的影响,以期为生产具有产区微生物特色的葡萄酒提供理论基础和技术支持。
1 材料与方法
1.1 材料与菌种
葡萄酒酵母:Aroma White酵母(Saccharomyces cerevisiae),购于意大利Enartis公司。
酿酒葡萄赤霞珠:2019年9月24日采摘自甘肃农业大学葡萄园(北纬36°5′25″、东经103°41′32″),总糖为208.00 g/L,可滴定酸(以酒石酸计)6.088 g/L,成熟度良好。
酒酒球菌菌株:本土O.oeni GF-2、ZX-1菌株均分离自河西走廊葡萄酒产区,由甘肃省葡萄与葡萄酒工程学重点实验室鉴定并保存。
商业乳酸菌:乳酸菌(LALVIN VP41),原产法国,购自上海康禧食品饮业有限公司。
ATB培养基[16]:葡萄糖10 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,琼脂20 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,半胱氨酸盐酸盐0.5 g/L,番茄汁25%(体积分数),使用1 mol/L NaOH调pH值至4.8,121 ℃灭菌20 min。
试剂:L-苹果酸检测试剂盒,爱尔兰Megazyme公司;2-辛醇(内标物),乙酸乙酯、乙酸异戊酯、己酸甲酯、己酸乙酯、癸酸乙酯、辛酸、金合欢醇、香叶醇、β-香茅醇、(Z)-橙花叔醇、α-萜品醇、β-大马士酮、里那醇、苯乙醇、戊醇、己醇等香气标准品均为色谱纯,美国Sigma公司;葡萄糖、蛋白胨、酵母浸粉、偏重亚硫酸钠、果胶酶、MgSO4、MnSO4、NaOH、无水乙醇等均为分析纯,购自天津光复化工研究所。
1.2 仪器与设备
生化培养箱(LRH),上海一恒科学仪器有限公司;超净工作台(SW-CJ-2FD),苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅(LDZX-50KBS),上海申安医疗器械厂;紫外可见分光光度计(UV-6100),上海元析仪器有限公司;气相色谱-质谱联用仪(TRACE 1310-ISQ)、单四级杆质谱仪(ISQ),美国Thermo Scientific公司;色谱柱(DB-WAX),美国Agilent Technologies公司;固相微萃取装置、萃取头(50/30 μm DVB/CAR-PDMS),美国Surpelco公司。
1.3 实验方法
1.3.1 菌种活化
酿酒酵母菌株活化:将酿酒酵母(Aroma White酵母)菌株干粉溶于10倍体积的dd H2O中,在28 ℃恒温水浴活化10 min;再加入等体积的赤霞珠葡萄汁,23 ℃恒温水浴活化10 min。
酒酒球菌菌株活化与培养:按要求配制ATB液体培养基,于121 ℃湿热条件灭菌20 min后,在超净工作台中静置冷却。取斜面冷冻保存的O.oeni菌株,室温下2 h后,挑取2环接种于ATB液体培养基中,于28 ℃生化培养箱中扩大培养。
商品菌株VP41按照产品使用说明(0.01 g/L)进行活化。将VP41活性干粉溶于10倍体积的dd H2O中,28 ℃恒温水浴活化10 min;再加入等体积赤霞珠葡萄汁,23 ℃恒温水浴活化10 min。
1.3.2 接种方式
本试验采取同时接种(接种酿酒酵母24 h后接种酒酒球菌)和顺序接种(AF发酵结束后)2种方式,分别接入本土酒酒球菌GF-2、ZX-1和商品菌VP41,同时设置空白对照CK。同时接种酒样编号:T-GF、T-ZX、T-VP41;顺序接种酒样编号:S-GF、S-ZX、S-VP41。每个处理重复3次。
1.3.3 葡萄酒酿造试验
1.3.3.1 工艺流程[17]
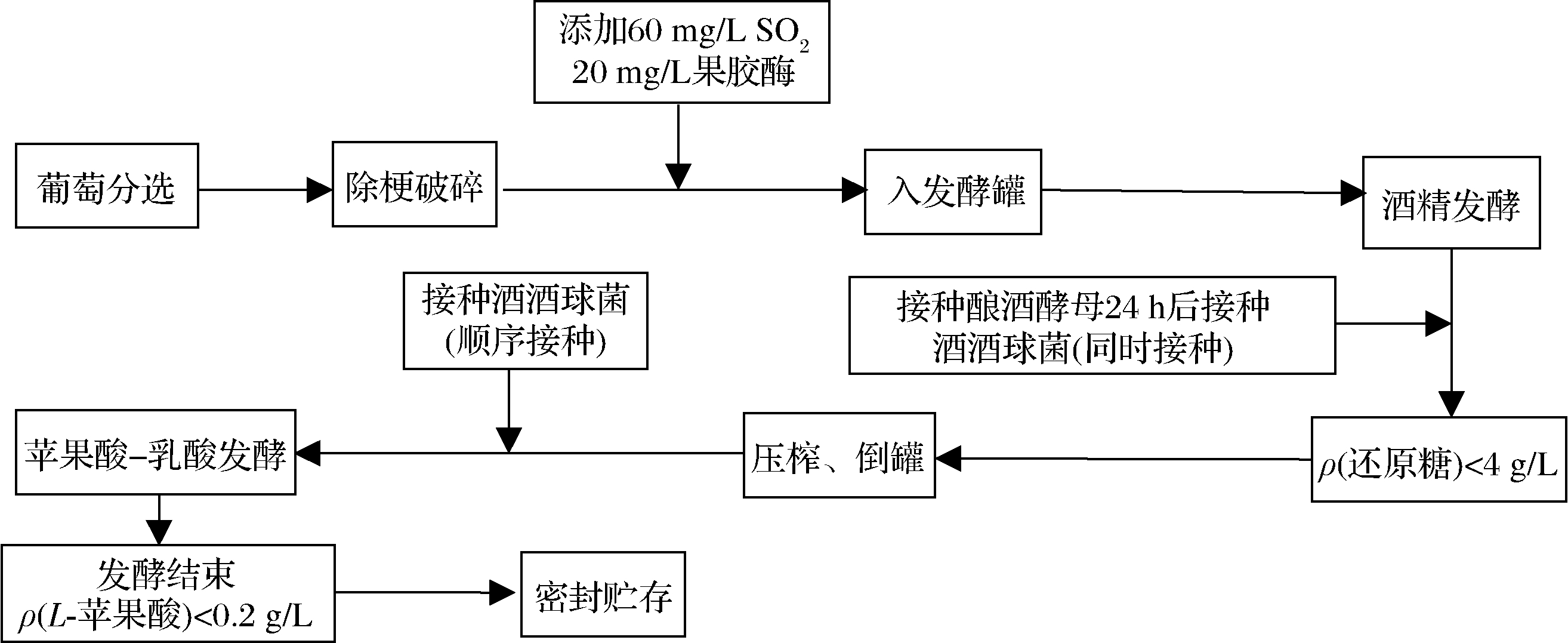
工艺要点:赤霞珠酿酒葡萄采收后人工筛选、除梗破碎,装入5.0 L发酵容器中,装液量为4.0 L,添加60 g/L SO2、20 mg/L果胶酶,纱布封口,室温静置12 h,然后根据1.3.2分别按酿酒酵母0.2 g/L、商业菌VP41 0.01 g/L、本土O.oeni 5%接种启动AF和MLF,MLF结束[ρ(L-苹果酸)<0.2 g/L]后取样待测。
1.3.4 葡萄酒理化指标测定
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》分析测定葡萄酒中pH值、残糖、总酸、挥发酸、酒精度等基本理化指标[18]。L-苹果酸测定参照试剂盒说明进行操作,测定发酵酒样中L-苹果酸含量。
1.3.5 葡萄酒中挥发性香气成分提取检测
参考祝霞等[19]的方法,使用HS-SPME和GC-MS技术对不同试验处理的酒样的香气物质进行检测。
香气成分富集:取8 mL待测酒样于15 mL顶空瓶中,加入2.5 g NaCl和10 μL内标物(质量浓度81.06 mg/L),加磁力搅拌转子后密封并摇匀,置于恒温磁力搅拌器中,40 ℃水浴平衡30 min后顶空萃取30 min。GC-MS分析条件:DB-WAX毛细管色谱柱(60 m×2.5 mm×0.25 μm);进样口温度240 ℃,进样5 min,不分流进样;柱温升温程序:初温50 ℃保持5 min,再以3.0 ℃/min升温至200 ℃,保持15 min;载气高纯氦气(He)流速1 mL/min;MS条件:电子轰击离子源;电子能量70 eV;质谱扫描范围m/z 20~350。
1.3.6 挥发性香气成分的定性与定量分析
定性与定量:参考祝霞等[19]的方法,采用保留指数(retention index,RI)和NIST-11、Wiley及香精香料谱库检索比对,结合谱图分析进行定性,确定香气物质。对已有的标准品的酯类、高级醇、萜烯类等化合物,利用其标准曲线(R2>0.995)进行定量,无标准品的香气化合物采用化学结构、官能团相似、碳原子数相近的标准物质进行半定量。
1.4 葡萄酒感官评价
参照VARELA等[20]的方法,略作修改。所有酒样进行随机编号,并由10名具有一定葡萄酒品尝经验或经过专业培训的人员(男女各5人)对酒样进行感官评定。分别从外观(澄清度、颜色强度),香气(花香、果香、甜味、脂肪味)和风味(酸度、浓郁度、余味长短、平衡感)共10个方面对酒样进行评价,使用10分结构化数值进行量化,0~10分表示感官逐渐增强。
1.5 数据统计与处理
根据葡萄酒酿造试验所得数据采用Microsoft Office Excel 2019、Origin 2018以及SPSS 20.0软件进行基本统计分析与数据处理。
2 结果与分析
2.1 主要理化指标分析
表1为2种不同接种方式发酵得到的赤霞珠干红葡萄酒的基本理化指标。由表1可知,各理化指标均符合GB/T 15037—2006的要求。T-GF、T-ZX、T-VP41、S-GF、S-ZX、S-VP41等6个处理组的残糖、L-苹果酸、总酸含量显著低于对照组CK(P<0.05),pH值和挥发酸含量均高于对照组CK,说明MLF在降低L-苹果酸、柔化酒体酸度的同时还消耗了部分还原糖,减少了二次发酵风险。就接种方式来看,同时接种的处理组总酸、挥发酸、色度、色调均显著高于顺序接种组(P<0.05)。同时接种(即AF、MLF同时进行)耗时10 d,顺序接种(AF结束后接种乳酸菌启动MLF)耗时21 d。
表1 赤霞珠干红葡萄酒基本理化指标分析
Table 1 Analysis of basic physical and chemical indexes of Cabernet Sauvignon dry red wine
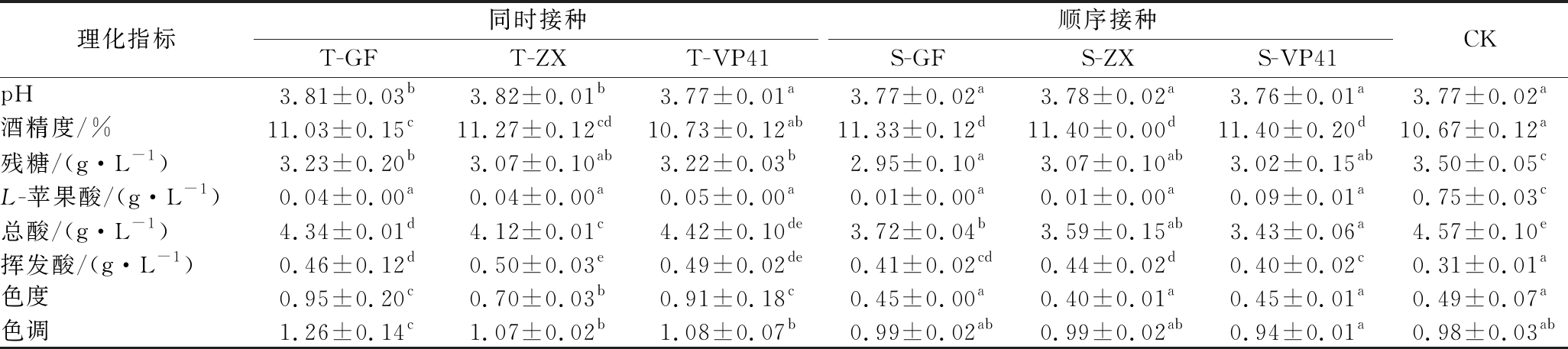
理化指标同时接种顺序接种T-GFT-ZXT-VP41S-GFS-ZXS-VP41CKpH3.81±0.03b3.82±0.01b3.77±0.01a3.77±0.02a3.78±0.02a3.76±0.01a3.77±0.02a酒精度/%11.03±0.15c11.27±0.12cd10.73±0.12ab11.33±0.12d11.40±0.00d11.40±0.20d10.67±0.12a残糖/(g·L-1)3.23±0.20b3.07±0.10ab3.22±0.03b2.95±0.10a3.07±0.10ab3.02±0.15ab3.50±0.05cL-苹果酸/(g·L-1)0.04±0.00a0.04±0.00a0.05±0.00a0.01±0.00a0.01±0.00a0.09±0.01a0.75±0.03c总酸/(g·L-1)4.34±0.01d4.12±0.01c4.42±0.10de3.72±0.04b3.59±0.15ab3.43±0.06a4.57±0.10e挥发酸/(g·L-1)0.46±0.12d0.50±0.03e0.49±0.02de0.41±0.02cd0.44±0.02d0.40±0.02c0.31±0.01a色度0.95±0.20c0.70±0.03b0.91±0.18c0.45±0.00a0.40±0.01a0.45±0.01a0.49±0.07a色调1.26±0.14c1.07±0.02b1.08±0.07b0.99±0.02ab0.99±0.02ab0.94±0.01a0.98±0.03ab
注:表中同一指标不同字母表示差异显著,样本量n=3,P<0.05
2.2 挥发性香气物质分析
本试验利用GC-MS对不同试验处理酒样的挥发性物质进行检测(详细数据见增强出版附件表1[21-25]),不同接种方式酿造的赤霞珠干红葡萄酒中挥发性化合物的种类及含量见图1。综合分析,不同接种方式、菌株发酵的酒样产生的同类化合物种类和含量均存在差异。本试验7组不同处理的酒样共检测出81种挥发性化合物,其中酯类30种,醇类27种,酸类7种,萜烯类8种以及9种其他类化合物。7个处理组挥发性化合物种类及含量分别为T-GF(56种,23 044.75 μg/L)、T-ZX(68种,18 048.56 μg/L)、T-VP41(72种,20 804.74 μg/L)、S-GF(59种,20 278.77 μg/L)、S-ZX(62种,19 715.60 μg/L)、S-VP41(69种,19 253.31 μg/L)、CK(59种,11 609.68 μg/L)。
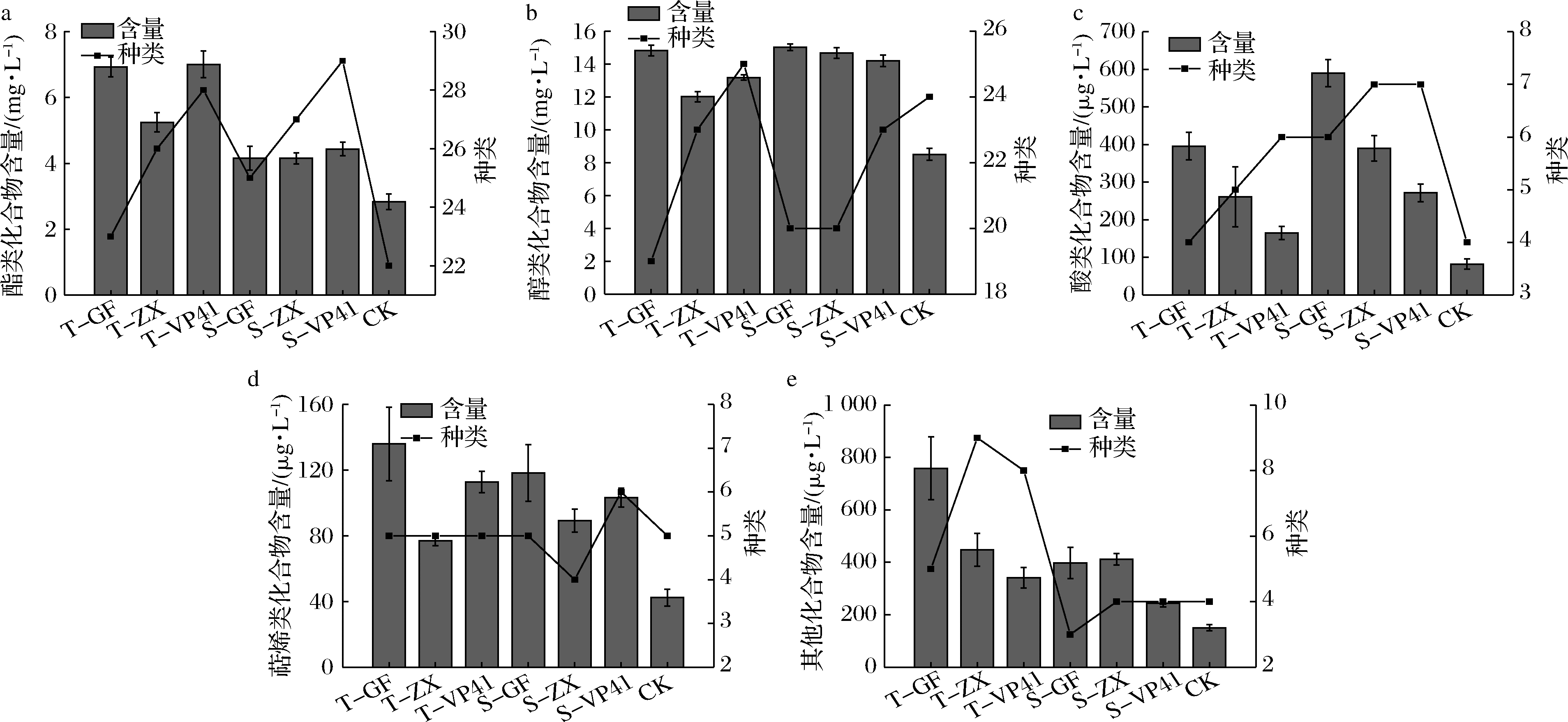
a-酯类化合物;b-醇类化合物;c-酸类化合物;d-萜烯类化合物;e-其他类物质
图1 葡萄酒挥发成分的GC-MS分析
Fig.1 Volatile components of wine samples by GC-MS analysis
2.2.1 酯类化合物
酯类化合物大多呈现水果香气。如乙酸乙酯、丁二酸二乙酯、己酸乙酯、乙酸异戊酯、壬酸乙酯、辛酸乙酯以及癸酸乙酯等,具有苹果、草莓、香蕉和桃李等水果香[26-27]。本实验7个不同处理组共检测出30种酯类化合物。由增强出版附表1可知,未进行MLF的空白对照组酯类化合物含量及种类(CK:2 832.59 μg/L,22种)明显低于其他MLF处理组(P<0.05)。同时接种的3个处理组酯类化合物含量显著高于顺序接种处理组(P<0.05),尤其是乙酯类化合物,极大地丰富了酒体的果香味;同一种接种处理组也存在菌株差异,同时接种处理组的VP41菌株酯类化合物种类、含量均占有明显优势,本土O.oeni GF-2、ZX-1次之。
2.2.2 醇类化合物
高级醇属于酵母酒精发酵过程中糖代谢和氨基酸转化的次级代谢产物之一[28]。由增强出版附表1可知,醇类化合物在所有挥发性物质中含量占比最大,本研究中共检测到27种醇类化合物,7组种类及含量分别为T-GF(19种,14 830.95 μg/L)、T-ZX(23种,12 017.72 μg/L)、T-VP41(25种,13 181.66 μg/L)、S-GF(20种,15 017.22 μg/L)、S-ZX(20种,14 675.77 μg/L)、S-VP41(23种,14 200.29 μg/L)、CK(24种,8 502.18 μg/L),除未进行MLF的空白对照组高级醇含量较低外,其余7组无明显差异,且与同时接种处理组相比,顺序接种组醇类化合物含量较高。同时,苯乙醇(玫瑰香、桃子味)、戊醇(辣味)、正己醇(酒精味、青草香)、异丁醇(水果香、花香)含量占比较大。无论同时还是顺序接种处理,本土O.oeni GF-2均比ZX-1具有明显优势。7组酒样均含一定量的苯乙醇,使酒体具有独特的紫罗兰香、丁香、茴香和玫瑰香味。
2.2.3 酸类化合物
酸类化合物一般来源于葡萄酒发酵过程中酵母和乳酸菌代谢所得的副产物,其多数化合物具有醋酸、腐臭及不愉快的脂肪酸味,但在较低浓度时可平衡酒体果香,赋予酒体特殊奶酪味[29-30]。由增强出版附表1可知,本试验共检测到7种酸类化合物,其中T-GF(4种,395.57 μg/L)、T-ZX(5种,260.79 μg/L)、T-VP41(6种,164.95 μg/L)、S-GF(6种,589.62 μg/L)、S-ZX(7种,389.68 μg/L)、S-VP41(7种,271.69 μg/L)、CK(4种,81.91 μg/L)。对比空白对照处理CK可知,MLF可明显提高葡萄酒酸类化合物含量。本土O.oeni GF-2、ZX-1产生有机酸含量均高于商业菌株VP41,且GF-2、ZX-1菌种间也存在较大差异。
2.2.4 萜烯类化合物
萜烯类化合物在葡萄酒香气成分中具有较大的贡献,其香气感官阈值极低,因此少量的萜烯类物质即可赋予葡萄酒较好的花果香和品种香[20,31]。由增强出版附表1可知,本实验7个处理组酒样共检测到8种萜烯类化合物,分别为香茅醇、橙花醇、香叶醇、松油醇、四氢薰衣草醇、大马士酮、香叶基丙酮和β-紫罗酮,且7个酒样中萜烯类含量由高到低为T-GF>T-VP41>S-GF>S-VP41>S-ZX>T-ZX>CK。CK组萜烯类化合物含量明显低于其他6组,所以MLF可以提高葡萄酒萜烯类化合物含量,赋予酒体强烈的花果香,进而丰富葡萄酒整体风味。
2.2.5 其他化合物
由增强出版附表1可知,7个不同处理的酿造酒样除酯类、醇类、酸类及萜烯类化合物外,还检测到醛、酮、酚、醚等9种其他化合物,其中苯甲醛(烘烤味、苦杏仁味)、甲基庚烯酮(水果香)赋予葡萄酒特殊的风味。对比空白对照CK组可知,MLF可明显提高挥发性化合物种类及含量,同时接种处理较顺序接种处理在挥发性化合物种类及含量上均具有明显优势。
2.3 挥发性化合物主成分分析
由于本试验检测到的挥发性化合物种类多、含量差异较大,因此采用主成分分析法确定不同接种方式酿造的赤霞珠干红葡萄酒的特征成分。对不同接种处理酒样的81种挥发性化合物以特征值>1提取主成分,进行主成分分析,并对葡萄酒香气特征贡献不大的香气成分因子舍去,最后剩余19种成分构成整个原始数据的主成分,得到PC1、PC2和PC3的方差贡献率分别为48.334%、23.085%和13.572%,三个主成分累计方差贡献率为84.991%,代表原始数据84.991%的信息。各挥发性化合物在PC1、PC2和PC3上的因子载荷图及挥发性化合物主成分分析酒样分布图见图2、图3。
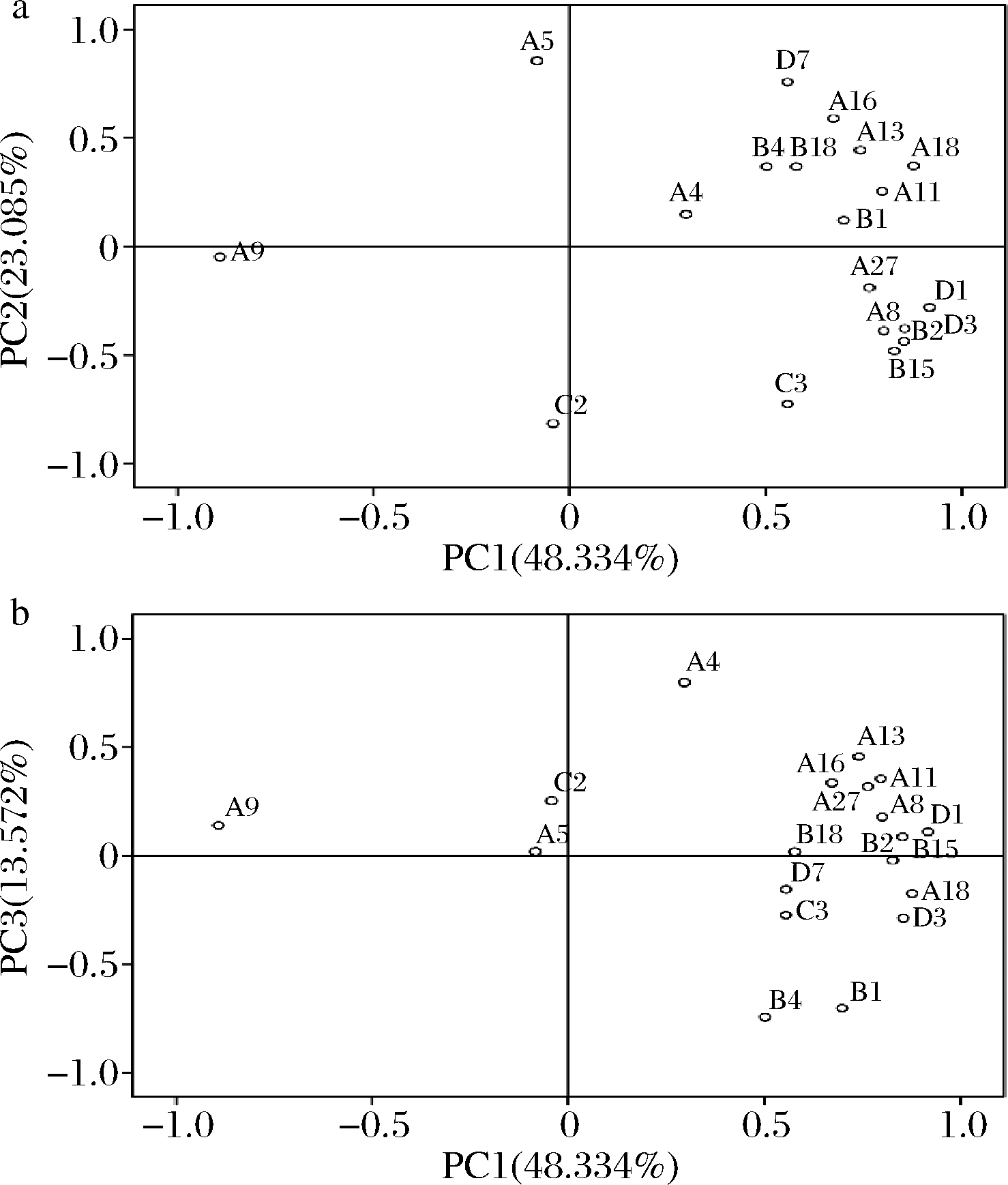
a-PC1-PC2;b-PC1-PC3
图2 挥发性化合物主成分分析的因子载荷图
Fig.2 Factor loading plots of PCA for volatile aroma compounds
由图2可知,月桂酸乙酯(花果香气)、乙酸苯乙酯(玫瑰花香、苹果香)苯甲醇(花香、果香)、苯乙醇(蜂蜜香、玫瑰、蔷薇香)、正己醇(水果香、花香)、香叶醇(玫瑰花香、柠檬、天竺葵味)、香茅醇(柠檬、柑橘香)等物质在PC1正半轴上的得分较高,即PC1正半轴主要反映了葡萄酒中的花果香特征,而PC1负半轴反映的香气信息较少;乙酸乙酯(水果香、酯香)、癸酸乙酯(脂肪酸味、水果味)、辛酸乙酯(花果香、杏子香)、辛酸甲酯(柑橘香气)、乙酸异戊酯(水果香、酸甜味)等物质在PC2正半轴上的得分较高,即PC2正半轴主要反映了果香、脂肪香的香气特征;而化合物2-甲基丁酸(黄油、乳酪味)、辛酸(奶油味)、戊醇(杂醇油气味、辣味)等物质在PC3正半轴上的得分较高,即代表葡萄酒的奶酪香特征。
由图3可知,T-GF、S-GF、S-VP41和T-VP41酒样位于香气化合物集聚的区域,其中T-GF、S-GF及S-VP41处理酒样分布在PC1正半轴及PC2负半轴,代表了果香、花香、乳酪等奶香味的萜烯类和酸类化合物香气特征信息。而T-VP41酒样则处于PC1和PC2正半轴,主要代表了花果香的酯类及醇类化合物香气特征信息。T-ZX和S-ZX代表了PC1负半轴和PC2正半轴的特征挥发性化合物信息,主要是乙酸乙酯、丁酸乙酯、辛酸甲酯,赋予葡萄酒浓郁的花果香和酯香,增加其香气复杂性。空白处理组CK处于PC1和PC2的负半轴,该区域挥发性化合物较少,且CK处理酒样与其他6组处理相距较远,推断该处理香气物质较为单一,与其他处理组差异较大。
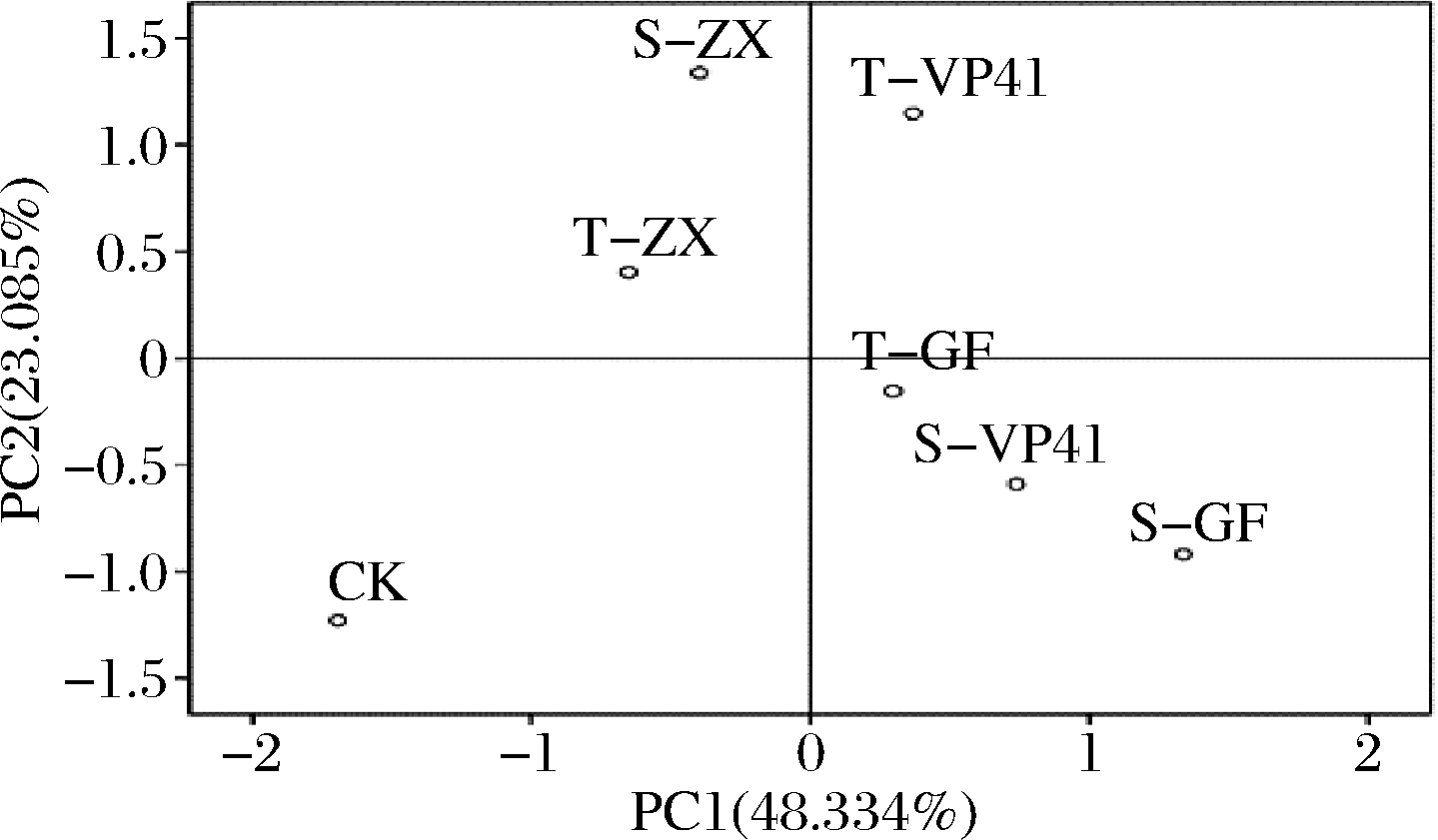
图3 挥发性化合物主成分分析的酒样分布图
Fig.3 Score plots of wine samples for PCA of the volatile aroma compounds
2.4 赤霞珠干红葡萄酒感官评价结果分析
由图4可知,在外观(色泽、澄清度)方面CK处理组分值较低,与MLF处理组有较为明显的差异;从香气(花香、果香、甜味、脂肪味)方面分析,MLF可明显增强葡萄酒花果香,使其口感变得更加柔和圆润。同时接种酒样花香、澄清度、色泽的评分均高于顺序接种酒样,且T-GF处理组酒样的花果香较为突出,本土O.oeni菌株GF-2、ZX-1的酸度、平衡感、余味长短无明显差异,但均高于商业菌株VP41和CK处理组。整体而言,MLF后酒样在香气、余味长短、平衡感方面均高于CK组,这是由于MLF提高了酒样中的酯类、醇类及酸类化合物含量,这与KNOLL等[8]的研究结果一致。综合分析,利用本土O.oeni进行同时接种MLF后的葡萄酒花果香较为突出,外观澄清度好,酒体平衡感、浓郁度较强。
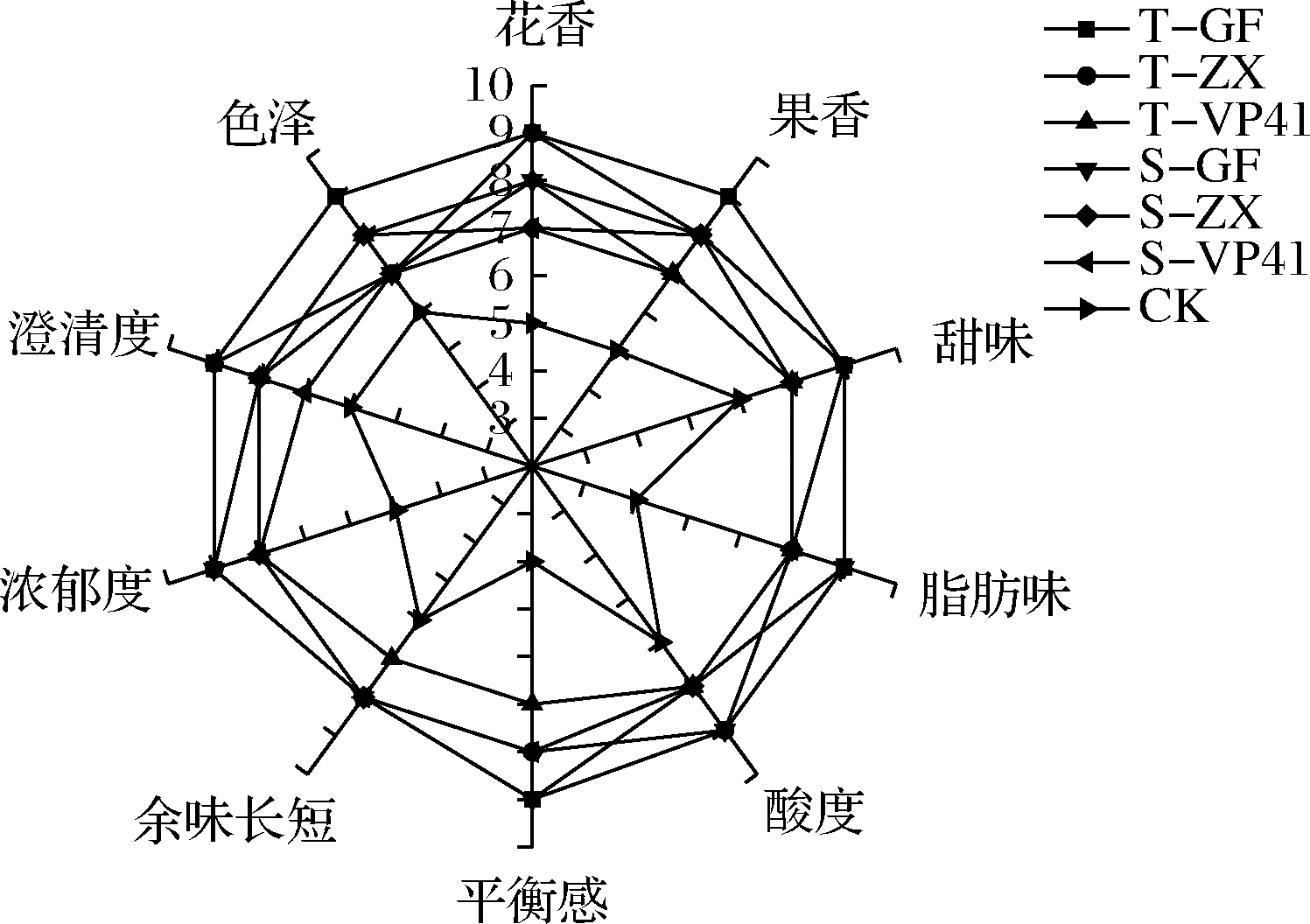
图4 赤霞珠干红葡萄酒感官分析雷达图
Fig.4 Radar map of sensory analysis for Cabernet Sauvignon dry red wine
3 结论
本研究以赤霞珠酿酒葡萄为原料,选取本土O.oeni菌株GF-2、ZX-1及商业菌VP41,采用同时和顺序2种不同的接种方式启动MLF酿造赤霞珠干红葡萄酒。结果表明,MLF过程能降低L-苹果酸,提高葡萄酒挥发性物质含量,尤其是酯类和萜烯类;与传统的顺序接种相比,同时接种MLF不仅大大地缩短了发酵时间,而且挥发性化合物种类多、含量高,丰富了葡萄酒酒体香气品质;综合感官评价分析,本土O.oeni GF-2菌株同时接种MLF酿造酒样中酯类和萜烯类化合物相对较高,赋予葡萄酒浓郁的花果香,具有一定的应用开发潜力。
[1] GONZALEZ-ARENZANA L,SANTAMARIA P,LOPEZ R,et al.Indigenous lactic acid bacteria communities in alcoholic and malolactic fermentations of Tempranillo wines elaborated in ten wineries of La Rioja (Spain)[J].Food Research International,2013,50(1):438-445.
[2] 彭传涛, 贾春雨,文彦,等.苹果酸-乳酸发酵对干红葡萄酒感官质量的影响[J].中国食品学报,2014,14(2):261-268.
PENG C T,JIA C Y,WEN Y,et al.Influence of Malo-lactic Fermentation on the sensory quality of dry red wine[J].Journal of Chinese Institute of Food Science and Technology,2014,14(2):261-268.
[3] MICHLMAYR H,NAUER S,BRANDES W,et al.Release of wine monoterpenes from natural precursors by glycosidases from Oenococcus oeni[J].Food Chemistry,2012,135(1):80-87.
[4] LI N,DIAN J,GAO D W,et al.Mutation and selection of Oenococcus oeni for controlling wine malolactic fermentation[J].European Food Research & Technology,2015,240(1):93-100.
[5] L PEZ I,TENORIO C,ZARAZAGA M,et al.Evidence of mixed wild populations of Oenococcus oeni strains during wine spontaneous malolactic fermentations[J].European Food Research and Technology,2007,226(1-2):215-223.
PEZ I,TENORIO C,ZARAZAGA M,et al.Evidence of mixed wild populations of Oenococcus oeni strains during wine spontaneous malolactic fermentations[J].European Food Research and Technology,2007,226(1-2):215-223.
[6] 张春晖. 中国优良酒类酒球菌(Oenococcus oeni)的分离筛选及苹果酸-乳酸发酵研究[D].杨凌:西北农林科技大学,2001.
ZHANG C H.Isolation and enological of Oenococcus oeni from Chinese wine and energy metabolism of malolactic fermentation[D].Yangling:Northwest A&F University,2001.
[7] 薛雪. 宁夏银川产区葡萄酒优良酒酒球菌的筛选及其发酵性能的研究[D].杨凌:西北农林科技大学,2018.
XUE X.The screening and fermentation performance of Oenococcus oeni from Ningxia Yinchuan wine product region[D].Yangling:Northwest A&F University,2018.
[8] KNOLL C,FRITSCH,SCHNELL S,et al.Impact of different malolactic fermentation inoculation scenarios on Riesling wine aroma[J].World Journal of Microbiology and Biotechnology,2012,28(3):1 143-1 153.
[9] SUMBY K M,GRBIN P R,JIRANEK V.Implications of new research and technologies for malolactic fermentation in wine[J].Applied Microbiology & Biotechnology,2014,98(19):8 111-8 132.
[10] ROSI I,FIA G,CANUTI V.Influence of different pH values and inoculation time on the growth and malolactic activity of a strain of Oenococcus oeni[J].Australian Journal of Grape and Wine Research,2003,9(3):194-199.
[11] GUZZON R,NARDIN T,MICHELETTI O,et al.Antimicrobial activity of ozone.Effectiveness against the main wine spoilage microorganisms and evaluation of impact on simple phenols in wine[J].Australian Journal of Grape and Wine Research,2013,19(2):180-188.
[12] MASSERA A,SORIA A,CATANIA C,et al.Simultaneous inoculation of Malbec (Vitis vinifera) musts with yeast and bacteria:effects on fermentation performance,sensory and sanitary attributes of wines[J].Food Technology & Biotechnology,2009,47(2):192-201.
[13] 赵现华, 李翠霞,李华.共发酵对蛇龙珠葡萄酒发酵动力学和香气成分的影响[J].中国酿造,2019,38(7):48-53.
ZHAO X H,LI C X,LI H.Effects of simultaneous fermentation on dynamics and aroma components of Cabernet Gernischet wine[J].China Brewing,2019,38(7):48-53.
[14] TRISTEZZA M,DIFEO L,TUFARIELLO M,et al.Simultaneous inoculation of yeasts and lactic acid bacteria:Effects on fermentation dynamics and chemical composition of Negroamaro wine[J].LWT,2016,66:406-412.
[15] 李凭,李彤,高莹莹,等.葡萄汁酵母和植物乳杆菌混合发酵对葡萄酒发酵的影响[J].食品与发酵工业,2019,45(3):138-142.
LI P,LI T,GAO Y Y,et al.Effects of co-fermentation of Saccharomyces uvarum and Lactobacillus plantarum on wine brewing[J].Food and Fermentation Industries,2019,45(3):138-142.
[16] 祝霞, 王璐璐,赵丹丹,等.甘肃河西走廊葡萄酒产区本土酒酒球菌发酵耐受性分析[J].食品科学,2020,41(18):159-164.
ZHU X,WANG L L,ZHAO D D,et al.Analysis of fermentation tolerance of native Oenococcus oeni in Hexi corridor of Gansu province[J].Food Science,2020,41(18):159-164.
[17] 赵宾宾. VR与MGFSH-5共酵对‘蛇龙珠’干红葡萄酒香气品质的影响[D].兰州:甘肃农业大学,2016.
ZHAO B B.Effect of co-fermentation with Saccharomyces cerevisiae and non-saccharomyces yeasts on aromatic composition of Cabernet Gernischet wine[D].Lanzhou:Gansu Agricultural University,2016.
[18] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
State administration of quality supervision,inspection and quarantine of the People’s Republic of China,China national standardization administration committee.GB/T 15038—2009 wine[S].Beijing:China Standards Press,2006.
[19] 祝霞, 王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业,2019,45(4):95-102.
ZHU X,WANG Y,LIU Q,et al.Effects of co-fermentation on the aroma of Italian Riesling low-alcohol sweet white wine[J].Food and Fermentation Industries,2019,45(4):95-102.
[20] VARELA C,SENGLER F,SOLOMON M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J].Food Chemistry,2016,209:57-64.
[21] 王倩倩,覃杰,马得草,等.优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J].中国农业科学,2018,51(11):2 178-2 192.
WANG Q Q,QIN J,MA D C,et al.Aroma enhancement of Ecolly dry white wine by co-inoculation of selected Pichia fermentans and Saccharomyces cerevisiae[J].Scientia Agricultura Sinica,2018,51(11):2 178-2 192.
[22] 李娜娜,束廷廷,梁艳英,等.不同采收期对爱格丽葡萄酒及蒸馏酒香气成分的影响[J].食品科学,2018,39(2):215-221.
LI N N,SHU T T,LIANG Y Y,et al.Effect of different harvest times on aroma components of Ecolly wines and distillations[J].Food Science,2018,39(2):215-221.
[23] 毛建利,李艳.黑果腺肋花楸酒与赤霞珠葡萄酒香气物质对比分析[J].食品科学,2019,40(22):270-276.
MAO J L,LI Y.Comparative analysis of aroma components of Black Chokeberry wine and Cabernet Sauvignon wine[J].Food Science,2019,40(22):270-276.
[24] NOGUEROL-PATO R,GONZ LEZ-
LEZ- LVAREZ M,GONZ
LVAREZ M,GONZ LEZ-BARREIRO C,et al.Aroma profile of Garnacha Tintorera-based sweet wines by chromatographic and sensorial analyses[J].Food Chemistry,2012,134(4):2 313-2 325.
LEZ-BARREIRO C,et al.Aroma profile of Garnacha Tintorera-based sweet wines by chromatographic and sensorial analyses[J].Food Chemistry,2012,134(4):2 313-2 325.
[25] 段雪荣, 陶永胜,杨雪峰,等.不同成熟度赤霞珠葡萄所酿酒香气质量分析[J].中国食品学报,2012,12(11):189-197.
DUAN X R,TAO Y S,YANG X F,et al.Aroma quality analysis of wines from Cabernet Sauvignon grapes with different maturities[J].Journal of Chinese Institute of Food Science and Technology,2012,12(11):189-197.
[26] 宫鹏飞, 马腾臻,鲁榕榕,等.不同下胶澄清剂对‘贵人香’冰白葡萄酒香气品质的影响[J].食品与发酵工业,2019,45(19):151-158.
GONG P F,MA T Z,LU R R,et al.Effects of different clarifying agents on aroma quality of ’Italian Riesling’ ice wine[J].Food and Fermentation Industries,2019,45(19):151-158.
[27] 王媛, 祝霞,杨学山,等.混菌发酵对美乐低醇桃红葡萄酒香气的影响[J].核农学报,2018,32(11):2 195-2 207.
WANG Y,ZHU X,YANG X S,et al.Effects of co-fermentation on volatile compounds of Merlot low alcohol rose wine[J].Journal of Nuclear Agricultural Sciences,2018,32(11):2 195-2 207.
[28] 李艳, 康俊杰,成晓玲,等.3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J].食品科学,2010,31(22):378-382.
LI Y,KANG J J,CHENG X L,et al.Aroma components in Cabernet Sauvignon dry red wine fermented with three species of yeast strains[J].Food Science,2010,31(22):378-382.
[29] 陶永胜, 彭传涛.中国霞多丽干白葡萄酒香气特征与成分关联分析[J].农业机械学报,2012,43(3):130-139.
TAO Y S,PENG C T.Correlation analysis of aroma characters and volatiles in Chardonnay dry white wines from five districts in China[J].Transactions of the Chinese Society for Agricultural Machinery,2012,43(3):130-139.
[30] 杨学山, 刘琦,段卫朋,等.不同浸渍工艺对贵人香干白葡萄酒香气品质的影响[J].核农学报,2020,34(10):2 271-2 279.
YANG X S,LIU Q,DUAN W P,et al.Effect of different maceration process on aroma quality of Italian Riesling dry white wine[J].Journal of Nuclear Agricultural Sciences,2020,34(10):2 271-2 279.
[31] 宋茹茹, 段卫朋,祝霞,等.戴尔有孢圆酵母与酿酒酵母顺序接种发酵对干红葡萄酒香气的影响[J].食品与发酵工业,2019,45(24):1-9.
SONG R R,DUAN W P,ZHU X,et al.Effects of sequential inoculation with Torulaspora delbrueckii and Saccharomyces cerevisiae on aroma profile of dry red wine[J].Food and Fermentation Industries,2019,45(24):1-9.