流行病学研究表明,植物产品的大量摄入与降低患慢性疾病(如动脉粥样硬化和癌症)的风险有关。而根据烹饪传统,蔬菜在进食前大多要经过不同方式的热处理。热处理的有益效果包括:灭活微生物,提高食品的安全性和消化率;软化食物基质,提高营养物的可提取性和生物有效性等。但同时热处理会带来不理想的后果,如营养物质的热降解,有毒化合物的形成,以及颜色接受度的下降等[1]。
西兰花被誉为“蔬菜皇冠”,具有含量丰富的叶绿素、类胡萝卜素、多酚、抗坏血酸及硫代葡萄糖苷等,可降低许多慢性疾病的发病率,包括癌症、心血管疾病、神经退行性疾病、代谢失调及其病理后遗症和自身免疫功能障碍[2]。
为更好地利用西兰花的高营养价值,有必要研究其在热加工过程中发生变化的机理。袁晶[3]在研究水煮、气蒸、微波、油炒和炖煮对西兰花的营养品质的影响时发现,蒸制能最大程度地保持西兰花的叶绿素、类胡萝卜素、可溶性蛋白和可溶性糖含量等营养物质。MEHMOOD等[4]在比较煮沸、煎炸、微波和蒸制对叶类蔬菜的影响时发现,蒸制就保留西兰花的生物活性成分而言比煮沸、煎炸和微波的效果更好。在家庭烹饪方式中,蒸制是加热西兰花最温和的一种烹饪方式,对其营养物质产生最小的影响。另外,JONES等[5]发现一些新兴的烹饪方式,例如真空低温煮制(sous-vide cooking)、变温煮制(<100 ℃),也能很好地保存西兰花中的营养物质。MART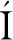 NEZ等[2]通过研究不同烹饪方式对西兰花和花椰菜的生物活性物质的影响时发现,真空低温烹饪在抗氧化能力的提高上优于其他烹饪方式,其次是蒸制。但是基于实用性来讲,蒸制是日常生活中最易实现的烹饪方式。而极少有研究提到不同蒸制功率对西兰花的影响,多数研究在比较烹饪方式对西兰花的影响时,或从相同的加热时间[5]或通过感官评价使得不同烹调方式达到相同的嫩度和色泽[6],前者的比较并未达到相同成熟度,而后者的感官评价存在一定的主观性。DOS REIS 等[7]在研究不同烹饪方式对西兰花营养品质的影响差异时,尽管不同烹饪方式的加热时间不同,但也并未提出达到相同成熟度的概念。
NEZ等[2]通过研究不同烹饪方式对西兰花和花椰菜的生物活性物质的影响时发现,真空低温烹饪在抗氧化能力的提高上优于其他烹饪方式,其次是蒸制。但是基于实用性来讲,蒸制是日常生活中最易实现的烹饪方式。而极少有研究提到不同蒸制功率对西兰花的影响,多数研究在比较烹饪方式对西兰花的影响时,或从相同的加热时间[5]或通过感官评价使得不同烹调方式达到相同的嫩度和色泽[6],前者的比较并未达到相同成熟度,而后者的感官评价存在一定的主观性。DOS REIS 等[7]在研究不同烹饪方式对西兰花营养品质的影响差异时,尽管不同烹饪方式的加热时间不同,但也并未提出达到相同成熟度的概念。
本实验以西兰花为研究对象,首先明确成熟度的表征方式,进而来比较达到相同成熟度时,不同蒸制功率对西兰花营养品质的影响,包括对胡萝卜素、抗坏血酸、总酚和抗氧化性的影响,以期为消费者选择合适的蒸制功率提供理论支撑。
1 材料与方法
1.1 材料与试剂
西兰花购自欧尚超市(无锡),置于4 ℃冰箱待用。
无水乙醇、丙酮、无水碳酸钠、福林酚、没食子酸、偏磷酸、Na3PO4、KH2PO4,均为分析纯;H3PO4(85%)、L-半胱氨酸(优级纯)、十六烷基三甲基溴化铵(色谱纯)、L(+)-抗坏血酸标准品(纯度≥99%)、甲醇(色谱纯),国药集团化学试剂有限公司。
1.2 仪器与设备
SSGP加厚大蒸锅,掌中宝厨具专营店;Taigroo钛古电磁炉,Taigroo官方旗舰店;EL204电子天平、PL2002电子天平、SevenCompact S220多参数测试仪,梅特勒-托利多仪器(上海)有限公司;705超低温冰箱、Heraeus Multifuge X1R台式高速冷冻离心机、酶标仪,赛默飞世尔科技(中国)有限公司;UV—2700紫外可见分光光度计,日本岛津公司;CR-700 d色彩色差计,柯尼卡美能达(中国)投资有限公司;TA.XT-Plus物性分析仪,英国Stable Micro System 公司;Bench Top Pro冷冻干燥机,美国VirTis公司;E2695 Waters Alliance 液相色谱仪,上海沃特世科技有限公司;UT322高精度接触式温度计(K型热电偶),优利德集团有限公司;组合式摇床,太仓市强乐实验设备有限公司;T10高速分散机、VORTEX3 S25漩涡混匀器,德国IKA公司;KQ-400DE型数控超声波清洗器,昆山市超声仪器有限公司;84-1A磁力搅拌器,上海司乐仪器有限公司。
1.3 实验方法
1.3.1 样品制备
将同一批次的西兰花按照小花花冠直径3.5~4.5 cm、花茎直径1.0~1.5 cm、花茎长度1.0~1.5 cm修剪,擦干表面水分,于4 ℃保存。
本实验采用100、500、1 000和1 600 W蒸制200 g西兰花至相同成熟度。
蒸制方法:称取800 g水,在1 600 W的蒸制功率下将水加热至沸腾,再分别将功率调至100、500、1 000和1 600 W,蒸制200 g西兰花至相同成熟度,其中西兰花小花以圆形的摆放方式放置在蒸屉上以保证均匀加热。蒸制完成后,将西兰花小花置于冰上快速冷却,防止残留的热量继续烹饪。冷却后,切成片状装入铝箔袋中,冷冻干燥,研磨成粉末存放在-80 ℃的超低温冰箱中用于指标检测。
1.3.2 西兰花小花升温曲线的测定
将温度探头垂直于小花花茎直径的中心点穿入,深度约为1 cm。然后放入蒸锅中开始加热,温度计设置15 s采集1次数据。
1.3.3 感官评价
西兰花的成熟度感官评价采用评分法,在进行品尝时,将西兰花具有一定的脆性同时没有生西兰花的涩感作为西兰花正常成熟的标准。具体的评分标准:1分:非常生;2分:较生;3分:正常熟;4分:过熟;5分:非常熟。西兰花硬度值大小的嗜好性评价采用9点喜好度标度法,1分表示极其不喜欢,9分表示极其喜欢。
1.3.4 西兰花小花花冠的颜色测定
颜色空间选择CIE L*,a*,b*。随机测定每朵西兰花小花花冠3个位置处的颜色,读取数据L*、a*、b*,其中L*值代表亮度(黑色=0,白色=100),a*值代表红绿值(红色>0,绿色<0),b*值代表黄蓝值(黄色>0,蓝色<0),采用a*来表征西兰花在加工中颜色的变化。
1.3.5 西兰花小花花茎的硬度测定
选用直径2 mm的穿刺探头P/2 N。测试参数:测前速度2.00 mm/s;测中速度1.00 mm/s;测后速度1.00 mm/s;穿刺距离5.00 mm;接触力5.00 g。结果以最大硬度值(g)输出。
1.3.6 叶绿素和类胡萝卜素含量测定
参考NY/T 3082—2017 《水果、蔬菜及其制品中叶绿素含量的测定分光光度法》。
1.3.7 抗坏血酸含量测定
参考GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》第一法高效液相色谱法,并加以修改。
试样提取:称取0.2 g西兰花粉末于50 mL避光离心管中,用40 mL 20 g/mL的偏磷酸溶液均质1 min,转移至50 mL的棕色容量瓶中,定容。摇匀后转移至50 mL离心管中,超声提取5 min,于5 000 r/min离心10 min。准确吸取20 mL上清液于50 mL离心管中,加入10 mL 40 g/L的L-半胱氨酸溶液,用100 g/L磷酸三钠溶液调节pH至7.0~7.2,以200 r/min振荡5 min。再用磷酸调节pH至2.5~2.8,用水将试液全部转移至50 mL容量瓶中,定容至刻度。混匀后取此试液过0.45 μm水相滤膜后待测。
1.3.8 总酚含量测定
测定方法:Folin-Ciocalteus法测定总酚含量,参考GB/T 31740.2—2015 《茶制品 第2部分:茶多酚》。
1.3.9 DPPH自由基清除率的测定
分别称取0.1 g西兰花冷冻干燥粉末于50 mL离心管中,加入10 mL的体积分数60%乙醇溶液匀浆(质量分数为2%),60 ℃超声提取30 min,取出后在7 800 r/min离心3 min,将上清液移出备用。
DPPH自由基清除率测定:将上清液用60%的乙醇稀释成质量分数为0.25%的样液,取浓度为0.2 mmol/L的DPPH溶液(溶于100%乙醇)0.5 mL,加入0.5 mL样液,振荡均匀,于室温下避光反应30 min,在517 nm处测定样品的吸光值(A1);空白组为0.5 mL 100%乙醇与0.5 mL样液在517 nm处的吸光值(A2);对照组为0.5 mL DPPH溶液与0.5 mL 100%乙醇在517 nm处的吸光值(A3)。样液对DPPH自由基清除能力按公式(1)计算:
DPPH自由基清除率![]()
(1)
1.4 数据处理
采用 SPSS 23.0对实验数据进行统计分析,用One-Way ANOVA 方法进行方差分析,采用Ducan’s multiple range test比较单个均值之间的差异,P<0.05时表明结果间存在显著差异。用Origin 2018软件进行作图分析。
2 结果与讨论
2.1 不同功率蒸制小花中心温度和耗水量的变化
对比了不同蒸制功率及相同蒸制时间下,西兰花小花中心温度和耗水量的变化(图1),由图1-a可知,蒸制功率越低,蒸制相同时间的小花中心温度越低,同时蒸制过程中小花中心温度的上升速度越慢;蒸制功率越低,蒸制相同时间后耗水量越少(图1-b),而蒸制功率越高,蒸制相同时间的耗水量越多。蒸制功率不同,相同时间的耗水量不同,样品的受热速率也不同,故对西兰花的营养品质的影响也有所不同。
a-中心温度的变化;b-耗水量的变化
图1 不同功率蒸制西兰花中心温度的变化及相同时间的耗水量
Fig.1 Changes in core temperature of broccoli steamed with different powers and water consumption at same time
2.2 不同功率蒸制西兰花达到相同成熟度时对其营养物质的影响
2.2.1 成熟度的表征方式和不同蒸制功率相同成熟度的确定
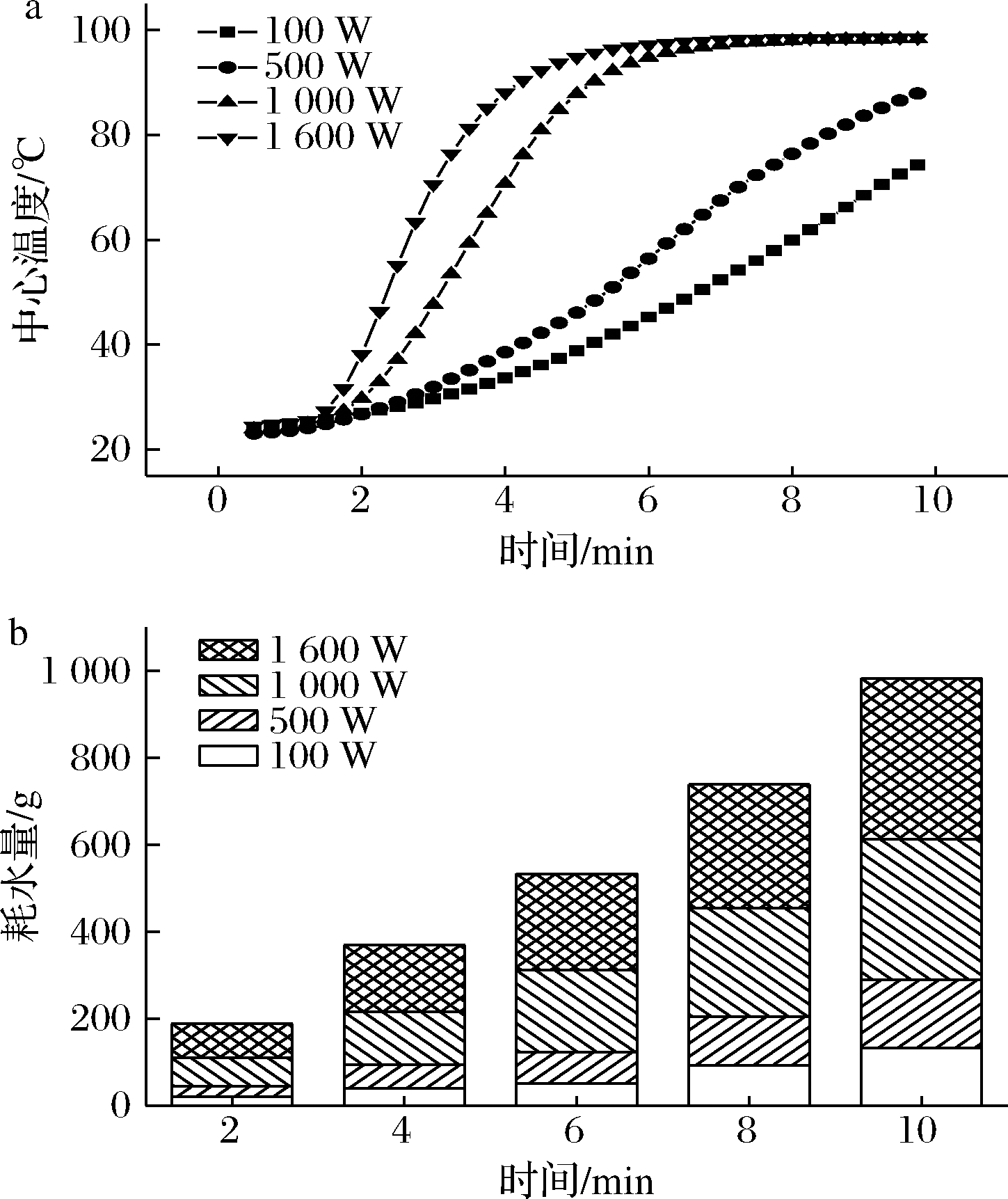
本实验通过质构仪测定西兰花随着加热时间的增加,硬度值的变化,同时进行感官评价,判断测得的硬度值是否能够客观判断西兰花的成熟度。西兰花小花硬度随着加热时间的延长,硬度值明显下降,同时,感官得分看出,硬度值降低,感官成熟度评分越来越高(图2-a)。用质构仪测定小花的最大硬度值,可以表征小花成熟的程度。
a-成熟度评分和硬度值的关系;b-总体喜好度和硬度值
图2 1 600 W下不同加热时间小花的最大硬度和感评得分及总体喜好度
Fig.2 Maximum hardness,sensory score and overall preference of florets under different heating times at 1 600 W
注:图中组间不同小写字母表示差异显著(P<0.05)(下同)
不同功率蒸制西兰花小花,随着蒸制时间的延长,其硬度值的变化一致,为较快判断人们对蒸制后西兰花成熟度的嗜好性,选择1 600 W蒸制不同的时间,使硬度值存在较软、中等硬度、较硬3个状态。组织10人进行喜好度感官评价,并同时测定每个时间点的硬度值,两者结合来判断人们喜欢的成熟度的硬度值。由图2-b可知,人们更加喜欢中等硬度(硬度值约为86.40~118.78 g)的西兰花,中等硬度的西兰花既没有生西兰花的涩味,也不过于软烂,没有咀嚼性。因此,在研究不同功率蒸制对西兰花的影响时,选择中等硬度的西兰花更有意义。
为分析不同蒸制条件下烹饪的西兰花的感官及与健康有关的特性,采用相同的硬度作为比较的标准。由图2-b可知,人们更喜欢1 600 W蒸制2~4 min的西兰花,以1 600 W蒸制3.5 min时的硬度值作为参考,100、500和1 000 W蒸至硬度值与1 600 W蒸制3.5 min的硬度值无显著性差异(表1)。
表1 不同功率蒸制西兰花达到相同成熟度时的硬度值
Table 1 Hardness values of broccoli steamed with different powers to reach the same maturity

功率/W时间/min硬度值/g10011.098.72±8.01a5008.597.65±9.29a1 0004.0101.09±11.24a1 6003.597.36±10.68a
2.2.2 颜色与色素含量变化
食物颜色对于人类来说是重要的“先天的对食物的价值的感知”,是食物健康质量的可靠指标[8]。而绿色蔬菜的绿色来自于叶绿素,绿色蔬菜加工过程中受光、温度、pH、氧和酶等条件的影响,组织细胞中叶绿素分解,从而发生褪色或变色[9]。通过观察可以发现低功率蒸制时对应的西兰花颜色为橄榄绿,稍发黄,而高功率蒸制时颜色较为鲜绿(图3),这归因于加热过程中叶绿素的降解[10]。
图3 不同功率蒸制西兰花的颜色变化
Fig.3 Changes in color indexes of broccoli steamed at different powers
可能由于高功率经过短时烹饪加热,表面细胞蛋白质变性,叶绿素从叶绿体中分离出来,从而呈现更为鲜亮的绿色[11]。而低功率蒸至相同成熟度用时较长,进而导致一部分叶绿素降解为橄榄绿色的脱镁叶绿素。因此,就颜色而言,功率越高越有利于西兰花颜色的保留。
西兰花的颜色变化主要取决于色素组成和含量,色素包括叶绿素和类胡萝卜素[12]。叶绿素在其生物环境中具有极好的稳定性。然而,当它们经过食品加工和烹调时,却处于不稳定状态。在热处理过程中的变化主要与处理温度、时间以及酶的热失活等因素有关[16]。叶绿素在经过热处理之后会降解产生几种重要的衍生物,最常见的是脱镁叶绿素,该反应在酸性条件下或在温和的热处理下很容易发生,颜色也由此改变为更褐色的色调[14]。根据蔬菜种类和烹饪方法的不同,叶绿素保留率可达19%~100%[15]。陈蔚辉等[19]研究发现漂烫和油炒之后菠菜的叶绿素含量均有所降低,其中漂烫后叶绿素降低约38.46%,油炒后降低约30.76%。
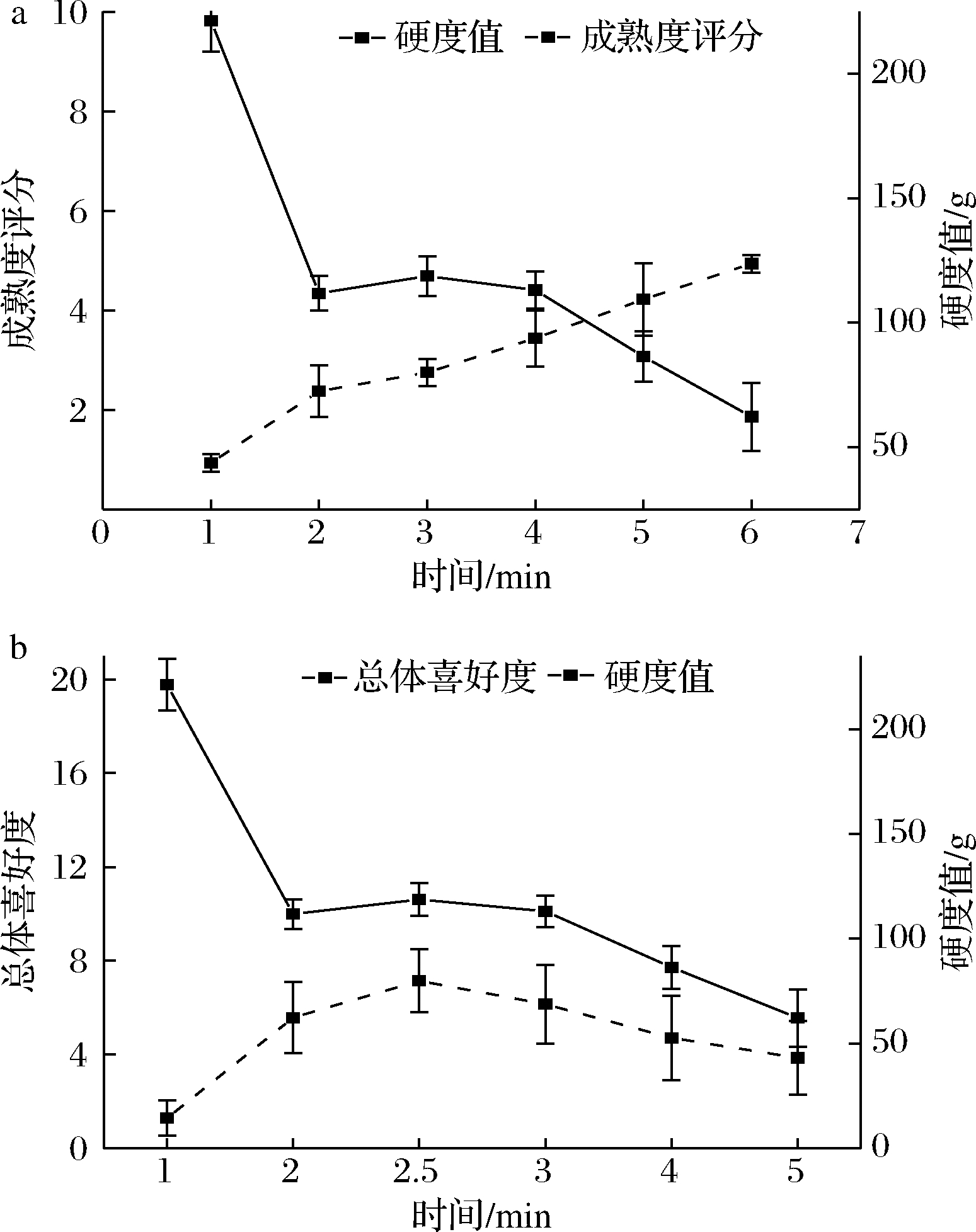
不同功率蒸制西兰花达到相同成熟度时,相比新鲜西兰花,蒸制后西兰花的叶绿素含量显著降低,这是因为热加工导致叶绿体蛋白质变性释放叶绿素,同时细胞释放有机酸,在酸的作用下,叶绿素发生一系列脱镁反应生成脱镁叶绿素,进而导致食品的颜色转变为橄榄绿、甚至褐色[16]。对比不同蒸制功率下的西兰花,其叶绿素含量基本呈现随蒸制功率增加而上升的趋势,因此,高功率蒸制更有效地保留了西兰花中的叶绿素(图4)。不过,1 000与100 W处理下的西兰花叶绿素含量无显著差异,但通过a*值可以看出100 W(-9.90)处的颜色较1 000 W(-11.10)稍黄,可能是由于低功率蒸制西兰花时,叶绿素转化成了脱镁叶绿素,由于脱镁叶绿素与叶绿素一样在663 nm处有光吸收,使得此处的光密度值升高[17],所以测得吸光值并无显著性降低,而颜色值则表现出差异。
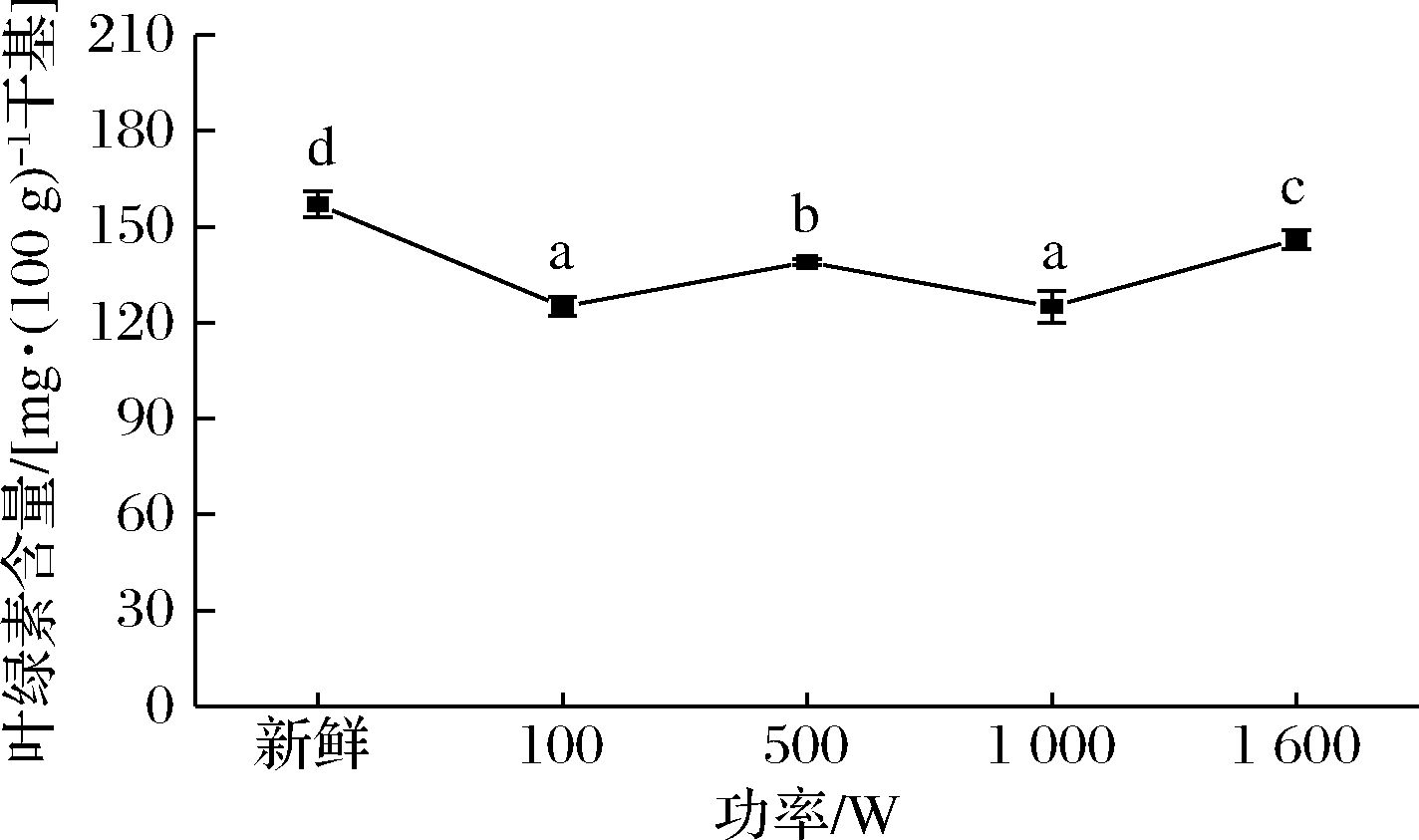
图4 不同功率蒸制西兰花的叶绿素含量变化
Fig.4 Changes of chlorophyll content of broccoli steamed at different power
叶绿素是评价绿色蔬菜及产品品质的一个重要指标,其对加工条件变化非常敏感,容易导致褪色或者变色[18]。马正强等[19]发现在香椿热烫过程中,叶绿素含量与色泽呈明显的线性关系。许凤等[23]发现青花菜在不同贮藏温度条件下,其颜色参数-a*/b*值随贮藏时间的延长不断下降,且叶绿素含量也不断下降。但由图3和图4对比可知,叶绿素含量的变化与色度值变化趋势并非一致,所以不同功率蒸制后西兰花的叶绿素含量变化并不能准确说明其色泽的变化情况,叶绿素含量随蒸制时间的变化以及与颜色的关系还需进一步探究讨论。
类胡萝卜素也存在于绿色蔬菜中,但是它们的颜色被叶绿素所掩盖。类胡萝卜素是不稳定的化合物,当暴露于光、氧气、高压下时,会发生分解。多项研究表明,食品加工过程中可以明显观察到加工参数对类胡萝卜素分解造成的影响。影响加工过程中类胡萝卜素稳定性的一些因素包括温度升高、加工时间延长、氧气、助氧化剂、酸败和高压等。GUILLÉN等的研究结果表明,煮沸、低于100 ℃煮制和真空低温煮制等加热方式均会使类胡萝卜素含量降低[23];PALMERO等[21]发现类胡萝卜素在高温长时间加热后,由于热敏性和脂溶性的发生,其含量明显下降;ZHANG等[22]也发现总类胡萝卜素含量随着加热时间的延长会逐渐降低;BARAKAT等[23]发现除蒸制和焙烤外,微波和油炸导致西兰花中的总类胡萝卜素含量发生不同程度地降低。在本研究中不同功率加热后,类胡萝卜素含量均有所降低,其中1 600 W蒸制后的保留率最高(图5)。而类胡萝卜素的损失主要是由氧化及热分解造成的,因为类胡萝卜素几乎不溶于水,因此蒸制并不带来溶水损失[24]。

图5 不同功率蒸制西兰花的类胡萝卜素含量变化
Fig.5 Changes of carotenoid content of broccoli steamed with different power
2.2.3 总酚含量变化
多酚类物质是西兰花具有抗氧化性的主要活性成分,其含量反映了西兰花的抗氧化能力[25]。多酚类化合物的稳定性取决于植物基质、加热条件和加热时间。MAZZEO等[26]的研究结果表明蒸制增加了所有冷冻蔬菜中的总酚含量和总的抗氧化能力,而煮沸则导致类胡萝卜素和酚类化合物的普遍损失和总抗氧化能力的降低。通常,较低温度和较短时间的蒸煮和微波处理能够更好地保留总酚含量[27-28]。由图6可知,新鲜西兰花、100、500、1 000、1 600功率处理下总酚含量分别为:793.2、773.37、817.66、824.38、867.80 mg/100 g干基。西兰花在高功率蒸制后相比新鲜组总酚含量均发生了不同程度的增加,这种增加可能是:(1)样品不与水接触且热处理导致了多酚氧化酶的失活;(2)热作用破坏了蔬菜结构,从而改善了从细胞基质中提取酚类化合物的能力,刺激膳食纤维结合的多酚类物质的释放,形成游离的酚类化合物[29];(3)细胞壁的破裂和植物基质的软化,以及酚类化合物的释放(自由或结合形式)。而低功率蒸制时总酚含量低于高功率蒸制,可能是因为低功率蒸制时蒸汽产生量较小,传热比较慢,蒸制相同成熟度时所需时间较长,而多酚化合物的稳定性多取决于加热时间,因此导致一部分酚类物质发生了热降解或者发生了氧化等反应[2]。
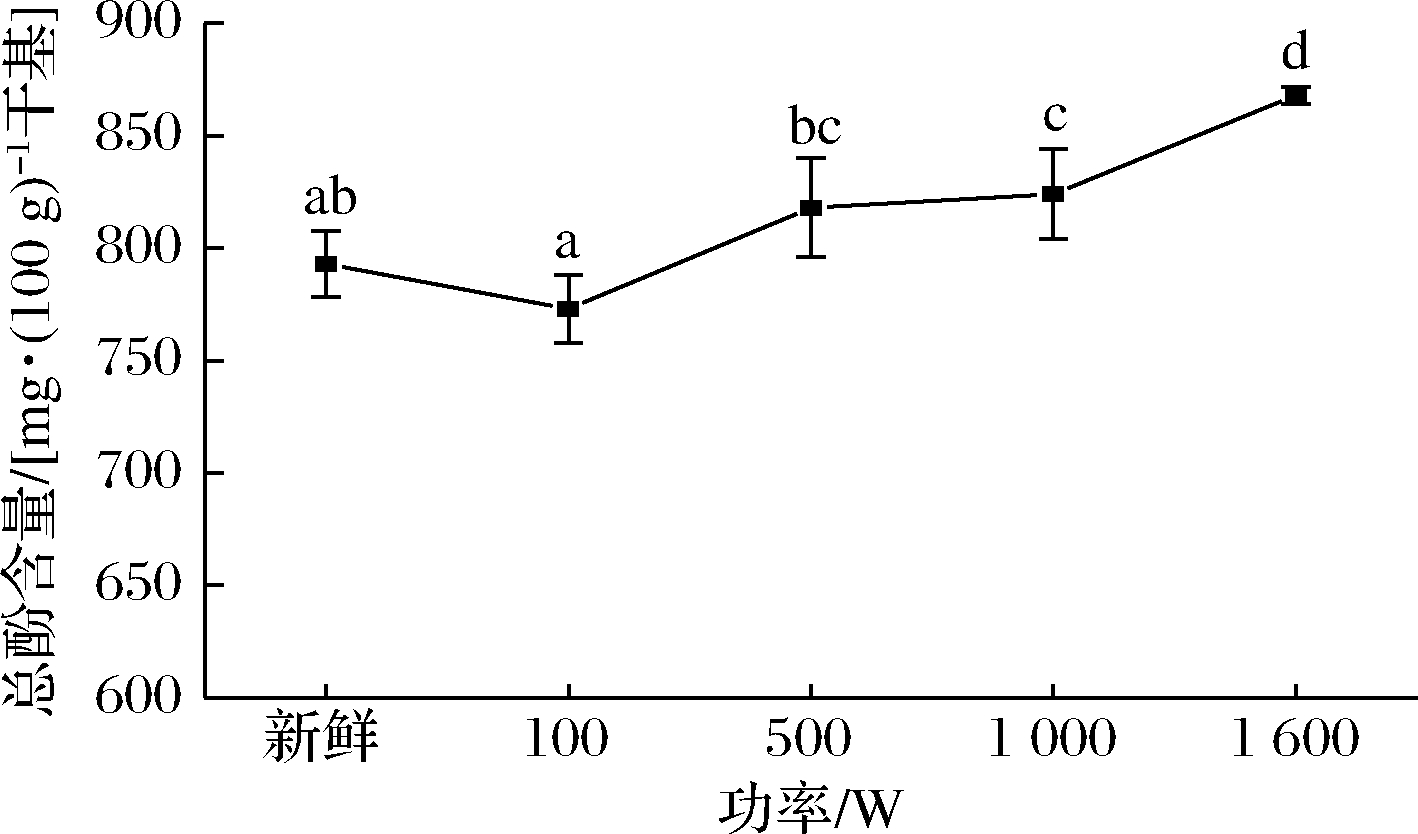
图6 不同功率蒸制达到相同成熟度时的总酚含量变化
Fig.6 Changes in total phenol when steaming with different powers to reach same maturity
2.2.4 抗坏血酸含量变化
抗坏血酸对热处理非常敏感,抗坏血酸的流失还取决于各种因素,包括温度和加热时间、加热介质、产品的研磨程度、暴露在水中的表面积、光线和氧气以及pH值。抗坏血酸作为水溶性维生素,一般来说,在较长时间和/或较高温度下加热会导致蔬菜流失大量抗坏血酸。因此不同功率蒸制后,西兰花的抗坏血酸含量均有不同程度地降低(图7),其中低功率蒸制时抗坏血酸含量降低较为明显(新鲜西兰花为841.35 mg/100 g干基;100 W功率下为669.31 mg/100 g干基),而高功率蒸制时无明显变化1 600 W功率下为821.76 mg/100 g干基)。不同功率蒸制西兰花时,因其传热速率不同,影响了蒸制的时间。而蒸制功率越高,传热速率越高,达到相同成熟度的时间越短;低功率蒸制时传热速率较低,达到相应成熟度的时间较长,所以蒸制过程中流经西兰花表面的水较多,带走了更多的抗坏血酸[30]。

图7 不同功率蒸制达到相同成熟度时的抗坏血酸含量变化
Fig.7 Changes in ascorbic acid content when steaming with different powers to reach the same maturity
2.2.5 抗氧化活性变化
西兰花中含有大量的抗氧化代谢物,如抗坏血酸、β-胡萝卜素、酚类化合物、α和β-生育酚和硫代葡萄糖苷等。抗氧化能力的提高可能是由于细胞壁和亚细胞室的热降解、具有抗氧化能力的新化合物的形成或氧化酶的失活[2]。TABART等[31]的研究结果表明,西兰花经过不同方式的烹饪之后抗氧化能力均有所提高。从图8可知,不同功率蒸制后西兰花的抗氧化活性均有所升高,其中1 000和1 600 W蒸制后的抗氧化活性最高。
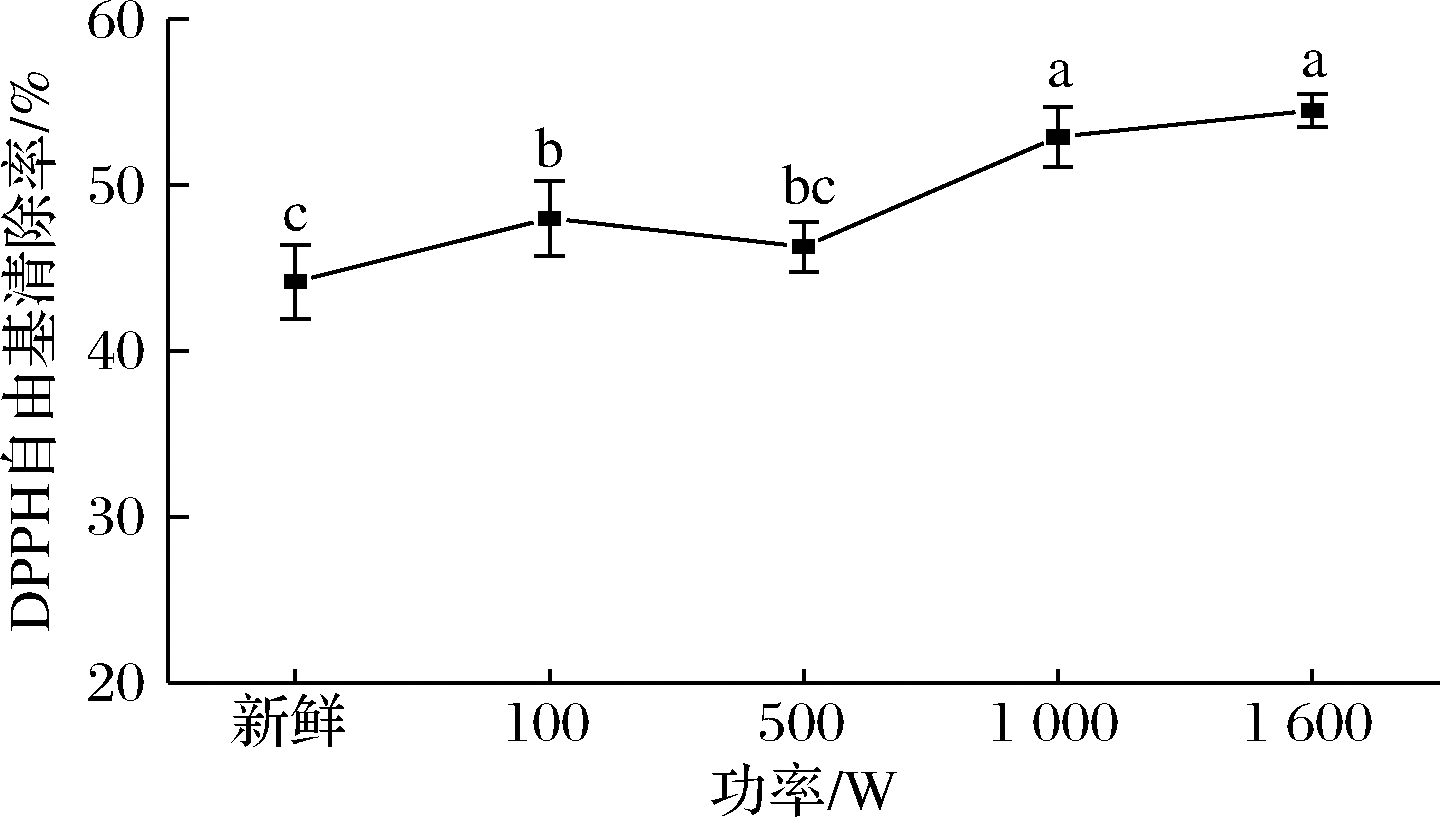
图8 不同功率蒸制达到相同成熟度时的抗氧化性变化
Fig.8 Changes in antioxidant capacity when steaming with different powers to reach the same maturity
3 结论
研究结果表明,加热后西兰花的成熟度可以用西兰花小花茎的最大硬度值表征,当不同加热方式的最大硬度值无显著性差异时可认为其成熟度相同。通过比较不同功率蒸制西兰花达到相同成熟度时对其营养物质的影响发现,功率越高,蒸制后西兰花的颜色就越鲜绿;叶绿素和类胡萝卜素含量的变化随着蒸制功率的升高整体呈现上升趋势;同样,蒸制功率越高,传热速率越快,达到相同成熟度时西兰花的多酚和抗坏血酸含量越高;因此采用1 000 W以上较高功率蒸制西兰花,外观较好,营养素含量较高。
[1] ZHAN L,PANG L,MA Y,et al.Thermal processing affecting phytochemical contents and total antioxidant capacity in broccoli (Brassica oleracea L.)[J].Journal of Food Processing and Preservation,2018,42(3):e13848.
[2] MART NEZ S,ARMESTO J,G
NEZ S,ARMESTO J,G MEZ-LIMI L,et al.Impact of processing and storage on the nutritional and sensory properties and bioactive components of Brassica spp.A review[J].Food Chemistry,2020,313:126065.
MEZ-LIMI L,et al.Impact of processing and storage on the nutritional and sensory properties and bioactive components of Brassica spp.A review[J].Food Chemistry,2020,313:126065.
[3] 袁晶.不同贮藏和烹饪方法对青花菜品质的影响[D].杭州:浙江大学蔬菜学,2006.
YUAN J.Studies on effect of different storage and cooking methods on quality of broccoli[D].Hangzhou:Zhejiang University,2006.
[4] MEHMOOD A,ZEB A.Effects of different cooking techniques on bioactive contents of leafy vegetables[J].International Journal of Gastronomy and Food Science,2020,22:100246.
[5] JONES R B,FRISINA C L,WINKLER S,et al.Cooking method significantly effects glucosinolate content and sulforaphane production in broccoli florets[J].Food Chemistry,2010,123(2):237-242.
[6] TURKMEN N,POYRAZOGLU E S,SARI F,et al.Effects of cooking methods on chlorophylls,pheophytins and colour of selected green vegetables[J].International Journal of Food Science and Technology,2006,41(3):281-288.
[7] DOS REIS L C R,DE OLIVEIREV R,HAGEN M E K,et al.Effect of cooking on the concentration of bioactive compounds in broccoli (Brassica oleracea var.Avenger) and cauliflower (Brassica oleracea var.Alphina F1) grown in an organic system[J].Food Chemistry,2015,172:770-777.
[8] LAFARGA T,VI  AS I,BOBO G,et al.Effect of steaming and sous vide processing on the total phenolic content,vitamin C and antioxidant potential of the genus Brassica[J].Innovative Food Science & Emerging Technologies,2018,47:412-420.
AS I,BOBO G,et al.Effect of steaming and sous vide processing on the total phenolic content,vitamin C and antioxidant potential of the genus Brassica[J].Innovative Food Science & Emerging Technologies,2018,47:412-420.
[9] 康三江,张海燕,苟丽娜,等.野生蒲公英漂烫中叶绿素和颜色的热降解动力学[J].食品工业,2020,41(2):66-70.
KANG S J,ZHANG H Y,GOU L N,et al.Kinetics of Chlorophyll Degradation and Color Loss in Wild Dandelion[J].The Food Industry,2020,41(2):66-70.
[10] BONGONI R,VERKERK R,STEENBEKKERS B,et al.Evaluation of different cooking conditions on broccoli (Brassica oleracea var.italica) to improve the nutritional value and consumer acceptance[J].Plant Foods for Human Nutrition,2014,69(3):228-234.
[11] 彭燕.不同烹饪处理对芹菜感官和营养品质的影响[J].中国食品学报,2012,12(2):81-87.
PENG Y.Effect of different cooking methods on sensory and nutritional quality of celeries[J].Journal of Chinese Institute of Food Science and Technology,2012,12(2):81-87.
[12] LUO F,CHENG S,CAI J,et al.Chlorophyll degradation and carotenoid biosynthetic pathways:Gene expression and pigment content in broccoli during yellowing[J].Food Chemistry,2019,297(1):121-128.
[13] 张丽华.猕猴桃果实制浆中叶绿素降解机理及其护绿方法研究[D].咸阳:西北农林科技大学,2012.
ZHANG L H.Studies on Chlorophyll degradation and methods for delaying green color change of kiwifruit puree during break processing[D].Xianyang:Northwest A&F University,2012.
[14] 杨全福,王首宇.浅谈绿色蔬菜在加工过程对叶绿素的保护[J].甘肃农业,2005(10):21.
YANG Q F,WANG S Y.Talking about the protection of green vegetables to chlorophyll during processing[J].Gansu Agriculture,2005(10):21.
[15] TURKEN N,POYRAZOGLU E S,SARI F,et al.Effects of cooking methods on chlorophylls,pheophytins and colour of selected green vegetables[J].International Journal of Food Science and Technology,2006,41(3):281-288.
[16] 陈蔚辉,罗婉芝.不同烹饪方法对菠菜营养品质的影响[J].食品科技,2011,36(12):80-82.
CHEN W H,LUO W Z.Effects of different cooking methods on nutrition of spinach[J].Food Science and Technology,2011,36(12):80-82.
[17] 梁慧锋,张英锋,马子川.涮烫时间对绿叶菜中叶绿素含量影响的研究[J].渤海大学学报(自然科学版),2010,31(1):6-10.
LIANG H F,ZHANG Y F,MA Z C.Relationship between the length of swill time and chlorophyll content in green vegetable[J].Journal of Bohai University(Natural Science Edition),2010,31(1):6-10.
[18] 刘春泉,卓成龙,宋江峰,等.毛豆仁低温冻藏期叶绿素和色泽降解动力学[J].江苏农业学报,2011,27(4):858-862.
LIU C Q,ZHUO C L,SONG J F,et al.Degradation kinetics of color and chlorophyll in frozen edamames[J].Jiangsu Journal of Agricultural Sciences,2011,27(4):858-862.
[19] 马正强,崔灵绸,张贝贝,等.热烫处理对香椿叶绿素及颜色的影响[J].中国食品学报,2017,17(1):179-185.
MA Z Q,CUI L C,ZHANG B B,et al.The Effects of Blanching on Chlorophyll and Color of Toona sinensis[J].Journal of Chinese Institute of Food Science and Technology,2017,17(1):179-185.
[20] GUILLÉN S,MIR-BEL J,ORIA R,et al.Influence of cooking conditions on organoleptic and health-related properties of artichokes,green beans,broccoli and carrots[J].Food Chemistry,2017,217:209-216.
[21] PALMERO P,LEMMENS L,HENDRICKX M,et al.Role of carotenoid type on the effect of thermal processing on bioaccessibility[J].Food Chemistry,2014,157:275-282.
[22] ZHANG D,HAMAUZU Y.Phenolics,ascorbic acid,carotenoids and antioxidant activity of broccoli and their changes during conventional and microwave cooking[J].Food Chemistry,2004,88(4):503-509.
[23] BARAKAT H,ROHN S.Effect of different cooking methods on bioactive compounds in vegetarian,broccoli-based bars[J].Journal of Functional Foods,2014,11:407-416.
[24] 何湘漪,何洪巨,范志红,等.烹调方法对3种叶菜中类黄酮和类胡萝卜素的影响[J].中国食品学报,2016,16(7):276-282.
HE X Y,HE H J,FAN Z H,et al.Effect of cooking treatments on carotenoids and total flavonoid in three leafy vegetables[J].Journal of Chinese Institute of Food Science and Technology,2016,16(7):276-282.
[25] 张怡,关文强,张娜,等.温度对西兰花抗氧化活性及其品质指标影响[J].食品研究与开发,2011,32(8):156-161.
ZHANG Y,GUAN W Q,ZHANG N,et al.Changes of antioxidant activity,compounds and quality of broccoli florets during different temperatures[J].Food Research and Development ,2011,32(8):156-161.
[26] MAZZEO T,N DRI D,CHIAVARO E,et al.Effect of two cooking procedures on phytochemical compounds,total antioxidant capacity and colour of selected frozen vegetables[J].Food Chemistry,2011,128(3):627-633.
[27] TIAN J,CHEN J,LV F,et al.Domestic cooking methods affect the phytochemical composition and antioxidant activity of purple-fleshed potatoes[J].Food Chemistry,2016,197:1 264-1 270.
[28] TIAN J,CHEN J,YE X,et al.Health benefits of the potato affected by domestic cooking:A review[J].Food Chemistry,2016,202:165-175.
[29] ZHAO C,LIU Y,LAI S,et al.Effects of domestic cooking process on the chemical and biological properties of dietary phytochemicals[J].Trends in Food Science & Technology,2019,85:55-66.
[30] 黄微.烹饪及消费方式对青花菜营养品质及碳排放量的影响研究[D].华东理工大学食品科学,2012.
HUANG W.Research on the impact of cooking methods and home treatment habits for the nutrition quality and carbon emissions in cauliflower[D].East China University of Science and Technology,2012.
[31] TABART J,PINCEMAIL J,KEVERS C,et al.Processing effects on antioxidant,glucosinolate,and sulforaphane contents in broccoli and red cabbage[J].European Food Research & Technology,2018,244(12):2 085-2 094.