马铃薯是世界第四大粮食作物,我国是世界上最大的马铃薯生产国和消费国。我国马铃薯消费以鲜食为主,加工占比不足30%。马铃薯加工产品有马铃薯淀粉及全粉、粉条、粉丝、粉皮等淀粉制品[1];包括薯条、薯片等方便膨化制品[2];还有馒头、面条、米粉、饼干等发酵、非发酵、焙烤类主食产品[3]。
马铃薯蛋白约占马铃薯鲜重的0.15%~3.02%[4],是一种优良植物蛋白,营养价值可与鸡蛋相媲美,可广泛用于食品与医药行业[5]。马铃薯蛋白可以分为3类,大分子蛋白(分子质量>45 kDa),约占总量10%;patatin蛋白(40 kDa<分子质量<45 kDa),约占总量40%;蛋白酶抑制剂(5 kDa<分子质量<25 kDa),约占总量50%[6]。马铃薯蛋白酶抑制剂又可分抑制剂Ⅰ、抑制剂Ⅱ、丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂、天门冬氨酸蛋白酶抑制剂、Kunitz型蛋白酶抑制剂、羧肽酶抑制剂等7类,其中抑制剂Ⅰ、抑制剂Ⅱ、Kunitz型蛋白酶抑制剂以及大部分的丝氨酸蛋白酶抑制剂、天冬氨酸蛋白酶抑制剂均具有胰蛋白酶抑制活性[7]。胰蛋白酶抑制剂可与胰蛋白酶结合,促进胆囊收缩素释放,提升饱腹感,起到控制体重的效果,此外,胰蛋白酶抑制剂还具有抗炎、抗菌、护胃等生理功效[8-9]。
目前的研究主要集中于马铃薯蛋白结构特性[10-11]、物化特性[12-13],而对于马铃薯蛋白消化特性、胰蛋白酶活性,特别是不同热加工处理方式对马铃薯蛋白胰蛋白酶活性与消化率影响报道较少。热处理是食品加工中不可避免的加工方法,目前常见的热处理方法包括湿热、干热、微波等方法[14],适度热处理能够使紧密的大豆蛋白结构变得松散,导致其内部酶作用位点充分暴露,利于蛋白酶与作用位点结合,提高大豆蛋白消化率[15]。本研究以3个不同品种马铃薯蛋白为原料,探讨加工条件对马铃薯蛋白消化特性及胰蛋白酶抑制剂活性的影响,以期为马铃薯蛋白质食品化利用和马铃薯产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
鄂10、鄂11、米拉等3个品种鲜马铃薯均来自于湖北省农业科学院粮食作物研究所资源圃。
NaOH、HCl、Na2CO3、NaH2PO4、Na2HPO4、CaCl2、NaCl、Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐(Na-Benzoyl-DL-arginine-4-nitroanilide hydrochloride,BAPNA)等,国药集团化学试剂有限公司;胃蛋白酶(P7000)、胰蛋白酶(T—4799),Sigma公司;透析袋(1 k、2 kDa),上海源叶生物科技有限公司。
1.2 仪器与设备
FG2便携式pH计,梅特勒-托利多仪器有限公司;LXJ-ⅡB型离心机,上海安亭科学仪器厂;LGJ-25C冷冻干燥机,北京四环科学仪器厂有限公司;L-8900型全自动氨基酸分析仪,日本日立;YM-75立式压力蒸汽灭菌器,上海三申医疗器械有限公司;MKX-G1C1B微波加热装置,青岛迈可威微波创新科技有限公司;DHG-9423A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;SHA-B恒温振荡器,常州国华电器有限公司;SKD-0852消化炉,上海沛欧分析仪器有限公司;K9840自动凯氏定氮仪,济南海能仪器股份有限公司;UV-3802分光光度计,上海尤尼科仪器有限公司。
1.3 试验方法
1.3.1 马铃薯蛋白制备及基本成分测定
马铃薯蛋白提取参照齐斌等[17]的方法。新鲜马铃薯经清洗、切块、打碎后,按料液比1∶10与0.4 mol/L NaCl溶液(pH 8.0)混合,40 ℃下浸提1 h,于室温下3 000 r/min离心15 min,取上清液,调节pH至3.2,充分搅拌后,静置1 h,于4 ℃下3 000 r/min离心15 min,收集沉淀,加水溶解,调节pH至中性,透析袋(1 kDa)脱盐,冻干得马铃薯蛋白,备用。
参照GB 5009.3—2016、GB 5009.4—2016、GB 5009.5—2016、GB 5009.9—2016中方法测定马铃薯蛋白中水分、灰分、蛋白质、淀粉含量;采用苯酚-硫酸法测定马铃薯蛋白中可溶性总糖含量。
1.3.2 蛋白质氨基酸组成分析
参照鞠栋等[17]的方法。蛋白经酸解后,采用全自动氨基酸分析仪分析氨基酸组成。
1.3.3 氨基酸营养价值指标及计算方法
在不同马铃薯蛋白氨基酸组成分析结果基础上,马铃薯蛋白氨基酸比值系数(ratio coefficient of amino acid,RCAA)与氨基酸比值系数分(score of ratio coefficient of amino acid,SRCAA)以FAO/WHO标准蛋白模式必需氨基酸组成为对照,参照鞠栋等[17]的方法。基于鸡蛋蛋白模式,计算马铃薯蛋白必需氨基酸指数(essential amino acid index,EAAI)、生物效价(biological valence,BV)、营养指数(nutrition index,NI)等指标,分别按公式(1)(2)(3)计算:
(1)
BV=1.09×EAAI-11.7
(2)
(3)
式中:A、B…I,必需氨基酸含量,mg/g;p,马铃薯蛋白;s,鸡蛋蛋白。
马铃薯蛋白相对于标准蛋白(鸡蛋蛋白)贴近度:以鸡蛋蛋白中必需氨基酸组成为对照,参照赵凤敏等[18]的方法进行计算。
1.3.4 不同热处理方式下马铃薯蛋白消化率
马铃薯蛋白溶液(8 mg/mL)置于三角瓶中封口后分别于100 ℃下水浴处理30 min、121 ℃下处理20 min、700 W下微波处理3 min后,分别冻干备用,得常压热处理、高压热处理、微波处理马铃薯蛋白;取一定量马铃薯蛋白粉,于鼓风干燥箱内130 ℃下处理1 h,得干热处理马铃薯蛋白,测定不同热处理方式下马铃薯蛋白消化率。
马铃薯蛋白消化率测定参照文献[19-20]的方法,稍作修改。取10 mL质量浓度为4 mg/mL,pH 1.5的马铃薯蛋白溶液,按酶底质量比1∶100加入5 mg/mL胃蛋白酶溶液(用0.01 mol/L HCl溶液配制),充分混合后于37 ℃下水浴振荡(150 r/min)消化30 min,用1 mol/L NaOH溶液调节酶解液pH至7.8,按酶底质量比1∶30加入5 mg/mL胰酶(pH 7.0磷酸缓冲液),充分混合后于40 ℃下水浴振荡(150 r/min)消化120 min,随后加入100 μL 150 mmol/L的Na2CO3溶液终止反应。消化液用2 kDa透析袋透析过夜后,冻干,得未消化马铃薯蛋白,采用微量凯氏定氮法测定未消化马铃薯蛋白含量。马铃薯蛋白消化率按公式(4)计算:
马铃薯蛋白消化率/%=
(4)
1.3.5 不同常压热处理时间下马铃薯蛋白消化率及胰蛋白酶抑制剂活性测定
取一定量马铃薯蛋白与蒸馏水混合,配制成质量浓度为8 mg/mL蛋白溶液,马铃薯蛋白溶液分别置于100 ℃下处理0、10、20、30、40、50、60 min后,冻干,测定冻干粉中蛋白消化率及胰蛋白酶抑制剂活性(trypsin inhibitor activity,TIA)。
马铃薯TIA测定按照参照文献[21-22]的方法进行。取4支10 mL试管,分别标记为a、b、c、d,其中a试管中加入2.0 mL蒸馏水;b管中加入2.0 mL胰蛋白酶溶液,2.0 mL蒸馏水;c试管中加入1.0 mL上述热处理后马铃薯蛋白溶液(pH 9.4~9.6),1.0 mL蒸馏水;d试管中加入1.0 mL上述热处理后马铃薯蛋白溶液,1.0 mL蒸馏水,2.0 mL胰蛋白酶溶液。各试管充分混匀后,于37 ℃下预热10 min,随后向每个试管中加入5.0 mL 37 ℃预热的BAPNA,充分混匀后,37 ℃下反应10 min,随后,立即向各试管中加入1.0 mL 体积分数30%的乙酸终止反应,且向a和c试管中分别加入2.0 mL胰蛋白酶溶液,混合液于1 500 r/min下离心10 min后,上清液于410 nm下比色,记录各管吸光值分别为Aa、Ab、Ac、Ad,设定Ae=(Ab-Aa)-(Ad-Ac),在此需调整待测马铃薯蛋白溶液浓度,使得40%<100 Ae/(Ab-Aa)<60%,此外,经测定,1 μg胰蛋白酶可导致吸光值变化幅度为0.019,马铃薯蛋白TIA按公式(5)计算:
TIA/(mg 胰蛋白酶·g-1 马铃薯![]()
(5)
式中:D,测定过程中马铃薯蛋白溶液稀释倍数;c,初始马铃薯蛋白溶液浓度。
BAPNA溶液配制:40 mg BAPNA完全溶解于1 mL二甲基亚砜中,用50 mmol/L pH 8.2 Tris缓冲液(含20 mmol/L CaCl2)定容至100 mL。胰蛋白酶溶液配制:用1 mmol/L HCl溶液溶解至最终质量浓度为20 mg/L。
1.3.6 数据分析
所有试验均重复3次,利用SPSS Statistics软件进行数据统计分析,数据均以均值±标准差表示,显著水平为P<0.05。
2 结果与分析
2.1 不同品种马铃薯蛋白基本成分
由表1可知,鄂10、鄂11、米拉等3个品种马铃薯蛋白的纯度分别为73.48%、75.37%、80.36%;可溶性糖含量分别为7.34%、6.76%、5.92%;淀粉含量分别为0.86%、1.05%、0.46%;灰分含量分别为5.12%、4.37%、3.08%。
表1 不同品种马铃薯蛋白基本成分 单位:%
Table 1 Composition of potato protein from different varieties
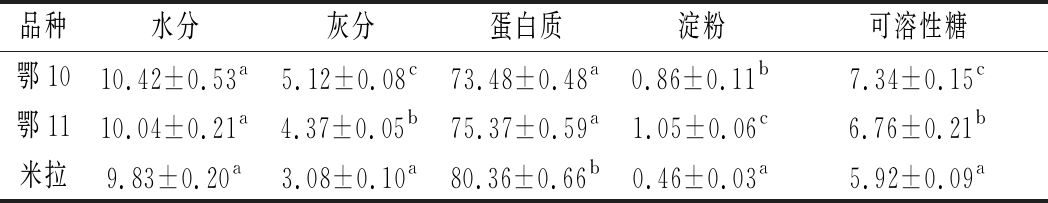
品种水分灰分蛋白质淀粉可溶性糖鄂1010.42±0.53a5.12±0.08c73.48±0.48a0.86±0.11b7.34±0.15c鄂1110.04±0.21a4.37±0.05b75.37±0.59a1.05±0.06c6.76±0.21b米拉9.83±0.20a3.08±0.10a80.36±0.66b0.46±0.03a5.92±0.09a
2.2 不同品种马铃薯蛋白氨基酸组成
由表2可知,鄂10、鄂11、米拉等3个品种马铃薯蛋白均检测出17种氨基酸(未检测出色氨酸),包括8种必需氨基酸(酪氨酸由苯丙氨酸转化而成)、9种非必需氨基酸,总氨基酸含量分别为732.37、745.48、788.68 mg/g,其中必需氨基酸含量分别为327.53、317.98、349.02 mg/g,必需氨基酸占总氨基酸比例分别为44.72%、42.65%、44.25%,必需氨基酸与非必需氨基酸含量比值分别为0.81、0.74、0.79。齐斌等[16]制备的马铃薯蛋白中必需氨基酸占总氨基酸比例为44.02%,必需氨基酸含量与非必需氨基酸含量比值为0.79,与本研究结果接近,且亦未检测出色氨酸。
表2 不同品种马铃薯蛋白氨基酸含量 单位:mg/g
Table 2 Content of amino acid of potato protein from different varieties
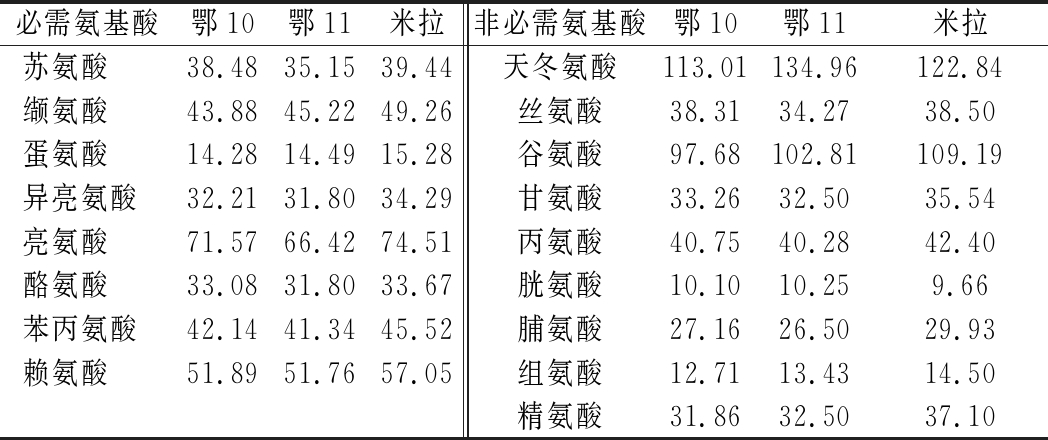
必需氨基酸鄂10鄂11米拉非必需氨基酸鄂10鄂11米拉苏氨酸38.4835.1539.44天冬氨酸113.01134.96122.84缬氨酸43.8845.2249.26丝氨酸38.3134.2738.50蛋氨酸14.2814.4915.28谷氨酸97.68102.81109.19异亮氨酸32.2131.8034.29甘氨酸33.2632.5035.54亮氨酸71.5766.4274.51丙氨酸40.7540.2842.40酪氨酸33.0831.8033.67胱氨酸10.1010.259.66苯丙氨酸42.1441.3445.52脯氨酸27.1626.5029.93赖氨酸51.8951.7657.05组氨酸12.7113.4314.50精氨酸31.8632.5037.10
2.3 马铃薯蛋白营养价值评价
2.3.1 基于FAO/WHO标准蛋白模式的马铃薯蛋白RCAA
RCAA表示样品蛋白必需氨基酸组成与FAO/WHO标准蛋白必需氨基酸组成接近程度,RCAA<1表示与FAO/WHO标准蛋白相比,该种氨基酸含量相对不足;RCAA>1表示该种氨基酸含量相对过剩,RCAA值最小的氨基酸即为样品蛋白第一限制性氨基酸[17]。此外,SRCAA反映样品蛋白总体营养价值高低,该值越接近100,表示该样品蛋白营养价值越高。由表3可知,鄂10、鄂11、米拉等3个品种的马铃薯蛋白第一限制性氨基酸均为蛋氨酸,且缬氨酸、异亮氨酸含量均相对不足;马铃薯蛋白SRCAA值从高到低依次为米拉(71.17)、鄂11(71.16)、鄂10(70.76),3个品种间SRCAA值相差较小。赵凤敏等[18]测定了29个品种马铃薯蛋白RCAA与SRCAA,结果表明,29个品种中24个品种马铃薯蛋白第一限制性氨基酸为苏氨酸、4个品种为亮氨酸、1个品种为异亮氨酸,且蛋氨酸+半胱氨酸含量均相对过剩,异亮氨酸、亮氨酸、苯丙氨酸+酪氨酸、赖氨酸含量均相对不足;SRCAA值介于16.96~65.94,平均值仅为![]() 等[23]对13个品种马铃薯蛋白氨基酸组成进行分析,结果表明,4个品种马铃薯蛋白第一限制性氨基酸为蛋氨酸、7个品种为亮氨酸、2个品种为赖氨酸。马铃薯蛋白中氨基酸组成与含量与马铃薯品种有关,也受种植栽培条件的影响[16,23]。
等[23]对13个品种马铃薯蛋白氨基酸组成进行分析,结果表明,4个品种马铃薯蛋白第一限制性氨基酸为蛋氨酸、7个品种为亮氨酸、2个品种为赖氨酸。马铃薯蛋白中氨基酸组成与含量与马铃薯品种有关,也受种植栽培条件的影响[16,23]。
表3 不同品种马铃薯蛋白RCAA
Table 3 RCAA of potato protein from different varieties
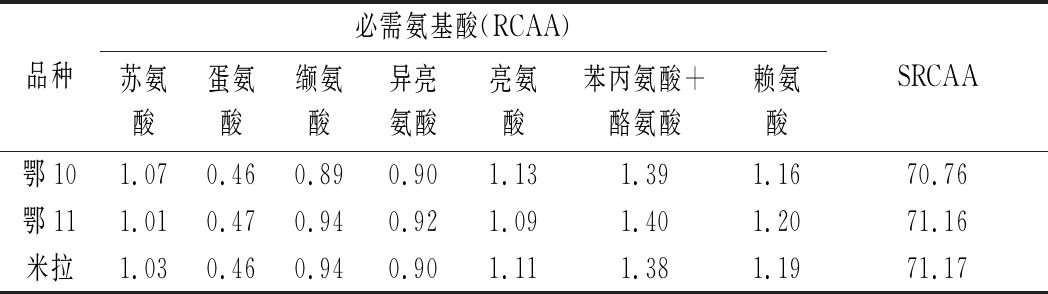
品种必需氨基酸(RCAA)苏氨酸蛋氨酸缬氨酸异亮氨酸亮氨酸苯丙氨酸+酪氨酸赖氨酸SRCAA鄂101.070.460.890.901.131.391.1670.76鄂111.010.470.940.921.091.401.2071.16米拉1.030.460.940.901.111.381.1971.17
2.3.2 基于鸡蛋蛋白模式的马铃薯蛋白营养价值评价
由表4可知,相对于鸡蛋蛋白,鄂10、鄂11、米拉等3个品种马铃薯蛋白贴近度分别为0.865、0.858、0.884,均超过0.85,接近1,这与赵凤敏等[18]研究结果相近。相对于鸡蛋蛋白,米拉EAAI最高,鄂10次之,鄂11最小,分别为67.54、63.27、61.81。BV是评价蛋白经消化吸收后利用的程度,米拉BV最高达61.92,鄂11最低仅55.67。鄂10、鄂11、米拉3个品种马铃薯蛋白NI分别为42.07、41.96、49.76。
表4 不同品种马铃薯蛋白营养价值评价
Table 4 Nutrition value evaluation of potato protein from different varieties
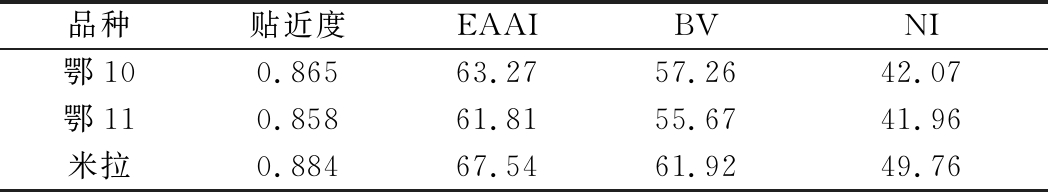
品种贴近度EAAIBVNI鄂100.86563.2757.2642.07鄂110.85861.8155.6741.96米拉0.88467.5461.9249.76
2.4 不同热处理方式对马铃薯蛋白消化率的影响
由图1可知,热处理方式对马铃薯蛋白消化率有显著影响(P<0.05),高压热处理马铃薯蛋白消化率最高,处理后鄂10、鄂11、米拉等蛋白消化率分别达82.77%、88.92%、89.69%;干热处理马铃薯蛋白消化率最低,处理后鄂10、鄂11、米拉等蛋白消化率分别仅为53.54%、51.74%、51.50%。常压、高压热处理后鄂10的蛋白消化率显著低于鄂11和米拉,后两者间无显著差异;微波处理的鄂10、鄂11、米拉等3个品种马铃薯蛋白消化率存在显著差异,分别为64.63%、66.68%、62.34%;干热处理后鄂10的蛋白消化率显著高于鄂11和米拉,后两者间无显著差异。VANGA等[24]研究结果表明,未经处理豆奶蛋白消化率为77.35%,随着超声处理时间延长,豆奶蛋白消化率呈上升变化趋势,超声波处理16 min后,消化率可达84.03%;85 ℃微波处理6 min,豆奶蛋白消化率可达91.38%。
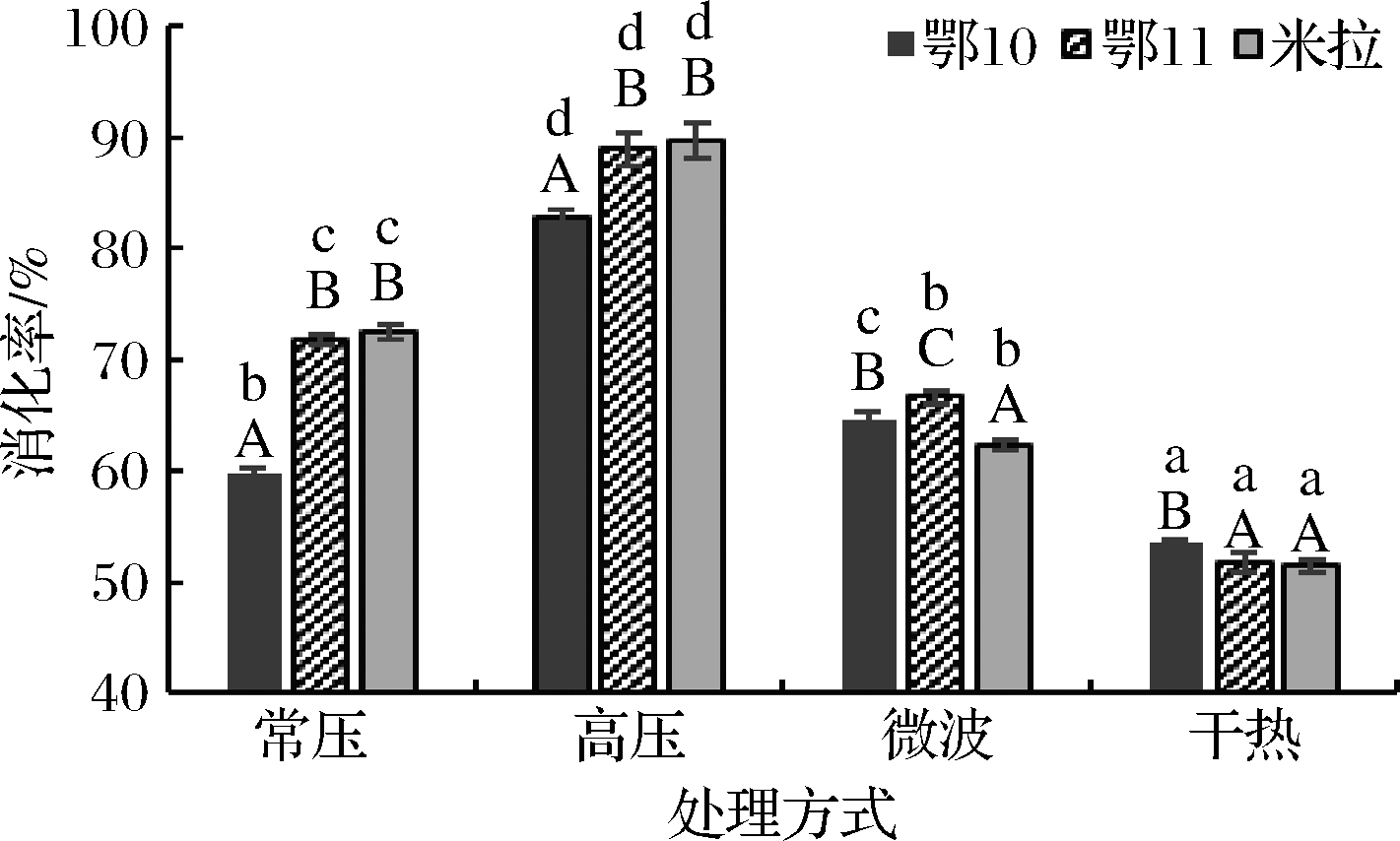
图1 热处理方式对马铃薯蛋白消化率的影响
Fig.1 Effect of heat-treated method on digestibility of potato protein
注:小写字母不同表示相同品种不同热处理方式间存显著性差异(P<0.05);大写字母不同表示相同热处理方式不同品种间存在显著性差异(下同)
2.5 常压热处理时间对马铃薯蛋白胰蛋白酶抑制剂活性影响
由图2可知,常压热处理时间对马铃薯蛋白TIA有显著影响,未经处理鄂10、鄂11、米拉等3个品种马铃薯蛋白TIA分别为537.81、524.28、471.41 mg/g,常压热处理40 min内,马铃薯蛋白TIA值与热处理时间呈显著负相关(P<0.05);热处理40 min后,热处理时间对马铃薯蛋白TIA无显著影响,常压热处理60 min后,鄂10、鄂11、米拉等3个品种马铃薯蛋白TIA分别降至20.24、20.07、13.41 mg/g。相同热处理时间下,马铃薯品种鄂10、鄂11蛋白的TIA显著高于米拉。LI等[7]研究表明,随着热处理温度与时间延长,从马铃薯汁中回收马铃薯分离蛋白的TIA显著降低,与未处理马铃薯分离蛋白相比,马铃薯分离蛋白于70 ℃下热处理70 min,其TIA值下降了86.13%。WAGLAY等[5]比较了热沉、酸沉法及FeCl3、乙醇、(NH4)2SO4等试剂沉淀制备的马铃薯蛋白的TIA,其中酸沉法制备马铃薯蛋白的TIA为493.6 mg/g,明显低于本研究中酸沉法制备鄂10、鄂11、米拉等马铃薯蛋白的TIA。
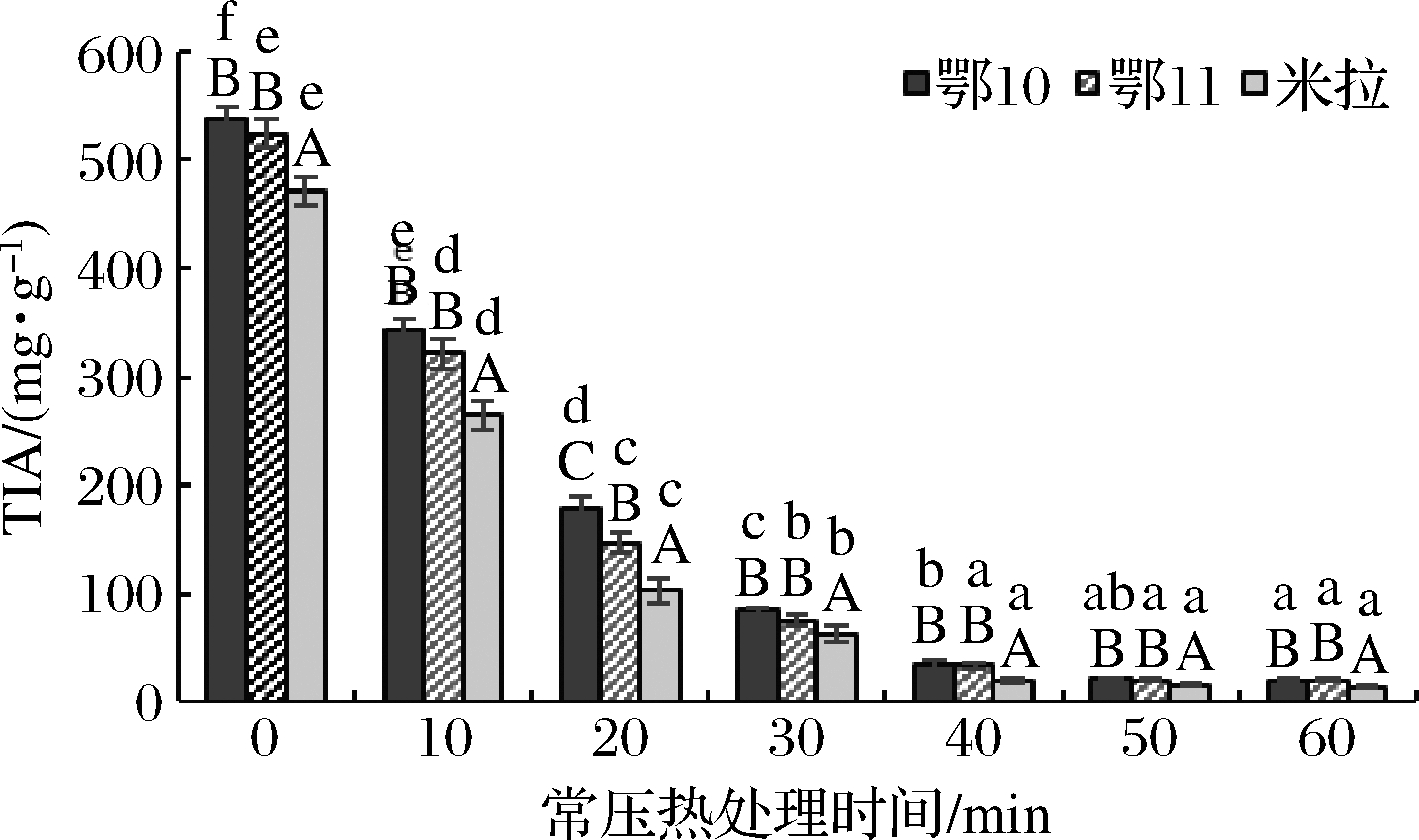
图2 常压热处理时间对马铃薯胰蛋白酶抑制剂活性影响
Fig.2 Effect of normal pressure heat-treated time on TIA of potato protein
2.6 常压热处理时间对马铃薯蛋白消化率的影响
由图3可知,常压热处理时间对马铃薯蛋白消化率有显著影响,未经处理鄂10、鄂11、米拉等3个品种马铃薯蛋白消化率分别为28.80%、42.95%、48.42%,常压热处理50 min内,热处理时间与马铃薯蛋白消化率呈显著正相关(P<0.05);热处理50 min后,热处理时间对马铃薯蛋白消化率无显著影响,常压热处理60 min后,鄂10、鄂11、米拉等3个品种马铃薯蛋白消化率分别达72.47%、82.55%、83.75%。相同热处理时间下,鄂10的蛋白消化率显著低于鄂11和米拉;未经处理及热处理10、20、50 min时,米拉的蛋白消化率显著高于鄂11,其他热处理时间下这2个品种间蛋白消化率无显著差异。不同品种牛豆蛋白消化率也存在显著差异[25];多糖可以弱化水溶胶中蛋白间相互作用,使得蛋白酶更易与酶切位点结合,提高蛋白消化利用率[26]。
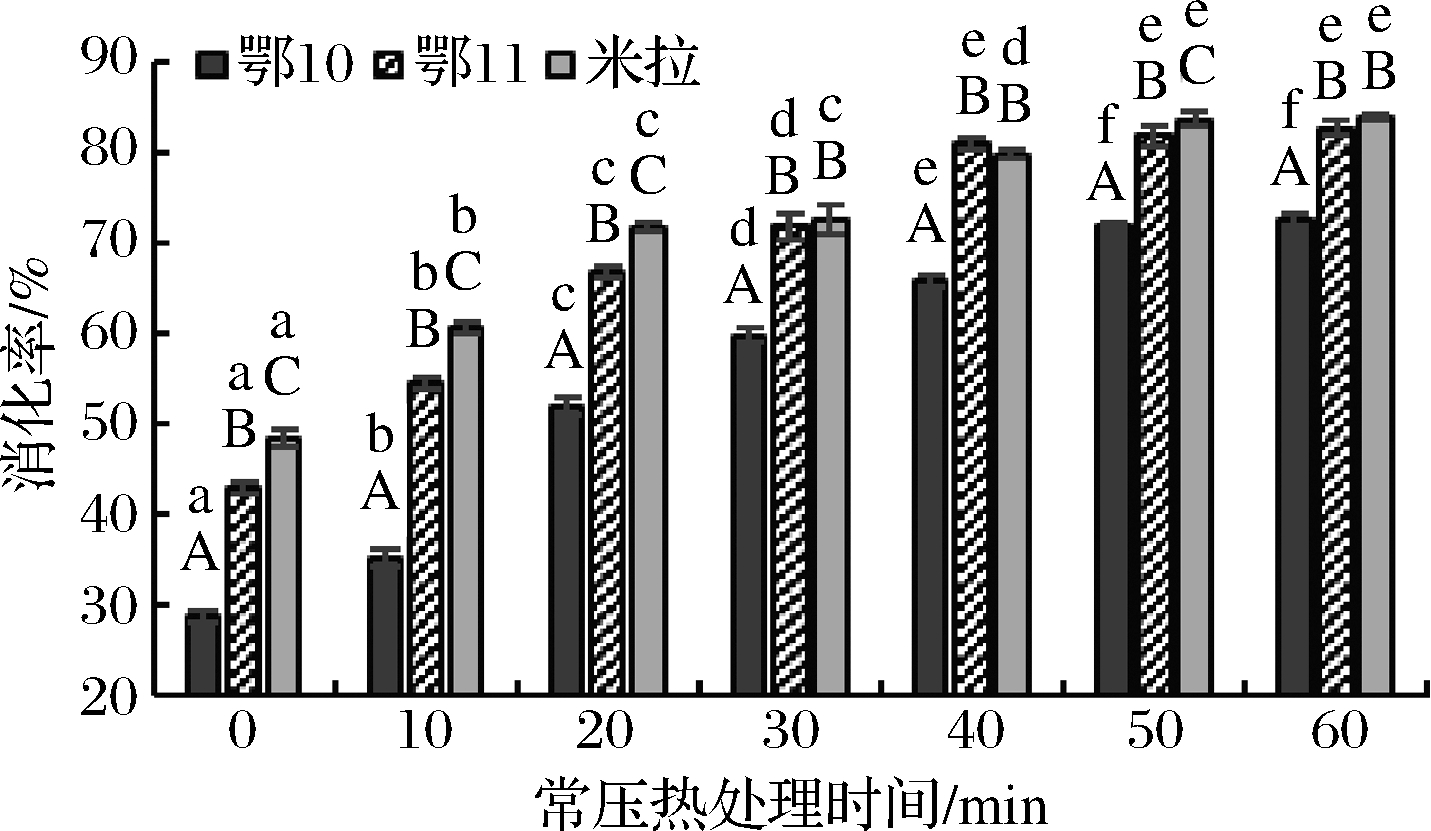
图3 常压热处理时间对马铃薯蛋白消化率的影响
Fig.3 Effect of normal pressure heat-treated time on digestibility of potato protein
3 结论与讨论
米拉、鄂10、鄂11等3个品种马铃薯蛋白均具有较高营养价值,相比之下,米拉营养价值较高、鄂11营养价值较低。鄂10、鄂11、米拉等3个品种马铃薯蛋白必需氨基酸占总氨基酸比例分别为44.72%、42.65%、44.25%,对比FAO/WHO标准蛋白模式,3个品种马铃薯蛋白第一限制性氨基酸均为蛋氨酸,且缬氨酸、异亮氨酸含量均相对不足,其SRCAA由高到低依次为71.17(米拉)、71.16(鄂11)、70.76(鄂10)。对比鸡蛋蛋白,鄂10、鄂11、米拉等3个品种马铃薯蛋白贴近度分别为0.865、0.858、0.884;EAAI分别为67.54、63.27、61.81;BV分别为57.26、55.67、61.92;NI分别为42.07、41.96、49.76。
热处理方式及常压热处理时间对马铃薯蛋白消化率有显著影响,几种处理方式下马铃薯蛋白消化率由高到低依次为高压热处理>微波>常压热处理>干热;常压、高压热处理下,鄂11和米拉蛋白消化率显著高于鄂10,而干热处理的鄂10蛋白消化率显著高于米拉和鄂11,高压热处理下,鄂10、鄂11和米拉蛋白消化率分别为82.77%、88.92%、89.69%。随着常压热处理时间延长,3个品种马铃薯蛋白TIA均呈下降趋势、消化率呈上升趋势,常压热处理0~50 min,相同品种不同处理时间下马铃薯蛋白TIA与消化率均存显著性差异。相同热处理条件不同品种间马铃薯蛋白消化率差异可能与品种有关,也可能与蛋白质中多糖含量有关,具体原因还有待进一步探讨。
[1] 邓晓君, 杨炳南,尹学清,等.国内马铃薯全粉加工技术及应用研究进展[J].食品研究与开发,2019,40(11):213-218.
DENG X J,YANG B N,YIN X Q,et al.Progress of processing technology and application of dehydrated potato granules and flakes powder in China[J].Food Research and Development,2019,40(11):213-218.
[2] 杨延辰, 何江涛,宋健宇,等.马铃薯泥工业化加工方法探讨[J].中国马铃薯,2019,33(2):110-113.
YANG Y C,HE J T,SONG J Y,et al.Industrial processing method of mashed potato[J].Chinese Potato Journal,2019,33(2):110-113.
[3] 王芳, 刘雁南,赵文.推进中国马铃薯主食化进程研究[J].世界农业,2016,443:11-14.
WANG F,LIU Y N,ZHAO W.Research of advancing the course of using potato as staple food[J].World Agriculture,2016,443:11-14.
[4] 杨炳南,张小燕,赵凤敏,等.常见马铃薯品种特性分析及加工适宜性分类[J].食品科学技术学报,2016,34(1):28-36.
YANG B N,ZHANG X Y,ZHAO F M,et al.Characteristic analysis and processing suitability clustering of common potato cultivars[J].Journal of Food Science and Technology,2016,34(1):28-36.
[5] WAGLAY A,KARBOUNE S,ALLI I.Potato protein isolates:Recovery and characterization of their properties[J].Food Chemistry,2014,142:373-382.
[6] DABESTANI S,ARCOT J,CHEN V.Protein recovery from potato processing water:Pre-treatment and membrane fouling minimization[J].Journal of Food Engineering,2017,195:85-96.
[7] LI Q M,HUANG L,LUO Z G,et al.Stability of trypsin inhibitor isolated from potato fruit juice against pH and heating treatment and in vitro gastrointestinal digestion[J].Food Chemistry,2020,328:127152.
[8] RIBEIRO J A,SERQUIZ A C,SILVA P F,et al.Trypsin inhibitor from Tamarindus indica L.seeds reduces weight gain and food consumption and increases plasmatic cholecystokinin levels[J].Clinics (Sao Paulo,Brazil),2015,70(2):136-143.
[9] KIM J Y,PARK S C,KIM M H,et al.Antimicrobial activity studies on a trypsin-chymotrypsin protease inhibitor obtained from potato[J].Biochemical and Biophysical Research Communications,2005,330(3):921-927.
[10] ANDLINGER D J,BORNKEßEL A C,JUNG I,et al.Microstructures of potato protein hydrogels and aerogels produced by thermal crosslinking and supercritical drying[J].Food Hydrocolloids,2021,112:106305.
[11] WAGLAY A,ACHOURI A,KARBOUNE S,et al.Pilot plant extraction of potato proteins and their structural and functional properties[J].LWT,2019,113:108275.
[12] DACHMANN E,NOBIS V,KULOZIK U,et al.Surface and foaming properties of potato proteins:Impact of protein concentration,pH value and ionic strength[J].Food Hydrocolloids,2020,107:105981.
[13] 程宇, 程珂,陈力宏,等.不同方法制备马铃薯蛋白的结构及功能性质研究[J].食品科技,2015,40(2):228-232.
CHENG Y,CHENG K,CHEN L H,et al.Structural and functional properties of potato protein prepared using different methods[J].Food Science and Technology,2015,40(2):228-232.
[14] 周小理, 侍荣华,周一鸣,等.热处理方式对苦荞蛋白功能特性的影响[J].农业工程学报,2018,34(9):292-298.
ZHOU X L,SHI R H,ZHOU Y M,et al.Influence of heat treatment on function characteristics of tartary buckwheat protein[J].Transactions of Chinese Society of Agricultural Engineering,2018,34(9):292-298.
[15] 赵城彬, 尹欢欢,鄢健楠,等.不同热处理条件下大豆蛋白体外模拟消化产物结构和分子质量分布[J].中国食品学报,2020,20(5):59-65.
ZHAO C B,YIN H H,YAN J N,et al.Structure and molecular weight distribution in vitro digestion products of soy protein at different heat treatment conditions[J].Journal of Chinese Institute of Food Science and Technology,2020,20(5):59-65.
[16] 齐斌, 郑丽雪,朴金苗.马铃薯分离蛋白的提取工艺[J].食品科学,2010,31(22):297-300.
QI B,ZHENG L X,PIAO J M.Extraction processing of potato protein isolate[J].Food Science,2010,31(22):297-300.
[17] 鞠栋, 木泰华,孙红男,等.不同工艺马铃薯粉物化特性及氨基酸组成比较[J].核农学报,2017,31(6):1 100-1 109.
JU D,MU T H,SUN H N,et al.Comparison study on physicochemical property and amino acid composition of potato flour made by different processing methods[J].Journal of Nuclear Agricultural Sciences,2017,31(6):1 100-1 109.
[18] 赵凤敏, 李树君,张小燕,等.不同品种马铃薯的氨基酸营养价值评价[J].中国粮油学报,2014,29(9):13-18.
ZHAO F M,LI S J,ZHANG X Y,et al.Nutritional evaluation of amino acids in different potato cultivars[J].Journal of the Chinese Cereals and Oils Association,2014,29(9):13-18.
[19] VILELA R M,LANDS L C,CHAN H M,et al.High hydrostatic pressure enhances whey protein digestibility to generate whey peptides that improve glutathione status in CFTR-deficient lung epithelial cells[J].Molecular Nutrition & Food Research,2006,50(11):1 013-1 029.
[20] LIU G Q,GILDING E K,KERR E D,et al.Increasing protein content and digestibility in sorghum grain with a synthetic biology approach[J].Journal of Cereal Science,2019,85:27-34.
[21] SMITH C,VAN MEGEN W,TWAALFHOVEN L,et al.The determination of trypsin inhibitor levels in foodstuffs[J].Journal of the Science of Food and Agriculture,1980,31(4):341-350.
[22] POUVREAU L,GRUPPEN H,PIERSMA S R,et al.Relative abundance and inhibitory distribution of protease inhibitors in potato juice from cv.Elkana[J].Journal of Agricultural and Food Chemistry,2001,49:2 864-2 874.
[23] ![]() A,KITA A,KU
A,KITA A,KU AKOWSKA K,et al.The quality of protein of coloured fleshed potatoes[J].Food Chemistry,2013,141(3):2 960-2 966.
AKOWSKA K,et al.The quality of protein of coloured fleshed potatoes[J].Food Chemistry,2013,141(3):2 960-2 966.
[24] VANGA S K,WANG J,RAGHAVAN V.Effect of ultrasound and microwave processing on the structure,in-vitro digestibility and trypsin inhibitor activity of soymilk proteins[J].LWT,2020,131:109708.
[25] TEKA T A,RETTA N,BULTOSA G,et al.Protein fractions,in vitro protein digestibility and amino acid composition of select cowpea varieties grown in Ethiopia[J].Food Bioscience,2020,36:100634.
[26] OZEL B,AYDIN O,OZTOP M H.In vitro digestion of polysaccharide including whey protein isolate hydrogels[J].Carbohydrate Polymers,2020,229:115469.