双歧杆菌作为人体肠道中非常重要的一类菌群,具有调节肠道菌群,维持肠道菌群环境平衡;增强机体免疫及改善蛋白质代谢,促进蛋白质吸收等多种生物学功能[1]。但是双歧杆菌是一类挑剔的微生物,其生长所需的营养物质较为复杂,对氮源的需求更为苛刻。目前市面上可商业化的双歧杆菌多为动物双歧杆菌、短双歧杆菌和长双歧杆菌,两歧双歧杆菌较少。因为两歧双歧杆菌的制备非常困难,且大部分的两歧双歧杆菌的耐渗透压能力弱,这就意味着氮源中不被利用的成分将通过增加发酵液的渗透压对菌株的生长产生抑制作用,氮源能否被有效利用是制约其生长的一个关键因素。
为了在蛋白质丰富的环境中生长,乳酸菌在不断进化过程中形成了蛋白水解系统来降解外源蛋白,产生多肽及游离氨基酸以满足自身的生长需求。蛋白水解系统主要由3个部分组分[2-3]:将外源大分子蛋白水解成多肽的细胞壁蛋白酶(cell envelope protease,CEP);将多肽转运进入细胞内的多个肽转运系统;以及将转运进入细胞内的多肽进一步水解成游离氨基酸的多种肽酶。双歧杆菌的形态和生理特征与乳酸菌相似[4],但其蛋白水解系统并不完备。JANER等[5]研究发现,在动物双歧杆菌中不含CEP活性,但是鉴定并表征出细胞壁内肽酶PepO。CHANG等[6]研究也发现在长双歧杆菌KACC中不存在CEP,尽管在长双歧杆菌DJO10A以及长双歧杆菌婴儿亚种ATCC15697中存在一种类似枯草芽孢杆菌蛋白酶的丝氨酸蛋白酶,但是对其遗传和生化特性及鉴定仍未见报道。
虽然大部分双歧杆菌缺乏CEP,但王靖麟等[7]发现,鲟鱼肝蛋白酶解液对6株双歧杆菌均具有显著的促生长效果,说明经处理后得到的多肽和游离氨基酸可被菌株利用以满足其生长需求。张娜等[8]利用碱性蛋白酶水解大豆蛋白后得到的组分能够有效促进双歧杆菌L80的增殖。这些现象表明,双歧杆菌蛋白水解系统不完备,水解蛋白质的能力弱,但可以利用环境中的多肽及游离氨基酸进行生长。因此,通过不同途径制备得到的氮源,其多肽及游离氨基酸的组成将是制约双歧杆菌生长的关键因素。本文所研究的两歧双歧杆菌F35在前期实验中,已从基因型和表型两方面验证其不存在CEP相关活性,在此基础上,将系统探究两歧双歧杆菌F35对不同氮源的利用效率,并对氮源的组成特性做进一步分析,为今后氮源生产企业针对两歧双歧杆菌生产适宜氮源提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
两歧双歧杆菌F35(CCFM16),由江南大学食品生物技术中心保藏。
1.1.2 试剂
葡萄糖、酵母粉、牛肉膏、蛋白胨、NaCl,谷氨酸、天冬氨酸、蛋氨酸等18种氨基酸,鸟嘌呤、腺嘌呤、黄嘌呤、叶酸、烟酸等13种碱基维生素,国药集团化学试剂有限公司;酵母浸粉888、酵母浸粉803、大豆蛋白胨、鱼骨蛋白胨,安琪酵母有限公司;胰蛋白胨、胰酪蛋白胨,郑州盛仁堂生物科技有限公司;鱼蛋白胨、牛骨蛋白胨,上海耐今实业有限公司;含17种氨基酸的标准溶液,美国Sigma公司;三乙胺、乙腈(色谱纯)、异硫氰酸苯酯(phenyl isothiocyanate,PITC)、酪蛋白,创赛生物科技有限公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;UV—2450紫外分光光度计,日本岛津公司;MS3 IKA振荡器,德国IKA;Waters 1525高效液相色谱仪,美国沃特世公司;AW500SG Electrotek厌氧工作站,英国依莱泰科;Ag 1100高效液相色谱仪,美国安捷伦公司;Lyobeta 5ps冻干机,西班牙泰式达公司;电热恒温水浴锅,上海森信实验有限公司。
1.3 实验方法
1.3.1 菌株的活化与菌体的制备
将冷藏于-80 ℃的保菌管取出,待其融化后,用接种环蘸取少量菌液于MRS-L固体培养基上划线,于厌氧工作站中37 ℃恒温培养48 h。待长出菌落后,挑取单菌落接种于5 mL MRS液体管中,厌氧培养18~24 h,按上述操作重复2~3次得到活化的菌液。
参考周兴雅[9]的方法,离心活化后的菌体,收集2 g以上菌泥待基因组测定。
1.3.2 两歧双歧杆菌利用不同氮源的增殖效果
准确称取25 g/L的酵母浸粉888、酵母浸粉803等上述8种氮源,替换MRS培养基中的全部氮源(牛肉膏、蛋白胨、酵母粉),配制成不同的含单一氮源的培养基,按2%的接种量接种上述活化好的菌液,厌氧工作站中37 ℃恒温培养至稳定期,测定OD600及pH,以MRS组为对照。
1.3.3 不同氮源组成成分分析
1.3.3.1 氮源分子质量分布的测定
采用高效液相色谱法测定分子质量的分布情况,洗脱条件:TSKgel 2000 SWXL色谱柱(300 mm×7.8 mm),流动相是V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1的混合溶液,柱温30 ℃,流速设置为0.5 mL/min,紫外检测器的检测波长220 nm。
1.3.3.2 氮源中游离氨基酸组成分析
称取1 g左右的氮源并准确记录质量,用0.5 g/L的三氯乙酸定容至25 mL,混匀后常温超声20 min,静置3 h。溶液经双层滤纸过滤后,取1 mL澄清的滤液于离心管中,15 000 r/min离心30 min后取400 μL待测。采用反相高效液相色谱(reverse phase high-performance liquid chromatography,RP-HPLC)测定氨基酸,进行PITC柱前衍生化[10]:取200 μL样品溶液于1.5 mL离心管中,加入100 μL体积分数14%三乙胺乙腈溶液,100 μL 体积分数1.25% PITC乙腈溶液,混匀后室温静置1 h。然后加入300 μL正己烷,摇匀后放置10 min,10 000 r/min离心5 min,取下层溶液,0.45 μm针头过滤器过滤。取20 μL上柱分析(Fortis C18,250 mm×4.6 mm),利用pH 6.5醋酸钠溶液(流动相A)和80%乙腈溶液(流动相B)进行梯度洗脱,流速1 mL/min,柱温43 ℃,检测波长254 nm,上样体积5 μL。
1.3.4 酪蛋白水解物对两歧双歧杆菌的促生长活性分析
1.3.4.1 酪蛋白水解物的制备
配制底物质量浓度70 g/L的酪蛋白溶液,95 ℃,10 min热处理钝化酶后,调整至风味蛋白酶最适反应温度和pH,加酶量为4 000 U/g 蛋白,采用pH-stat法使体系维持在最适pH±0.05,反应结束后立即沸水浴10 min使酶失活,冷却后将溶液pH值调整到4.6沉淀未水解的酪蛋白,8 000 r/min离心15 min后取上清液,冻干收集干粉备用。
1.3.4.2 促进两歧双歧杆菌生长活性的测定
将酪蛋白水解物、酪蛋白水解物与酵母浸粉888质量比1∶1的复合物,分别等氮量替换化学合成培养基(chemically defined medium,CDM)[11-12]中氮源(氨基酸),接种2%的活化菌液,于厌氧工作站中37 ℃恒温培养至稳定期,测定发酵液pH及OD600。
1.3.5 两歧双歧杆菌氨基酸营养缺陷型测定
关于氨基酸营养缺陷型的测定,采用CDM对两歧双歧杆菌进行测定。配制18种分别缺失1种氨基酸的培养基以及1种全氨基酸培养基,接种2%的活化菌液,于厌氧工作站中37 ℃恒温培养至稳定期,测定发酵液pH及OD600,测定菌株在各培养基中的生长情况,以全氨基酸培养基组为对照。
1.3.6 基因草图测序及组装
采用de novo从头测序。菌株的扫描采用Illumina HiSeq测序平台,对质检合格的DNA样品构建插入片段为400 bp的片段,进行PE150(pair-end)测序,即双端测序,单端测序读长150 bp,每个样品提供不低于基因组100×覆盖深度的原始测序数据量(raw data),最终组装得到多条基因组scaffold。由于Illumina Hiseq的原始测序数据会存在一些质量比较低的数据,另外一般raw data中会有极少部分的reads带有测序引物、接头等人工列,为了使后续的组装更加准确,测序过程中会对原始数据进行质量剪切,以得到高质量序列[13]。
利用软件SOAPdenovo2(http://soap.genomics.org.cn/)对二代测序后的优化序列进行多个Kmer参数的拼接,得到最优的contigs组装结果,然后把reads比对到contig上,根据reads的paired-end和overlap关系,对组装结果进行局部组装和优化,形成scaffolds。
1.3.7 基因组预测与注释
利用Glimmer[14](http://ccb.jhu.edu/software/glimmer/index.shtml),GeneMarkS[15],Prodigal软件对基因组中的编码序列(CDS)进行预测。利用tRNAscan-SE v2.0[16]软件(http://trna.ucsc.edu/software/)对基因组中包含的tRNA进行预测。
将预测得到的编码基因与数据库NR[17]、Swiss-Prot[18]、KEGG[19]比对进行功能基因注释。
1.3.8 生物信息分析
氨基酸合成代谢途径参照KEGG通路数据库进行挖掘;Uniprot(http://www.genome.jp/kegg/pathway.html)数据库中下载蛋白序列,使用本地BLASTP确认各基因在该基因组中的存在情况。
1.3.9 数据统计与分析
试验中每个实验值的测定均为3次平行实验的平均值,以平均值±标准偏差来表示,在后期的统计分析中不再重复强调。
2 结果
2.1 两歧双歧杆菌对不同氮源的利用效果
按照1.3.2的方法测定菌株对单位质量不同氮源的增殖效果,结果如表1所示。两歧双歧杆菌F35对胰蛋白胨、鱼蛋白胨以及牛骨蛋白胨表现最高的利用效率,其次是鱼骨蛋白胨、大豆蛋白胨和胰酪蛋白胨,但是对酵母浸粉类氮源的利用效果很差甚至几乎不利用。
表1 不同氮源培养基对两歧双歧杆菌F35生长的影响
Table 1 Effects of different nitrogen sources on the growth of B.bifidum F35
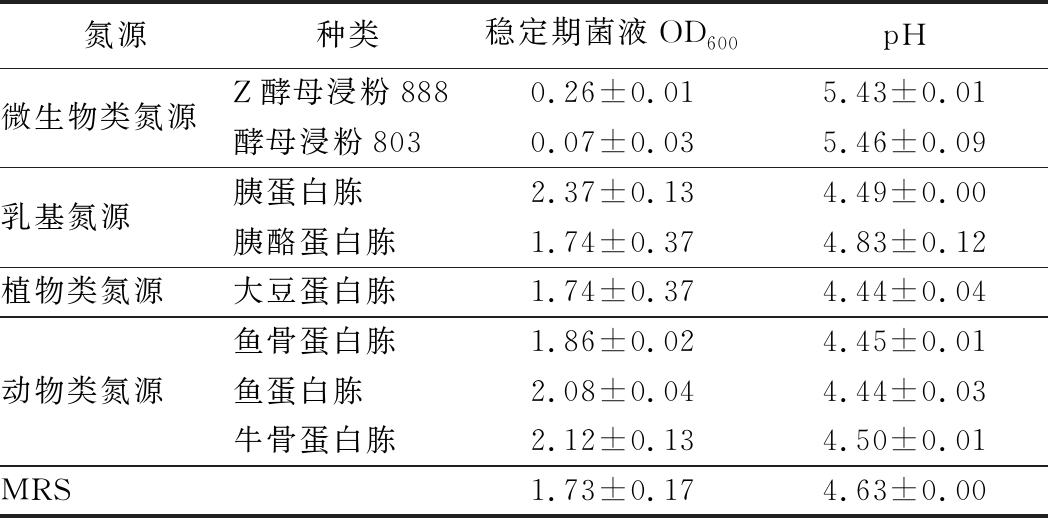
氮源种类稳定期菌液OD600pH微生物类氮源Z酵母浸粉8880.26±0.015.43±0.01酵母浸粉8030.07±0.035.46±0.09乳基氮源胰蛋白胨2.37±0.134.49±0.00胰酪蛋白胨1.74±0.374.83±0.12植物类氮源大豆蛋白胨1.74±0.374.44±0.04动物类氮源鱼骨蛋白胨1.86±0.024.45±0.01鱼蛋白胨2.08±0.044.44±0.03牛骨蛋白胨2.12±0.134.50±0.01MRS1.73±0.174.63±0.00
2.2 氮源分子质量组成
通过高效液相色谱法对不同氮源的分子质量分布进行测定,结果如表2所示。酵母浸粉888和酵母浸粉803氨基酸含量分别高达63.19%和66.99%,为胰蛋白胨、胰酪蛋白胨、大豆蛋白胨、鱼骨蛋白胨和牛骨蛋白胨5种氮源的2倍多,甚至达到鱼蛋白胨(12.61%)的5倍以上。
表2 氮源的分子质量分布
Table 2 Molecular weight distribution of nitrogen source
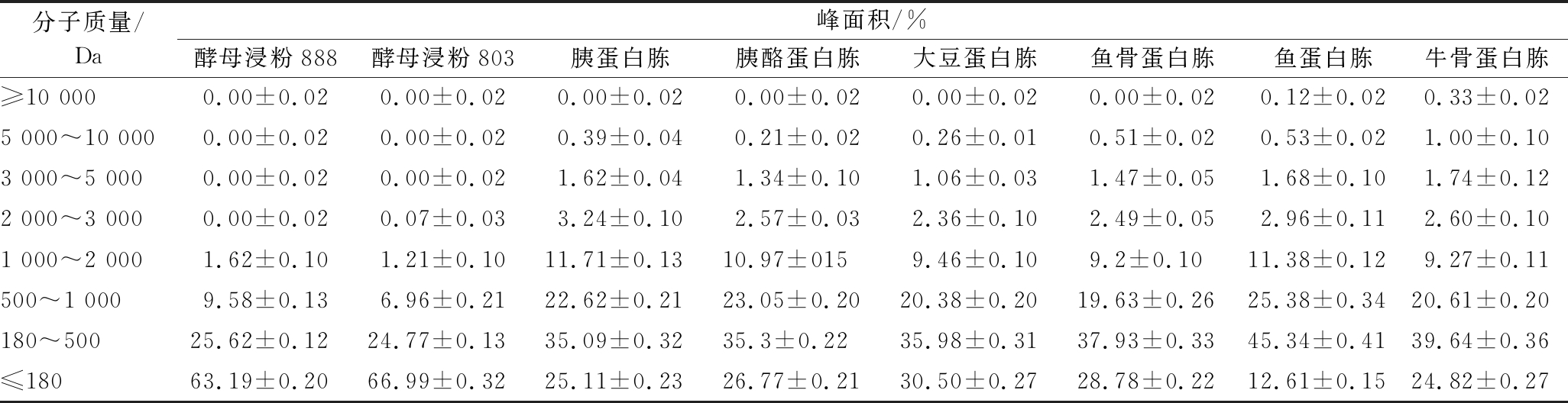
分子质量/Da峰面积/%酵母浸粉888酵母浸粉803胰蛋白胨胰酪蛋白胨大豆蛋白胨鱼骨蛋白胨鱼蛋白胨牛骨蛋白胨≥10 0000.00±0.020.00±0.020.00±0.020.00±0.020.00±0.020.00±0.020.12±0.020.33±0.025 000~10 0000.00±0.020.00±0.020.39±0.040.21±0.020.26±0.010.51±0.020.53±0.021.00±0.103 000~5 0000.00±0.020.00±0.021.62±0.041.34±0.101.06±0.031.47±0.051.68±0.101.74±0.122 000~3 0000.00±0.020.07±0.033.24±0.102.57±0.032.36±0.102.49±0.052.96±0.112.60±0.101 000~2 0001.62±0.101.21±0.1011.71±0.1310.97±0159.46±0.109.2±0.1011.38±0.129.27±0.11500~1 0009.58±0.136.96±0.2122.62±0.2123.05±0.2020.38±0.2019.63±0.2625.38±0.3420.61±0.20180~50025.62±0.1224.77±0.1335.09±0.3235.3±0.2235.98±0.3137.93±0.3345.34±0.4139.64±0.36≤18063.19±0.2066.99±0.3225.11±0.2326.77±0.2130.50±0.2728.78±0.2212.61±0.1524.82±0.27
此外,酵母浸粉888和酵母浸粉803中分子质量180~2 000 Da的多肽成分占比分别为36.82%和32.94%,仅为其他6种氮源中含量的一半。
2.3 不同类型氮源对菌株的增殖效果
如表3所示,从含有游离氨基酸的培养上和含有酪蛋白水解物的培养基上所获得的生长结果可以看出,生长至24 h时,游离氨基酸组几乎未表现生长(OD600<0.20),而酪蛋白水解物组已达到生长稳定期,且最终生长值远低于酪蛋白水解物组。
表3 不同类型氮源对两歧双歧杆菌F35生长的影响(OD600)
Table 3 Influence of different types of nitrogen sources on growth of B.bifidum F35(OD600)
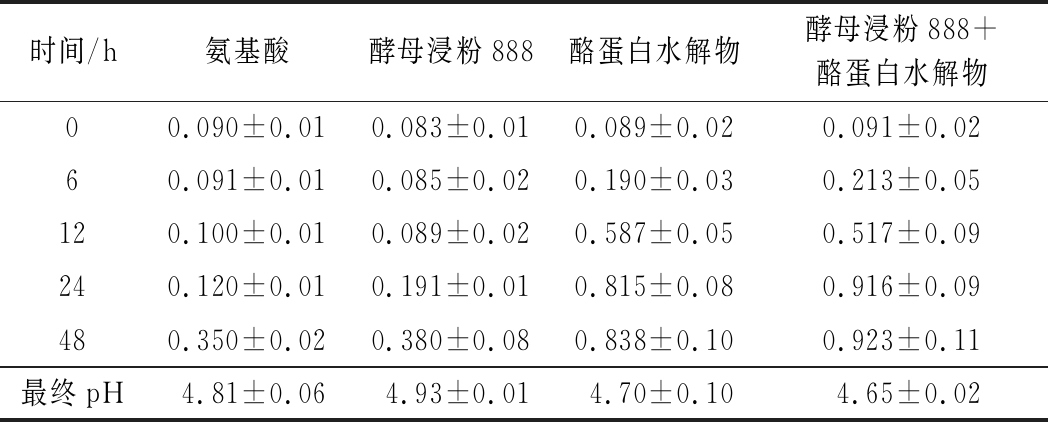
时间/h氨基酸酵母浸粉888酪蛋白水解物酵母浸粉888+酪蛋白水解物00.090±0.010.083±0.010.089±0.020.091±0.0260.091±0.010.085±0.020.190±0.030.213±0.05120.100±0.010.089±0.020.587±0.050.517±0.09240.120±0.010.191±0.010.815±0.080.916±0.09480.350±0.020.380±0.080.838±0.100.923±0.11最终pH4.81±0.064.93±0.014.70±0.104.65±0.02
酪蛋白水解物的分子质量分布如表4所示,酪蛋白水解物中180~2 000 Da的多肽含量高达88.63%,当酵母浸粉888与其1∶1复配后,相较于酵母浸粉888单一氮源组,两歧双歧杆菌生长值及生长效率显著提高。
表4 酪蛋白水解物分子质量分布
Table 4 Molecular weight distribution of casein hydrolysate
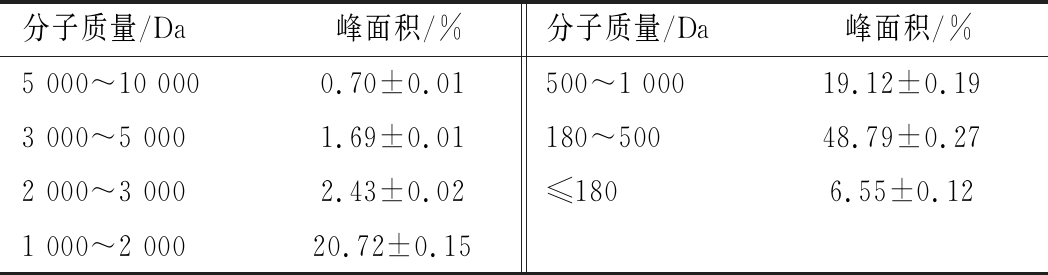
分子质量/Da峰面积/%分子质量/Da峰面积/%5 000~10 0000.70±0.01500~1 00019.12±0.193 000~5 0001.69±0.01180~50048.79±0.272 000~3 0002.43±0.02≤1806.55±0.121 000~2 00020.72±0.15
2.4 氨基酸转运及生物合成
如表5所示,两歧双歧杆菌基因组中存在着许多编码氨基酸转运系统的基因,以满足菌株生理代谢需求。两歧双歧杆菌可以通过谷氨酸ABC型转运系统转运谷氨酸,该系统主要是由4个蛋白组成,即ATP结合蛋白(GluA)、2个细胞膜蛋白(GluC、GluD)、细胞外溶质结合蛋白(GluB)。脂肪族氨基酸(色氨酸、酪氨酸、苯丙氨酸)可以由转运系统AroP转运进入细胞内。蛋氨酸ABC型转运系统可以将蛋氨酸转运进入细胞内,该系统由底物结合蛋白(MetQ)、渗透酶蛋白(MetI)以及ATP结合蛋白(MetN)。半胱氨酸可以由相应的TcyP转运系统转运进入细胞内以满足菌株生长需求。
表5 两歧双歧杆菌F35的氨基酸转运系统
Table 5 Amino acid transport system of B.bifidum F35
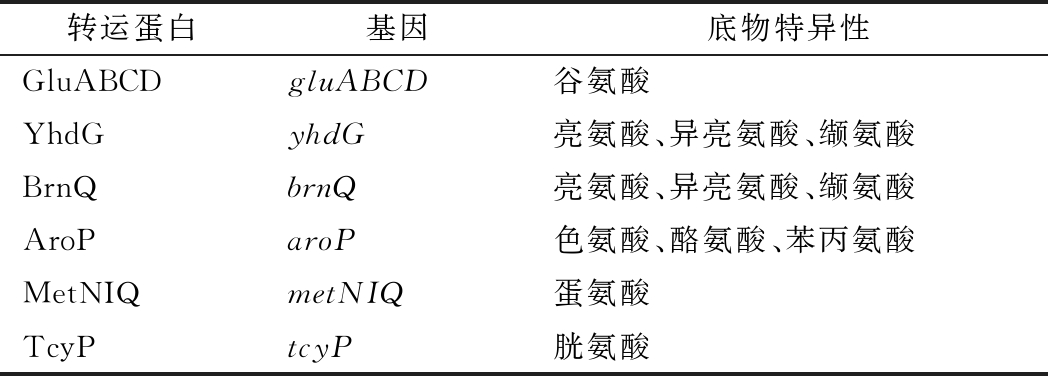
转运蛋白基因底物特异性GluABCDgluABCD谷氨酸YhdGyhdG亮氨酸、异亮氨酸、缬氨酸BrnQbrnQ亮氨酸、异亮氨酸、缬氨酸AroParoP色氨酸、酪氨酸、苯丙氨酸MetNIQmetNIQ蛋氨酸TcyPtcyP胱氨酸
在细菌中,一般至少存在2种类型的支链氨基酸转运蛋白,一种是高亲和力的ABC型转运蛋白,另一种是低亲和力的支链氨基酸渗透酶[20-21]。在两歧双歧杆菌中仅存在具有低亲和力的BrnQ和YhdG蛋白,这2种渗透酶均具有转运支链氨基酸的能力[22-23],同时还可以在一定程度上转运蛋氨酸。
两歧双歧杆菌F35的18种氨基酸生物合成途径注释结果表明,除半胱氨酸外,该菌株具有利用分支酸、草酰乙酸、丙酮酸等物质合成其他17种氨基酸的的完整生物合成途径,因此该菌株具有合成这17种氨基酸的能力,其相关基因的分布情况如图1 所示。
2.5 氨基酸营养缺陷型分析
为了从表型上对两歧双歧杆菌氨基酸生物合成分析结果做进一步验证,采用1.3.5的方法进行测定,结果如图2所示。当两歧双歧杆菌在CDM上培养时,其最高生长值(OD600=0.57±0.02)比在含丰富氮源的MRS上培养时所获得的最高生长值(OD600=1.73±0.17)明显降低,且增殖时间由MRS上的24 h延长至72 h,增殖效率显著降低。仅当剔除或者添加Cys时,所获得的生长值会发生显著降低(OD600<0.20)或升高。
2.6 氮源的氨基酸组成及其对菌株生长的影响
对8种氮源的游离氨基酸组成分析,结果如表6。结果表明,8种氮源中游离氨基酸种类不存在差异性,但酵母浸粉类氮源中疏水性氨基酸的总量显著高于其他几种氮源,为其他各氮源中疏水性氨基酸总量的2倍以上。
疏水性氨基酸对菌株生长的影响的探究结果如图3所示,当CDM中剔除疏水性氨基酸后,获得的最大生长值高出全氨基酸培养基组29%。

图1 两歧双歧杆菌氨基酸生物合成相关基因分布图
Fig.1 Distribution of genes related to amino acid biosynthesis of B.bifidum
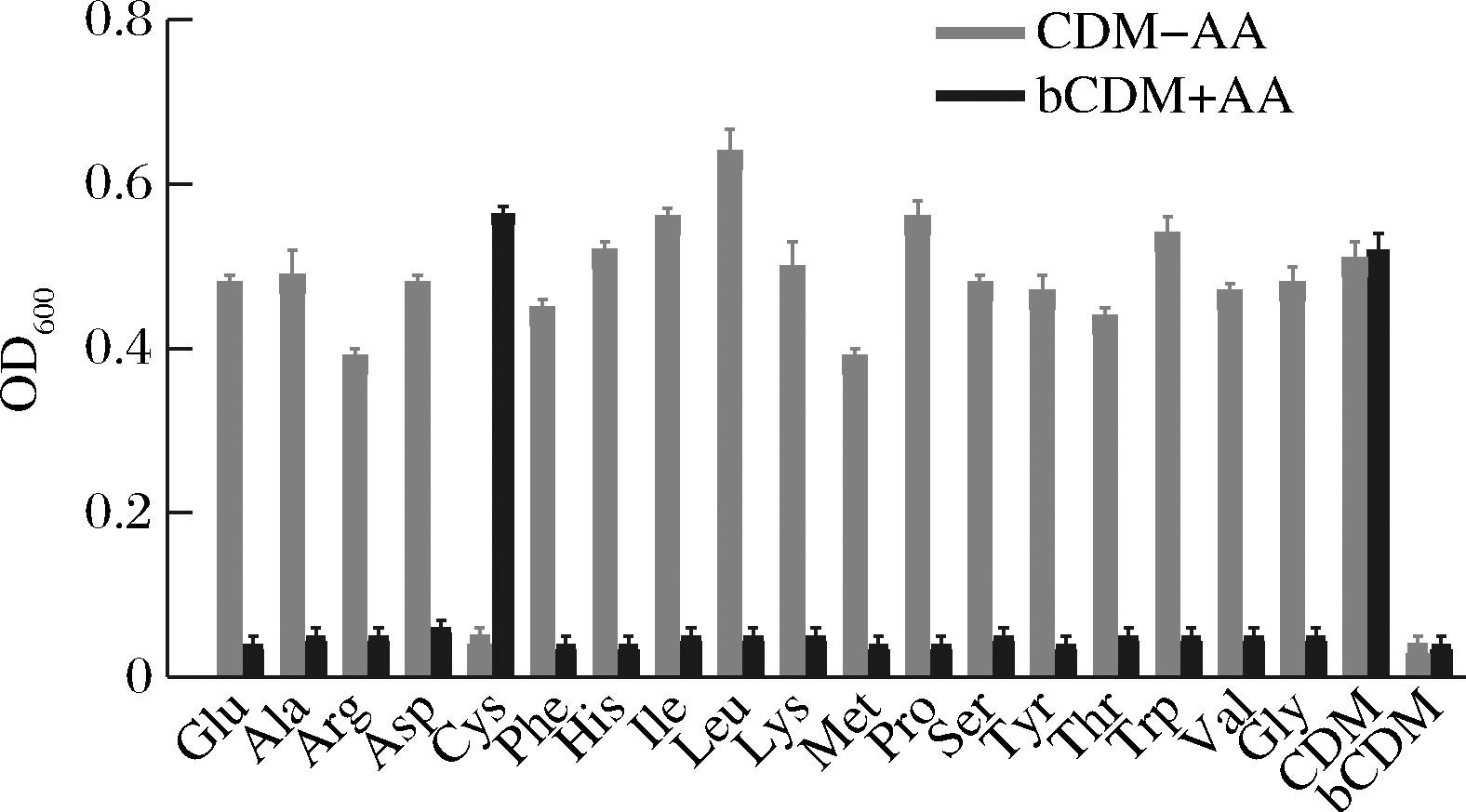
CDM-AA-化学合成培养基中剔除该氨基酸; bCDM+AA-基础化学合成培养基上添加该氨基酸
图2 两歧双歧杆菌F35在CDM上的生长情况
Fig.2 Growth of B.bifidum F35 on CDM
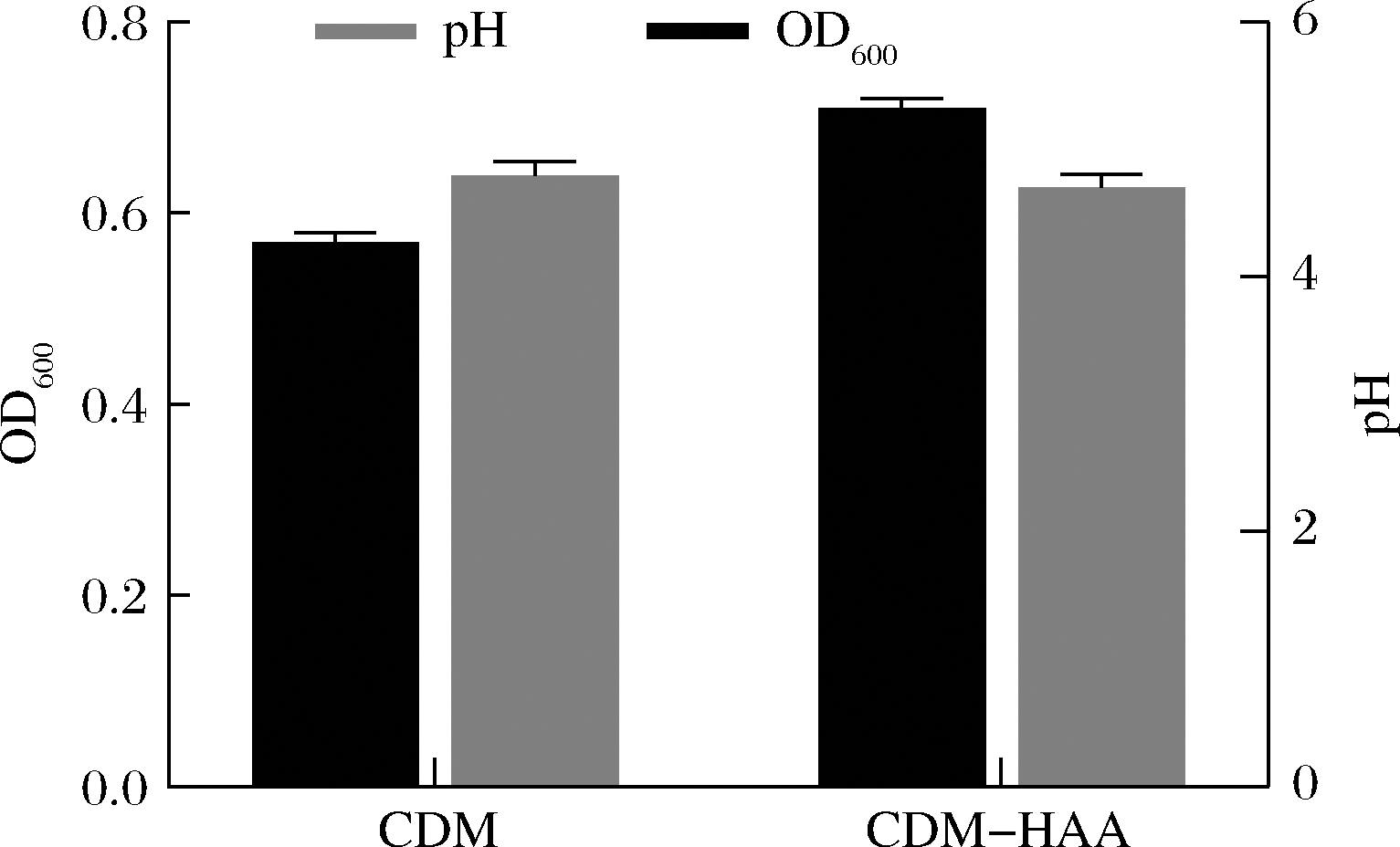
图3 疏水性氨基酸对两歧双歧杆菌F35生长的影响
Fig.3 Effect of hydrophobic amino acids on growth of B.bifidum F35
3 讨论与结论
通过不同氮源对两歧双歧杆菌F35的增殖结果可以看出,两歧双歧杆菌F35对不同氮源的利用存在偏好性。氮源在菌株生长过程中为其提供氨基酸、多肽等营养物质以满足其生长需求,由于双歧杆菌较弱的蛋白水解活性,故其增殖速度的快慢与培养基中所含有的游离氨基酸和小分子肽的含量密切相关。对氮源的分子质量组成的进一步研究发现,酵母浸粉类氮源中游离氨基酸含量为其他氮源的2~5倍,但2 000 Da以下小分子肽含量仅为其他氮源的一半,TURRONI等[24]曾报道肽链的长短是决定肽促进乳酸菌生长活性强弱的一个重要因素;张清丽[25]在研究酪蛋白肽对乳酸菌的促生长作用时也发现,分子质量<3 kDa的成分是酶解物中主要的促生长因子;此外,PROULX等[26]还发现,最适于促进双歧杆菌生长的商业酪蛋白水解物中99.6%的肽分子质量<2 kDa。
表6 氮源的游离氨基酸组成分析 单位:g/100 g
Table 6 Analysis of free amino acid composition of nitrogen source
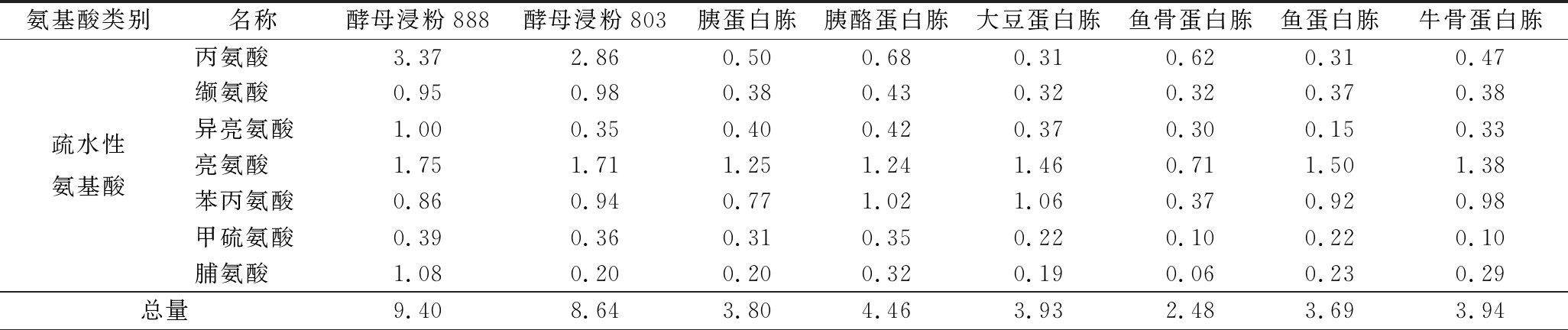
氨基酸类别名称酵母浸粉888酵母浸粉803胰蛋白胨胰酪蛋白胨大豆蛋白胨鱼骨蛋白胨鱼蛋白胨牛骨蛋白胨疏水性氨基酸丙氨酸3.372.860.500.680.310.620.310.47缬氨酸0.950.980.380.430.320.320.370.38异亮氨酸1.000.350.400.420.370.300.150.33亮氨酸1.751.711.251.241.460.711.501.38苯丙氨酸0.860.940.771.021.060.370.920.98甲硫氨酸0.390.360.310.350.220.100.220.10脯氨酸1.080.200.200.320.190.060.230.29总量9.408.643.804.463.932.483.693.94
续表6
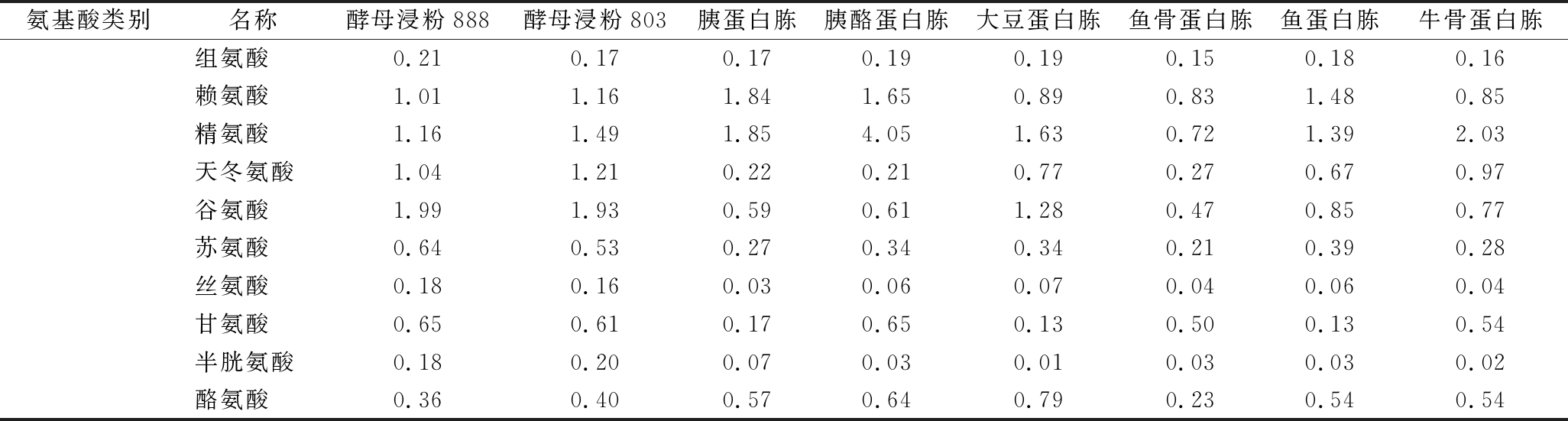
氨基酸类别名称酵母浸粉888酵母浸粉803胰蛋白胨胰酪蛋白胨大豆蛋白胨鱼骨蛋白胨鱼蛋白胨牛骨蛋白胨组氨酸0.210.170.170.190.190.150.180.16赖氨酸1.011.161.841.650.890.831.480.85精氨酸1.161.491.854.051.630.721.392.03天冬氨酸1.041.210.220.210.770.270.670.97谷氨酸1.991.930.590.611.280.470.850.77苏氨酸0.640.530.270.340.340.210.390.28丝氨酸0.180.160.030.060.070.040.060.04甘氨酸0.650.610.170.650.130.500.130.54半胱氨酸0.180.200.070.030.010.030.030.02酪氨酸0.360.400.570.640.790.230.540.54
通过利用不同类型的氮源来培养两歧双歧杆菌F35,实验发现酪蛋白水解物比只含氨基酸的混合物对两歧双歧杆菌表现出更好的增殖效果,该菌株利用多肽的增殖效率高于氨基酸,该结果与PROULX等[26]、KONGO等[27]的研究结果一致,他们分别报道了酪蛋白水解物和酶解乳清比游离形式的氨基酸对双歧杆菌生长的促进作用要好。将180~2 000 Da的多肽含量高达88.63%的酪蛋白水解物与酵母浸粉888以1∶1比例复配后,相较于酵母浸粉888单一氮源,培养基中180~2 000 Da的多肽含量大大升高,从而提高了两歧双歧杆菌生长值及生长效率。可见,高含量的180~2 000 Da的多肽有利于两歧双歧杆菌的增殖,而酵母浸粉类氮源中该组分含量较低是导致两歧双歧杆菌生长效果差的原因之一。
当具有有效增殖作用的多肽含量较少时,菌株的生长与其培养基中游离氨基酸密切相关,但酵母浸粉类氮源中高含量的游离氨基酸却不能被菌株有效利用。对两歧双歧杆菌F35氨基酸生物合成及转运的分析发现,该菌株具有17种氨基酸的合成能力和丰富的氨基酸转运系统,此外,在该菌株的基因组中缺失编码丝氨酸转乙酰酶(EC:2.6.1.51)和O-乙酰基丝氨酸裂解酶(EC:2.5.1.47)的基因,前者可催化丝氨酸发生乙酰化反应,生成O-乙酰基-L丝氨酸(O-acetylserine,OAS),后者可催化OAS和硫化物反应生成半胱氨酸[28],故该菌株不具备合成半胱氨酸的能力,但可以通过相应转运蛋白TcyP转运进入细胞内以满足菌体生长需求。氨基酸营养缺陷型分析实验中,仅当剔除或者添加Cys时,所获得的生长值会发生显著降低(OD600<0.20)或升高,结果表明两歧双歧杆菌F35仅表现为半胱氨酸营养缺陷型,也进一步证明在该菌株中其他17种氨基酸生物合成途径的完整性。
氨基酸转运及生成能力的完整性表明了菌株对于氨基酸的可利用性,酵母浸粉类氮源中高含量的游离氨基酸仍不能有效促进菌株的生长。对氮源的氨基酸组成分析结果发现,酵母浸粉类氮源的疏水性氨基酸含量为其他氮源的2倍以上,为探究疏水性氨基酸对两歧双歧杆菌F35生长的影响,将CDM中疏水性氨基酸剔除后观察菌株的生长情况,结果表明疏水性氨基酸混合物的存在,对两歧双歧杆菌F35以氨基酸为氮源的生长具有一定程度的抑制作用;再结合表3可以发现,疏水性氨基酸会抑制菌株对氨基酸的利用,但是对于肽的利用没有影响。先前研究中也出现过类似现象,BRAUN等[29]曾研究发现疏水性氨基酸Ile、Leu、Phe、Met可以引起衣原体Val可逆的生长抑制,衣原体BrnQ转运蛋白竞争性抑制缬氨酸摄取是疏水性氨基酸抑制衣原体生长的主要作用机制;此外STUCKY等[30]对德氏乳杆菌乳亚种DSM7290的BrnQ转运蛋白的研究中发现,异亮氨酸、缬氨酸对于亮氨酸的摄取具有同样的抑制作用;在谷氨酸棒杆菌VAL1中也存在类似的疏水性氨基酸竞争性抑制作用[31]。
综上所述,两歧双歧杆菌F35对不同氮源的利用存在偏好性,对富含氨基酸的酵母浸粉类氮源几乎不利用,偏好利用富含多肽的蛋白胨。其利用多肽的增殖效率高于氨基酸;大量疏水性氨基酸的存在会抑制菌株以氨基酸为氮源的增殖,但是不会影响菌株对多肽的利用。两歧双歧杆菌F35基因型及表型均表现为半胱氨酸营养缺陷型;其基因组中存在丰富的编码氨基酸转运系统的基因,且存在17种氨基酸完整的生物合成途径,以满足菌体生理代谢需求。
[1] 李吉平,陈雪,刘建华,等.双歧杆菌生物特性及其功能研究进展[J].中国奶牛,2020(6):57-61.
LI J P,CHEN X,LIU J H,et al.Advances in biological characteristics and functions of Bifidobacterium[J].China Dairy Cattle,2020(6):57-61
[2] 杜越欧,侯俊财.乳酸菌蛋白水解体系及相关基因表达的研究进展[J].食品工业科技,2013,34(3):383-386;391.
DU Y O,HOU J C.Research progress in proteolysis system of lactic acid bacteria and related gene expression[J].Science and Technology of Food Industry,2013,34(3):383-386;391.
[3] BROWN L,PINGITORE E V,MOZZI F,et al.Lactic acid bacteria as cell factories for the generation of bioactive peptides[J].Protein and Peptide Letters,2017,24(2):146-155.
[4] TURRONI F,DURANTI S,BOTTACINI F,et al.Bifidobacterium bifidum as an example of a specialized human gut commensal[J].Frontiers in Microbiology,2014,5:437.
[5] JANER C,ARIGONI F,LEE B H,et al.Enzymatic ability of Bifidobacterium animalis subsp. lactis to hydrolyze milk proteins:Identification and characterization of endopeptidase O[J].Applied & Environmental Microbiology,2005,71(12):8 460-8 465.
[6] CHANG O K,SEOL K H,JEONG S G,et al.Casein hydrolysis by Bifidobacterium longum KACC91563 and antioxidant activities of peptides derived therefrom[J].Journal of Dairy Science,2013,96(9):5 544-5 555.
[7] 王靖麟,王世博,徐睿,等.鲟鱼肝酶解条件优化及酶解液对双歧杆菌增殖效果的研究[J].中国酿造,2020,39(4):152-158.
WANG J L,WANG S B,XU R,et al.Optimization of enzymatic hydrolysis conditions of sturgeon liver protein and effect of the hydrolysate on Bifidobacterium proliferation[J].China Brewing,2020,39(4):152-158.
[8] 张娜,郭庆启,石彦国,等.促进益生菌增殖的大豆蛋白水解物的制备方法及其应用: CN107912533A[P].2018-04-17.
ZHANG N,GUO QQ,SHI Y G,et al.Preparation method and application of soybean protein hydrolysate for promoting probiotics proliferation: China CN107912533A[P].2018-04-17.
[9] 周兴雅.格氏乳杆菌与副格氏乳杆菌的筛选,基因组比较及安全性评价[D].无锡:江南大学,2019.
ZHOU X Y.Isolation,comparative genomics and safety assessment of Lactobcillus gasseri and Lactobaacillus paragasseri[D].Wuxi:Jiangnan University,2019.
[10] 赵杰,岳华,苟学磊,等.伊枯草菌素A发酵过程中游离氨基酸的HPLC分析[J].生物技术通报,2018,34(8):151-158.
ZHAO J,YUE H,GOU X L,et al.Analysis of free amino acids during fermentation of iturin a by high performance liquid chromatography[J].Biotechnology Bulletin,2018,34(8):151-158.
[11] FERRARIO C,DURANTI S,MILANI C,et al.Exploring amino acid auxotrophy in Bifidobacterium bifidum PRL2010[J].Frontiers in Microbiology,2015,6:1331.
[12] CRONIN M,ZOMER A,FITZGERALD G,et al.Identification of iron-regulated genes of Bifidobacterium breve UCC2003 as a basis for controlled gene expression[J].Bioengineered Bugs,2012,3(3):157-167.
[13] BROWN J,PIRRUNG M,MCCUE L A.FQC Dashboard:Integrates FastQC results into a web-based,interactive,and extensible FASTQ quality control tool[J].Bioinformatics,2017,33(19):3 137-3 139.
[14] DELCHER A L,BRATKE K A,POWERS E C,et al.Identifying bacterial genes and endosymbiont DNA with Glimmer[J].Bioinformatics,2007,23(6):673-679.
[15] BESEMER J,BORODOVSKY M.GeneMark:web software for gene finding in prokaryotes,eukaryotes and viruses[J].Nucleic Acids Research,2005,33(suppl_2):W451-W454.
[16] LOWE T M,CHAN P P.tRNAscan-SE On-line:Integrating search and context for analysis of transfer RNA genes[J].Nucleic Acids Research,2016,44(W1):W54-W57.
[17] BLEASBY A J,AKRIGG D,ATTWOOD T K.OWL:a non-redundant composite protein sequence database[J].Nucleic Acids Research,1994,22(17):3 574-3 577.
[18] BAIROCH A,APWEILER R.The SWISS-PROT protein sequence database and its supplement TrEMBL in 2000[J].Nucleic Acids Research,2000,28(1):45-48.
[19] OGATA H,GOTO S,SATO K,et al.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research,2000,28(1):27-30.
[20] RIBARDO D A,HENDRIXSON D R.Analysis of the LIV system of Campylobacter jejuni reveals alternative roles for LivJ and LivK in commensalism beyond branched-chain amino acid transport.[J].Journal of Bacteriology,2011,193(22):6 233-6 243.
[21] KAISER J C,OMER S,SHELDON J R,et al.Role of BrnQ1 and BrnQ2 in branched-chain amino acid transport and virulence in Staphylococcus aureus[J].Infection and Immunity,2015,83(3):1 019-1 029.
[22] DEN HENGST C D,GROENEVELD M,KUIPERS O P,et al.Identification and functional characterization of the Lactococcus lactis CodY-regulated branched-chain amino acid permease BcaP (CtrA)[J].Journal of Bacteriology,2006,188(9):3 280-3 289.
[23] KREDICH H M.Biosynthesis of cysteine[J].Ecosal Plus,2008,3(1).DOI:10.1128/ecosalplus.3.6.1.11
[24] ST-GELAIS D,ROY D,HACHÉ S,et al.Growth of nonproteolytic Lactococcus lactis in culture medium supplemented with different casein hydrolyzates[J].Journal of Dairy Science,1993,76(11):3 327-3 337.
[25] 张清丽.酪蛋白活性肽对乳酸菌生长代谢及酸乳发酵影响的研究[D].广州:华南理工大学,2011.
ZHANG Q L.Studies on the infuence of casein-derived bioactive peptides on lactic acid bacteria metabolism and yoghurt fermentation[D].Guangzhou:South China University of Technology,2011.
[26] PROULX M,WARD P,GAUTHIER S F,et al.Comparison of Bifidobacterial growth-promoting activity of ultrafiltered casein hydrolyzate fractions[J].Le Lait,1994,74(2):139-152.
[27] KONGO J M,GOMES A M P,MALCATA F X.Development of a chemically defined medium for growth of Bifidobacterium animalis[J].Journal of Food Science,2002,68(9):2 742-2 746.
[28] AL-YOUNES H M,BRINKMANN V,MEYER T F.Interaction of Chlamydia trachomatis serovar L2 with the host autophagic pathway[J].Infection and Immunity,2004,72(8):4 751-4 762.
[29] BRAUN P R,AL-YOUNES H,GUSSMANN J,et al.Competitive inhibition of amino acid uptake suppresses chlamydial growth:Involvement of the chlamydial amino acid transporter BrnQ[J].Journal of Bacteriology,2008,190(5):1 822-1 830.
[30] STUCKY K,HAGTING A,KLEIN J R,et al.Cloning and characterization of brnQ,a gene encoding a low-affinity,branched-chain amino acid carrier in Lactobacillus delbrdückii subsp.lactic DSM-7290[J].Molecular and General Genetics MGG,1995,249(6):682-690.
[31] LANGE C,RITTMANN D,WENDISCH V F,et al.Global expression profiling and physiological characterization of Corynebacterium glutamicum grown in the presence of L-valine[J].Applied and Environmental Microbiology,2003,69(5):2 521-2 532.