鱼肉是居民餐桌上的重要组成部分,其安全性与人民生活息息相关。随着现代水产养殖业呈集约化和规模化发展,水产生物疫情的爆发频率也逐渐增高,而生产者和经营者为了预防和治疗各种病害、提高产量效益,常在水产生物中使用药物,加上对这些药物的毒性和危害认识不足,导致超量和超种类的滥用、误用、违规使用,以及不遵守休药期等现象屡禁不止,水产品中药物残留超标现象时有发生[1-4]。磺胺类、喹诺酮类、酰胺醇类、硝基咪唑类药物以及一些违禁添加物,例如孔雀石绿等,因为价格低廉,药效好而被经常使用。这些残留在水产品中的药物经食用后在人体中蓄积,会产生致畸、致癌等严重危害[5]。因此,如何提高检验效率、降低检测成本,控制和消除药残,保证食品安全,是重大民生课题[6-7]。
由于不同种类间药物的化学性质差别较大,兽药多残留检测存在诸多困难,如残留量甚微、兽药品种繁多、动物源性食品基质复杂等,目前常用的检测方法大多是测定某一种或某一类药物。然而在实际工作当中,对于同一个样品测定多种药物残留时,分别测定会涉及多个样品前处理和多种类型的仪器,耗费大量的人力、物力和时间,检验成本高且对环境不友好,面对一些突发事件和应急任务时,分别测定的方法就显得力不从心,因此,建立简便、快速、高通量、高灵敏度的方法已成为未来兽药残留检测的趋势[8-10]。液相色谱串联质谱技术集中了色谱和质谱的优点,将色谱的分离能力和质谱的高选择性、高灵敏度结合起来,是近几年来水、土、动物源性食品及排泄物等基质中多类兽药残留快速测定的首选[4,11-21]。
2019年,国家食品安全监督抽查针对淡水鱼类共涵盖了9类药物残留,包括喹诺酮类、磺胺类、酰胺醇类、硝基呋喃类代谢物、硝基咪唑类、四环素族、地西泮、五氯酚酸钠和孔雀石绿,涉及的检测方法除磺胺类和喹诺酮类药物可以用《农业部1077号公告-1-2008》同时测定外,其余7类药物残留均采用国标或相应标准中检测方法(GB/T 19857—2005《水产品中孔雀石绿和结晶紫残留量的测定》、GB/T 20756—2006《可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定 液相色谱-串联质谱法》、SN/T 3235—2012《出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》、GB/T 21318—2007《动物源性食品中硝基咪唑残留量检测方法》、GB 23200.92—2016《食品安全国家标准 动物源性食品中五氯酚残留量的测定 液相色谱-质谱法》)。针对这种情况,本文结合2019年的监督抽查任务,将鱼肉中的6类药物残留使用QuEChERS(quick,easy,cheap,effective,rugged,safe)的方法进行前处理,利用高效液相色谱串联质谱(LC-MS/MS)技术,建立了一种同时测定鱼肉中磺胺类、喹诺酮类、酰胺醇类、硝基咪唑类、地西泮和孔雀石绿类药物残留的检测技术。
1 材料与方法
1.1 仪器与试剂
仪器设备:HPLC-MS/MS 8050液相色谱串联质谱仪,日本Shimadzu公司;Milli-Q超纯水发生器,美国Millipore公司;GL-21B高速冷冻离心机,上海安亭科学仪器厂;雷磁PH S-3C酸度计,上海天美科学仪器有限公司;均质仪,美国Tomtec公司。
试剂:乙腈、甲醇、丙酮,均为色谱纯,德国Merck;Na2SO4、NaCl、盐酸、MgSO4,均为分析纯,国药集团化学试剂有限公司;兽药标准品,德国Dr.Ehrenstorfer GmbH。
1.2 标准溶液的配制
准确称取10 mg(精确至0.01 mg)各个兽药标准品于10 mL容量瓶中,根据各兽药的性质用乙腈、甲醇、丙酮等溶剂溶解并定容,制得25种兽药的单一标准储备液(1 mg/mL)。根据需要用乙腈稀释成相应浓度的单一标准工作液。分别吸取一定量的标准储备液,配制成混合标准储备液,临用前稀释成合适浓度的混合标准工作液。
1.3 HPLC-MS/MS条件
液相色谱条件:CAPCELL PAK C18色谱柱(2.0 mm×100 mm×3 μm),日本资生堂公司;柱温40 ℃;流动相A相为5 mmol/L甲酸-甲酸铵水溶液,B相为V(乙腈)∶V(甲醇)=1∶1;线性梯度洗脱程序:0~2 min,90% A,2~3 min,90%~85% A,保持10 min,13~20 min,85%~10% A,保持5 min,25~25.1 min,85%~10%A,保持至28 min;流速0.2 mL/min;进样体积1 μL。
质谱测定条件:电喷雾离子源;正负离子同时扫描;多反应监测模式;各个分析物的质谱信息见表1。
表1 25种分析物的质谱采集参数及保留时间
Table 1 MS/MS parameters and retention times of 25 analytes
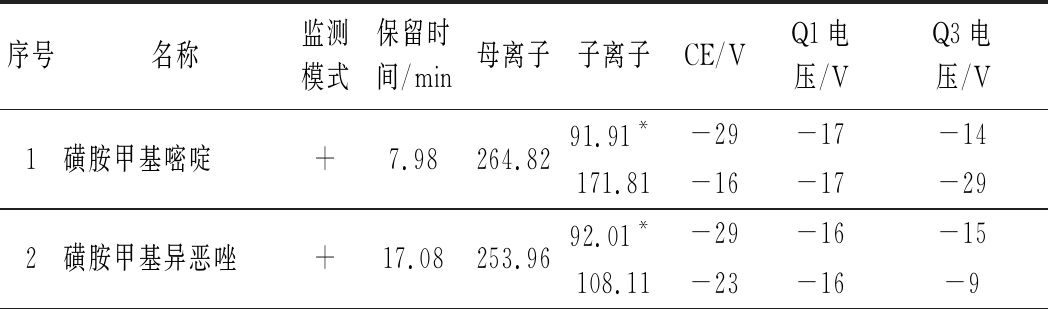
序号名称监测模式保留时间/min母离子子离子CE/VQ1电压/VQ3电压/V1磺胺甲基嘧啶+7.98264.8291.91*-29-17-14171.81-16-17-292磺胺甲基异恶唑+17.08253.9692.01*-29-16-15108.11-23-16-9
续表1
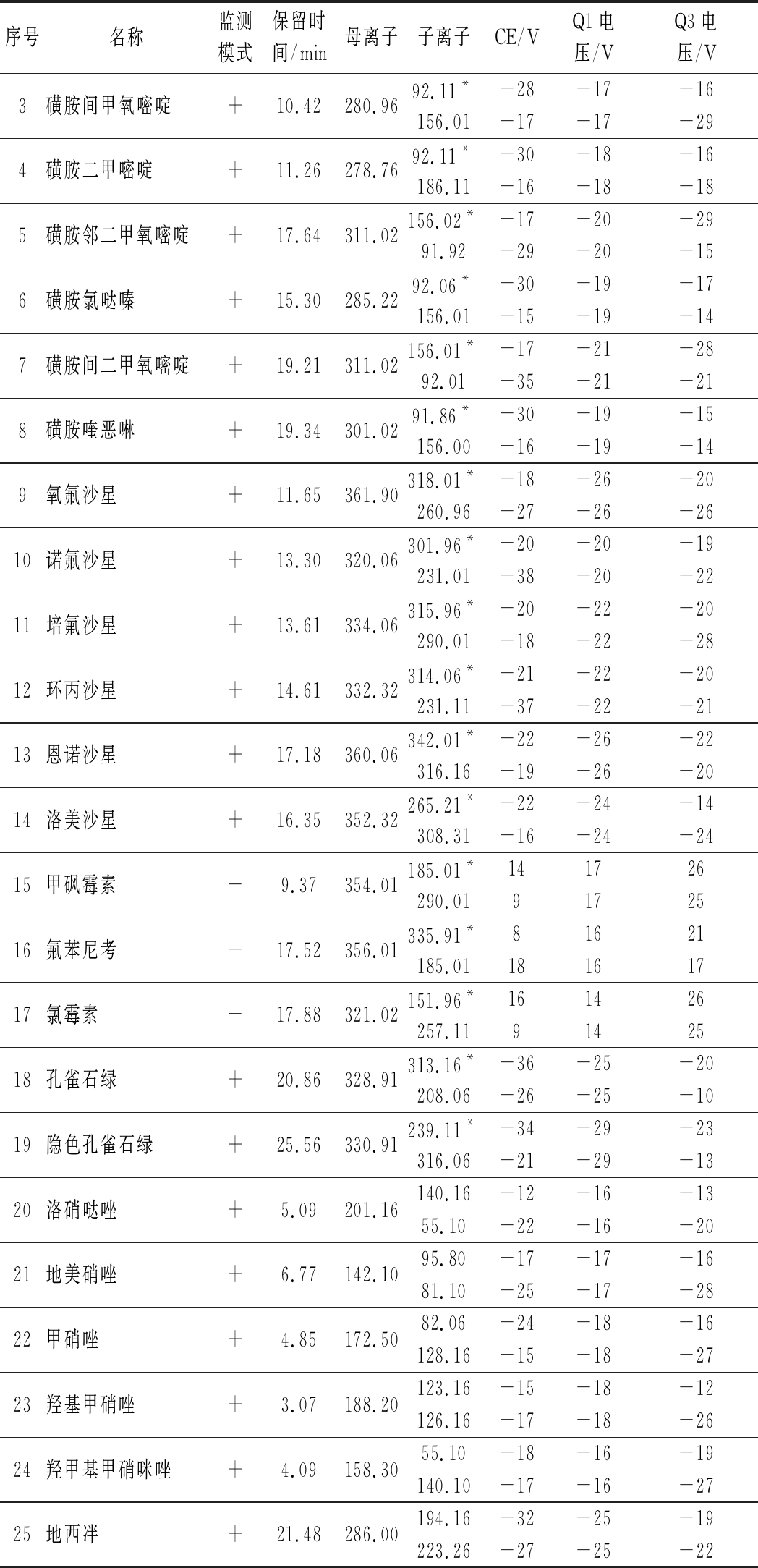
序号名称监测模式保留时间/min母离子子离子CE/VQ1电压/VQ3电压/V3磺胺间甲氧嘧啶+10.42280.9692.11*-28-17-16156.01-17-17-294磺胺二甲嘧啶+11.26278.7692.11*-30-18-16186.11-16-18-185磺胺邻二甲氧嘧啶+17.64311.02156.02*-17-20-2991.92-29-20-156磺胺氯哒嗪+15.30285.2292.06*-30-19-17156.01-15-19-147磺胺间二甲氧嘧啶+19.21311.02156.01*-17-21-2892.01-35-21-218磺胺喹恶啉+19.34301.0291.86*-30-19-15156.00-16-19-149氧氟沙星+11.65361.90318.01*-18-26-20260.96-27-26-2610诺氟沙星+13.30320.06301.96*-20-20-19231.01-38-20-2211培氟沙星+13.61334.06315.96*-20-22-20290.01-18-22-2812环丙沙星+14.61332.32314.06*-21-22-20231.11-37-22-2113恩诺沙星+17.18360.06342.01*-22-26-22316.16-19-26-2014洛美沙星+16.35352.32265.21*-22-24-14308.31-16-24-2415甲砜霉素-9.37354.01185.01*141726290.019172516氟苯尼考-17.52356.01335.91*81621185.0118161717氯霉素-17.88321.02151.96*161426257.119142518孔雀石绿+20.86328.91313.16*-36-25-20208.06-26-25-1019隐色孔雀石绿+25.56330.91239.11*-34-29-23316.06-21-29-1320洛硝哒唑+5.09201.16140.16-12-16-1355.10-22-16-2021地美硝唑+6.77142.1095.80-17-17-1681.10-25-17-2822甲硝唑+4.85172.5082.06-24-18-16128.16-15-18-2723羟基甲硝唑+3.07188.20123.16-15-18-12126.16-17-18-2624羟甲基甲硝咪唑+4.09158.3055.10-18-16-19140.10-17-16-2725地西冸+21.48286.00194.16-32-25-19223.26-27-25-22
注:*为定量离子
1.4 样品前处理
精确称量5 g样品于50 mL离心管中,加入4 mL 0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液(pH 4.0)和16 mL 5%甲酸乙腈,剧烈振揺1 min;加入NaCl(1 g)和Na2SO4(4 g),高速均质分散3 min,然后涡旋2 min;10 000 r/min离心12 min备用。
取一个10 mL离心管,装入300 mg MgSO4和50 mg C18,然后吸取2 mL样品上清液,涡旋30 s,然后以6 000 r/min离心5 min。吸取1 mL上清液于另一干净离心管中,加入1 mL水,混匀,过0.22 μm滤膜,待检测。
2 结果与讨论
2.1 仪器条件的选择
2.1.1 液相条件的确认
水相的选择方面,实验对比了加入甲酸、甲酸铵、乙酸、乙酸铵以及它们不同浓度组合时的分离效果,发现加入5 mmol/L甲酸铵-甲酸水溶液时各个分析物的峰形和分离效果最好。有机相的选择方面,实验尝试了乙腈、甲醇以及乙腈和甲醇不同比例组合时的分析效果,结果表明当乙腈和甲醇比例为1∶1时,综合分离度和峰形最优。综合考虑最终确定以V(5 mmol/L甲酸铵-甲酸水溶液)∶V(乙腈-甲醇)=1∶1作为流动相。
为了获得更好的分离度,实验采用梯度洗脱程序。为了延迟一些高极性化合物的保留时间,实验初期阶段的水相比例较高,而后逐渐降低水相的比例,使得化合物按极性由强到弱顺序,逐步被洗脱下来。当全部目标化合物洗脱出来以后,为了使一些强保留的弱极性杂质从柱子上洗脱下来,采用高有机相比例冲洗柱子。经过反复实验,综合考虑分离度和总分析时间,确定1.3中的梯度洗脱程序为最佳方案。图1所示为25种兽药在该条件下的总离子流图。
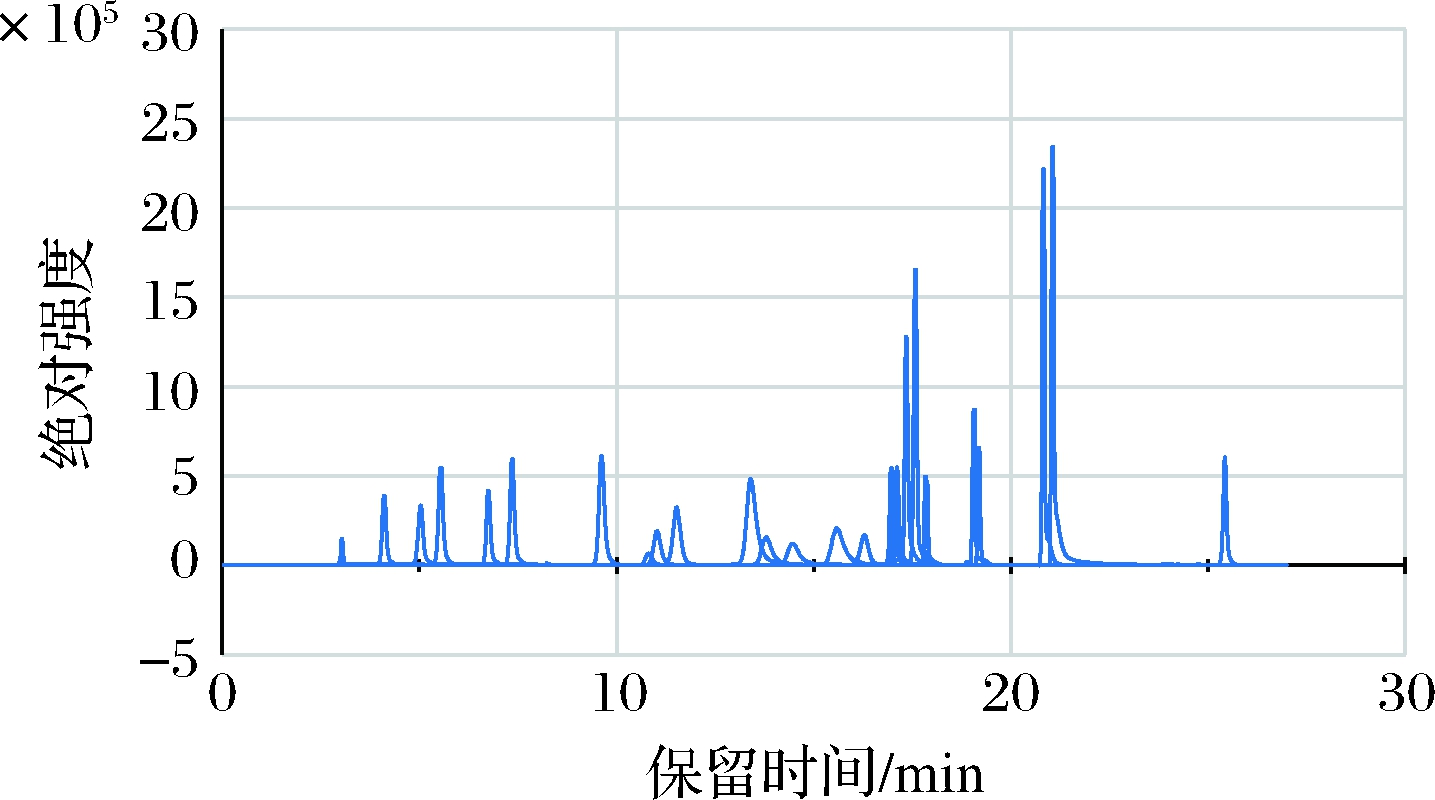
图1 25种兽药混合标准溶液的总离子流图(50 μg/L)
Fig.1 Mass spectra of veterinary drug residues
2.1.2 质谱条件的确认
通过分别注射单一标准溶液,使用仪器自动优化的方法获得各个目标化合物的最优质谱条件。根据各个化合物的保留时间,分窗口采集信号,以便获得良好的灵敏度。
2.2 提取溶剂的选择
考虑到本文所涵盖的几类药物化学性质差异显著,本文比较了乙腈、甲醇、0.2%甲酸乙腈、0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液+乙腈、0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液+0.2%甲酸乙腈作为提取液时的提取效率。结果表明,0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液+0.2%甲酸乙腈作为提取溶剂时几类化合物的综合提取效率最优。因此实验初步选定提取溶剂为:0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液+0.2%甲酸乙腈。
实验又进一步比较了不同酸度的提取溶液对提取效率的影响,比较了0.2%、0.4%、1%、3%、5%、7%甲酸乙腈+0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液作为提取溶剂时的实验效果,结果表明,在0.2%~7%,随着pH值的不断下降,喹诺酮类化合物的回收率逐步上升,但磺胺类化合物的回收率不断下降,其他几类化合物回收率先上升再下降。统筹考虑,最终选定0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液+5%甲酸乙腈作为提取溶剂。
2.3 盐析剂和脱水剂的确定
实验比较了盐析剂NaCl和乙酸钠,脱水剂Na2SO4和MgSO4对实验结果的影响,并进一步确认了它们的用量。结果表明,加入乙酸钠和MgSO4会释放热量,造成一些兽药的回收率下降。实验最终确定NaCl作为盐析剂,用量为1 g;Na2SO4作为脱水剂,用量为4 g。
2.4 净化剂的确定
为了减少干扰物,降低基质效应的影响,需要对样品进行净化。常规的净化除杂填料有N-丙基乙二胺(primary secondary amine,PSA)、C18、—NH2吸附剂和石墨化炭黑(graphitizing of carbon black,GCB)等。PSA和—NH2主要用来除去脂肪酸、糖类等极性杂质;C18主要吸附非极性物质和油脂类杂质;GCB能吸附弱极性和具有苯环结构的化合物,会导致该类化合物回收率的下降,对本文所涉及的一些药物不适用。
本文比较了PSA、C18的除杂效果,结果表明:PSA能使磺胺类药物的回收率大幅降低,这可能是因为PSA吸附了该类化合物;C18能起到很好的净化作用,并有较好的回收率。因此,选用C18来去除杂质。
实验又进一步比较了C18和MgSO4不同用量配比时的除杂效果,分别为:30和200 mg,50和300 mg,100和600 mg,150和900 mg。结果表明50 mg C18和300 mg MgSO4时净化效果为满意,随着净化剂用量的进一步增加,净化效果没有明显提升。统筹考虑做样成本和除杂效果等原因,最终确定净化剂为50 mg C18和300 mg MgSO4。
2.5 方法学评价
2.5.1 线性关系和检出限
根据需要准确吸取一定量1.2中制备的标准储备液,配制成一系列质量浓度(0.1、0.2、0.5、1、5、10、50、100、200 μg/L)的混合标准工作液,在1.3的仪器条件下进行实验。以各个化合物的浓度和峰面积为横纵坐标,绘制线性关系曲线。结果得到25种化合物的相关系数范围0.990 2~0.999 9,说明25种兽药在0.1~200 μg/L具有良好的线性关系。
2.5.2 准确度和精密度
以草鱼样品为基质空白,进行5个重复3个水平(2、4和10 μg/kg)的添加回收实验,实验结果见表2。25种化合物的平均回收率为71.8%~107%,相对标准偏差(relative standard deviation,RSD)为4.4%~9.2%,该方法精密度和准确度能满足现有法规的要求,可用于准确定量,适用于实际样品的测定。
表2 兽药残留添加回收表
Table 2 Recoveries and precisions of veterinary drug residues
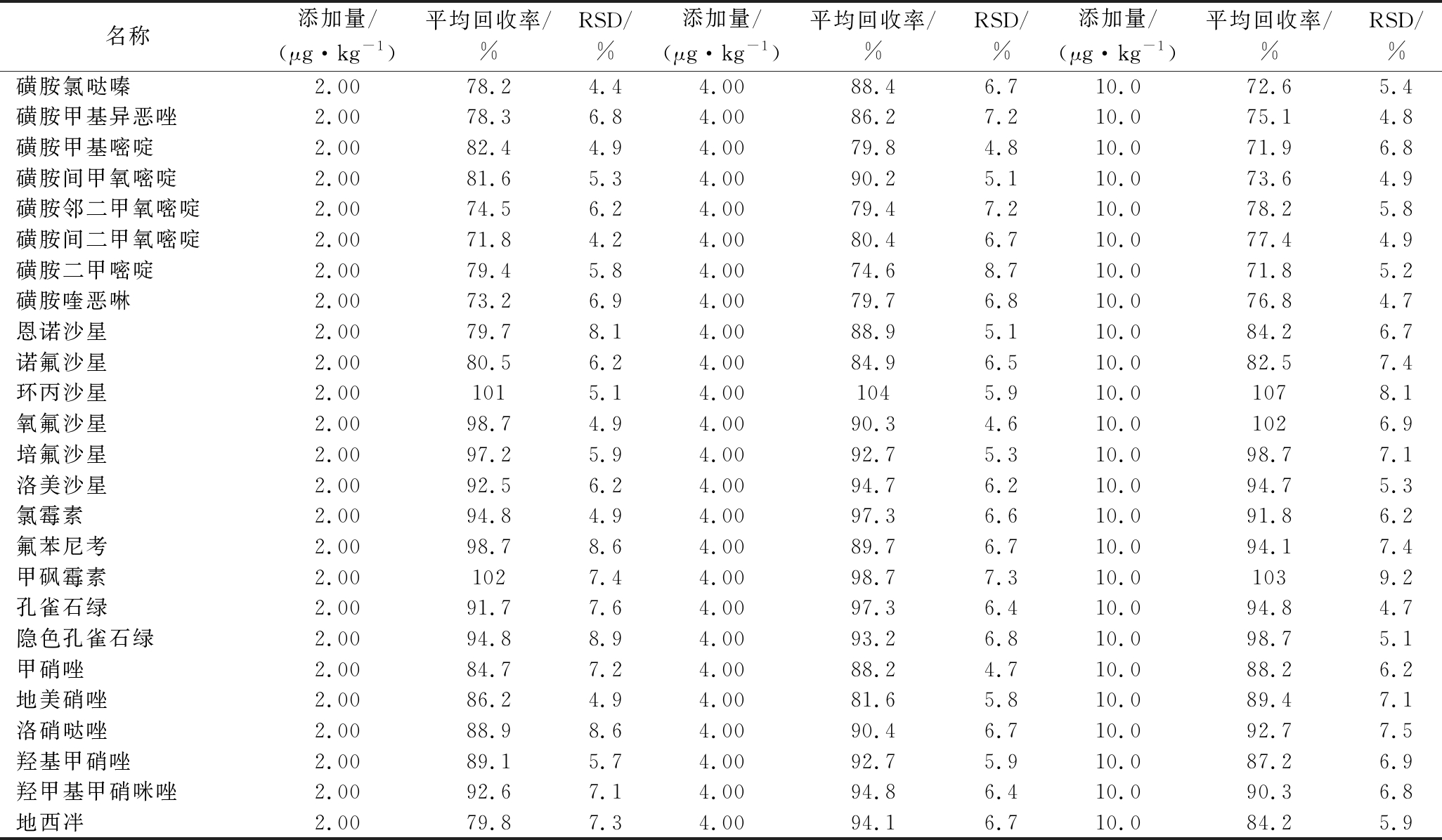
名称添加量/(μg·kg-1)平均回收率/%RSD/%添加量/(μg·kg-1)平均回收率/%RSD/%添加量/(μg·kg-1)平均回收率/%RSD/%磺胺氯哒嗪2.0078.24.44.0088.46.710.072.65.4磺胺甲基异恶唑2.0078.36.84.0086.27.210.075.14.8磺胺甲基嘧啶2.0082.44.94.0079.84.810.071.96.8磺胺间甲氧嘧啶2.0081.65.34.0090.25.110.073.64.9磺胺邻二甲氧嘧啶2.0074.56.24.0079.47.210.078.25.8磺胺间二甲氧嘧啶2.0071.84.24.0080.46.710.077.44.9磺胺二甲嘧啶2.0079.45.84.0074.68.710.071.85.2磺胺喹恶啉2.0073.26.94.0079.76.810.076.84.7恩诺沙星2.0079.78.14.0088.95.110.084.26.7诺氟沙星2.0080.56.24.0084.96.510.082.57.4环丙沙星2.001015.14.001045.910.01078.1氧氟沙星2.0098.74.94.0090.34.610.01026.9培氟沙星2.0097.25.94.0092.75.310.098.77.1洛美沙星2.0092.56.24.0094.76.210.094.75.3氯霉素2.0094.84.94.0097.36.610.091.86.2氟苯尼考2.0098.78.64.0089.76.710.094.17.4甲砜霉素2.001027.44.0098.77.310.01039.2孔雀石绿2.0091.77.64.0097.36.410.094.84.7隐色孔雀石绿2.0094.88.94.0093.26.810.098.75.1甲硝唑2.0084.77.24.0088.24.710.088.26.2地美硝唑2.0086.24.94.0081.65.810.089.47.1洛硝哒唑2.0088.98.64.0090.46.710.092.77.5羟基甲硝唑2.0089.15.74.0092.75.910.087.26.9羟甲基甲硝咪唑2.0092.67.14.0094.86.410.090.36.8地西冸2.0079.87.34.0094.16.710.084.25.9
2.6 实际样品的测定
本课题组在2019年的食品安全监督抽查工作中,鱼类产品共检出恩诺沙星、氧氟沙星、磺胺嘧啶若干份,其中恩诺沙星最低值16 μg/kg,最高值596 μg/kg,氧氟沙星最低值28.9 μg/kg,最髙值476 μg/kg,磺胺类总量(磺胺嘧啶、磺胺二甲嘧啶、磺胺甲基嘧啶、磺胺甲恶唑、磺胺间二甲氧嘧啶、磺胺邻二甲氧嘧啶、磺胺间甲氧嘧啶、磺胺氯哒嗪、磺胺喹恶啉之和)最低值13.2 μg/kg,最髙值113 μg/kg。使用本文所述的方法,对检出的阳性样品与国标法进行方法比对试验,实验结果采取F检验方法进行单因素方差分析,结果显示2种方法在显著性水平为0.05水平时,无显著性差异(表3)。
表3 国标法与本文所建立方法检测结果对比表 单位:mg/kg
Table 3 Comparison between national standard method and the method established in this paper

恩诺沙星测定值磺胺类总量氧氟沙星测定值GB/T 20366—2006本文所建方法农业部1077号公告-1-2008本文所建方法GB/T 20366—2006本文所建方法1612.113.216.428.936.924.618.928.932.832.642.758.650.644.248.764.978.464.272.448.941.380.970.188.680.462.357.847638711913578.870.2--13411484.978.4--21017988.480.7--36431492.688.6--459492113104--596538----F检验统计量0.021F检验统计量0.076F检验统计量0.016F检验临界值4.35(α=0.05)F检验临界值4.41(α=0.05)F检验临界值5.31(α=0.05)统计结果无显著性差异统计结果无显著性差异统计结果无显著性差异
3 结论
本研究建立了使用QuEChERS前处理方法,同时测定鱼肉中磺胺类、喹诺酮类、酰胺醇类等药物多残留的检测技术。该技术的前处理方法简单、快速,方法学评价结果符合兽药残留的相关要求。使用本文建立的方法对实际工作中检出的阳性样品进行测定,结果表明该方法和国标法测定结果无显著差异,该方法可以用于实际样品的检测。
[1] 罗辉泰, 黄晓兰,吴惠勤,等.快速高效液相色谱-串联质谱法同时测定水产品中5类33种药物残留[J].分析化学,2012,40(2):273-279.
LUO H T,HUANG X L,WU H Q,et al.Simultaneous determination of 33 medicine residues in aquatic products by rapid resolution liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2012,40(2):273-279.
[2] 张宪臣, 李蓉,张朋杰,等.QuEChERS-超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速测定水产品中25种药物残留[J].色谱,2018,36(2):114-124.
ZHANG X C,LI R,ZHANG P J,et al.Rapid determination of 25 drug residues in aquatic products by ultra performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry[J].Chinese Journal of Chromatography,2018,36(2):114-124.
[3] 刘洪斌, 李颖,李艳华,等.UPLC-MS/MS方法同时检测猪肉中67种禁限用药物残留[J].农产品质量与安全,2017(5):65-72;77.
LIU H B,LI Y,LI Y H,et al.Determination of 67 medicine residues in pork products by UPLC-MS/MS[J].Quality and Safety of Agro-Products,2017(5):65-72;77.
[4] 李俊锁, 邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002.
LI J S,QIU Y M,WANG C.Drug Residue Analysis[M].Shanghai:shanghai scientific and Technical Literature Publishing house,2002.
[5] 张桂云, 杨伟强,林振宇.分散固相萃取-超高效液相色谱串联质谱法检测水产品中多兽药残留[J].福州大学学报(自然科学版),2019,47(3):424-429;434.
ZHANG G Y,YANG W Q,LIN Z Y.Determination of mutiple veterinary drug residues in aquatic products based on the combination of DSPE method and UPLC-MS/MS[J].Journal of Fuzhou University (Natural Science Edition),2019,47(3):424-429;434.
[6] 潘灿平. 农兽药残留研究动态[J].食品安全质量检测学报,2018,9(6):1 217-1 218.
PAN C P.Research trends on pesticide and veterinary drug residues[J].Journal of Food Safety & Quality,2018,9(6):1 217-1 218.
[7] 梁素丹, 陈剑刚,张艳.全自动固相萃取-超高效液相色谱-串联质谱法同时测定动物肌肉中喹诺酮类和四环素类兽药残留[J].中国食品卫生杂志,2018,30(2):151-157.
LIANG S D,CHEN J G,ZHANG Y.Simultaneous determination of veterinary drug residues of quinolones and tetracyclines in animal tissue by ultra performance liquid chromatography-tandem mass spectrometry with automatic solid phase extraction[J].Chinese Journal of Food Hygiene,2018,30(2):151-157.
[8] 王超众, 刘信奎,张连成,等.动物源性食品中 65 种兽药残留的快速检测方法[J].食品与生物技术学报,2020,39(4):102-111.
WANG C Z,LIU X K,ZHANG L C,et al.Rapid detection of 65 veterinary drug residues in animal origin foods[J].Journal of Food Science and Biotechnology,2020,39(4):102-111.
[9] 郭萌萌, 谭志军,孙晓杰,等.液相色谱-串联质谱法同时测定水产品中三苯甲烷类、氯霉素类、磺胺类、氟喹诺酮类和四环素类渔药残留[J].中国渔业质量与标准,2013,3(1):51-58.
GUO M M,TAN Z J,SUN X J,et al.Simultaneous determination of five kinds of veterinary drug residues in aquatic products by liquid chromatography with tandem mass spectrometry[J].Chinese Fishery Quality and Standards,2013,3(1):51-58.
[10] 方从容, 高洁,王雨昕,等.QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125种兽药残留[J].色谱,2018,36(11):1 119-1 131.
FANG C R,GAO J,WANG Y X,et al.Determination of 125 veterinary drugs residues in eggs by QuEChERS-ultra-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2018,36(11):1 119-1 131.
[11] 张晓强, 张波,方萍,等.QuEChERS-超高效液相色谱-串联质谱法快速测定鱼肉中22种磺胺类药物残留[J].理化检验-化学分册,2015,51(3):369-374.
ZHANG X Q,ZHANG B,FANG P,et al.Rapid determination of 22 sulfonamide residues in fish by QuEChERS-UPLC-MS/MS[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2015,51(3):369-374.
[12] 梁晶晶, 徐潇颖,丁宇琦,等.高效液相色谱-串联质谱法快速测定水产品中19种喹诺酮类药物残留[J].分析测试学报,2018,37(2):224-230.
LIANG J J,XU X Y,DING Y Q,et al.Determination of 19 quinolone antibacterials residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis,2018,37(2):224-230.
[13] 高彦.QuEChERS结合LC-MS/MS法在动物源性食品中兽药残留分析中的应用研究[D].郑州:郑州大学,2017.
GAO Y.Research and application of QuEChERS combined LC-MS/MS on veterinary drug residue in animal-derived food[D].Zhengzhou:Zhengzhou University,2017.
[14] 杨雯筌, 张晓燕,姚倩,等.液相色谱-串联质谱法检测雄蜂蛹粉中50种抗生素残留[J].色谱,2019,37(1):46-53.
YANG W Q,ZHANG X Y,YAO Q,et al.Determination of 50 antibiotic residues in drone pupa powder by liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2019,37(1):46-53.
[15] LI R J,WU M C.High-throughput determination of 30 veterinary drug residues in milk powder by dispersive solid-phase extraction coupled with ultra-high performance liquid chromatography tandem mass spectrometry[J].Food Analytical Methods,2017,10(11):3 753-3 762.
[16] WANG J,LEUNG D,CHOW W,et al.Development and validation of a multiclass method for analysis of veterinary drug residues in milk using ultrahigh performance liquid chromatography electrospray ionization quadrupole orbitrap mass spectrometry[J].Journal of Agricultural and Food Chemistry,2015,63(41):9 175-9 187.
[17] ZHU W X,YANG J Z,WANG Z X,et al.Rapid determination of 88 veterinary drug residues in milk using automated Turbor Flow online clean-up mode coupled to liquid chromatography-tandem mass spectrometry[J].Talanta,2016,148:401-411.
[18] KIM J,SUH J H,CHO H D,et al.Analytical method for fast screening and confirmation of multi-class veterinary drug residues in fish and shrimp by LC-MS/MS[J].Food Additives & Contaminants:Part A,2016,33(3):420-432.
[19] JANK L,MARTINS M T,ARSAND J B,et al.An LC-ESI-MS/MS method for residues of fluoroquinolones,sulfonamides,tetracyclines and trimethoprim in feedingstuffs:Validation and surveillance[J].Food Additives & Contaminants:Part A,2018,35(10):1 975-1 989.
[20] VEACH B T,ANGLIN R,MUDALIGE T K,et al.Quantitation and confirmation of chloramphenicol,florfenicol,and nitrofuran metabolites in honey using LC-MS/MS[J].Journal of AOAC International,2018,101(3):897-904.
[21] ZANG G D,FU J W,YANG Q Z,et al.Determination of three kinds of polyether drug residues in eggs by QuEChERS dSPE EMR-Lipid-LC/MS/MS[J].Agricultural Biotechnology,2018,1:120-122.