阿苯达唑又名丙硫咪唑,是苯并咪唑类驱虫药物,因其治疗效果好、毒性小等优势,被广泛用于治疗动物的肠道寄生虫感染病,是目前兽医临床使用最广泛的药物之一[1-2]。阿苯达唑进入动物体内后会快速代谢为阿苯达唑亚砜,阿苯达唑亚砜进一步转化为阿苯达唑砜和阿苯达唑-2-氨基砜[3-4]。目前,对养殖中使用阿苯达唑药物的管理日益加强,对其及其代谢物进行风险评估也极为重视,是动物源性食品中兽药残留重点监控对象之一,GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》规定了其在动物性食品中的最大残留量[5],动物肌肉中最大残留限量为100 μg/kg。
阿苯达唑及其代谢物常用检测方法有高效液相色谱法(HPLC)[6-9],高效液相色谱-串联质谱法(HPLC-MS/MS)[10-13],超高效液相色谱-飞行时间质谱联用[14],气相色谱-串联质谱法(GC-MS/MS)[15]等。其中HPLC-MS/MS法因其准确度和灵敏度高、选择性强等优点,广泛用于动物源性食品中兽药残留的分析测定。QuEChERS净化方法前处理简单快速、溶剂使用量少,在农兽药残留分析中应用广泛[16-19]。本研究拟利用QuEChERS技术结合超高效液相色谱-串联质谱法(ultra high performance liquid chromatography-tandem mass-spectrometry, UHPLC-MS/MS)分析技术,通过优化色谱和质谱参数、提取溶剂和净化方法等条件,建立了畜肉(猪肉、牛肉)中阿苯达唑及其代谢物残留量的快速分析方法。本方法具有简单、快速、准确和灵敏度高等优点,适用于畜肉(猪肉、牛肉)中阿苯达唑及其代谢物残留量的快速筛查和定量分析,具有较强的实用价值。
1 材料与方法
1.1 仪器和试剂
1.1.1 主要仪器
Agilent 6470三重四级杆串联质谱仪,配有ESI源及Agilent 1290超高效液相色谱,美国Agilent公司;Blixer3搅拌机,法国ROBOT COUPA公司;UMV-2多管涡旋混合器,北京普立泰科仪器有限公司;XW-80A涡旋混合器,上海米青科实业有限公司;陶瓷均质子,迪马科技有限公司;十八烷基键合硅胶吸附剂(C18)、乙二胺-N-丙基硅烷(primary secondary amine,PSA)、0.22 μm聚四氟乙烯(poly tetra fluoroethylene,PTFE)滤膜,上海安普实验科技股份有限公司。
1.1.2 主要试剂
甲醇、乙腈(色谱纯),德国Merck公司;乙酸乙酯(分析纯)、无水硫酸镁,天津市科密欧化学试剂有限公司;甲酸(色谱纯),上海安普实验科技股份有限公司;乙酸铵(分析纯),西亚试剂;阿苯达唑、阿苯达唑砜、阿苯达唑亚砜、阿苯达唑-2-氨基砜(纯度>98%),百灵威科技有限公司。
1.2 标准溶液配制
精密称取阿苯达唑、阿苯达唑砜、阿苯达唑亚砜、阿苯达唑-2-氨基砜10 mg(精确至0.000 1 g)于100 mL棕色容量瓶中,用甲醇溶解并定容至刻度线,混匀,分别配制成质量浓度为100 mg/L标准储备液,-18 ℃避光保存。用甲醇将4种标准储备液分别逐级稀释至所需的混合标准工作液,现配现用。
1.3 色谱条件
色谱柱:ZORBAX Eclipse Plus-C18反相色谱柱(100 mm×2.1 mm,1.8 μm),美国Agilent公司;流动相A:0.1%(体积分数)甲酸水溶液,B:乙腈;梯度洗脱程序:0.0~0.5 min,10% B;0.5~2.5 min,10%~90% B;2.5~3.0 min,90% B;3.0~3.1 min,90%~10% B;3.1~4.5 min,10%。流速:0.3 mL/min;柱温40 ℃;进样体积5.0 μL。
1.4 质谱条件
离子源:电喷雾离子源,正离子扫描;多反应监测;毛细管电压4.0 kV;雾化器压力40 psi;干燥气流速10 L/min;干燥气温度300 ℃;鞘气流速10 L/min;鞘气温度300 ℃。
1.5 样品前处理
称取捣碎后的组织样品5.00 g于50 mL具塞离心管中,准确加入10 mL乙腈,加入1粒陶瓷均质子,涡旋振荡10 min,4 500 r/min常温离心10 min,吸取2 mL上清液于15 mL离心管中,加入500 mg无水硫酸镁和100 mg C18吸附剂,涡旋1 min,5 000 r/min离心2 min,取上清液过0.22 μm PTFE滤膜,待测。
1.6 基质工作曲线配制
依次吸取不同体积的标准使用液加入相同取样量的2种空白基质样品中(牛肉、猪肉),样品按1.5前处理方法处理后得到2种基质工作曲线,分别对2种样品进行定量校正。基质标准工作曲线范围分别为:阿苯达唑0.05~5.00 ng/mL,阿苯达唑砜0.10~10.00 ng/mL,阿苯达唑亚砜和阿苯达唑-2-氨基砜0.50~50.00 ng/mL。
2 结果与分析
2.1 样品前处理的优化
2.1.1 提取
选用基质猪肉、牛肉阴性样品,实验分别考察了乙腈、含0.1%(体积分数)甲酸的乙腈溶液、乙酸乙酯和含0.1%(体积分数)甲酸的乙酸乙酯溶液的提取效率。结果见图1-a,结果表明,2种畜肉基质中乙腈和含0.1%甲酸的乙腈溶液的提取效果明显优于乙酸乙酯和含0.1%甲酸的乙酸乙酯溶液的提取效果,且乙腈的提取效果略优于含0.1%甲酸的乙腈溶液,因此本实验选择乙腈作为样品提取溶剂。
实验对涡旋振荡提取的时间(5、10、15 min)进行了考察,结果发现,在5~10 min时,随着时间的延长目标物提取效果明显增大,10 min以后随着时间的增加,目标物提取效果基本趋于稳定,如图1-b所示。故实验选用涡旋振荡10 min作为样品提取的时间。

a-溶剂;b-时间
1-阿苯达唑;2-阿苯达唑砜;3-阿苯达唑亚砜;4-阿苯达唑-2-氨基砜
图1 提取溶剂和提取时间对猪肉、牛肉中阿苯达唑及其代谢物的回收率范围(n=3)
Fig.1 Recovery rates of albendazole and its metabolites in pork and beef with extraction solvents and extraction times
2.1.2 净化
目前,除了市售已有的产品,常用的吸附剂有C18、PSA等。本研究拟对QuEChERS dSPE EMR-Lipid净化管、Oasis PRiME HLB固相萃取小柱(无须活化、上样直接收集滤液)、PSA吸附剂及C18吸附剂净化效果进行了考察。结果如图2-a,使用QuEChERS dSPE EMR-Lipid净化管和Oasis PRiME HLB固相萃取小柱净化时,目标物几乎被填料完全吸附;使用PSA吸附剂时对目标物有较强的吸附作用,导致目标物损失较大;使用C18吸附剂净化时,目标物损失较少,满足相关要求。实验进一步对C18吸附剂的用量(50、100、150 mg)进行优化。结果见图2-b,使用100 mg C18吸附剂净化样品时,净化效果较好,且目标物损失较少。最终本实验使用500 mg无水硫酸镁和100 mg C18吸附剂作为样品前处理方法。

a-净化试剂;b-C18用量
图2 净化试剂及C18用量的优化(n=3)
Fig.2 Optimization of purification reagent and dosage of C18
2.2 色谱条件的优化
本实验采用超高效液相色谱配合C18超高压反相色谱柱对目标物进行分离。实验分别考察了乙腈-水、乙腈-0.1%甲酸水、乙腈-0.1%甲酸水(含2 mmol/L乙酸铵溶液)、甲醇-0.1%甲酸水、甲醇-0.1%甲酸水(含2 mmol/L乙酸铵溶液)等不同洗脱体系对目标物分离能力。结果表明,使用乙腈-0.1%甲酸水作为流动相时,目标物有良好的色谱分离效果,色谱峰峰型更好,且有较好的响应值,进一步对梯度洗脱程序进行优化,使目标物有较好的分离,缩短样品分析时间,提高了分析效率;实验考察了不同柱温(25、30、40、50 ℃)对目标物分离效果的影响,结果表明采用40 ℃的柱温时目标物有较好的分离效果。从而确立了最佳色谱条件,样品单次分析时间仅需4.5 min,满足大批样品的快速检测分析。
2.3 质谱条件的优化
配制100 μg/L的标准溶液采用不接色谱柱直接进入质谱的电喷雾离子源,在正离子模式下一级全扫描质谱得到各目标物分子离子峰([M+H]+),通过优化去簇电压,对母离子进行二级质谱分析,得到特征碎片离子质谱图,选择特征碎片离子中响应值高、基线噪声低的离子对作为定性离子对,选择响应值最高的离子对作为定量离子对,优化子离子对碰撞能量,使其丰度最大;进一步优化毛细管电压、雾化器压力、干燥和鞘气的温度及压力等质谱参数,使其离子化效率最佳,得到最优的质谱条件,如表1。
表1 质谱参数
Table 1 Mass spectrum conditions of albendazole and its metabolites
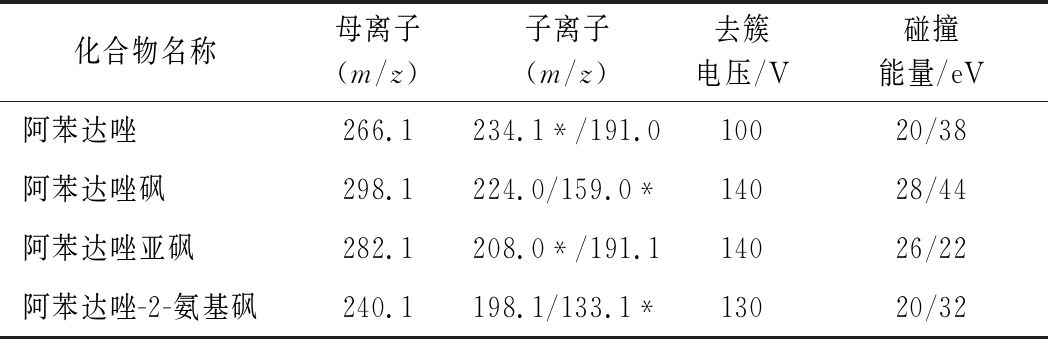
化合物名称母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV阿苯达唑266.1234.1*/191.010020/38阿苯达唑砜298.1224.0/159.0*14028/44阿苯达唑亚砜282.1208.0*/191.114026/22阿苯达唑-2-氨基砜240.1198.1/133.1*13020/32
注:*为定量离子
2.4 方法学评价
2.4.1 基质效应的评价及消除
基质效应(matrix effect,ME)是与目标物共同洗脱并干扰质谱仪电离过程的基质物质引起而导致目标化合物信号强度有不同程度的增强或减弱的现象,包括基质增强效应和基质抑制效应[20],易影响仪器的灵敏度和分析结果的准确性。因而在建立UHPLC-MS/MS检测方法时应对基质效应进行评价,为保证结果的准确可靠,采取措施消除或减弱其影响是非常必要的。本方法采用空白样品处理液匹配标准曲线和纯溶剂匹配标准曲线评价基质效应,即ME=(基质标准溶液曲线斜率/无基质标准溶液曲线斜率-1)×100%,负值表示存在基质抑制效应,正值表示存在基质增强效应,绝对值越大则基质效应越强。本文在阿苯达唑及其代谢物标准曲线范围浓度内进行评价(表2),可以看出阿苯达唑及其代谢物均存在较强的基质效应,阿苯达唑和阿苯达唑-2-氨基砜为基质抑制效应,阿苯达唑砜和阿苯达唑亚砜为基质增强效应。
2.4.2 方法的标准曲线和检出限
本方法采用空白样液稀释混合标准工作曲线,制备成系列不同浓度的混合标准工作液,在选定的色谱和质谱条件下测定,以标准溶液定量离子对峰面积(y)对其质量浓度(x)做标准曲线,得到阿苯达唑及其代谢物的工作曲线。结果表明,阿苯达唑及其代谢物各自的质量浓度范围内,呈现良好的线性关系,相关系数(R2)均>0.998,适用于定量分析。通过向阴性样品中添加目标物来考察方法的检出限(S/N=3)和定量限(S/N=10),最终确定方法的检出限为(μg/kg):阿苯达唑-2-氨基砜1 ;阿苯达唑亚砜1;阿苯达唑砜0.2;阿苯达唑0.1。定量限为(μg/kg):阿苯达唑-2-氨基砜3;阿苯达唑亚砜3;阿苯达唑砜0.6;阿苯达唑0.3。结果见表2,说明该方法具有较好的灵敏度。
表2 方法线性方程、相关系数、基质效应、检出限及定量限
Table 2 Calibration equation,correlation coefficient,ME,LOD and LOQ of the method
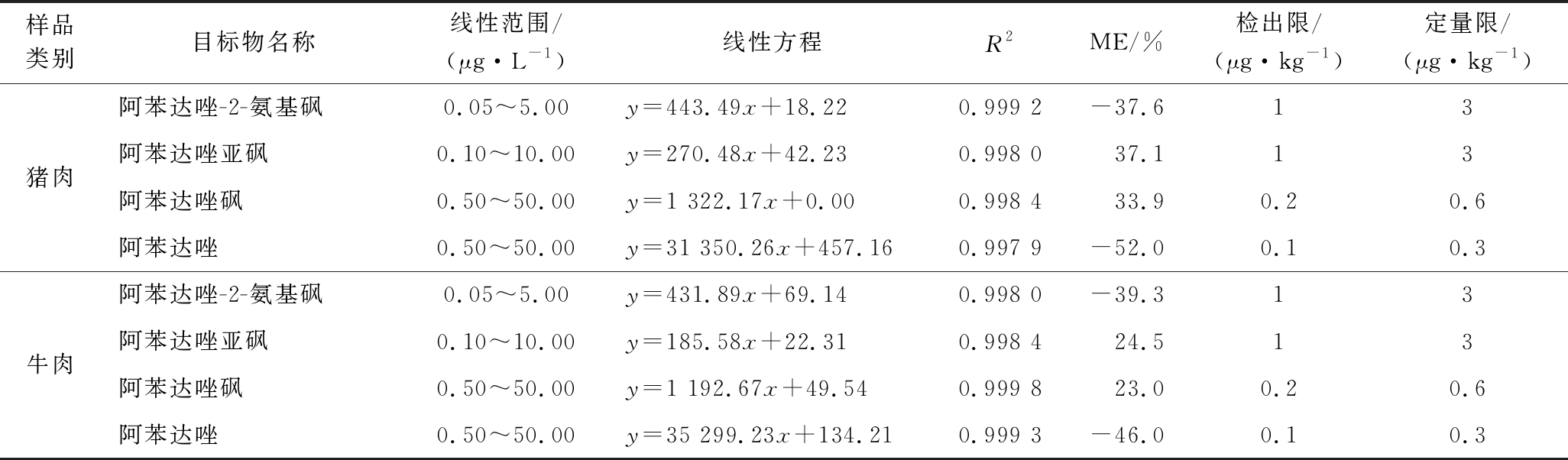
样品类别目标物名称线性范围/(μg·L-1)线性方程R2ME/%检出限/(μg·kg-1)定量限/(μg·kg-1)猪肉阿苯达唑-2-氨基砜0.05~5.00y=443.49x+18.220.999 2-37.613阿苯达唑亚砜0.10~10.00y=270.48x+42.230.998 037.113阿苯达唑砜0.50~50.00y=1 322.17x+0.000.998 433.90.20.6阿苯达唑0.50~50.00y=31 350.26x+457.160.997 9-52.00.10.3牛肉阿苯达唑-2-氨基砜0.05~5.00y=431.89x+69.140.998 0-39.313阿苯达唑亚砜0.10~10.00y=185.58x+22.310.998 424.513阿苯达唑砜0.50~50.00y=1 192.67x+49.540.999 823.00.20.6阿苯达唑0.50~50.00y=35 299.23x+134.210.999 3-46.00.10.3
2.5 加标回收及精密度考察
选取猪肉和牛肉阴性样品,分别添加检出限的1、2、10倍3个不同浓度,每个添加水平做6个平行,按照1.5中的样品前处理方法进行提取净化,3个加标浓度连续做3 d,分别计算平均回收率和精密度,精密度以相对标准偏差(relative standard deviation,RSD)表示。结果如表3所示,3个添加水平的准确度均<15%,日内(n=6)平均回收率分别为猪肉:81.9%~109.8%,牛肉:82.3%~103.5%;日内(n=6)RSD分别为猪肉:3.3%~12.5%,牛肉:1.8%~9.0%。日间(n=3)平均回收率分别为猪肉:81.8%~99.0%,牛肉:86.3%~99.0%;日间(n=3)RSD分别为猪肉:3.1%~12.6%,牛肉:2.4%~14.4%。说明该方法具有较好的重复性与准确性,能够满足猪肉和牛肉中阿苯达唑及其代谢物残留量的测定。图3为混合标准溶液、空白样品和加标样品的总离子流图。
2.6 实际样品的测定
利用本研究建立的方法对市售的50批次猪肉样品、38批次牛肉样品进行测定,其中1份猪肉样品和1份牛肉样品中阿苯达唑-2-氨基砜检测结果为阳性,含量分别为3.40、32.1 μg/kg,其余样品均未检出或低于定量限。
表3 回收率和精密度
Table 3 Recoveries and precision of the method
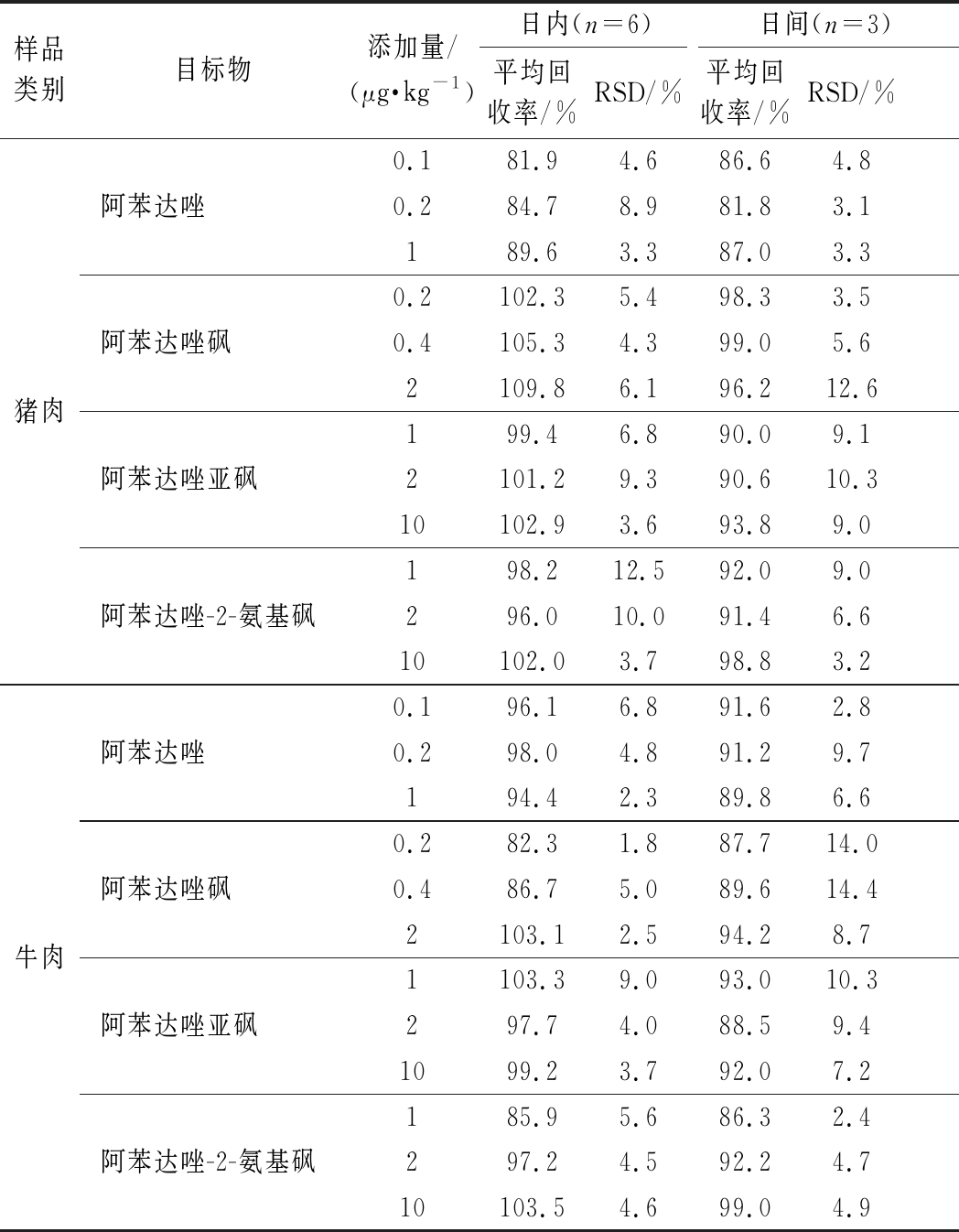
样品类别目标物添加量/(μg·kg-1)日内(n=6)日间(n=3)平均回收率/%RSD/%平均回收率/%RSD/%猪肉阿苯达唑0.181.94.686.64.80.284.78.981.83.1189.63.387.03.3阿苯达唑砜0.2102.35.498.33.50.4105.34.399.05.62109.86.196.212.6阿苯达唑亚砜199.46.890.09.12101.29.390.610.310102.93.693.89.0阿苯达唑-2-氨基砜198.212.592.09.0296.010.091.46.610102.03.798.83.2牛肉阿苯达唑0.196.16.891.62.80.298.04.891.29.7194.42.389.86.6阿苯达唑砜0.282.31.887.714.00.486.75.089.614.42103.12.594.28.7阿苯达唑亚砜1103.39.093.010.3297.74.088.59.41099.23.792.07.2阿苯达唑-2-氨基砜185.95.686.32.4297.24.592.24.710103.54.699.04.9

a-4种阿苯达唑混合标准溶液(阿苯达唑0.5 μg/L,阿苯达唑砜1 μg/L,阿苯达唑亚砜和阿苯达唑-2-氨基砜5 μg/L);b-猪肉样品加标(阿苯达唑1 μg/kg,阿苯达唑砜2 μg/kg,阿苯达唑亚砜和阿苯达唑-2-氨基砜10 μg/kg);c-牛肉样品加标(阿苯达唑1 μg/kg,阿苯达唑砜2 μg/kg,阿苯达唑亚砜和阿苯达唑-2-氨基砜10 μg/kg);d-猪肉空白样品;e-牛肉空白样品;A-阿苯达唑-2-氨基砜;B-阿苯达唑亚砜;C-阿苯达唑砜;D-阿苯达唑
图3 混合标准溶液、猪肉样品加标、猪肉、牛肉样品加标和牛肉总离子流图
Fig.3 Total ion chromatograms of standard solution,pork sample spiked with albendazole and its metabolites,pork blank sample,beef sample spiked with albendazole and its metabolites and beef blank sample
3 结论
本研究采用高效液相色谱-串联质谱仪建立了猪肉、牛肉中阿苯达唑及其代谢物(阿苯达唑砜、阿苯达唑亚砜、阿苯达唑-2-氨基砜)残留量的快速分析方法,通过对样品前处理、液相色谱、质谱等条件进行了优化,并进行了方法学考察。结果表明,阿苯达唑及其代谢物在4.5 min内完成分析,且目标物有较好的分离度,相关系数(R2)均>0.998,检测限为0.1~1 μg/kg,定量限在0.3~3 μg/kg,日内(n=6)平均回收率在81.9%~109.8%,日间(n=3)平均回收率在81.8%~99.0%,精密度为1.8%~14.4%。本方法操作简单、快速、准确、灵敏度高,重现性好,回收率高且稳定,检测限及定量限低于现有检测方法要求,能够准确定性和定量分析畜肉(猪肉、牛肉)中阿苯达唑及其代谢物残留量,满足日常分析检测的要求。
[1] DAVIS A,DIXON H,PAWLOWSKI Z S.Multicentre clinical trials of benzimidazole-carbamates in human cystic echinococcosis (phase 2)[J].Bulletin of the World Health Organization,1989,67(5):503-508.
[2] 路宽,覃亮.抗寄生虫药阿苯达唑新活性研究[J].中国当代医药,2010,17(23):12-13.
LU K,QIN L.Study on new activity of antiparasitic drug albendazole[J].China Modern Medicine,2010,17(23):12-13.
[3] JONGSUKSUNTIGUL P,JERADIT C,PORNPATTANAKUL S,et al.A comparative study on the efficacy of albendazole and mebendazole in the treatment of ascariasis,hookworm infection and trichuriasis[J].The Southeast Asian Journal of Tropical Medicine and Public Health,1993,24(4):724-729.
[4] 李晓婷, 周绪正,李冰,等.广谱抗蠕虫药阿苯达唑研究进展[J].中兽医医药杂志,2019,38(3):26-29.
LI X T,ZHOU X Z,LI B,et al.Reviewed on research of albendazole[J].Journal of Traditional Chinese Veterinary Medicine,2019,38(3):26-29.
[5] 中华人民共和国农业农村部,中华人民共和国国家卫生健康委员会,中华人民共和国国家市场监督管理总局.GB 31650—2019食品安全国家标准 食品中兽药最大残留限量[S].北京:中国标准出版社,2019.
Ministry of Agriculture and Rural Areas of the People’s Republic of China,National Health Commission of the People’s Republic of China,State Administration of Quality Supervision.GB 31650—2019,National food safety standard,Maximum residue limits of veterinary drugs in food[S].Beijing:China Standards Press,2019.
[6] 吴宁鹏, 彭丽,孟蕾,等.高效液相色谱-荧光法测定牛羊组织中阿苯达唑及其代谢物的残留量[J].中国兽药杂志,2017,51(2):35-39.
WU N P,PENG L,MENG L,et al.Determination ofalbendazole and its main metabolites residues in cattle and ovine tissues by HPLC-FLD[J].Chinese Journal of Veterinary Drug,2017,51(2):35-39.
[7] 杜红鸽,谭旭信,方忠意,等.高效液相色谱法测定动物肌肉中的阿苯达唑及其代谢物[J].中国兽药杂志,2010,44(1):52-55.
DU H G,TAN X X,FANG Z Y,et al.Determination ofalbendazole and its metabolite in animal muscle by HPLC[J].Chinese Journal of Veterinary Drug,2010,44(1):52-55.
[8] SHAIKH B,RUMMEL N,REIMSCHUESSEL R.Determination of albendazole and its major metabolites in the muscle tissues of Atlantic salmon,tilapia,and rainbow trout by high performance liquid chromatography with fluorometric detection[J].Journal of Agricultural and Food Chemistry,2003,51(11):3 254-3 259.
[9] FLETOURIS D J,PAPAPANAGIOTOU E P,NAKOS D S,et al.Highlysensitive ion pair liquid chromatographic determination of albendazole marker residue in animal tissues[J].Journal of Agricultural and Food Chemistry,2005,53(4):893-898.
[10] SARANER N,ÖZKAN G Y,GÜNEY B,et al.Determination of albendazole sulfoxide in human plasma by using liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B,2016,1 022:1-5.
[11] 张小军, 郑斌,张虹,等.超高效液相色谱-串联质谱法测定草鱼肉中阿苯达唑及其代谢物残留[J].分析化学,2011,39(6):815-820.
ZHANG X J,ZHENG B,ZHANG H,et al.Determination ofalbendzole and its metabolites in grass carp meat by ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2011,39(6):815-820.
[12] 赵超群, 刘柱,徐潇颖,等.超高效液相色谱-串联质谱法测定奶粉中16种苯并咪唑类药物残留量[J].理化检验-化学分册,2017,53(7):765-770.
ZHAO C Q,LIU Z,XU X Y,et al.UHPLC-MS/MS determination of residual amounts of 16 benzimidazoles in milk powder[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2017,53(7):765-770.
[13] CHHONKER Y S,EDI C,MURRY D J.LC-MS/MS method for simultaneous determination of diethylcarbamazine,albendazole and albendazole metabolites in human plasma:Application to a clinical pharmacokinetic study[J].Journal of Pharmaceutical and Biomedical Analysis,2018,151:84-90.
[14] 张海波, 黄琼,卢帅,等.UPLC-Q-TOF-MS法测定绵羊血浆中阿苯达唑及其3种代谢产物的浓度及药代动力学研究[J].新疆医科大学学报,2018,41(12):1 543-1 548.
ZHANG H B,HUANG Q,LU S,et al.Simultaneous determination of albendazole and its three metabolites in sheep plasma by UPLC-Q-TOF-MS and pharmacokinetic study[J].Journal of Xinjiang Medical University,2018,41(12):1 543-1 548.
[15] MARKUS J,SHERMA J.Method II.gas chromatographic/mass spectrometric confirmatory method for albendazole residues in cattle liver[J].Journal of AOAC International,1992,75(6):1 135-1 137.
[16] 倪建秀, 陈涛,陈桂芳.QuEChERS方法在食用农产品农兽药残留检测中的应用进展[J].现代农药,2016,15(5):5-8;11.
NI J X,CHEN T,CHEN G F,Research progress of QuEChERS for determination of pesticides and veterinary drugs residues in edible agro-products[J].Modern Agrochemicals,2016,15(5):5-8;11.
[17] MOLINA-RUIZ J M,CIESLIK E,WALKOWSKA I.Optimization of the QuEChERS method for determination of pesticide residues in chicken liver samples by gas chromatography-mass spectrometry[J].Food Analytical Methods,2015,8(4):898-906.
[18] 张爱芝, 王全林,曹丽丽,等.QuEChERS-超高效液相色谱-串联质谱法测定蔬菜中250种农药残留[J].色谱,2016,34(2):158-164.
ZHANG A Z,WANG Q L,CAO L L,et al.Determination of 250 pesticide residues in vegetables using QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2016,34(2):158-164.
[19] RIZZETTI T M,KEMMERICH M,MARTINS M L,et al.Optimization of a QuEChERS based method by means of central composite design for pesticide multiresidue determination in orange juice by UHPLC-MS/MS[J].Food Chemistry,2016,196:25-33.
[20] FAN S F,ZHAO P Y,YU C S,et al.Simultaneous determination of 36 pesticide residues in spinach and cauliflower by LC-MS/MS using multi-walled carbon nanotubes-based dispersive solid-phase clean-up[J].Food Additives & Contaminants:Part A,2014,31(1):73-82.