饮料生产企业在生产过程中常加入食品合成色素,以提升消费者的食欲和购买欲。但合成色素食用过多,会对人体造成危害。GB 2760—2014《食品安全国家标准 食品添加剂-使用标准》对食品中加入合成色素的使用量作了严格规定,如碳酸饮料中的蓝色染料亮蓝不得超过0.025 g/kg、糖果中亮蓝不得超过0.30 g/kg,饮料和糖果中的黄色染料柠檬黄和日落黄均不得超过0.10 g/kg。故研究食品中合成色素的含量有着重要意义。目前,国内外对食品中合成色素的检测方法主要有:高效液相色谱法[1-4]、液-质联用法[5-6]、荧光法[7-9]、电化学法[10-12] 和分光光度法[13-15] 等。前2种方法前处理相当麻烦、费时,且运行成本较高;荧光法和电化学法的条件要求均较苛刻;分光光度法虽然操作简便,仪器价廉,但对食品复杂成分中色素,尤其是各色素吸收峰重叠较大时,不便进行分析,需采用某些吸附和分离措施才能进行检测,使操作变得非常复杂;文献所报道的分光光度法除采用吸附、分离措施外,还用较复杂的数学公式来处理混合色素的含量分析问题。本文根据被测物的定性分析结果,采用直接光度法和酸度控制光度法相结合的方法,来实现碳酸饮料中混合色素的定量分析,尚未见文献报道。
1 材料与方法
1.1 材料与试剂
标准物质:亮蓝(bright blue,BRIB;纯度≥98%,Lot:YO1030 JA13)、柠檬黄(tartrazine,TAR;纯度≥98%,Lot:A3 J6L1)、日落黄(sunset yellow,SUN;纯度≥98%,Lot:JN1103RA14),北京盛世康普化工技术研究院,北京普析科技有限公司。
试剂:灿烂绿(bright green,BRIG;纯度99%),成都市科龙化工试剂厂;氨丁三醇(Tris,纯度99%),河南天孚化工有限公司;盐酸、氨水(NH3·H2O)、甲酸、无水乙醇,均为分析纯,重庆川东化工有限公司;聚酰胺粉(纯度99%),化夏化学北京公司;柠檬酸(分析纯)、甲醇(分析纯),上海阿拉丁生化科技股份有限公司;水,自制超纯水。
样品:芬达苹果味饮料(1#)、芬达橙味饮料(2#)、佳得乐蓝莓味饮料(3#),当地超市。
1.2 仪器与设备
KQ-200VDE型超声波清洗机,昆山市超声仪器有限公司;U—3010型紫外-可见分光光度计,日本日立公司;pHS-3C型酸度计,上海虹益仪器仪表有限公司生产。
1.3 溶液配制
标准溶液:1.00×10-3 mol/L BRIB(854.0 mg/L)、TAR(534.4 mg/L)和SUN(452.4 mg/L)贮备液,操作液均为1.00×10-4 mol/L,于冰箱4 ℃保存。BRIG 溶液:1.00×10-3 mol/L水溶液。Tris-HCl溶液:pH 3.0~9.8(用pH 计测定)。
1.4 样品处理
分别准确移取1#~3# 饮料30.0 mL,置于各小烧杯中称量(精确至±0.000 1 g),于45 ℃超声20 min(除CO2),再用NH3·H2O调至近中性,加热至60 ℃,往样液中加入1 g已调成糊状的聚酰胺粉,搅拌、抽滤,用60 ℃ pH 4.0的水(用柠檬酸调成pH 4.0)洗涤3~5 次(每次5 mL),再用甲醇-甲酸(体积比6∶4)混合液洗涤3~5次(每次5 mL),最后用水洗至洗出液为无色为止。用乙醇-氨水-水混合液(体积比7∶2∶1)解吸3~5次(每次5 mL),直至色素完全解吸,合并解吸液,加乙酸中和至近中性,再在70 ℃水浴上蒸发至近干,加水溶解后定容至5.0 mL。取该液4.0 mL,用水定容至25.0 mL,得1#~3#待测液,冰箱4 ℃保存。
1.5 实验方法
取1.4的待测液扫描吸收光谱,定性分析各样液中所含物质的成份,再进行各物质的定量分析。准确移取适量1.00×10-4 mol/L BRIB标准溶液于10 mL比色管中,用水稀释至刻度,摇匀。再准确移取适量1.00×10-4 mol/L TAR和SUN标准溶液,分别置于10 mL比色管中,加入2.00 mL 1.00×10-3 mol/L BRIG和1.00 mL Tris-HCl溶液(pH 3.50),摇匀,用水定容。待充分反应15 min后,在分光光度计上以水作参比,在628 nm处测定BRIB溶液的吸光度(A1);以相应的试剂空白作参比,在426 nm处测定TAR-BRIG 体系的吸光度(A2),在500 nm处测定SUN-BRIG体系的吸光度(A3)。从而求得饮料中共存色素—BRIB、TAR和SUN的含量。
2 结果与分析
2.1 亮蓝、柠檬黄、日落黄及与灿烂绿反应的吸收光谱特征
亮蓝、柠檬黄、日落黄及经1.4处理后的待测饮料样液的吸收光谱图见图1。亮蓝标准溶液在628 nm处有最大吸收(曲线1),柠檬黄标准溶液在428 nm有最大吸收(曲线2),日落黄标准溶液在480 nm处有最大吸收(曲线3);比较1#样~3#样的吸收曲线,可定性:1#样中含有亮蓝和柠檬黄(曲线4),2#样中含有日落黄和柠檬黄(曲线5),3#样中含有亮蓝(曲线6)。
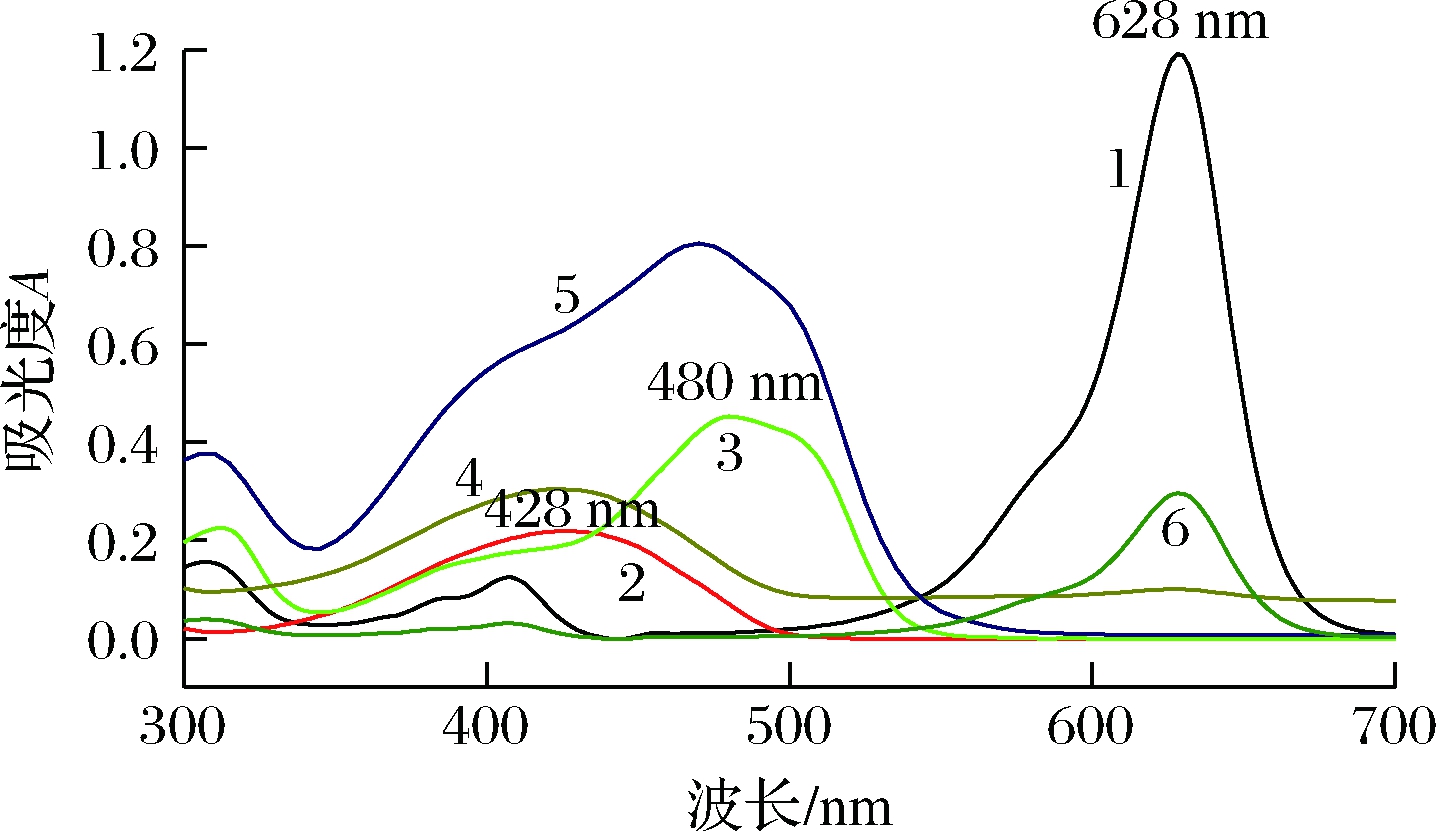
1-8.54 mg/L亮蓝,水作参比;2-5.34 mg/L柠檬黄,水作参比;3-4.52 mg/L日落黄,水作参比;4-1#饮料样液;5-2#饮料样液;6-3#饮料样液
图1 亮蓝、柠檬黄、日落黄及饮料样液的吸收光谱
Fig.1 The absorption spectra of bright blue,tartrazine,sunset yellow and beverage samples
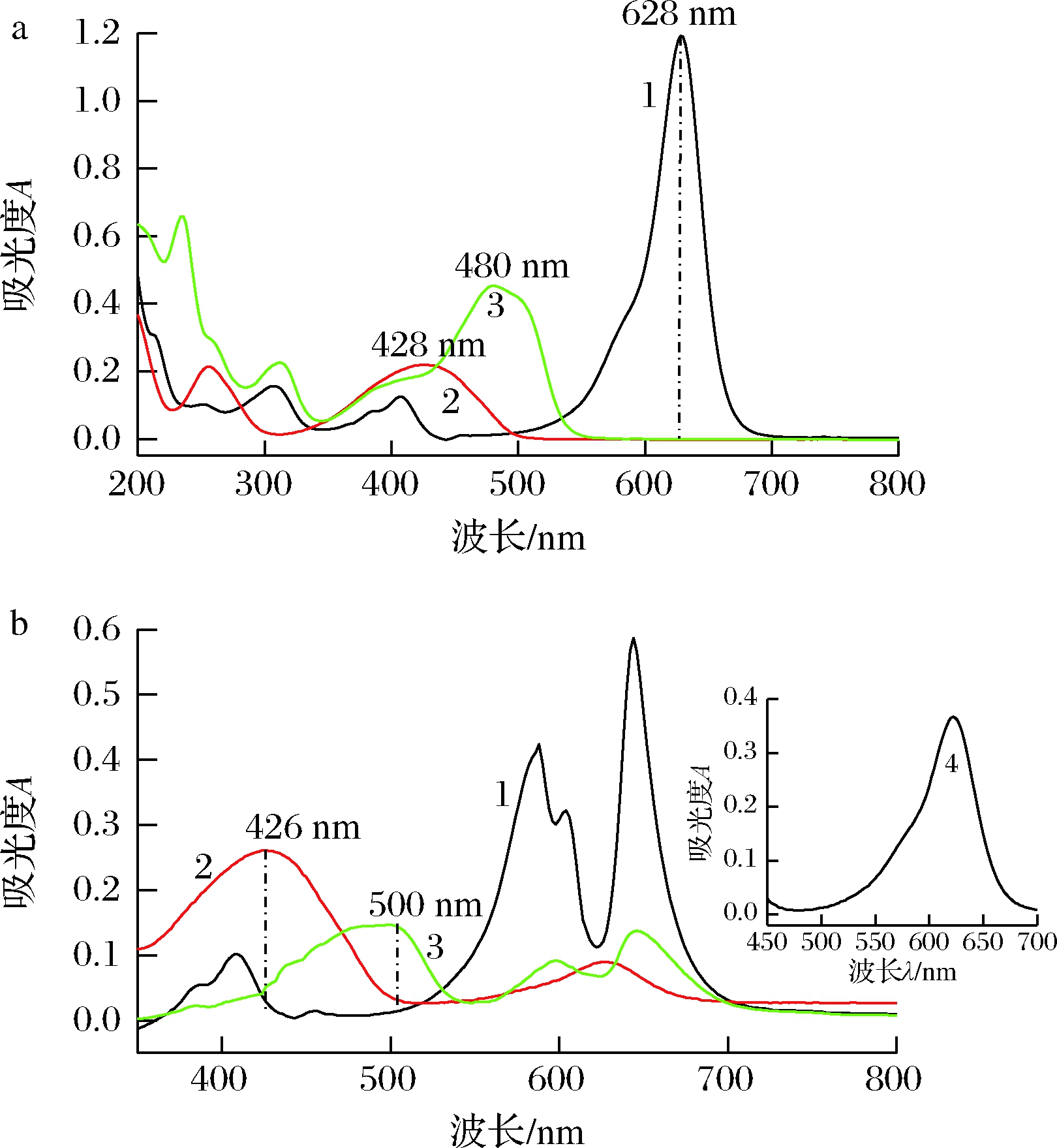
a:1-8.54 mg/L亮蓝;2-5.34 mg/L柠檬黄;3-4.52 mg/L日落黄,1,2,3均为水作参比;b:1-8.54 mg/L亮蓝—2.00×10-4 mol/L灿烂绿;2-5.34 mg/L柠檬黄—2.00×10-4 mol/L灿烂绿;3-4.52 mg/L日落黄—2.00×10-4 mol/L灿烂绿,1,2,3 pH均为3.50,均为试剂空白作参比;4-2.00×10-5 mol/L灿烂绿,pH 3.50,水作参比
图2 亮蓝、柠檬黄和日落黄与灿烂绿的吸收光谱
Fig.2 The absorption spectra of the reaction of bright blue, tartrazine and sunset yellow with bright green
由图2-a可知,当亮蓝、柠檬黄和日落黄共存时,在628 nm处,可直接测定亮蓝的吸光度,柠檬黄和日落黄不干扰测定;而柠檬黄和日落黄的吸收曲线相互重叠较多,干扰较大,不能进行分别定量测定。
由图2-b可知,当以灿烂绿作探针,在pH 3.50 Tris-HCl条件下,柠檬黄与灿烂绿反应生成的离子缔合物的最大吸收波长位于426 nm(灿烂绿的最大吸收波长为623 nm),相比灿烂绿紫移197 nm,说明柠檬黄与灿烂绿确实发生了化学反应生成了新的物质;日落黄与灿烂绿反应生成的离子缔合物的最大吸收波长位于500 nm,相比灿烂绿蓝移123 nm,说明两者确实发生了化学反应生成了新物质。从吸收曲线2和曲线3可知,亮蓝、柠檬黄和日落黄共存时,可以在426 nm处测定柠檬黄,日落黄和亮蓝不干扰测定,也可在500 nm处测定日落黄,柠檬黄和亮蓝也不干扰测定。
由图3可知,亮蓝、柠檬黄和日落黄在各自相应条件下,均有线性吸收关系。故当亮蓝、柠檬黄和日落黄共存时,可用分光光度法直接测定亮蓝,用酸度控制(pH 3.5 Tris-HCl溶液)分光光度法分别测定共存物中的柠檬黄和日落黄,从而达到分别测定共存色素含量的目的。吸收光谱特征见表1。
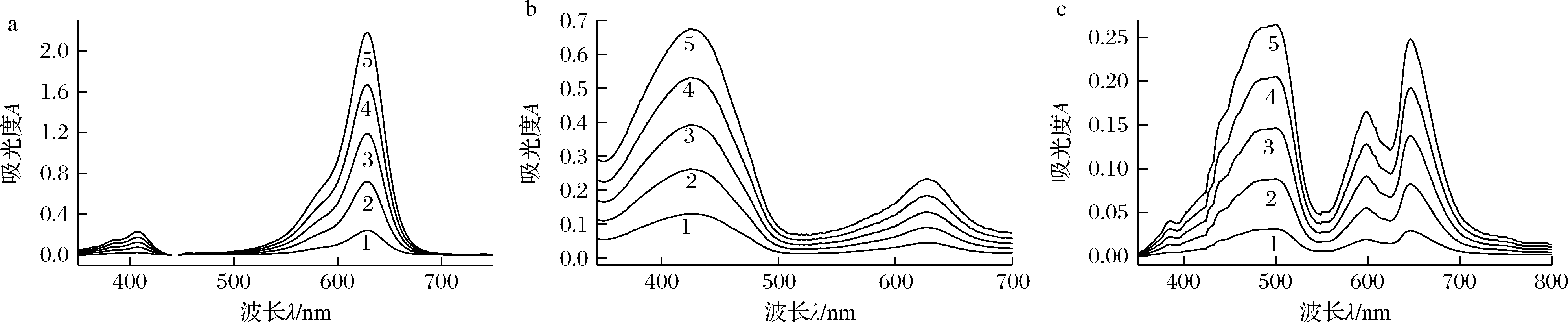
a:1~5-1.71、5.12、8.54、12.0、15.4 mg/L亮蓝,水作参比;b:1~5-2.67、5.34、8.02、10.7、13.4 mg/L柠檬黄—2.00×10-4 mol/L灿烂绿,pH 3.50,试剂空白作参比;c:1~5-0.905、2.71、4.52、6.33、8.14 mg/L日落黄—2.00×10-4 mol/L灿烂绿,pH 3.50,试剂空白作参比
图3 亮蓝、柠檬黄-灿烂绿、日落黄-灿烂绿的线性吸收光谱
Fig.3 Linear absorption spectra of bright blue,tartrazine-bright green and sunset yellow-bright green
表1 亮蓝、柠檬黄及日落黄的吸收光谱特征
Table 1 The absorption spectrum characteristics of bright blue and tartrazine and sunset yellow
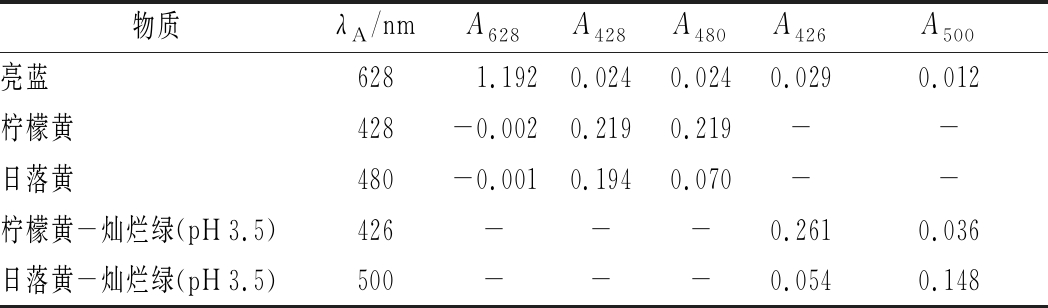
物质λA/nmA628A428A480A426A500亮蓝6281.1920.0240.0240.0290.012柠檬黄428-0.0020.2190.219--日落黄480-0.0010.1940.070--柠檬黄-灿烂绿(pH 3.5)426---0.2610.036日落黄-灿烂绿(pH 3.5)500---0.0540.148
2.2 溶液pH
从2.1分析可知,当亮蓝、柠檬黄和日落黄共存时,柠檬黄和日落黄不干扰亮蓝的测定,即亮蓝不需辅助条件便可直接进行定量测定,当考察Tris-HCl酸度对亮蓝吸光度的影响时,结果表明,亮蓝基本不受酸度的影响,这与它的耐酸、耐碱性一致,故实验中不用调节酸度;亮蓝对柠檬黄和日落黄的测定基本不干扰,当以灿烂绿作探针时,亮蓝也不干扰柠檬黄和日落黄的测定;柠檬黄与日落黄测定中的干扰主要为两种物质的互相干扰,因此本实验考察了分别测定共存物中柠檬黄和日落黄时所需的酸度条件。从图4-a可知,柠檬黄-灿烂绿体系与日落黄-灿烂绿体系在426 nm波长和pH 3.50 Tris-HCl条件下,可以单独测定柠檬黄,日落黄不干扰;从图4-b可知,柠檬黄-灿烂绿体系与日落黄-灿烂绿体系在500 nm波长和pH 3.50 Tris-HCl条件下,可以单独测定日落黄,柠檬黄不干扰。故在2.00 mL 1.00×10-3 mol/L灿烂绿条件下,选择1.00 mL Tris-HCl (pH 3.50) 分别作为测定柠檬黄和日落黄的介质条件,从而达到分别测定共存物质的目的。
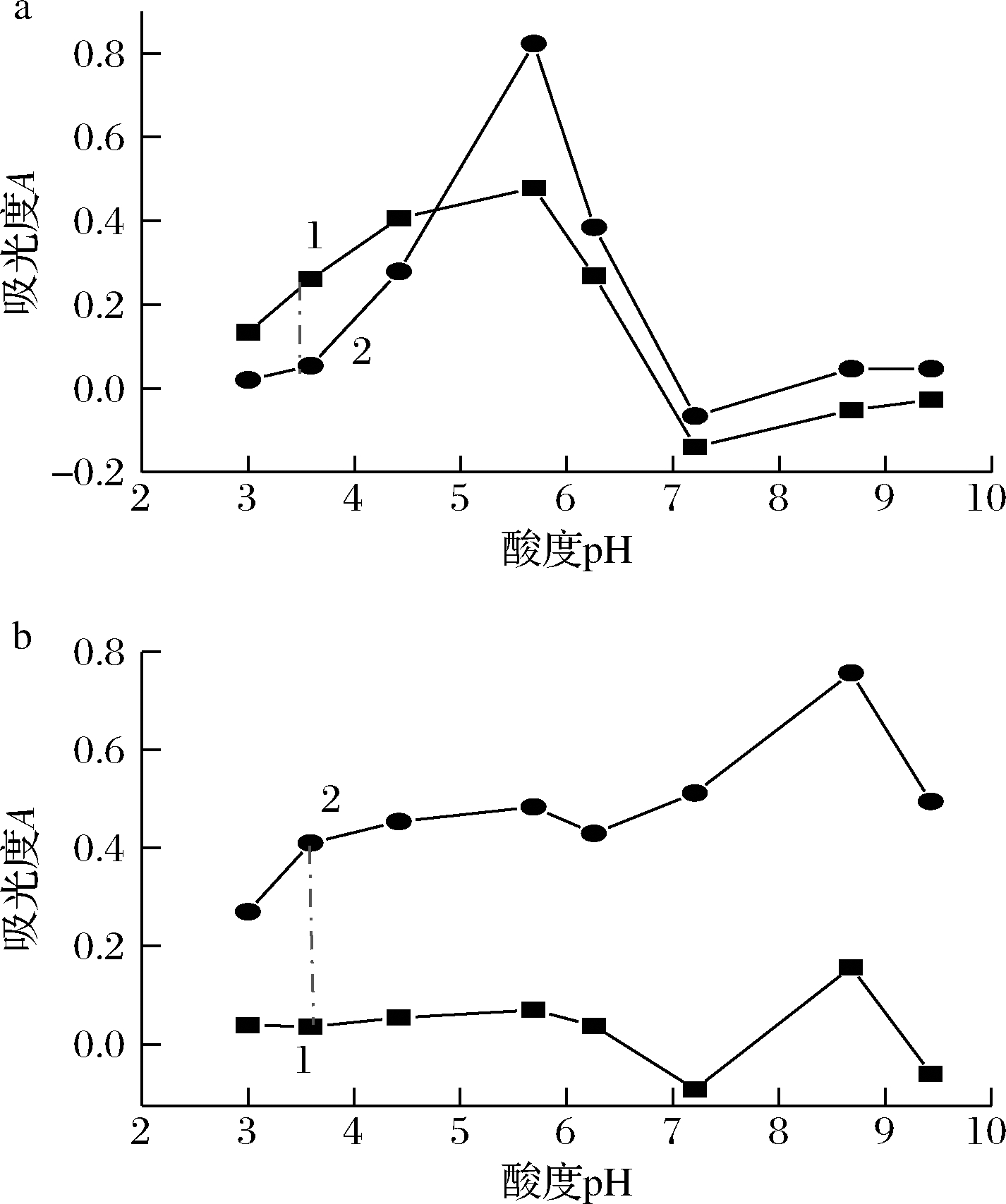
a-426 nm的吸光度值;b-500 nm的吸光度值
1-5.34 mg/L柠檬黄-2.00×10-4 mol/L灿烂绿;2-4.52 mg/L
日落黄-2.00×10-4 mol/L灿烂绿
图4 溶液pH对吸光度 的影响
Fig.4 Effect of solution pH on absorbance
2.3 反应时间
在前述条件不变的情况下,对亮蓝、柠檬黄和日落黄测定中是否受时间影响进行了考察。结果表明,单独的亮蓝测定不受时间影响;柠檬黄-灿烂绿体系与日落黄-灿烂绿体系受时间影响较大,只有在充分反应15 min后至60 min进行测定,吸光度才最大且稳定。故测定时间选在最佳时间段。
2.4 方法学考察
2.4.1 标准曲线及灵敏度
准确移取1.00×10-4 mol/L亮蓝和日落黄标准液0.00、0.20、0.60、1.00、1.40、1.80 mL,柠檬黄标准溶液0.00、0.50、1.00、1.50、2.00、2.50 mL,分别置于10 mL比色管中,并于柠檬黄和日落黄的比色管中加入1.00 mL Tris-HCl溶液(pH 3.50)和2.00 mL 1.00×10-3 mol/L灿烂绿溶液,用水定容,摇匀,按1.5中的测定方法测定各标准系列溶液的吸光度(n=3),作吸光度和质量浓度的标准曲线,其相关参数见表2。可见,该方法有较宽的线性范围、较好的线性关系和较高的灵敏度。
表2 亮蓝、柠檬黄及日落黄的标准曲线相关参数
Table 2 Related parameters of standard curves of bright blue,tartrazine and sunset yellow
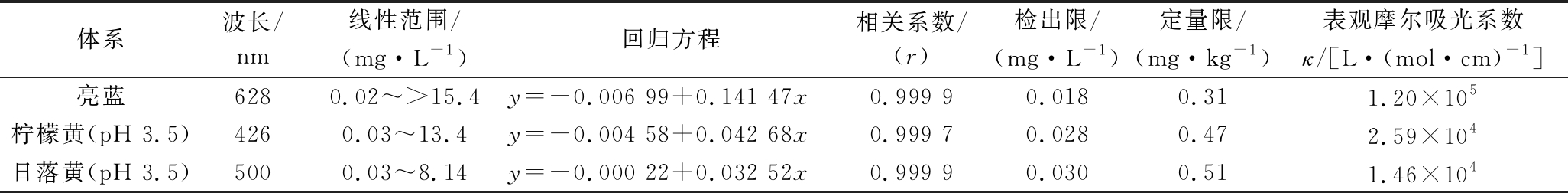
体系波长/nm线性范围/(mg·L-1)回归方程相关系数/(r)检出限/(mg·L-1)定量限/(mg·kg-1)表观摩尔吸光系数κ/[L·(mol·cm)-1]亮蓝6280.02~>15.4y=-0.006 99+0.141 47x0.999 90.0180.311.20×105柠檬黄(pH 3.5)4260.03~13.4y=-0.004 58+0.042 68x0.999 70.0280.472.59×104日落黄(pH 3.5)5000.03~8.14y=-0.000 22+0.032 52x0.999 90.0300.511.46×104
2.4.2 方法的选择性
按照1.5 的方法,考察某些可能的共存物质对该方法测定亮蓝、柠檬黄和日落黄的影响,结果见表3。可知,当相对误差<±5%时,用本方法测定亮蓝、柠檬黄及日落黄时,氨基酸类、糖类及食品中常见的部分添加剂均有较大允许倍数,常见阴、阳离子中除Fe3+和Al3+的允许倍数较小外,其余离子有较大允许倍数,不干扰亮蓝、柠檬黄及日落黄的测定。故该法有良好的选择性。
表3 共存物质的影响
Table 3 Effect of coexistent substance
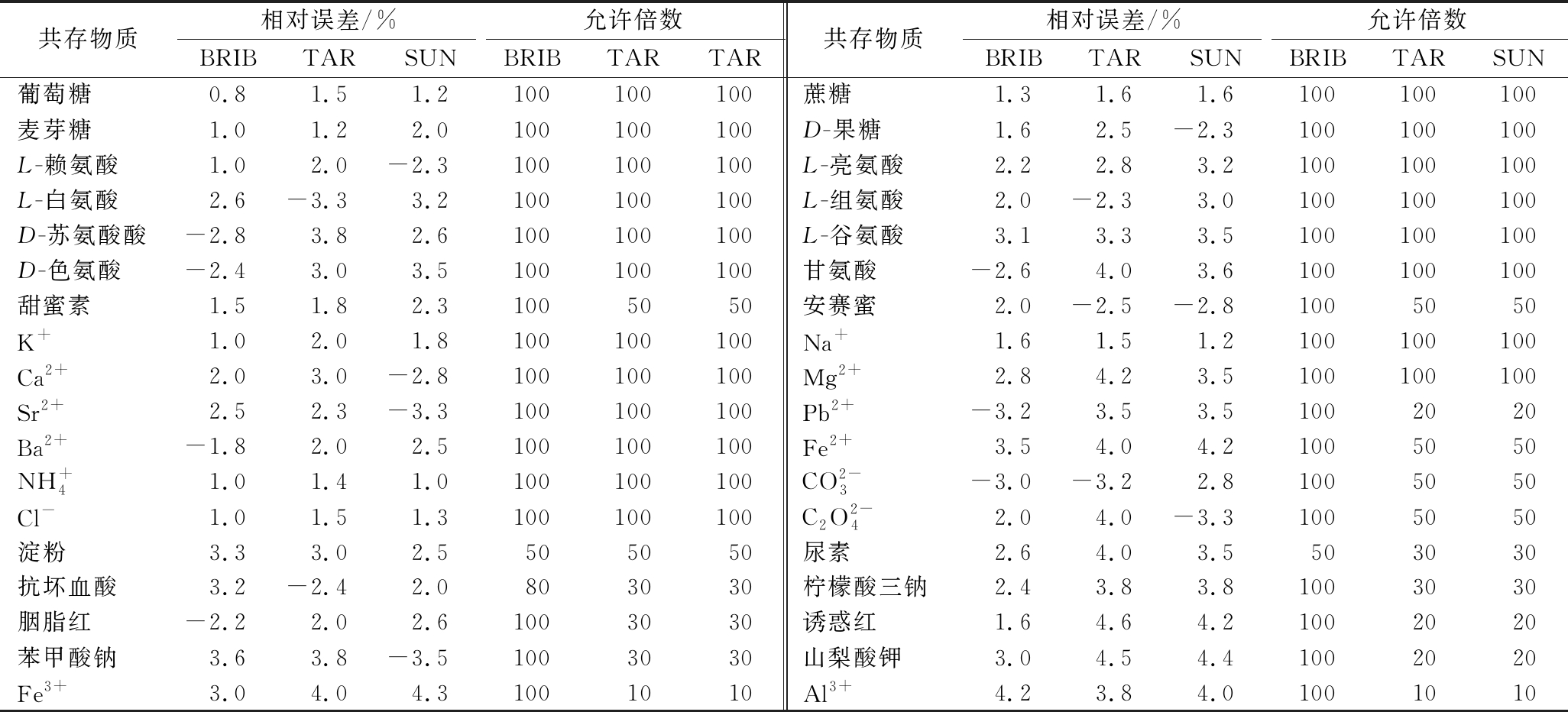
共存物质相对误差/%允许倍数BRIBTARSUNBRIBTARTAR共存物质相对误差/%允许倍数BRIBTARSUNBRIBTARSUN葡萄糖0.81.51.2100100100蔗糖1.31.61.6100100100麦芽糖1.01.22.0100100100D-果糖1.62.5-2.3100100100L-赖氨酸1.02.0-2.3100100100L-亮氨酸2.22.83.2100100100L-白氨酸2.6-3.33.2100100100L-组氨酸2.0-2.33.0100100100D-苏氨酸酸-2.83.82.6100100100L-谷氨酸3.13.33.5100100100D-色氨酸-2.43.03.5100100100甘氨酸-2.64.03.6100100100甜蜜素1.51.82.31005050安赛蜜2.0-2.5-2.81005050K+1.02.01.8100100100Na+1.61.51.2100100100Ca2+2.03.0-2.8100100100Mg2+2.84.23.5100100100Sr2+2.52.3-3.3100100100Pb2+-3.23.53.51002020Ba2+-1.82.02.5100100100Fe2+3.54.04.21005050NH+41.01.41.0100100100CO2-3-3.0-3.22.81005050Cl-1.01.51.3100100100C2O2-42.04.0-3.31005050淀粉3.33.02.5505050尿素2.64.03.5503030抗坏血酸3.2-2.42.0803030柠檬酸三钠2.43.83.81003030胭脂红-2.22.02.61003030诱惑红1.64.64.21002020苯甲酸钠3.63.8-3.51003030山梨酸钾3.04.54.41002020Fe3+3.04.04.31001010Al3+4.23.84.01001010
2.4.3 样品测定、准确度及精密度
取1.4下制备好的待测液2.00 mL代替标准溶液,按实验方法测定各样液中亮蓝、柠檬黄和日落黄的含量(n=5)。再照样液的制备方法制取样加标(不同浓度水平)溶液,做加标回收试验(n=5)。同时,用GB 5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》中HPLC法作对照试验,并对2种方法的测定结果进行显著性检验,结果见表4。F检验结果表明,当置信度为90%,2种方法的测定次数均为5(自由度为4)时,2种方法测定结果的精密度间无显著性差异;t检验结果表明,2种方法的准确度间无显著性差异。故新方法准确可靠,可用于定量测定碳酸饮料中共存的亮蓝、柠檬黄及日落黄的含量。
表4 饮料样品分析结果及回收试验(n=5)
Table 4 Analysis results and recovery test of beverage samples (n=5)

样品样品含量/(mg·L-1)显著性检验本法对照法F检验t检验样品本底值/(×10-3mg)加标量/(×10-3mg)平均值/(×10-3 mg)平均回收率/%相对标准偏差/%1#0.8542.3597.22.0BRIB0.7930.8001.25 注:ND 为未检出;如样品含量<检出限,按检出限的1/2 计算回收率
3 结论
用直接光度法测定共存色素(亮蓝、柠檬黄和日落黄)中的亮蓝、用酸度控制光度法分别测定共存物中的柠檬黄和日落黄,有较宽的线性范围、较高灵敏度和较好的选择性,准确度和精密度均满足定量分析要求。样品处理中,色素经吸附、洗脱处理后,可以不经分离便可达到分别测定共存色素的目的。该法与液相色谱法相比,更为简便、快速。该法适于芬达苹果味、橙味及佳得乐蓝莓味饮料中共存亮蓝、柠檬黄和日落黄的批量测定。
[1] LI Q,LIU W,ZHU X S.Green choline amino acid Ionic liquid aqueous two-phase extraction coupled with HPLC for analysis sunset yellow in beverages[J].Food Analytical Methods,2019,12(11):2 527-2 534.
[2] LI R,WANG Y,TAN J,et al.Simultaneous determination of synthetic edible pigments in beverages by titania-based RP-HPLC[J].Arabian Journal of Chemistry,2020,13(2):3 875-3 881.
[3] CHEN D M,WU M R,XIE S Y,et al.Determination of tartrazine,lutein,capsanthin,canthaxanthin and β-carotene in animal-derived foods and feeds by HPLC method[J].Journal of Chromatographic Science,2019,57(5): 462-468.
[4] 江生,敖菊梅,潘正,等.高效液相色谱法同时快速测定饮料中的12 种食品添加剂[J].分析试验室,2017,36(6):729-731.
JIANG S,AO J M,PAN Z,et al.Simultaneous and rapid determination of 12 kinds of food additives in drinks by HPLC[J].Chinese Journal of Analysis Laboratory,2017,36(6):729-731.
[5] 粟有志,刘俊,李艳美,等.固相萃取—高效液相色谱—串联质谱法测定枸杞中9种红色合成色素[J].分析科学学报,2016,32(6):846-850.
SU Y Z,LIU J,LI Y M,et al.Determination of 9 red syntheticpigmentsin Chinese wolfberry by solid—phase extraction—high performance liquid chromatography—tandem mass spectrometry[J].Journal of Analytical Science,2016,32(6):846-850.
[6] 王雪莲,马博雅,王首忠,等.高效液相色谱-串联质谱法同时测定食品中9 种人工色素[J].食品安全质量检测学报,2018,9(1):128-134.
WANG X L,MA B Y,WANG S Z,et al.Simultaneous determination of 9 kinds of synthetic colorants in food by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality,2018,9(1):128-134.
[7] RUBIO L,SANLLORENTE S,SARABIA L A,et al.Determination of cochineal and erythrosine in cherries in syrup in the presence of quenching effect by means of excitation-emission fluorescence data and three-way PARAFAC decomposition[J].Talanta,2019,196:153-162.
[8] YANG X P,LUO N,TAN Z J,et al.A fluorescence probe for tartrazine detection in foodstuff samples based on fluorescence resonance energy transfer[J].Food Analytical Methods,2017,10(5):1 308-1 316.
[9] 杨彩玲,赵国虎,张鸣,等.氮掺杂碳量子点荧光猝灭法测定柠檬黄[J].化学研究与应用,2019,31(7):1 293-1 298.
YANG C L,ZHAO G H,ZHANG M,et al.Determination of tartrazine based on fluorescent quenching of nitrogen doped carbon quantum dot[J].Chemical Research and Application,2019,31(7):1 293-1 298.
[10] 孙章华,陈美凤,尹明静,等.聚甘氨酸修饰电极测定食品中的诱惑红[J].食品与发酵工业,2014,40(12):185-189.
SUN Z H,CHEN M F,YIN M J,et al.Poly( glycine) modified electrode for determination of allura red in food[J].Food and Fermentation Industries,2014,40(12):185-189.
[11] TAHTAISLEYEN S,GORDUK O,SAHIN Y.Electrochemical determination of tartrazine using a graphene/poly (L-phenylalanine) modified pencil graphite electrode[J].Analytical Letters,2020,53(11):1 683-1 703.
[12] ARVAND M,ZEINOLABEDINPOUR G.Determination of sunset yellow in foodstuffs by surface modification of nonconductive polyester of polyvinyl alcohol sheet used as overhead projector film[J].Food Analytical Methods,2019,12(8):1 858-1 870.
[13] BORDAGARAY A,DAVILA S,GARCIA-ARRONA R,et al.Simultaneous determination of food colorants in liquid samples by UV-visible spectroscopy and multivariate data analysis using a reduced calibration matrix[J].Journal of Chemometrics,2019,33(10):3 176-3 182.
[14] BISGIN A T.Simultaneous spectrophotometric determination of brilliant blue and tartrazine in diverse sample matrices after solid phase extraction[J].Journal of AOAC International,2020,103(6):1 478-1 485.
[15] 孙延春,敬铭.分光光度法测定饮料中色素含量[J].四川理工学院学报(自然科学版),2012,25(5):25-28.
SUN Y C,JING M.Determination of pigments in beverage by ultraviolet spectrophotometry[J].Journal of Sichuan University of Science & Engineering(Natural Science Edition),2012,25(5):25-28.