1,2,4-丁三醇(1,2,4-butantriol,BT)是三羟基四碳多元醇,易溶于醇类及水,无色无味的油状液体[1]。BT是重要的药物合成中间体,可用于合成肿瘤和皮肤病药物等;也可用于减少烟草中的有害物质[2]。BT的三硝酸酯(1,2,4-butanetriol trinitrate,BTTN)是重要的增塑剂,具有比硝化甘油更好的热稳定性、可塑性和低敏感性,是导弹等军事武器的重要推进器成分等[3]。
近年来,在大肠杆菌(Escherichia coli)中以木糖为底物开展了大量BT生物合成途径研究。BT的生物合成最后一步需要NAD(P)H参与醇脱氢[3-4],同时,葡萄糖和木糖2种底物的转运需要消耗ATP[5],这两者可以通过TCA循环获得,但是代谢会产生低级酸等副产物[6],即代谢溢流效应。乙酸会影响细菌胞内pH值、渗透压和氨基酸的合成[7],从而降低生物量、ATP和还原力,同时外源基因表达受到严重影响[8]。而且乙酸通过乙酰辅酶A合成酶途径(ACS,由acs基因编码)转化为乙酰辅酶A时会消耗大量ATP[9]。
目前,BT的代谢合成研究主要集中在弱化BT途径直接副产物合成[4]、高活性脱羧酶筛选[10]以及建立无细胞体系[11-12]等,本论文敲除宿主细胞E.coli的乙酸合成关键基因磷酸转乙酰化酶(pta)和丙酮酸氧化酶(poxB)弱化大肠杆菌乙酸途径,减少乙酸溢流,增加丙酮酸和乙酰辅酶A节点流向草酰乙酸等下游路径的碳流方法,探索提高1,2,4-丁三醇产量,获得了较好的结果,为以E.coli为底盘细胞的类似化合物的合成生物学改造提供借鉴。
1 材料与方法
1.1 试剂与仪器
卡那霉素、壮观霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、阿拉伯糖,生工生物工程(上海)股份有限公司;蛋白胨、酵母提取物,英国Oxoid公司;DNA凝胶回收试剂盒、质粒提取试剂盒,上海康朗生物科技有限公司;高保真酶、限制性内切酶,大连宝生物工程有限公司(TaKaRa);一步法克隆试剂盒,南京诺唯赞生物科技有限公司;1,2,4-丁三醇,上海阿拉丁化学试剂有限公司;其他试剂均为国产分析纯。
PCR仪、电转仪,Eppendorf公司;液相色谱柱:Aminex HPX-87H column(300 mm×7.8 mm;9 μm),Bio-Rad公司;BIO-TECH 5L 发酵罐,上海保兴生物设备工程有限公司;引物由上海亦欣生物科技有限公司合成。
1.2 菌株与质粒
本研究使用的菌株和质粒参见表1。
表1 本研究使用的菌株和质粒
Table 1 Strains and plasmids used in this study
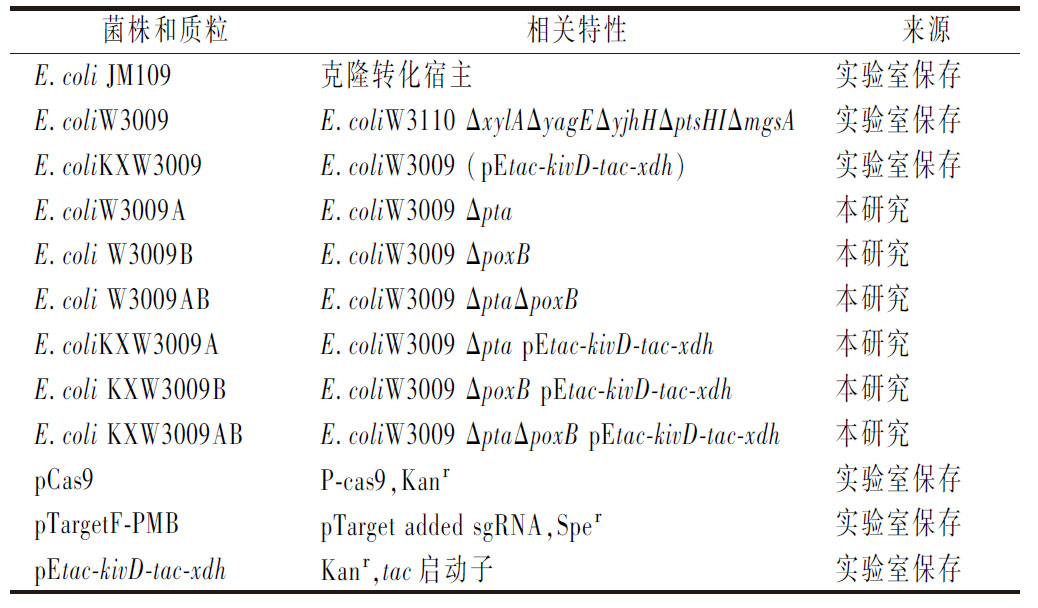
菌株和质粒相关特性来源E.coli JM109克隆转化宿主实验室保存E.coliW3009E.coliW3110 ΔxylAΔyagEΔyjhHΔptsHIΔmgsA实验室保存E.coliKXW3009E.coliW3009 (pEtac-kivD-tac-xdh)实验室保存E.coliW3009AE.coliW3009 Δpta本研究E.coli W3009BE.coliW3009 ΔpoxB 本研究E.coli W3009ABE.coliW3009 ΔptaΔpoxB本研究E.coliKXW3009AE.coliW3009 Δpta pEtac-kivD-tac-xdh本研究E.coli KXW3009BE.coliW3009 ΔpoxB pEtac-kivD-tac-xdh本研究E.coli KXW3009ABE.coliW3009 ΔptaΔpoxB pEtac-kivD-tac-xdh本研究pCas9P-cas9,Kanr实验室保存pTargetF-PMBpTarget added sgRNA,Sper实验室保存pEtac-kivD-tac-xdhKanr,tac启动子实验室保存
1.3 引物
本研究使用的引物参见表2。
表2 本研究使用引物
Table 2 Primers used in this study

引物名称引物序列(5'→3')PTA-F1ACCGAAGTGACCAGCGACTGPTA-R1cggatgatgacgagaGGTTTATCCTCTTTCGTTACCGCPTA-F2aaaccTCTCGTCATCATCCGCAGCTPTA-R2GGTGATACTCAGGTTCGCCTGCSg-PTA-FATCCGTGCAATGGAACGCAAggttttagagctagaaatagcaagttSg-PTA-RTTGCGTTCCATTGCACGGATactagtattatacctaggactgagcPoxB-F1CCCAGTAGCAGAAGCGGCGAPoxB-R1GGTTCTCCATCTCCTGAATGTGATAACGPoxB-F2CGTTATCACATTCAGGAGATGGAGAACCAAAGGGTGGCATTTCCCGTCATAATAAGPoxB-R2GCAGCCGCGTCTATGGGTTGSg-PoxB-FCCAAAACACTCGAATCGGCAggttttagagctagaaatagcaagttSg-PoxB-RTGCCGATTCGAGTGTTTTGGactagtattatacctaggactgagcPTA-F-1TGTCCCGTATTATTATGCTGATCCPTA-R-1TACTGCTGCTGTGCAGACTGPoxB-F-1TGAAACAAACGGTTGCAGCPoxB-R-1TACCTTAGCCAGTTTGTTTTCG
注:小写序列表示靶基因的同源臂序列,F表示正向引物,R表示反向引物
1.4 培养基与培养方法
种子培养基(LB培养基)(g/L):NaCl 10.0,蛋白胨10.0,酵母提取物5.0。
发酵培养基(g/L):NaCl 15.0,蛋白胨15.0,酵母提取物7.5,CaCO3 10.0,木糖30.0,葡萄糖10.0。
5L发酵罐培养基(g/L):NaCl 15.0,蛋白胨15.0,酵母提取物7.5,葡萄糖、木糖浓度参照以下各图图例。
种子培养:1%接种量(体积比),37 ℃、150 r/min培养12 h。
发酵培养:250 mL三角瓶中装液量为50 mL,1%接种量(体积比)。37 ℃、200 r/min培养至OD600 nm为0.6~0.8时,加入终浓度为0.5 mmol/L IPTG进行诱导,同时加入木糖、葡萄糖,继续培养至48 h。所有发酵设置3个平行实验。
上罐发酵培养:5 L发酵罐装液量为2.5 L。接种量为10%(体积比),培养温度维持在37 ℃,转速为400 r/min,通气量 1.5 vvm,pH控制在7.0。所有发酵设置3个平行实验。
1.5 敲除菌株构建
根据参考文献[14]中的CRISPR/Cas9技术对E.coli W3009进行基因敲除。在NCBI上查找E.coli W3110中pta和poxB基因序列设计引物(表2),分别构建含有sgRNA的pTargetF-PMB[15](引物为Sg-PTA-F/Sg-PTA-R,Sg-PoxB-F/Sg-PoxB-R)和目的基因上、下游各500 bp的融合片段[14](引物为PTA-F1/PTA-R1,PTA-F2/PTA-R2;PoxB-F1/PoxB-R1,PoxB-F2/PoxB-R2)。将pCas9质粒电转入E.coli W3009中。加入终浓度为50 mmol/L的阿拉伯糖诱导pCas9质粒的表达,将pTargetF-PMB和融合的片段电转入含有质粒pCas9的E.coli W3009,涂布含有50 mg/L Kan 和100 mg/L Spe抗性的LB平板,30 ℃过夜培养,然后通过菌落PCR(引物PTA-F-1/PTA-R-1,PoxB-F-1/PoxB-R-1)筛选阳性转化子。敲除成功的菌株在对数生长期时加入终浓度为0.5 mmol/L IPTG诱导消除pTargetF-pMB质粒;42 ℃连续传代消除pCas9质粒,最终获得不带抗性的敲除菌株。
1.6 检测方法
发酵液中葡萄糖、木糖、BT和乙酸等代谢产物用HPLC示差法检测,木糖酸在紫外下检测。流动相为5.0 mmol/L的H2SO4,流速为0.6 mL/min,色谱柱为Aminex HPX-87H,柱温60 ℃,使用示差和紫外检测器进行检测,进样量为10 μL。OD600 nm利用分光光度计测定发酵液在600 nm下的吸光度。
2 结果与分析
2.1 弱化乙酸途径对底盘细胞生长的影响
如图1所示,敲除poxB基因,OD600 nm值达到13.8,提高了26.6%。其原因是弱化了丙酮酸流向乙酸的碳流,促进TCA循环[16],为细胞生长提供更多能量。相反,敲除pta菌株的生物量有明显降低,由于该途径与ATP合成相关[17],最终导致细胞内能量失衡,不利于菌体生长。在此基础上利用改造后的宿主研究对BT合成的影响。
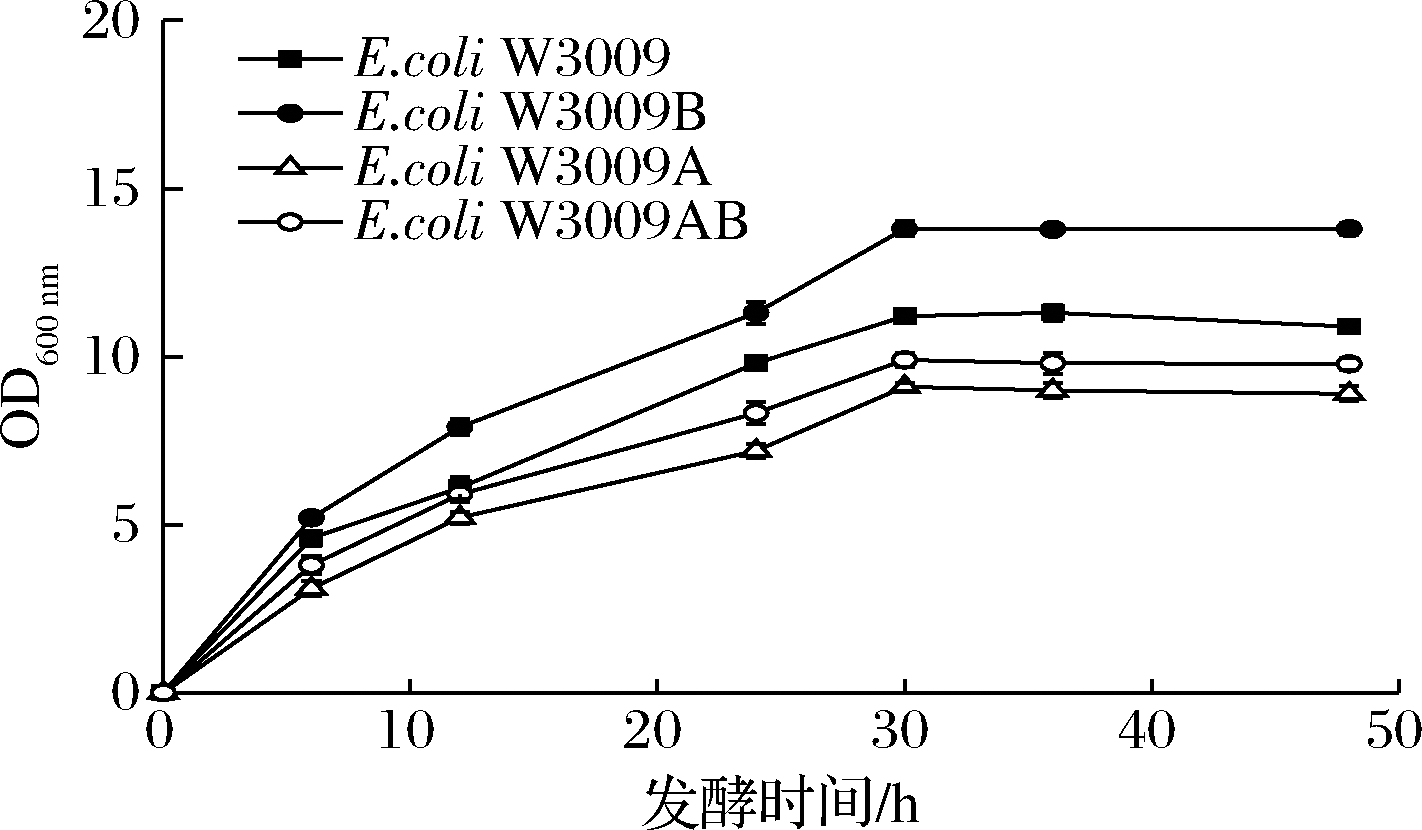
图1 弱化乙酸途径对底盘细胞生物量的影响
Fig.1 Influence of the weakened acetate pathway on biomass
2.2 以poxB基因缺失株为宿主的1,2,4-丁三醇合成
丙酮酸通过poxB基因编码的丙酮酸氧化酶催化合成乙酸[16]。与对照菌株E.coli KXW3009相比,敲除poxB可以弱化乙酸,减少丙酮酸消耗增加流向TCA循环的碳流,提高胞内ATP和还原力[18]。如图2-a和图2-b所示,poxB的缺失使乙酸最高积累量减少了37.9%,生物量提高了13.3%,且葡萄糖完全消耗,说明敲除poxB可以增强葡萄糖消耗,对生物量有明显的正调控。其原因可能是增加了流向TCA循环的碳流,促进了细胞代谢,减少了乙酸对细胞的毒害作用。另外,单敲poxB与对照菌E.coli KXW3009相比,残留木糖减少了约85%,但木糖摩尔转化率从0.75 mol/mol降低到0.67 mol/mol,木糖酸含量从6.3 g/L增加到6.8 g/L,提高了7.9%,其原因可能是该策略为木糖转运提供了更多能量,木糖消耗的增加促进了中间代谢产物的积累。单敲poxB菌株BT产量由9.5 g/L提高到13.1 g/L,单位菌体产量增加了23.3%(图2-a、图2-b)。上述结果表明,敲除poxB减少乙酸合成的同时促进了细胞生长、葡萄糖和木糖消耗,增强了BT合成能力,但是降低了木糖转摩尔化率。
2.3 以pta基因缺失株为宿主的1,2,4-丁三醇合成
pta基因编码的磷酸转乙酰酶催化乙酰辅酶A转化为乙酸[16]。与对照菌株E.coli KXW3009相比,敲除pta可以弱化乙酸途径,减少乙酰辅酶A节点处碳流流向乙酸[18]。如图2-a和图2-c所示,pta缺失使乙酸最高积累量减少了84.5%。生物量降低了21.9%,葡萄糖和木糖残留增加了72.7%和35.3%,说明pta缺失不利于菌体生长。其原因可能是由于乙酰辅酶A和丙酮酸通量不平衡[18],而反过来又会影响底物的消耗,同时Pta-AckA途径是ATP合成的重要方式[14]。BT产量下降了24%,但是单位菌体产量和木糖转化率提高了6.7%,木糖摩尔转化率达到0.8 mol/mol,木糖酸含量降低了44%,说明菌体量的降低导致BT终产量的降低,但是增强了BT合成途径,降低了中间代谢产物的积累。
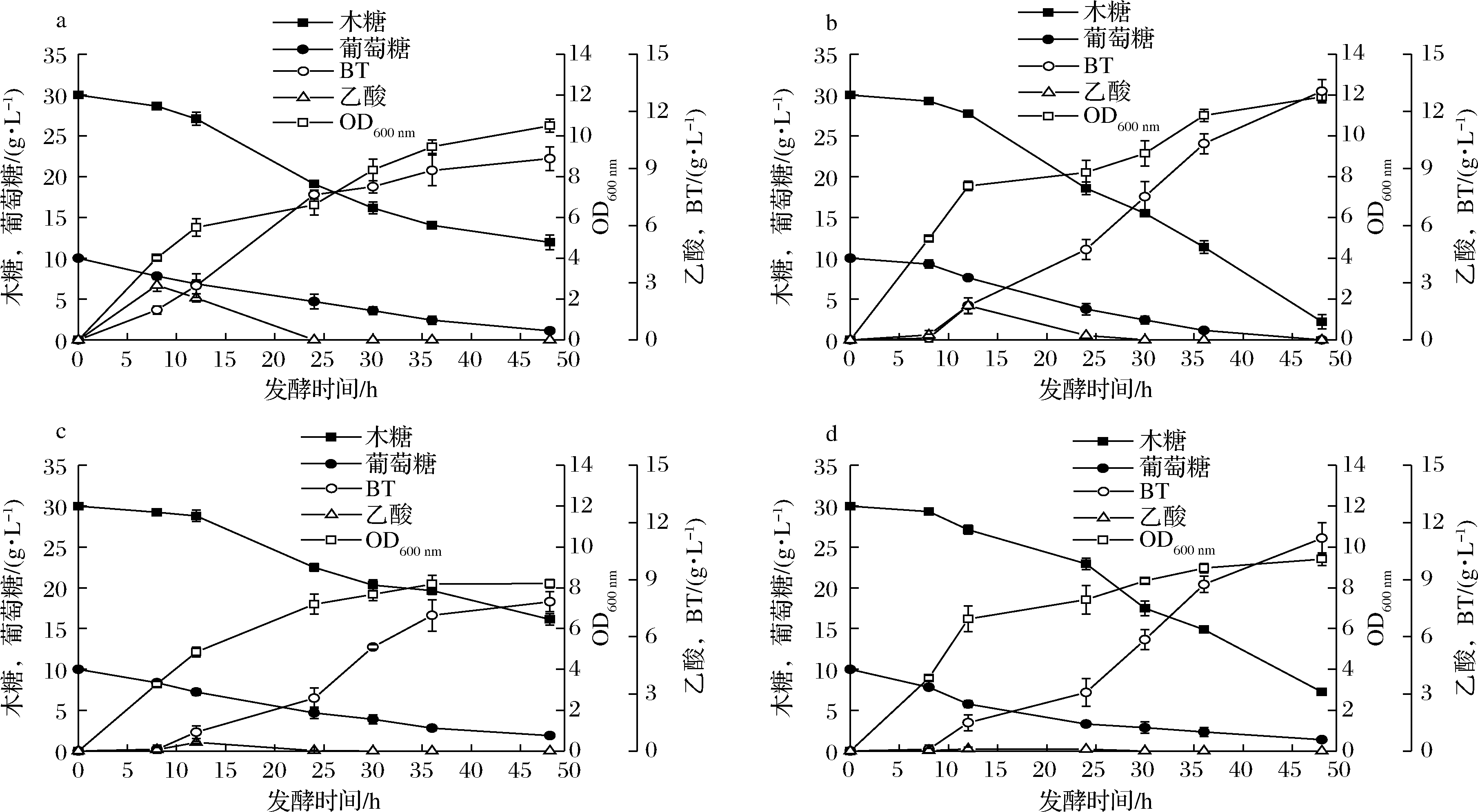
a-E.coli KXW3009;b-E.coli KXW3009B;c-E.coli KXW3009A;d-E.coli KXW3009AB
图2 摇瓶发酵代谢产物产量
Fig.2 Metabolite production during shake flask fermentation
2.4 以共敲除pta和poxB基因缺失株为宿主的1,2,4-丁三醇合成
结合以上两种策略,在E.coli W3009中双敲pta和poxB基因,以期进一步弱化乙酸,双敲菌株积累的乙酸与单敲poxB和单敲pta相比分别降低了93.9%和75.5%,与对照菌株E.coli KXW3009相比降低了96.1%(图2)。与对照相比,生物量降低了10.5%,说明共敲除pta和poxB对生物量有负调控,此结果与单敲pta类似。但是BT终产量和单位菌体产量分别提高了18.9%和30%,BT达到11.2 g/L,说明双敲菌株可以进一步提高胞内还原力,强化BT合成途径。
2.5 不同敲除菌株发酵比较及葡萄糖优化
由表3可知,除单敲poxB外,敲除菌株生物量均低于对照菌株,而在pta缺失菌株中敲除poxB可以缓解菌株的生长缺陷,说明敲除poxB对生物量是正向调控的,可能是减少了丙酮酸的消耗,促进了TCA循环。单敲pta菌株的葡萄糖和木糖利用率以及单位菌体木糖消耗是最低的但是摩尔转化率最高,说明敲除pta虽然会降低生物量和底物摄取,但是强化了BT合成途径,提高了木糖摩尔转化率。
表3 不同菌株发酵参数
Table 3 Comparison of parameters of strains

菌株OD600 nmBT/(g·L-1)木糖利用率/(g·L-1)葡萄糖利用率/(g·L-1)木糖摩尔转化率/(mol·mol-1)单位菌体木糖消耗/(g·g-1)BT单位菌体产量/(g·g-1)E.coliKXW300910.5±0.319.5±0.620.60±0.020.89±0.030.75±0.025.7±0.123.0±0.19E.coliKXW3009B11.9±0.2113.1±0.560.93±0.031.0±0.020.67±0.017.7±0.133.7±0.16E.coli KXW3009A8.2±0.217.8±0.520.46±0.010.81±0.010.80±0.025.6±0.293.2±0.23E.coliKXW3009AB9.4±0.3011.2±0.720.76±0.030.86±0.020.70±0.038.1±0.183.9±0.26
有研究表明,共敲除pta和poxB能够进一步提高乙酰辅酶A含量[19],而胞内NAD(P)H水平直接影响BT的合成[20]。如表3所示,双敲菌株BT单位菌体产量均高于单敲poxB和pta以及对照菌株E.coli KXW3009,分别提高了5.4%、21.8%、30%,单位菌体木糖消耗量分别提高了5.2%、44.6%、42.1%,表明进一步弱化乙酸可以增加胞内还原力,提高木糖利用能力,强化BT的合成。但过度抑制乙酸途径反而会影响菌体生长,导致双敲菌株BT终产量低于单敲poxB菌株,所以选择E.coli KXW3009B为后续研究对象。
由于弱化乙酸途径较大地影响到葡萄糖代谢能力,所以对培养基中葡萄糖添加量进行优化。如图3-a和图3-b所示,随着葡萄糖初始质量浓度的增加,改造菌株葡萄糖消耗也增加,同时菌株的OD600 nm也随着增加,但是当葡萄糖初始浓度达到15 g/L时,生物量开始下降。另外,除了葡萄糖初始浓度为10 g/L时,其他葡萄糖优化条件下木糖残留均增加(图3-c)。
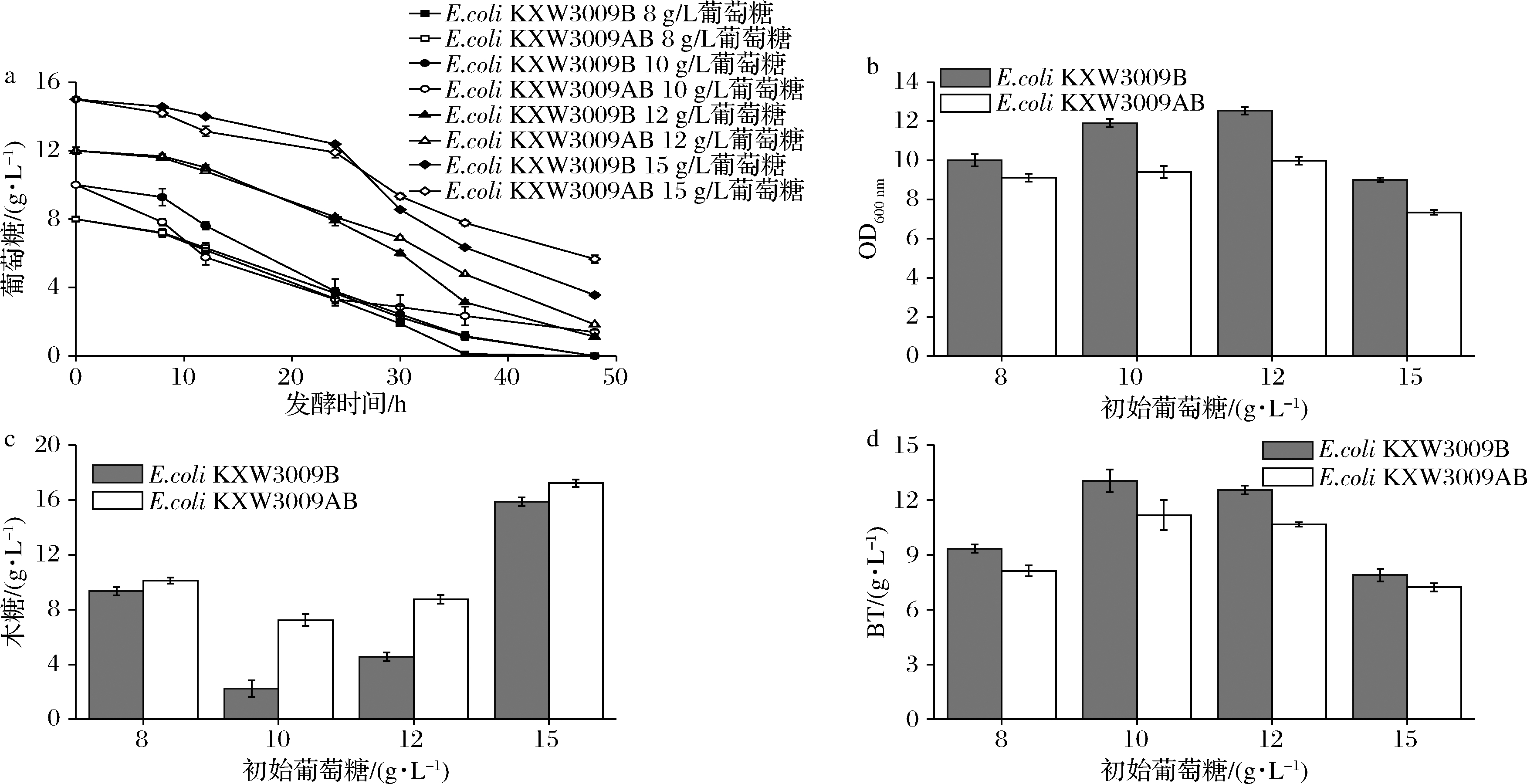
a-葡萄糖消耗;b-OD600 nm;c-木糖残留;d-BT产量
图3 葡萄糖优化摇瓶发酵代谢产物产量
Fig.3 Glucose optimized shake flask fermentation metabolite yield
其原因可能是当葡萄糖初始质量浓度<10 g/L时菌株生物量降低,减少了木糖消耗。而当葡萄糖初始>10 g/L时,较高浓度的葡萄糖限制了木糖的消耗[3],进而导致BT产量的降低。最终单敲poxB和双敲菌株均在葡萄糖初始浓度达到10 g/L时BT产量达到最高,分别为13.1和11.2 g/L(图3-d)。
2.6 5 L发酵罐分批补料发酵
对菌株E.coli KXW3009B、E.coli KXW3009AB以及对照菌株E.coli KXW3009进行分批补料发酵。与对照菌株相比,E.coli KXW3009B和E.coli KXW3009AB中乙酸积累分别减少了34%和75%(图4-a、图4-b和图4-c)。此外,最终E.coli KXW3009B的生物量提高了14.2%,而E.coli KXW3009AB生物量降低了15%,表明适度弱化乙酸途径可以增加TCA循环的碳通量,为细胞生长提供了更多的碳源和能量,而过度弱化乙酸途径会影响细胞生长。

a-E.coli KXW3009;b-E.coli KXW3009B;c-E.coli KXW3009AB
图4 5 L发酵罐发酵过程中敲除菌株的代谢产物产量
Fig.4 Metabolite yield of knockout strains during fermentation in 5 L fermenters
目前有研究通过对大肠杆菌中PTS系统进行改造,发酵罐产量达到7.5 g/L[21]。通过在大肠杆菌中敲除基因mtfA,实现木糖和葡萄糖共利用,最终重组菌中BT产量和摩尔转化率分别为7.2 g/L和0.55 mol/mol[20]。利用PyjhI驱动的遗传开关合成BT,BT产量仅有1.3 g/L[22]。本论文通过弱化乙酸途径可以减少碳源浪费和对细胞的毒害作用[7],提高木糖消耗,促进BT的合成,最终在5 L发酵罐分批补料发酵中E.coli KXW3009B和E.coli KXW3009AB的BT产量分别达到16.1和15.4 g/L,摩尔转化率分别达到0.69 mol/mol和0.72 mol/mol。所以选择E.coli KXW3009B为后续研究对象。
3 结论
本研究在E.coli W3009中敲除丙酮酸氧化酶poxB和磷酸转乙酰酶pta减少了乙酸的合成,强化了TCA循环,并考察了细胞生长和BT合成。通过弱化乙酸考察对细胞生长的影响,只有单敲poxB才能促进细胞生长。在弱化乙酸E.coli基础上考察对BT合成的影响,单敲或双敲均可以提高BT单位菌体产量,并且双敲高于单敲,说明弱化乙酸途径强化了BT合成。敲除pta降低了80%以上的乙酸,但是影响了细胞生长,降低了木糖和葡萄糖的消耗以及BT终产量。而对生物量有促进作用的单敲poxB菌株,BT最终产量达到13.1 g/L,摩尔转化率为0.67 mol/mol。对敲除poxB的菌株进行5 L发酵罐分批补料发酵,产量达到16.1 g/L,摩尔转化率达到0.69 mol/mol。综上,适宜的乙酸途径弱化策略可以强化TCA循环,葡萄糖消耗增加可以为BT合成提供更多NAD(P)H,但是过度抑制乙酸途径反而会影响菌体生长,为今后进一步代谢改造E.coli提高BT的产量提供了理论基础和研究思路,并为以E.coli为底盘细胞的合成类似化合物的合成生物学改造提供借鉴。
[1] 何姝颖,诸葛斌,陆信曜,等.副产物途径的缺失对大肠杆菌合成D-1,2,4-丁三醇的影响[J].微生物学通报,2017,44(1):30-37.
HE S Y,ZHUGE B,LU X Y,et al.Influence of the deficiency of by-product pathways on biosynthesis of D-1,2,4-butanetriol in Escherichia coli[J].Microbiology China,2017,44(1):30-37.
[2] BORSUK K,FRELEK J,LYSEK R,et al.Six-membered cyclic sulfites derived from glucofuranose and 1,2,4-butanetriol[J].Chirality,2001,13(9):533-540.
[3] 景培源. 多策略强化1,2,4-丁三醇的生物合成[D].无锡:江南大学,2018.
JING P Y.Enhanced 1,2,4-butanetriol bioproduction by multistrategy[D].Wuxi:Jiangnan University,2018.
[4] VALDEHUESA K N G,LIU H W,RAMOS K R M,et al.Direct bioconversion of D-xylose to 1,2,4-butanetriol in an engineered Escherichia coli[J].Process Biochemistry,2014,49(1):25-32.
[5] HARA K Y,KONDO A.ATP regulation in bioproduction[J].Microbial Cell Factories,2015,14:198
[6] VALGEPEA K,ADAMBERG K,NAHKU R,et al.Systems biology approach reveals that overflow metabolism of acetate in Escherichia coli is triggered by carbon catabolite repression of acetyl-CoA synthetase[J].BMC Systems Biology,2010,4:166.
[7] 谢梦梦,胡会涛,陆信曜,等.强化乙醛酸和TCA循环对克雷伯氏菌合成1,3-丙二醇的影响[J].食品与发酵工业,2020,46(19):17-22.
XIE M M,HU H T,LU X Y,et al.Strengthening glyoxylate bypass and the TCA cycle improved 1,3-propanediol production in Klebsiella pneumoniae[J].Food and Fermentation Industries,2020,46(19):17-22.
[8] FARMER W R,LIAO J C.Reduction of aerobic acetate production by Escherichia coli[J].Applied and Environmental Microbiology,1997,63(8):3 205-3 210.
[9] LIN J,ZHANG Y Q,XU D F,et al.Deletion of poxB,pta,and ackA improves 1,3-propanediol production by Klebsiella pneumoniae[J].Applied Microbiology and Biotechnology,2016,100(6):2 775-2 784.
[10] JING P Y,CAO X,LU X Y,et al.Modification of an engineered Escherichia coli by a combined strategy of deleting branch pathway,fine-tuning xylose isomerase expression,and substituting decarboxylase to improve 1,2,4-butanetriol production[J].Journal of Bioscience and Bioengineering,2018,126(5):547-552.
[11] WANG X,XU N N,HU S W,et al.D-1,2,4-Butanetriol production from renewable biomass with optimization of synthetic pathway in engineered Escherichia coli[J].Bioresource Technology,2018,250:406-412.
[12] GAO Q,WANG X,HU S W,et al.High-yield production of D-1,2,4-butanetriol from lignocellulose-derived xylose by using a synthetic enzyme cascade in a cell-free system[J].Journal of Biotechnology,2019,292:76-83.
[13] ASHOK S,RAJ S M,RATHNASINGH C,et al.Development of recombinant Klebsiella pneumoniae ΔdhaT strain for the co-production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol[J].Applied Microbiology and Biotechnology,2011,90(4):1 253-1 265.
[14] 李玉石,刘郁青,杨程雨,等.代谢改造克雷伯氏菌合成D-1,2,4-丁三醇[J].微生物学通报,2020,47(8):2 505-2 515.
LI Y S,LIU Y Q,YANG C Y,et al.Production of D-1,2,4-butanetriol by engineering Klebsiella pneumoniae[J].Microbiology China,2020,47(8):2 505-2 515.
[15] 祖金珊,徐世文,陆信曜,等.整合型1,2,4-丁三醇重组菌的构建及共底物发酵[J].应用与环境生物学报,2019,25(4):966-971.
ZU J S,XU S W,LU X Y,et al.Construction of a 1,2,4-butanetriol-integrated strain and fermentation of its co-substrate[J].Chinese Journal of Applied & Environmental Biology,2019,25(4):966-971.
[16] HOLMS W H.The central metabolic pathways of Escherichia coli relationship between flux and control at a branch point,efficiency of conversion to biomass,and excretion of acetate[J].Current Topics in Cellular Regulation,1986,28:69-105.
[17] WANG Q,ZHANG Z,ZHU Y,et al.Impact of poxB,pta,and ackA genes on mineral-weathering of Enterobacter cloacae S71[J].Journal of Basic Microbiology,2018,58(7):633-642.
[18] CHANG D E,SHIN S,RHEE J S,et al.Acetate metabolism in a pta mutant of Escherichia coli W3110:Importance of maintaining acetyl coenzyme A flux for growth and survival[J].Journal of Bacteriology,1999,181(21):6 656-6 663.
[19] KANG Z,GAO C,WANG Q,et al.A novel strategy for succinate and polyhydroxybutyrate co-production in Escherichia coli[J].Bioresource Technology,2010,101(19):7 675-7 678.
[20] 王金保. 重组大肠杆菌生物合成D-1,2,4-丁三醇的系统优化[D].北京:北京理工大学,2016.
WANG J B.Systematic optimization of synthetic pathways for D-1,2,4-butanetriol production by recombinant E.coli[D].Beijing:Beijing Institute of Technology,2016.
[21] 马鹏飞. 重组大肠杆菌合成D-1,2,4-丁三醇代谢系统的理性改造[D].北京:北京理工大学,2015.
MA P F.Rational modification of metabolic system for D-1,2,4-butanetriol production by recombinant Escherichia coli[D].Beijing:Beijing Institute of Technology,2015.
[22] BA ARES A B,VALDEHUESA K N G,RAMOS K R M,et al.Discovering a novel D-xylonate-responsive promoter:The PyjhI-driven genetic switch towards better 1,2,4-butanetriol production[J].Applied Microbiology and Biotechnology.2019,103(19):8 063-8 074.
ARES A B,VALDEHUESA K N G,RAMOS K R M,et al.Discovering a novel D-xylonate-responsive promoter:The PyjhI-driven genetic switch towards better 1,2,4-butanetriol production[J].Applied Microbiology and Biotechnology.2019,103(19):8 063-8 074.