肌原纤维蛋白(myofibrillar protein,MP)又称盐溶性蛋白,是由肌球蛋白、肌动蛋白、肌动球蛋白、肌钙蛋白以及原肌球蛋白等组成的复合物,是肌肉中含量最高的蛋白质,约占肉蛋白总含量的55%~60%,其中肌球蛋白约占35%[1]。MP的空间结构和功能特性对肌肉品质至关重要,直接影响到肉制品的弹性、多汁性及口感等各种感官性质。比如,MP具有两亲性,既能与水又能与脂肪结合,可形成包裹脂肪微粒和油滴的蛋白膜,从而达到分散和稳定脂肪的作用[1],以维持肉制品的质地,这在肉糜加工中十分重要;另外,MP具有优良的凝胶特性,即在热诱导作用下先展开、后逐步发生交联聚集,最后形成连续的三维网状凝胶结构[2],从而赋予肉制品较好的质构特性和感官品质。然而,MP在加工储藏过程中常发生过度氧化,结构和功能特性被破坏,导致肉制品色泽变差,风味劣变,嫩度、保油保水性以及营养品质下降等,大大缩短产品的货架期。因此,如何采取有效方法以减少肉中蛋白质的氧化变性,延缓肉制品品质劣化,是当前研究的热点问题之一。
植物多酚是一种广泛存在于植物体内的多元酚类次生代谢物,主要存在于植物的皮、根、叶、果中,其最高含量可达20%以上[3]。绝大部分的多酚类化合物属于水溶性物质,主要存在于植物细胞的液泡中,其天然存在的形式多与糖类结合形成糖苷。常见多酚种类如表1所示,酚类化合物的结构通式如图1所示。多酚结构复杂,其以苯酚为基本骨架,以苯环的多羟基取代为特征[1],这种独特的化学结构使其具有抗氧化、降血脂、抗肿瘤、抑菌消炎、抗辐射、抗基因突变和预防心血管疾病等功能活性[1,4],近些年来被广泛应用于食品和医药等行业。研究得知,多酚结构中的邻位酚羟基极易被氧化成醌类结构,消耗环境中的氧,同时能有效清除自由基,具有较强的抗氧化能力[1]。因此,多酚可作为优良的天然抗氧化剂添加到肉制品中,与MP结合形成复合物,以改善蛋白质的结构特征和功能特性,并且这种结合能够很好地抑制肉制品中微生物生长和延缓脂肪氧化[5],对于维持肉制品品质具有重要作用。
图1 酚类化合物的结构通式
Fig.1 General structural formula of phenolic compounds
表1 常见多酚种类及其性质
Table 1 Types and properties of common polyphenols

种类名称相对分子质量主要理化性质主要来源 参考文献酚酸类咖啡酸180.15微溶于冷水,易溶于热水和冷乙醇;对pH敏感;抑菌、抗病毒活性等咖啡、葡萄酒等[3,5]绿原酸354.31极易溶于热水,易溶于乙醇和丙酮,微溶于醋酸乙酯;对温度、pH和光敏感;抗菌、抗病毒、抗氧化活性等杜仲、金银花、土豆等[3-4]阿魏酸194.19可溶于热水,微溶于冷水,在水溶液中稳定性较差,易溶于甲醇、乙醇、丙酮;对光敏感;抗氧化、抗血栓、抗菌活性等阿魏、当归、米糠等[5]没食子酸170.12溶于热水,难溶于冷水;对pH敏感;抗氧化、抗炎、抗突变活性等五倍子、蓝莓、苹果等[3,6]迷迭香酸360.31溶于水,稳定性较好;对光敏感;抗氧化、抗菌、抗炎活性等迷迭香、鼠尾草等[7]类黄酮类槲皮素302.00几乎不溶于水,溶于冰醋酸;对pH和光敏感;抗氧化、抗肿瘤、抗炎活性等洋葱、葡萄、苦荞麦等[3,5]芦丁610.51能溶于吡啶、甲酰和碱液,微溶于乙醇、丙酮和乙酸乙酯;对pH和光敏感;抗氧化、抗炎活性和维生素P样作用等葡萄、苦荞麦、番茄等[5,8]儿茶素290.27溶于热水、乙醇、乙酸和丙酮,微溶于冷水和乙醚;对pH和光敏感;抗氧化、抗菌活性等绿茶、荞麦等[3,5]表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)458.40微溶于水,易溶于乙醇;对pH和光敏感;抗氧化、抗肿瘤、抑菌活性等绿茶等[3,9]花青素易溶于水、甲醇、乙醇、稀碱和稀酸等;对温度和光敏感;抗氧化、抗突变活性等葡萄、茄子、樱桃等[4]单宁原花青素468.42溶于水和大多有机溶剂;对光敏感;抗氧化活性和金属螯合剂作用等葡萄、蓝莓、石榴等[4]木酚素类亚麻木酚素686.28易溶于甲醇、乙醇、二甲基亚砜等;对温度和pH敏感;抗氧化、抗肿瘤、抗癌活性等亚麻籽、芝麻等[5]芪类白藜芦醇228.25难溶于水,溶于乙醚、氯仿、甲醇、乙醇和丙酮等;对温度、pH和光敏感;抗氧化、抗炎、抗癌及心血管保护等作用葡萄、桑葚等[3,5]
1 多酚与MP的相互作用机制
多酚与MP间的相互作用主要分为不可逆的共价相互作用和可逆的非共价相互作用,2种作用可同时发生[9],并且由此获得的抗氧化作用已得到广泛验证[1,10]。
1.1 共价相互作用
多酚与MP的共价相互作用是由共价键作用力形成,通常较强且不可逆。多酚通过酶促氧化或非酶促氧化清除自由基转变成活性较高的亲电子物质——醌类或半醌类物质,其极易与蛋白质某些侧链氨基酸(如半胱氨酸、赖氨酸、色氨酸)的亲核基团发生共价结合[9]。MP的作用位点主要为巯基和氨基,发生加成反应后形成“巯基-醌”、“氨基-醌”加成产物,如图2所示。若这些加合物被进一步氧化为相应的醌类物质,再次与其他分子的侧链亲核基团结合,则可能会引起蛋白交联聚集[1]。
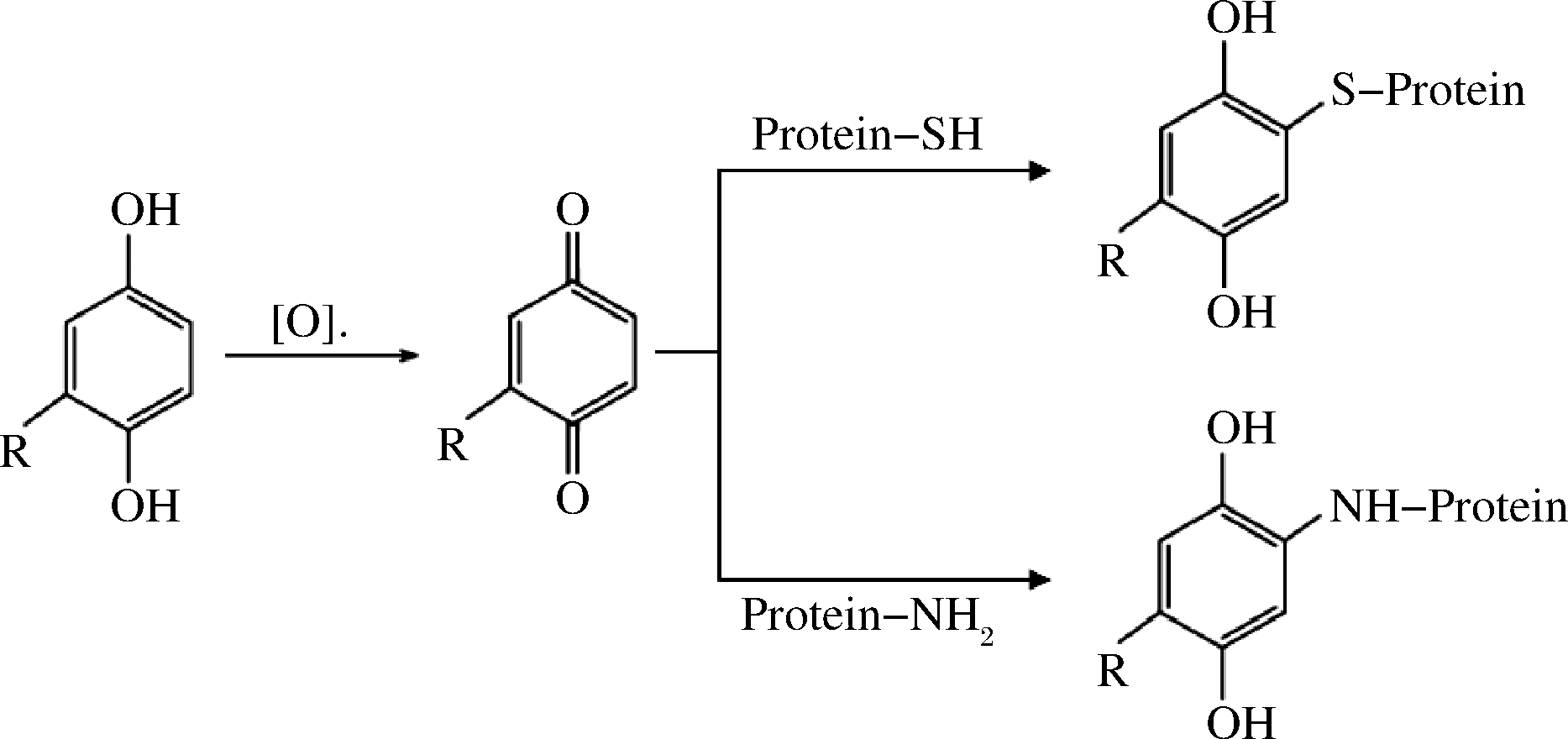
图2 多酚与MP共价相互作用
Fig.2 The covalent interaction between polyphenols and myofibrillar protein
与多酚发生共价结合后,MP的巯基、游离氨基水平明显降低,二级、三级结构也发生一定改变[11]。例如,唐长波[7]研究了迷迭香酸与MP的反应机制,表明多酚氧化后形成活性亲电中间体醌,然后在氨基酸不同加合位点与亲核基团(巯基和胺基)形成加合物,使MP中相应基团含量降低;雷娜[9]研究发现,猪肉MP与EGCG发生共价结合,生成“氨基-醌”和“巯基-醌”,导致相应基团含量显著下降,且随着EGCG剂量升高而更加明显。
1.2 非共价相互作用
多酚与MP的非共价相互作用通常涉及非共价键,多数是可逆的且作用力较弱,包括疏水相互作用、氢键、范德华力和静电相互作用等,如图3所示。其中,疏水相互作用被认为是最主要的驱动力,氢键则起到进一步加强的作用[12]。疏水相互作用主要是由多酚的芳香环和MP的疏水基团(如脯氨酸残基的吡咯环)之间相互靠近而产生的;氢键的存在较为普遍,主要发生在多酚的羟基基团和MP的氢原子受体位点(如主链上的肽基、侧链上的氨基和羧基);范德华力主要是指多酚与MP的极性基团相互靠近,从而产生取向力[13];静电相互作用则主要是由离子间相互吸引或排斥所产生,如多酚带负电的羟基基团和MP带正电的基团(如赖氨酸的ε-氨基基团)相互吸引而形成离子键等。
尽管非共价作用力较弱,但对于多酚与MP的结合仍然具有重要意义。例如,黄渊等[14]研究发现,EGCG、白藜芦醇与鲢鱼肌球蛋白之间发生结合的主要作用力是氢键和范德华力,并且是自发过程;CHENG等[15]研究了5种多酚物质(花青素3-O-葡萄糖苷、花青素3-O-芸香糖苷、咖啡酸、槲皮素、芦丁)对猪肉MP的结构修饰作用发现,5种多酚均使MP固有色氨酸荧光强度产生了不同程度的降低,这表明蛋白质解折叠且多酚与色氨酸残基之间可能发生了非共价相互作用。

图3 多酚与MP非共价相互作用
Fig.3 The non-covalent interaction between polyphenols and myofibrillar protein
2 相互作用对MP性质的影响
随着科技的迅速发展以及人们健康意识的不断提高,多酚等天然抗氧化物质被越来越多地应用于肉及肉制品的生产加工中,以替代某些合成抗氧化剂和抑菌剂,用来延缓蛋白氧化和抑制微生物引起的腐败,其能在适宜条件下与MP发生相互作用形成多酚-蛋白复合物,改善蛋白因氧化造成的结构破坏和功能特性降低,从而减少营养物质的流失并使肌肉保持良好的品质特性,同时还能抑制微生物的生长繁殖,起到良好的抑菌防腐作用[16],进而有效提高肉制品品质并延长货架期。![]() 等[17]向猪肉丸中添加了富含没食子酸、槲皮素、芦丁等酚类成分的荞麦壳提取物,结果表明其显著延缓了蛋白和脂肪氧化,并且改善了肉丸的硬度、弹性和咀嚼性等质构特性,这可能归因于其与MP的相互作用促进了蛋白结构展开和分子间的有序交联,增强了凝胶结构的致密性,并对凝胶强度、硬度和保水性等起到了改善作用。孟彤[18]研究了海带多酚提取物对猪肉乳化肠品质和氧化稳定性的影响,结果表明其能够发挥良好的抗氧化作用,提高乳化肠中脂质和蛋白质的氧化稳定性,同时多酚还能通过与MP的相互作用改善蛋白溶解度和乳化性能,使乳化肠的质构得到改善,并对保持肠的色泽、提高气味和滋味可接受度起到了积极作用。此外,植物多酚还被证明能够抑制生物胺的生成,并可作为硝酸盐替代物添加到香肠、腊肉制品中,对肉制品的色泽和安全起到改善作用[16]。
等[17]向猪肉丸中添加了富含没食子酸、槲皮素、芦丁等酚类成分的荞麦壳提取物,结果表明其显著延缓了蛋白和脂肪氧化,并且改善了肉丸的硬度、弹性和咀嚼性等质构特性,这可能归因于其与MP的相互作用促进了蛋白结构展开和分子间的有序交联,增强了凝胶结构的致密性,并对凝胶强度、硬度和保水性等起到了改善作用。孟彤[18]研究了海带多酚提取物对猪肉乳化肠品质和氧化稳定性的影响,结果表明其能够发挥良好的抗氧化作用,提高乳化肠中脂质和蛋白质的氧化稳定性,同时多酚还能通过与MP的相互作用改善蛋白溶解度和乳化性能,使乳化肠的质构得到改善,并对保持肠的色泽、提高气味和滋味可接受度起到了积极作用。此外,植物多酚还被证明能够抑制生物胺的生成,并可作为硝酸盐替代物添加到香肠、腊肉制品中,对肉制品的色泽和安全起到改善作用[16]。
目前,在肉制品的生产加工应用中,植物多酚主要可作为食品添加剂和动物饲粮的饲料添加剂,既能改善动物肉品质,又能对肉制品的品质特性起到积极作用,但同时其也存在着一定的问题和限制。例如,多酚本身易被氧化而产生自由基和其他具有氧化性的产物,大量累积后可能会起到促氧化作用,这并不是肉制品加工中所期望的;某些多酚的脂溶性较差,见光易分解,在实际应用中存在着溶解度低、活性成分不稳定及功能发挥不理想的问题;另外,目前允许作为添加剂的酚类只有很少数,其他多酚在食品中的适宜添加量和生物毒性还需进一步研究;许多植物提取物本身富含色素和风味,可能影响肉制品的感官性质等。因此,需要进一步探讨多酚的添加及其与MP的相互作用对蛋白结构和功能特性的具体影响,并阐述其对肉品品质的影响机理,以求开发安全高效的多酚添加策略,并进一步形成成熟的品质调控技术,促进多酚在肉及肉制品中的合理高效应用。
2.1 对MP结构的影响
2.1.1 二级结构
MP中α-螺旋结构含量丰富,主要集中在肌球蛋白尾部,通过分子内的羰基氧和氨基氢之间形成的氢键来维持稳定[19]。当MP被氧化后,羰基氧的电子云密度增加,氢键作用力减弱,部分α-螺旋转变成β-折叠和β-转角,而二者都含有较少的分子间氢键,最终导致不稳定的二级结构[20]。贾娜等[21]的研究发现,没食子酸可以显著抑制这种氢键作用力的减弱,从而抑制α-螺旋含量的减少,这表明多酚可以在一定程度上抑制蛋白质的结构破坏,降低蛋白氧化聚合程度。LI等[20]研究发现,添加低浓度的茶多酚可以抑制鱼肉MP中α-螺旋的减少,但当茶多酚浓度升高时,其含有的大量羟基会干扰氢键的稳定性,过量的多酚也可能与MP发生结合,引起蛋白结构的进一步变化,从而导致α-螺旋的减少。另外,CHENG等[15]比较了5种多酚物质对猪肉MP的结构修饰作用,发现咖啡酸显著促进了α-螺旋转变为其他二级结构,而其他多酚化合物则作用相反,这可能是因为咖啡酸与MP的相互作用最强,进而引起了蛋白结构的进一步展开,这也从侧面说明不同结构的多酚与MP的相互作用方式有所差异。事实上,关于多酚对MP二级结构的影响这一问题,许多学者之间的研究成果是存在矛盾的,这可能归因于所使用的蛋白质类型、多酚结构和浓度等存在一定差异。
2.1.2 三级结构
2.1.2.1 表面疏水性
蛋白质的表面疏水性是维持其三级结构的主要作用力,其变化是蛋白质构象变化的综合效应[6]。在氧化过程中,自由基攻击多肽链,蛋白质结构展开,内部疏水基团外露,导致表面疏水性升高。研究表明,添加适量多酚能够降低MP的表面疏水性,这是由于多酚的芳香环与氨基酸疏水性侧链形成复合物,并引入了多酚的亲水基团,阻止了MP内部疏水基团的暴露,从而起到延缓蛋白质氧化变性的作用;但当多酚使用量增加时,蛋白质表面疏水性又可能呈现不同的变化。例如,JIA等[22]的研究发现,与对照相比,含低浓度儿茶素的MP表面疏水性略有降低,但高浓度的儿茶素却促进了MP结构展开及内部疏水性氨基酸暴露,导致较高的表面疏水性。并且,表面疏水性升高表明MP与水之间的相互作用减弱,蛋白质的不稳定性增加,这可能会促进其产生聚集和沉淀[23]。
2.1.2.2 固有色氨酸荧光
蛋白质在折叠状态下,色氨酸残基位于蛋白质核心的疏水环境内,具有高荧光强度且对微环境的变化十分敏感,通常表现为荧光强度或最大发射波长的改变[6],以此反映蛋白质三级结构的变化。氧化促使蛋白质解折叠,色氨酸残基暴露于亲水环境中,其荧光强度明显降低;此外,最大发射波长的蓝移通常表明环境疏水性的增加,红移则表明环境疏水性的减小而极性增加。CAO等[24]研究发现,氧化使猪肉MP解折叠,固有色氨酸荧光强度降低,而绿原酸的添加增强了极性环境并对色氨酸产生屏蔽作用,导致荧光强度进一步降低。同样,DAI等[25]研究发现,在添加了迷迭香酸后,猪肉MP产生了荧光猝灭现象,且最大发射波长轻微红移,这表明多酚的添加对MP三级结构的展开起到了一定的促进作用。
2.1.3 其他结构
蛋白质中羰基和巯基的含量高低常被用于评估蛋白质的氧化修饰程度。通常,含有游离胺的氨基酸残基很容易被氧化脱氨转化成羰基化合物,并进一步发生其他化学反应,引起蛋白不可逆的损伤。研究表明,多酚能够有效阻断这种羰基链式反应,清除·OH,从而显著抑制了MP中羰基的形成[21],但在不同条件下,多酚也可能存在着抗氧化和促氧化的双重作用,过量的多酚甚至可能有助于蛋白质羰基化[20]。另外,蛋白质侧链上的巯基极易被氧化成二硫键,有时还会生成非二硫键的含硫化合物,引起蛋白质间无序的交联聚集并导致总巯基含量降低。研究表明,多酚可以有效抑制巯基的氧化,减缓其含量降低速率[26];但同时,多酚也可能与MP发生“巯基-醌”加成反应,导致巯基减少,以此保护蛋白氧化位点并抑制蛋白质间二硫键的生成[21]。例如,LI等[20]通过研究不同剂量的茶多酚对草鱼MP结构的影响发现,低浓度的茶多酚有效抑制了MP羰基的生成和总巯基含量的降低,表明其具有良好的抗氧化活性,但过量的茶多酚却通过与MP的共价和非共价相互结合起到了促氧化作用,导致了羰基的增多和总巯基的减少。
总的来说,加工储藏过程中的过度氧化会破坏MP的各级结构,导致蛋白质侧链基团修饰、分子间发生交联聚集等,进而对MP的功能性质产生不利影响,导致肉制品感官品质下降和营养成分流失[25]。当前的研究大多采用了Fenton氧化体系产生·OH,来模拟储藏加工中的蛋白氧化系统,且有效表明适量的多酚具有良好的抗氧化能力,可通过相互作用与MP形成复合物,抑制MP因氧化而导致的结构破坏,如阻断羰基化反应、抑制巯基氧化、抑制α-螺旋转变为其他不稳定的二级结构,以及对其三级结构变化也有一定影响,但当多酚种类与浓度等条件改变时,这些影响也可能存在双重作用。而目前,这方面仍存在需要继续探究的问题。例如,不同种类的多酚对MP二级结构的影响存在很大差异,这可能与多酚分子质量或羟基基团数目有着一定的相关性;多酚对MP各侧链基团的修饰有无优先选择性,多酚过量时的促氧化机制以及如何进行调控等,都值得进一步研究和总结。结构决定功能,深入研究多酚改变MP结构的具体机制,进而寻求相应的调控方式,将对改善MP功能特性、提高肉制品品质具有重要意义(表2)。
表2 多酚与MP相互作用对MP结构的影响
Table 2 Effects of interaction between polyphenols and MP on the structure of MP
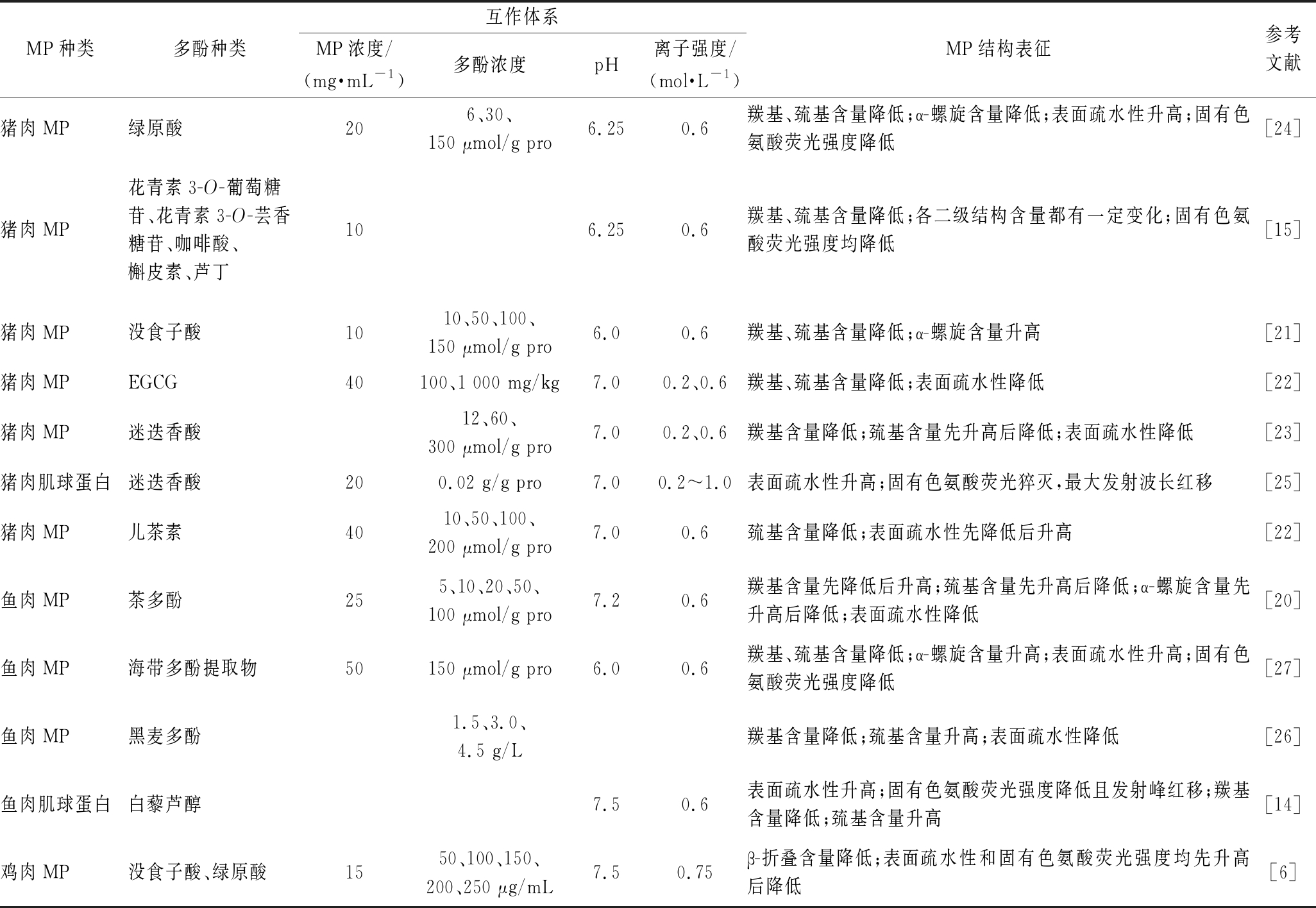
MP种类多酚种类互作体系MP浓度/(mg·mL-1)多酚浓度pH离子强度/(mol·L-1)MP结构表征参考文献猪肉MP绿原酸206、30、150 μmol/g pro6.250.6羰基、巯基含量降低;α-螺旋含量降低;表面疏水性升高;固有色氨酸荧光强度降低[24]猪肉MP花青素3-O-葡萄糖苷、花青素3-O-芸香糖苷、咖啡酸、槲皮素、芦丁106.250.6羰基、巯基含量降低;各二级结构含量都有一定变化;固有色氨酸荧光强度均降低[15]猪肉MP没食子酸1010、50、100、150 μmol/g pro6.00.6羰基、巯基含量降低;α-螺旋含量升高[21]猪肉MPEGCG40100、1 000 mg/kg7.00.2、0.6羰基、巯基含量降低;表面疏水性降低[22]猪肉MP迷迭香酸12、60、300 μmol/g pro7.00.2、0.6羰基含量降低;巯基含量先升高后降低;表面疏水性降低[23]猪肉肌球蛋白迷迭香酸200.02 g/g pro7.00.2~1.0表面疏水性升高;固有色氨酸荧光猝灭,最大发射波长红移[25]猪肉MP儿茶素4010、50、100、200 μmol/g pro7.00.6巯基含量降低;表面疏水性先降低后升高[22]鱼肉MP茶多酚255、10、20、50、100 μmol/g pro7.20.6羰基含量先降低后升高;巯基含量先升高后降低;α-螺旋含量先升高后降低;表面疏水性降低[20]鱼肉MP海带多酚提取物50150 μmol/g pro6.00.6羰基、巯基含量降低;α-螺旋含量升高;表面疏水性升高;固有色氨酸荧光强度降低[27]鱼肉MP黑麦多酚1.5、3.0、4.5 g/L羰基含量降低;巯基含量升高;表面疏水性降低[26]鱼肉肌球蛋白白藜芦醇7.50.6表面疏水性升高;固有色氨酸荧光强度降低且发射峰红移;羰基含量降低;巯基含量升高[14]鸡肉MP没食子酸、绿原酸1550、100、150、200、250 μg/mL7.50.75β-折叠含量降低;表面疏水性和固有色氨酸荧光强度均先升高后降低[6]
2.2 对MP功能特性的影响
2.2.1 溶解度
MP属于盐溶性蛋白质,其溶解度直接影响着乳化性、凝胶性和起泡性等其他功能性质。过度氧化使MP结构展开,内部疏水基团外露,导致亲水基团与水之间的相互作用被减弱,而蛋白分子间疏水相互作用增强,进而易引起蛋白交联聚集[26]。研究表明,添加适量的多酚能够阻碍MP疏水基团外露,同时引入亲水基团,从而提高蛋白质溶解度;但过量的多酚会与MP发生结合,屏蔽蛋白的亲水基团,进而引起蛋白聚集、溶解度下降。例如,WANG等[23]的研究发现,添加低剂量的迷迭香酸能够有效抑制MP的氧化并减缓其溶解度降低速率,但高剂量的迷迭香酸氧化后生成的醌会与MP的活性基团发生加成反应,引起蛋白聚集;贾娜等[21]的研究也表明,没食子酸会与猪肉MP发生交联结合,削弱了MP与水的相互作用并加速蛋白聚集,从而导致MP溶解度降低。
蛋白质的溶解度与其功能特性直接相关,因而在实际生产中提高MP的溶解度是改善肉制品加工特性的重要前提之一。研究表明,多酚对MP溶解度的双重影响一般与多酚浓度有关,对此进行调控可达到改善溶解性的目的。另外,除研究离子强度与多酚共同作用机制外,其他可能用于改善多酚-蛋白复合物溶解度的物理化学方法也值得继续探究,例如超声波的空化作用可减小蛋白粒径[28-29],超高压处理促使蛋白解聚和结构展开[30-31],进而提高其溶解度,某些氨基酸(如赖氨酸、精氨酸)的添加可抑制蛋白聚集,增强蛋白与水的相互作用,从而作为增溶剂以促溶蛋白[32-33]等,并思考多酚在其中发挥的是协同作用还是拮抗作用,这有助于后续研究如何进一步改善MP功能特性。
2.2.2 乳化特性
肉类蛋白质的乳化性能可以反映出蛋白质-蛋白质、蛋白质-脂肪的交联能力,主要包括乳化活性和乳化稳定性[2]。MP是肌肉中参与乳化的主要蛋白质,具有“两亲性”,能吸附在脂肪颗粒表面,形成具有良好黏弹性的界面蛋白膜,以此固定脂肪颗粒并阻止油滴聚合[13],进而形成稳定的乳化物,赋予产品良好的保油保水性和质构特性。但肉制品在加工储藏过程中MP易被过度氧化,造成结构被破坏、乳化性能降低。一般来说,多酚的添加能够有效改善MP的乳化特性,但也按多酚种类和浓度而存在双重作用。添加适量的多酚能够有效抑制MP的氧化变性和溶解度降低,从而改善乳化性能;但多酚过量时可能会引起MP的不良聚集,导致难以形成稳定的界面膜。张典[6]研究发现,在鸡肉MP氧化体系中,加入低浓度没食子酸和绿原酸可显著增强MP的乳化活性和乳化稳定性,但高浓度时多酚结合MP形成少量不溶物,使油滴表面的蛋白膜变薄,甚至可能引起MP聚集,在乳化过程中难以拉伸和包裹油滴表面,导致乳化活性降低。此外,CHENG等[15]比较了花青素3-O-葡萄糖苷、花青素3-O-芸香糖苷、咖啡酸、槲皮素和芦丁对猪肉MP乳化特性的影响,发现咖啡酸显著干扰了乳化过程,而芦丁显著提高了MP的乳化性能,这表明不同种类的多酚与MP的相互作用方式可能有所不同,对其乳化性能的影响也存在明显差异。
对于进一步增强MP的乳化性能而言,多酚-蛋白共价结合物的效果往往优于非共价结合物[34],因此如何调控反应条件使其选择性生成更多稳定的共价结合物,还需进一步探究和明确;其次,MP与多糖的结合可以增强其物理稳定性,因此多糖-多酚-蛋白三元复合物对改善MP乳化特性同样存在显著作用[2],也是当前的研究热点之一;另外,还需进一步研究环境应力对乳液型输送系统性能的影响,例如多酚-蛋白复合物制备乳液的冻融稳定性、盐稳定性及热稳定性[35]等,这对蛋白乳液在加工、存储、运输和应用过程中保持理想的功能性能具有重要意义。
2.2.3 凝胶特性
MP具有良好的凝胶性能,对肉制品的特性起着主要作用。在热诱导凝胶形成过程中,MP变性展开,随后肌球蛋白通过头-头相连、头-尾相连和尾-尾相连的方式发生交联,最终形成致密稳定的三维网络结构,即为凝胶。凝胶的结构和理化特性取决于MP变性展开与交联凝集的相对速率,当展开速率快于凝集速率时,有利于形成致密的凝胶网络,能够防止脂质小球和水滴聚结,并确保脂质和水在连续的蛋白质相中保持良好的分散状态,从而形成稳定的肉糜[13];反之则会促进粗糙且无序的蛋白质网络或凝结物的形成。研究表明,适量的多酚能够作为交联剂,与不同MP分子的亲核基团发生共价结合,从而促进蛋白质间的有序交联,提高凝胶性能;但过量的多酚会导致共价结合过度,破坏蛋白质空间结构,引起其不良聚集并妨碍凝胶形成。SUN等[36]通过研究苹果多酚对鱼肉MP凝胶特性的影响发现,多酚羟基的亲水性能够使多酚-蛋白复合物的水合性增强,进而增加了凝胶结构的致密化,提高了凝胶强度和凝胶硬度、弹性、咀嚼度等质构特性。杨豫菘[2]的研究表明,向羊肉MP中添加茶多酚可以显著提高凝胶保水性、硬度、胶着度,并且由于茶多酚的较多结合位点与MP交联形成胶束,使得凝胶网状结构更加紧密且均匀。另外,CAO等[24]研究发现绿原酸浓度能影响猪肉MP凝胶特性的变化,在低浓度时促进MP 凝胶化,但在高浓度时会破坏MP结构并导致蛋白过度聚集,且过量的多酚覆盖在MP表面,屏蔽了反应性官能团(SH和NH3),阻碍蛋白质间相互作用,显著抑制了凝胶形成。
总体而言,目前对MP凝胶特性的研究已较为广泛,但仍有可以继续钻研的空间。如对于凝胶形成过程中,寻求更佳方式以调控蛋白质结构展开与凝集的相对速率;深入研究参与凝胶化过程的蛋白分子间作用力,探究多酚的加入是否增强或减弱了这些作用力,进而影响了凝胶性能;基于多酚与MP的相互作用,从分子水平调控复合物的生成,从而优化凝胶网络结构,并进一步改善利用MP的凝胶特性制备的可食用可降解薄膜的品质[37-38]等。凝胶特性是MP最重要的功能特性之一,直接影响着肉制品的质构特性和感官性质,因此基于改善凝胶特性的相关研究具有重要的现实意义,需不断进行挖掘与深究(表3)。
3 相互作用的影响因素
多酚与MP之间的相互作用常会受到反应物自身特性和外界条件的影响,如多酚与蛋白质的种类、结构、分子量和摩尔比以及反应温度、pH值、溶剂组成和离子强度等[13]。
表3 多酚与MP相互作用对MP功能特性的影响
Table 3 Effect of interaction between polyphenols and MP on the functional properties of MP
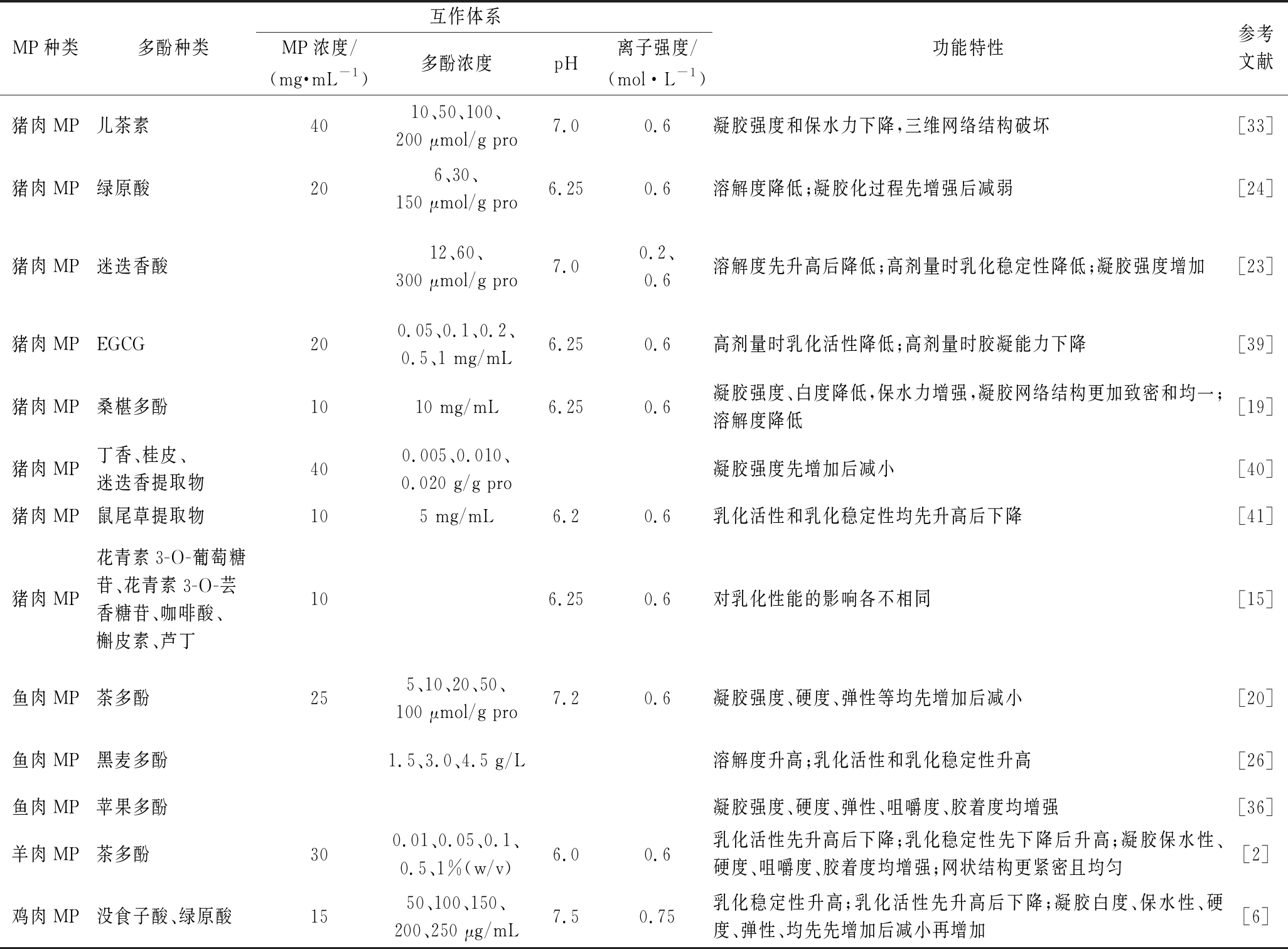
MP种类多酚种类互作体系MP浓度/(mg·mL-1)多酚浓度pH 离子强度/(mol·L-1)功能特性参考文献猪肉MP儿茶素4010、50、100、200 μmol/g pro7.00.6凝胶强度和保水力下降,三维网络结构破坏[33]猪肉MP绿原酸206、30、150 μmol/g pro6.250.6溶解度降低;凝胶化过程先增强后减弱[24]猪肉MP迷迭香酸12、60、300 μmol/g pro7.0 0.2、0.6溶解度先升高后降低;高剂量时乳化稳定性降低;凝胶强度增加[23]猪肉MPEGCG200.05、0.1、0.2、0.5、1 mg/mL6.250.6高剂量时乳化活性降低;高剂量时胶凝能力下降[39]猪肉MP桑椹多酚1010 mg/mL6.250.6凝胶强度、白度降低,保水力增强,凝胶网络结构更加致密和均一;溶解度降低[19]猪肉MP丁香、桂皮、迷迭香提取物400.005、0.010、0.020 g/g pro凝胶强度先增加后减小[40]猪肉MP鼠尾草提取物105 mg/mL6.20.6乳化活性和乳化稳定性均先升高后下降[41]猪肉MP花青素3-O-葡萄糖苷、花青素3-O-芸香糖苷、咖啡酸、槲皮素、芦丁106.250.6对乳化性能的影响各不相同[15]鱼肉MP茶多酚255、10、20、50、100 μmol/g pro7.20.6凝胶强度、硬度、弹性等均先增加后减小[20]鱼肉MP黑麦多酚1.5、3.0、4.5 g/L溶解度升高;乳化活性和乳化稳定性升高[26]鱼肉MP苹果多酚凝胶强度、硬度、弹性、咀嚼度、胶着度均增强[36]羊肉MP茶多酚300.01、0.05、0.1、0.5、1%(w/v)6.00.6乳化活性先升高后下降;乳化稳定性先下降后升高;凝胶保水性、硬度、咀嚼度、胶着度均增强;网状结构更紧密且均匀[2]鸡肉MP没食子酸、绿原酸1550、100、150、200、250 μg/mL7.50.75乳化稳定性升高;乳化活性先升高后下降;凝胶白度、保水性、硬度、弹性、均先先增加后减小再增加[6]
3.1 多酚种类
多酚种类众多,其结构、分子质量及活性基团的数量和分布等因素都会影响其与MP的相互作用。一般认为,简单的酚类物质与蛋白质的结合能力较弱,而聚合度较高、分子质量较大及结合位点较多的多酚与蛋白质的结合能力更强[12]。CHENG等[15]比较了花青素3-O-葡萄糖苷、花青素3-O-芸香糖苷、咖啡酸、槲皮素、芦丁、对猪肉MP的影响,发现咖啡酸的水溶性最高,对MP的结构修饰作用最强,导致α-螺旋的显著减少和色氨酸荧光猝灭,并使复合物表现出最高的溶解度和抗氧化活性,而芦丁则增加了MP的表面疏水性,显著提高了MP的乳化性能。此外,黄渊等[14]研究发现,EGCG、白藜芦醇与鲢鱼肌球蛋白之间的主要作用力是氢键和范德华力,且2种多酚在同一条件下反应的热力学参数不相同,说明两者与MP发生非共价相互作用的强度存在差异。另外,多酚与MP间适当的相互作用可以显著改善蛋白结构、抑制蛋白氧化和改善蛋白功能特性,但并不是所有的多酚都能对此起到积极作用,某些酚类化合物甚至会加速蛋白氧化[15],例如,多酚对色氨酸氧化可以同时发挥抗氧化剂和促氧化剂作用,这主要取决于其种类、化学结构及浓度,酚酸(如没食子酸)通常充当促氧化剂,其结构中的羟基排列易促进半醌的形成,从而降解氨基酸,而具有邻苯二酚结构的其余酚类和其他类黄酮(如槲皮素和染料木黄酮)通常充当抗氧化剂,这可能归因于其邻位羟基的强自由基清除能力、结构排列的稳定性以及金属螯合活性等[42],当然,这也不能一概而论,具体研究中往往还有其他因素的影响,因此在实际应用中,选择合适的多酚类型和作用条件,是保证其在一定条件下发挥积极作用的重要前提。
3.2 温度
一般来说,温度升高会诱导MP的构象变化,暴露出内部被掩埋的疏水位点,分子间疏水相互作用会增强,而氢键作用力会减弱[12],且不同的温度处理还可能对多酚的含量造成影响。DAI等[25]研究发现,温度升高能显著促进猪肉肌球蛋白三级结构的展开和疏水基团的暴露,且40~60 ℃的加热条件有助于增强蛋白与迷迭香酸之间的疏水相互作用,而70 ℃的加热条件则会促进迷迭香酸氧化生成醌基,从而增强其与肌球蛋白之间的共价结合。此外,ZENG等[43]将从糙米中提取的27种多酚物质经加热处理后,发现酚类物质含量和总抗氧化活性均降低,其能清除自由基转化为醌类物质的能力也降低;且加热使酚类糖苷去糖基化,羟基数目减少,这对氢键作用力不利。黄渊等[14]的研究发现,在25~37 ℃,EGCG、白藜芦醇与肌球蛋白之间非共价相互作用的结合常数、结合位点数都随温度升高而降低,表明作用力逐渐减弱。
3.3 pH值
MP是两性电解质,环境pH值影响着其所带静电荷、解离状态及构象等特征。其次,多酚在碱性环境中稳定性变差,易通过非酶促氧化转化为醌类或半醌类物质,进而增强与MP的共价相互作用。LI等[44]研究发现,在接近肌球蛋白等电点的酸性条件下,分子易聚集沉淀,而在远离等电点的碱性条件下,分子间静电排斥力增大,溶解度升高,且碱诱导了肌球蛋白部分结构展开,疏水残基外露,有助于加强其与多酚间的疏水相互作用。另外,ANNA等[45]研究发现,EGCG和槲皮素的氢供体数量均随着环境pH值减小而增加,因此在酸性条件下更有助于增强其与MP间的氢键作用力;而在碱性条件下,多酚自身的氧化分解加剧,易生成醌类物质,从而增强其与MP间的共价相互作用。
3.4 离子强度
MP属于盐溶性蛋白质,离子强度的提高可改善其溶解度;此外,离子强度的变化可诱导MP构象改变,并能影响多酚的氢供体数量与分布,进而改变氢键强弱。雷娜[9]研究发现,相较于0.2 mol/L NaCl条件,MP在0.6 mol/L NaCl条件下具有更高的溶解度,且其游离氨基基团和巯基基团更易于被EGCG醌基基团攻击,进而增强二者间的共价相互作用。另外,WANG等[46]研究了不同NaCl浓度(0.1~3 mol/L)对鱼肌球蛋白结构的影响,发现在0.1~0.6 mol/L内,离子浓度的提高促进了肌球蛋白粗丝的解离和肽链的延伸,同时提高了溶解度,而进一步提高离子强度则引起了分子疏水域的展开,暴露出更多疏水基团,从而有助于促进疏水相互作用。ANNA等[45]比较了Al3+、Zn2+、Cu2+3种金属离子对EGCG和槲皮素抗氧化活性的影响,发现Al3+较其他2种离子能显著减少多酚的氢供体数量,降低其抗氧化活性。
总体而言,多酚与MP的相互作用会受到诸多因素的影响,其中多酚种类、温度、pH值和离子强度较为重要。多酚种类的影响主要与其分子质量和反应基团数目相关,温度则会改变MP构象和非共价作用力的强弱,pH值主要影响MP所带电荷以及多酚稳定性,离子强度则主要是与MP溶解度和结构相关。不同影响因素水平的高低有各自不同的效果,种类繁多的多酚之间也可能存在协同或拮抗作用,因此探究各条件的最佳水平并进而寻求最优组合,将对多酚-蛋白复合物的实际应用有着深远意义。
4 展望
MP是肌肉中重要的蛋白质,其在加工储藏过程中的氧化会造成结构破坏和分子间交联,进而影响乳化和凝胶等功能特性,导致肉制品品质劣化;多酚类物质作为性质优良且来源广泛的天然抗氧化剂,可在MP结构的修饰和功能特性的改善、抑制肉制品氧化等方面发挥重要作用。由众多研究可知,多酚与MP的相互作用包括“巯基-醌”、“氨基-醌”加成反应等不可逆的共价相互作用和疏水相互作用、氢键、范德华力及静电相互作用等可逆的非共价相互作用,这对MP的结构和功能特性具有重要影响,且相互作用的类型和强度会受到多因素影响,如多酚和蛋白质的种类、结构等自身特性及温度、pH值、离子强度等外界条件。
综上所述,目前对于多酚对MP结构和功能特性的研究已较为广泛,但仍有需要探索的空间。首先,目前绝大多数实验的研究对象是猪肉MP,少部分是鱼肉MP,但对禽肉MP的研究相对较少,而相互作用的类型和强度,以及相互作用对MP结构和功能的具体影响等都与原料自身特性(种类、结构等)密切相关,因此对不同种类MP的研究需要更加丰富一些。其次,在改善MP功能特性方面,大多数研究集中在对其凝胶特性的探讨,例如目前已经研究了多酚对MP凝胶形成的剂量依赖作用[23],添加糖类控制多酚与MP相互作用程度或形成三元复合物以改善凝胶质量[47-48],以及脂质氧化产物与多酚对蛋白凝胶特性的共同影响等[10,49],此外,添加了多酚的蛋白质膜有着可降解、可再生和抗氧化活性高的特性,也将是具有开发潜力的一种新型包装材料[37-38];但相对而言,针对MP乳化特性的研究和应用较少,因此需要更加深入探究相互作用对其乳化性能的具体影响机制,寻求改善乳化性能的最优调控条件,进而制备性质优良的乳液和开发新型乳化剂;另外,根据蛋白质的两亲性,设计构造以多酚-MP复合物为载体的生物活性物质递送体系,如药物、脂肪酸及其他亲脂性化合物等[50],进而应用到焙烤食品、糕点、乳制品和饮料等多个方面,具有广阔的应用前景和重要的实际意义。
[1] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学,2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins:Mechanism and application[D].Wuxi:Jiangnan University,2016.
[2] 杨豫菘. 茶多酚对羊肉肌原纤维蛋白凝胶体系功能特性的影响[D].呼和浩特:内蒙古农业大学,2019.
YANG Y S.Effects of tea polyphenols on the functional properties of mutton myofibrillar protein gel[D].Hohhot:Inner Mongolia Agricultural University,2019.
[3] ZHANG L,MCCLEMENTS D J,WEI Z L,et al.Delivery of synergistic polyphenol combinations using biopolymer-based systems:Advances in physicochemical properties,stability and bioavailability[J].Critical Reviews in Food Science and Nutrition,2020,60(12):2 083-2 097.
[4] 夏婷, 赵超亚,杜鹏,等.食品中多酚类化合物种类、提取方法和检测技术研究进展[J].食品与发酵工业,2019,45(5):231-238.
XIA T,ZHAO C Y,DU P,et al.Research progress on classification,extraction,and detection of polyphenols in foods[J].Food and Fermentation Industry,2019,45 (5):231-238.
[5] 郑红梅, 王少英,史新娥.植物多酚的抗氧化作用及其改善肉质的机制[J].动物营养学报,2020,32(5):2 037-2 045.
ZHENG H M,WANG S Y,SHI X E.Antioxidative effects of plant polyphenols and its mechanism of improving meat quality[J].Chinese Journal of Animal Nutrition,2020,32 (5):2 037-2 045.
[6] 张典. 没食子酸和绿原酸对磷酸化鸡胸肉肌原纤维蛋白性质的作用研究[D].天津:天津商业大学,2019.
ZHANG D.Effects of gallic acid and chlorogenic acid on properties of phosphorylated myofibrin from chicken breast[D].Tianjin:Tianjin Commercial University,2019.
[7] 唐长波. 迷迭香酸与肌原纤维蛋白加合产物的形成及其对肉品品质的影响机制研究[D].南京:南京农业大学,2017.
TANG C B.Study on the formation of adducts between rosmarinic acid and myofibrillar protein and its effects on meat quality[D].Nanjing:Nanjing Agricultural University,2017.
[8] WANG L B,WANG L J,LI Z G,et al.Diverse effects of rutin and quercetin on the pasting,rheological and structural properties of Tartary buckwheat starch[J].Food Chemistry,2021,335:127 556.
[9] 雷娜. EGCG修饰巯基对肌原纤维蛋白乳化凝胶特性的影响及机制研究[D].咸阳:西北农林科技大学,2017.
LEI N.Influence of thiol modified byegcg on the quality of emulsion gel ofmyofibril protein[D].Xianyang:Northwest Agriculture and Forestry University,2017.
[10] LV Y Q,CHEN L,WU H Z,et al.(-)-Epigallocatechin-3-gallate-mediated formation of myofibrillar protein emulsion gels under malondialdehyde-induced oxidative stress[J].Food Chemistry,2019,285:139-146.
[11] TANG C B,ZHANG W G,ZOU Y F,et al.Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J].Food Hydrocolloids,2017,67:197-205.
[12] 刘夫国, 马翠翠,王迪,等.蛋白质与多酚相互作用研究进展[J].食品与发酵工业,2016,42(2):282-288.
LIU F G,MA C C,WANG D,et al.Recent research progress on interactions between polyphenols and proteins[J].Food and Fermentation Industries,2016,42 (2):282-288.
[13] 彭林, 马良,戴宏杰,等.多酚与肌原纤维蛋白相互作用机制及其对蛋白特性的影响研究进展[J].食品科学,2020,41(11):239-246.
PENG L,MA L,DAI H J,et al.Recent progress in understanding the interaction mechanism between polyphenols and myofibrillar protein and its effects on protein properties[J].Food Science,2020,41 (11):239-246.
[14] 黄渊, 岳世阳,熊善柏,等.2种天然抗氧化剂与鲢鱼肌球蛋白的相互作用[J].食品科学,2019,40(4):14-20.
HUANG Y,YUE S Y,XIONG S B,et al.Interaction between two natural antioxidants and silver carp myosin[J].Food Science,2019,40 (4):14-20.
[15] CHENG J R,ZHU M J,LIU X M.Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J].Food Chemistry,2020,308:125 592.
[16] EFENBERGER-SZMECHTYK M,NOWAK A,CZYZOWSKA A.Plant extracts rich in polyphenols:Antibacterial agents and natural preservatives for meat and meat products[J].Critical Reviews in Food Science and Nutrition,2021,61(11):149-178.
[17] ![]() M,SZWENGIEL A,DZIEDZIC K,et al.The effect of buckwheat hull extract on lipid oxidation in frozen-stored meat products[J].Journal of Food Science,2017,82(4):882-889.
M,SZWENGIEL A,DZIEDZIC K,et al.The effect of buckwheat hull extract on lipid oxidation in frozen-stored meat products[J].Journal of Food Science,2017,82(4):882-889.
[18] 孟彤. 海带多酚提取物对猪肉乳化肠品质及氧化稳定性的影响[D].上海:上海海洋大学,2015.
MENG T.Effect of saccharina japonica aresch phenolic extracts on the edible quality and oxidative stability of pork sausage[D].Shanghai:Shanghai Ocean University,2015.
[19] 李登龙. 微胶囊化桑椹多酚调控猪肉蛋白氧化研究[D].喀什:喀什大学,2020.
LI D L.Study on the regulation of meat pork protein oxidation by microcapsulated mulberry polyphenols[D].Kashgar:Kashgar University,2020.
[20] LI X P,LIU C K,WANG J X,et al.Tea polyphenols affect oxidative modification and solution stability of myofibrillar protein from grass carp (Ctenopharyngodon idellus)[J].Food Biophysics,2020,15(4):397-408.
[21] 贾娜, 刘丹,宋立,等.没食子酸抑制猪肉肌原纤维蛋白氧化及其与蛋白的交联作用[J].中国食品学报,2019,19(1):12-19.
JIA N,LIU D,SONG L,et al.The inhibition effect of gallic acid on oxidation of pork myofibrillar proteins and the crosslinking interaction between gallic acid and proteins[J].Journal of Chinese Institute of Food Science and Technology,2019,19 (1):12-19.
[22] JIA N,WANG L T,SHAO J H,et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science,2017,127:45-50.
[23] WANG S X,ZHANG Y M,CHEN L,et al.Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J].Food Chemistry,2018,243:50-57.
[24] CAO Y G,XIONG Y L.Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J].Food Chemistry,2015,180:235-243.
[25] DAI H J,CHEN X K,PENG L,et al.The mechanism of improved myosin gel properties by low dose rosmarinic acid addition during gel formation[J].Food Hydrocolloids,2020,106:105 869.
[26] 郭利芳, 吴肖淮,颜燕,等.黑麦多酚对泥鳅冰温贮藏过程中肌原纤维蛋白功能特性的影响[J].食品工业科技,2021,42(1):312-316.
GUO L F,WU X H,YAN Y,et al.Effect of rye polyphenol on functional properties of loach myofibrillar protein during superchilling storage[J].Science and Technology of Food Industry,2021,42 (1):312-316.
[27] HE B Y,MING Y,PU Y,et al.The dual effects of riboflavin and kelp polyphenol extracts on the gel properties of myofibrillar protein from Scomberomorus Niphonius under UVA irradiation[J].Food Chemistry,2020,332:127 373.
[28] PAN J F,LIAN H L,JIA H,et al.Ultrasound treatment modified the functional mode of gallic acid on properties of fish myofibrillar protein[J].Food Chemistry,2020,320:126 637.
[29] CHEN J H,XU Y J,PIUS B A,et al.Changes of myofibrillar protein structure improved the stability and distribution of baicalein in emulsion[J].LWT,2021,137:110 404.
[30] ZHANG Z Y,YANG Y L,ZHOU P,et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chemistry,2017,217:678-686.
[31] LI G S,CHEN Y T,XUAN S F,et al.Rheological properties and structure of myofibrillar protein extracted from Oratosquilla oratoria muscle as affected by ultra-high pressure[J].International Journal of Food Properties,2019,22(1):1 310-1 321.
[32] LI S Y,ZHENG Y D,XU P,et al.L-lysine and l-arginine inhibit myosin aggregation and interact with acidic amino acid residues of myosin:The role in increasing myosin solubility[J].Food Chemistry,2018,242:22-28.
[33] LI S Y,LI L X,ZHU X X,et al.Conformational and charge changes induced by L-Arginine and L-lysine increase the solubility of chicken myosin[J].Food Hydrocolloids,2019,89:330-336.
[34] QUAN T H,BENJAKUL S,SAE-LEAW T,et al.Protein-polyphenol conjugates:Antioxidant property,functionalities and their applications[J].Trends in Food Science & Technology,2019,91:507-517.
[35] 何青. 猪肉肌原纤维蛋白颗粒稳定高内相Pickering乳液的制备及营养输送特性研究[D].锦州:渤海大学,2020.
HE Q.Preparation and nutrient delivery characteristics of high internal phase pickering emulsion stabled by pork myofibrillar particles[D].Jinzhou:Bohai University,2020.
[36] SUN L J,SUN J J,THAVARAJ P,et al.Effects of thinned young apple polyphenols on the quality of grass carp (Ctenopharyngodon idellus) surimi during cold storage[J].Food Chemistry,2017,224:372-381.
[37] NIE X H,GONG Y D,WANG N N,et al.Preparation and characterization of edible myofibrillar protein-based film incorporated with grape seed procyanidins and green tea polyphenol[J].LWT-Food Science and Technology,2015,64(2):1 042-1 046.
[38] KAEWPRACHU P,OSAKO K,RUNGRAENG N,et al.Characterization of fish myofibrillar protein film incorporated with catechin-Kradon extract[J].International Journal of Biological Macromolecules,2018,107:1 463-1 473.
[39] CAO Y G,AIN S,TRUE A D,et al.Effects of (-)-epigallocatechin-3-gallate incorporation on the physicochemical and oxidative stability of myofibrillar protein-soybean oil emulsions[J].Food Chemistry,2018,245:439-445.
[40] 刘丹, 贾娜,杨磊,等.3种不同香辛料提取物对猪肉肌原纤维蛋白功能特性的影响[J].食品科学,2017,38(15):14-19.
LIU D,JIA N,YANG L,et al.Influence of three different spice extracts on functional characteristics of pork myofibrillar protein[J].Food Science,2017,38 (15):14-19.
[41] LI Y Y,LIU H T,LIU Q,et al.Effects of zein hydrolysates coupled with sage (Salvia officinalis) extract on the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions[J].Food Hydrocolloids,2019,87:149-157.
[42] UTRERA M,ESTÉVEZ M.Analysis of tryptophan oxidation by fluorescence spectroscopy:Effect of metal-catalyzed oxidation and selected phenolic compounds[J].Food Chemistry,2012,135(1):88-93.
[43] ZENG Z C,HU X T,MCCLEMENTS D J,et al.Hydrothermal stability of phenolic extracts of brown rice[J].Food Chemistry,2019,271:114-121.
[44] WEI L,CAO L W,XIONG S B,et al.Effects of pH on self-assembly of silver carp myosin at low temperature[J].Food Bioscience,2019,30:100 420.
[45] PEKAL A,PYRZYNSKA K.Effect of pH and metal ions on DPPH radical scavenging activity of tea[J].International Journal of Food Sciences and Nutrition,2015,66(1):58-62.
[46] WANG G,LIU M M,CAO L W,et al.Effects of different NaCl concentrations on self-assembly of silver carp myosin[J].Food Bioscience,2018,24:1-8.
[47] ZHANG Y M,CHEN L,LV Y Q,et al.Inhibition of interaction between epigallocatechin-3-gallate and myofibrillar protein by cyclodextrin derivatives improves gel quality under oxidative stress[J].Food Research International,2018,108:8-17.
[48] 张风雪. 亚麻籽胶对儿茶素-肌原纤维蛋白互作的抑制作用及乳化凝胶特性的影响[D].锦州:渤海大学,2019.
ZHANG F X.Effect of flaxseed gum on inhibition of catechin myofibrillar protein interaction and emulsification gel properties[D].Jinzhou:Bohai University,2019.
[49] LV Y Q,FENG X C,WANG Y J,et al.The gelation properties of myofibrillar proteins prepared with malondialdehyde and (-)-epigallocatechin-3-gallate[J].Food Chemistry,2021,340:127 817.
[50] CHANPHAI P,TAJMIR-RIAHI H A.Tea polyphenols bind serum albumins:A potential application for polyphenol delivery[J].Food Hydrocolloids,2019,89:461-467.