多糖是由糖苷键连接,由10个以上单糖组成的高分子碳水化合物[1]。其结构复杂,种类繁多,在调节细胞生命活动过程中起着重要作用,与核酸、蛋白质和脂质一起被称为生命体的四大基础物质[2]。乳酸菌是公认安全(generally recognized as safe,GRAS)的微生物[3],所产胞外多糖(extracellular polysaccharide,EPS)也被认为是安全无害的。乳酸菌胞外多糖是乳酸菌在生长和代谢过程中分泌到细胞外的多糖类化合物,可分为黏液多糖和荚膜多糖[4],两者结构相似,但荚膜多糖与细胞结合紧密,通过简单离心不能分离,通常所说的胞外多糖多为黏液多糖。根据结构和组成的不同,可分为同多糖(homopolysaccharide,HoPS)和杂多糖 (heteropolysaccharide,HePS)。同多糖的合成通常是在细胞外进行的,其组成简单,一般只由一种单糖组成;杂多糖的合成主要在细胞质中进行,其组成成分比较复杂,由不同种类的单糖或者单糖衍生物组成[5]。大多数乳酸菌产生的胞外多糖都是HePS,与HoPS相比,其结构复杂,包含不同比例的单糖,如鼠李糖、葡萄糖、半乳糖等,有时还会出现糖醛酸、N-乙酰半乳糖胺和一些非碳水化合物取代基如乙酸盐、丙酮酸等,它们可能对胞外多糖的益生功能起到关键作用[6]。
不同来源乳酸菌的胞外多糖有多种健康功效,如益生元的作用、调节免疫功能、抗氧化、抗肿瘤和降胆固醇等[7]。有关植物乳杆菌(Lactobacillus plantarum)、嗜热链球菌(Streptococcus thermophilus)等的胞外多糖的研究报道较多,对乳酸片球菌胞外多糖的研究较为少见,且大多集中研究益生效果,对其一级结构或者高级结构影响其益生特性的机制研究较少。本文对益生功能较好的1株乳酸片球菌C6菌株所产的胞外多糖进行分离纯化,分析其单糖组成,并进行了红外光谱测定和核磁共振分析,探讨胞外多糖结构与其抗氧化性能的关系,为乳酸菌胞外多糖作为天然抗氧化剂的研究和应用提供理论依据。
高产胞外多糖的乳酸片球菌C6菌株,由本实验室分离鉴定和保藏。
DEAE-Sepharose Fast Flow、Sepharose CL-6B、透析袋、Tris,北京索莱宝科技有限公司;硫酸、苯酚, 广州化学试剂厂;岩藻糖(fucose,Fuc)、鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、盐酸氨基葡萄糖(glucosamine hydrochloride,Gah)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glc)、N-乙酰-D-氨基葡萄糖(N-acetyl-D-glucosamine,NAG)、木糖(xylose,Xyl)、甘露糖(mannose,Man)、果糖(fructose,Fru)、核糖(ribose,Rib)、3-脱氧-D-甘露-2-辛酮糖酸(3-deoxy-D-manno-oct-2-ulsonic acid,Kdo)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖醛酸(glucuronic acid,GlcA),上海源叶生物科技有限公司;焦性没食子酸,天津市北辰方正试剂厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[ 2,2′-azinobis-(3-ethylbenzthiazoline-6-sulfonic acid),ABTS],美国Sigma公司。
MRS培养基:无水葡萄糖20.0 g/L,胰蛋白胨10.0 g/L,牛肉膏5.0 g/L,酵母粉4.0 g/L,吐温-80 1.0 mL/L,无水乙酸钠5.0 g/L,柠檬酸三铵 2.0 g/L,K2HPO4·3H2O 2.0 g/L,结晶MgSO4 0.2 g/L,MnSO4·H2O 0.05 g/L。终pH为6.0,121 ℃高压蒸汽灭菌20 min。
ABTS工作液:将ABTS溶液(7.4 mmol/L)与等体积K2S2O8溶液(2.6 mmol/L)充分混合,置于黑暗条件下静置12 h后放入冰箱保存备用。每次使用前用PBS溶液(pH 7.4)稀释,使其OD734 nm为(0.7±0.02)。
ESCO ClassⅡ生物安全柜,新加坡艺思高科技有限公司;ALPHA 2-4 LDplus冷冻干燥机,德国CHRIST公司;Avanti J-E落地式高速大容量离心机,美国Beckman Coulter公司;HH-4恒温水浴锅,常州智博瑞仪器制造有限公司;VersaMax光栅型酶标仪,美国Melecular Devices公司;1525高效液相色谱仪,美国Waters公司;ICS5000离子色谱仪,美国Thermo Fisher公司;Avance III HD核磁共振波谱仪,瑞士Bruker公司。
1.3.1 乳酸片球菌EPS的提取
参考卢承蓉等[8]的方法并略作修改。将菌株按3%接种量接种于MRS培养基中,37 ℃恒温静置培养24 h,连续活化3次后于10 000 r/min离心10 min(4 ℃),弃去培养液中的菌体,取上清液并加入800 g/L三氯乙酸溶液,使溶液中三氯乙酸终质量浓度为4 g/L,在4 ℃冰箱中静置6~8 h后于10 000 r/min离心15 min(4 ℃),弃去蛋白质沉淀,取上清液,加入自身3倍体积预冷的乙醇(体积分数95%),在4 ℃冰箱中静置12~15 h后于10 000 r/min离心15 min(4 ℃),取多糖沉淀并加入去离子水溶解后移至透析袋中,截留分子质量8 k~14 kDa,用去离子水透析3 h后第1次换水,之后每隔8 h换1次水,持续2 d,收集透析液后进行真空冷冻干燥,即得到粗多糖。
1.3.2 乳酸片球菌EPS的分离纯化
1.3.2.1 DEAE-Sepharose Fast Flow离子交换层析
Tris-HCl溶液平衡DEAE-Sepharose Fast Flow(2.6 cm×58 cm)离子交换层析柱过夜,0.1 g粗多糖溶于5 mL Tris-HCl溶液中,0.45 μm滤头过滤后上样,以含不同浓度NaCl(0、0.1、0.3、0.5、0.7 mol/L)的Tris-HCl溶液作为洗脱液,流速1 mL/min进行梯度洗脱,每8 mL收集1管,以硫酸-苯酚法[9]检测多糖含量,测定其OD490 nm。以管数为横坐标,OD490 nm为纵坐标,作洗脱曲线。根据洗脱曲线收集每一个单一峰,在减压条件下浓缩,用去离子水透析2 d,真空冷冻干燥。
1.3.2.2 Sepharose CL-6B 分子筛层析
Tris-HCl溶液平衡Sepharose CL-6B(2.6 cm×60 cm)层析柱过夜,取经离子交换层析后的多糖样品0.1 g溶于1 mL Tris-HCl溶液中,0.45 μm滤头过滤后上样,以Tris-HCl溶液作为洗脱液,流速0.5 mL/min进行洗脱,每8 mL收集1管,硫酸-苯酚检测多糖含量,测定其OD490 nm。以管数为横坐标,OD490 nm为纵坐标,作洗脱曲线。根据洗脱曲线收集每一个单一峰,在减压条件下浓缩,用去离子水透析2 d,真空冷冻干燥。
1.3.3 乳酸片球菌EPS纯化组分的抗氧化活性
1.3.3.1 对DPPH自由基的清除能力
At:1 mL 8.0 mg/mL EPS溶液与1 mL 0.2 mmol/L DPPH-乙醇溶液;Ar:1 mL 8.0 mg/mL EPS溶液与1 mL无水乙醇;A0:1 mL无水乙醇与1 mL 0.2 mmol/L DPPH-乙醇溶液。配制A0、At、Ar这3种溶液,分别充分混匀后在常温黑暗条件下静置30 min,测其OD517 nm。按公式(1)计算DPPH自由基的清除率:
DPPH自由基清除率![]()
(1)
式中:At、Ar、A0分别为相应溶液的吸光度(下同)。
1.3.3.2 对ABTS阳离子自由基的清除能力
At:60 μL 8.0 mg/mL EPS溶液与3.0 mL ABTS工作液;Ar:60 μL 8.0 mg/mL EPS溶液与3.0 mL K2S2O8溶液;A0:60 μL去离子水与3.0 mL ABTS工作液。配制A0、At、Ar这3种溶液,分别充分混匀后置于30 ℃的恒温水浴锅中反应5 min,测其OD734 nm。按公式(2)计算ABTS阳离子自由基的清除率:
ABTS阳离子自由基清除率![]()
(2)
1.3.3.3 对·OH的清除能力
At:1 mL 8.0 mg/mL EPS溶液、1 mL 9.0 mmol/L FeSO4溶液、1 mL 9.0 mmol/L水杨酸-乙醇与1 mL 8.8 mmol/L H2O2;Ar:将At中H2O2溶液替换成去离子水;A0:将At中EPS溶液替换成去离子水。配制A0、At、Ar这3种溶液,分别充分混匀后置于37 ℃的恒温水浴锅中反应30 min,测其OD510 nm。按公式(3)计算·OH的清除率:
·OH清除率![]()
(3)
1.3.3.4 对![]() 的清除能力
的清除能力
At:40 μL EPS溶液(8.0 mg/mL)中加入120 μL Tris-HCl(pH 8.2),再置于30 ℃的恒温水浴锅中反应20 min,待自然冷却后加入120 μL焦性没食子酸(7.0 mmol/L),摇匀反应3 min,再加入40 μL浓盐酸停止反应;Ar:将At中焦性没食子酸换成去离子水;A0:将At中EPS溶液换成去离子水。配制A0、At、Ar三种溶液测其OD320 nm。按公式(4)计算![]() 清除率:
清除率:
![]() 清除率
清除率![]()
(4)
1.3.4 乳酸片球菌EPS纯化组分的结构分析
1.3.4.1 相对分子质量测定
纯化后EPS的相对分子质量(Mw)测定采用凝胶渗透色谱(gel permeation chromatography,GPC)进行测定。取0.5 mg的样品溶解于1 mL超纯水中,0.22 μm滤膜过滤后进行GPC检测。采用不同相对分子质量的标准葡聚糖制作标准曲线,以保留时间为横坐标,lg Mw为纵坐标。
GPC条件:采用PL aquqgel-OH MI×ED(250 mm×4.6 mm,8 μm)色谱柱,2414示差折光检测器,以0.2 mol/L NaNO3、0.01 mol/L NaH2PO4(pH 7)为流动相;柱温30 ℃;进样量10 μL;流速1 mL/min进行洗脱。
1.3.4.2 单糖组成分析
EPS单糖定性分析:通过对比样品与单糖标准品的出峰时间来确定EPS纯化组分的单糖组成。取各样品4 mg于安瓿瓶中,加入1 mL 2 mol/L三氟乙酸,120 ℃水解3 h。准确吸取200 μL酸水解溶液转移至1.5 mL EP管中氮吹吹干,加入1 mL水涡旋混匀,12 000 r/min离心5 min后取上清液,采用离子色谱仪分析。
分析条件:采用Dionex CarbopacTM PA20色谱柱(3 mm×150 mm);电化学检测器;进样量5 μL;以A:H2O,B:250 mmol/L NaOH,C:50 mmol/L NaOH和500 mmol/L 乙酸钠作为流动相,进行三元梯度洗脱;柱温30 ℃;流速0.3 mL/min。
1.3.4.3 红外光谱测定
取2 mg EPS和200 mg KBr充分混合研磨均匀,压片机压片,以空白KBr为空白,调整基线,扣除背景干扰,透射模式测定,扫描次数为32,红外光谱分辨率为4 cm-1,4 000~400 cm-1扫描。
1.3.4.4 核磁共振(nuclear magnetic resonance,NMR)分析
取5 mg EPS中加入0.5 mL重水,超声至完全溶解后,于500 MHz Bruker Avance III HD型核磁共振波谱仪进行分析,以四甲基硅烷为内标,室温测定EPS的1H NMR、13C NMR。
2.1.1 DEAE-Sepharose Fast Flow离子交换层析纯化EPS
经粗提的EPS为混合多糖,含有其他杂质,需对其进一步分离纯化。DEAE-Sepharose Fast Flow是一种弱阴离子交换介质,适用于中性多糖、酸性多糖的分离[10]。图1所示,粗EPS经不同浓度的Tris-NaCl洗脱后共得到5个多糖组分,将其中3个含量较多的组分分别命名为EPS1、EPS2、EPS3。
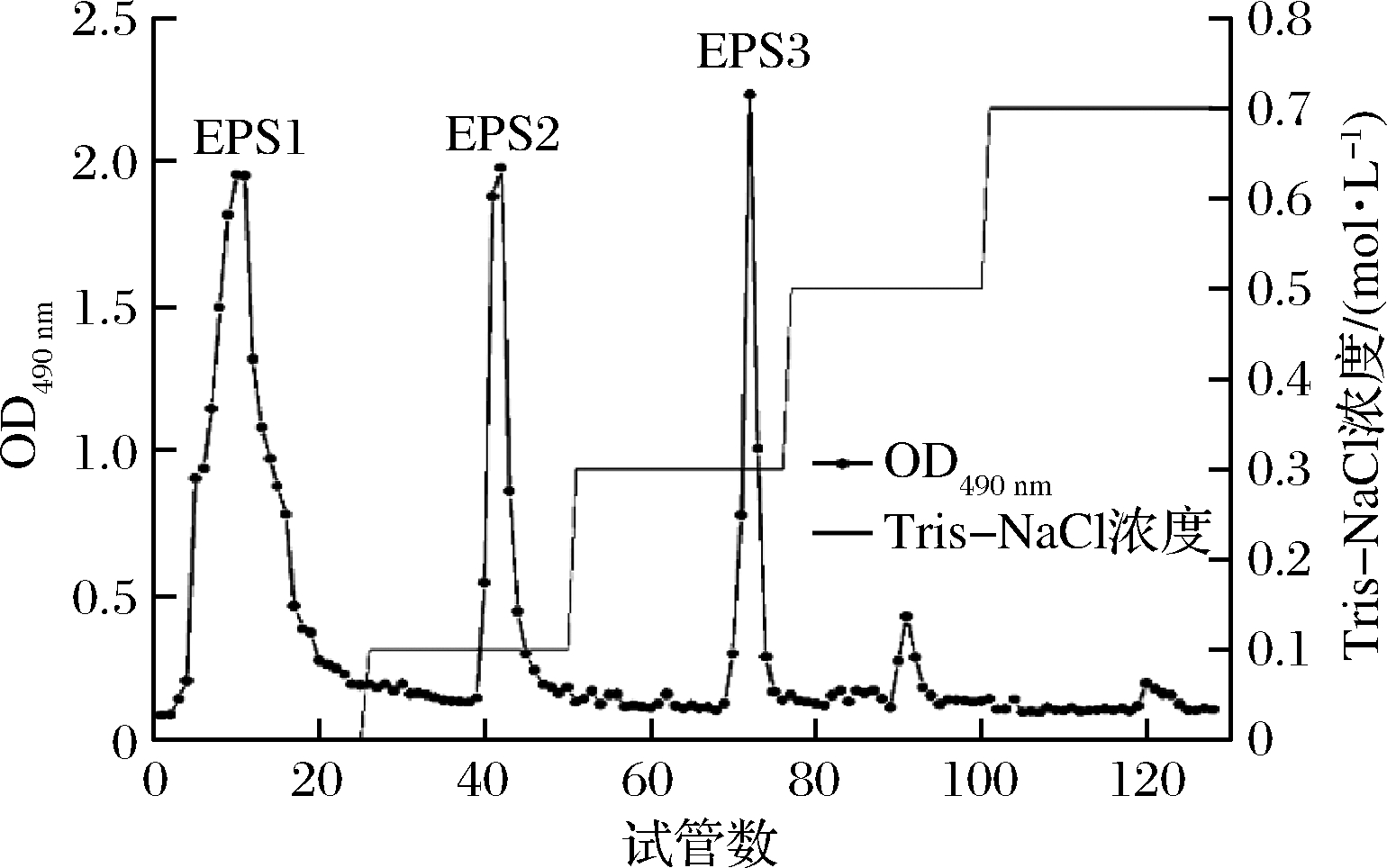
图1 DEAE-Sepharose Fast Flow离子交换层析纯化EPS
Fig.1 DEAE-Sepharose Fast Flow ion exchange chromatography of EPS
EPS1由Tris-HCl洗脱得到,可知EPS1不带电荷,为中性多糖;EPS2、EPS3分别由含NaCl浓度为0.1、0.3 mol/L 的Tris-HCl洗脱得到,因此这2个组分带负电荷,可知它们为酸性多糖或含有酸性基团的糖类复合物[11]。
2.1.2 Sepharose CL-6B分子筛层析纯化EPS
经离子交换层析后可得到电荷性质相近的多糖组分,但其分子质量可能不同,因此还需进行下一步分离纯化。琼脂糖凝胶CL-6B的排阻极限为1×104~4×106 Da,适用于多糖组分的进一步分离纯化。由图2可知,3个多糖纯化组分经分子筛层析后,EPS2、EPS3得到比较对称的单一尖锐峰,由此可知EPS2和EPS3均为分子质量大小均一的单一组分。
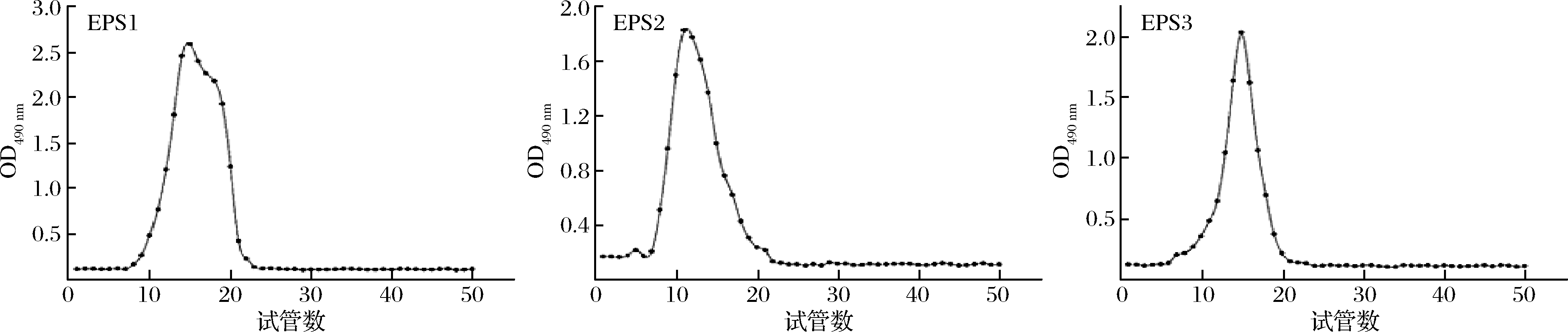
图2 EPS1、EPS2、EPS3的Sepharose CL-6B分子筛层析
Fig.2 Sepharose CL-6B molecular exclusion chromatography for EPS1,EPS2,EPS3
EPS的抗氧化活性与多种因素有关,包括分子质量、单糖组成、所含官能团及多糖提取方法等[9]。如图3所示,EPS纯化组分在质量浓度为8.00 mg/mL时,3个纯化组分对·OH和DPPH自由基的清除率分别为27.61%、32.05%、65.50%及31.55%、49.16%、83.60%,EPS2和EPS3清除率明显大于EPS1;3个纯化组分对ABTS阳离子自由基的清除率分别为54.97%、33.09%、55.90%,EPS3和EPS1清除率相差不大,但都略高于EPS2;3个纯化组分对![]() 的清除率均较低,但EPS3的清除率还是最高。由此可见EPS3抗氧化活性最高,尤其对DPPH和·OH这2种自由基的效果最好;EPS2对DPPH自由基、ABTS阳离子自由基和
的清除率均较低,但EPS3的清除率还是最高。由此可见EPS3抗氧化活性最高,尤其对DPPH和·OH这2种自由基的效果最好;EPS2对DPPH自由基、ABTS阳离子自由基和![]() 的清除率比EPS1也要好,为了探究EPS纯化组分的抗氧化活性与其结构的关系,本文选取EPS2与EPS3进行后续的结构分析。
的清除率比EPS1也要好,为了探究EPS纯化组分的抗氧化活性与其结构的关系,本文选取EPS2与EPS3进行后续的结构分析。
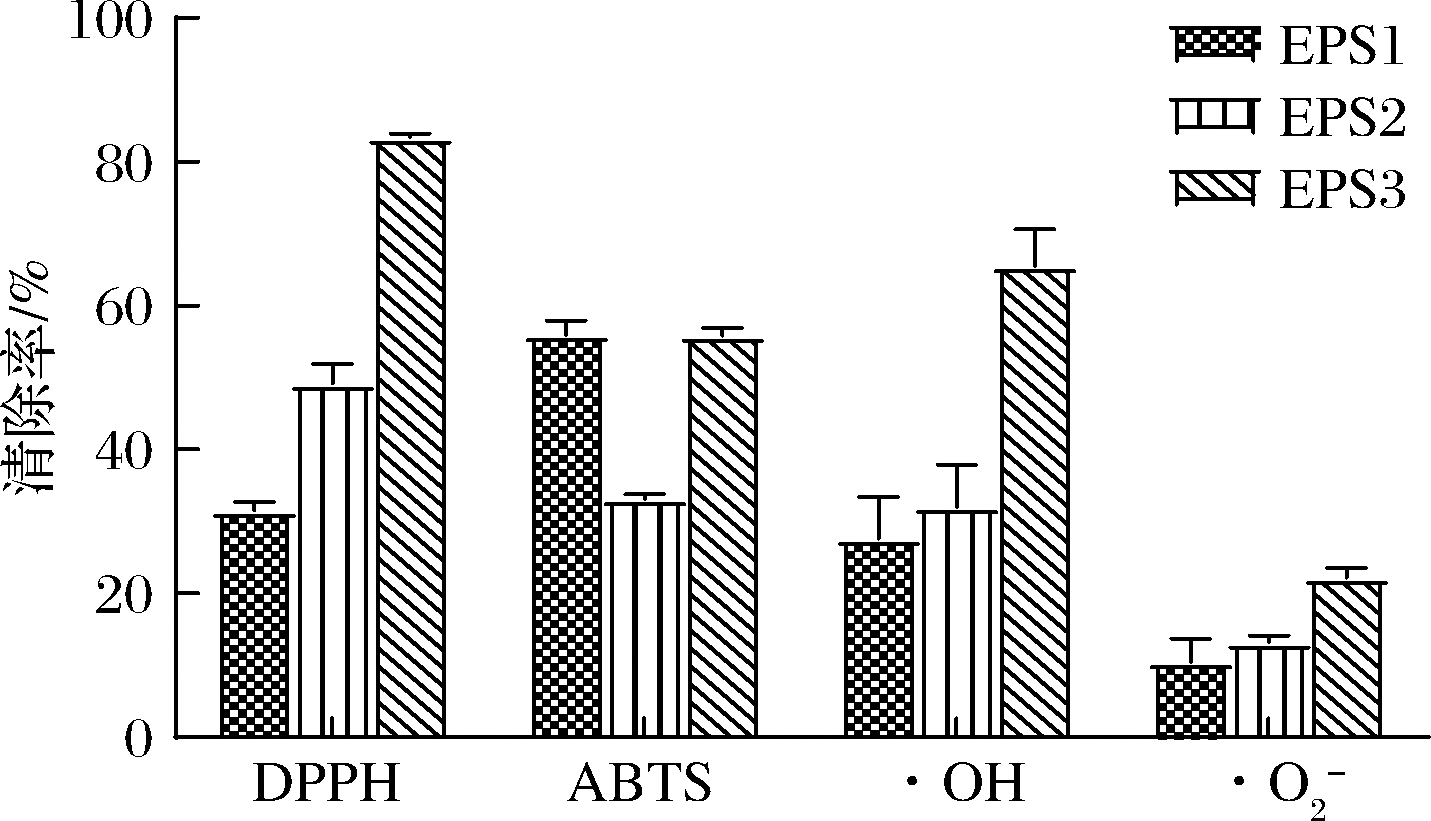
图3 EPS纯化组分的抗氧化活性测定
Fig.3 Antioxidant activities of the EPSs
2.3.1 EPS纯化组分的相对分子质量测定
使用GPC测定EPS的相对分子质量。用不同相对分子质量的标准葡聚糖来制作标准曲线,得到回归方程y=-1.061 7x+12.896 8,R2=0.993 1。EPS2、EPS3的保留时间分别为8.116 7、8.000 0 min,代入标准曲线方程,计算得到其分子质量分别为1.90×104、2.53×104 Da。
乳酸菌EPS的分子质量通常在1×104~4×106 Da[12],EPS的分子质量、糖苷键构型对物理活性及益生功能有着重要影响。分子质量较低的EPS具备更好的水溶性及相对更加舒展的糖链构象,从而具备更好的生物活性[13]。
2.3.2 EPS纯化组分的单糖组成分析
采用14种单糖为标准品,以离子色谱仪分析EPS纯化组分的单糖组成,结果如图4所示,2.18 min及40.45 min处分别为NaOH及乙酸钠的峰;EPS2主要由木糖组成,另有少量的盐酸氨基葡萄糖、半乳糖、葡萄糖,其摩尔比为0.912∶0.016∶0.022∶0.051;EPS3则由盐酸氨基葡萄糖、半乳糖、葡萄糖、木糖、半乳糖醛酸、葡萄糖醛酸组成,其摩尔比为0.105∶0.231∶0.471∶0.170∶ 0.010∶0.013。
乳酸菌的EPS多为HePS,其单糖成分多为葡萄糖、半乳糖、木糖、甘露糖、阿拉伯糖、果糖、鼠李糖等[14],其中葡萄糖与半乳糖为乳酸菌EPS中最常见的单糖,这可能与培养基的成分有关[15]。本文中乳酸片球菌C6的EPS2单糖组分主要为木糖、盐酸氨基葡萄糖、半乳糖及葡萄糖,而EPS3的单糖组分主要为盐酸氨基葡萄糖、半乳糖、葡萄糖、木糖、半乳糖醛酸及葡萄糖醛酸,其中半乳糖、葡萄糖、木糖、半乳糖醛酸及葡萄糖醛酸为乳酸菌EPS中常见单糖组分。LIU等[16]分析1株植物乳杆菌的EPS,发现其主要由甘露糖、半乳糖、葡萄糖醛酸及葡萄糖组成;WANG等[17]发现植物乳杆菌KX041在MRS肉汤培养基中产生的EPS由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成。而盐酸氨基葡萄糖在乳酸菌EPS单糖组分中则少见报道,这种组分目前可以用来预防和治疗关节炎,对EPS3益生功能的多样性有待进一步研究。EPS的抗氧化能力与糖醛酸的含量相关[18],EPS3的抗氧化能力强于EPS2可能是因为其含有半乳糖醛酸、葡萄糖醛酸成分。
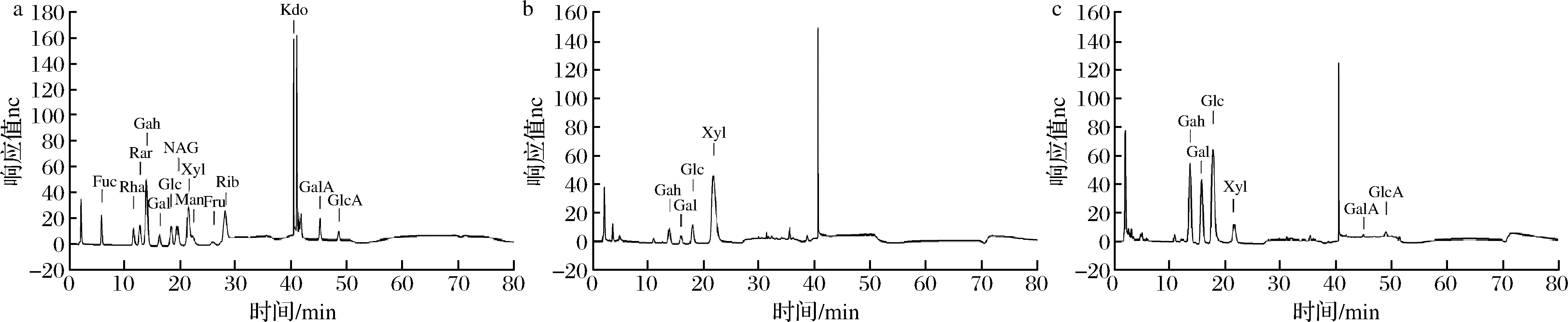
a-单糖标准品,b-EPS2,c-EPS3
图4 单糖标准品及EPS的离子色谱图
Fig.4 Ion chromatogram of monosaccharide standards and EPSs
2.3.3 EPS纯化组分的红外光谱分析
对纯化EPS进行红外光谱扫描,探究其主要官能团组成,结果如图5所示。
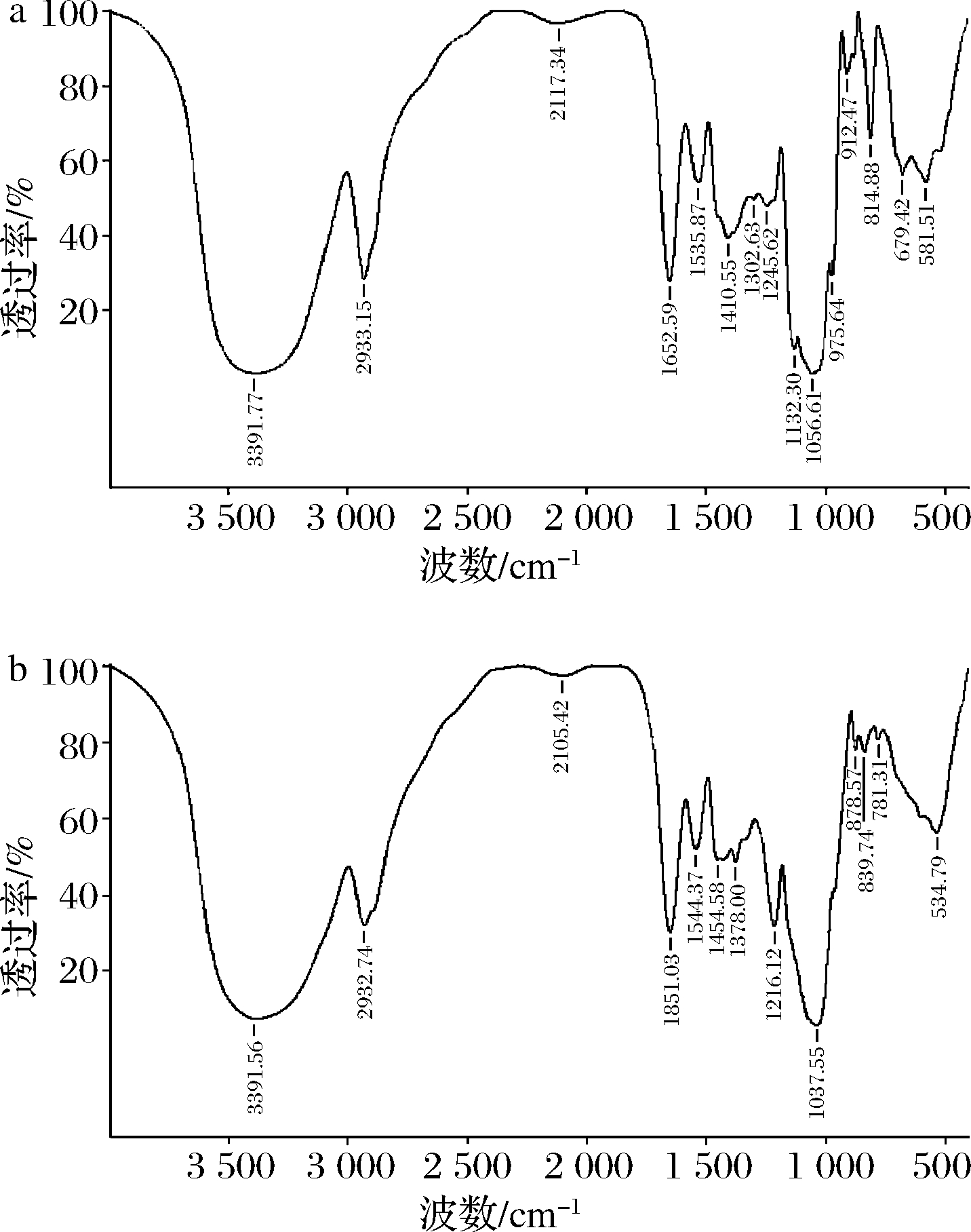
a-EPS2;b-EPS3
图5 EPSs的红外光谱扫描图
Fig.5 Infrared spectrum scan of EPSs
3 391.77 cm-1(EPS2)、3 391.56 cm-1(EPS3)处出现宽而强的吸收峰,这表明2种EPS都存在大量羟基[19];2 933.15、2 932.74 cm-1处出现的小尖峰是C—H键伸缩振动的结果[5];1 652.59、1 651.03 cm-1处为C![]() O及C—N伸缩振动引起的吸收峰[20];1 535.87、1 544.37 cm-1为C—O振动产生的吸收峰[21];1 410.55 cm-1(EPS2)处的吸收峰是酯类或醚类的伸缩振动引起的[16];1 378.00 cm-1(EPS3)为C—H的变角振动吸收峰[22]。1 200~800 cm-1可用为不同多糖的指纹图谱分析,1 216.12 cm-1(EPS3)处的小尖峰是由吡喃糖环的拉伸振动引起的[22],1 132(EPS2)、1 056.61(EPS2)、1 037.55(EPS3)cm-1可能为C—O—C糖苷键及C—O键的伸缩振动峰[23],它们可能由糖骨架中的吡喃环的羟基和醚键产生;912.47 cm-1(EPS2)处为α-糖苷键的特征吸收峰[24],814.88 cm-1(EPS2)处的吸收峰表示含有甘露糖残基。EPS3含有糖醛酸,在1 700~1 775 cm-1处没有吸收峰,与LIU等[16]单糖分析相似,可能是由于EPS糖醛酸的COOH充当阳离子的结合位点,例如Na+。总而言之,这2个多糖组分中存在糖的吡喃环、羰基、羟基等官能团,与多糖的常见结构相符。
O及C—N伸缩振动引起的吸收峰[20];1 535.87、1 544.37 cm-1为C—O振动产生的吸收峰[21];1 410.55 cm-1(EPS2)处的吸收峰是酯类或醚类的伸缩振动引起的[16];1 378.00 cm-1(EPS3)为C—H的变角振动吸收峰[22]。1 200~800 cm-1可用为不同多糖的指纹图谱分析,1 216.12 cm-1(EPS3)处的小尖峰是由吡喃糖环的拉伸振动引起的[22],1 132(EPS2)、1 056.61(EPS2)、1 037.55(EPS3)cm-1可能为C—O—C糖苷键及C—O键的伸缩振动峰[23],它们可能由糖骨架中的吡喃环的羟基和醚键产生;912.47 cm-1(EPS2)处为α-糖苷键的特征吸收峰[24],814.88 cm-1(EPS2)处的吸收峰表示含有甘露糖残基。EPS3含有糖醛酸,在1 700~1 775 cm-1处没有吸收峰,与LIU等[16]单糖分析相似,可能是由于EPS糖醛酸的COOH充当阳离子的结合位点,例如Na+。总而言之,这2个多糖组分中存在糖的吡喃环、羰基、羟基等官能团,与多糖的常见结构相符。
2.3.4 EPS纯化组分的NMR分析
2.3.4.1 EPS纯化组分的1H NMR分析
EPS的1H NMR可分为3个区域:δ 4.5~5.5 信号为异头质子区,δ 3.1~4.5 为环质子区域,对应于C2~C6连接的质子,δ 1.2~2.4 为烷基区[25-26]。EPS在1H NMR中的质子信号范围很窄,且存在耦合和裂分,因此无法确认所有质子的化学位移,一般α-吡喃糖的异头氢质子信号δ >4.95,而β-吡喃糖的异头氢质子信号δ<4.95,因而1H NMR的谱图主要用于确认EPS的糖苷键构型。
图6分别为EPS2、EPS3的1H NMR谱图,5.4处无信号,表明所有糖残基均属于吡喃糖,与红外光谱保持一致。4.80、4.79 处的强峰为重水产生的吸收峰,此外EPS2、EPS3在4.5~5.5 分别出现6、7种异头氢质子信号,其信号分别为5.31、5.15、5.13、5.10、5.05、4.91 及5.46、5.42、5.31、5.23、4.67、4.66、4.52,2种EPS组分中糖苷键构型均含有α构型、β构型。1H NMR的环质子区域(3.1~4.5)信号堆叠,证实了EPS结构复杂,有研究表明D-葡萄糖羰基氢在3.53 处为三重态(t),在3.57和3.75 处具有双-双态(dd)信号,在3.92和3.96 处为双重dubletos(dl)[27]。HePS中通常会同时存在α和β构型,EPS的构型对其益生功能起重要作用,LI等[28]研究中,β构型糖苷键的EPS具有更强的抗癌作用,此外,与α-(1→4)键相比,具β-(1→4)键EPS溶液的黏性更大[6]。
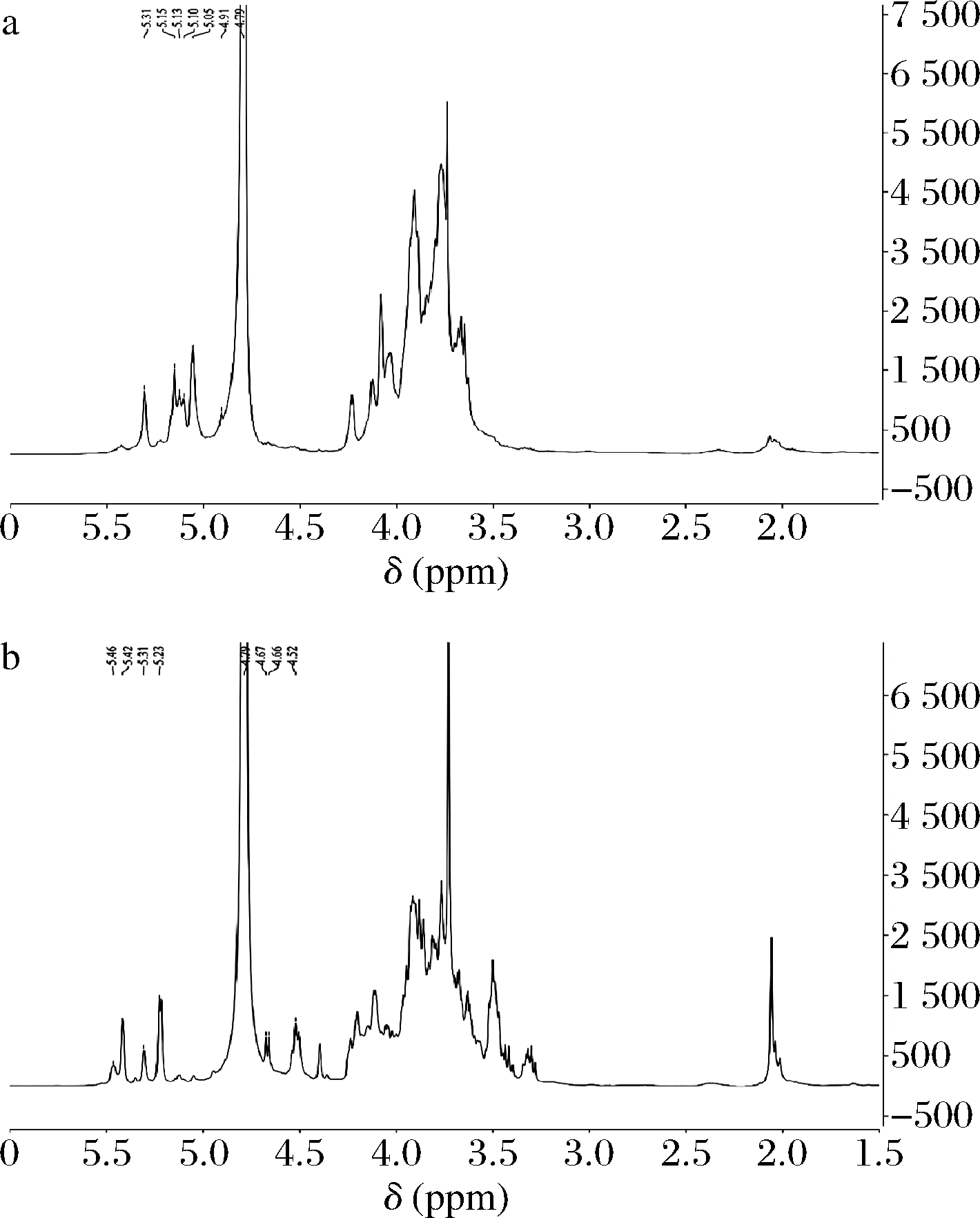
a-EPS2-b-EPS3
图6 EPSs的1H NMR谱图
Fig.6 1H NMR spectrum of EPSs
2.3.4.2 EPS纯化组分的13C NMR分析
EPS的13C NMR谱图包括异头碳区域(95~110)、环碳区域(50~85)[29]。在13C NMR光谱中,δ 95~101的峰主要是由于α-异头碳引起的,而δ 101~105主要归因于β-异头碳[30],所以13C NMR光谱主要用来确定EPS的糖苷键类型及构型。
图7分别为EPS2、EPS3的13C NMR谱图。2种EPS的异头碳区域分别有7、6种异头碳信号,分别为102.19、102.01、100.78、100.54、98.22、98.08及109.20、108.54、106.62、103.04、102.78、101.14、95.29,表明EPS2、EPS3分别含有7、6种糖残基,2种EPS均含有α-异头碳、β-异头碳,与1H NMR的结果一致。EPS2在160~180处没有信号,表明其不含糖醛酸,而EPS3在160~180处的低信号表明其含有糖醛酸,这与单糖组成分析结果一致。2种EPS在90处均无明显信号,表明其不含呋喃环构型[31]。
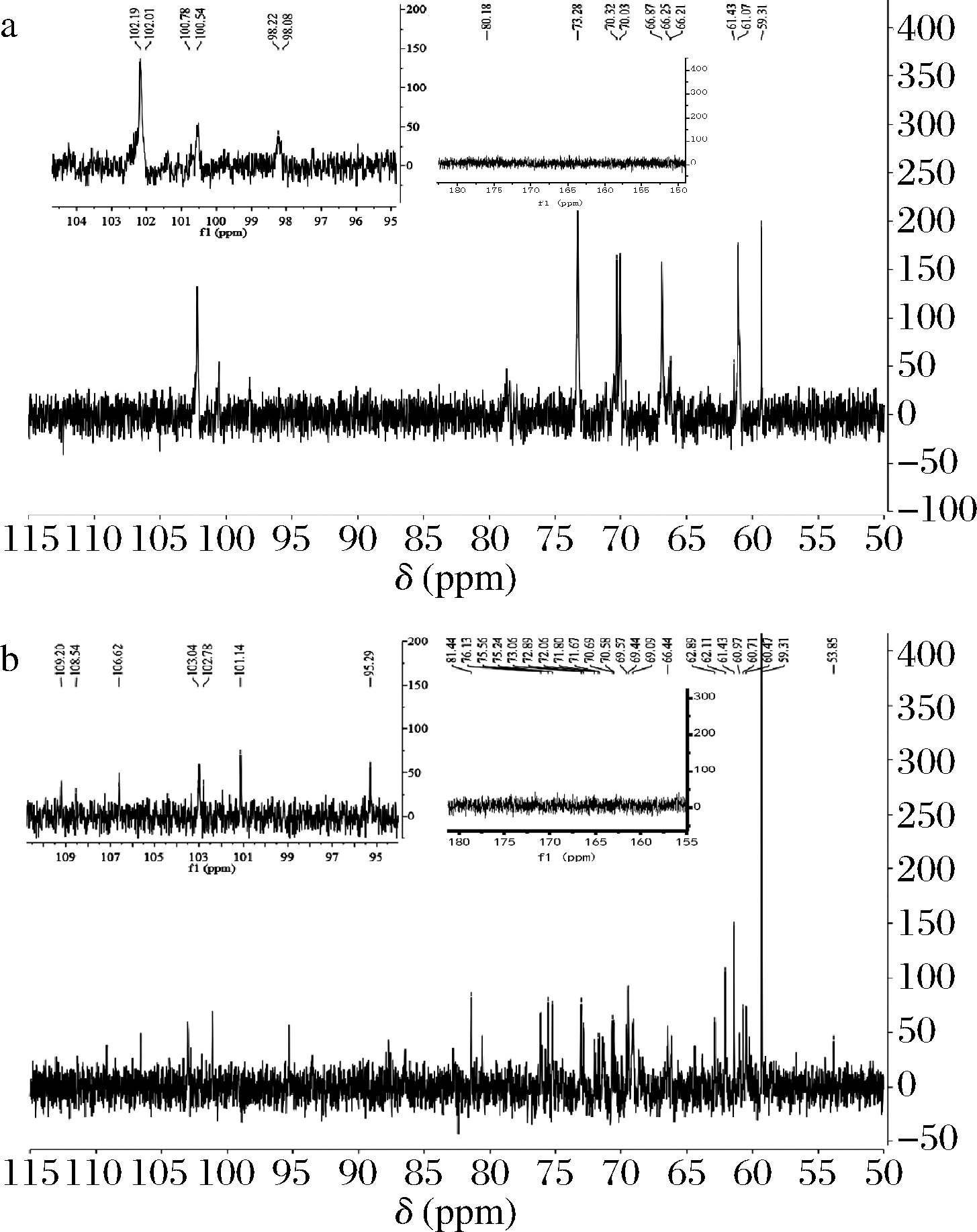
a-EPS2;b-EPS3
图7 EPSs的13C NMR谱图
Fig.7 13C NMR spectrum of EPSs
对乳酸片球菌C6菌株的胞外多糖采用离子交换层析和分子筛层析进行分离纯化,得到3个纯化组分EPS1、EPS2和EPS3。这3个纯化组分具有一定的体外抗氧化能力,对DPPH自由基、ABTS阳离子自由基![]() 等均有清除作用,各组分的清除效果存在一定差异,其中EPS2和EPS3抗氧化能力比EPS1强。以凝胶渗透色谱测定EPS2和EPS3的分子质量分别为1.90×104、2.53×104 Da。离子色谱分析表明EPS2由木糖、盐酸氨基葡萄糖、半乳糖、葡萄糖组成,摩尔比为0.912∶0.016∶0.022∶0.051;EPS3则由盐酸氨基葡萄糖、半乳糖、葡萄糖、木糖、半乳糖醛酸、葡萄糖醛酸组成,其摩尔比为0.105∶0.231∶0.471∶0.170∶0.010∶0.013。EPS3的抗氧化能力最强,可能与其含有的盐酸氨基葡萄糖、半乳糖醛酸及葡萄糖醛酸有关。红外光谱扫描显示EPS2和EPS3多糖组分中存在糖的吡喃环、羰基、羟基等官能团,与多糖的常见结构相符。核磁共振分析显示2个EPS组分的糖环类型均为吡喃糖环,糖苷键构型既有α构型也有β构型。本研究为乳酸片球菌EPS的研究和应用提供参考资料,为深入探究EPS结构与其抗氧化功能之间的关系提供理论依据。
等均有清除作用,各组分的清除效果存在一定差异,其中EPS2和EPS3抗氧化能力比EPS1强。以凝胶渗透色谱测定EPS2和EPS3的分子质量分别为1.90×104、2.53×104 Da。离子色谱分析表明EPS2由木糖、盐酸氨基葡萄糖、半乳糖、葡萄糖组成,摩尔比为0.912∶0.016∶0.022∶0.051;EPS3则由盐酸氨基葡萄糖、半乳糖、葡萄糖、木糖、半乳糖醛酸、葡萄糖醛酸组成,其摩尔比为0.105∶0.231∶0.471∶0.170∶0.010∶0.013。EPS3的抗氧化能力最强,可能与其含有的盐酸氨基葡萄糖、半乳糖醛酸及葡萄糖醛酸有关。红外光谱扫描显示EPS2和EPS3多糖组分中存在糖的吡喃环、羰基、羟基等官能团,与多糖的常见结构相符。核磁共振分析显示2个EPS组分的糖环类型均为吡喃糖环,糖苷键构型既有α构型也有β构型。本研究为乳酸片球菌EPS的研究和应用提供参考资料,为深入探究EPS结构与其抗氧化功能之间的关系提供理论依据。
[1] 吴梦琪,夏玮,徐志珍,等.植物多糖的分离纯化、结构解析及生物活性研究进展[J].化学世界,2019,60(11):737-747.
WU M Q,XIA W,XU Z Z,et al.Review on isolation and purification,structural elucidation and biological activity of botanical polysaccharides[J].Chemical World,2019,60(11):737-747.
[2] ZENG M H,KONG Q T,LIU F,et al.The anticancer activity of Lycium barbarum polysaccharide by inhibiting autophagy in human skin squamous cell carcinoma cells in vitro and in vivo[J].International Journal of Polymer Science,2019,2019:1-8.
[3] BOMFIM V B,PEREIRA LOPES NETO J H,LEITE K S,et al.Partial characterization and antioxidant activity of exopolysaccharides produced by Lactobacillus plantarum CNPC003[J].LWT,2020,127.DOI:10.1016/j.lwt.2020.109349.
[4] XU Y M,CUI Y L,YUE F F,et al.Exopolysaccharides produced by lactic acid bacteria and Bifidobacteria:Structures,physiochemical functions and applications in the food industry[J].Food Hydrocolloids,2019,94:475-499.
[5] LI S J,HUANG R H,SHAH N P,et al.Antioxidant and antibacterial activities of exopolysaccharides from Bifidobacterium bifidum WBIN03 and Lactobacillus plantarum R315[J].Journal of Dairy Science,2014,97(12):7 334-7 343.
[6] 黄承敏,陈绮,游善兵,等.乳酸菌胞外多糖的分类及生物活性研究进展[J].中国乳业,2019(9):59-62.
HUANG C M,CHEN Q,YOU S B,et al.Advances in classification and bioactivity of exopolysaccharides from lactic acid bacteria[J].China Dairy,2019(9):59-62.
[7] ALE E C,ROJAS M F,REINHEIMER J A,et al.Lactobacillus fermentum:Could EPS production ability be responsible for functional properties?[J].Food Microbiology,2020,90.DOI:10.1016/j.fm.2020.103465.
[8] 卢承蓉,叶美芝,上官文丹,等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业,2020,46(12):14-20.
LU C R,YE M Z,SHANGGUAN W D,et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries,2020,46(12):14-20.
[9] WANG J,ZHAO X,TIAN Z,et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J].Carbohydrate Polymers,2015,125:16-25.
[10] SUN N X,LIU H P,LIU S G,et al.Purification,preliminary structure and antitumor activity of exopolysaccharide produced by Streptococcus thermophilus CH9[J].Molecules,2018,23(11):2898.
[11] WANG K,LI W,RUI X,et al.Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810[J].International Journal of Biological Macromolecules,2014,63:133-139.
[12] LYNCH K M,ZANNINI E,COFFEY A,et al.Lactic acid bacteria exopolysaccharides in foods and beverages:Lsolation,properties,characterization,and health benefits[J].Annual Review of Food Science and Technology,2018,9:155-176.
[13] SURAYOT U,WANG J G,SEESURIYACHAN P,et al.Exopolysaccharides from lactic acid bacteria:Structural analysis,molecular weight effect on immunomodulation[J].International Journal of Biological Macromolecules,2014,68:233-240.
[14] WANG J,WU T,FANG X B,et al.Characterization and immunomodulatory activity of an exopolysaccharide produced by Lactobacillus plantarum JLK0142 isolated from fermented dairy tofu[J].International Journal of Biological Macromolecules,2018,115:985-993.
[15] XU Z Y,GUO Q B,ZHANG H,et al.Exopolysaccharide produced by Streptococcus thermophiles S-3:Molecular,partial structural and rheological properties[J].Carbohydrate Polymers,2018,194:132-138.
[16] LIU T,ZHOU K,YIN S,et al.Purification and characterization of an exopolysaccharide produced by Lactobacillus plantarum HY isolated from home-made Sichuan Pickle[J].International Journal of Biological Macromolecules,2019,134:516-526.
[17] WANG X,SHAO C G,LIU L,et al.Optimization,partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J].International Journal of Biological Macromolecules,2017,103:1 173-1 184.
[18] ZHU W J,WANG Y Z,YAN F,et al.Physical and chemical properties,percutaneous absorption-promoting effects of exopolysaccharide produced by Bacillus atrophaeus WYZ strain[J].Carbohydrate Polymers,2018,192:52-60.
[19] WANG Y P,LI C,LIU P,et al.Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet Kefir[J].Carbohydrate Polymers,2010,82(3):895-903.
[20] 王荣平. 酸马奶源植物乳杆菌胞外多糖的制备、结构解析及抗氧化研究[D].呼和浩特:内蒙古农业大学,2017.
WANG R P.Preparation,structural elucidation and antioxidant research of exopolysaccharides produced by Lactobacillus plantarum isolated from koumiss[D].Hohhot:Inner Mongolia Agricultural University,2017.
[21] CHEN Y L,MAO W J,WANG J F,et al.Preparation and structural elucidation of a glucomannogalactan from marine fungus Penicillium commune[J].Carbohydrate Polymers,2013,97(2):293-299.
[22] AYYASH M,ABU-JDAYIL B,ITSARANUWAT P,et al.Characterization,bioactivities,and rheological properties of exopolysaccharide produced by novel probiotic Lactobacillus plantarum C70 isolated from camel milk[J].International Journal of Biological Macromolecules,2020,144:938-946.
[23] BARUAH R,MAINA N H,KATINA K,et al.Functional food applications of dextran from Weissella cibaria RBA12 from pummelo (Citrus maxima)[J].International Journal of Food Microbiology,2017,242:124-131.
[24] YE G B,CHEN Y H,WANG C L,et al.Purification and characterization of exopolysaccharide produced by Weissella cibaria YB-1 from pickle Chinese cabbage[J].International Journal of Biological Macromolecules,2018,120:1 315-1 321.
[25] NAMBIAR R B,SELLAMUTHU P S,PERUMAL A B,et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum HM47 isolated from human breast milk[J].Process Biochemistry,2018,73:15-22.
[26] RUIZ RODR GUEZ L G,MOHAMED F,BLECKWEDEL J,et al.Diversity and functional properties of lactic acid bacteria isolated from wild fruits and flowers present in Northern Argentina[J].Frontiers in Microbiology,2019,10:1091.
GUEZ L G,MOHAMED F,BLECKWEDEL J,et al.Diversity and functional properties of lactic acid bacteria isolated from wild fruits and flowers present in Northern Argentina[J].Frontiers in Microbiology,2019,10:1091.
[27] FARINAZZO F S,VALENTE L J,ALMEIDA M B,et al.Characterization and antioxidant activity of an exopolysaccharide produced by Leuconostoc pseudomesenteroides JF17 from jucara fruits (Euterpe edulis Martius)[J].Process Biochemistry,2020,91:141-148.
[28] LI W,XIA X D,TANG W Z,et al.Structural characterization and anticancer activity of cell-bound exopolysaccharide from Lactobacillus helveticus MB2-1[J].Journal of Agricultural and Food Chemistry,2015,63(13):3 454-3 463.
[29] MIN W H,FANG X B,WU T,et al.Characterization and antioxidant activity of an acidic exopolysaccharide from Lactobacillus plantarum JLAU103[J].Journal of Bioscience and Bioengineering,2019,127(6):758-766.
[30] HUANG S Q,LI J W,LI Y Q,et al.Purification and structural characterization of a new water-soluble neutral polysaccharide GLP-F1-1 from Ganoderma lucidum[J].International Journal of Biological Macromolecules,2011,48(1):165-169.
[31] ISMAIL B,NAMPOOTHIRI K M.Production,purification and structural characterization of an exopolysaccharide produced by a probiotic Lactobacillus plantarum MTCC 9510[J].Archives of Microbiology,2010,192(12):1 049-1 057.