维生素B12又称为钴胺素,是一类含有钴的咕啉类化合物的总称。1926年MINOT和MURPHY发现动物的肝脏能治疗恶性贫血症[1],但并不知道是何种物质在起作用。直至1948年,RICKES 和SMITH分别从肝脏中提取和纯化得到了一种红色结晶,并将其命名为维生素![]() 年,美国科学家WOODWARD等完成了维生素B12的化学合成[3]。维生素B12的化学结构复杂,并且是自然界中生物合成途径最繁琐的小分子物质之一[4]。根据钴胺素上配体的不同,可将其分为多种形式,如甲基钴胺素、腺苷钴胺素、羟基钴胺素和氰基钴胺素等。其中甲基钴胺素和腺苷钴胺素都具有生物活性,腺苷钴胺素为微生物合成的主要形式[5]。
年,美国科学家WOODWARD等完成了维生素B12的化学合成[3]。维生素B12的化学结构复杂,并且是自然界中生物合成途径最繁琐的小分子物质之一[4]。根据钴胺素上配体的不同,可将其分为多种形式,如甲基钴胺素、腺苷钴胺素、羟基钴胺素和氰基钴胺素等。其中甲基钴胺素和腺苷钴胺素都具有生物活性,腺苷钴胺素为微生物合成的主要形式[5]。
维生素B12化学合成极其繁琐且昂贵,从肝脏等动物组织提取的效率和效益十分低下。目前主要通过微生物发酵法来实现商业化生产[6]。生物合成主要有2种常用工艺,一种是利用脱氮假单胞杆菌(Pseudomonas denitrificans)或黏着剑菌(Ensifer adhaerens)进行的有氧发酵工艺[7];一种是利用费氏丙酸杆菌(Propionibacterium freudenrechii)进行的厌氧发酵工艺[8]。E.adhaerens属于根瘤菌的一种[9],发酵工艺简便,且含有生成维生素B12所需的全部基因[10],目前是主要工业生产菌株。维生素B12的从头合成途径涉及30多个基因,但是部分基因的作用机理尚不清楚[11],且大部分基因受到维生素B12的反馈调节[12]。目前,E.adhaerens的基因操作系统尚不完善[13]。由于上述各种原因,对于维生素B12途径的优化困难重重,因此本研究通过诱变育种的方式提高E.adhaerens生产维生素B12的能力。
相比其他传统诱变方法,常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变方法具有操作简单、运行成本低廉、条件温和无污染无危害等优点,是目前最常用的诱变方法[14]。高通量筛选技术结合诱变育种仍然是目前获得优良突变株的主要方法。高通量筛选以各种微孔板如48、96深/浅孔板作为主要工具,利用自动化检测工具可快速的获得所需的数据[15]。利用全自动移液工作站、微生物筛选系统、酶标仪等设备可以增加筛选效率[16]。另外,流式细胞仪能够准确、快速地从大量的细胞中分选出单个的目标细胞,效率更高[17]。基于特定的荧光染色剂能够区分细胞的死活,结合流式细胞仪可以快速地分选出通过诱变后的活细胞,节省了普通筛选流程中的平板单菌落过程[18]。通过染色剂结合流式细胞仪检测可以快速检测诱变后的致死率[19]。基于维生素B12在361 nm处有吸收峰且干扰较少,本研究构建了基于酶标仪的维生素B12检测系统[20]。以1株维生素B12工业生产菌株黏着剑菌(E.adhaerens)作为出发菌株,通过ARTP诱变处理,结合流式细胞仪、移液工作站、酶标仪、微孔板等仪器设备对诱变后的菌株进行检测、分选和培养[21],对高产菌株进行初筛,随后通过摇瓶发酵复筛,HPLC检测获得稳定高产维生素B12菌株。
1 材料与方法
1.1 实验材料
1.1.1 菌株
黏着剑菌(Ensifer adhaerens),湖南鸿鹰生物科技有限公司。
1.1.2 培养基
LB培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10 (固体加琼脂 15)。
种子培养基(g/L):甜菜糖蜜 100,(NH4)2SO4 0.7,MnSO4 0.02,ZnSO4·7H2O 0.02,MgSO4·7H2O 1.5,(NH4)2HPO4 1.8,CoCl2 0.02,5,6-二甲基苯并咪唑(DMBI) 0.01,乳化硅油 0.2 (pH 7.3~7.4)。
发酵培养基(g/L):麦芽糖浆 100,甜菜碱 15,KH2PO4 1.0,ZnSO4·7H2O 0.1,CoCl2 0.084,DMBI 0.07,FeCl3 0.83,甘油磷酸脂 0.18,玉米浆(质量分数为50%) 50,轻质MgCl2 0.05,MgSO4 1.3,(NH4)2SO4 1.3,尿素 0.63,轻质CaCO3 1.0 (pH 7.5~7.8)。
1.1.3 试剂与仪器
氰钴胺,麦克林公司;羟钴胺,Sigma公司;NaNO2、冰醋酸,国药集团公司。
ARTP-IIS型 ARTP 诱变育种仪,无锡源清天木生物科技有限公司;Cytation3酶标仪,美国 BioTek 公司;LC-20AT高效液相色谱,日本岛津公司;FACSAriaIII流式细胞仪,美国BD 公司。
1.2 实验方法
1.2.1 培养条件
平板活化:从甘油管或斜面上挑取1环菌体于LB固体平板上划线,30 ℃培养3 d至长出单菌落。
摇瓶培养:从平板上挑取单菌落接种于种子培养基中,30 ℃、220 r/min培养48 h长至对数生长期。
摇瓶发酵培养:以体积分数为10%的接种量,从培养了48 h的液体培养基转接于发酵培养基中,30 ℃、220 r/min发酵180 h。
1.2.2 ARTP诱变方法
出发菌株黏着剑菌(E.adhaerens)在LB液体培养基中,30 ℃,220 r/min条件下培养24 h至对数生长中后期。吸取1 mL菌液至1.5 mL无菌EP管中,离心取上清液,用无菌PBS (pH=7.4)或生理盐水洗菌体3次,用含有质量分数为5%甘油的无菌PBS或生理盐水稀释至OD600为0.6~0.8。吸取10 μL稀释后的菌液均匀的涂于ARTP诱变用的无菌载片表面,用ARTP诱变仪对进行诱变。样品处理完毕后,将载片放入无菌PBS或生理盐水中,振荡30~60 s,洗脱载片上的诱变菌液形成新的菌悬液。将新的菌悬液稀释梯度涂布于LB固体平板上,30 ℃培养箱中培养3 d后计数。
1.2.3 诱变致死率计算方法
致死率按公式(1)计算
致死率![]()
(1)
式中:A,在同一稀释梯度下未经ARTP处理的空白对照平板单菌落个数;B,经过诱变处理后的平板单菌落个数。
1.2.4 基于流式细胞仪的高通量筛选方法
染料的配制与染色:称取1 mg荧光染料碘化丙啶(propidium iodide,PI),用PBS(pH=7.4)缓冲液定量至10 mL,获得100 μg/mL的PI母液,4 ℃避光保存备用。取诱变后的菌液950 μL,加50 μL 100 μg/mL的PI母液,4 ℃避光染色20 min。
将染色后的菌液通过流式细胞仪分选至装有发酵培养基的48深孔板,30 ℃,220 r/min发酵180 h,按照1.3.2的方法进行钴胺素的检测,将获得的高产菌株划线活化后进行摇瓶的复筛。
1.3 钴胺素检测方法
1.3.1 基于高效液相色谱(HPLC)的检测方法
取400 μL发酵液于1.5 mL EP管中,加入40 μL冰醋酸和40 μL 质量分数为12.5%的NaNO2,摇匀,煮沸30 min。待冷却至室温后加入520 μL水,离心吸取上清液500 μL至新的1.5 mL EP管中,加入200 μL质量分数为12.55%的KH2PO4,加入200 μL的水,混匀后过0.22 μm滤膜进行液相检测。
HPLC检测条件:C18-250A色谱柱(4.6 mm×250 mm,5 μm),流动相为V(甲醇)∶V(水)=28∶72。等速洗脱,洗脱流速为0.8 mL/min,吸收波长为361 nm,色谱柱温为38 ℃,进样体积10 μL。
1.3.2 基于酶标仪的检测方法
由于钴胺素在361 nm处有吸收峰,取发酵后孔板中的发酵液100 μL于96浅孔板中,加入100 μL 0.4 mol/L的草酸,静置破壁20 min,离心取上清液稀释20倍,通过酶标仪检测各孔液体在361 nm处的吸光度。
2 结果与分析
2.1 维生素B12筛选方法的建立
2.1.1 钴胺素标准品与OD361的相关性
钴胺素标准品的水溶液通过光谱扫描,发现钴胺素在361 nm处有最大吸收峰。将钴胺素水溶液稀释至一定浓度梯度,检测其在361 nm处的吸光值,绘制标准曲线,钴胺素水溶液与OD361具有良好的相关性(R2=0.999 59),其线性化方程为Y=8.677 82X+0.081 49。再将钴胺素标准品用发酵培养基配成一定浓度梯度钴胺素溶液,检测其在361 nm处的吸光值,绘制曲线检测发酵培养基对钴胺素的干扰,发现发酵培养基对钴胺素的吸光度干扰不大(R2=0.971 6),其线性化方程为Y=0.502 64X+0.587 53。因此,该方法可以作为钴胺素产量的初筛检测方法。
2.1.2 草酸破壁时间的确定
由于E.adhaerens所产生的钴胺素会有大部分分泌至胞外,因此用于高通量筛选需要有一个方便且快速的破壁方法,以快速检测发酵液中所有钴胺素的产量。本研究采用0.4 mol/L的草酸作为细胞破壁试剂,取180 h发酵液500 μL,加入500 μL的0.4 mol/L的草酸(对照加等量的水),分别反应5、10、15、20 min,通过显微镜观察细胞破碎情况,结果如图1所示。处理细胞到10 min时,细胞基本破碎完全,考虑到细胞破碎完全问题,后续采用破壁时间20 min。
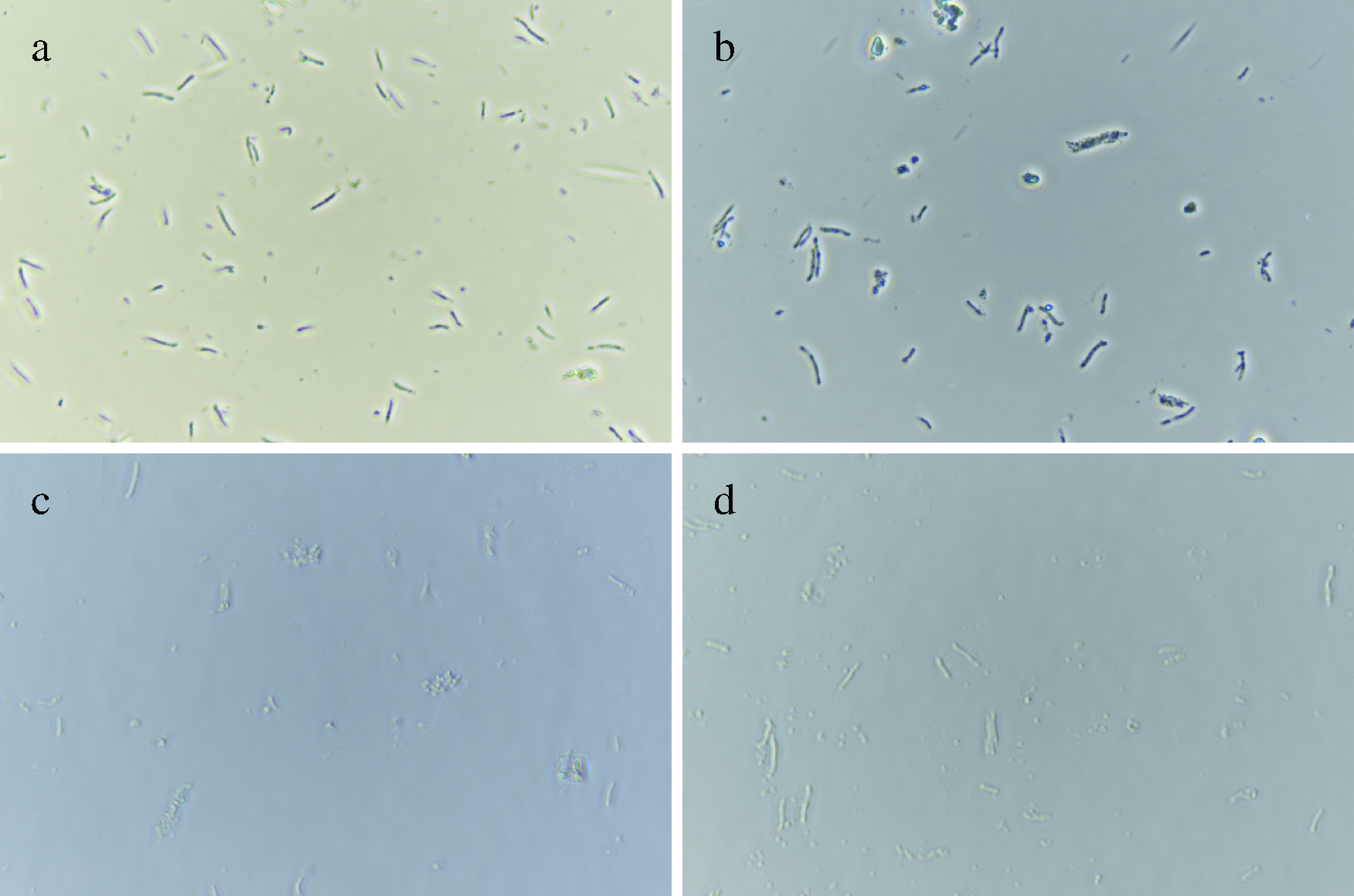
a-未处理的发酵液;b-草酸处理5 min;c-草酸处理10 min;d-草酸处理15 min
图1 草酸破壁镜检图
Fig.1 Microscopic examination of cell wall broken by oxalic acid
2.1.3 初筛方法的精确性检测
在发酵过程中的不同时间取样,加入0.4 mol/L草酸破壁处理20 min,离心取上清液,分别用酶标仪和HPLC检测发酵液中钴胺素产量,绘制相关曲线检验酶标仪检测结果与HPLC检测结果之间的相关性。通过酶标仪检测,OD361与发酵产量的相关性良好(R2=0.938 13),其线性化方程为Y=5.905 68X-2.118 67。因此,上述破壁及检测方法可以作为维生素B12初筛检测的“筛子”。
2.2 ARTP诱变致死率曲线的绘制
通过平板计数法计算ARTP致死率,将诱变后的菌悬液稀释成不同的浓度梯度后涂布LB固体平板,30 ℃培养3 d,计算不同诱变时间涂板所长出的菌落数,计算致死率,绘制致死率曲线,结果如图2所示。当处理时间在80 s时,致死率达到90%;当处理时间在120 s时,致死率接近100%。故选取ARTP处理时间80 s,致死率90%左右作为后续处理的条件。

图2 ARTP诱变致死率曲线
Fig.2 ARTP mutagenesis lethality curve
2.3 流式细胞仪分选结果
以未经PI染色的菌悬液作为阴性对照,用流式细胞仪区分ARTP不同处理条件下活细胞与死细胞,图3-a设门P1圈出E.adhaerens菌株区域,以防止菌液中微小颗粒的干扰;图3-b设门P2圈出菌液中的单个细胞,以防止黏连细胞干扰;图3-c根据阴性对照设门Q1圈出菌液中的活细胞;图3-d PI染色后的菌液根据阴性对照区分菌液中的死细胞和活细胞。
2.4 诱变育种筛选结果
2.4.1 诱变突变菌株的初筛
借助于流式细胞仪、酶标仪检测器等能够快速、准确地分析并获得菌株,已广泛应用于微生物的高通量筛选[21]。本研究采用ARTP诱变菌株E.adhaerens F3-3,进行2轮诱变。取发酵液按照1.3.2的方法进行处理,通过酶标仪检测处理后液体在361 nm处的吸光度从而筛选出高产维生素B12的菌株,结果如图4所示。通过酶标仪检测361 nm处的吸光值,获得不同生产能力的菌株,从中选出29株生产能力较强的菌株进行后续的复筛。

a-设门P1圈出脱氮假单孢杆菌区域;b-设门P2去除菌株中的黏连细胞;c-根据阴性对照设门圈出活细胞;d-PI染色后设门区分细胞的死活
图3 PI染料染色流式图
Fig.3 Flow cytometry diagram after PI dye staining
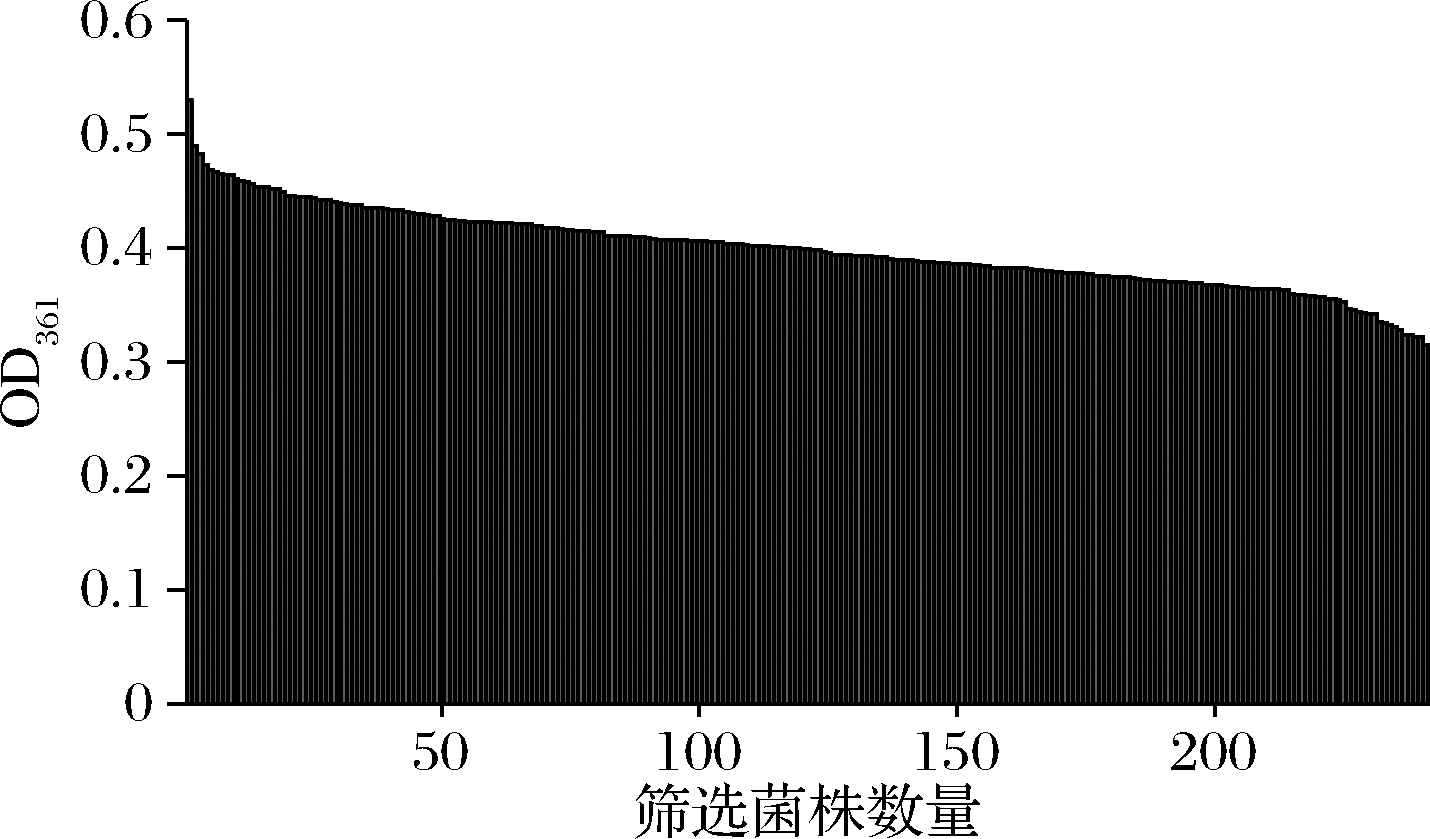
图4 诱变菌株初筛结果
Fig.4 Preliminary screening of mutagenic strains
2.4.2 诱变突变菌株的复筛

图5 诱变菌株复筛产量
Fig.5 Mutagenic strain re-screening yield
将初筛得到的高产菌株重新划线接种发酵培养基进行发酵验证,30 ℃、220 r/min培养180 h后,通过HPLC检测发酵液中维生素B12的产量,经过2轮筛选,获得高产菌株46H-1(图5)。通过遗传稳定性验证后最终产量为110.25 mg/L(表1),产量相较于原始菌株F3-3(88.36 mg/L)提高了24.8%。
表1 突变菌株遗传稳定性分析
Table 1 Analysis of genetic stability of mutant strains

传代次数突变菌株维生素B12产量/(mg·L-1)46H-115B-137A-21117.7±1.08113.8±1.71107.9±2.223107.4±3.06104.8±2.27105.9±0.916110.3±1.20108.3±2.34101.7±1.66
3 讨论与结论
由于维生素B12的生物合成途径复杂,主要是通过诱变育种的方式强化生产。目前,有关维生素B12生产菌株诱变后的快速检测方法较少,利用高效液相色谱等检测方法过于复杂不便于快速检测;同时,由于E.adhaerens所生产的维生素B12有一部分会残留在胞内,因此需要有一个对于菌株快速处理破壁释放维生素B12的方法。本研究应用ARTP诱变对维生素B12工业生产菌株E.adhaerens进行诱变处理,结合流式细胞仪、酶标仪以及移液工作站等仪器对诱变菌株进行分选、检测。由于维生素B12在361 nm处具有吸收峰,同时E.adhaerens所产生的维生素B12会有部分残留在胞内,因此根据这2个特点,构建了对于E.adhaerens的快速高效的破壁方法以及检测方法。通过2轮的ARTP诱变及筛选,获得突变菌株46H-1,产量相较于原始菌株提升了24.8%,经验证,具有较好的遗传稳定性。
[1] MINOT G R,MURPHY W P.Treatment of pernicious anemia by a special diet[J].Jama,1983,250:3 328-3 335.
[2] SMITH E L.Presence of cobalt in the anti-pernicious anaemia factor[J].Nature,1948,162(4 108):144.
[3] 马蕙, 王丽丽,张春晓,等.维生素B12的生物合成、发酵生产与应用[J].生物工程学报,2008,24(6):927-932.
MA H,WANG L L,ZHANG C X,et al.Biosynthesis,fermentation and application of vitamin B12-A review[J].Chinese Journal of Biotechnology,2008,24(6):927-932.
[4] WARREN M J,RAUX E,SCHUBERT H L,et al.The biosynthesis of adenosylcobalamin (vitamin B-12)[J].Natural Product Reports,2002,19(4):390-412.
[5] CHAN C W,MONDRAG N A.Crystal structure of an atypical cobalamin riboswitch reveals RNA structural adaptability as basis for promiscuous ligand binding[J].Nucleic Acids Research,2020,48(13):7 569-7 583.
N A.Crystal structure of an atypical cobalamin riboswitch reveals RNA structural adaptability as basis for promiscuous ligand binding[J].Nucleic Acids Research,2020,48(13):7 569-7 583.
[6] MARSH E N G,PATTERSON D P,LI L,et al.Adenosyl radical:Reagent and catalyst in enzyme reactions[J].Chembiochem,2010,11:604-621.
[7] XIA W,CHEN W,PENG W F,et al.Industrial vitamin B12 production by Pseudomonas denitrificans using maltose syrup and corn steep liquor as the cost-effective fermentation substrates[J].Bioprocess and Biosystems Engineering,2015,38(6):1 065-1 073.
[8] WANG P,ZHANG Z W,JIAO Y J,et al.Improved propionic acid and 5,6-dimethylbenzimidazole control strategy for vitamin B12 fermentation by Propionibacterium freudenreichii[J].Journal of Biotechnology,2015,193:123-129.
[9] THI VU H,ITOH H,ISHII S,et al.Identification and phylogenetic characterization of cobalamin biosynthetic genes of Ensifer adhaerens[J].Microbes and Environments,2013,28(1):153-155.
[10] RYCHEN G,AQUILINA G,AZIMONTI G,et al.Safety and efficacy of vitamin B12 (in the form of cyanocobalamin) produced by Ensifer spp.as a feed additive for all animal species based on a dossier submitted by VITAC EEIG[J].Efsa Journal,2018,16:e05336.
[11] FANG H,LI D,KANG J,et al.Metabolic engineering of Escherichia coli for de novo biosynthesis of vitamin B12[J].Nature Communications,2018,9(1):4 917.
[12] VITRESCHAK A G,RODIONOV D A,MIRONOV A A,et al.Regulation of the vitamin B12 metabolism and transport in bacteria by a conserved RNA structural element[J].RNA,2003,9(9):1 084-1 097.
[13] RATHORE D S,LOPEZ-VERNAZA M A,DOOHAN F,et al.Profiling antibiotic resistance and electrotransformation potential of Ensifer adhaerens OV14;a non-Agrobacterium species capable of efficient rates of plant transformation[J].FEMS Microbiology Letters,2015,362(17):fnv126.
[14] ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology,2014,98(12):5 387-5 396.
[15] ALVAREZ J C.High-throughput docking as a source of novel drug leads[J].Current Opinion in Chemical Biology,2004,8:365-370.
[16] LIANG Y,ZHU Y,FANG Q,et al.Advances in high-throughput,automated techniques and instrumention for protein crystallization screening[J].Chinese Journal of Chromatography,2016,34:1 137-1 144.
[17] DU G S,FANG Q,DEN TOONDER J M J.Microfluidics for cell-based high throughput screening platforms-A review[J].Analytica Chimica Acta,2016,903:36-50.
[18] LUO Z S,ZENG W Z,DU G C,et al.A high-throughput screening procedure for enhancing pyruvate production in Candida glabrata by random mutagenesis[J].Bioprocess abd Biosystems Engineering,2017,40(5):693-701.
[19] CAO X,LUO Z,ZENG W,et al.Enhanced avermectin production by Streptomyces avermitilis ATCC 31267 using high-throughput screening aided by fluorescence-activated cell sorting[J].Applied Microbiology Biotechnolgy,2018,102:703-712.
[20] CAI Y Y,XIA M M,DONG H N,et al.Engineering a vitamin B-12 high-throughput screening system by riboswitch sensor in Sinorhizobium meliloti[J].BMC Biotechnology,2018,18:27.
[21] ZENG W,GUO L,XU S,et al.High-throughput screening technology in industrial biotechnology[J].Trends in Biotechnology,2020,38:888-906.