代谢组学在1998年由OLIVER等首次提出[1],它通过考察生物体系受刺激或扰动后,小分子质量(<1 kDa)代谢物随时间的变化,动态监测整个生物体系代谢进程[2]。现如今已被广泛应用于临床医学、中药研究和食品科学等研究领域[3-5]。
近年来,随着人们生活质量的提高和健康意识的增强,越来越多的消费者开始注重营养与健康,风味优良且营养丰富的发酵乳迎来了更广阔的市场。嗜热链球菌是一种广泛应用于酸奶和奶酪发酵的微生物,在牛奶中具有良好的适应性,该特性在其基因组信息中也得到了证实[6]。嗜热链球菌可在发酵过程中产生乙醛、双乙酰、胞外多糖等次级代谢物,这些小分子物质能够有效改善发酵乳的风味和质地,并赋予发酵乳抗菌、抗氧化和提高机体免疫力等功效[7]。尽管研究表明服用益生菌发酵乳对人体健康有益,但发酵过程复杂且难以控制,无法确定发挥营养功效的具体活性物质[8],且对发酵剂菌株的代谢特性也知之甚少。因此,基于代谢组学技术监测发酵过程中代谢产物的变化对于生产具有良好营养和感官品质的发酵乳制品及乳酸菌发酵剂的开发利用具有重要意义。
本研究选用分离自甘肃省玛曲县曲拉中的嗜热链球菌S4作为发酵菌株,采集发酵前期(3 h,pH=6.39)、发酵中期(7 h,pH=5.12)、发酵后期(9 h,pH=4.53)的发酵乳样品,基于超高效液相色谱-四极杆飞行时间质谱联用技术(ultra-performance liquid chromatography-quadrupole-time-of-flight-mass spectrometry,UPLC-Q-TOF-MS),对不同发酵阶段发酵乳中差异代谢物进行研究,从代谢组学层面揭示该菌株发酵过程中的代谢特性,并对发酵乳营养价值进行评估,为嗜热链球菌S4产业化生产及发酵乳品质控制提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种
嗜热链球菌S4(Streptococcus thermophilus S4)由内蒙古农业大学乳酸菌菌种资源库提供。
1.1.2 主要试剂
色谱级乙腈、甲酸、氨水,美国Sigma公司;异亮氨酸脑啡肽,美国Waters公司;脱脂乳粉,恒天然商贸(上海)有限公司。
1.1.3 主要仪器
超高效液相色谱-四级杆飞行时间质谱仪(ACQUITY UPLC/Xevo G2 QTOF),美国Waters公司。
1.2 实验方法
1.2.1 发酵乳制备
10%脱脂乳粉和6.5%白砂糖混匀(均为质量分数),溶于预热至60 ℃的蒸馏水中,完全溶解后,静置水合30 min,95 ℃、10 min杀菌后冷却至42 ℃。嗜热链球菌S4按5.0×106 CFU/mL接种量接种,37 ℃恒温培养箱中培养至pH降至4.5时终止发酵。
1.2.2 UPLC-Q-TOF MS分析
1.2.2.1 样品前处理
取3 mL发酵乳样品,与乙腈溶液以3∶1的体积比均匀混合,10 000×g离心10 min;吸取2 mL上清液,与乙腈溶液再以1∶3的体积比混合,振荡均匀,4 ℃静置2 h;12 000×g离心5 min后取上清液蒸发浓缩至干;体积分数40%乙腈溶液复溶,经0.22 μm微孔滤膜过滤至上样瓶中,上机测定。9份发酵乳各取2 mL混于50 mL离心管内,与待测样品以同样的方式进行处理后作为质量控制样品。
1.2.2.2 色谱、质谱条件
选用Acquity UPLC®HSS C18色谱柱,设置柱温45 ℃,样品室温度10 ℃,流速0.3 mL/min,进样量5 μL。正离子模式扫描下:流动相A为H2O+0.1%甲酸,B为乙腈+0.1%甲酸;负离子模式扫描下:流动相A为H2O+0.1% NH4·OH溶液,B为纯乙腈,梯度洗脱条件见表1[9]。
采用ESI源正离子(ESI+)与负离子(ESI-)模式扫描,扫描范围设定在m/z 50~1 000。采用质量浓度为2 μg/L的异亮氨酸脑啡肽进行实时质量校正,正离子模式下锁定质量数m/z 556.277 1,负离子模式下锁定质量数m/z 554.261 5。设定毛细管电压2.5 kV、样品锥孔电压40 kV、源温100 ℃、脱溶剂气温度350 ℃、锥孔气流速50 h/L和脱溶剂气流速600 h/L[10]。
表1 流动相梯度洗脱条件
Table 1 Mobile phase gradient elution conditions

时间/min流速/(mL·min-1)流动相A/%流动相B/%0.4598.02.00.250.4598.02.012.000.452.098.014.000.452.098.014.100.4598.02.017.000.4598.02.0
1.2.2.3 数据处理及多元统计分析
UPLC-QTOF MS获得的原始数据经转化及预处理后,使用MetaboAnalyst 4.0在线软件进一步对数据进行标准化处理,使数据更具可比性。模式识别分析采用SIMCA 14.0软件完成,最终结合P<0.05,变量投影重要性(variable importance in the projection,VIP)≥1以及两组间的差异倍数≥2等条件筛选获得差异代谢物,并使用MetaboAnalyst 4.0结合KEGG数据库进行代谢通路分析。
2 结果与分析
2.1 嗜热链球菌S4发酵乳代谢组学分析
2.1.1 数据质控分析
质量控制在大规模代谢组学研究中具有重要作用,通常通过分析质控样本随时间变化情况来评估代谢组学数据的质量及仪器的稳定性。图1-a、图1-b分别为正负离子扫描模式下所有质控样本的变化趋势,不难看出所有的质控样品变化均很小(<±2SD)。图1-c、图1-d中,全部质量控制样品聚为一簇,且与受试样品有明显区分,进一步证明数据采集过程中试验条件合理且仪器稳定性好。
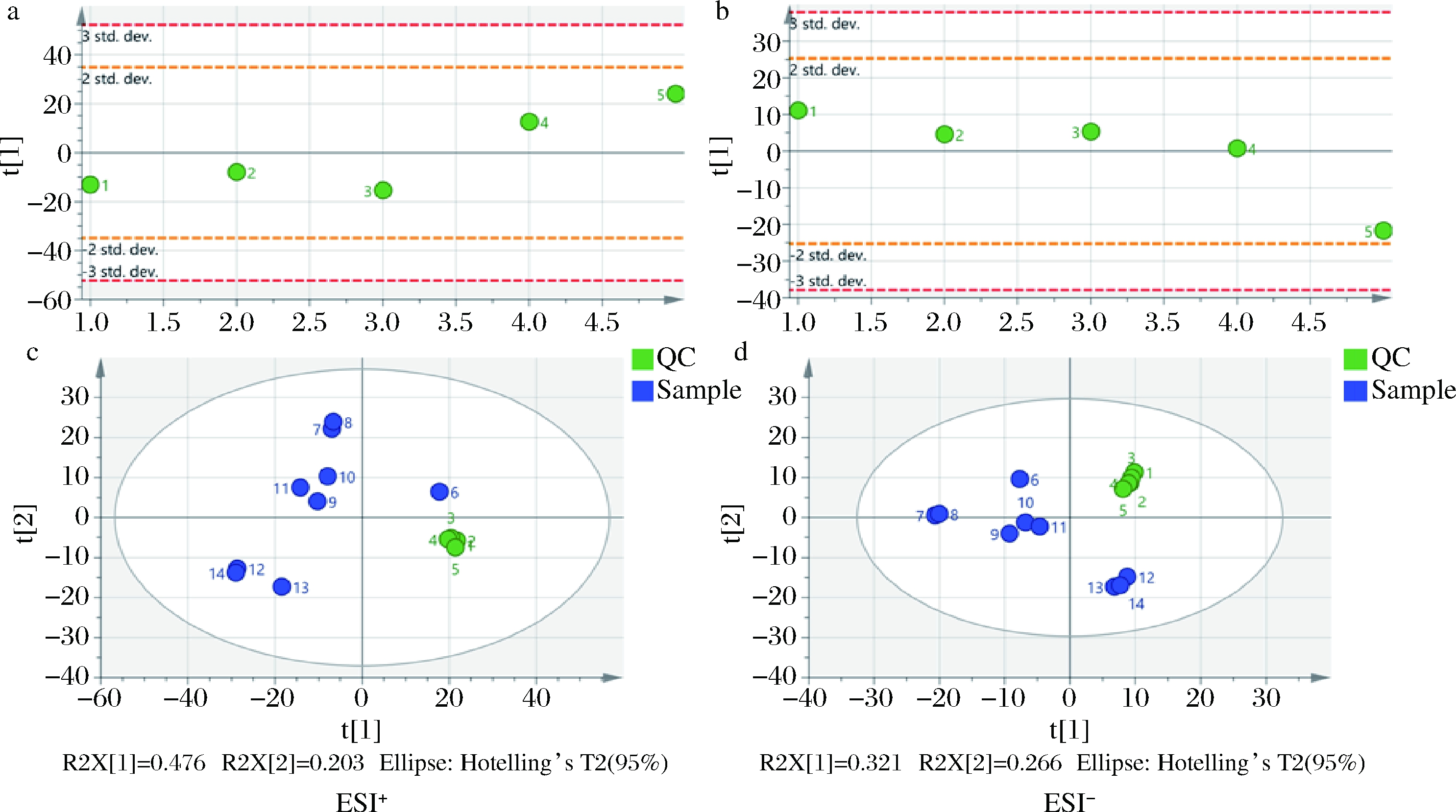
a-ESI+质控样本的变化趋势图;b-ESI-质控样本的变化趋势;c- ESI+主成分分析图;d-ESI-主成分分析图
图1 质控样本评估
Fig.1 Assessment of quality control sample
2.1.2 嗜热链球菌S4发酵乳主成分分析
本研究利用主成分分析方法,通过将多维数据转化成几个综合主成分来评估样品的分组情况。由图2可知,所有质量控制样本聚集成一簇,说明数据采集过程中仪器及试验条件稳定,所得数据准确可靠。不同发酵阶段发酵乳样品组内聚集紧凑,距离较小,说明测定结果重复性较好。且不同发酵阶段发酵乳样品组间区分明显,距离较大,说明不同发酵阶段发酵乳样品具有明显差异,随着发酵时间的延长,发酵乳体系内代谢物发生明显变化。
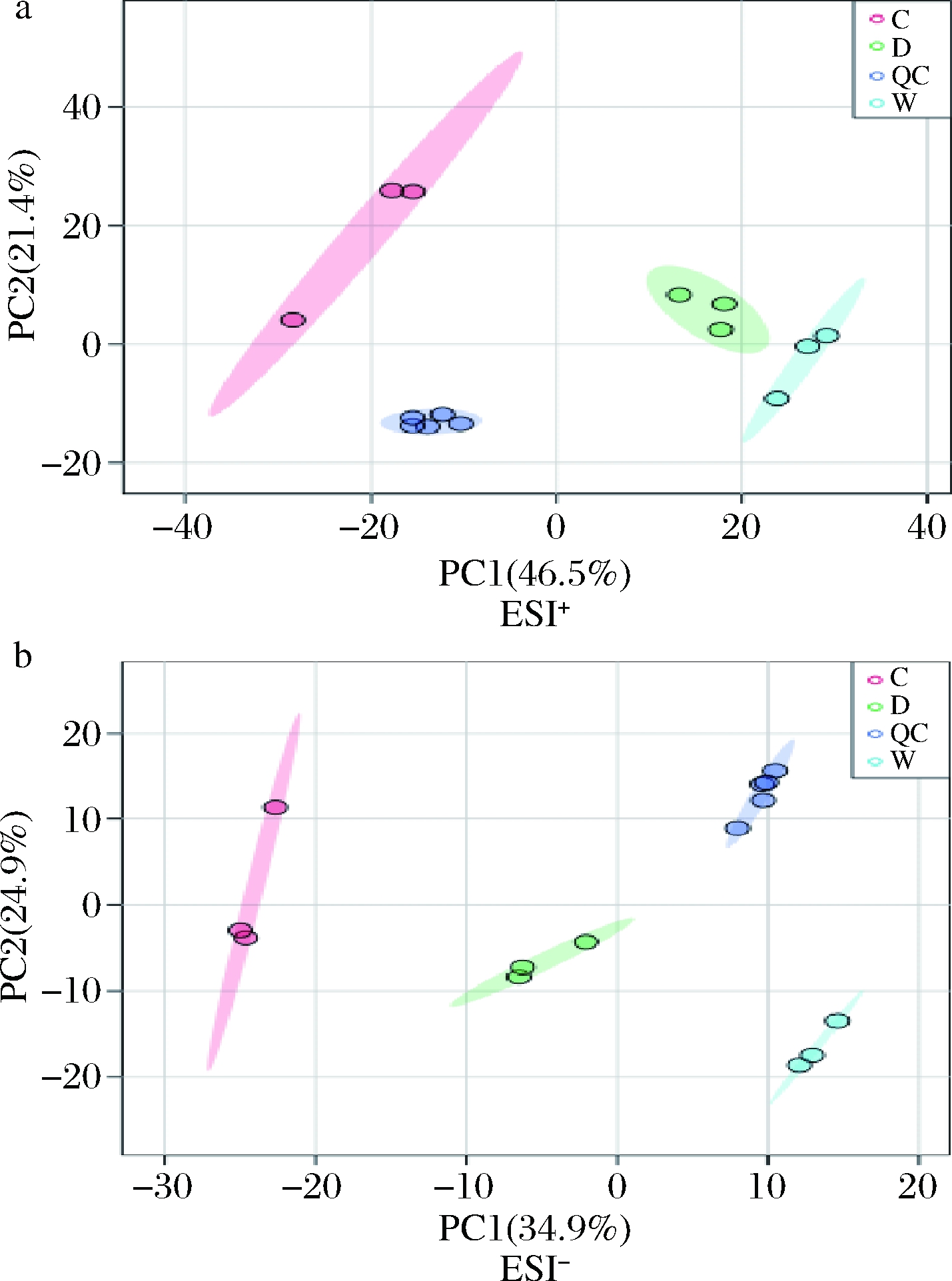
a-ESI+;b-ESI-
C-发酵前期;D-发酵中期;W-发酵后期;QC-质控样本(下同)
图2 不同发酵阶段发酵乳的主成分得分图
Fig.2 PCA score plots of fermented milk at different fermentation stages
2.1.3 嗜热链球菌S4发酵乳正交偏最小二乘判别分析
为准确获得两组间差异代谢物,本研究又采用正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)有监督的判别方法对不同发酵阶段发酵乳进行分析。由图3、图4和图5可知,正负离子模式下,发酵前期、发酵中期和发酵后期每两组间分离效果良好。OPLS-DA具体参数结果如下,图3-a:Q2=0.968,R2Y=0.999;图4-a:Q2=0.992,R2Y=1.000;图5-a:Q2=0.988,R2Y=1.000(本文仅提供具有代表性的正离子模式结果)。其中Q2表示该模型的预测能力,R2Y表示该模型的解释能力,Q2和R2Y越接近1表示模型越可信,越理想。本试验中各模型的解释率和预测率均在0.9以上,表明模型建立成功,具有指导意义。在S-plot中,每个小黑点代表1个变量,离原点越远的变量贡献越大,差异越明显,越有可能成为潜在生物标记物。图中小红框标出代谢物的VIP值≥1,这些物质将进一步结合差异倍数和显著性差异参数进行再次筛选。
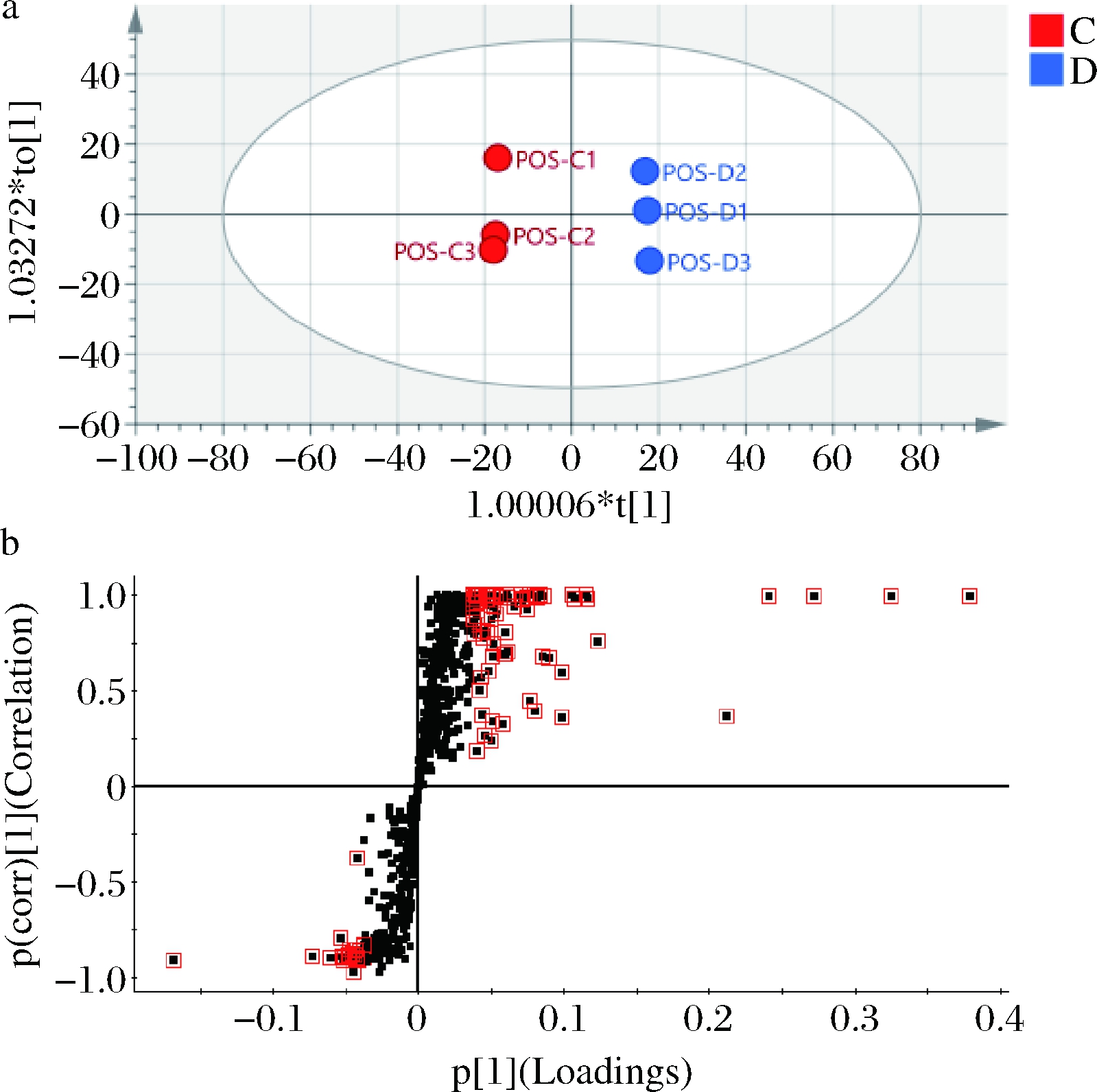
a-OPLS-DA图;b-S-plot
图3 发酵前期VS发酵中期OPLS-DA图和S-plot图
Fig.3 OPLS-DA plot and S-plot of pre-fermentation phase VS mid-fermentation phase
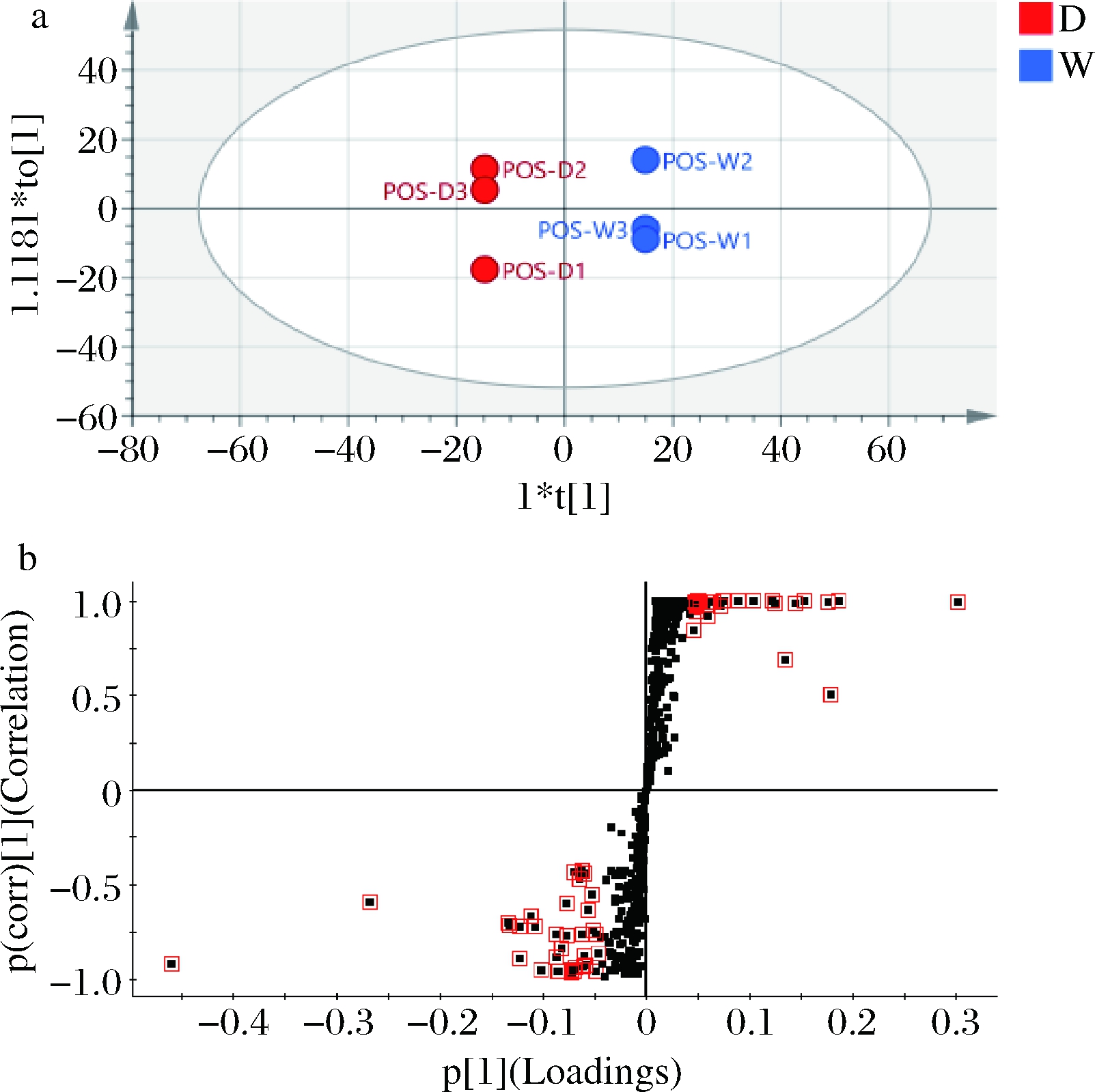
a-OPLS-DA图;b-S-plot
图4 发酵中期VS发酵后期OPLS-DA图和S-plot图
Fig.4 OPLS-DA plot and S-plot of mid-fermentation phase VS end-fermentation phase
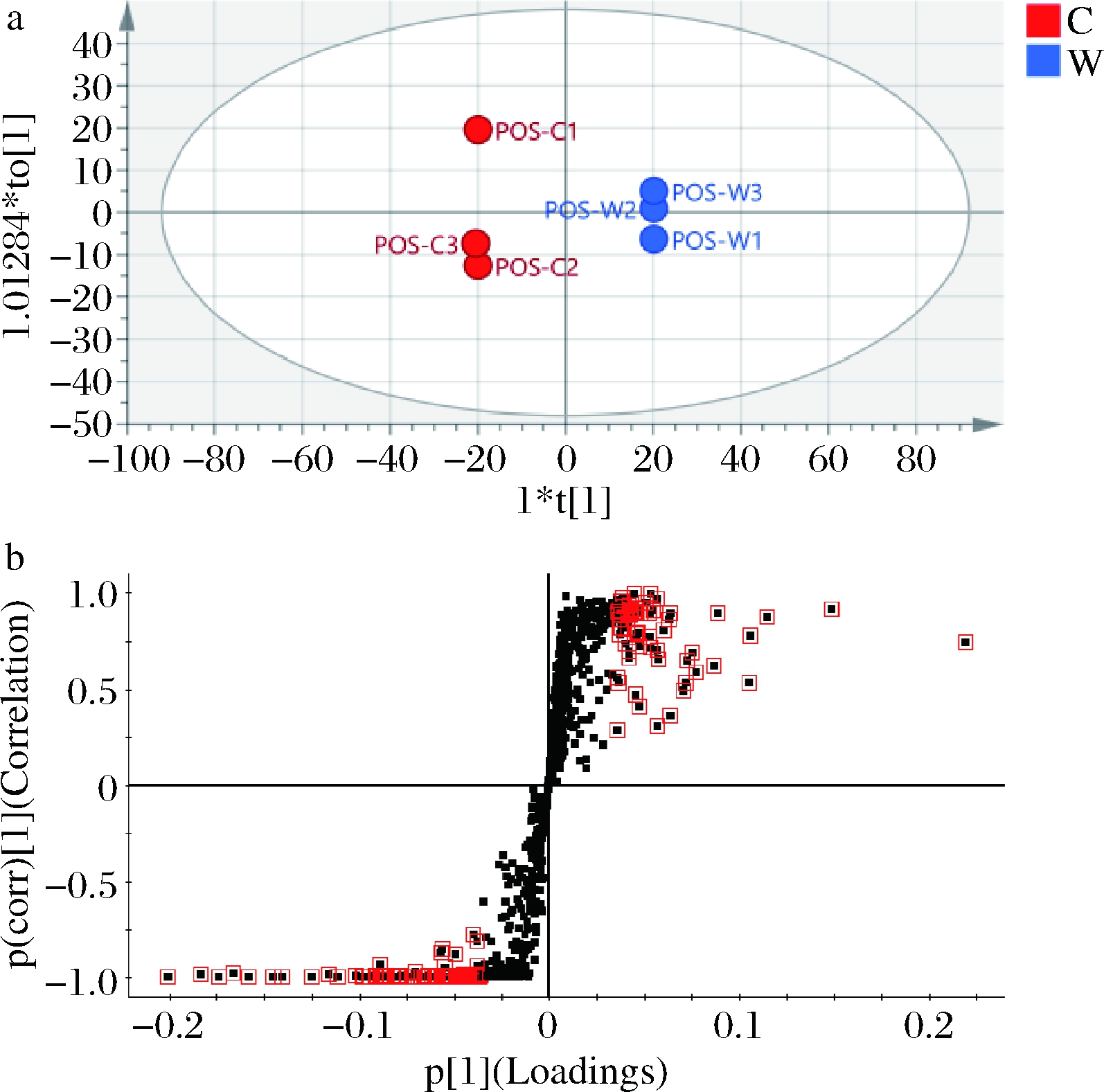
a-OPLS-DA图;b-S-plot
图5 发酵前期VS发酵后期OPLS-DA图和S-plot图
Fig.5 OPLS-DA plot and S-plot of pre-fermentation phase VS end-fermentation phase
值得一提的是,OPLS-DA极易出现所创模型过度拟合的情况,因此需要对模型可靠性进行验证。验证方法为将原本的分组标签去除并打乱,随机置换200次得到置换检验图。置换检验得到的回归直线与Y轴的截距可作为评估模型是否过拟合的标准。通常R2的截距应明显小于模型变量的解释度,Q2的截距也应该明显小于预测度,即回归直线的斜率>1。由图6可知,3个模型中回归直线的斜率均>1,说明本次试验数据不存在过度拟合。且Q2与Y轴的截距小于0,说明模型稳健,结果可信度高。
2.1.4 嗜热链球菌S4发酵乳差异代谢物鉴定结果
高通量的代谢组学数据分析和功能解释仍是目前限制非靶向代谢组学技术的主要因素,为了获得尽可能准确的差异代谢物,本研究使用MetaboAnalyst 4.0在线软件中的MS Peaks to Pathway模块实现了从质谱峰直接预测生物功能活性,该方法绕过了主观鉴定差异代谢物环节,使预测结果更可靠[11]。并在此基础上结合VIP≥1,差异倍数≥2,P<0.05等基本筛选原则共同确定不同发酵阶段发酵乳的差异代谢物,鉴定结果见表2、表3和表4。
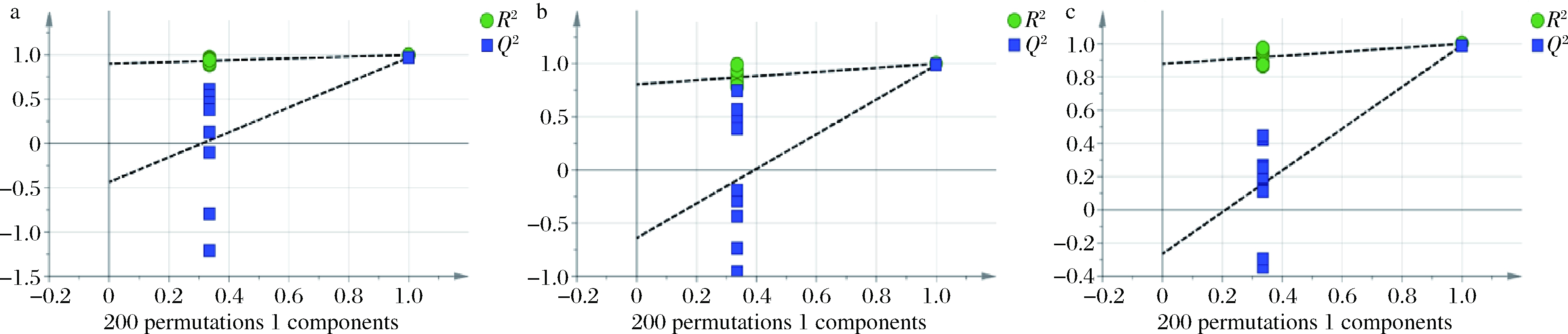
a-发酵前期 VS 发酵中期;b-发酵中期 VS 发酵后期;c-发酵前期 VS 发酵后期
图6 不同比较组间的置换检验分析
Fig.6 The permutation test analysis between different comparison group
表2 发酵前期和发酵中期差异代谢物
Table 2 Significantly different metabolites between pre-fermentation phase and mid-fermentation phase

质荷比(m/z)保留时间/min分子式代谢物名称P值VIP值差异倍数150.053 30.93C6H11NO24-乙酰氨基丁醛5.1E-121.791 8614.361307.031 40.75C7H15N2O8P甘氨酰胺核苷酸1.12E-061.767 9814.328271.021 11.44C7H15O10P7-磷酸景天庚酮糖0.000 3741.788 4814.382321.049 71.24C9H14N2O12P2尿苷二磷酸0.000 4671.215 1715.364121.0651.61C9H8O3苯丙酮酸2.59E-101.940 6716.681889.220 88.21C42H44FeN4O16西罗红血素4.11E-091.915 2416.644120.081 22.44C9H11NO2L-苯丙氨酸8.72E-091.894 3416.611187.107 94.13C8H12N2O2吡哆胺5.96E-071.789 1416.45120.081 73.13C5H11NO2甜菜碱7.63E-061.801 0716.466183.025 51.03C5H14NO胆碱1.94E-071.749 97-14.298
表3 发酵中期和发酵后期差异代谢物
Table 3 Significantly different metabolites between mid-fermentation phase and end-fermentation phase

质荷比(m/z)保留时间/min分子式代谢物名称P值VIP值差异倍数307.031 40.75C7H15N2O8P甘氨酰胺核苷酸0.000 8431.200 0311.132147.076 54.16C5H10N2O3L-谷氨酰胺1.58E-091.646 8313.527133.060 93.98C4H8 N2O3L-天门冬酰胺4.00E-091.624 7713.494
续表3

质荷比(m/z)保留时间/min分子式代谢物名称P值VIP值差异倍数274.092 34.17C10H13N5O3脱氧核苷5.25E-091.632 913.506120.081 22.44C9H11NO2L-苯丙氨酸6.29E-091.700 411.735215.139 33.92C10H18N2O3脱硫生物素2.47E-082.220 4713.488129.102 24.19C6H14N2O2L-赖氨酸9.89E-081.600 9813.458146.060 53.52C9H11NO3酪氨酸0.000 1681.081 811.501889.220 88.21C42H44FeN4O16西罗红血素0.000 2911.720 0311.933321.049 71.24C9H14N2O12P2吡哆胺0.000 454 341.610 0811.892121.0651.61C9H8O3苯丙酮酸0.001 112 31.050 911.369120.081 73.13C5H11NO2甜菜碱0.001 942 31.472 4512.356281.071.19C11H15N5O3S甲硫腺苷0.005 0371.128 5311.622241.038 52.95C11H12N2O2色氨酸7.71E-081.794 61-12.259363.087 51.08C13H18N4O66,7-二甲基-8-核糖醇基-2,4-二氧四氢蝶啶0.000 7711.136 7-10.974
表4 发酵前期和发酵后期差异代谢物
Table 4 Significantly different metabolites between pre-fermentation phase and end-fermentation phase

质荷比(m/z)保留时间/min分子式代谢物名称P值VIP值差异倍数307.031 40.75C7H15N2O8P甘氨酰胺核苷酸3.04E-101.577 8415.584150.053 30.93C6H11NO24-乙酰氨基丁醛3.09E-091.515 5715.468194.043 10.93C7H11NO42-乙酰氨基-5-氧戊酸5.93E-071.507 9615.455187.107 94.13C8H12N2O2吡哆胺2.22E-111.610 0813.422731.683 65.61C55H90O去甲肾上腺素1.21E-091.670 913.529147.076 54.16C5H10N2O3L-谷氨酰胺2.92E-091.646 8313.487121.0651.61C9H8O3苯丙酮酸4.99E-091.718 5813.61133.060 93.98C4H8 N2O3L-天冬酰胺7.61E-091.624 7713.448120.081 22.44C9H11NO2L-苯丙氨酸9.43E-091.700 413.559274.092 34.17C10H13N5O3脱氧腺苷9.88E-091.632 913.463120.081 73.13C5H11NO2甜菜碱1.03E-081.660 213.51889.220 88.21C42H44FeN4O16西罗红血素1.94E-081.720 0313.613215.139 33.92C10H18N2O3脱硫生物素4.72E-081.620 413.441129.102 24.19C6H14N2O2L-赖氨酸1.95E-071.600 9813.406261.028 31.00C9H11N2O8P2',3'-环尿酸2.46E-051.624 2813.453321.049 71.24C9H14N2O12P2尿苷二磷酸0.000 109 431.243 612.691146.060 53.52C9H11NO3酪氨酸0.004 477 51.081 812.357188.070 93.53C11H12N2O2色氨酸0.004 8471.032 0812.227281.071.19C11H15N5O3S甲硫腺苷0.006 3391.018 2612.2179.056 41.3C6H12O6D-半乳糖1.27E-071.599 21-15.623183.025 51.03C5H14NO胆碱1.94E-071.494 78-15.428699.377 44.83C35H60O7P2七戊二烯二磷酸1.02E-051.482 97-15.408363.087 51.08C13H18N4O66,7-二甲基-8-核糖醇基-2,4-二氧四氢蝶啶6.10E-051.008 15-14.301
由表2~表4可知,发酵过程中,维生素类吡哆胺含量一直显著增加,脱硫生物素含量发酵中期开始显著增加。人体必需氨基酸类L-苯丙氨酸含量一直显著增加,L-赖氨酸和色氨酸含量发酵中期开始显著增加,其他氨基酸类L-谷氨酰胺、L-天冬酰胺和酪氨酸含量发酵中期开始显著增加。由此可见,氨基酸代谢主要发生在发酵中后期。除此之外,D-半乳糖、胆碱、6,7-二甲基-8-核糖醇基-2,4-二氧四氢蝶啶(DRL)等含量呈现下降趋势。
2.1.5 嗜热链球菌S4发酵乳代谢通路富集分析
利用MetaboAnalyst 4.0中的Enrichment Analysis模块,对表2~表4鉴定到的差异代谢物进行代谢通路富集分析。由图7可知,发酵前期为乳酸菌生长迟滞期,产生的代谢物较少,因此涉及到的代谢通路较少;发酵后期代谢过程复杂,产生的代谢物质较多,涉及的代谢通路也相对较多。代谢通路主要集中在苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙氨酸代谢,磷酸戊糖途径,维生素B6代谢,半乳糖代谢等代谢途径。
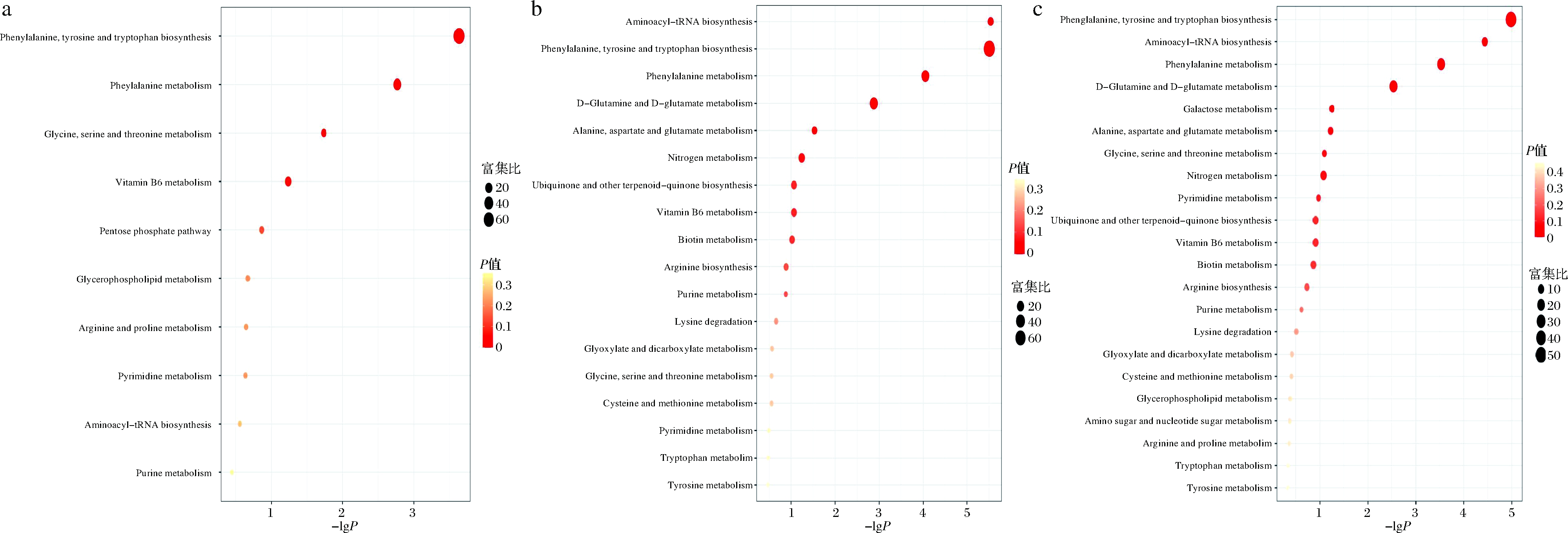
a-发酵前期 VS 发酵中期;b-发酵中期 VS 发酵后期;c-发酵前期 VS 发酵后期
图7 不同比较组间的差异代谢物富集分析
Fig.7 The enrichment analysis of differencial metabolites between different comparison group
3 讨论
3.1 维生素
本研究中,吡哆胺和脱硫生物素含量显著增加,DRL含量显著下降。维生素B6包括吡哆醇、吡哆胺和吡哆醛3种形式,在生物体内三者可以相互转化[12]。3种化合物的磷酸酯都具有生物活性,在氨基酸代谢中具有重要作用,醛亚胺中间复合物起到中间枢纽作用。脱硫生物素是合成生物素所必须的前体物质,转化过程中硫原子由生物素合成酶的Fe-S簇提供[13]。生物素在高等动物新陈代谢过程中不可或缺,但无法自身合成,只能通过自身微生物合成或从食物中获得[14],生物素广泛存在于牛奶、肝、谷类、蔬菜等食物中。DRL是核黄素合成的直接前体物质,2分子DRL可通过歧化反应生成核黄素。有研究表明乳酸乳球菌和发酵乳杆菌等乳酸菌可以生物合成核黄素[15-16],该物质具有重要生理功能,是保证机体正常代谢的必需物质。
3.2 碳水化合物
嗜热链球菌可代谢利用多种碳水化合物,但对乳糖的偏好性最强[17]。乳糖是牛乳中主要的碳水化合物,乳糖不耐症患者因体内缺少乳糖酶,不能分解利用乳糖,而引起腹泻、胀气等不良反应。发酵乳中乳酸菌能够利用乳糖产生乳酸,满足乳糖不耐症患者对牛乳的营养需求[18]。本研究中,D-半乳糖含量有所下降,这是因为乳糖在乳糖酶的作用下分解为半乳糖,半乳糖经转化生成1-磷酸葡萄糖和UDP-半乳糖,随后进入糖酵解途径产生能量。D-半乳糖是广泛存在于哺乳动物乳汁中,但有研究发现长期D-半乳糖诱导的小鼠会出现寿命缩短、神经损伤、认知能力下降等症状[19]。由此可见,嗜热链球菌S4具有降解牛乳中潜在有害物质的作用。7-磷酸景天庚酮糖是磷酸戊糖途径的中间体,嗜热链球菌是兼性厌氧菌,非氧化反应阶段,5-磷酸核酮糖又转变为5-磷酸核糖和5-磷酸木酮糖。在转酮酶的作用下,2分子5-磷酸核糖和2分子5-磷酸木酮糖反应生成7-磷酸景天庚酮糖[20]。NAGY等[21]认为7-磷酸景天庚酮糖是磷酸戊糖途径中的重要中间产物,起到糖酵解和磷酸戊糖途径交界处碳通量变阻器作用。
3.3 氨基酸
嗜热链球菌因具有细胞壁蛋白酶基因PrtS,能够利用蛋白水解系统水解牛乳中的酪蛋白为肽类及氨基酸,供机体生理代谢需要。此外,一些氨基酸还可进一步转化为醛酮类等风味物质,游离氨基酸的种类和数量对酸奶的品质和风味具有重要影响[22]。本研究中L-苯丙氨酸、L-赖氨酸和色氨酸等人体必需氨基酸含量均显著增加。由此可见,嗜热链球菌S4发酵乳是补充人体必需氨基酸的良好来源。黄珊[23]基于转录组学和代谢组学对嗜热链球菌TF96氨基酸代谢机制进行了研究,结果表明大部分常见氨基酸浓度呈现上升趋势,与本研究结果一致。此外,苯丙氨酸可经转氨反应生成苯丙酮酸,发酵过程中苯丙酮酸含量呈现上升趋势,苯丙酮酸进一步在脱氢酶的作用下还原为苯乳酸,大量文献证明植物乳杆菌能够代谢产生苯乳酸[24-26]。苯乳酸是一种天然广谱生物抑菌剂,其因生物合成反应条件温和且副产物少而逐渐引起了人们的关注。它不仅可以延长发酵乳制品的货架期,还可抑制人体内致病菌生长,现已被广泛应用于食品、医药等领域[27]。
酪氨酸含量从发酵中期开始显著增加,酪氨酸通过儿茶酚胺途径经左旋多巴脱羧酶和β-羟化酶作用生成去甲肾上腺素[23],因而发酵后期去甲肾上腺素含量升高。去甲肾上腺素是一种重要的单胺类神经递质,参与多项生理过程,可用于治疗急性心肌梗塞或体外循环术后引起的低血压等[28]。发酵乳中氨基酸的种类及数量被认为是评估产品营养质量的重要指标,KANG等[8]基于LC-MS技术对发酵大豆食品(meju)发酵过程中的代谢物变化进行全面研究,共鉴定出包括赖氨酸、谷氨酰胺、色氨酸等在内的22个潜在生物标记物,并提出了初步的meju发酵代谢途径。
3.4 其他代谢产物
胆碱是认知发育、新陈代谢、肝功能和同型半胱氨酸代谢调节的重要营养素,是合成神经递质、乙酰胆碱、甜菜碱和磷脂的必需物质。胆碱可在人体肝脏中少量合成,但不足以满足人体需要,必须由食物供给[29]。本研究中胆碱含量降低,甜菜碱含量增加,说明发酵过程激发了渗透调节机制,胆碱不可逆的氧化为甜菜碱。该结果与DILGER等[30]的研究结果一致,胆碱的减少量用于甜菜碱的合成。甜菜碱是一种渗透剂和甲基供体,具有调节细胞体积和组织完整性、维持水分平衡等作用[31-32]。作为甲基供体,甜菜碱通过甜菜碱-同型半胱氨酸S-甲基转移酶作用使同型半胱氨酸再甲基化为蛋氨酸和二甲基甘氨酸,二甲基甘氨酸进一步去甲基化产生肌氨酸,随后被代谢为甘氨酸,导致碳单元转入叶酸库[33]。有研究表明甜菜碱可抑制急性肝衰竭小鼠的Toll样受体4反应并有助于恢复肠道菌群[34]。
4 结论
本研究基于UPLC-QTOF MS技术,通过主成分分析和OPLS-DA并结合数据库检索及质谱信息匹配,从代谢组学层面系统分析嗜热链球菌S4在牛乳中的代谢特性。发酵过程中,共筛选出包括7-磷酸景天庚酮糖、吡哆胺、赖氨酸、色氨酸等在内的24个差异代谢物。主要涉及碳水化合物代谢、氨基酸代谢、维生素代谢等多条代谢途径。嗜热链球菌S4在发酵过程中产生的差异代谢物多为氨基酸、维生素、胆碱等初级代谢产物,其种类和含量对发酵乳的风味质地及营养益生特性具有积极作用。由此可见,该菌株可作为潜在发酵剂用于乳制品的生产中。
[1] OLIVER S G,WINSON M K,KELL D B,et al.Systematic functional analysis of the yeast genome[J].Trends in Biotechnology,1998,16(9):373-378.
[2] 戴媛. 大豆多肽TTYY的抗氧化功能及其代谢组学研究[D].长春:吉林大学,2017.
DAI Y.Studies on antioxidant function and its metabonomics of soybean polypeptide TTYY[D].Changchun:JiLin University,2017.
[3] WASILEWSKA E,ZLOTKOWSKA D,WROBLEWSKA B.Yogurt starter cultures of Streptococcus thermophilus and Lactobacillus bulgaricus ameliorate symptoms and modulate the immune response in a mouse model of dextran sulfate sodium-induced colitis[J].Journal of Dairy Science,2019,102(1):37-53.
[4] ZHANG Y,SHI J F,FEI Q Q,et al.Plasma and urine metabonomics coupled with UPLC-Q-TOF/MS and multivariate data analysis on potential biomarkers in anemia and hematinic effects of steamed notoginseng[J].Phytochemistry Letters,2020,38:55-64.
[5] 李震宇, 崔伊凡,秦雪梅.中药材质量评价的挑战与代谢组学应用于中药材质量评价的研究进展[J].中草药,2018,49(10):2 221-2 229.
LI Z Y,CUI Y F,QIN X M.Challenge of quality evaluation of traditional Chinese medicinal materials and application progress on metabolomic approach in its quality valuation[J].Chinese Traditional and Herbal Drugs,2018,49(10):2 221-2 229.
[6] GOH Y J,GOIN C,HUTKINS R,et al.Specialized adaptation of a lactic acid bacterium to the milk environment:the comparative genomics of Streptococcus thermophilus LMD-9[J].Microbial Cell Factories,2011,10(S1):S22.
[7] RASMUSSEN T B,DANIELSEN M,VALINA O,et al.Streptococcus thermophilus core genome:comparative genome hybridization study of 47 strains[J].Applied and Environmental Microbiology,2008,74(15):4 703-4 710.
[8] KANG H J,YANG H J,KIM M J,et al.Metabolomic analysis of meju during fermentation by ultra performance liquid chromatography-quadrupole-time of flight mass spectrometry (UPLC-Q-TOF MS)[J].Food Chemistry,2011,127(3):1 056-1 064.
[9] 李丹阳,郑岩,张文羿,等.嗜热链球菌S10发酵乳贮藏期间的代谢组学研究[J].中国食品学报,2020,20(11):185-192.
LI D Y,ZHENG Y,ZHANG W Y,et al.Metabolomics analysis of S.thermophilus S10 fermented milk during storage[J].Journal of Chinese Institute of Food Science and Technology,2020,20(11):185-192.
[10] 米智慧.基于液质联用技术瑞士乳杆菌H9发酵乳代谢组学特性研究[D].呼和浩特:内蒙古农业大学,2018.
MI ZH.Study on the metabolomics of fermented milk of Lactobacillus helveticus H9 based on LC-MS[D].Hohhot:Inner Mongolia Agricultural University,2018.
[11] CHONG J,WISHART D S,XIA J.Using metaboanalyst 4.0 for comprehensive and integrative metabolomics data analysis[J].Current Protocols in Bioinformatics,2019,68(1):e86.
[12] ÇATAK J,ÇAMAN R,CEYLAN Z.Critical vitamin assessment:Pyridoxal,pyridoxamine,and pyridoxine levels for three species of raw and cooked fish samples[J].Journal of Aquatic Food Product Technology,2020,29(10):981-989.
[13] MARQUET A,FLORENTIN D,PLOUX O,et al.In vivo formation of C-S bonds in biotin.An example of radical chemistry under reducing conditions[J].Journal of Physical Organic Chemistry,1998,11(8-9):529-535
[14] 侯朝. 脱硫生物素合成酶抑制剂的设计、合成与生物活性[D].咸阳:西北农林科技大学,2017.
HOU C.Design,sythesis and evaluation of dethiobiotin synthetase inhibitors[D].Xianyang:Northwest A&F University,2017.
[15] BURGESS C,O’CONNELL M M,SYBESMA W,et al.Riboflavin production in Lactococcus lactis:Potential for in situ production of vitamin-enriched foods[J].Applied and Environmental Microbiology,2004,70(10):5 769-5 777.
[16] THAKUR K,TOMAR S K,DE S.Lactic acid bacteria as a cell factory for riboflavin production[J].Microbial Biotechnology,2016,9(4):441-451.
[17] LIU G F,QIAO Y L,ZHANG Y J,et al.Metabolic profiles of carbohydrates in Streptococcus thermophilus during pH-controlled batch fermentation[J].Frontiers in Microbiology,2020,11:1131.
[18] 钟燕, 黄承钰,阴文娅,等.益生菌和酸奶对乳糖不耐受者的作用研究[J].营养学报,2005,27(5):401-405.
ZHONG Y,HUANG C Y,YIN W Y,et al.Effects of probiotics and yoghurt on lactose intolerance[J].Acta Nutrimenta Sinica,2005,27(5):401-405.
[19] YU C C,HE C,DU Y J,et al.Preventive electroacupuncture reduces cognitive deficits in a rat model of D-galactose-induced aging[J].Neural Regeneration Research,2021,16(5):916-923.
[20] 刘俊梅, 王辉,李琢伟,等.赤藓糖醇合成途径及关键酶的研究进展[J].粮油加工(电子版),2015(5):58-61;65.
LIU J M,WANG H,LI Z W,et al.Research progress of erythritol biosynthetic pathway and key enzymes[J].Cereals and Oils Processing (Electronic Version),2015(5):58-61;65.
[21] NAGY C,HASCHEMI A.Sedoheptulose kinase regulates cellular carbohydrate metabolism by sedoheptulose 7-phosphate supply[J].Biochemical Society Transactions,2013,41(2):674-680.
[22] 白凤翎, 张柏林,赵宏飞.乳酸菌蛋白代谢研究进展[J].食品科学,2010,31(19):381-384.
BAI F L,ZHANG B L,ZHAO H F.Progress in protein metabolism of lactic acid bacteria[J].Food Science,2010,31(19):381-384.
[23] 黄珊. 基于转录组学与代谢组学的Streptococcus thermophilus TF96氨基酸代谢机制研究[D].哈尔滨:东北农业大学,2017.
HUANG S.Integrating transcriptomics and metabolomics to reveal metabolism of amino acid of Streptococcus thermophilus TF96[D].Harbin:Northeast Agricultural University,2017.
[24] LI M H,MENG X M,SUN Z Y,et al.Effects of NADH availability on 3-phenyllactic acid production by Lactobacillus plantarum expressing formate dehydrogenase[J].Current Microbiology,2019,76(6):706-712.
[25] WU W Y,DENG G,LIU C J,et al.Optimization and multiomic basis of phenyllactic acid overproduction by Lactobacillus plantarum[J].Journal of Agricultural and Food Chemistry,2020,68(6):1 741-1 749.
[26] ZHENG Z J,MA C J,GAO C,et al.Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J].Plos One,2011,6(4):e19030.
[27] MU W M,YU S H,ZHU L J,et al.Recent research on 3-phenyllactic acid,a broad-spectrum antimicrobial compound[J].Applied Microbiology and Biotechnology,2012,95(5):1 155-1 163.
[28] 崔勤, 赵荣,郑霄,等.去甲肾上腺素等在救治体外循环术后循环功能衰竭患者中的作用[J].第四军医大学学报,2005,26(18):1 702-1 704.
CUI Q,ZHAO R,ZHENG X,et al.Effectiveness of norepinephrine on patients with circulation function failure following extracorporeal circulation operation[J].Journal of the Fourth Military Medical University,2005,26(18):1 702-1 704.
[29] WALLACE T C,BLUSZTAJN J K,CAUDILL M A,et al.Choline:the underconsumed and underappreciated essential nutrient[J].Nutrition Today,2018,53(6):240-253.
[30] DILGER R N,GARROW T A,BAKER D H.Betaine can partially spare choline in chicks but only when added to diets containing a minimal level of choline[J].Journal of Nutrition,2007,137(10):2 224-2 228.
[31] KEMPSON S A,MONTROSE M H.Osmotic regulation of renal betaine transport:transcription and beyond[J].Pflugers Archiv-European Journal of Physiology,2004,449(3):227-234.
[32] UELAND P M.Choline and betaine in health and disease[J].Journal of Inherited Metabolic Disease,2011,34(1):3-15.
[33] SOLOWAY S,STETTEN D J.The metabolism of choline and its conversion to glycine in the rat[J].The Journal of Biological Chemistry,1953,204(1):207-214.
[34] CHEN Q,WANG Y,JIAO F Z,et al.Betaine inhibits Toll-like receptor 4 responses and restores intestinal microbiota in acute liver failure mice[J].Scientific Reports,2020,10(1):21850.