氧化应激是生物体内氧化与抗氧化作用失衡的一种状态,可造成脂质、蛋白质和DNA等氧化损伤而引起细胞凋亡,其已被证实与多种慢性疾病、衰老有着密切关系[1]。为此,应用抗氧化活性物质成为了降低生物体氧化损伤的一种策略。抗氧化肽源于食品蛋白质,由于具有资源丰富、稳定性好、安全性高等优势,逐渐备受关注。
酪蛋白糖巨肽(glycomacropeptide,GMP)是一种具有64个氨基酸残基的糖肽,富含缬氨酸、亮氨酸等支链氨基酸,但几乎不含苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸[2];其主要糖基为唾液酸[3]。正因为GMP独特的氨基酸构成,其酶解产物在结构与功能活性方面可能不同于其他蛋白酶解产物。近年来科研工作者开始关注GMP酶解产物,发现其具有益生、抗炎等功能活性,如GMP酶解产物可促进保加利亚乳杆菌和嗜热链球菌的生长[4];可通过阻断NF-κb信号通路,抑制脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞中一氧化氮(nitric oxide,NO)产生和炎症因子mRNA表达,发挥抗炎作用[5]。
目前国内外关于GMP酶解产物的抗氧化性研究报道较少,仅CHENG等[6]采用木瓜蛋白酶酶解GMP,发现其酶解产物对RAW 264.7小鼠巨噬细胞的氧化损伤有保护作用。基于此,本文拟采用碱性蛋白酶、中性蛋白酶和木瓜蛋白酶等商业酶制剂对GMP进行降解,比较其酶解产物的自由基清除能力与抗氧化损伤能力,为GMP酶解产物功能食品配料开发提供研究依据。
GMP,丹麦Arla公司;中性蛋白酶、木瓜蛋白酶,上海瑞永生物科技有限公司;碱性蛋白酶,上海麦克林生化科技有限公司;RAW 264.7(小鼠巨噬细胞),中国科学院生物化学与细胞生物学研究所上海细胞库;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)、2,2,-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS))、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)等试剂均为分析纯,美国sigma公司;焦性没食子酸,国药集团化学试剂有限公司。
MCO-17AC型二氧化碳培养箱,日本Sanyo 公司;CKX41型倒置光学显微镜、IX53型倒置荧光显微镜,日本Olympus公司;Synergy H1多功能酶标仪,美国Bio-TEK公司;ACB-4A1超净工作台,南京非同科学仪器有限公司。
1.3.1 GMP酶解产物的制备
采用不同pH的0.1 mol/L磷酸盐缓冲溶液配制30 g/L GMP溶液,按100 U/g添加量分别加入中性蛋白酶、木瓜蛋白酶和碱性蛋白酶,酶解条件见表1,酶解0.5、1、2、4、6 h后取样,快速置于85 ℃下热处理20 min使酶失活;而后快速冷却至室温,离心(10 000 r/min,20 min),上清液冷冻干燥,备用;酶解产物分别命名为N-GMPH、P-GMPH和A-GMPH。
表1 GMP的酶解参数
Table 1 Enzymatic parameters of GMP

蛋白酶pH温度/℃酶添加量/(U·g-1)GMP质量浓度/(g·L-1)酶解时间/h碱性蛋白酶9.050100300~6中性蛋白酶7.055100300~6木瓜蛋白酶6.050100300~6
1.3.2 水解度
参考ADLER-NISSEN等的方法[7]。0.1 mL样液中依次加入1 mL 0.2 mol/L磷酸盐缓冲液(pH 8.2)和1 mL 0.1% TNBS溶液,混匀,50 ℃下避光反应60 min,而后加入2 mL 0.1 mol/L HCl溶液以终止反应,快速冷却至室温,340 nm处测定吸光度。以L-亮氨酸为标准品做标准曲线,根据公式(1)计算水解度:
水解度![]()
(1)
式中:ω1,水解前的氨基氮质量分数,mg/g (蛋白);ω2,水解后的氨基氮质量分数,mg/g (蛋白);ω3,GMP完全水解后的氮质量分数,mg/g (蛋白)。
1.3.3 抗氧化活性测定
1.3.3.1 ABTS阳离子自由基清除能力
参考WANG等[8]的方法。取0.1 mL样液与3.9 mL ABTS工作液混匀,室温下避光反应10 min,734 nm处测定吸光度。以蒸馏水为阴性对照,以维生素C为阳性对照。根据公式(2)计算其ABTS阳离子自由基清除活性,且以维生素C当量/mL来表示:
ABTS阳离子自由基清除率![]()
(2)
式中:A1,阴性对照吸光度;A2,样液或阳性对照吸光度。
1.3.3.2 DPPH自由基清除能力
采用NIE等[9]的方法测定。2 mL样液与2 mL DPPH自由基溶液(0.1 mmol/L,95%乙醇配制)混合均匀,室温下避光反应30 min,以蒸馏水为阴性对照,维生素C为阳性对照,517 nm处记录吸光度。根据公式(3)计算其DPPH自由基清除能力,且以维生素C当量/mL来表示:
DPPH自由基清除率![]()
(3)
式中:A1,阴性对照吸光度;A2,样液或阳性对照吸光度。
1.3.3.3 ![]() 清除能力
清除能力
采用HOMAYOUNI-TABRIZI等[10]的方法。0.1 mL样液与2.8 mL 1 mmol/L Tris缓冲液(pH 8.2)混合,加入0.1 mL 30 mmol/L焦性没食子酸引发反应,室温下反应4 min。以蒸馏水为阴性对照,维生素C为阳性对照,320 nm处每30 s测定其吸光度。
根据吸光度随时间变化的曲线计算斜率,即得到氧化速率。根据公式(4)计算其![]() 清除活性如下:
清除活性如下:
![]() 清除率
清除率![]()
(4)
式中: V1,阴性对照氧化速率,Abs/min;V2,样液或阳性对照氧化速率,Abs/min。
1.3.4 对H2O2诱导RAW 264.7细胞氧化损伤的保护作用
1.3.4.1 细胞培养
RAW 264.7 细胞以RPIM1640(含10%胎牛血清,1%青霉素-链霉素双抗)为培养基,置于37 ℃、5% CO2的培养箱中进行培养。
1.3.4.2 细胞存活率的测定
将对数生长期的RAW 264.7细胞接种到96孔板(1×104/孔),在培养箱中37 ℃培养24 h后,分别加入100 μL样液使其终质量浓度为0.05、0.1、0.5、1 mg/mL,继续培养12 h,再加入100 μL 400 μmol/L H2O2共培养6 h。采用MTT法[11]测定细胞活力。对照组中未加H2O2和样液,其细胞存活率计为100%;双氧水组未加样液。
1.3.4.3 活性氧(reactive oxygen species,ROS)生成量的测定
将对数生长期的RAW 264.7细胞分别接种到96孔板(1×104/孔)和6孔板中(5×105/孔),在培养箱中37 ℃培养24 h后,加入样液使终质量浓度为0.5 mg/mL,培养12 h,然后加入100 μL 400 μmol/L H2O2共培养6 h。采用DCFH-DA法[12]测定细胞ROS生成量,同时使用倒置荧光显微镜观察细胞ROS荧光强度。对照组中未加H2O2和样液;双氧水组未加样液,其ROS生成量计为100%。
所有实验至少重复3次,结果表示为平均值±标准差(SD)。采用GraphPad Prism 7.0软件对实验数据进行单因素方差检验(analysis of variance,ANOVA)及Tukey检验;P<0.05说明统计学上存在显著性差异。
蛋白酶种类对GMP酶解程度的影响如图1所示。随着酶解时间的增加,GMP酶解程度逐渐增加而后趋于平缓,其中中性蛋白酶对GMP的酶解作用明显优于木瓜蛋白酶和碱性蛋白酶,后二者之间并无明显差异。这可能是因为:(1)GMP分子中苏氨酸、谷氨酸、脯氨酸等氨基酸残基所占比例较高,基本不含酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸残基[2];(2)蛋白酶作用位点不同,其中碱性蛋白酶作用位点主要为酪氨酸、苯丙氨酸、色丙氨酸、亮氨酸、异亮氨酸等氨基酸残基,木瓜蛋白酶作用位点主要为赖氨酸、精氨酸、甘氨酸和半胱氨酸等氨基酸残基,而中性蛋白酶作用位点相对广泛,并可酶切苏氨酸残基[13]。
当酶解至4 h时,水解度基本趋于平缓,中性蛋白酶、木瓜蛋白酶和碱性蛋白酶等对GMP的酶解程度分别为(11.82±0.58)%、(9.77±0.92)%和(9.01±0.58)%。该水解度低于已有的研究,如O’SULLIVAN等[14]采用碱性蛋白酶酶解酪蛋白,水解度可达(18.01±1.59)%,这是源于GMP独特的氨基酸组成,其可供蛋白酶的作用位点较少。结果表明,中性蛋白酶对GMP的酶解程度较大。
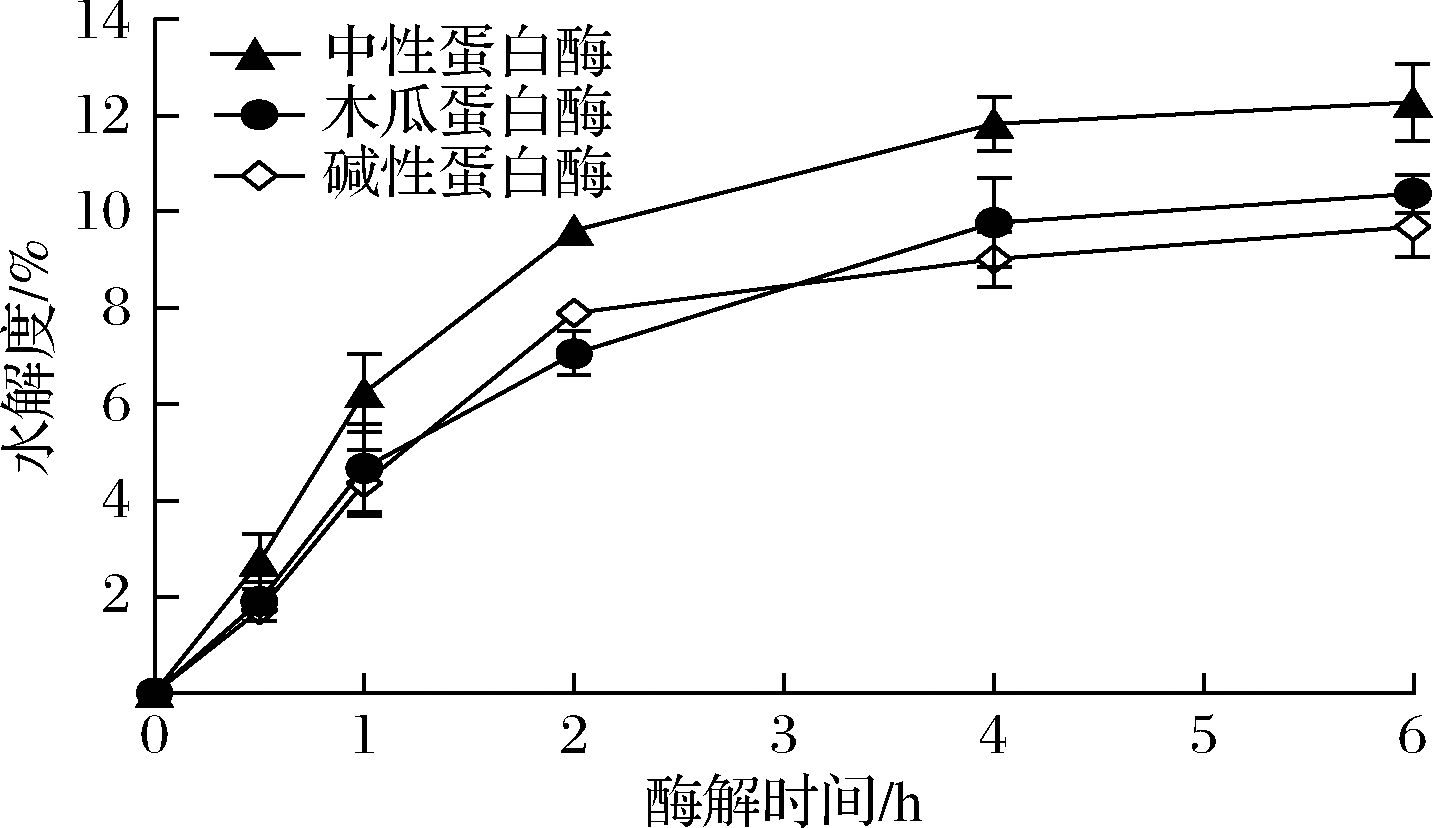
图1 蛋白酶种类对GMP酶解程度的影响
Fig.1 Effects of protease type on enzymolysis degree of GMP
ABTS阳离子自由基、DPPH自由基和![]() 常用于体外抗氧化评价[15]。GMP经不同蛋白酶酶解后,其酶解产物对ABTS自由基、DPPH自由基和
常用于体外抗氧化评价[15]。GMP经不同蛋白酶酶解后,其酶解产物对ABTS自由基、DPPH自由基和![]() 的清除作用如图2所示。
的清除作用如图2所示。

a-ABTS阳离子自由基;b-DPPH自由基;![]()
图2 蛋白酶种类对GMP酶解产物清除自由基能力的影响
Fig.2 Effects of protease type on free radical scavenging ability of GMP hydrolysate
与GMP相比,GMP酶解产物(N-GMPH,P-GMPH和A-GMPH)均表现出较强的ABTS阳离子自由基、DPPH自由基和![]() 清除能力,且随着酶解时间的延长,总体上呈现增加而后趋于平缓的趋势。一般来说,蛋白质酶解程度增加,肽段携带的电子数量增加,这有利于肽段与自由基结合,从而阻断自由基反应[16]。但酶解1~2 h所得到的P-GMPH,其ABTS阳离子自由基和
清除能力,且随着酶解时间的延长,总体上呈现增加而后趋于平缓的趋势。一般来说,蛋白质酶解程度增加,肽段携带的电子数量增加,这有利于肽段与自由基结合,从而阻断自由基反应[16]。但酶解1~2 h所得到的P-GMPH,其ABTS阳离子自由基和![]() 清除能力发生下降,而后呈现上升趋势,这可能与其酶解产物组成有关,推测是初期产生的某些大分子肽段具有较好的抗氧化活性,但随着酶解时间增加,该肽段发生降解,导致抗氧化活性降低;随着GMP进一步降解形成大量的小分子肽段,其抗氧化活性增加。
清除能力发生下降,而后呈现上升趋势,这可能与其酶解产物组成有关,推测是初期产生的某些大分子肽段具有较好的抗氧化活性,但随着酶解时间增加,该肽段发生降解,导致抗氧化活性降低;随着GMP进一步降解形成大量的小分子肽段,其抗氧化活性增加。
当酶解至4 h后,GMP酶解产物对ABTS阳离子自由基和![]() 的清除能力达到平缓,N-GMPH的效果均优于P-GMPH和A-GMPH,其清除ABTS阳离子自由基的能力可达到(73.32±2.93)mg维生素C当量/mL,远高于白肛海地瓜多肽(44.92 mg维生素C当量/mL)[17],且
的清除能力达到平缓,N-GMPH的效果均优于P-GMPH和A-GMPH,其清除ABTS阳离子自由基的能力可达到(73.32±2.93)mg维生素C当量/mL,远高于白肛海地瓜多肽(44.92 mg维生素C当量/mL)[17],且![]() 清除率达到(12.00±1.17)%。当酶解1 h后,GMP酶解产物对DPPH自由基的清除能力达到平缓,但P-GMPH[(1.57±0.11)mg维生素C当量/mL]的效果略高于N-GMPH[(1.23±0.17)mg 维生素C当量/mL],明显高于A-GMPH[(0.84±0.1)mg维生素C当量/mL]。上述结果说明,GMP酶解产物清除各自由基的能力与水解度之间并不完全符合对应关系;包斐等[18]得到相似的结果。究其原因是蛋白酶种类不同,GMP酶解产物中的肽段在结构和含量上存在很大的差异。综合比较,选用中性蛋白酶对GMP酶解4 h制备N-GMPH,进行细胞抗氧化损伤研究。
清除率达到(12.00±1.17)%。当酶解1 h后,GMP酶解产物对DPPH自由基的清除能力达到平缓,但P-GMPH[(1.57±0.11)mg维生素C当量/mL]的效果略高于N-GMPH[(1.23±0.17)mg 维生素C当量/mL],明显高于A-GMPH[(0.84±0.1)mg维生素C当量/mL]。上述结果说明,GMP酶解产物清除各自由基的能力与水解度之间并不完全符合对应关系;包斐等[18]得到相似的结果。究其原因是蛋白酶种类不同,GMP酶解产物中的肽段在结构和含量上存在很大的差异。综合比较,选用中性蛋白酶对GMP酶解4 h制备N-GMPH,进行细胞抗氧化损伤研究。
2.3.1 氧化模型的建立
H2O2进入细胞后可转化为·OH,具有较强的氧化能力,故常用H2O2建立细胞氧化应激模型。H2O2处理对RAW 264.7细胞存活率的影响如图3所示。结果表明,随着H2O2浓度的增加,细胞存活率下降,说明其诱导了细胞的氧化损伤。其中400 μmol/L H2O2可降低细胞存活率降至(54.72±0.45)%,因此选择400 μmol/L浓度进行实验。

图3 H2O2处理对RAW 264.7细胞存活率的影响
Fig.3 Effect of H2O2 treatment on RAW 264.7 cell viability
2.3.2 N-GMPH对H2O2诱导RAW 264.7细胞存活率的影响
GMP经中性蛋白酶酶解4 h后,其酶解产物N-GMPH对RAW 264.7细胞存活率的影响如图4所示。结果表明,GMP预处理对RAW267.4细胞存活率影响较弱,说明其对细胞氧化损伤基本无保护作用;而N-GMPH预处理可显著提高RAW 264.7细胞存活率(P<0.05),这是因为:(1)与GMP相比,N-GMPH本身具有更高的自由基清除能力(图2);(2)N-GMPH含有较多的小分子肽,其容易发生跨膜转运进入细胞内,淬灭H2O2在细胞内经代谢产生的ROS[19],从而发挥抗氧化损伤作用。凌玉芳[20]亦发现,使用双酶(胃蛋白酶-胰蛋白酶)对乳清蛋白进行酶解,其酶解产物显著提高细胞存活率,可改善H2O2所致的PC12细胞氧化损伤。
此外,N-PMPH对RAW 267.4细胞氧化损伤的保护作用呈现浓度正相关;当酶解产物质量浓度为0.5和1 mg/mL时,可将RAW 267.4细胞存活率提高至(79.32±1.85)%和(80.70±1.23)%,二者之间无显著性差异。因此,选用质量浓度为0.5 mg/mL N-GMPH进行后续实验。

图4 N-GMPH对H2O2诱导RAW 264.7细胞存活率的影响
Fig.4 Effects of N-GMPH on H2O2-induced RAW 264.7 cells viability
注:不同小写字母表示差异显著(P<0.05)(下同)
2.3.3 N-GMPH对H2O2诱导RAW 264.7细胞内ROS生成量的影响
过量ROS会破坏细胞内氧化和抗氧化系统之间的平衡,导致氧化应激,从而进一步破坏细胞的结构和功能[21],所以ROS水平可用于反映细胞氧化损伤程度。GMP经中性蛋白酶酶解4 h后,其酶解产物N-GMPH对H2O2诱导RAW 264.7细胞内ROS生成量的影响如图5所示。H2O2显著提高了RAW 264.7细胞中ROS生成量,说明细胞氧化损伤主要源于ROS的大量增加。GMP可降低ROS生成量,但下降程度仅为(6.29±0.76)%,这在一定程度上可解释GMP对细胞氧化损伤无保护作用(图4);而N-GMPH显著减少细胞中ROS生成量至(44.50±2.29)%,该结果验证了其具有良好的抗氧化活性。
同时,荧光倒置显微镜可观察到(图6),对照组细胞呈现弱绿色荧光,H2O2处理后则显示出强烈的绿色荧光,意味着细胞中ROS水平明显增加,进一步证明H2O2诱导了细胞的氧化应激;与H2O2组相比,0.5 mg/mL GMP与N-GMPH预处理后细胞的绿色荧光强度均发生了不同程度的减弱,尤其是后者荧光强度显著降低,该结果与细胞内ROS生成量(图5)基本一致。杜梦霞[22]、马萍等[23] 亦发现,豆类蛋白酶解产物可显著降低细胞内的ROS水平。由此推测,N-GMPH可通过消除细胞中ROS恢复胞内氧化还原平衡,从而减轻胞内脂质、蛋白质和DNA等生命物质的损伤,达到缓解H2O2诱导细胞氧化损伤的作用。
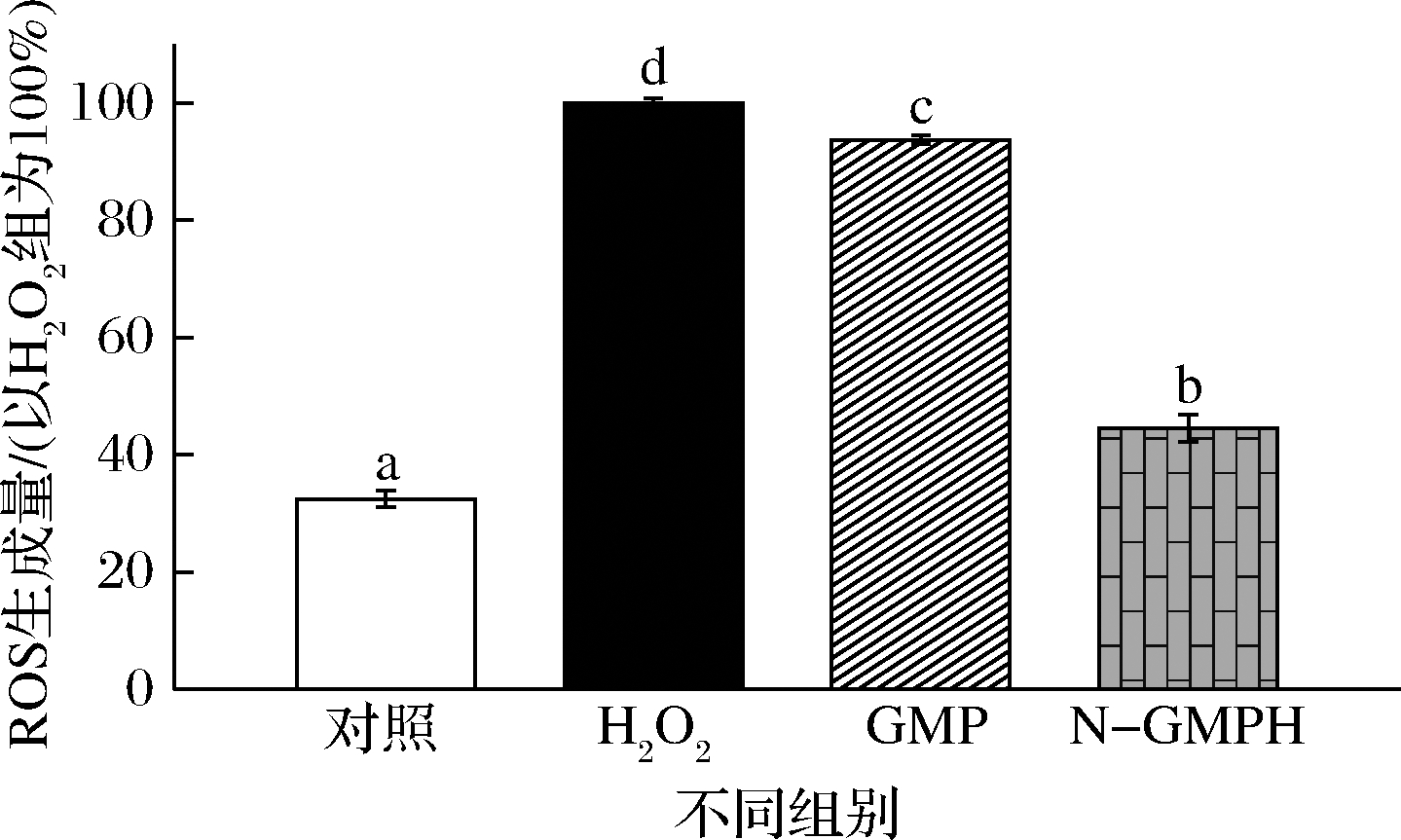
图5 N-GMPH对 H2O2诱导RAW 264.7细胞内ROS生成量的影响
Fig.5 Effects of N-GMPH on ROS production of H2O2-induced RAW 264.7 cells

a-空白组;b-H2O2组;c-GMP;d-N-GMPH
图6 N-GMPH对H2O2诱导RAW 264.7细胞内ROS水平的影响(200×)
Fig.6 Effects of N-GMPH on ROS levels in H2O2-induced RAW 264.7 cells
本文主要探究了GMP酶解产物清除自由基能力及其对细胞氧化损伤的保护作用。研究发现,GMP酶解产物的自由基清除能力明显高于GMP,且与蛋白酶种类有关;与P-GMPH和A-GMPH相比,N-GMPH 表现出较强的ABTS阳离子自由基和![]() 清除能力,而DPPH自由基清除能力略低于P-GMPH。酶解4 h所得到的N-GMPH可有效降低H2O2诱导的RAW 246.7细胞ROS水平,提高细胞活力,说明其能有效保护细胞免受氧化损伤。综上所述,N-GMPH是一种潜在的高效抗氧化肽,可作为功能配料应用于食品加工中;后期可进一步研究N-GMPH在氧化应激相关信号通路的调节作用。
清除能力,而DPPH自由基清除能力略低于P-GMPH。酶解4 h所得到的N-GMPH可有效降低H2O2诱导的RAW 246.7细胞ROS水平,提高细胞活力,说明其能有效保护细胞免受氧化损伤。综上所述,N-GMPH是一种潜在的高效抗氧化肽,可作为功能配料应用于食品加工中;后期可进一步研究N-GMPH在氧化应激相关信号通路的调节作用。
[1] 李冀,于雪,马育轩,等.中药及其有效成分抗炎机制的研究进展[J].中医药学报,2010,38(2):134-137.
LI J,YU X,MA Y X,et al.Research progress on anti-inflammatory mechanism of traditional Chinese medicine and its active components[J].Acta Chinese Medicine and Pharmacology,2010,38(2):134-137.
[2] 张秀媛.酪蛋白糖巨肽制备技术的研究[D].成都:西华大学,2008.
ZHANG X Y.Research on preparation technique of casein glycomacropeptide[D].Chengdu:Xihua University,2008.
[3] 高志芳.乳源活性肽的研究:酪蛋白糖巨肽的酶法制备与分离纯化[D].大连:大连工业大学,2008.
GAO Z F.Study on bioactive peptides from milk—preparation and purification of casein glycomacropeptide with enzyme[D].Dalian:Dalian Polytechnic University,2008.
[4] TIAN Q,WANG T T,TANG X,et al.Developing a potential prebiotic of yogurt:Growth of Bifidobacterium and yogurt cultures with addition of glycomacropeptide hydrolysate[J].International Journal of Food Science & Technology,2015,50(1):120-127.
[5] LI T G,CHENG X,DU M,et al.Upregulation of heme oxygenase-1 mediates the anti-inflammatory activity of casein glycomacropeptide (GMP) hydrolysates in LPS-stimulated macrophages[J].Food & Function,2017,8(7):2 475-2 484.
[6] CHENG X,GAO D X,SONG J J,et al.Casein glycomacropeptide hydrolysate exerts cytoprotection against H2O2-induced oxidative stress in RAW 264.7 macrophages via ROS-dependent heme oxygenase-1 expression[J].RSC Advances,2015,5(6):4 511-4 523.
[7] ADLER-NISSEN J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1 256-1 262.
[8] WANG Z X,LIU X Y,XIE H K,et al.Antioxidant activity and functional properties of Alcalase-hydrolyzed scallop protein hydrolysate and its role in the inhibition of cytotoxicity in vitro[J].Food Chemistry,2021,344:128 566.
[9] NIE X H,ZHAO L M,REGENSTEIN J M,et al.Antioxidant capacity of Maillard reaction products' fractions with different molecular weight distribution from chicken bone hydrolysate-galactose system[J].International Journal of Food Science & Technology,2017,52(7):1 632-1 638.
[10] HOMAYOUNI-TABRIZI M,ASOODEH A,SOLTANI M.Cytotoxic and antioxidant capacity of camel milk peptides:Effects of isolated peptide on superoxide dismutase and catalase gene expression[J].Journal of Food and Drug Analysis,2017,25(3):567-575.
[11] 李上标,裴淑艳,蒋超,等.MTT比色法研究应用进展[J].西北民族大学学报(自然科学版),2013,34(3):68-73;91.
LI S B,PEI S Y,JIANG C,et al.Research and application progress of MTT colorimetry[J].Journal of Northwest University for Nationalities (Natural Science),2013,34(3):68-73;91.
[12] FERM NDEZ-TOMÉ S,RAMOS S,CORDERO-HERRERA I,et al.In vitro chemo-protective effect of bioactive peptide lunasin against oxidative stress in human HepG2 cells[J].Food Research International,2014,62:793-800.
NDEZ-TOMÉ S,RAMOS S,CORDERO-HERRERA I,et al.In vitro chemo-protective effect of bioactive peptide lunasin against oxidative stress in human HepG2 cells[J].Food Research International,2014,62:793-800.
[13] 林晓玲.鸡软骨多肽的制备分离,结构解析及其对成骨细胞生长机制影响的研究[D].广州:华南理工大学,2019.
LIN X L.Preparation,isolation and structural analysis of chicken cartilage peptides and their effects on the growth mechanism of osteoblast[D].Guangzhou:South China University of Technology,2019.
[14] O’SULLIVAN S M,O’CALLAGHAN Y C,O’KEEFFE M B,et al.Immunomodulatory activity of 5 kDa permeate fractions of casein hydrolysates generated using a range of enzymes in Jurkat T cells and RAW 264.7 macrophages[J].International Dairy Journal,2019,91:9-17.
[15] 王晓宇,杜国荣,李华.抗氧化能力的体外测定方法研究进展[J].食品与生物技术学报,2012,31(3):247-252.
WANG X Y,DU G R,LI H.Progress of analytical methods for antioxidant capacity in vitro[J].Journal of Food Science and Biotechnology,2012,31(3):247-252.
[16] 李军,罗娟,涂宗财,等.鲢鱼骨胶原多肽的制备及其抗氧化活性研究[J].食品与发酵工业,2020,46(2):222-230.
LI J,LUO J,TU Z C,et al.Study on the preparation and antioxidant activity of collagen polypeptide from silver carp bone[J].Food and Fermentation Industries,2020,46(2):222-230.
[17] 袁坤山,孙国琼,郑艺,等.酶解白肛海地瓜蛋白制备抗氧化肽的工艺研究[J].食品科技,2014,39(7):76-83.
YUAN K S,SUN G Q,ZHENG Y,et al.Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from sea cucumber (Acaudina leucoprocta)[J].Food Science and Technology,2014,39(7):76-83.
[18] 包斐,孙丽霞,孙建华,等.长蛇鲻鱼蛋白水解制备抗氧化肽工艺研究[J].食品科技,2019,44(8):241-247.
BAO F,SUN L X,SUN J H,et al.Optimization of technology conditions for antioxidant peptides from protein hydrolysates of lizard fish[J].Food Science and Technology,2019,44(8):241-247.
[19] SZETO H H.Cell-permeable,mitochondrial-targeted,peptide antioxidants[J].AAPS Journal,2006,8(2):E277-E283.
[20] 凌玉芳.乳清蛋白酶解物对过氧化氢诱导的氧化损伤的保护作用[D].无锡:江南大学,2011.
LING Y F.Protective effect of whey protein hydrolysates on hydrogen peroxide-induced oxidative[D].Wuxi:Jiangnan University,2011.
[21] MIRZAEI M,MIRDAMADI S,SAFAVI M.Antioxidant activity and protective effects of Saccharomyces cerevisiae peptide fractions against H2O2-induced oxidative stress in Caco-2 cells[J].Journal of Food Measurement and Characterization,2019,13(4):2 654-2 662.
[22] 杜梦霞.绿豆蛋白酶解物的制备及其对NCTC1469细胞氧化损伤的保护作用[D].南昌:南昌大学,2018.
DU M X.Preparation of mung bean protein hydrolysate and its protective effect on oxidative damage of NCTC1469 cells[D].Nanchang:Nanchang University,2018.
[23] 马萍,程天赋,郭增旺,等.紫花芸豆肽修复H2O2对HepG2细胞的氧化应激损伤[J].食品科学,2020,41(1):175-182.
MA P,CHENG T F,GUO Z W,et al.Cytoprotective effect of Phaseolus vulgaris peptides against H2O2-induced oxidative damage in HepG2 cells[J].Food Science,2020,41(1):175-182.