D-阿洛酮糖是一种稀有糖[1],是D-果糖的C-3差向异构体,主要来源于少部分植物和细菌。D-阿洛酮糖除具有低能量、改善肠道菌群、抗龋齿等生理功能[2-4]外,还在抑制血糖升高与体脂积累、清除自由基、神经保护等诸多方面发挥着重要生理活性作用[5-10]。D-阿洛酮糖甜度可达到果糖的70%[11],能量只有蔗糖的0.3%[12],是一种新型甜味剂[13-15],尤其适用于糖尿病及肥胖症人群[16]。目前其生产主要依赖生物转化法,即以D-果糖为底物,在D-阿洛酮糖3-差向异构酶(D-psicose-3-epimerase,DPE)的催化作用下将D-果糖转化为D-阿洛酮糖[17-18],但该反应转化率低,约为30%。为了提高转化率,WEN等[19]建立了一种“磷酸化-脱磷酸”级联反应,即将DPE与L-鼠李树胶糖激酶(L-rhamnulose kinase,RhaB)偶联,利用RhaB催化D-阿洛酮糖为D-阿洛酮糖1-磷酸,后者再通过磷酸酶将D-阿洛酮糖1-磷酸脱磷酸为D-阿洛酮糖,通过该级联反应可大大提高D-阿洛酮糖的转化率。
RhaB属于己糖激酶-肌动蛋白-hsp70家族的一种[20],在N端及C端都有5股β折叠,在它们的间隙处有ATP结合位点[21-27]。RhaB可以磷酸化C-3构型为R型的稀有糖,但对C-3构型为S构型的糖无活性[19]。近年来,RhaB被用于D-阿洛酮糖的生产,通过RhaB的引入,可大大提高D-阿洛酮糖的转化率[19, 28-30]。
鉴于目前对于RhaB的研究较少且其在D-阿洛酮糖合成中有重要应用,本研究从福氏志贺菌(Shigella flexneri 2a str.301)的基因组DNA中克隆得到了rhaB基因(Gene ID:1025156)并对其进行改良,对突变体酶学性质进行了一系列分析。将RhaB与D-阿洛酮糖进行分子对接,初步研究了RhaB的催化机制,为其在D-阿洛酮糖生产方面的应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
大肠杆菌Escherichia coli XL10-gold、BL21(DE3)及福氏志贺菌(Shigella flexneri 2a str.301)基因组,本实验室保存;菌株BL21(DE3)/pET28a-rhaB、菌株BL21(DE3)/pET28a-rhaBE437Q,本研究构建。
1.1.2 酶试剂及耗材
PCR所需试剂(Prime STAR)、限制性内切酶,宝生物工程(大连)有限公司(TaKaRa);PCR所需试剂(KOD FX Neo),日本东洋纺公司(TOYOBO);ATP、D-果糖,上海生工生物公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、标准蛋白试剂盒(12 000~200 000 Da),Sigma-Aldrich公司;Ni2+亲和层析柱,GE公司;各种稀有糖,TCI(上海)化成工业发展有限公司;薄层色谱(thin-layer chromatography,TLC)薄层层析板60 F254,德国默克公司;Sugar-PakTM色谱分析柱(300 mm×6.5 mm),美国Waters公司。
1.1.3 培养基及其他溶液的配制
LB培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 5,琼脂粉20(固体培养基),高压蒸汽灭菌(121 ℃,15 min)。
TB培养基:酵母提取物24 g/L,胰蛋白胨12 g/L,甘油体积分数为0.4%,K2HPO4 12.53 g/L,KH2PO4 2.31 g/L,营养成分和盐分开高压蒸汽灭菌(121 ℃,15 min)后混匀。
蛋白纯化缓冲液:裂解、平衡缓冲液:25 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl;洗涤缓冲液:25 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl,60 mmol/L咪唑;洗脱缓冲液:25 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl,500 mmol/L咪唑;脱盐缓冲液:25 mmol/L Tris-HCl (pH 8.0),50 mmol/L NaCl。
1.1.4 仪器与设备
AG 22331 Hamburg PCR仪,德国Eppendorf公司;PAC300电泳仪Bio-Rad Power,美国伯乐公司;E2695 HPLC,美国Waters公司;VCX 750超声波细胞粉碎机,南京新辰生物科技有限公司。
1.2 实验方法
1.2.1 重组质粒的构建
采用Prime STAR聚合酶进行PCR 时,以福氏志贺菌(S.flexneri 2a str.301)基因组为模板,以rhaB-F:GCGCGGATTCATGACCTTTCGCAATTGTGT(BamH Ⅰ)为上游引物,以rhaB-R:ATATCCATGGTCATGCGCAAAGCTCCTTTG(Hind Ⅲ)为下游引物进行PCR得到目的基因,目的基因与pET28a载体经双酶切后将载体与目的基因用DNA连接酶Ligation-mix于25 ℃静置20 min连接。将连接产物转化至大肠杆菌XL10-gold感受态细胞,置于冰上25 min,42 ℃热激40 s,冰上放置3 min后将转化产物涂布至LB[卡那霉素(kanamycin,Kan)](50 μg/mL)平板。挑取阳性克隆进行菌落PCR及双酶切验证最后送测序。pET28a-rhaBE437Q的构建所用PCR试剂为KOD FX Neo,以pET28a-rhaB为模板,以RhaBE437Q-F:GGCAATATCGGCATCCAGTTAATGACGCTGGAT为上游引物,以RhaBE437Q-R:ATCCAGCGTCATTAACTGGATGCCGATATTGCC为下游引物进行PCR,用去甲基化酶DpnⅠ消化掉PCR产物中的模板质粒后转化至大肠杆菌XL10-gold感受态细胞,提取质粒并测序。
1.2.2 重组蛋白在大肠杆菌中的诱导表达
将上述测序成功的重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,涂布至LB(Kan)(50 μg/mL)平板37 ℃过夜培养。挑取单菌落接种至5 mL LB(Kan)(50 μg/mL)培养基37 ℃培养过夜,后以1%接种量转接至200 mL TB(Kan)(50 μg/mL)培养基,37 ℃振荡培养2 h左右待OD600为0.6~0.8,加入终浓度为0.1 mmol/L IPTG转入16 ℃诱导表达20 h,收集菌体置于-20 ℃备用(分别取500 μL诱导前及诱导后菌体用于后续SDS-PAGE检测)。
1.2.3 重组蛋白的分离纯化
将菌体重悬于预先预冷的装有10 mL裂解缓冲液的50 mL离心管中,冰上超声破碎,破碎2 s,间歇2 s,总时间30 min,显微镜下观察菌体是否破碎。将破碎液于低温条件下进行高速离心,得到的上清液和沉淀分别取样,上清液用于蛋白的纯化。采用Ni2+亲和层析的方法进行纯化(5 mL HisTrpTMHP),纯化步骤如下:(1)用30 mL无菌水清洗柱子;(2)10 mL 0.1 mol/L的NiSO4再生柱子;(3)20 mL无菌水洗去未结合的Ni2+;(4)20 mL平衡缓冲液平衡柱子;(5)缓慢上样,使蛋白与柱子充分结合;(6)20 mL平衡缓冲液洗去未结合的蛋白;(7)20 mL低浓度咪唑洗去结合能力较弱的杂蛋白;(8)20 mL高浓度咪唑洗去目标蛋白并收集。收集到的蛋白含有较多盐,因此将蛋白进行脱盐处理。将收集到的目标蛋白用超滤管(10 kDa)进行浓缩(3 600×g,4 ℃离心一定时间),加入脱盐缓冲液,浓缩到一定体积后加入终体积分数为10%的甘油并测浓度,后分装为小管置于-20 ℃保存。
1.2.4 重组蛋白RhaB的氨基酸序列分析
将福氏志贺菌(S.flexneri 2a str.301)来源的RhaB蛋白(RhaB-Sf 2a str.301,蛋白ID NP_709708)与福氏志贺菌(S.flexneri)来源的RhaB蛋白(RhaB-Sf,蛋白ID WP_039062492.1),大肠杆菌(E.coli)来源的RhaB蛋白(RhaB-E.coli,蛋白ID WP_000144054.1)通过CLC Sequence viewer进行序列比对。
1.2.5 重组蛋白RhaB及RhaBE437Q活性的测定
整个酶反应体系体积为250 μL,其中底物D-阿洛酮糖5 g/L,MnSO4 5 mmol/L,ATP 27 mmol/L,重组蛋白0.2 mg/mL,50 mmol/L pH 8.5的Tris-HCl补足至250 μL。37 ℃反应10 min,100 ℃加热10 min终止反应。取0.5 μL反应液进行TLC检测,展开剂为V(正丁醇)∶V(乙酸)∶V(水)=2∶1∶1的混合液。用茴香醛染色检测D-阿洛酮糖1-磷酸的生成。取余下反应液离心(15 000 r/min,10 min),取上清液过0.22 μm 滤膜进行HPLC检测,通过检测反应中D-阿洛酮糖的减少量来定义酶活性。检测条件为:Sugar-PakTM色谱柱,流动相为500 mg/L的EDTA钙盐,流速为0.5 mL/min,柱温为80 ℃,示差检测器。
1.2.6 重组蛋白(RhaBE437Q)分子质量的检测
采用SDS-PAGE(5%浓缩胶、10%分离胶)进行重组蛋白单亚基分子质量的测定,考马斯亮蓝染色。采用凝胶过滤层析检测整体的蛋白分子质量,检测条件:TSK G3000SWXL凝胶柱,流动相为PBS溶液,流速为0.5 mL/min,紫外检测器,检测波长为280 nm。
1.2.7 重组蛋白(RhaBE437Q)最适反应条件的测定
整个酶反应体系体积为250 μL,其中底物D-阿洛酮糖5 g/L,MnSO4 5 mmol/L,ATP 30 mmol/L,重组蛋白RhaBE437Q 0.2 mg/mL,50 mmol/L pH 8.5的Tris-HCl补足至250 μL。不同温度条件下反应5 min,100 ℃ 加热10 min终止反应,检测反应后D-阿洛酮糖的减少量。采用不同pH的缓冲液进行最适pH的测定,其中pH 6~7为磷酸盐缓冲液,pH 7~8.5为Tris-HCl缓冲液,pH 8.5~10为Gly-NaOH缓冲液。测定最适金属离子时,先将重组蛋白RhaBE437Q用含有50 mmol/L EDTA的Tris-HCl(50 mmol/L,pH 8.0)溶液透析12 h以除去金属离子,然后再用不含EDTA的Tris-HCl(50 mmol/L,pH 8.0)溶液透析12 h除去EDTA,选用Zn2+、Co2+、Ca2+、Cu2+、Mn2+、Ni2+、Mg2+7种离子及EDTA测定酶活性。
1.2.8 重组蛋白(RhaBE437Q)底物特异性的测定
以不同稀有糖为底物(D/L-果糖,D/L-阿洛酮糖,D/L-山梨糖,D/L-塔格糖),酶反应体系同酶活性测定,40 ℃反应5 min,HPLC检测糖的减少量,对D-阿洛酮糖的活性定义为100%,测定重组蛋白RhaBE437Q对D-阿洛酮糖的活性以及对其他糖的相对活性。
1.2.9 重组蛋白RhaBE437Q对D-阿洛酮糖催化机理的分析
采用SWISS-MODEL 在线程序(https://swissmodel.expasy.org/),以大肠杆菌来源RhaB为模板(PDB:2cgl.1.A,同源性98.57%)同源建模得到RhaBE437Q蛋白结构模型。后将D-阿洛酮糖与重组蛋白RhaBE437Q蛋白结构模型利用AutoDock软件[31]进行分子对接,利用Pymol分析其催化机理。
2 结果与分析
2.1 重组蛋白RhaB的氨基酸序列分析
序列比对(图1)显示,2种福氏志贺菌来源RhaB-Sf 2a str.301与RhaB-Sf的氨基酸序列具有高度保守性,仅在437号氨基酸位点存在差异。RhaB-Sf 2a str.301 第437号位点氨基酸为谷氨酸(E),而RhaB-Sf该位点氨基酸为谷氨酰胺(Q),且大肠杆菌来源RhaB-E.coli该位点氨基酸也为谷氨酰胺(Q),因此将RhaB-Sf 2a str.301第437号氨基酸位点的谷氨酸(E)突变为谷氨酰胺(Q)。
2.2 重组蛋白RhaB、RhaBE437Q的表达纯化
RhaB、RhaBE437Q理论等电点(isoelectric point,pI)和分子质量(Mw)分别为pI 5.03/54 050.04 Da(RhaB),pI 5.08/54 049.05 Da(RhaBE437Q)(www.Expasy.Org)。由SDS-PAGE结果(图2)可知,经IPTG诱导后,RhaB、RhaBE437Q蛋白在50~70 kDa均有清晰的目的条带,因此二者在大肠杆菌中均成功表达。与RhaB蛋白相比,RhaBE437Q蛋白更多的以可溶性蛋白的方式存在;而RhaB蛋白大多以包涵体形式存在,仅存在极少部分的可溶性蛋白。
2.3 重组蛋白RhaB、RhaBE437Q的活性检测
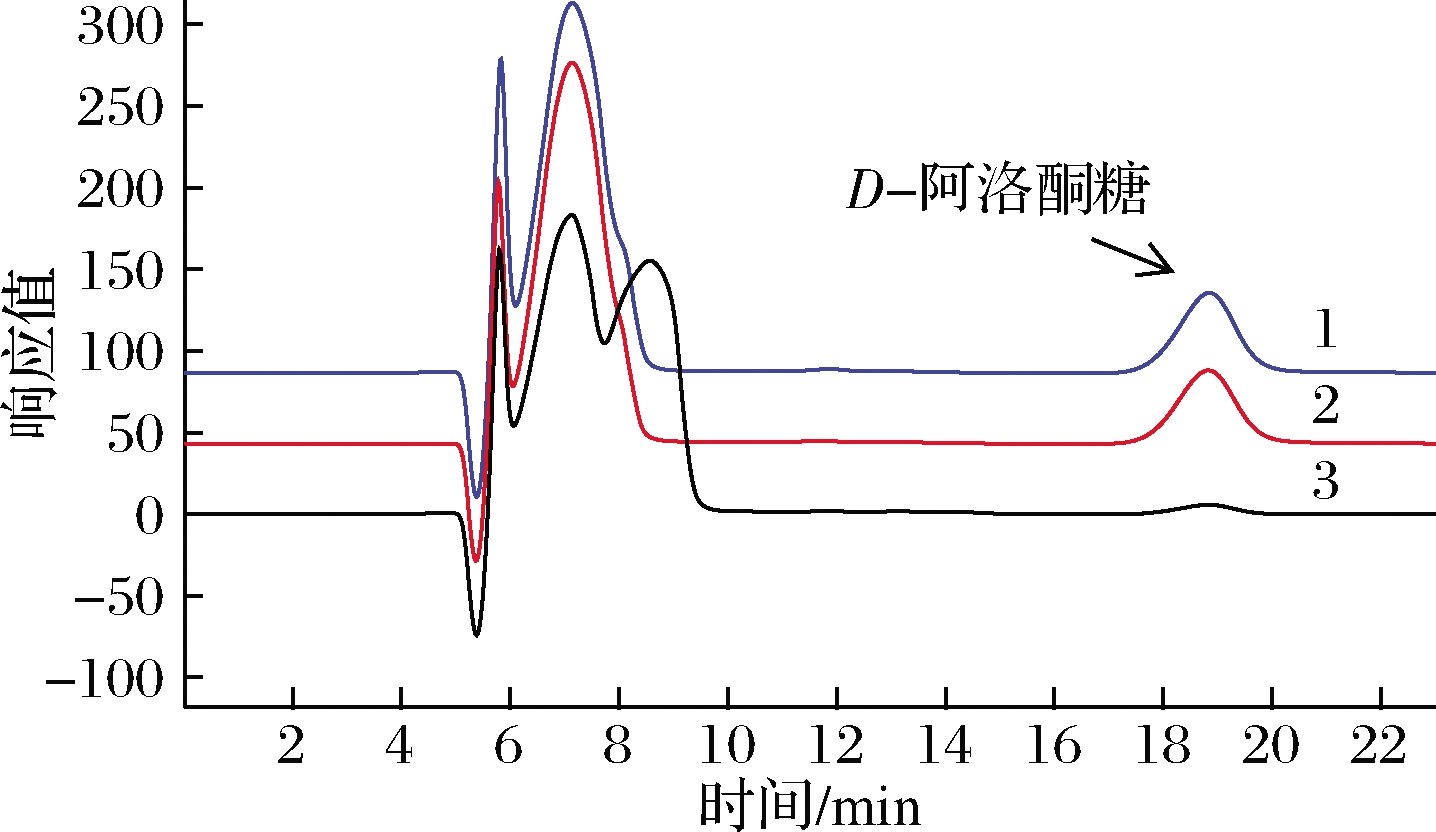
以D-阿洛酮糖为底物,RhaB蛋白可将D-阿洛酮糖磷酸化生成D-阿洛酮糖1-磷酸。由于D-阿洛酮糖和其磷酸糖极性相差较大,因此可通过TLC来检测。TLC结果如图3所示,大肠杆菌来源的RhaB蛋白催化D-阿洛酮糖生成D-阿洛酮糖1-磷酸,在D-阿洛酮糖下方可看到清晰的磷酸糖的点(如图3中箭头所示);而福氏志贺菌(S.flexneri 2a str.301)来源的RhaB蛋白对D-阿洛酮糖几乎无活性,从TLC图(图3-a)看不到磷酸糖的生成;而RhaBE37Q蛋白与大肠杆菌来源的RhaB蛋白相比,可看到几乎相同量磷酸糖的产生(图3-b)。同时通过HPLC检测D-阿洛酮糖的减少量(图4),发现突变体蛋白活性为未突变蛋白的10倍。因此推测福氏志贺菌(S.flexneri 2a str.301)来源的RhaB蛋白第437号位点氨基酸是影响其表达及活性的关键氨基酸。

图1 RhaB-Sf 2a str.301、RhaB-Sf、RhaB-E.coli 3种不同来源的RhaB氨基酸序列比对
Fig.1 Amino acid sequence alignment of different sources of RhaB (RhaB-Sf 2a str.301, RhaB-Sf, RhaB-E.coli)
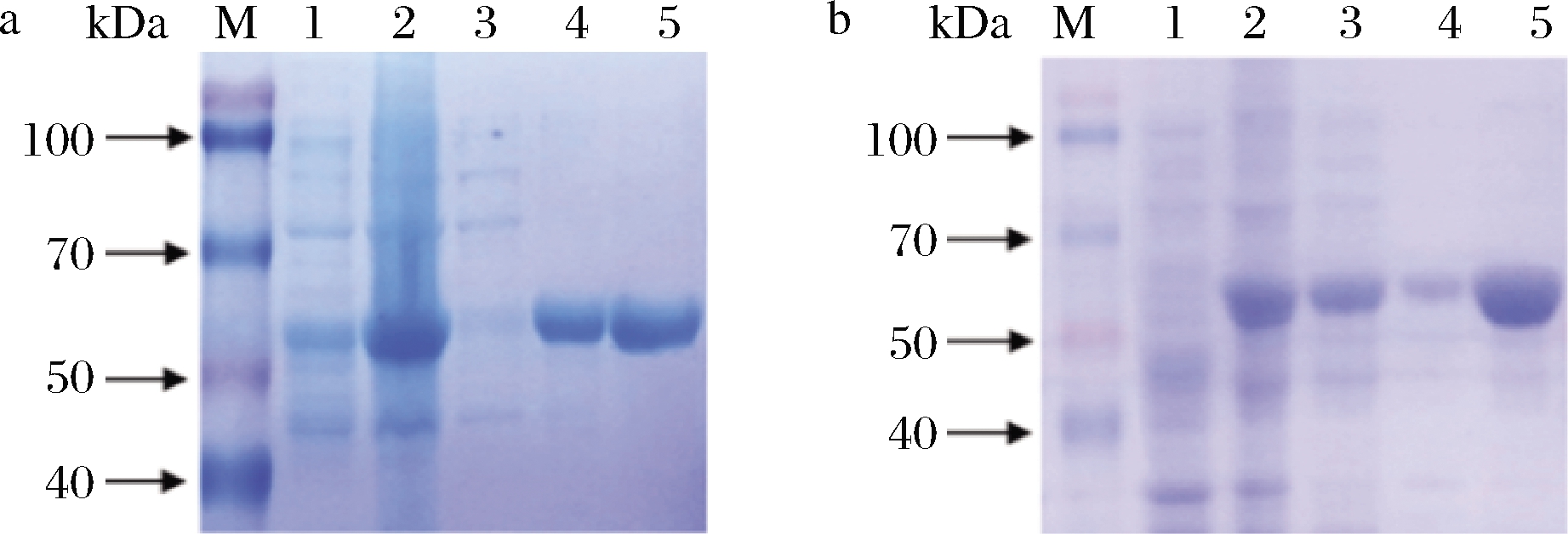
M-蛋白Marker;1-诱导前全细胞;2-诱导20 h的全细胞; 3-细胞裂解液上清液;4-细胞裂解沉淀;5-纯化后蛋白 a-突变前;b-突变后
图2 SDS-PAGE检测重组蛋白RhaB/RhaBE437Q的表达和纯化
Fig.2 SDS-PAGE analysis of RhaB/RhaBE437Q expression and purification
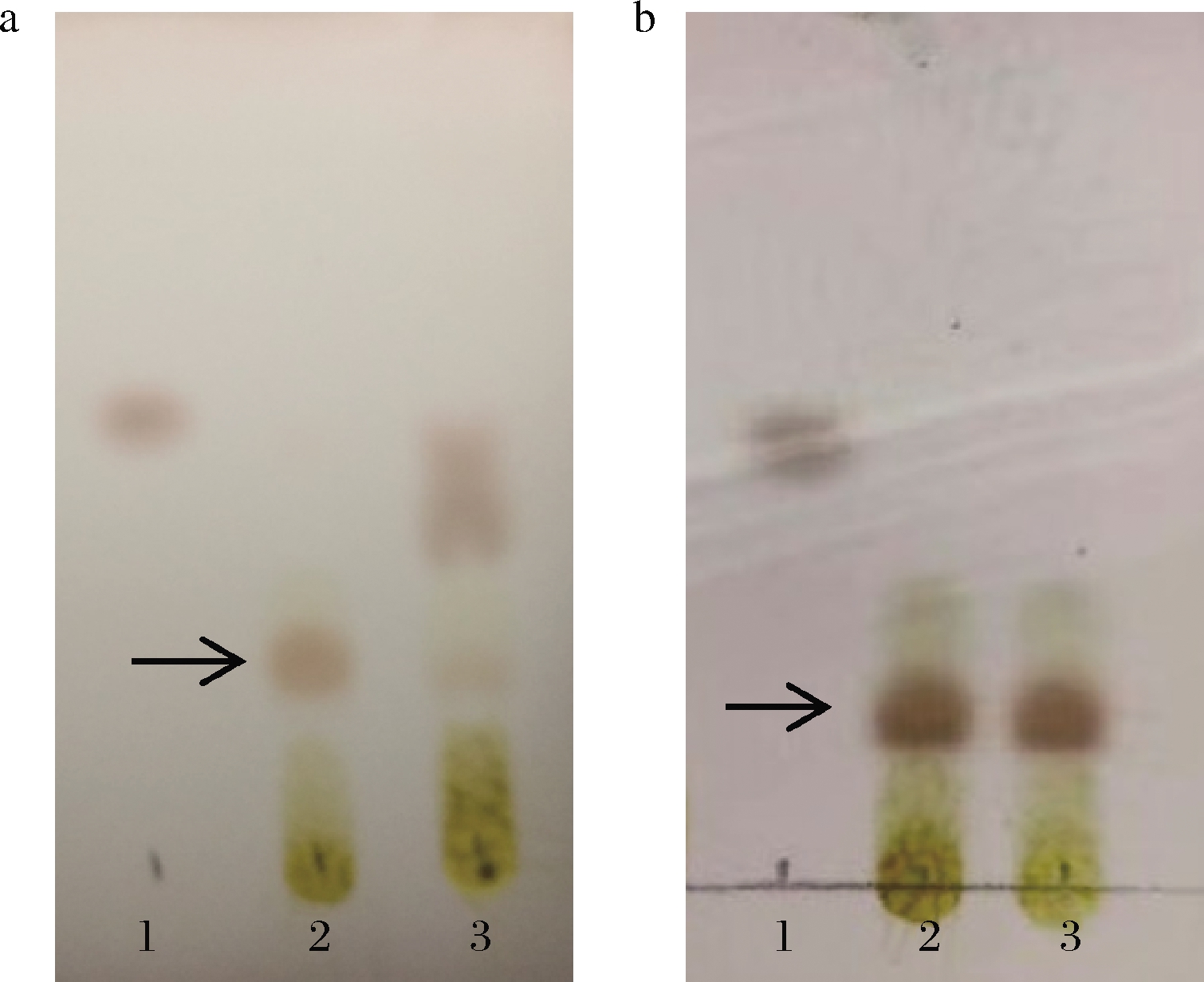
1-D-阿洛酮糖标样;2-大肠杆菌来源RhaB蛋白催化 D-阿洛酮糖反应液;3-福氏志贺菌来源RhaB/RhaBE437Q 蛋白催化D-阿洛酮糖反应液 a-RhaB;b-RhaBE437Q
图3 TLC检测RhaB及RhaBE437Q蛋白活性
Fig.3 TLC analysis of the activities of RhaB and RhaBE437Q
注:图中箭头所指表示磷酸糖(图7同)
1-反应前;2-RhaB反应5 min;3-RhaBE437Q反应5 min
图4 HPLC检测RhaB及RhaBE437Q蛋白活性
Fig.4 HPLC analysis of the activities of RhaB and RhaBE437Q
2.4 重组蛋白RhaBE437Q分子质量的确定
通过SDS-PAGE可知RhaBE437Q蛋白单个亚基分子质量约为54 kDa(图2-b),整体蛋白分子质量通过凝胶柱(TSK G3000SWXL)分析计算可知约为58 kDa(图5),因此福氏志贺菌(S.flexneri 2a str.301)来源的RhaBE437Q与大肠杆菌来源的RhaB蛋白[32]一样,均为单体蛋白。
2.5 金属离子、温度、pH对重组蛋白RhaBE437Q活性的影响
金属离子、温度、pH对于酶促反应具有重要影响。由图6-a可知,Mn2+对反应的促进作用最为明显。除Mn2+和Mg2+外,其余金属离子对酶催化几乎无促进作用。根据文献报道,大肠杆菌来源的RhaB最适反应温度为35 ℃,最适pH值为8.0[29]。在10~60 ℃,测定重组蛋白RhaBE437Q的最适反应温度,结果如图6-b所示,重组蛋白RhaBE437Q的最适反应温度为40 ℃;在20~50 ℃,重组蛋白RhaBE437Q仍保留50%以上的活性;但当温度超过40 ℃时,酶活性降低较为明显,说明随着温度升高,温度对酶结构影响较大,是影响酶活性的主要因素。在pH 6~10测定反应的最适pH,由图6-c可知,反应的最适pH值为8.5,且在该范围内重组蛋白RhaBE437Q均可保持60%以上的酶活性,说明重组蛋白RhaBE437Q有较宽泛的pH耐受性。
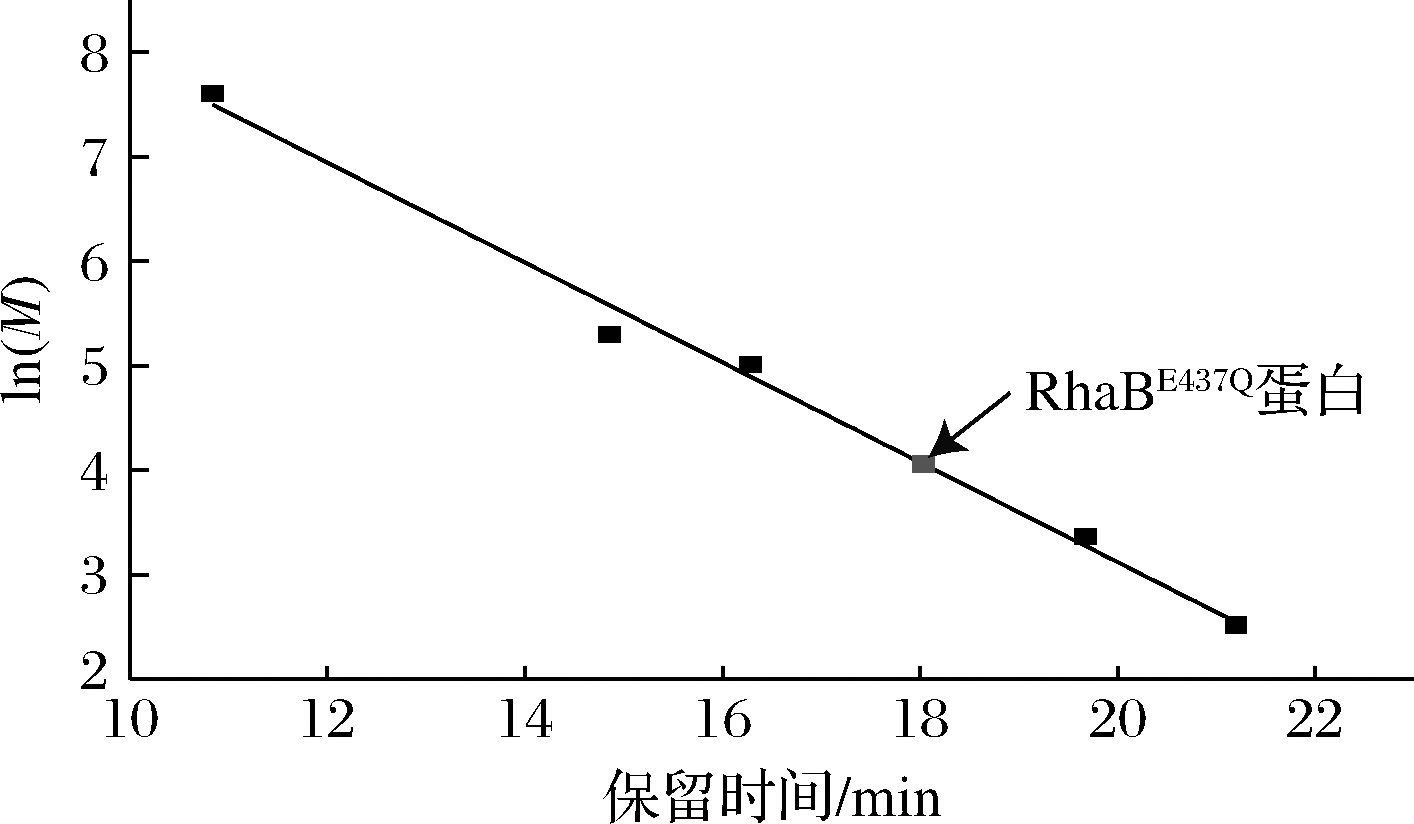
图5 RhaBE437Q蛋白分子质量的测定
Fig.5 Gel filtration chromatography analysis of RhaBE437Q′s molecular mass
注:标准蛋白包括葡聚糖(2 000 kDa),β-淀粉酶(200 kDa), 乙醇脱氢酶(150 kDa),碳酸酐酶(29 kDa),细胞色素c(12.4 kDa)
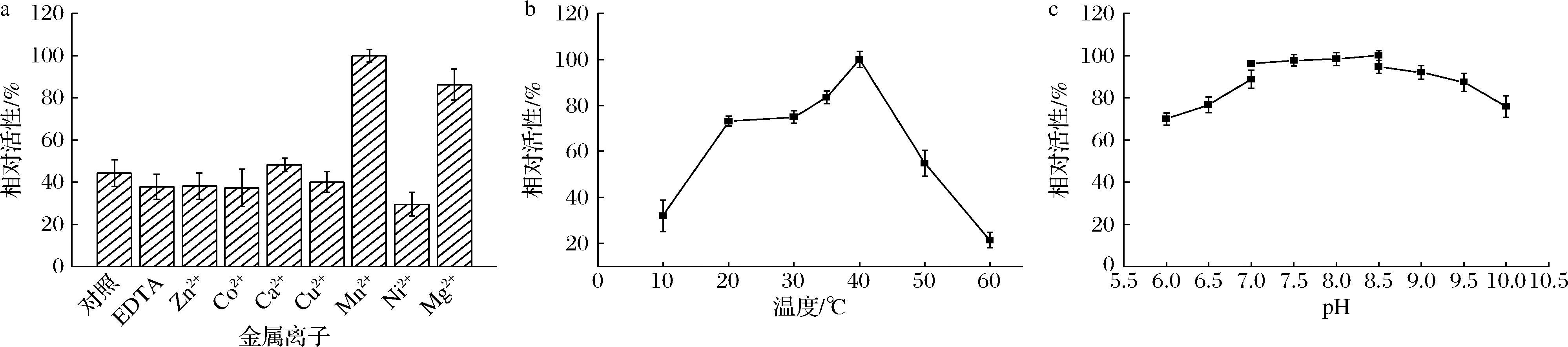
a-金属离子;b-温度;c-pH
图6 金属离子、温度、pH对RhaBE437Q活性的影响
Fig.6 Effect of metal ions, temperature and pH on the activity of RhaBE437Q
2.6 重组蛋白RhaBE437Q底物特异性的分析
以不同的稀有糖为底物,通过TLC检测磷酸糖的产生来分析重组蛋白RhaBE437Q的底物特异性。由TLC结果可知(图7),重组蛋白RhaBE437Q与D-阿洛酮糖、L-果糖、D-山梨糖、L-塔格糖反应均有磷酸糖的产生(如图7中黑色箭头所示),而与L-阿洛酮糖、D-果糖、L-山梨糖、D-塔格糖反应无磷酸糖产生。与文献报道一致,RhaB蛋白只能催化C-3构型为R构型的稀有糖[20]。经HPLC检测反应中糖的减少量,对D-阿洛酮糖活性定义为100%,则L-果糖、D-山梨糖、L-塔格糖的相对活性分别为76%、77%、102%。
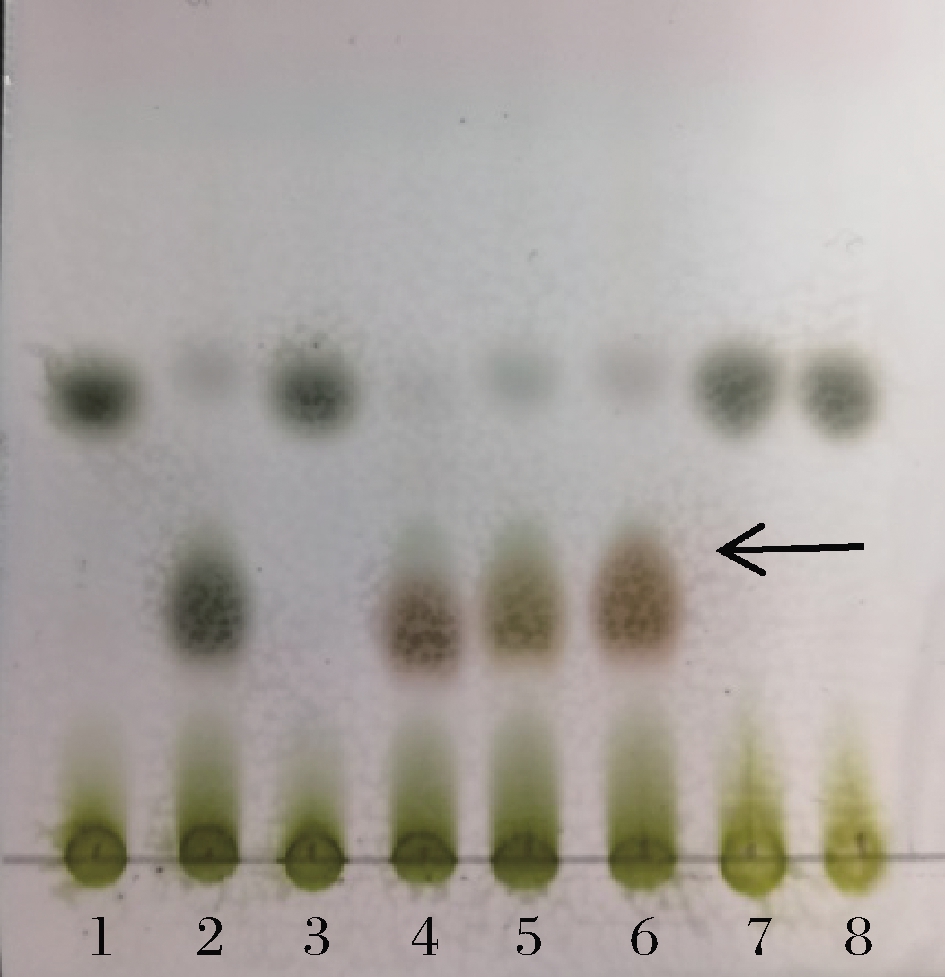
1-D-果糖;2-D-阿洛酮糖;3-L-阿洛酮糖; 4-L-果糖;5-D-山梨糖;6-L-塔格糖; 7-L-山梨糖;8-D-塔格糖
图7 TLC检测RhaBE437Q底物特异性
Fig.7 TLC analysis of substrate specificity of RhaBE437Q
2.7 重组蛋白RhaBE437Q对D-阿洛酮糖催化机理的分析
RhaBE437Q蛋白结构模型和D-阿洛酮糖分子对接结果如图8所示,该模型可清晰的看出RhaBE437Q的结构,ADP、PO3及底物D-阿洛酮糖的位置。重组蛋白RhaBE437Q在N端及C端都有β折叠,ADP位于其间隙处。PO3为ATP结合位点,位于ADP和D-阿洛酮糖之间。底物D-阿洛酮糖位于蛋白的中心。437号氨基酸突变位点虽远离活性中心及底物结合口袋,但对蛋白质的表达及活性产生了很大影响,类似于XIE等[33]对辛伐他汀合酶的改造结果。推测该位点为暴露在溶剂中的氨基酸位点,突变后降低了蛋白质的聚合作用,改善了蛋白质的错误折叠,因此改变了蛋白质的表达水平及活性。由图9可知,底物D-阿洛酮糖与RhaBE437Q结合位点周围的氨基酸有Gly83、His236、Asp237、Thr238、Trp260、Asn296。底物D-阿洛酮糖与重组蛋白RhaBE437Q的Gly83、His236、Asp237、Thr238氨基酸形成氢键,同时,底物D-阿洛酮糖与重组蛋白RhaBE437Q在Phe134、Glu284、Leu132、Trp82、Leu262位点之间有范德华力的产生。但范德华力与氢键相比作用力较弱,因此主要的分子间相互作用仍为氢键。这些氨基酸可能在酶与底物的结合和催化过程中起着重要作用,可为进一步饱和突变验证酶活性中心关键残基提供指导。
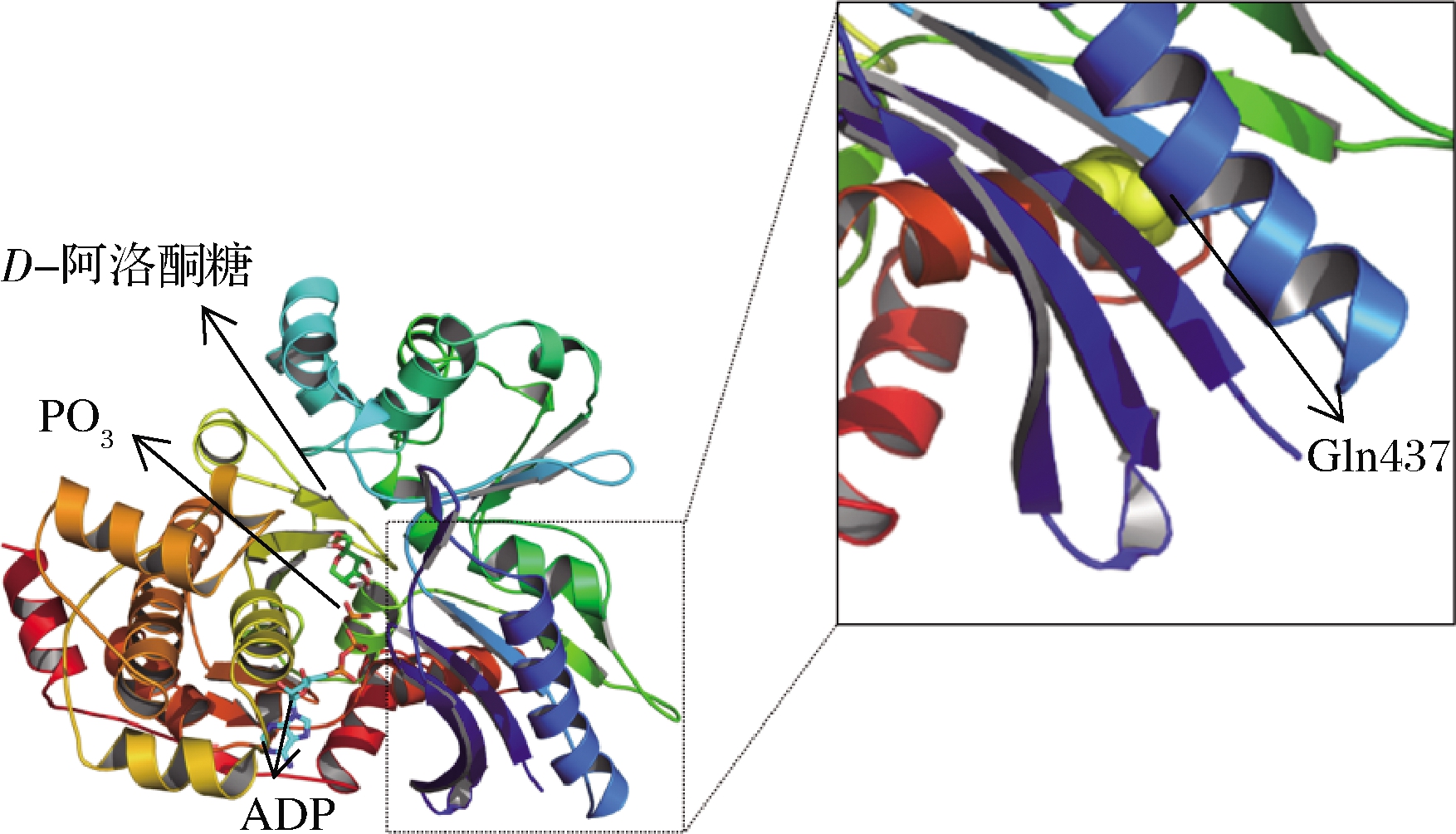
图8 重组蛋白RhaBE437Q与D-阿洛酮糖的对接模型
Fig.8 The overall position model of D-allulose binding on RhaBE437Q
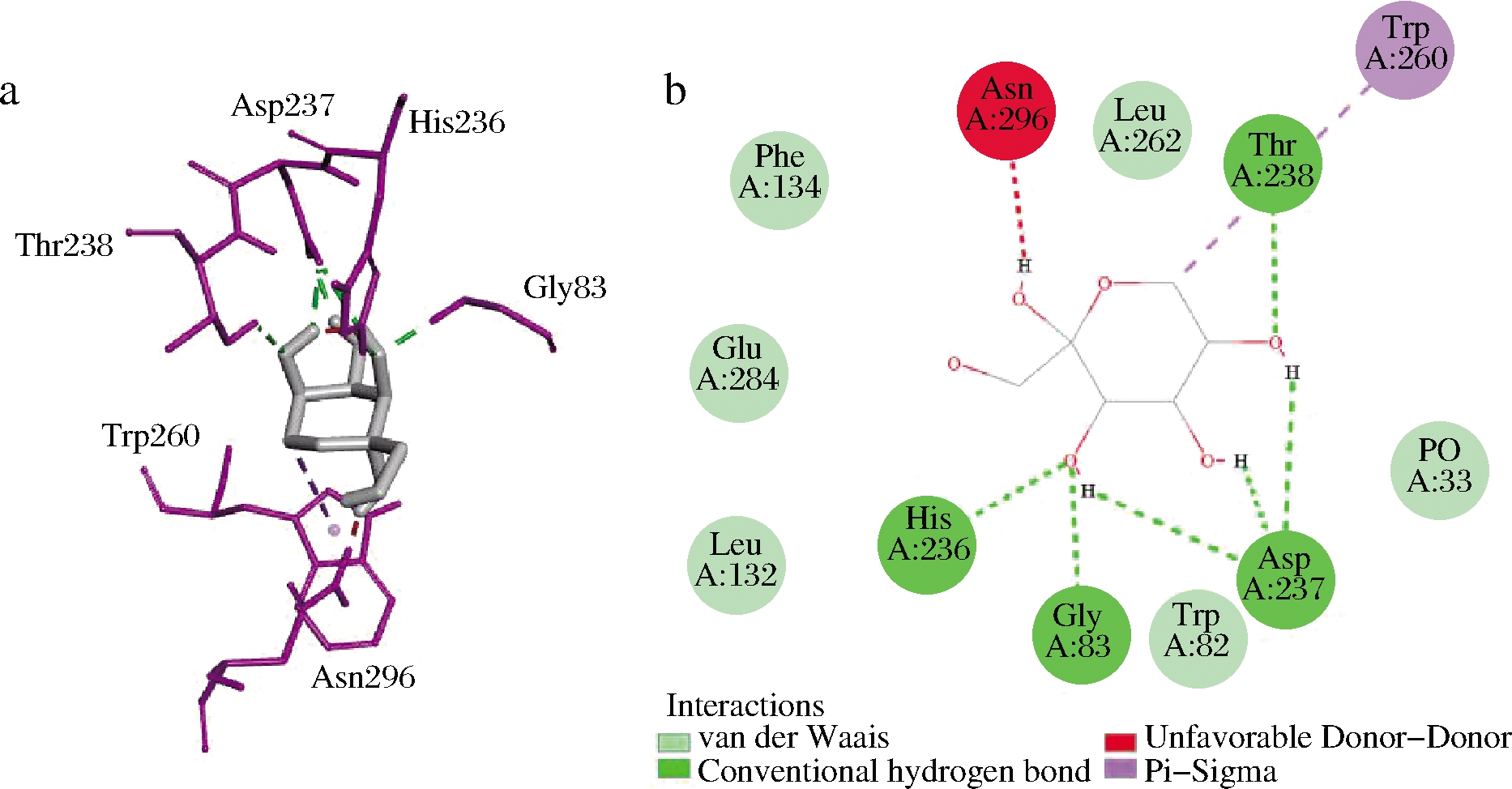
a-D-阿洛酮糖与重组蛋白RhaBE437Q之间氨基酸残基三维谱图; b-D-阿洛酮糖与重组蛋白RhaBE437Q之间相互作用力二维谱图
图9 重组蛋白RhaBE437Q与D-阿洛酮糖的结合位点
Fig.9 Binding site of D-allulose on RhaBE437Q
3 结论
从福氏志贺菌(S.flexneri 2a str.301)中克隆得到了rhaB基因,对其进行定点突变得到rhaBE437Q基因,并成功在 E.coli BL21(DE3)中进行表达,利用镍离子亲和层析柱对突变体蛋白进行纯化,发现突变体蛋白可溶性及活性均得到很大改善。研究了突变体蛋白的酶学性质:突变蛋白为单体;其最优反应条件为40 ℃,pH 8.5,Mn2+;突变体蛋白对C-3构型为R构型的糖有催化作用;将其与底物D-阿洛酮糖进行分子对接,酶活性中心Gly83、His236、Asp237、Thr238等残基与D-阿洛酮糖间存在氢键作用,推测是影响酶催化的关键残基,可进行进一步突变验证。重组蛋白RhaBE437Q的研究可为工业化生产D-阿洛酮糖提供更多方法。
[1] GRANSTRÖM T B, TAKATA G, TOKUDA M, et al.Izumoring:A novel and complete strategy for bioproduction of rare sugars[J].Journal of Bioscience & Bioengineering, 2004, 97(2):89-94.
[2] 贾东旭, 孙晨奕, 彭晨, 等.D-阿洛酮糖及其合成研究进展[J].食品与发酵工业, 2021, 47(3):211-217.
JIA D X, SUN C Y, PENG C, et al.Advances on D-psicose and its synthesis[J].Food and Fermentation Industries, 2021, 47(3):211-217.
[3] HAN Y, YOON J, CHOI M S.Tracing the anti-inflammatory mechanism/triggers of d-allulose:A profile study of microbiome composition and mRNA expression in diet-induced obese mice[J].Molecular Nutrition & Food Research, 2020, 64(5):1900982.
[4] HAN Y, PARK H, CHOI B R, et al.Alteration of microbiome profile by D-allulose in amelioration of high-fat-diet-induced obesity in mice[J].Nutrients, 2020, 12(2):352.
[5] ZHANG W L, YU S H, ZHANG T, et al.Recent advances in D-allulose:Physiological functionalities, applications, and biological production[J].Trends in Food Science & Technology, 2016, 54:127-137.
[6] LEE D, HAN Y, KWON E Y, et al.D-allulose ameliorates metabolic dysfunction in C57BL/KsJ-db/db mice[J].Molecules, 2020, 25(16):3 656.
[7] MOON S, KIM Y H, CHOI K.Inhibition of 3T3-L1 adipocyte differentiation by D-allulose[J].Biotechnology and Bioprocess Engineering, 2020, 25(1):22-28.
[8] PONGKAN W, JINAWONG K, PRATCHAYASAKUL W, et al.D-allulose provides cardioprotective effect by attenuating cardiac mitochondrial dysfunction in obesity-induced insulin-resistant rats[J].European Journal of Nutrition, 2021,60(4):2 047-2 061.
[9] PRATCHAYASAKUL W, JINAWONG K, PONGKAN W, et al.Not only metformin, but also D-allulose, alleviates metabolic disturbance and cognitive decline in prediabetic rats[J].Nutritional Neuroscience, 2020.DOI:10.1080/1028415X.2020.1840050.
[10] IWASAKI Y, SENDO M, DEZAKI K, et al.GLP-1 release and vagal afferent activation mediate the beneficial metabolic and chronotherapeutic effects of D-allulose[J].Nature Communications, 2018, 9(1):113.
[11] CHUNG M Y, OH D K, LEE K W.Hypoglycemic health benefits of D-psicose[J].Journal of Agricultural & Food Chemistry, 2012, 60(4):863-869.
[12] CHATTOPADHYAY S, RAYCHAUDHURI U, CHAKRABORTY R.Artificial sweeteners—a review[J].Journal of Food Science and Technology, 2014, 51(4):611-621.
[13] ATES E G, OZVURAL E B, OZTOP M H.Understanding the role of d-allulose and soy protein addition in pectin gels[J].Journal of Applied Polymer Science, 2021, 138(8):49885.
[14] LEE P, OH H, KIM S Y, et al.Effects of d-allulose as a sucrose substitute on the physicochemical, textural, and sensorial properties of pound cakes[J].Journal of Food Processing and Preservation, 2020, 44(6):e14472.
[15] KANASAKI A, IIDA T, MURAO K, et al.D-allulose enhances uptake of HDL-cholesterol into rat′s primary hepatocyte via SR-B1[J].Cytotechnology, 2020, 72(2):295-301.
[16] TANAKA M, HAYASHI N, IIDA T, et al.Effects of chocolate containing D-allulose on postprandial lipid and carbohydrate metabolism in young Japanese women[J].Food Science and Technology Research, 2020, 26(5):623-632.
[17] MEN Y, ZHU P, ZHU Y M, et al.The development of low-calorie sugar and functional jujube food using biological transformation and fermentation coupling technology[J].Food Science & Nutrition, 2019, 7(4):1 302-1 310.
[18] 佟毅, 沈雪梅, 王靖, 等.一种新型D-阿洛酮糖3-差向异构酶及其应用:中国, CN109306347B[P].2019-08-30.
TONG Y, SHEN X M, WANG J, et al.A novel D-allulose 3-epimerase and its application:China, CN109306347B[P].2019-08-30.
[19] WEN L Q, HUANG K, WEI M H, et al.Facile enzymatic synthesis of ketoses[J].Angewandte Chemie International Edition, 2015, 54(43):12 654-12 658.
[20] BORK P, SANDER C, VALENCIA A.An ATPase domain common to prokaryotic cell cycle proteins, sugar kinases, actin, and hsp70 heat shock proteins[J].Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(16):7 290-7 294.
[21] VAN DEN ENT F, LÖWE J.Crystal structure of the cell division protein FtsA from Thermotoga maritima[J].The EMBO Journal, 2000, 19(20):5 300-5 307.
[22] BUSS K A, COOPER D R, INGRAM-SMITH C, et al.Urkinase:Structure of acetate kinase, a member of the ASKHA superfamily of phosphotransferases[J].Journal of Bacteriology, 2001, 183(2):680-686.
[23] LOCHER K P, HANS M, YEH A P, et al.Crystal structure of the Acidaminococcus fermentans 2-hydroxyglutaryl-CoA dehydratase component A[J].Journal of Molecular Biology, 2001, 307(1):297-308.
[24] VAN DEN ENT F, MØLLER J J, AMOS L A, et al.F-actin-like filaments formed by plasmid segregation protein ParM[J].The EMBO Journal, 2002, 21(24):6 935-6 943.
[25] DIAO J S, COOPER D R, SANDERS D A, et al.Crystallization of butyrate kinase 2 from Thermotoga maritima mediated by vapor diffusion of acetic acid[J].Acta Crystallographica, Section D, Biological Crytallography, 2003, 59(6):1 100-1 102.
[26] MUKAI T, KAWAI S, MORI S, et al.Crystal structure of bacterial inorganic polyphosphate/ATP-glucomannokinase—insights into kinase evolution[J].Journal of Biological Chemistry, 2004, 279(48):50 591-50 600.
[27] SIMANSHU D K, SAVITHRI H S, MURTHY M R N.Crystal structures of ADP and AMPPNP-bound propionate kinase (TdcD) from Salmonella typhimurium:Comparison with members of acetate and sugar kinase/heat shock cognate 70/actin superfamily[J].Journal of Molecular Biology, 2005, 352(4):876-892.
[28] XIAO Q, NIU J R, LIU H, et al.High conversion of D-fructose into D-allulose by enzymes coupling with an ATP regeneration system[J].Molecular Biotechnology, 2019,61(6):432-441.
[29] 温俊婷. L-鼠李树胶糖激酶在D-阿洛酮糖合成中的应用[D].无锡:江南大学, 2019.
WEN J T.Application of L-rhamnulose kinase on production of D-psicose [D].Wuxi:Jiangnan University, 2019.
[30] 朱理平, 高晓冬, 李子杰, 等.一种利用全细胞转化合成D-阿洛酮糖的方法:中国, CN111518853A[P].2020-08-11.
ZHU L P, GAO X D, LI Z J, et al.A method for synthesizing D-allulose by whole cell transformation:China, CN111518853A[P].2020-08-11.
[31] MORRIS G M, HUEY R, LINDSTROM W, et al.AutoDock4 and AutoDockTools4:Automated docking with selective receptor flexibility[J].Journal of Computational Chemistry, 2009, 30(16):2 785-2 791.
[32] GRUENINGER D, SCHULZ G E.Substrate spectrum of L-rhamnulose kinase related to models derived from two ternary complex structures[J].FEBS Letters, 2007, 581(16):3 127-3 130.
[33] XIE X K, PASHKOV I, GAO X, et al.Rational improvement of simvastatin synthase solubility in Escherichia coli leads to higher whole-cell biocatalytic activity[J].Biotechnology & Bioengineering, 2009, 102(1):20-28.