牛胃包含瘤胃、网胃、瓣胃和皱胃,瓣胃内层的叶片被称作毛肚,别称牛百叶、百叶肚等[1-3]。在国外,由于毛肚的色值和黏结度的分值较低,一般不会用于重组肉产品原料。在国内,毛肚作为火锅菜品的主力军,以其脆嫩化渣的口感和丰富充足的营养获得了消费者的喜爱,消费地区也从川渝地区拓展到全国范围,消费量与日俱增,发展潜力巨大[4]。根据加工贮藏方式不同,毛肚可分为鲜毛肚、盐渍毛肚、干制毛肚、冻干毛肚、涨发毛肚等。毛肚含有多种营养成分,其中蛋白质含量占比约为14.5%,易被人体消化吸收[3]。目前关于毛肚的研究主要集中在嫩化保水[5]、涨发工艺优化[2, 6-8]、保鲜[4, 9]、品质控制[4, 10]等方面,但有关毛肚蛋白的研究寥寥无几。
胶原蛋白是毛肚内部最主要的蛋白成分。胶原蛋白具有由3个α多肽链构成的右三螺旋结构。毛肚胶原蛋白的特征主要由其内部多肽链的周期性配置决定[11-12]。不同来源胶原的类型也不同,据报道,牛瘤胃平滑肌中有7种类型的胶原:I型、III型、IV型、V型、VI型、VIII型和XII型[13]。胶原蛋白的提取方式重点有酶法、酸法和碱法,都是依据原料胶原蛋白的性质改变胶原蛋白所处的外部环境,将胶原蛋白与其他蛋白分离从而将胶原蛋白提取出来[13]。在实践中,为了更有效地提取胶原蛋白,通常使用复合方法提取,例如,前人利用酸酶复合法提取了羊屠宰副产物[14]、耗牛瘤胃平滑肌[13]、乌鳢皮[15]、海参[16]等原料未变性的酶促溶性胶原蛋白。胶原蛋白结构对毛肚的加工性能和品质变化影响重大,因此研究毛肚胶原蛋白的结构特点十分必要。但有关毛肚胶原蛋白方面的研究至今尚未见报道。鲜毛肚和盐渍毛肚是制作涨发毛肚的主要原料,而盐渍过程会导致蛋白变性,蛋白分子发生交联,暴露疏水集团,蛋白不断降解,故而2种毛肚的胶原结构可能存在差异,在毛肚涨发过程中胶原的变化机理也不尽相同。故本研究以黄牛鲜毛肚和盐渍毛肚为原料,提取酶促溶性胶原蛋白,并对毛肚的胶原蛋白结构进行表征,以期为毛肚加工提供理论和科研依据。
1 材料与方法
1.1 材料与试剂
原料:黄牛鲜毛肚、盐渍毛肚购于重庆市南岸区水产批发市场,低温保藏运输至实验室后立即处理。其中,盐渍毛肚是由黄牛鲜毛肚经干盐盐渍加工制成。
试剂:十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,简称SDS-PAGE)凝胶制备试剂盒,北京索莱宝科技有限公司;蛋白Marker(10~200 kDa),赛默飞世尔科技(中国)有限公司;胃蛋白酶,范德生物科技有限公司;盐酸、氯化钠、柠檬酸、正丁醇(分析纯),重庆市钛新化工有限公司;冰醋酸、氢氧化钠(分析纯),重庆市跃翔化工有限公司;重蒸酚(分析纯),博美生物科技有限公司。
1.2 仪器和设备
FA2004分析天平,上海精密科学仪器有限公司;TGL-16医用冷冻离心机,四川蜀科仪器有限公司;SYNERGYH1MG全波长酶标仪,美国基因公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;HH-6数显恒温搅拌水浴锅,常州鸿泽实验科技有限公司;UV-1900紫外分光光度仪,上海菁华科技仪器有限公司;L-8800全自动氨基酸分析仪,日本Hitachi公司;Spectrun l00红外光谱仪,美国PerkinElmer公司;Bio-Rad基础电泳仪,美国Bio-Rad公司;G-BOX EF凝胶成像系统,美国Syngene公司。
1.3 实验方法
1.3.1 毛肚胶原蛋白的提取
参考LI等[13]的做法,并略作修改。去除鲜毛肚和盐渍毛肚的表面异物后清洗干净。毛肚切碎后按照1∶10(g∶mL)的固液比添加0.1 mol/L氢氧化钠溶液,浸泡72 h除去色素和杂质蛋白。用超纯水洗至中性pH值。按照1∶10(g∶mL)的固液比添加10%的正丁醇溶液,浸泡48 h除去多余的脂肪。用超纯水洗至中性pH值。按照1∶10(g∶mL)的固液比添加含有胃蛋白酶的0.1 mol/L醋酸溶液,胃蛋白酶的添加量为1%,搅拌72 h。将滤液收集起来,进行盐析、离心、透析、真空冷冻干燥、封口包装,并将样品置于-20 ℃的冰箱中,供测定指标使用。以上所有操作均在低温下进行。
1.3.2 SDS-PAGE分析
参考NAN等[17]的方法,并略作修改。配制2 mg/mL毛肚胶原蛋白溶液,按照4∶1(体积比)溶解于SDS-PAGE样品缓冲液中,一组加入5%(体积分数) β-巯基乙醇,一组不加β-巯基乙醇。在100 ℃水浴中放置5 min后,用10%的分离胶和5%的浓缩胶对溶解后的胶原样品进行分析。
1.3.3 紫外光谱分析
采用0.1 mol/L冰醋酸溶液溶解鲜毛肚与盐渍毛肚的胶原蛋白,制备质量浓度为0.5 mg/mL的鲜毛肚和盐渍毛肚胶原蛋白溶液,扫描了鲜毛肚与盐渍毛肚的胶原蛋白紫外吸收光谱(400~190 nm)。
1.3.4 氨基酸组成分析
参考LI等[16]的方法,并略作修改。分别称取毛肚的胶原蛋白样品约10 mg,并在110 ℃下水解22 h,检测鲜毛肚与盐渍毛肚的胶原蛋白氨基酸组成及含量占比。
1.3.5 荧光光谱分析
采用0.1 mol/L冰醋酸溶液溶解鲜毛肚与盐渍毛肚的胶原蛋白,制备质量浓度0.5 mg/mL的鲜毛肚和盐渍毛肚胶原蛋白溶液,扫描了鲜毛肚与盐渍毛肚的胶原蛋白荧光光谱(400~300 nm)。其中,激发波长设定为280 nm,缝隙宽度是5 nm[18]。
1.3.6 红外光谱分析
参考NOORZAI等[19]的方法,略作修改。即采用傅里叶变换红外光谱仪进行测定,取1 mg经过冷冻干燥后的样品,加入100 mg KBr于研钵中研磨均匀,在全波长400~4 000 cm-1下扫描。利用测试软件对毛肚胶原蛋白的红外光谱进行自动基线校正、平滑、标准化处理后,导出原数据。再利用Peakfit 4.12处理毛肚胶原蛋白酰胺I区(1 600~1 700 cm-1),依次进行相关基线校正、Gaussian去卷积、二阶导数拟合,分别汇总鲜毛肚和盐渍毛肚的胶原蛋白二级结构组成在其二级结构中的占比。
1.3.7 扫描电镜分析
分别将冻干的毛肚胶原蛋白固定喷金,设置加速电压为10 kV,使用扫描电镜观察鲜毛肚和盐渍毛肚的胶原蛋白微观结构。
1.3.8 数据处理
数据由Microsoft Excel 2010和Origin 8.0分析和处理,每组数据设定3个平行,采用表示数据。
2 结果与分析
2.1 毛肚胶原蛋白的SDS-PAGE图谱分析
毛肚胶原蛋白的电泳图谱如图1所示。鲜毛肚和盐渍毛肚的胶原蛋白主要包含α1链、α2链、β链,其中α链的亚基分子质量约为115 kDa,与中华鳖裙边胶原蛋白[20]、草鱼鱼鳞胶原蛋白[21]、水母[12]及豹纹翼甲鲶皮肤[22]等蛋白谱型保持一致,与I型胶原蛋白特征相符,表明毛肚的胶原蛋白主要是由I型胶原蛋白构成的。相较于鲜毛肚,盐渍毛肚的胶原蛋白具有相同的蛋白谱型,但其亚基条带强度较弱。同时,对比添加β-巯基乙醇前后的胶原蛋白电泳条带,发现并无杂带,蛋白图谱保持一致,说明毛肚的胶原蛋白结构内不含二硫键,且纯度较高。
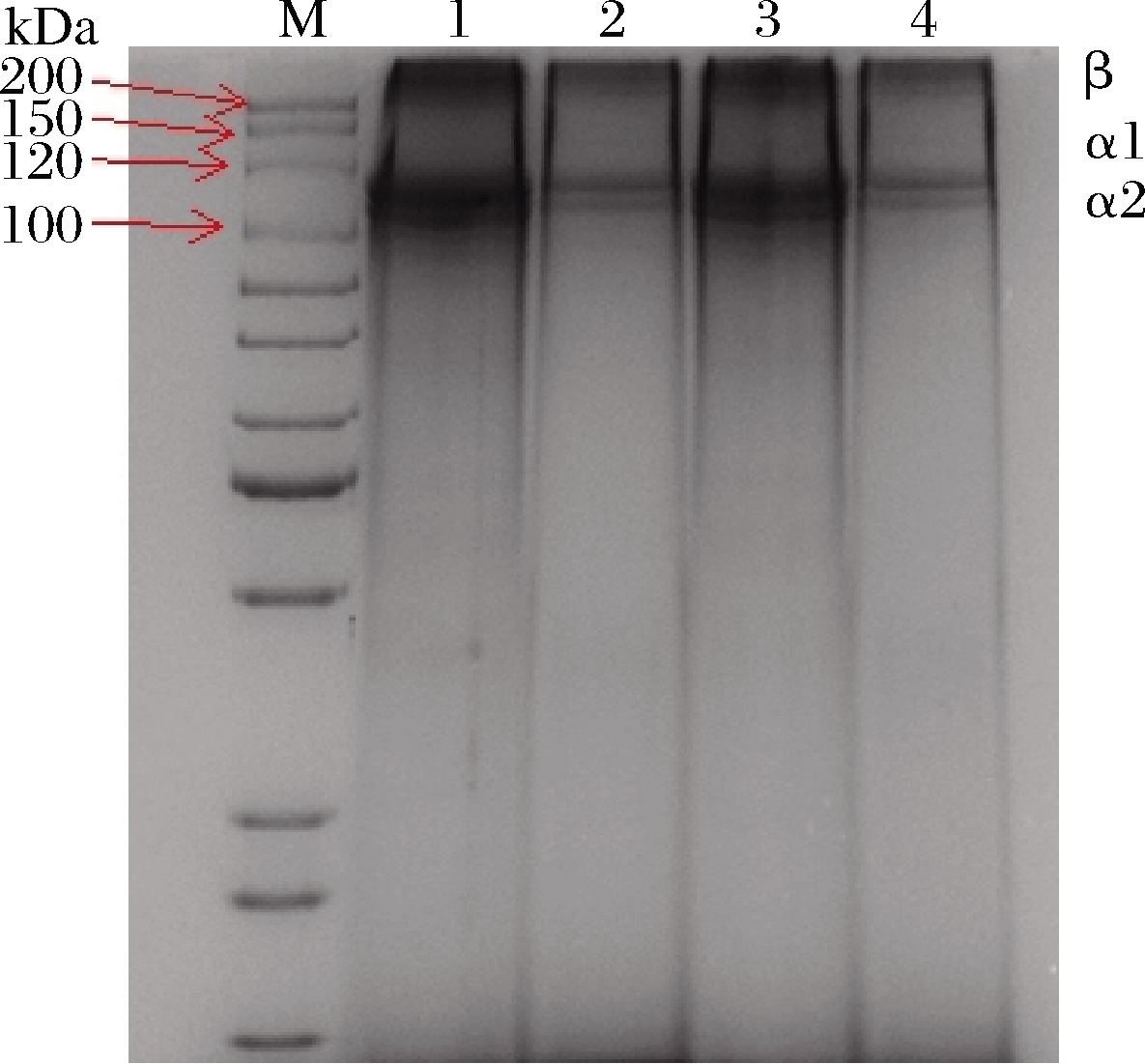
M-次高分子质量标准蛋白Marker;1-鲜毛肚胶原 蛋白(未加β-巯基乙醇);2-盐渍毛肚胶原蛋白 (未加β-巯基乙醇);3-鲜毛肚胶原蛋白(添加β-巯基 乙醇);4-盐渍毛肚胶原蛋白(添加β-巯基乙醇)
图1 毛肚胶原蛋白的聚丙烯酰胺凝胶电泳
Fig.1 SDS-PAGE patterns of collagen of tripe
2.2 毛肚胶原蛋白的紫外光谱分析
毛肚胶原蛋白的紫外光谱如图2所示,胶原多肽链含有羰基、羧基和酰胺基等官能团,在230 nm处产生明显的吸收峰[16, 23]。由图2可知,鲜毛肚0.5 mg/mL 胶原蛋白溶液的最大吸收波长是226 nm,而盐渍毛肚0.5 mg/mL胶原蛋白溶液的最大吸收波长是228 nm,最大吸收波长发生红移,紫外吸收峰强度增大,说明2种毛肚的胶原蛋白结构存在一定差异,盐渍过程可能改变了胶原蛋白的三螺旋结构,使其暴露出更多的发色基团。鲜毛肚和盐渍毛肚的胶原蛋白在280 nm附近存在宽钝的微弱吸收峰,表明毛肚的胶原蛋白内部包含少量酪氨酸、苯丙氨酸等,与表1中氨基酸组成的分析结果一致[24]。
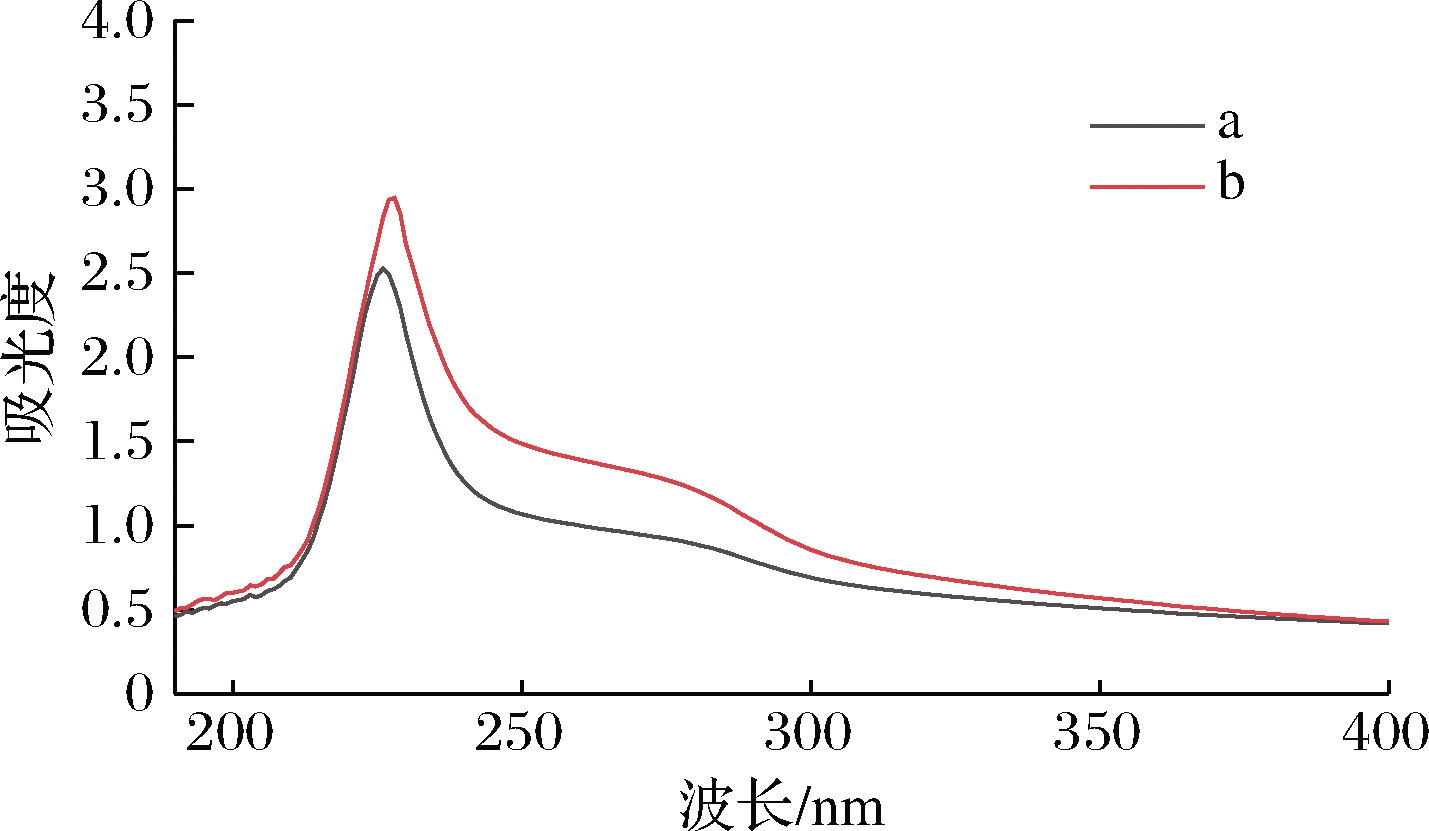
a-0.5 mg/mL鲜毛肚胶原蛋白;b-0.5 mg/mL 盐渍毛肚胶原蛋白
图2 毛肚胶原蛋白的紫外光谱
Fig.2 UV absorbance spectrum of collagen of tripe
2.3 毛肚胶原蛋白的氨基酸组成及含量分析
表1列出了鲜毛肚和盐渍毛肚的胶原蛋白氨基酸组成及含量。通常而言,胶原蛋白的结构内每3个氨基酸序列中包含1个甘氨酸,其残基对1 000个氨基酸总残基占比约为1/3[16, 25]。鲜毛肚和盐渍毛肚的胶原蛋白中Glu、Gly、Ala、Pro、Asp、Arg等氨基酸含量较高,而Tyr、Met、His、Cys、Phe等氨基酸质量分数占比较低,符合胶原蛋白的一般特征。其中,Gly占比最高,前者Gly含量占质量总分数的26.45%,测定结果与海蜇Gly含量25.99%[26],鱿鱼皮Gly含量26.89%[27],马面鱼皮Gly含量24.12%[28]相似。后者Gly含量明显低于前者,但Phe、Tyr、Leu以及Asp等氨基酸含量高于前者,说明2种毛肚的胶原蛋白氨基酸组成存在一定差异。
表1 毛肚胶原蛋白的氨基酸组成及含量
Table 1 Amino acid composion of collagen of tripe

氨基酸组成 含量/%新鲜毛肚盐渍毛肚Asp天冬氨酸7.457.85Thr苏氨酸2.923.72Ser丝氨酸4.625.12Glu谷氨酸12.0013.01Gly甘氨酸26.5017.77Ala丙氨酸9.947.70Cys半胱氨酸0.140.32Val缬氨酸3.423.99Met甲硫氨酸0.200.21Ile异亮氨酸2.393.17Leu亮氨酸4.206.29Tyr酪氨酸1.533.11Phe苯丙氨酸2.883.98Lys赖氨酸3.774.80His组氨酸1.142.10Arg精氨酸8.577.68Pro脯氨酸8.429.19
2.4 毛肚胶原蛋白的荧光光谱分析
毛肚胶原蛋白的荧光光谱如图3所示,能够反映胶原蛋白的三级结构变化情况。毛肚胶原蛋白含有少量的芳香族氨基酸,内部含有的共轭双键和苯环结构在特定的激发波长内可生成荧光,故可通过分析2种毛肚的胶原蛋白发射荧光光谱研究鲜毛肚和盐渍毛肚的胶原蛋白变化情况[18]。由图3可知,鲜毛肚0.5 mg/mL胶原蛋白溶液在336 nm处的荧光强度最强,盐渍毛肚0.5 mg/mL胶原蛋白溶液在334 nm处的荧光强度最强。因此,与鲜毛肚相比,盐渍毛肚胶原蛋白的荧光强度明显降低,并由336 nm蓝移至334 nm处,说明2种毛肚胶原蛋白结构存在差异,盐渍过程可能会导致芳香族氨基酸的微环境发生改变,胶原结构不断伸展,胶原蛋白发生变性聚集生成大胶原分子,致使能量传递减弱,故盐渍毛肚胶原蛋白的荧光强度明显降低。
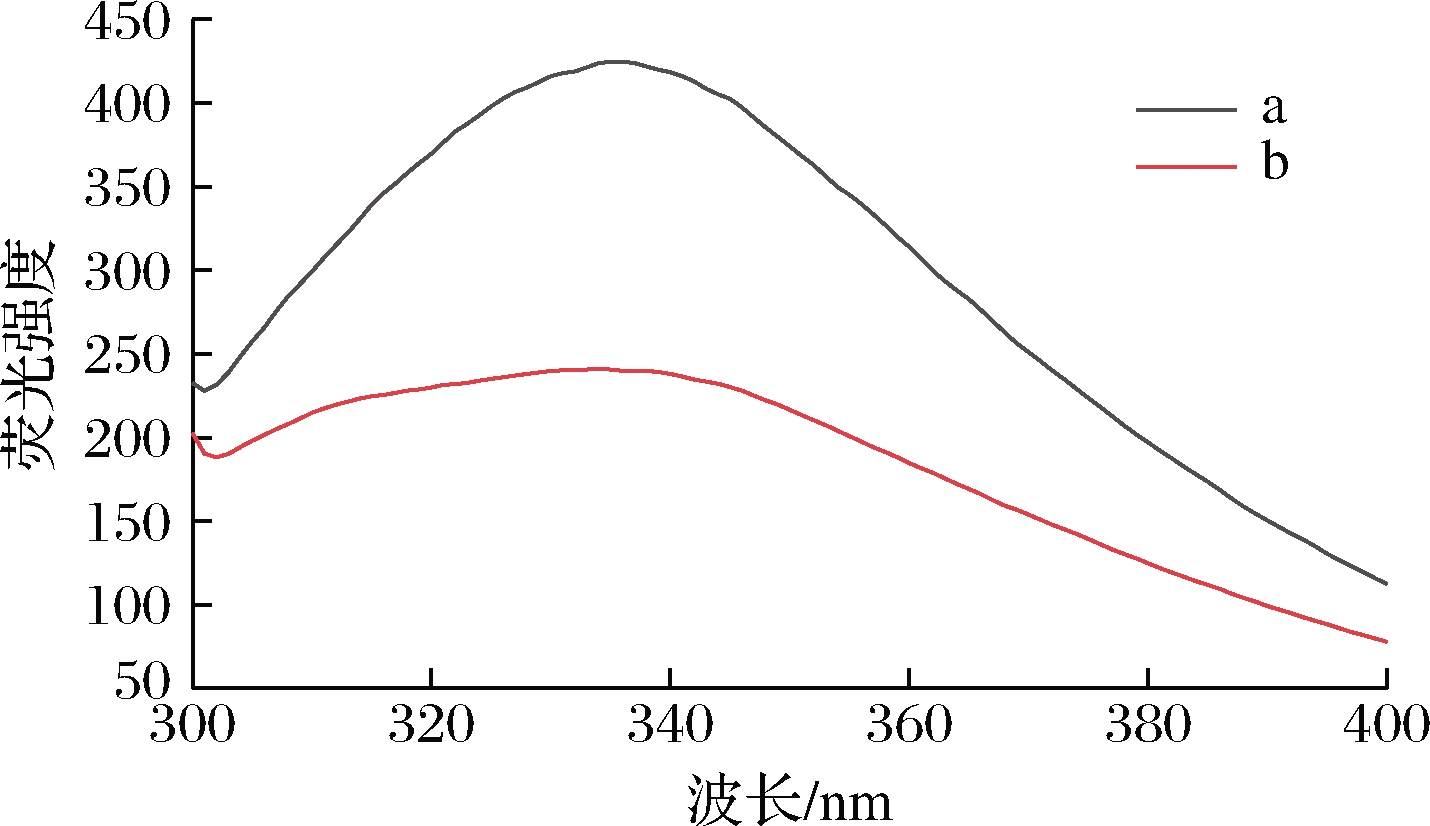
a-0.5 mg/mL鲜毛肚胶原蛋白;b-0.5 mg/mL 盐渍毛肚胶原蛋白
图3 毛肚胶原蛋白的荧光光谱
Fig.3 Fluorescence spectrum of collagen of tripe
2.5 毛肚胶原蛋白的傅里叶红外光谱分析
图4为毛肚胶原蛋白的红外光谱。酰胺化合物A、B、I、II和III区的吸收峰决定了胶原蛋白性质的主要特征。已知酰胺类化合物A、B、I、II和III区的吸收峰通常出现在3 400 cm-1、3 000 cm-1、1 700~1 600 cm-1、1 600~1 500 cm-1以及1 300~1 200 cm-1处[29]。酰胺A区与N—H的伸缩振动相关,当N—H参与生成氢键时,吸收峰蓝移,往往出现在3 300 cm-1处[14]。酰胺B区和—CH2的不对称弹性振动有关[12]。酰胺I、II和III区的范围能够影响蛋白质的形状,酰胺I区与肽链内羰基的拉伸振动相关,是研究蛋白质二级结构的重要区带[30]。酰胺II区与C—N拉伸耦合及N—H伸缩振动相关,酰胺III区反映了胶原蛋白特性,参与生成胶原蛋白的三螺旋结构[19]。从鲜毛肚中提取的胶原蛋白在3 339.00、2 923.70、1 659.55、1 552.25、1 238.34 cm-1处分别发现了酰胺类化合物A、B、I、II、III的吸收峰,从盐渍毛肚中提取的胶原蛋白在3 330.50、2 923.36、1 657.71、1 546.06、1 237.42 cm-1处分别发现了酰胺类化合物A、B、I、II、III的吸收峰,与瘤胃平滑肌[13]、欧洲鳗鱼[31]等胶原蛋白的吸收峰相似,证明所提取产物是胶原蛋白。

a-鲜毛肚胶原蛋白;b-盐渍毛肚胶原蛋白
图4 毛肚胶原蛋白的红外光谱
Fig.4 FTIR spectrum of collagen of tripe
由表2可知,鲜毛肚中β-折叠、无规则卷曲、α-螺旋及β-转角等部分含量占胶原蛋白总蛋白二级结构的27.21%、24.39%、13.07%、35.32%,而盐渍毛肚中β-折叠、无规则卷曲、α-螺旋及β-转角等部分含量占胶原蛋白总蛋白二级结构的24.86%、25.54%、13.90%、35.69%,这说明鲜毛肚和盐渍毛肚的胶原蛋白二级结构存在差异,与鲜毛肚相比,盐渍毛肚胶原蛋白内部β-折叠的相对含量降低,而不规则卷曲、α-螺旋和β-转角的相对含量增加,原因可能是盐渍过程破坏了胶原蛋白和其他分子交互作用,导致胶原蛋白结构二级结构发生改变[32]。
表2 毛肚胶原蛋白的二级结构组成
Table 2 Secondary structrure composition of collagen of tripe
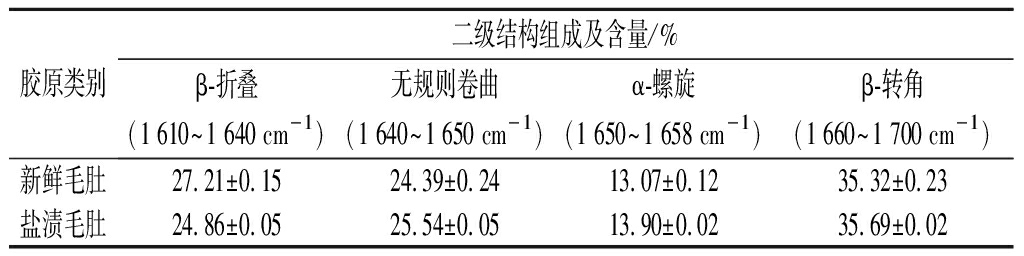
胶原类别二级结构组成及含量/%β-折叠(1 610~1 640 cm-1)无规则卷曲(1 640~1 650 cm-1)α-螺旋(1 650~1 658 cm-1)β-转角(1 660~1 700 cm-1)新鲜毛肚27.21±0.1524.39±0.2413.07±0.1235.32±0.23盐渍毛肚24.86±0.0525.54±0.0513.90±0.0235.69±0.02
2.6 毛肚胶原蛋白的微观结构分析
毛肚胶原蛋白的电镜扫描图像如图5所示。鲜毛肚和盐渍毛肚的胶原蛋白微观结构存在差异,与鲜毛肚相比,盐渍毛肚的胶原蛋白折叠结构减少,孔洞增加,破碎效果明显,无序化程度加深,可能是因为盐渍过程胶原结构不断伸展,部分胶原蛋白发生变性,破坏了胶原蛋白三螺旋结构,胶原破碎成小分子结构并开始聚集。

a-新鲜毛肚(×500);b-新鲜毛肚(×2 000); c-盐渍毛肚(×500);d-盐渍毛肚(×2 000)
图5 毛肚胶原蛋白的扫描电镜图
Fig.5 Scanning electron micrograph of collagen of tripe
3 结论与讨论
研究以黄牛鲜毛肚和盐渍毛肚为原料,提取酶促溶性胶原蛋白,对毛肚的胶原蛋白结构进行表征。SDS-PAGE凝胶电泳结果显示,毛肚的胶原蛋白含有3条条带,分别是β链、α1链、α2链,无外源蛋白带,纯度较高,与I型胶原蛋白谱型相符。紫外光谱、傅里叶红外光谱和荧光光谱表明,鲜毛肚和盐渍毛肚的提取产物属于胶原蛋白,不同的是,2种毛肚的胶原蛋白结构存在差异,与盐渍毛肚相比,鲜毛肚的胶原蛋白保留了更完整的三螺旋结构。二级结构拟算结果表明,毛肚的β-转角相对含量占比最高,与鲜毛肚相比,盐渍毛肚的β-折叠的相对含量降低,而不规则卷曲、α-螺旋和β-转角的相对含量增加。扫描电镜结果再次显示2种毛肚胶原蛋白的结构存在差异,盐渍毛肚胶原蛋白折叠结构减少,孔洞增加,破碎效果明显,无序化程度加深。综上所述,对鲜毛肚和盐渍毛肚的胶原蛋白结构进行表征,为毛肚加工提供理论和科研依据,可也为后续研究毛肚原料的加工条件、保藏方式对其胶原蛋白的影响提供参考依据。
[1] 朱建飞, 杨晨曦, 常海军, 等.响应面法优化火锅毛肚无磷保水工艺[J].中国食品添加剂, 2019, 30(4):134-137.
ZHU J F, YANG C X, CHANG H J,et al.Optimization of phosphate-free water-holding technique for bovine omasum for hotpot by response surface methodology[J].China Food Additives, 2019, 30(4):134-137.
[2] 胡代芳, 李洪军, 贺稚非.响应面试验优化毛肚碱发工艺[J].食品与发酵工业, 2018, 44(8):211-217.
HU D F, LI H J, HE Z F.Optimization of lye macerating process of beef tripe by response surface methodology[J].Food and Fermentation Industries, 2018, 44(8):211-217.
[3] 贾蓉, 王国泽, 唐仁勇, 等.毛肚特点及生产工艺研究[J].肉类工业, 2019(8):54-58.
JIA R, WANG G Z, TANG R Y, et al.Study on the production technology and characteristics of tripe[J].Meat Industry, 2019(8):54-58.
[4] 王晓琼, 毕秀芳, 刘欢, 等.超高压处理对鲜毛肚的杀菌效果及品质的影响[J].食品与发酵工业, 2020, 46(6):212-216.
WANG X Q, BI X F, LIU H, et al.Effect of ultra-high pressure treatment on microbial inactivation and quality of fresh hairy belly[J].Food and Fermentation Industries, 2020, 46(6):212-216.
[5] 高菲菲, 王蓉蓉, 姚瑶, 等.磷酸盐对牛肚嫩度及保水性的影响[J].食品科学, 2013, 34(13):132-135.
GAO F F, WANG R R, YAO Y, et al.Effect of polyphosphate on tenderness and water-holding capacity of beef tripe[J].Food Science, 2013,34 (13):132-135.
[6] 李凛, 李璟, 周世一, 等.响应面法优化水发工艺参数改善毛肚感官品质[J].食品研究与开发, 2012, 33(1):80-84.
LI L, LI J, ZHOU S Y, et al.Optimization of the rehydration processing parameters of beef tripe by response surface method to improve the sensory quality[J].Food Research and Development, 2012, 33(1):80-84.
[7] 李凛, 李璟, 周世一, 等.5种不同发制方式对毛肚增重和感官品质的影响[J].广东农业科学, 2011, 38(23):102-103;113.
LI L, LI J, ZHOU S Y, et al.Comparison study on the weight-adding and sensory quality influenced by using five different rehydration mode of beef tripe[J].Guangdong Agricultural Sciences, 2011, 38(23):102-103;113.
[8] 李凛, 李璟, 周世一, 等.三种碱对水发毛肚感官品质及增重影响的比较[J].食品研究与开发, 2012, 33(2):87-90.
LI L, LI J, ZHOU S Y, et al.Comparison study on the sensory quality and weight-adding influenced by using three different lye on the rehydrati on of beef tripe[J].Food Research and Development, 2012, 33(2):87-90.
[9] 陈晓麟, 梅广, 丁晓雯.二氧化氯对猪肉、毛肚和鸭肠保鲜效果的影响[J].食品工业科技, 2010, 31(3):342-345.
CHEN X L, MEI G, DING X W.Effect of chlorine dioxide on the preservati on of pork, cattle stomach and duck intestine[J].Science and Technology of Food Industry, 2010, 31(3):342-345.
[10] 贾洪锋, 张淼, 邓红, 等.加热对毛肚品质的影响[J].食品工业科技, 2017, 38(20):166-170.
JIA H F, ZHANG M, DENG H, et al.Influence of heating on the quality of beef tripe[J].Science and Technology of Food Industry, 2017, 38(20):166-170.
[11] METREVELI N O, JARIASHVILI K K, NAMICHEISHVILI L O, et al.UV-vis and FT-IR spectra of ultraviolet irradiated collagen in the presence of antioxidant ascorbic acid[J].Ecotoxicology and Environmental Safety, 2010, 73(3):448-455.
[12] BHUIMBAR M V, BHAGWAT P K, DANDGE P B.Extraction and characterization of acid soluble collagen from fish waste:Development of collagen-chitosan blend as food packaging film[J].Journal of Environmental Chemical Engineering, 2019, 7(2):102983.
[13] LI S S, YU Q L.Extraction and characterization of collagens from yak rumen smooth muscle[J].Animal Science Journal, 2019, 90(12):1 581-1 589.
[14] VIDAL A R, DUARTE L P, SCHMIDT M M, et al.Extraction and characterization of collagen from sheep slaughter by-products[J].Waste Management, 2020, 102:838-846.
[15] LIU W T, ZHANG Y Z, CUI N B, et al.Extraction and characterization of pepsin-solubilized collagen from snakehead (Channa argus) skin:Effects of hydrogen peroxide pretreatments and pepsin hydrolysis strategies[J].Process Biochemistry, 2019, 76:194-202.
[16] LI P H, LU W C, CHAN Y J, et al.Extraction and and characterization of collagen from sea cucumber (Holothuria cinerascens) and its potential application in moisturizing cosmetics[J].Aquaculture, 2020, 515.DOI:10.1016/j.aquaculture.2019.734590.
[17] NAN J, ZOU M L, WANG H B, et al.Effect of ultra-high pressure on molecular structure and properties of bullfrog skin collagen[J].International Journal of Biological Macromolecules, 2018, 111:200-207.
[18] 李从虎, 吴彦, 马兴红, 等.基于荧光光谱技术研究胶原蛋白溶液中分子的聚集行为[J].光谱学与光谱分析, 2019, 39(7):2 023-2 028.
LI C H, WU Y, MA X H, et al.Aggregation behavior of collagen molecules in aqueous solution based on fluorescence spectroscopy technology[J].Spectroscopy and Spectral Analysis, 2019, 39(7):2 023-2 028.
[19] NOORZAI S, VERBEEK C J R, LAY M C, et al.Collagen extraction from various waste bovine hide sources[J].Waste and Biomass Valorization, 2020, 11(11):5 687-5 698.
[20] 张强, 黄鑫, 符安卫, 等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业, 2019, 45(12):176-182.
ZHANG Q, HUANG X, FU A W, et al.Extraction and characterization of collagens in Chinese sturgeon calipash[J].Food and Fermentation Industries, 2019, 45(12):176-182.
[21] 陈铁壁, 刘冬敏, 鹿康, 等.草鱼鱼鳞胶原蛋白酸酶分步提取工艺研究[J].食品与机械, 2016, 32(8):163-166;219.
CHEN T B, LIU D M, LU K, et al.Combinated use of enzyme and acid for collagen extraction from fish scales[J].Food & Machinery, 2016, 32(8):163-166;219.
[22] NURUBHASHA R, SAMPATH KUMAR N S, THIRUMALASETTI S K, et al.Extraction and characterization of collagen from the skin of Pterygoplichthys pardalis and its potential application in food industries[J].Food Science and Biotechnology, 2019, 28(6):1 811-1 817.
[23] CHEN S L, TANG L L, HAO G X, et al.Effects of α1/α2 ratios and drying temperatures on the properties of gelatin films prepared from tilapia (Tilapia zillii) skins[J].Food Hydrocolloids, 2016, 52:573-580.
[24] YAN M Y, LI B F, ZHAO X, et al.Characterization of acid-soluble collagen from the skin of walleye pollock (Theragra chalcogramma)[J].Food Chemistry, 2008, 107(4):1 581-1 586.
[25] ZENG S K, YIN J J, YANG S Q, et al.Structure and characteristics of acid and pepsin-solubilized collagens from the skin of cobia (Rachycentron canadum)[J].Food Chemistry, 2012, 135(3):1 975-1 984.
[26] 冯玲玲, 冯进, 李春阳.海蜇I型胶原蛋白的提取及结构特性研究[J].食品工业科技, 2021,42(7):15-21.
FENG L L, FENG J, LI C Y.Extraction and structural characteristics of type I collagen from Rhopilema esculenta[J].Science and Technology of Food Industry, 2021,42(7):15-21.
[27] 林琳. 鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学, 2006.
LIU L.Studies on preparation of collagen and bioactivities of collagen polypeptide from the skins of aquafic animals[D].Qingdao:Ocean University of China, 2006.
[28] 夏珊珊, 曹少谦, 刘亮, 等.响应面法优化马面鱼皮胶原蛋白提取工艺及胶原组成分析[J].核农学报, 2014, 28(5):869-875.
XIA S S, CAO S Q, LIU L, et al.Composition and optimization of extraction of collagen from navodon septentionalis skin using response surface methodology[J].Journal of Nuclear Agricultural Sciences, 2014, 28(5):869-875.
[29] WANG F, GUO X Y, ZHANG D N, et al.Ultrasound-assisted extraction and purification of taurine from the red algae Porphyra yezoensis[J].Ultrasonics Sonochemistry, 2015, 24:36-42.
[30] BERISIO R, VITAGLIANO L, MAZZARELLA L, et al.Crystal structure of the collagen triple helix model [(Pro-Pro-Gly)10]3 [J].Protein Science, 2002, 11(2):262-270.
[31] CAO W Q, SHI L F, WENG W Y.Histological distribution and characterization of collagen in European eel (Anguilla anguilla) muscle[J].Journal of Aquatic Food Product Technology, 2020, 29(1):121-131.
[32] 刘锐, 张影全, 武亮, 等.真空和面过程中面团蛋白质结构的变化[J].中国食品学报, 2019, 19(5):139-148.
LIU R, ZHANG Y Q, WU L, et al.Change of protein structure in noodle dough during vacuum mixing[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(5):139-148.